Гидробиологический анализ активного ила очистных сооружений г. Бирска
Выпускная
квалификационная работа
ГИДРОБИОЛОГИЧЕСКИЙ
АНАЛИЗ АКТИВНОГО ИЛА ОЧИСТНЫХ СООРУЖЕНИЙ
г. БИРСКА
ОГЛАВЛЕНИЕ
Введение
Глава I.
Литературный обзор
I.1
Природно-климатические и промышленные условия г. Бирска.2 Источники загрязнения
внутренних водоемов.3 Технология очистки сточных вод на очистных сооружениях г.
Бирска.4 Систематическое положение организмов активного ила
Глава II.
Материал и методика.1 Материал и оборудование.2 Гидробиологический анализ
активного ила
Глава III.
Результаты и обсуждение.1 Определение видового состава активного ила
III.2
Годовая динамика видового состава активного ила.3 Определение эффективности
работы активного ила
Выводы
Список использованной литературы
Приложения
ВВЕДЕНИЕ
Вода - ценнейший природный ресурс. Она играет
исключительную роль в процессах обмена веществ, составляющих основу жизни.
Огромное значение вода имеет в промышленном и сельскохозяйственном
производстве. Общеизвестна необходимость ее для бытовых потребностей человека,
всех растений и животных. Для многих живых существ она служит средой обитания.
Рост городов, бурное развитие промышленности,
интенсификация сельского хозяйства, значительное расширение площадей орошаемых
земель, улучшение культурно-бытовых условий и ряд других факторов все больше
усложняет проблемы обеспечения водой.
Дефицит пресной воды уже сейчас становится
мировой проблемой. Все более возрастающие потребности промышленности и
сельского хозяйства в воде заставляют все страны, ученых мира искать
разнообразные средства для решения этой проблемы.
На современном этапе определяются следующие
направления рационального использования водных ресурсов: более полное
использование и расширенное воспроизводство ресурсов пресных вод; разработка
новых технологических процессов, позволяющих предотвратить загрязнение водоемов
и свести к минимуму потребление свежей воды.
В условиях экологического кризиса одной из
наиболее важных проблем является очистка сточных вод и восстановление водных
ресурсов региона. Из существующих способов очистки воды, наиболее эффективна
биологическая, которая происходит в аэротенках с помощью активного ила по тем
же принципам, что и в природных водоемах (Джимова., 1989).
Гидробиологический анализ активного ила и
биопленки является одним из самых оперативных способов контроля работы
сооружений биологической очистки, включающей биофильтры или аэротенки.
Учитывая вышеизложенное, целью работы было
изучение биологического компонента экосистемы очистных сооружений и изменения в
его составе в процессе функционирования. В соответствии с целью в задачи работы
входило:
. Изучить схемы устройства очистных
сооружений, специализирующихся на очистке бытовых сточных вод.
. Освоить метод гидробиологического
анализа активного ила.
. Изучить видовой состав биологического
компонента экосистемы очистных сооружений и возможность использования его для
более полной очистки сточных вод.
. Определить эффективность работы
активного ила в условиях г.Бирска и оценить степень очистки сточных вод
сбрасываемых в р.Белую.
. Определить сезонную динамику численности
видового разнообразия простейших активного ила аэротенков очистных сооружений.
I. ЛИТЕРАТУРНЫЙ ОБЗОР
I.1
Природно-климатические и промышленные условия города Бирска
Город Бирск расположен на правом берегу реки
Белой, ниже города Уфы. Река Белая имеет здесь широкую, хорошо разработанную
долину, шириной от 5 до 9 км, с ассиметричным строением. Правый коренной склон
реки Белой, представляет собой водораздел рек Белой и Бирь, крутой и высокий.
Относительная высота его бровки над урезом р. Белой составляет 50-85м.
Рельеф территории города носит всхолмленный
полого-увалистый характер с абсолютными отметками до 150-190 м. и
характеризуется наличием большого количества оврагов и балок, особенно
береговой склон реки Белой. В береговых обрывах рек и бортах оврагов
распространены оползневые явления. В юго-восточной части города рельеф осложнен
карстовыми проявлениями.
Восточная часть территории, имеющая сравнительно
ровную поверхность, прорезана ручьем Калмаза, длина которого имеет очень
разветвленное верховье.
К северу, в сторону долины реки Бирь,
водораздельный склон становится пологим. Здесь хорошо выражены в рельефе пойма
и первая надпойменная терраса, реки Белой. Пойменная терраса узкой полосой
протягивается вдоль правого берега реки. Первая надпойменная терраса
возвышается над пойменной в виде уступа высотой 3-5м. Ширина её изменяется от
0,25 до 1,5км. Поверхность этой террасы также сравнительно ровная.
Климат района резко континентальный, с холодной
зимой и жарким летом. Средняя годовая температура наружного воздуха +2,60С,
абсолютная минимальная -440С, абсолютная максимальная +380С. Глубина
промерзания почвы - 1,8м. Годовое количество осадков - 678мм. Преобладающее
направление ветров в январе - южное, в июле - северное и западное (Канализация
г. Бирска, 1983).
Промышленность Бирского района Республики
Башкортостан представлена в основном предприятиями пищевой и перерабатывающей
отраслей. На территории района расположены: Бирский спиртоводочный комбинат
филиал ОАО «Башспирт», 12 хлебопекарен, 12 цехов по производству мясных
полуфабрикатов, 2-по производству колбасных изделий, 2 по переработке молока,
2-по солению и копчению рыбы. Осуществляют производственную деятельность
предприятия легкой промышленности (ООО «Бирская швейная фабрика», ООО «Мария»),
полиграфической промышленности (Бирская городская типография), по производству
строительных материалов (Бирский кирпичный завод филиал ООО «Элмстрой», ООО
«Профнастил-Бирск»), мебели (ИП Закиров Р.В.), изделий из пластмасс (ООО
«Спектр») (www.admbirsk.ru).
Таким образом расположение,
природно-климатические и промышленные условия г. Бирска позволяют предположить
о низком уровне загрязненности сточных вод и большом разнообразии
биологического компонента экосистемы очистных сооружений.
I.2 Источники
загрязнения внутренних водоемов
Под загрязнением водных ресурсов понимают любые
изменения физических, химических и биологических свойств воды в водоемах в
связи со сбрасыванием в них жидких, твердых и газообразных веществ, которые
причиняют или могут создать неудобства, делая воду данных водоемов опасной для
использования, нанося ущерб народному хозяйству, здоровью и безопасности
населения.
Загрязнение поверхностных и подземных вод можно
распределить на типы:
. механическое - повышение содержания
механических примесей, свойственное в основном поверхностным видам загрязнений;
. химическое - наличие в воде
органических и неорганических веществ токсического и нетоксического действия;
. бактериальное и биологическое - наличие
в воде разнообразных патогенных микроорганизмов, грибов и мелких водорослей;
. радиоактивное - присутствие
радиоактивных веществ в поверхностных или подземных водах;
. тепловое - выпуск в водоемы подогретых
вод тепловых и атомных ЭС.
Основными источниками загрязнения и засорения
водоемов является недостаточно очищенные сточные воды промышленных и
коммунальных предприятий, крупных животноводческих комплексов, отходы
производства при разработке рудных ископаемых; воды шахт, рудников, обработке и
сплаве лесоматериалов; сбросы водного и железнодорожного транспорта; отходы
первичной обработки льна, пестициды и т.д. Загрязняющие вещества, попадая в
природные водоемы, приводят к качественным изменениям воды, которые в основном
проявляются в изменении физических свойств воды, в частности, появление
неприятных запахов, привкусов и т.д.); в изменении химического состава воды, в
частности, появление в ней вредных веществ, в наличии плавающих веществ на
поверхности воды и откладывании их на дне водоемов.
Производственные сточные воды загрязнены в
основном отходами и выбросами производства. Количественный и качественный
состав их разнообразен и зависит от отрасли промышленности, ее технологических
процессов, которые делят на две основные группы: содержащие неорганические
примеси, в т.ч. и токсические, и содержащие яды. К первой группе относятся
сточные воды содовых, сульфатных, азотно-туковых заводов, обогатительных фабрик
свинцовых, цинковых, никелевых руд и т.д., в которых содержатся кислоты,
щелочи, ионы тяжелых металлов и др. Сточные воды этой группы в основном изменяют
физические свойства воды. Сточные воды второй группы сбрасывают
нефтеперерабатывающие, нефтехимические заводы, предприятия органического
синтеза, коксохимические и другие. В стоках содержатся разные нефтепродукты,
аммиак, альдегиды, смолы, фенолы и другие вредные вещества. Вредоносное
действие сточных вод этой группы заключается главным образом в окислительных
процессах, вследствие которых уменьшается содержание в воде кислорода,
увеличивается биохимическая потребность в нем, ухудшаются органолептические
показатели воды.
Рост населения, расширение старых и
возникновение новых городов значительно увеличили поступление бытовых стоков во
внутренние водоемы. Эти стоки стали источником загрязнения рек и озер
болезнетворными бактериями и гельминтами. В еще большей степени загрязняют
водоемы моющие синтетические средства, широко используемые в быту. Они находят
широкое применение также в промышленности и сельском хозяйстве. Содержащиеся в
них химические вещества, поступая со сточными водами в реки и озера, оказывают
значительное влияние на биологический и физический режим водоемов. В результате
снижается способность вод к насыщению кислородом, парализуется деятельность
бактерий, минерализующих органические вещества.
Вызывает серьезное беспокойство загрязнение водоемов
пестицидами и минеральными удобрениями, которые попадают с полей вместе со
струями дождевой и талой воды. В результате исследований, например, доказано,
что инсектициды, содержащиеся в воде в виде суспензий, растворяются в
нефтепродуктах, которыми загрязнены реки и озера. Это взаимодействие приводит к
значительному ослаблению окислительных функций водных растений. Попадая в
водоемы, пестициды накапливаются в планктоне, бентосе, рыбе, а по цепочке
питания попадают в организм человека, действуя отрицательно как на отдельные
органы, так и на организм в целом. В связи с интенсификацией животноводства все
более дают о себе знать стоки предприятий данной отрасли сельского хозяйства.
Сточные воды, содержащие растительные волокна,
животные и растительные жиры, фекальную массу, остатки плодов и овощей, отходы
кожевенной и целлюлозно-бумажной промышленности, сахарных и пивоваренных
заводов, предприятий мясомолочной, консервной и кондитерской промышленности,
являются причиной органических загрязнений водоемов.
В сточных водах около 60% веществ органического
происхождения, к этой же категории относятся биологические (бактерии, вирусы,
грибы, водоросли) загрязнения в коммунально-бытовых, медико-санитарных водах и
отходах кожевенных и шерстомойных предприятий.
Нагретые сточные воды тепловых электростанций и
др. производств причиняют “тепловое загрязнение”, которое угрожает довольно
серьезными последствиями: в нагретой воде меньше кислорода, резко изменяется
термический режим, что отрицательно влияет на флору и фауну водоемов, при этом
возникают благотворные условия для массового развития в водохранилищах
сине-зеленых водорослей - так называемого “цветения воды” (Роев, 1993).
Исходя из классификации источниками загрязнения,
водных ресурсов г. Бирска являются механический, биологический и бактериальный
типы загрязнений. Это связано с низким развитием промышленности и
экологического благополучия района.
I.3 Технология очистки
сточных вод на очистных сооружениях г. Бирска
очистной активный ил загрязнение
Технология очистки сточных вод на любых очистных
сооружениях включает поэтапную механическую, биологическую и химическую
очистку, которые осуществляются в камерах с общепринятыми названиями:
решетки-дробилки, песколовки, первичные отстойники, аэротенки, регенераторы,
минерализаторы, вторичные отстойники, контактные резервуары. Технология очистки
сточных вод на очистных сооружениях г. Бирска осуществляется по общепринятой
схеме (рис. 1.).
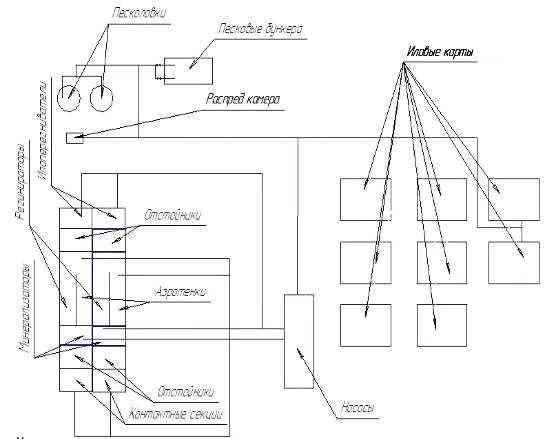
Рис. 1. Технологическая схема очистных
сооружений г.Бирска
Сточные воды, перекачиваемые главной
канализационной насосной станцией, подается напорно-самотечным коллектором в
приемную камеру очистных сооружений. Далее стоки направляются к
решеткам-дробилкам, проходят водоизмерительный лоток и поступают в песколовки,
где задерживаются крупные минеральные примеси, главным образом песок. Песок из
песколовок удаляется гидроэлеваторами в песковые бункеры, откуда вывозится
автотранспортом.
После песколовок стоки поступают в первичные
радиальные отстойники, где происходит задержание основной массы взвешенных
веществ. Осветленная вода из отстойников поступает в аэротенки, где происходит
биологический процесс очистки стоков. Активный ил, образующийся в аэротенках,
задерживается во вторичных отстойниках, а очищенные сточные воды поступают в
контактные резервуары. В контактных резервуарах обеззараживаются хлором и далее
по выпускному коллектору сбрасываются в р. Белую.
Циркулирующий активный ил из вторичных
отстойниках поступает в аэротенки, избыточный ил подается в аэробные
минерализаторы, откуда насосами, установленные в производственном корпусе,
подается на иловые площадки. Дренажные воды иловых площадок совместно с
хозфекальными водами внутриплощадочной канализации насосной станции
откачиваются в приёмную камеру очистных сооружений. Подсушенный ил с иловых
площадок вывозится автотранспортом, на специальное отведенное место, где должен
быть подвергнут компостированию, после чего может быть использован для нужд
сельского хозяйства как удобрение (Технологический регламент…, 1979).
I.4 Систематическое
положение организмов активного ила
В биоценозах активного ила присутствуют
представители шести отделов микрофлоры (бактерии, грибы, диатомовые, зеленые,
синезеленые, эвгленовые микроводоросли) и девяти таксономических групп
микрофауны (жгутиконосцы, саркодовые, инфузории, первичнополостные и
вторичнополостные черви, брюхоресничные черви, коловратки, тихоходки,
паукообразные).
Для правильной характеристики биоценоза
активного ила в целом необходимо охарактеризовать как состояние бактериальных
популяций, основных деструкторов загрязнений так и простейших, составляющих
приблизительно 5-10% от общей биомассы и осуществляющих активное доедание
диспергированных бактерий.
Активный ил представляет сложную экологическую
систему, организмы которой находятся на разных трофических уровнях.
Гетеротрофные бактерии, водоросли, сапрофитные грибы и сапрофитные простейшие -
первичные поедатели составляют I трофический уровень. Голозойные простейшие
представляют II трофический уровень, а отдельные виды нематод, хищные
коловратки, сосущие инфузории, тихоходки, хищные грибы - III трофический
уровень.
Отдел Бактерии (Bacteria)
Бактерии активного ила представлены тремя
основными формами: палочки кокки и спириллы. Маленький размер бактерий
определяет большую удельную поверхность, обеспечивающую высокую интенсивность
потребления субстрата. В сооружениях биологической очистки бактерии существуют
в виде компактной или рыхлой массы, образуя скопления, особая форма флокуляции
бактерий называется зооглеями. Зооглеи различают по форме: они могут быть
шарообразной, гроздевидной или древовидной формы с широкими лопастями или
представлять собой узкие плотные тяжи (прил.1, рис.1). Развитие и характер
зооглей зависит от качества поступающей сточной жидкости и параметров процесса
очистки.
Особый интерес в активном иле представляют
нитчатые хламидобактери вызывающие его вспухание при чрезмерном развитии, когда
они занимают “нишу” гелеобразующей сапрофитной микрофлоры, вытесненной, в свою
очередь, неблагоприятными условиями (недостаток кислорода, наличие токсических
веществ, высокие концентрации легкоокисляемых органических загрязняющих
веществ).
К хламидобактериям относятся бесцветные
серобактерии (роды Beggiatorix, Leucothrix, Thiothrix, и др.). Скользящие,
подвижные Thiothrix и Beggiatoa (прил.1, рис.2) различаются толщиной нитей,
сегментацией и расположением в них гранул серы. Серобактерии способны окислять
минеральные соединения серы.
Нитчатые бактерии рода Sphaerotllus наиболее
часто встречаются в активном иле и относятся также к хламидобактериям. Вызывают
вспухание ила при его перегрузке по легкоокисляемой органике.
Водоросли (Algae)
На сооружениях биологической очистки
обнаруживаются микроводоросли, относящиеся к 4-м отделам: диатомовые, зеленые,
синезеленые, эвгленовые.
Биоценоз активного ила аэротенков почти
полностью гетеротрофен. Водоросли на очистных сооружениях следует рассматривать
как облигатные виды для вторичных отстойников и факультативные для аэротенков.
В первичных отстойниках в связи с высокими
содержаниями загрязняющих веществ, обычно развиты только представители
вольвоксовых и синезеленых водорослей.
Особого внимания заслуживают синезеленые
водоросли Cyanpphyta. В связи с тем, что эти водоросли способны переходить к
фотосинтезу, сходному с бактериальным, высокой устойчивостью к воздействию
неблагоприяных факторов (температура, щелочность среды), а также токсикантов,
они могут достигать значительной численности в активном иле аэротенков и
вызывать вспухание, они же, как правило, вызывают "цветение" водоемов.
Трудно отделить от рода Sphaerotilus гормогониевые водоросли Tolypothrix.
Наиболее часто в активном иле встречаются синезеленые водоросли родов Anabaena,
Microcystis.
Грибы (Fungi)
В активном иле встречаются грибы поскольку они
способны усваивать специфические загрязнения сточных вод: клетчатку, парафин,
углеводороды. Основными формами грибов активного ила являются сапрофитные и
хищные.
Сапрофитные грибы, обычные обитатели аэротенков,
хорошо устойчивы к изменению рН сточных вод в кислую сторону, их отличает более
толстый септированный мицелий (прил.1, рис.3). Хищные гифомицеты на
вегетативном мицелии толщиной не более 5-8 мкм имеют ловчие приспособления для
улавливания и использования в пищу нематод, коловраток, простейших, часто
значительно превосходящих их по размеру (прил.1, рис.4). Хищные грибы
развиваются в биоценозе ила при высоком качестве очистки с нитрификацией, при
низких нагрузках на активный ил (Кутикова, 1984).
Подтип саркодовых (Sarcodina)
включает три класса Lobosea
(подклассы Testacealobosia
и Gymnamoebia), классы Filosea
и Hellozoea. Корненожки
разделяются на голых амеб (подкласс Gymnamoebia), характеризующихся мягкой
изменчивой формой тела и передвижением с помощью псевдоподий, и раковинные
(подкласс Testacealobosia и класс Filosea), которые несут раковину из
органического вещества и различных минеральных включений.
Голые амебы питаются бактериями, мелкими
простейшими и растворенными в воде питательными веществами. Такой разнообразный
тип питания позволяет предложить значительную роль голых амеб в очистке сточных
вод. Иногда в активном иле встречаются жгутиковые стадии голых корненожек.
При высокой нагрузке в активном иле развиваются
многочисленные мелкие амебы, так называемой группы "Limax", имеющие
удлиненную форму с одной подвижной псевдоподией. Эта группа, по-видимому,
представляет собой несколько видов амеб с разными циклами развития, устойчивыми
к действию температур и химических факторов. Также встречается крупная амеба
Pelomyxa palustris. Не исключено попадание в аэротенки мелких патогенных амеб
особенно в искусственно подогреваемых сооружениях. В нормально работающие
аэротенках изредка встречается крупная Amoeba proteus. Мелкие амебы -
показатели нарушения очистки, высокой нагрузки, неудовлетворительной аэрации,
диспергирования хлопьев и высокого содержания в иловой смеси бактерий, не
связанных с хлопьями активного ила. Крупные амебы - обычные обитатели нормально
функционирующего ила.
Тип питания саркодовых - голозойный. Основа пищи
бактерии, мелкие жгутиконосцы. Раковинным амебам присуще и диффузное питание
растворенными в воде питательными веществами (Гельцер, 1972).
Раковинные корненожки в активном иле разделяются
на две экологические группы: парящие и приуроченные к хлопьям активного ила.
Парящие, или планктонные корненожки, при отстаивании иловой смеси оседают
значительно медленнее иловой массы, они долгое время остаются во взвешенном
состоянии из-за большой удельной поверхности, создаваемой многочисленными
длинными развитыми филлоподиями. В эту группу входят Gromia fluviatilis и
Gromia neglecta. Питаются диспергированными бактериями, мелкими простейшими,
поэтому развиваются в массе при нарушении процесса очистки и дефлокуляции
хлопьев активного ила.
Остальные обнаруживаемые в активном иле
саркодовые объединяются в группу бентосных (связанных с хлопьями ила).
Увеличение численности бентосных корненожек связано с увеличением удельных
нагрузок на активный ил. Это обусловлено не типом питания, т.к., с одной
стороны, при увеличении удельных нагрузок увеличивается биомасса бактерий в хлопьях
(прирост ила), а с другой, - повышение содержания растворенной легкоусвояемой
органики в сточных водах улучшает диффузное питание раковинных амеб и создает
благоприятные условия для их интенсивного размножения.
Чаще всего в активном иле встречаются представители
родов Arcella, Centropyxis, Pamphagus, Euglypha (прил.1, рис.5), Difflugia и
др., которые практически постоянно представлены в активном иле.
Солнечники. Класс солнечников наиболее часто
представлен в активном иле родом Actinophrys. Солнечники - хищники, питаются
жгутиковыми, коловратками, инфузориями. Могут достигать массового развития в
период неблагоприятного воздействия на хлопья активного - ила, что приводит к
их разрушению и чрезмерному развитию мелких жгутиконосцев - излюбленной пищи солнечников
(Кутикова, 1984).
Подтип Бесцветные жгутиконосцы (Flagellata).
Встречаются как одиночные, так и колониальные формы. В загрязненных водах
образуют шаровидные колонии Oicomonas, каждая особь которых имеет по одному
длинному жгутику. Одновременно присутствуют Bodo - одиночные с двумя жгутиками.
Основную их пищу составляют бактерии, мелкие органические частицы ила,
растворенное органическое вещество. Из бесцветных эвгленовых жгутиконосцев
обычна Astasia. В качестве дополнения к классу жгутиковых рассматривают
бесцветных одноклеточных водорослей хризомонад, имеющих сходное с ними
строение. В аэротенках, особенно на прудах, на полях фильтрации в теплое время
года при хорошей очистке в массе развиваются зеленые эвгленовые Euglena,
Phacus, Trachelomonas. Наиболее крупный представитель данного класса - хищные
Peranema trichophorum - развивается в биоценозе аэротенков, работающих на
полную биологическую очистку, в иле с хорошими нитрифицирующими свойствами.
Низкие энергетические процессы и высокая
сапробиологическая валентность позволяет жгутиконосцам развиваться при высоких
нагрузках или в пусковой период сооружений, в условиях низкого содержания
кислорода в иловой смеси, в момент аварийных сбросов и перегрузок. В стабильных
илах эта группа обычно в массе не развивается, а появление их в биоценозах
может говорить о неблагополучии в технологическом режиме сооружения.
Подтип ресничные инфузории (Ciliata).
Индикаторное значение инфузорий определяется их способом питания и ассоциацией
с хлопьями активного ила. Степень ассоциированности инфузорий с хлопьями
зависит от зрелости последних.
Многие индивидуальные виды являются индикаторами
принципиально различных состояний процесса очистки. Присутствие большого числа
Vorticella campanula и Vorticella nebulifera указывает на недогрузку ила, в то
время как Vorticеlla microstoma характеризует противоположные условия.
При характеристике технологического процесса
очистки физиологическое ее состояние ресничных инфузорий имеет существенное
значение. Инфузории, как большинство простейших, обладают способностью при
наступлении неблагоприятных условий выделять вокруг своего тела особую
оболочку, т.е. инцистироваться, и таким способом временно избегать влияния
окружающей среды или, по крайней мере, уменьшать это влияние.
В активном иле встречаются четыре класса:
. Kinetophragminophora - все тело равномерно
покрыто ресничками, которые не дифференцированы на соматические и ротовые.
Цитостом расположен поверхностно. Многие из них - специализированные хищники
(роды Coleps ,Litonotus,
Hemiophrys, Amphileptus).
. Oligohymenophora - реснички на теле
расположены равномерно, ротовое отверстие углублено на дно вестибулума, со
сложной вестибулярной цилиатурой (род Colpidium).
В основном, это крупные, свободно плавающие инфузории - седиментаторы пищевых
частиц.
. Peritricha - сложная околоротовая цилиатура,
на теле ресниц нет. Перитрихи имеют форму колокольчиков, передний расширенный
конец тела образует валик (перистом), покрытый ресничками. В активном иле
встречаются перитрихи, прикрепленные во взрослом состоянии стебельком к
субстрату и поэтому часто называемые сидячими инфузориями.
. Polyhymenophora - на теле реснички
неравномерные, собранные в виде цирр на брюшной стороне для ползания, или
сохраняется равномерный ресничный покров. Также как у предыдущего класса
имеется сложная околоротовая спираль.
С увеличением содержания органических
загрязняющих веществ в сточных водах, а также при различных нарушениях
технологического режима очистки в активном иле возрастает доля крупных
бактериофагов, свободноплавающих инфузорий Chilodonella cucullulus. Другие
характерные виды: Chilodonella uncinata; Amphileptus claparedei; в
перегруженном иле встречаются: Tetrahymena, вид толерантный к анаэробным
условиям, сероводороду и углекислоте; Paramecium caudatum; Paramecium putrinum;
Paramecium aurelia (прил.1, рис. 6). Перечисленные виды развиваются в массе при
диспергировании хлопьев ила, в биоценозе высоконагружаемых аэротенков,
отдельные представители свидетельствуют о возможном залеживании и гниении ила в
аэротенках или отстойниках, также характеризуются выносливостью к недостатку
кислорода.
Инфузории с расположением небольшого количества
ресничек на брюшной стороне тела, которыми они пользуются как ножками, быстро
передвигаясь по хлопьям активного ила, называются брюхоресничными (прил.1,
рис.7). Aspidisca costata наиболее распространена в активном иле, нормально
работающих аэротенков. Однако из-за широкого диапазона толерантности к
разнообразным факторам среды часто встречается в илах различных условий
очистки. Aspidisca lynceus и Aspidisca turrita - брюхоресничные инфузории,
встречающиеся при снижении нагрузок, с хорошо протекающими процессами
нитрификации.fallax выносит несколько большее загрязнение. Euplotes patella
непрерывно пребывают в быстром движении на поверхности ила.
Из отряда Heterotricha характерными являются
Stentor; Spirostomum ambiguum (прил.1, рис. 8).
Кругоресничные инфузории (Peritricha)
прикрепляются ножкой к хлопьям активного ила. Однако, среди представителей
данного класса имеются и подвижные виды. Прикрепленных перитрих более 1000
видов и среди них встречаются как одиночные, так и колониальные формы (прил.1,
рис. 9). Прикрепленные инфузории в случае ухудшения аэробных условий или при
наступлении других неблагоприятных факторов переходят в плавающее состояние.
Род Vorticella, преобладающий в аэротенках,
отличается высокой пластичностью приспособления к условиям среды, встречается в
широком диапазоне органических нагрузок. Питается бактериями и мелким детритом.
Vorticella microstoma обычна в очистных сооружениях. Род Vorticella дает
несколько переходных вариантов, при этом перистом перитрих оказывается тем
шире, чем ниже концентрация органических веществ (и численность бактерий), в то
время как в перегруженных илах перистом узкий.
Колонии рода Epistylis. Наличие вида Е.
plicatilis в активном иле свидетельствует о высоком качестве очистки и хороших
нитрифицирующих свойствах ила.
Представители рода Opercularia Вид Opercularia
coarctata считается постоянным обитателем "хорошего" созревшего ила,
особенно, если колонии находятся в активном состоянии с работающими раскрытыми
ресничными дисками.
Род Zoothamnium Наличие представителей этого
рода в активном иле, как правило, свидетельствует о полном окислении
загрязняющих веществ с последующей нитрификацией. В массе развиваются в
недогруженных илах с продленной аэрацией.
Роды Vaginicola,
Cothurnia и Thuricola
(прил.1, рис. 10) Vaginicola crystallina, V.striata характеризуют недогруженные
очистные сооружения, большой период аэрации и высокое качество очищенной воды.
Подтип сосущие инфузории (Suctoria).
Специализированные хищники, прикрепленные к хлопьям ила, питание составляют
мелкие и крупные простейшие ила. Развиваются суктории в небольших количествах
при полном окислении загрязняющих веществ и стабилизации процесса очистки
сточных вод. Индикаторы высокого качества очистки. Суктории в активном иле
представлены прикрепленными с помощью несокращающегося стебелька формами
(прил.1, рис. 11). В активном иле встречаются следующие виды сосущих инфузорий:
Tokophrya mollis, T. quadripartita, Podophrya fixa, P. maupasii, P. carchesii.
Представители родов Acineta, Discophrya, ,Rhadophrya встречаются в
низконагружаемых илах, в аэротенках продленной аэрации, обеспечивающих высокое
качество очистки сточных вод (Кутикова, 1984).
Многоклеточные беспозвоночные активного ила
(Metazoa)
Класс Коловратки (Rotifera) Некоторые виды
коловраток покрыты панцирем (прил.1, рис. 12), они развиваются обычно в
низконагружаемом активном иле, формирующем высокое качество очистки.
Беспанцирные коловратки, такие как Rotaria rotatoria, Philodina roseola,
обитатели ила аэротенков, обеспечивающих полное окисление загрязняющих веществ.
При сокращении передняя часть (голова) втягивается в туловище, которое чаще
всего сужается в более или менее ясно выраженную ногу, часто кольчатую снаружи
(ложносегментированную), заканчивающуюся присоской, либо одним или несколькими
пальцами. Коловратки - сложно организованные животные, имеющие мускулатуру и
органы пищеварительной системы. Имеются нервные узлы и головной мозг. Строение
полового аппарата самок лежит в основе подразделения коловраток на две группы:
с 2-мя яичниками и 2-мя желточниками - Bdelloida (исключительно самки, самцы
никогда не обнаруживались) и с 1-м яичником и 1-м желточником Monogonata.
Представителей коловраток обычно можно
обнаружить в активном иле зрелого возраста при полной биологической очистке
(прил.1, рис. 13).rotatoria, Philodina roseola, Adineta - представители
биоценозов ила обычных аэротенков городских очистных сооружений. Ухудшение условий
работы аэротенков вызывает появление Callidina и Rotaria neptunia.
Представители родов Lecane, Lepadella, Cephalodella, Colurella характеризуют
работу аэротенков с низкими нагрузками, продленную аэрацию, полное окисление.
Примыкающий к собственно коловраткам и
относящийся к червям типа Gastrotriha (брюхоресничные черви), род Chaetonotus,
хотя и редко, но обнаруживается в активном иле, в основном, при продленной
аэрации. Легко отличается от коловраток отсутствием мерцательного органа.
Питаются гастротрихи бактериями, протистами и детритом с помощью ротовых
ресничек или засасывая, работающей как насос, глоткой. Chaetonotus maximus -
биоиндикатор недогруженных илов, высокой минерализации, глубокой очистки.
Тип Первичнополостные черви. В активном иле из
первичнополостных червей встречаются круглые черви нематоды (Nematoda) (прил.1,
рис. 14). В биоценоз активного ила входят несколько видов нематод, которые в
незначительных количествах могут развиваться в хорошо работающем иле. Заметное
количество может указывать на залеживание, плохое перемешивание ила,
недостаточную аэрацию, поскольку нематоды предпочитают застойные зоны. Нематоды
пропускают часть иловой массы через свой кишечник, часто не успевая переварить
ее, что приводит иногда к их гибели. Хлопья от пищеварительной деятельности
хорошо минерализуются, уплотняются.
Тип Вторичнополостные черви. В биоценоз
активного ила входит множество микроскопических малощетинковых червей
Oligochaeta (прил.1, рис. 15). Питаются олигохеты как и нематоды, активным
илом, пропуская его через кишечник.
В биоценозах активного ила чаще всего
развиваются черви аэлозомы, несущие жировые включения, окрашенные
коратиноидами. Аэлозомы очень быстро размножаются в активном иле за счет
паротомии, то есть отделения особей от заднего конца тела, который быстро
дорастает до нужных размеров. При очень хорошем питании паротомией может
отделяться целая, цепочка червей: три и даже четыре особи. Питаются бактериями,
простейшими в хлопьях ила, которые, в свою очередь, хорошо минерализуют и
уплотняют.
Класс Паукообразные. В хорошем активном иле
редко встречается небольшое, количество водных клещей, относящихся к классу
паукообразных (Arachnida) Клещи развиваются в хорошо минерализованном иногда в
голодающем активном иле. Более часто они встречаются в биофильтрах
Тихоходки (Tardigrada) считаются родственными
членистоногим, от которых отличаются отсутствием их основных признаков -
наружного скелета и членистых конечностей. Питание хищное, прокалывают жертву
двумя стилетами, расположенными в ротовой полости, и высасывают клеточное
содержимое из водорослей, простейших, нематод и коловраток. Для переживания
неблагоприятных условий имеют две приспособительные особенности -
инцистирование (животное втягивает конечности, сбрасывает кутикулу и
сворачивается в капсулированный шарик) и образование толстостенных покоящихся
яиц (прил.1, рис. 16). В таком анабиотическом состоянии тихоходки могут
существовать много лет, что объясняет их периодическое с интервалом в несколько
лет) появление на очистных сооружениях в тех случаях, когда представители
третьего трофического уровня получают благоприятные условия для своего
развития.
Ветвистоусые рачки. Daphnia, Moina иногда в
массовом количестве развиваются в аэротенках-отстойниках или во вторичных
отстойниках недогруженных станций с длительным периодом аэрации и глубокой
нитрификацией при условии хорошего качества очистки. В состав активного ила не
входят.
На биофильтрах, кроме всех перечисленных
организмов, встречаются личинки насекомых, двукрылых Psichoda. Обычны на
биофильтрах и вилохвостки Podura - на конце тела есть прыгательная вилка
(Догель,1981).
II. МАТЕРИАЛ И МЕТОДИКА
II.1 Материал и
оборудование
Исследования были проведены на очистных
сооружениях г.Бирска в 2008-2010г. Материалом для работы служили пробы активного
ила двух аэротенков и двух регенераторов, а также данные гидробиологического
анализа в течении 2009 года. Пробы активного ила исследовали в
специализированной лаборатории, где было использовано следующее оборудование:
- микроскоп бинокулярный с увеличением
в 30, 100, 200, 400, 900 раз;
- микроскоп люминесцентный с
увеличением в 30-1350 раз;
- микроскоп бинокулярный
стереоскопический (МБС);
- окуляр-микрометр с измерительной
линейкой;
- объект-микрометр ГОСТ 7513;
- устройство для наблюдения методом
фазового контраста КФ-4;
- весы лабораторные общего назначения
ГОСТ 24104;
- сушильный шкаф с терморегулятором
СНОЛ 2,5 (3,5);
- холодильник для хранения проб;
- счетные камеры Кольвитца, Горяева ТУ
42816, Тома на 0,1-1,0 мм глубины;
- пробоотборник любого типа объемом
500-700 см3;
- термометры в металлической оправе
для измерения температуры воды ГОСТ 2045..2. Гидробиологический анализ
активного ила
Для характеристики работы очистных сооружений
гидробиологический анализ имеет основное значение, поскольку характеризует
состав, количественное распределение и своеобразие организмов активного ила.
Характерные изменения в биоценозе активного ила наилучшим образом отражают
протекание процесса очистки, позволяют быстро оценить его качественный уровень
и сделать выводы об основных неблагоприятных факторах, ухудшающих эффективность
очистки сточных вод.
Гидробиологический анализ заключается в оценке,
с помощью микроскопирования, состояния и структурных особенностей биоценоза
активного ила, организмы которого обладают способностью реагировать
качественным изменением и количественным распределением отдельных групп на
состав и свойства очищаемых сточных вод, а также на условия жизнеобеспечения,
регулируемые режимом эксплуатации сооружений (Методическое руководство по
гидробиологическому…,1996).
Отбор и хранение проб
Микроскопирование ила производится 1 раз в
декаду. В период, когда работа сооружений дестабилизируется какими-либо
чрезвычайными обстоятельствами (поступление на очистку токсичных сточных вод,
нарушение технологического режима и т.д.), требуется более регулярное и
тщательное гидробиологическое наблюдение, анализ проводится 2-3 раза в декаду
или ежедневно. Пробы для анализа берут отдельно из каждого узла сооружений
биологической очистки (аэротенки, регенераторы, вторичные отстойники и т.д.).
Пробы, отобранные из разных зон аэротенков, будут характеризовать состояние
зональных биоценозов на разных этапах очистки сточных вод, поэтому отбирать
пробы в каждом коридоре аэротенков на гидробиологический анализ не следует.
Приготовленную посуду для отбора проб
ополаскивают отобранной водой. Для анализа пробу отбирают повторно. Для этого
используют ковш объемом 500 см3. Первый раз ковш следует погрузить в воду на 3
мин, чтобы его температура сравнялась с температурой воды, затем ковш погружают
на глубину 0,5 м и сразу же извлекают. Иловую смесь переливают в стеклянную
бутыль объемом 3 дм3 так, чтобы все содержимое ковша было вылито. Отбор
повторяют до тех пор, пока не наберется 2,8-2,9 дм3 иловой смеси. Отобранная
проба снабжается этикеткой, на которой указывается дата, место отбора. Бутыль
не закупоривают и немедленно доставляют в лабораторию, где ее содержимое
тщательно перемешивается и разливается следующим образом:
. 1 дм3 - в литровый мерный цилиндр,
калиброванный от самого дна для определения дозы ила по объему;
. 1,5 дм3 - в склянку для отстаивания и
определения прозрачности надиловой воды;
. 100 см3 - в цилиндр объемом 100 см3 для
определения дозы ила по весу;
. 100 см3 в стакан для
гидробиологического анализа и хранения.
При взятии проб измеряют температуру воды. Для
этого используют термометры с ценой деления 0,1 °С. Для определения температуры
на месте взятия пробы 1 дм3 воды наливают в склянку, нижнюю часть термометра
погружают в воду и через 5 мин отсчитывают показания, держа его вместе со
склянкой на уровне глаз.
Время от отбора пробы до ее анализа необходимо
сократить до минимума, к гидробиологическому анализу следует приступать не
позднее 30-40 мин с момента взятия пробы, после того как температура смеси
активного ила сравняется с температурой помещения. При невозможности проведения
анализа в указанный срок пробы активного ила охлаждают (+4°С). Хранить пробы
следует не более 24 часов после отбора при температуре 3-4°С. Консервация проб
не допускается. При проведении анализа температура пробы должна соответствовать
температуре помещения, в котором он проводится
Гидробиологический метод
Гидробиологический анализ активного ила состоит
из следующих этапов:
. визуальное исследование ила в
стеклянном цилиндре;
. определение видов, подвидов организмов
(для мелких жгутиконосцев, колоний бактерий ограничиваются более высокими
систематическими рангами);
. определение численности каждого вида
методом количественного счета;
. описание функционального состояния,
особенностей внутреннего строения, морфологических изменений у индикаторных
организмов;
. определение размеров некоторых
характерных биоиндикаторов проводится в том случае, если при микроскопическом
исследовании выявляется их заметное измельчение, а также для уточнения видовой диагностики;
. распределение биоиндикаторов на
характерные группы организмов, присутствующих в данной пробе ила (основные
критерии распределения - это пищевые потребности биоиндикаторов, их отношение к
концентрации растворенного кислорода, адаптационно-экологическая пластичность,
понимаемая как способность существовать и приспосабливаться в широком диапазоне
изменений окружающей среды, устойчивость к воздействию токсичных сточных вод);
. итоговая оценка биоценоза, отнесение
его к одному из определенных типов, характеристика установленного типа;
. подготовка гидробиологического
заключения.
Выполненные по каждой анализируемой пробе
процедуры записывают в рабочем журнале, а качество активного ила сравнивают с
данными гидрохимических анализов и технологических расчетов.
Перед исследованием ила под микроскопом
необходимо описать его особенности при визуальном наблюдении в стеклянном
цилиндре. Измеряют осадок ила по объему в цилиндре объемом 1 дм3 за 30 мин
отстаивания, скорость осаждения, цвет хлопьев активного ила. Нормальный цвет
ила буро-коричневый, густого мясного бульона. Темный, землистый ил с оттенком
черноты может быть следствием плохого перемешивания иловой смеси и недостатка
кислорода или плохой циркуляции и откачки ила (залеживание, загнивание ила). Запах
ила должен быть болотистый, без преобладания запаха каких-либо химических
веществ. Отмечают процесс хлопьеобразования при уплотнении, происходит ли
оседание общей массой с четкой границей очищенной жидкости или наблюдается
разрыв массы, быстро или медленно протекает флокуляция (компактные или
диспергированные хлопья и загрязняют ли надиловую воду).
После 30-минутного отстаивания описывают внешний
вид надиловой воды. Надиловая вода должна быть прозрачная, не окрашенная, не
опалесцирующая. Прозрачность зависит от глубины окисления загрязняющих веществ,
а также от наличия в воде мелких, не осе дающих за 2 часа хлопьев активного ила
и диспергированных бактерий. Любые, даже незначительные изменения в составе
сточных вод и в технологическом режиме их очистки имеют следствием присутствие
в очищенной воде мелких хлопьев и большого числа свободно живущих бактерий, что
приводит к падению прозрачности очищенной воды. Прозрачность воды анализируется
в пробе, отобранной в конце зоны аэрации или сборном канале аэротенков. При
прозрачности 30 см и более все другие санитарные показатели, как правило,
соответствуют высокой степени очистки.
Рассчитывается иловой индекс и использует его
значения для характеристики седиментационных свойств активного ила. Условно
принято считать для очистных сооружений искусственной биологической очистки
оптимальными значениями илового индекса от 90 до 130 см3/г. Одно из основных
требований к иловому индексу - стабильность его значений, которая указывает на
удовлетворительные условия эксплуатации очистных сооружений.
Для исследования микрофауны активного ила
наиболее широко используется метод "живой" капли под покровным
стеклом или в счетных камерах с помощью световой, фазовоконтрастной микроскопии
(Методическое руководство по гидробиологическому…,1996).
Метод количественного учета организмов
При ориентировочном просмотре проб можно вести
учет частоты встречаемости организмов индикаторов по балльной системе, когда
оценивается относительная численность организмов по условной пятибалльной шкале
(табл. 1.). Преимущества - быстрота выполнения анализа (10-15 мин), поэтому
использовать этот метод лучше при массовых анализах. Недостаток -
субъективность оценки, невысокая точность. Необходимо тщательно перемешать
пробу, затем отбирается некалиброванная капля в объеме 0,1 см3.
При учете используется покровное стекло 24x24
мм. Просматривается 2-3 капли, в каждой по 40 полей зрения, причем препарат
проводят зигзагообразно, так, что материал просматривается практически
полностью. Учет производится при увеличении 5x10 или 10x10. Учету подлежат все
встречающиеся организмы.
Таблица 1.
Условные баллы встречаемости организмов
|
Частота
встречаемости
|
Цифровое
обозначение частоты встречаемости (баллы)
|
|
единично
|
1
|
|
мало
|
2
|
|
порядочно
|
3
|
|
много
|
4
|
|
масса
|
5
|
Определение концентрации активного ила по массе
(дозы ила по весу)
Метод заключается в фильтровании определенного
объема иловой смеси с последующим высушиванием и взвешиванием осадка.
Характеризует сухое вещество активного ила, выраженное в г/дм3.
Выполнение измерений: В сушильный шкаф ставятся
открытые пронумерованные бюксы с помещенными в них беззольными бумажными
фильтрами. После того, как температура установится на 105°С, отмечают время и
сушат 1 час, затем повышают температуру до 120°С и сушат еще 30 минут. В шкафу
бюксы закрывают, охлаждают в эксикаторе до комнатной температуры и взвешивают.
Отобранная иловая смесь находится в лабораторном помещении пока ее температура
не сравняется с комнатной, после чего иловую смесь тщательно перемешивают,
наливают в 100 см3 цилиндр и фильтруют этот объем через бумажный фильтр с
помощью водоструйного насоса через воронку Бюхнера. После того, как иловая
смесь вся пройдет через фильтр, цилиндр тщательно споласкивают небольшим
количеством дистиллированной воды, которая также отфильтровывается.
Фильтр, сохраняющий форму воронки, накладывается
на соответствующий бюкс и помещается в холодный сушильный шкаф, крышка бюкса
помещается рядом с бюксом. Затем анализируемый материал помещается в шкаф.
Включаем его и при 120°С пробы выдерживаются до постоянного веса. Первое
взвешивание бюксов производится через 30 мин высушивания. Перед взвешиванием
шкаф выключается, каждый фильтр осторожно, чтобы не потерять осадок,
складывается и помещается в соответствующий бюкс. После этого с помощью
специальных щипцов бюксы закрываются крышками и переносятся из шкафа в
эксикатор.
После того, как бюксы в эксикаторе охладятся до
комнатной температуры, начинают взвешивание ила. Перед взвешиванием следует
тщательно проверить соответствие номеров крышек и бюксов. Взвешивают, вычитая
начальную массу бюкса, с фильтром. Доза ила по весу d рассчитывается по
формуле:
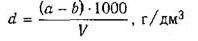
где 1000 - коэффициентпересчета см3 в дм3;
а и b - вес бюкса с осадком и без осадка
соответственно, г;- объем отфильтрованной пробы, см3.
Определение дозы ила по объему и илового индекса
Доза ила по объему характеризует
седиментационные свойства активного ила, т.е. способность его к осаждению за 30
минут отстаивания. Иловой индекс это объем 1 грамма сухого ила занимаемый им за
30 минут отстаивания в 1 дм3 цилиндре. Иловой индекс также характеризует
седиментационные свойства ила, но уже с учетом его сухой массы.
Отобранная иловая смесь находится в лабораторном
помещении пока ее температура не сравняется с комнатной, после чего иловая
смесь тщательно перемешивается, наливается в 1 дм3 цилиндр, который ставится на
горизонтальную поверхность стола, включается секундомер и через каждые 3 мин
отмечают объем в см3, занимаемый оседающей массой активного ила. Через 30 мин
отстаивания записывают окончательное значение дозы ила по объему, выраженное в
см3. Результат округляют до целых см3.
Наблюдения следует проводить в прохладном
помещении, вдали от источников тепла, так как при температуре выше 25°С во
время наблюдений может произойти всплывание осевшего активного ила вследствие
денитрификации. В жаркое время года пробу перед анализом желательно охладить до
18-20°С в холодильнике.
Иловой индекс рассчитывается, после того как
получены значения дозы ила по сухому весу и объему. Результат, получается от
деления численных значений дозы ила по объему V (см3/дм3) на дозу ила по сухому
веществу d (г/дм3):
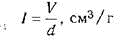
Прозрачность надиловой воды
Метод заключается в визуальном определении
светопропускания через столб надиловой воды. Мерой прозрачности служит высота
столба воды, выраженная в см, при которой можно читать шрифт определенного
размера и типа.
Отобранную пробу иловой смеси доводят до
комнатной температуры, тщательно перемешивают, наливают в склянку емкостью 1-1,5
дм3 и отстаивают 2 часа.
Прозрачность определяется чтением стандартного
шрифта Снеллена (высота букв 3,5 мм) через наполненный водой цилиндр Снеллена.
Цилиндр располагается над шрифтом на расстоянии 2 см. Чтение шрифта проводится
в хорошо освещенной комнате, но без попадания прямых солнечных лучей. Столб
воды регулируется за счет ее отбавления, поскольку сначала цилиндр Снеллена
наполняется до краев. По результатам трех определений вычисляют среднюю
величину прозрачности, выраженную в сантиметрах. Точность определения - ±0,5 см
(Методическое руководство по гидробиологическому…,1996).
Составление гидробиологического заключения.
Ведение рабочего журнала
По результатам гидробиологического анализа и
количественного счета организмов составляется таблица.
При характеристике биоценоза не следует уделять
внимание отдельным малочисленным видам, только характеристика сообщества как
единого целого позволит получить правильные выводы. Особое внимание
гидробиолога должно заслуживать значительное численное развитие, подавление или
исчезновение из биоценоза того или иного вида. Окончательные выводы делаются по
доминированию или исчезновению определяющих видов-индикаторов, индексу видового
разнообразия.
При сопоставлении выводов, полученных на
основании гидробиологического анализа, с гидрохимическими данными следует
помнить, что они могут не совпадать, поскольку гидробиологический анализ
выявляет нарушения более оперативно. При неблагоприятном воздействии сточных
вод или нарушении технологического режима эксплуатации очистных сооружений
качество очистки, регистрируемое химическими анализами, может сохраняться
удовлетворительным, а гидробиологическое обследование немедленно выявит
разрушение хлопьев и изменения в составе биоценоза и физиологическом состоянии
организмов ила. Такое запаздывание ухудшения качества очистки по
гидрохимическим данным объясняется тем, что при разрушении хлопьев и отдельных
клеток организмов ила очистку некоторое время осуществляют их внутренние
ферменты.
Все свои наблюдения гидробиолог регулярно заносит
в рабочий журнал. В начале рабочего журнала указывают сведения по пунктам:
. наименование и номер сооружения
(аэротенк, регенератор);
. расположение точки отбора проб
активного ила;
. дата, час отбора проб и исследования,
температура иловой смеси;
. осадок активного ила по объему,
см3/дм3;
. доза ила по весу, г/дм3;
. иловой индекс, см3/г;
. внешний вид надиловой воды;
. прозрачность надиловой воды, см;
. результаты качественного и
количественного гидробиологического контроля;
. индикаторная оценка процесса
биологической очистки и рекомендации по устранению выявленных нарушений.
III. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
.1
Определение видового состава активного ила
Одним из первых этапов гидробиологического
анализа является определение видов, подвидов организмов активного ила. Для
каждого сооружения биологической очистки должны быть определены свои
характерные биоиндикаторы для удовлетворительных и неудовлетворительных условий
ведения процесса очистки. Для сопоставления результатов гидробиологического
анализа с состоянием процесса биологической очистки и технологическим режимом
эксплуатации необходимо определить видовой состав биоиндикаторов активного ила
и их численное значение.
Анализируя пробы активного ила аэротенков и
регенераторов очистных сооружений г.Бирска, мы зарегистрировали следующий
состав: Aspidisca,
Litonotus, Vorticella
campanula, Vorticella
microstoma, Arcella,
Colpidium, Rotaria,
Coleps, Callidina,
Amoeba, Nematoda,
Rotaria, Opercularia,
Notommata, Epistylis,
Podophrya, Stentor,
Philodina, Catlypna,
Mastigophora, Oligochaeta,
Sphaerotilus, Zoogloea.
Данные представители были сфотографированы (прил. 1.). Анализ видового состава
организмов активного ила в период 2009 года (табл. 2.), показал, что
микроорганизмы находятся в относительном видовом и количественном постоянстве.
Это позволяет сделать вывод, что биоценоз активного ила стабильный и зрелый.
Присутствие достаточного количества коловраток и червей говорит о высокой
степени развития активного ила.
III.2 Годовая динамика видового состава активного ила
При оценке биоценоза активного ила особое
внимание уделяется многочисленным видам, процессам подавления или исчезновения
того или иного вида. Выводы делаются по доминированию или исчезновению
определяющих видов-индикаторов.
Результаты количественного счета организмов мы
попытались проанализировать в динамике с учетом данных гидрохимического анализа
этого же года (прил. 2.). Сравнивая значения допустимых концентраций со
значениями различных показателей анализа сточных вод при входе выяснилось, что
содержание большинства из последних, кроме хлорид-ионов и хрома, превышает
нормы. Значения же водородного показателя (pH)
варьирует в пределах предельных концентраций (6,5-8,5). Анализ количественного
счета организмов активного ила (табл. 2.) показал что численность таких видов
как Vorticella
campanula, Vorticella
microstoma, Colpidium,
Coleps, Arcella
в течении года варьирует.
Численность Vorticella
campanula в течении года
варьирует в пределах от 1 балла до 4 (рис. 2), что составляет в количественном
соотношении 1-40 особей в 0,1см3 пробы. Максимальные численные значения
наблюдаются в феврале и сентябре, тогда как минимальные приходятся на май-июль.
В остальные месяцы года можно обнаружить промежуточные значения. Подобную
динамику численности Vorticella
campanula можно объяснить
недогруженностью ила и низкими температурными значениями в холодные месяцы
года. Корреляции с показателями гидрохимического анализа не обнаружено.
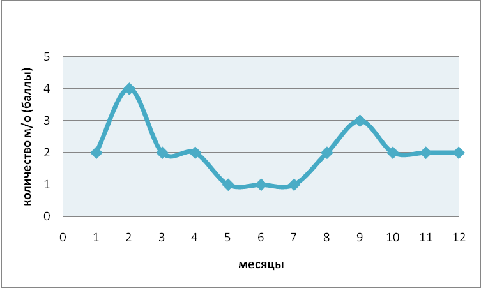
Рис. 2. Годовая динамика численности Vorticella
campanula
Численность Vorticella
microstoma в течении года
варьирует в пределах от 1 до 3 баллов (рис. 3) что составляет в количественном
соотношении 1-20 особей в 0,1 см3 пробы. Максимальные численные значения
наблюдаются в феврале и сентябре. Минимальные численные значения - в апреле,
июне и июле. Vorticella
microstoma это вид индикатор,
который развивается в перегруженном иле, проведя корреляцию с данным фактором
зависимости не выявлено. Корреляции с показателями гидрохимического анализа,
значениями pH и температуры
не обнаружено. Природа динамики численности данного вида не ясна и требует
дальнейшего изучения.
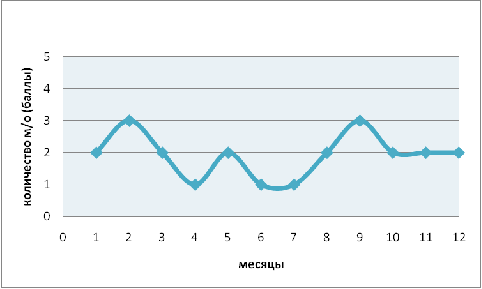
Рис. 3. Годовая динамика численности Vorticella
microstoma
Численность рода Coleps
в течение года варьирует в пределах от 0 до 3 баллов (рис. 4) что составляет в
количественном соотношении 0-20 особей в 0,1см3 пробы. Максимальные численные
значения наблюдаются в июне и сентябре, тогда как минимальные приходятся на
апрель и июнь. Корреляции с показателями гидрохимического анализа, значениями pH
и температуры не обнаружено. Можно предположить, что колебания численности
связаны с возрастанием численности бактерий (в период паводка) т.к. Coleps
является узкоспециализированным хищником.
Численность рода Colpidium
в течение года варьирует в пределах от 0 до 2 баллов что составляет в
количественном соотношении 0-10 особей в 0,1см3 пробы. Максимальные численные
значения наблюдаются с мая по июль, тогда как минимальные приходятся на
сентябрь. Корреляции с показателями гидрохимического анализа, значениями pH
не обнаружено. Такую динамику численности можно объяснить тем, что данный род
является стенобионтом по отношению к температурному режиму. На графике (рис. 5)
видно как резко возрастает численность с повышением температуры в летние
месяцы.
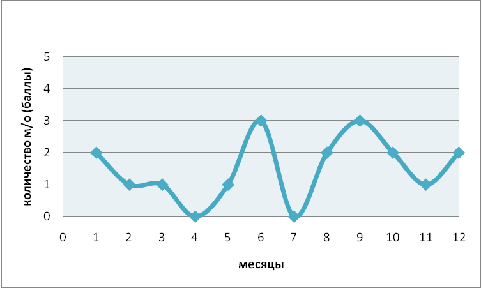
Рис. 4. Годовая динамика численности рода Coleps
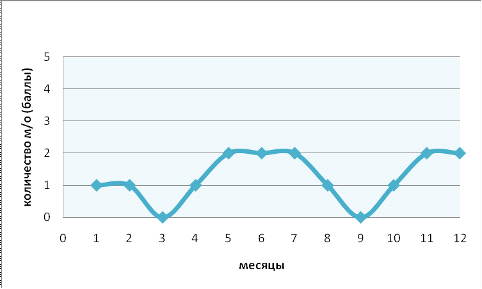
Рис. 5. Годовая динамика численности рода Colpidium
Численность рода Arcella
в течение года варьирует в пределах от 1 до 4 баллов (рис. 6) что составляет в
количественном соотношении 1-100 особей в 0,1см3 пробы. Максимальные численные
значения наблюдаются в августе и сентябре, тогда как минимальные приходятся на
март и апрель. Корреляции с показателями гидрохимического анализа и температуры
не обнаружено. Прослеживается скачкообразное колебание численности с периодом в
два месяца. Сопоставив данные динамики численности и значений pH
можно выявить зависимость. В период увеличения численности наблюдается снижение
значения pH.
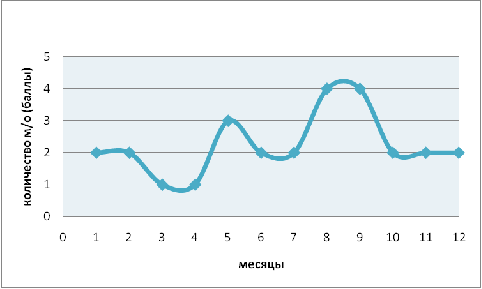
Рис. 6. Годовая динамика численности рода Arcella
Исходя из вышеизложенного можно сделать вывод,
что на очистных сооружениях г. Бирска, на состояние очистки существенным
образом влияет температура окружающей среды и активного ила. Значение pH
колеблется в незначительной степени. Малая токсичность стоков обусловлена отсутствием
тяжелой, химической и нефтяной промышленностью Токсичность стоков имеет
малозначительное влияние на динамику численности микроорганизмов. Корреляция
между гидробиологическим и гидрохимическим может обнаруживаться не сразу т.к.
при нарушении процесса очистки сточных вод, после разрушения хлопьев и клеток
микроорганизмов, еще некоторое время воздействуют ферменты. Гидробиологический
анализ является более оперативным по сравнению с гидрохимическим.
III.3 Определение
эффективности работы активного ила
Эффективность биологической очистки сточных вод
может быть оценена только по состоянию работы активного ила, для чего
проводится полный анализ характеристик исследуемых проб. За период 2009 года
нами был проведен гидробиологический анализ и проанализированы данные проб
активного ила по следующим показателям: доза ила по объему, доза ила по весу,
иловый индекс, pH,
температура, цвет осадка, видовое разнообразие, количественный учет численности
микроорганизмов (табл.2). Гидробиологический анализ проб проводили 2-3 раза в
месяц, точками отбора служили аэротенки и регенераторы двух секций (I,
II).
Таблица 2.
Рабочий журнал гидробиологического анализа
активного ила
|
Дата
отбора
|
Точка
от бора
|
Доза
ила по объему см3
|
Доза
ила по весу гр.
|
Иловый
индекс см3/г
|
pH
|
t0C
|
Внешний
вид осадка
|
Название
микроорганизмов
|
Баллы
|
|
|
|
|
|
|
|
|
|
I
|
II
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
|
14.01.
|
Iа
|
32
|
|
|
7,44
|
+6
-15
|
Коричн
|
Aspidisca
|
3
|
5
|
|
Iв
|
60
|
|
|
7,42
|
|
Прозрачн
|
Litonotus
|
2
|
1
|
|
IIа
|
80
|
|
|
7,24
|
|
Коричн
|
Vorticella campanula
|
2
|
2
|
|
IIв
|
87
|
|
|
7,26
|
|
Прозрачн
|
Vorticella microstoma
|
2
|
2
|
|
|
|
|
|
|
|
|
Arcella
|
2
|
2
|
|
|
|
|
|
|
|
|
Colpidium
|
1
|
1
|
|
|
|
|
|
|
|
|
Rotaria
|
-
|
1
|
|
|
|
|
|
|
|
|
Coleps
|
-
|
2
|
|
|
|
|
|
|
|
|
Callidina
|
-
|
2
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
2
|
2
|
|
15.01.
|
Iа
|
31
|
1,064
|
291
|
7,43
|
+5
-20
|
Коричн
|
Colpidium
|
2
|
1
|
|
Iв
|
58
|
1,482
|
391
|
7,40
|
|
Прозрачн
|
Vorticella campanula
|
2
|
2
|
|
IIа
|
71
|
2,563
|
277
|
7,19
|
|
Коричн
|
Vorticella microstoma
|
2
|
2
|
|
IIв
|
76
|
3,107
|
245
|
7,21
|
|
Прозрачн
|
Arcella
|
2
|
2
|
|
|
|
|
|
|
|
|
Aspidisca
|
3
|
5
|
|
|
|
|
|
|
|
|
Amoeba
|
1
|
-
|
|
|
|
|
|
|
|
|
Callidina
|
-
|
|
|
|
|
|
|
|
|
Nematoda
|
-
|
1
|
|
|
|
|
|
|
|
|
Rotaria
|
-
|
1
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
2
|
2
|
|
15.02.
|
Iа
|
33
|
1,432
|
230
|
7,27
|
+6
-17
|
Коричн
|
Aspidisca
|
3
|
4
|
|
Iв
|
55
|
1,629
|
338
|
7,13
|
|
Прозрачн
|
Coleps
|
-
|
1
|
|
IIа
|
54
|
2,103
|
257
|
7,18
|
|
Коричн
|
Vorticella campanula
|
3
|
3
|
|
IIв
|
69
|
2,506
|
275
|
7,09
|
|
Прозрачн
|
Vorticella microstoma
|
3
|
3
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
|
|
|
|
|
|
|
|
Litonotus
|
1
|
-
|
|
|
|
|
|
|
|
|
Arcella
|
2
|
2
|
|
|
|
|
|
|
|
|
Colpidium
|
1
|
1
|
|
|
|
|
|
|
|
|
Rotaria
|
-
|
1
|
|
|
|
|
|
|
|
|
Callidina
|
-
|
1
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
2
|
2
|
|
24.02.
|
Iа
|
46
|
|
|
7,25
|
+8
-8
|
Коричн
|
Vorticella campanula
|
3
|
4
|
|
Iв
|
67
|
|
|
7,11
|
|
Прозрачн
|
Vorticella microstoma
|
2
|
3
|
|
IIа
|
50
|
|
|
7,17
|
|
Коричн
|
Arcella
|
1
|
2
|
|
IIв
|
66
|
|
|
7,06
|
|
Прозрачн
|
Aspidisca
|
2
|
2
|
|
|
|
|
|
|
|
|
Litonotus
|
2
|
3
|
|
|
|
|
|
|
|
|
Rotaria
|
1
|
1
|
|
|
|
|
|
|
|
|
Nematoda
|
2
|
2
|
|
|
|
|
|
|
|
|
Coleps
|
-
|
1
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
2
|
2
|
|
10.03.
|
Iа
|
74
|
2,417
|
306
|
7,16
|
+10
-3
|
Коричн
|
Colpidium
|
3
|
2
|
|
Iв
|
82
|
2,895
|
283
|
7,22
|
|
Прозрач
|
Vorticella campanula
|
2
|
2
|
|
IIа
|
66
|
2,724
|
242
|
7,15
|
|
Коричн
|
Vorticella microstoma
|
2
|
2
|
|
IIв
|
79
|
3,344
|
237
|
7,28
|
|
Прозрач
|
Aspidisca
|
3
|
2
|
|
|
|
|
|
|
|
|
Opercularia
|
2
|
2
|
|
|
|
|
|
|
|
|
Litonotus
|
2
|
-
|
|
|
|
|
|
|
|
|
Notommata
|
2
|
1
|
|
|
|
|
|
|
|
|
Arcella
|
2
|
1
|
|
|
|
|
|
|
|
|
Callidina
|
1
|
2
|
|
|
|
|
|
|
|
|
Zoogloea
|
-
|
2
|
|
|
|
|
|
|
|
|
Rotaria
|
-
|
2
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
3
|
3
|
|
12.03.
|
Iа
|
40
|
1,794
|
|
7,18
|
+10
0
|
Коричн
|
Видовой
состав м/о без изменений
|
|
|
|
Iв
|
79
|
2,471
|
|
7,21
|
|
Прозрач
|
|
|
|
|
IIа
|
73
|
2,797
|
|
7,16
|
|
Коричн
|
|
|
|
|
IIв
|
83
|
3,691
|
|
7,26
|
|
Прозрач
|
|
|
|
|
16.04.
|
Iа
|
66
|
1,834
|
360
|
7,26
|
+8
-3
|
Коричн
|
Aspidisca
|
2
|
2
|
|
Iв
|
86
|
3,158
|
272
|
7,29
|
|
Прозрач
|
Arcella
|
1
|
1
|
|
IIа
|
71
|
3,126
|
227
|
7,19
|
|
Коричн
|
Epistylis
|
1
|
-
|
|
IIв
|
85
|
4,202
|
202
|
7,24
|
|
Прозрач
|
Opercularia
|
2
|
1
|
|
|
|
|
|
|
|
|
Vorticella campanula
|
2
|
2
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
|
|
|
|
|
|
|
|
Vorticella microstoma
|
3
|
2
|
|
|
|
|
|
|
|
|
Notommata
|
1
|
-
|
|
|
|
|
|
|
|
|
Colpidium
|
1
|
-
|
|
|
|
|
|
|
|
|
Litonotus
|
1
|
1
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
3
|
3
|
|
27.04.
|
Iа
|
62
|
1,654
|
|
7,45
|
+10
-1
|
Коричн
|
Aspidisca
|
2
|
3
|
|
Iв
|
83
|
2,729
|
|
7,38
|
|
Прозрач
|
Arcella
|
1
|
1
|
|
IIа
|
58
|
1,526
|
|
7,41
|
|
Коричн
|
Vorticella campanula
|
2
|
2
|
|
IIв
|
81
|
2,529
|
|
7,4
|
|
Прозрач
|
Vorticella microstoma
|
1
|
2
|
|
|
|
|
|
|
|
|
Colpidium
|
1
|
2
|
|
|
|
|
|
|
|
|
Notommata
|
1
|
1
|
|
|
|
|
|
|
|
|
Podophrya
|
1
|
1
|
|
|
|
|
|
|
|
|
Epistylis
|
1
|
2
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
3
|
3
|
|
14.05.
|
Iа
|
52
|
1,067
|
487
|
7,12
|
+12
+12
|
Коричн
|
Litonotus
|
2
|
1
|
|
Iв
|
74
|
1,496
|
495
|
7,19
|
|
Прозрач
|
Aspidisca
|
3
|
2
|
|
IIа
|
69
|
1,602
|
431
|
7,21
|
|
Коричн
|
Colpidium
|
2
|
|
IIв
|
80
|
2,133
|
375
|
7,24
|
|
Прозрач
|
Arcella
|
3
|
3
|
|
|
|
|
|
|
|
|
Opercularia
|
3
|
4
|
|
|
|
|
|
|
|
|
Callidina
|
1
|
-
|
|
|
|
|
|
|
|
|
Vorticella campanula
|
1
|
1
|
|
|
|
|
|
|
|
|
Vorticella microstoma
|
2
|
1
|
|
|
|
|
|
|
|
|
Epistylis
|
-
|
2
|
|
|
|
|
|
|
|
|
Stentor
|
-
|
1
|
|
|
|
|
|
|
|
|
Mastigophora
|
1
|
-
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
2
|
3
|
|
18.05.
|
Iа
|
69
|
|
|
7,25
|
+12
+8
|
Коричн
|
Vorticella campanula
|
2
|
2
|
|
Iв
|
83
|
|
|
7,26
|
|
Прозрач
|
Vorticella microstoma
|
2
|
2
|
|
IIа
|
78
|
|
|
7,17
|
|
Коричн
|
Arcella
|
2
|
2
|
|
IIв
|
85
|
|
|
7,2
|
|
Прозрач
|
Aspidisca
|
2
|
3
|
|
|
|
|
|
|
|
|
Colpidium
|
2
|
2
|
|
|
|
|
|
|
|
|
Callidina
|
1
|
2
|
|
|
|
|
|
|
|
|
Opercularia
|
2
|
3
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
3
|
3
|
|
20.05.
|
Iа
|
77
|
|
|
7,11
|
+11
+6
|
Коричн
|
Epistylis
|
2
|
2
|
|
Iв
|
86
|
|
|
7,14
|
|
Прозрач
|
Opercularia
|
3
|
2
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
|
IIа
|
79
|
|
|
7,15
|
|
Коричн
|
Aspidisca
|
2
|
2
|
|
IIв
|
86
|
|
|
7,19
|
|
Прозрач
|
Litonotus
|
1
|
1
|
|
|
|
|
|
|
|
|
Arcella
|
2
|
3
|
|
|
|
|
|
|
|
|
Vorticella campanula
|
2
|
1
|
|
|
|
|
|
|
|
|
Vorticella microstoma
|
1
|
1
|
|
|
|
|
|
|
|
|
Stentor
|
1
|
-
|
|
|
|
|
|
|
|
|
Notommata
|
-
|
1
|
|
|
|
|
|
|
|
|
Colpidium
|
1
|
1
|
|
|
|
|
|
|
|
|
Colleps
|
-
|
1
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
2
|
3
|
|
15.06.
|
Iа
|
44
|
1,216
|
362
|
7,11
|
+18
+20
|
Коричн
|
Colpidium
|
3
|
1
|
|
Iв
|
62
|
1,260
|
397
|
7,29
|
|
Прозрач
|
Arcella
|
2
|
2
|
|
IIа
|
65
|
1,781
|
365
|
7,26
|
|
Коричн
|
Opercularia
|
1
|
-
|
|
IIв
|
79
|
2,520
|
313
|
7,34
|
|
Прозрач
|
Coleps
|
3
|
-
|
|
|
|
|
|
|
|
|
Aspidisca
|
-
|
2
|
|
|
|
|
|
|
|
|
Notommata
|
-
|
1
|
|
|
|
|
|
|
|
|
Philodina
|
-
|
1
|
|
|
|
|
|
|
|
|
Mastigophora
|
-
|
2
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
2
|
3
|
|
16.06.
|
Iа
|
44
|
|
|
7,29
|
+19
+20
|
Коричн
|
Видовой
состав м/о без изменений
|
|
|
|
Iв
|
67
|
|
|
7,31
|
|
Прозрач
|
|
|
|
|
IIа
|
66
|
|
|
7,24
|
|
Коричн
|
|
|
|
|
IIв
|
81
|
|
|
7,25
|
|
Прозрач
|
|
|
|
|
17.06.
|
Iа
|
26
|
|
|
7,19
|
+19
+22
|
Коричн
|
Litonotus
|
3
|
|
|
Iв
|
66
|
|
|
7,24
|
|
Прозрач
|
Callidina
|
1
|
|
|
IIа
|
Ремонт
|
|
|
|
|
|
Arcella
|
2
|
|
|
IIв
|
|
|
|
|
|
|
Colpidium
|
1
|
|
|
|
|
|
|
|
|
|
Opercularia
|
1
|
|
|
|
|
|
|
|
|
|
Coleps
|
1
|
|
|
|
|
|
|
|
|
|
Zoogloea
|
1
|
|
|
|
|
|
|
|
|
|
Vorticella microstoma
|
1
|
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
3
|
|
|
20.07.
|
Iа
|
77
|
2,216
|
347
|
7,26
|
+18
+10
|
Коричн
|
Aspidisca
|
3
|
|
|
Iв
|
80
|
2,418
|
331
|
7,31
|
|
Прозрач
|
Vorticella campanula
|
2
|
|
|
|
|
|
|
|
|
|
Vorticella microstoma
|
1
|
|
|
|
|
|
|
|
|
|
Colpidium
|
2
|
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
|
|
|
|
|
|
|
|
Notommata
|
1
|
|
|
|
|
|
|
|
|
|
Amoeba
|
3
|
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
3
|
|
|
22.07.
|
Iа
|
73
|
|
|
7,31
|
+18
+10
|
Коричн
|
Aspidisca
|
3
|
|
|
Iв
|
78
|
|
|
7,34
|
|
Прозрач
|
Arcella
|
2
|
|
|
|
|
|
|
|
|
|
Podophrya
|
2
|
|
|
|
|
|
|
|
|
|
Amoeba
|
3
|
|
|
|
|
|
|
|
|
|
Vorticella campanula
|
1
|
|
|
|
|
|
|
|
|
|
Mastiphora
|
1
|
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
3
|
|
|
23.07.
|
Iа
|
70
|
2,222
|
|
7,28
|
+18
+10
|
Коричн
|
Aspidisca
|
4
|
|
|
Iв
|
84
|
3,062
|
|
7,31
|
|
Прозрач
|
Notommata
|
2
|
|
|
|
|
|
|
|
|
|
Arcella
|
2
|
|
|
|
|
|
|
|
|
|
Podophrya
|
1
|
|
|
|
|
|
|
|
|
|
Vorticella microstoma
|
1
|
|
|
|
|
|
|
|
|
|
Colpidium
|
1
|
|
|
|
|
|
|
|
|
|
Philodina
|
1
|
|
|
|
|
|
|
|
|
|
Amoeba
|
2
|
|
|
|
|
|
|
|
|
|
Mastigophora
|
1
|
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13.08.
|
Iа
|
10
|
0,269
|
342
|
7,34
|
+17
+13
|
Коричн
|
Colpidium
|
1
|
1
|
|
Iв
|
0,232
|
302
|
7,39
|
|
Прозрач
|
Arcella
|
4
|
4
|
|
IIа
|
67
|
1,417
|
473
|
7,27
|
|
Коричн
|
Coleps
|
1
|
1
|
|
IIв
|
77
|
1,914
|
402
|
7,31
|
|
Прозрач
|
Litonotus
|
2
|
3
|
|
|
|
|
|
|
|
|
Vorticella campanula
|
2
|
2
|
|
|
|
|
|
|
|
|
Vorticella microstoma
|
2
|
2
|
|
|
|
|
|
|
|
|
Callidina
|
1
|
-
|
|
|
|
|
|
|
|
|
Aspidisca
|
-
|
1
|
|
|
|
|
|
|
|
|
Notommata
|
-
|
1
|
|
|
|
|
|
|
|
|
Nematoda
|
-
|
1
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
2
|
3
|
|
17.08.
|
Iа
|
11
|
0,485
|
227
|
7,28
|
+18
+13
|
Коричн
|
Opercullaria
|
4
|
1
|
|
Iв
|
9
|
0,334
|
270
|
7,31
|
|
Прозрач
|
Callidina
|
1
|
-
|
|
IIа
|
73
|
1,608
|
454
|
7,26
|
|
Коричн
|
Arcella
|
3
|
3
|
|
IIв
|
80
|
1,883
|
425
|
7,24
|
|
Прозрач
|
Vorticella campanula
|
2
|
2
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
|
|
|
|
|
|
|
|
Vorticella microstoma
|
2
|
2
|
|
|
|
|
|
|
|
|
Litonotus
|
3
|
3
|
|
|
|
|
|
|
|
|
Coleps
|
1
|
2
|
|
|
|
|
|
|
|
|
Notommata
|
1
|
2
|
|
|
|
|
|
|
|
|
Zoogloea
|
2
|
-
|
|
|
|
|
|
|
|
|
Mastigophora
|
1
|
1
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
2
|
3
|
|
|
|
|
|
|
|
|
Oligochaeta
|
-
|
1
|
|
18.08.
|
Iа
|
14
|
|
|
7,41
|
+17
+11
|
Коричн
|
Litonotus
|
4
|
3
|
|
Iв
|
13
|
|
|
7,46
|
|
Прозрач
|
Arcella
|
3
|
3
|
|
IIа
|
74
|
|
|
7,52
|
|
Коричн
|
Vorticella campanula
|
2
|
2
|
|
IIв
|
81
|
|
|
7,54
|
|
Прозрач
|
Vorticella microstoma
|
2
|
2
|
|
|
|
|
|
|
|
|
Opercullaria
|
2
|
2
|
|
|
|
|
|
|
|
|
Coleps
|
2
|
1
|
|
|
|
|
|
|
|
|
Colpidium
|
1
|
-
|
|
|
|
|
|
|
|
|
Notommata
|
1
|
1
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
3
|
3
|
|
5.09.
|
Iа
|
20
|
|
|
7,36
|
+170
|
Коричн
|
Vorticella campanula
|
3
|
2
|
|
Iв
|
19
|
|
|
7,34
|
|
Прозрач
|
Vorticella microstoma
|
3
|
2
|
|
IIа
|
44
|
|
|
7,42
|
|
Коричн
|
Coleps
|
3
|
1
|
|
IIв
|
60
|
|
|
7,37
|
|
Прозрач
|
Arcella
|
4
|
3
|
|
|
|
|
|
|
|
|
Callidina
|
2
|
2
|
|
|
|
|
|
|
|
|
Zoogloea
|
2
|
-
|
|
|
|
|
|
|
|
|
Notommata
|
1
|
1
|
|
|
|
|
|
|
|
|
Philodina
|
3
|
2
|
|
|
|
|
|
|
|
|
Epistylis
|
1
|
-
|
|
|
|
|
|
|
|
|
Opercularia
|
2
|
3
|
|
|
|
|
|
|
|
|
Amoeba
|
1
|
2
|
|
|
|
|
|
|
|
|
Catlypna
|
2
|
3
|
|
|
|
|
|
|
|
|
Mastigophora
|
1
|
-
|
|
|
|
|
|
|
|
|
Aspidisca
|
-
|
2
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
2
|
2
|
|
8.09.
|
Iа
|
20
|
1,236
|
162
|
7,12
|
+18
|
Коричн
|
Arcella
|
4
|
3
|
|
Iв
|
23
|
1,274
|
180
|
7,32
|
|
Прозрачн
|
Vorticella campanula
|
3
|
2
|
|
IIа
|
46
|
1,613
|
285
|
7,36
|
|
Коричн
|
Vorticella microstoma
|
3
|
2
|
|
IIв
|
59
|
1,844
|
320
|
7,40
|
|
Прозрачн
|
Notommata
|
4
|
2
|
|
|
|
|
|
|
|
|
Coleps
|
3
|
2
|
|
|
|
|
|
|
|
|
Zoogloea
|
2
|
-
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
|
|
|
|
|
|
|
|
Amoeba
|
1
|
1
|
|
|
|
|
|
|
|
|
Callidina
|
2
|
1
|
|
|
|
|
|
|
|
|
Opercularia
|
1
|
3
|
|
|
|
|
|
|
|
|
Mastigophora
|
1
|
-
|
|
|
|
|
|
|
|
|
Aspidisca
|
-
|
1
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
2
|
3
|
|
23.10.
|
IIа
|
80
|
|
|
7,29
|
+14
+3
|
Коричн
|
Opercularia
|
|
3
|
|
IIв
|
86
|
|
|
7,32
|
|
Прозрачн
|
Vorticella campanula
|
|
2
|
|
|
|
|
|
|
|
|
Vorticella microstoma
|
|
1
|
|
|
|
|
|
|
|
|
Mastigophora
|
|
2
|
|
|
|
|
|
|
|
|
Arcella
|
|
2
|
|
|
|
|
|
|
|
|
Aspidisca
|
|
1
|
|
|
|
|
|
|
|
|
Coleps
|
|
2
|
|
|
|
|
|
|
|
|
Callidina
|
|
2
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
|
3
|
|
26.10.
|
IIа
|
87
|
1,932
|
440
|
7,32
|
+13
-8
|
Коричн
|
Opercularia
|
|
4
|
|
IIв
|
88
|
2,270
|
388
|
7,38
|
|
Прозрачн
|
Vorticella campanula
|
|
2
|
|
|
|
|
|
|
|
|
Vorticella microstoma
|
|
2
|
|
|
|
|
|
|
|
|
Arcella
|
|
2
|
|
2
|
|
|
|
|
|
|
|
|
Mastigophora
|
|
1
|
|
|
|
|
|
|
|
|
Callidina
|
|
1
|
|
|
|
|
|
|
|
|
Coleps
|
|
1
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
|
3
|
|
27.10.
|
Iа
|
12
|
|
|
7,27
|
+12
-8
|
Коричн
|
Vorticella campanula
|
2
|
2
|
|
Iв
|
8
|
|
|
7,31
|
|
Прозрачн
|
Vorticella microstoma
|
2
|
2
|
|
IIа
|
78
|
|
|
7,34
|
|
Коричн
|
Arcella
|
2
|
2
|
|
IIв
|
84
|
|
|
7,35
|
|
Прозрачн
|
Rotaria
|
1
|
-
|
|
|
|
|
|
|
|
|
Aspidisca
|
1
|
1
|
|
|
|
|
|
|
|
|
Catlypna
|
2
|
-
|
|
|
|
|
|
|
|
|
Callidina
|
1
|
1
|
|
|
|
|
|
|
|
|
Colpidium
|
1
|
-
|
|
|
|
|
|
|
|
|
Coleps
|
1
|
-
|
|
|
|
|
|
|
|
|
Notommata
|
1
|
1
|
|
|
|
|
|
|
|
|
Opercularia
|
2
|
3
|
|
|
|
|
|
|
|
|
Mastigophora
|
1
|
-
|
|
12.11.
|
Iа
|
10
|
0,708
|
141
|
7,27
|
+10
|
Коричн
|
Callidina
|
1
|
1
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
|
Iв
|
13
|
0,368
|
150
|
7,29
|
|
Прозрачн
|
Vorticella campanula
|
2
|
2
|
|
IIа
|
21
|
2,062
|
102
|
7,31
|
|
Коричн
|
Vorticella microstoma
|
2
|
2
|
|
IIв
|
44
|
2,604
|
163
|
7,34
|
|
Прозрачн
|
Arcella
|
2
|
2
|
|
|
|
|
|
|
|
|
Coleps
|
1
|
-
|
|
|
|
|
|
|
|
|
Aspidisca
|
1
|
2
|
|
|
|
|
|
|
|
|
Opercularia
|
2
|
3
|
|
|
|
|
|
|
|
|
Zoogloea
|
2
|
2
|
|
|
|
|
|
|
|
|
Mastigophora
|
1
|
-
|
|
|
|
|
|
|
|
|
Colpidium
|
2
|
1
|
|
|
|
|
|
|
|
|
Cathypna
|
-
|
1
|
|
|
|
|
|
|
|
|
Amoeba
|
-
|
1
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
2
|
2
|
|
23.11.
|
Iа
|
15
|
|
|
7,31
|
+9
-10
|
Коричн
|
Litonotus
|
1
|
-
|
|
Iв
|
20
|
|
|
7,29
|
|
Прозрачн
|
Arcella
|
2
|
2
|
|
IIа
|
46
|
|
|
7,26
|
|
Коричн
|
Colpidium
|
3
|
2
|
|
IIв
|
60
|
|
|
7,33
|
|
Прозрачн
|
Opercularia
|
2
|
3
|
|
|
|
|
|
|
|
|
Vorticella campanula
|
2
|
2
|
|
|
|
|
|
|
|
|
Vorticella microstoma
|
2
|
2
|
|
|
|
|
|
|
|
|
Rotaria
|
1
|
1
|
|
|
|
|
|
|
|
|
Aspidisca
|
1
|
2
|
|
|
|
|
|
|
|
|
Epistylis
|
1
|
-
|
|
|
|
|
|
|
|
|
Callidina
|
-
|
2
|
|
|
|
|
|
|
|
|
Oligochaeta
|
1
|
-
|
|
|
|
|
|
|
|
|
Nematoda
|
-
|
1
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
2
|
2
|
|
7.12.
|
Iа
|
18
|
1,006
|
179
|
7,21
|
+4
-25
|
Коричн
|
Vorticella campanula
|
2
|
2
|
|
Iв
|
27
|
1,457
|
185
|
7,23
|
|
Прозрачн
|
Vorticella microstoma
|
2
|
2
|
|
IIа
|
44
|
2,521
|
174
|
7,11
|
|
Коричн
|
Aspidisca
|
2
|
3
|
|
IIв
|
56
|
2,895
|
164
|
7,18
|
|
Прозрачн
|
Arcella
|
2
|
3
|
|
|
|
|
|
|
|
|
Cathypna
|
-
|
1
|
|
|
|
|
|
|
|
|
Litonotus
|
1
|
-
|
|
|
|
|
|
|
|
|
Coleps
|
1
|
2
|
|
|
|
|
|
|
|
|
Colpidium
|
1
|
2
|
|
|
|
|
|
|
|
|
Callidina
|
-
|
1
|
|
|
|
|
|
|
|
|
Amoeba
|
-
|
1
|
|
|
|
|
|
|
|
|
Rotaria
|
-
|
2
|
|
|
|
|
|
|
|
|
Opercularia
|
-
|
1
|
|
|
|
|
|
|
|
|
Notommata
|
-
|
1
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
2
|
2
|
|
21.12.
|
Iа
|
40
|
|
|
7,24
|
+5
-28
|
Коричн
|
Aspidisca
|
4
|
4
|
|
Iв
|
65
|
|
|
7,29
|
|
Прозрачн
|
Zoogloea
|
2
|
2
|
|
IIа
|
60
|
|
|
7,15
|
|
Коричн
|
Notommata
|
1
|
2
|
|
IIв
|
70
|
|
|
7,23
|
|
Прозрачн
|
Vorticella campanula
|
2
|
2
|
|
|
|
|
|
|
|
|
Vorticella microstoma
|
2
|
2
|
|
|
|
|
|
|
|
|
Callidina
|
1
|
2
|
|
|
|
|
|
|
|
|
Colpidium
|
1
|
-
|
|
|
|
|
|
|
|
|
Cathypna
|
1
|
2
|
|
|
|
|
|
|
|
|
Amoeba
|
-
|
1
|
|
|
|
|
|
|
|
|
Rotaria
|
-
|
2
|
|
|
|
|
|
|
|
|
Arcella
|
2
|
2
|
|
|
|
|
|
|
|
|
Coleps
|
-
|
1
|
|
|
|
|
|
|
|
|
Opercularia
|
-
|
3
|
|
|
|
|
|
|
|
|
Sphaerotilus
|
2
|
2
|
Данные дозы ила по объему и весу необходимы для
определения илового индекса, значение которого в течение года колеблется в
широких пределах от 102 до 495 см3/г. Максимальное значение приходится на май,
тогда как минимальное приходится на ноябрь. Прослеживается четкая тенденция
снижения значения илового индекса с начала года до конца. Анализ динамики
илового индекса в течение года показал, что данный показатель превышает
оптимальные значения (90-130 см3/г), это говорит о его малой способности к
седиментации, следовательно, разделение ила и очищенной воды нарушается и
приводит к избыточному выносу взвешенных веществ из вторичных отстойников. Но
для каждых очистных сооружений иловый индекс принимает свои значения, это
зависит от технологических возможностей своевременной выгрузки осевшего ила из
вторичных отстойников. В целом состояние ила по иловому индексу говорит об
удовлетворительной оценке. Внешний вид осадка буро коричневый. Это говорит о
хорошем перемешивании и достаточном насыщением кислородом иловой смеси. Что
соответствует нормальной работе очистных сооружений. В противном случае
наблюдался бы темный, землянистый ил с оттенком черноты, это признак
залеживания и загнивания ила. Значения pH
в течение года колеблются незначительно, в пределах от 7,06 до 7,54. Это
говорит о стабильности биологической очистки. Видовой состав достаточно
разнообразный, присутствуют представители фауны многоклеточных (коловратки,
черви), это говорит о высокой степени развития биоценоза активного ила. Имеется
несколько трофических уровней. Это означает что активный ил зрелый и достаточно
развитый. Все описанные организмы активны и находятся в подвижном состоянии.
Опираясь на вышеперечисленные факты можно
сделать общее заключение - состояние биологической очистки на очистных
сооружениях г. Бирска оценивается как удовлетворительное.
ВЫВОДЫ
. Анализ проб активного ила аэротенков и
регенераторов очистных сооружений г. Бирска позволил зарегистрировать
разнообразие представителей 6 таксономических групп микрофлоры и 9 -
микрофауны, что говорит о высокой степени развития биоценоза.
. Количественный анализ организмов
активного ила показал, что численность основного состава биоценоза находится в
относительном постоянстве, что позволяет оценить его в качестве стабильного и
зрелого.
. Выявлена годовая динамика численности
видов - индикаторов Vorticella
campanula, Vorticella
microstoma, Arcella,
Colpidium, Coleps
в пределах от 1 до 4 баллов, которая коррелирует, в основном¸
с
температурой окружающей среды и иловой смеси; корреляции с показателями
гидрохимического анализа не обнаружено, сто обусловлено малой токсичностью
сточных вод г. Бирска.
. Установлены среднегодовые значения
илового индекса - 257-310 см3/г, которые являются стабильными для очистных
сооружений г. Бирска и зависят от технологических возможностей своевременной
выгрузки осевшего ила из вторичных отстойников.
. Результаты гидробиологического анализа
по всем показателям позволяют сделать заключение об эффективной работе
активного ила на очистных сооружениях г. Бирска и оценить состояние очистки
сточных вод в качестве удовлетворительного.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Банина
Н.Н., Суханова К.Л. Простейшие в процессах биологической очистки сточных вод //
Актуальные вопросы гидробиологии. - Л.: Промрыбзавод, 1984. - С. 13-23.
2. Банина
Н.Н. Ciliata
в очистных сооружениях бытовых и смешанных сточных вод // Простейшие активного
ила. - Л.: Наука, - 1983. - С.527.
3. Банников
А.Г, Рустамов А.К, Вакулин А.А. Охрана природы. - М.:
Агропромиздат,
1987 - С. 10-13.
. Беспамятнов
Г. П., Кротов Ю. А. Предельно допустимые концентрации химических веществ в
окружающей среде. - Ленинград: Химия 1987. - С. 30-35.
5. Гавич
И.К. Методы охраны внутренних вод от загрязнения и истощения. - М.:
Агропромиздат, 1985 - С. 88-90
. Джимова
Н.Д., Читао С.И. Эколого-фаунистическая характеристика отдельных представителей
типа Protozoa, обитающих в активном иле очистных сооружений г. Майкопа,
Шовгеновского и Гиагинского районов Республики Адыгея. - Майкоп, 1989 - С. 1-3.
. Догель
А.В. Зоология беспозвоночных. - М., 1981. - 605с.
9. Дуганов
Г.В. Охрана окружающей природной Среды. - Киев: Выща школа, 1990 - С. 18-20.
10. Евилович
А.З. Утилизация осадков сточных вод. - М: Стройиздат, 1989. - С. 13-21.
. Жирнова
Е.В. Фауна кругоресничных инфузорий и сезонная динамика их численности в
водоемах южной лесостепи Омской области: методика сбора и обработки материала
// Вестник Омского государственного педагогического университета. - 2006. -№8.
- С. 13.
12. Жуков
А.И. Монгайт И.Л., Родзиллер И.Д. Методы очистки
производственных
сточных вод - М.: Стройиздат, 1990 - С. 22-28.
. ИСО
6341-82 Качество воды. Определение угнетения подвижности Daphnia
magna Straus
(Cladocera, Crustacea).
- С. 13-22.
. Карюхина
Т.А., Чурбанова И.Н. Контроль качества воды. - М: Стройиздат, 1986. - С. 50-55
. Карюхина
Т.А., Чурбанова И.Н. Химия воды и микробиология. - М: Стройиздат, 1983. - С.
74-81.
. Кутикова
Л.А Фауна аэротенков. - Ленинград, 1984. - С. 5-38.
17. Капинос
П.И, Панесенко Н.А. Охрана природы. - Киев: Выща школа, 1991 - С. 15-23.
18. Канализация
г.Бирска том-1, часть 1 пояснительная записка. - Бирск, 1983 - С. 105-119.
19. Лукиных
Н.А., Липман Б.Л., Криштул В.П. Методы доочистки сточных вод. М. Строииздат,
1978.
20. Методика
технологического контроля работы очистных сооружений городской канализации. -
М: Стройиздат, 1977. - С. 20-32.
. Методическое
руководство по гидробиологическому и бактериологическому контролю процесса
биологической очистки на сооружениях с аэротенками. ПНД Ф СБ 14.1.77-96 -
М.,1996. - С. 3-30.
. Методическое
руководство по гидробиологическому контролю нитчатых микроорганизмов активного
ила. ПНД Ф СБ 14.1.92-96 - М., 1996. - С. 7-18.
23. Правила
охраны поверхностных вод (Основные положения). - М., 1991. - С. 22-27.
24. Роев
Г.А. Очистные сооружения. Охрана окружающей среды. - М: Недра, 1993. - С.
15-18.
. Рабочий
журнал гидробиологического анализа очистных сооружений г. Бирска. - 2009. - С.
1-91.
. Соколова
В.Н. Охрана производственных сточных вод и утилизация осадков - М.: Стройиздат,
1992. - С. 55-63
. Сладечек
В.В. Атлас сапробных организмов. Унифицированные методы исследования качества
вод. - М., 1977. - С. 144-161.
. Туровский
И.С. "Обработка осадков сточных вод" - М.: Стройиздат, 1984. - С.
17-19.
. Технологический
регламент работы очистных сооружений канализации г.Бирска. Бирск, 1979 - С.
52-78.
. Унифицированные
методы исследования качества вод. Совещание руководителей водохозяйственных
органов стран-членов СЭВ. Ч. IV.
Микробиологические методы. - М., 1985. - С. 3-8.
. Фаткуллин
Р.А. Природные условия Республики Башкортостан и рациональное их использование.
- Уфа: Китап, 1996. - 154с.
32. Черняев
А.М. Защита водоемов от загрязнения малыми объектами. - Екатеринбург, 1994 - С.
17-25.
33. Шарова
И. Х. Зоология беспозвоночных. - М., 2004 - 567с.
34. Юрьев
Б.Т. Очистка сточных вод малых объектов. Рига: Авотс, 1983. - С. 18-28.
35. Юшманова
О.А Комплексное использование и охрана водных ресурсов. - М.: Агропромиздат,
1985 - С. 53-60
36. www.admbirsk.ru
Приложение 1
Фотографии активного ила под микроскопом
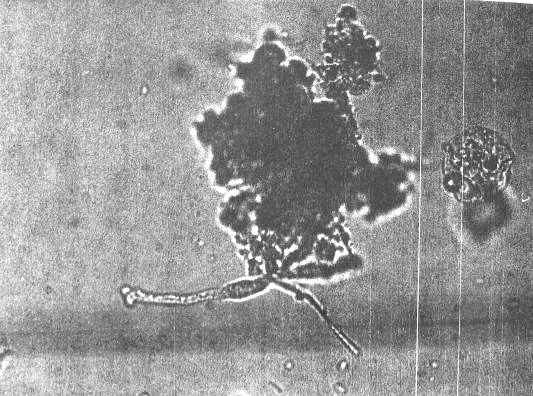
Рис. 1. Zoogloea
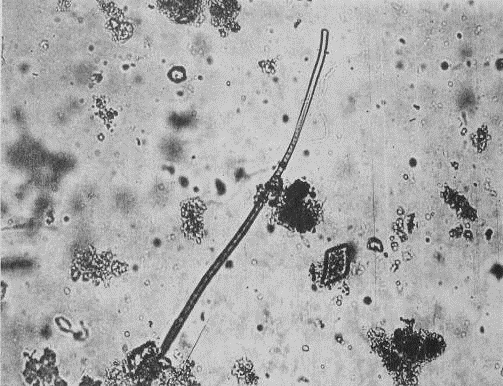
Рис. 2. Тионовая бактерия
Продолжение приложения 1

Рис. 3. Сапрофитные грибы
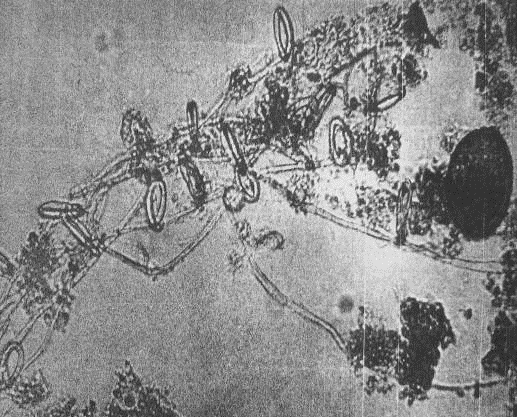
Рис. 4. Хищные грибы с ловчими петлями
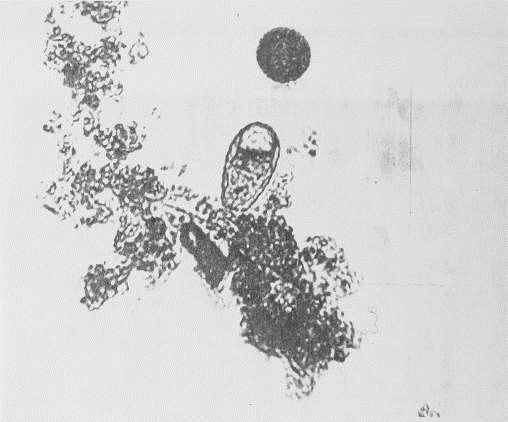
Рис. 5. Euglypha

Рис. 6. Paramecium aurelia
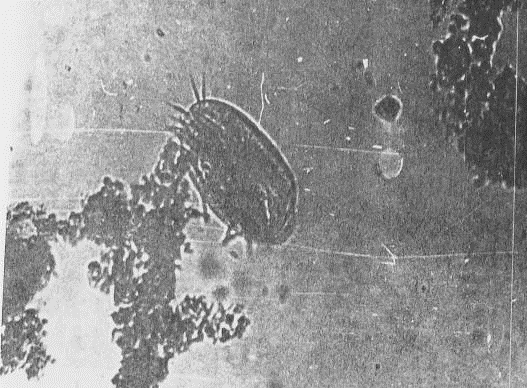
Рис. 7. Брюхоресничная инфузория

Рис. 8. Spirostomum ambiguum

Рис. 9. Колониальная форма инфузорий
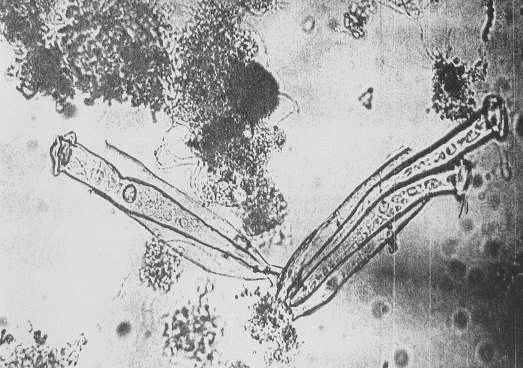
Рис. 10. Инфузории в домике
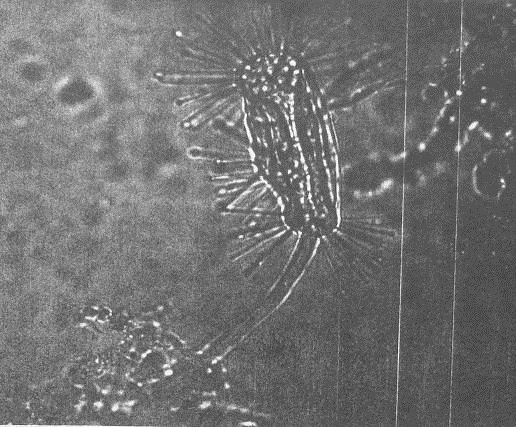
Рис. 11. Сосущая инфузория
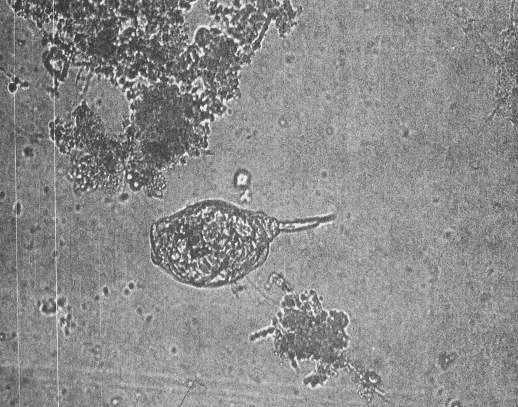
Рис. 12. Коловратка панцирная
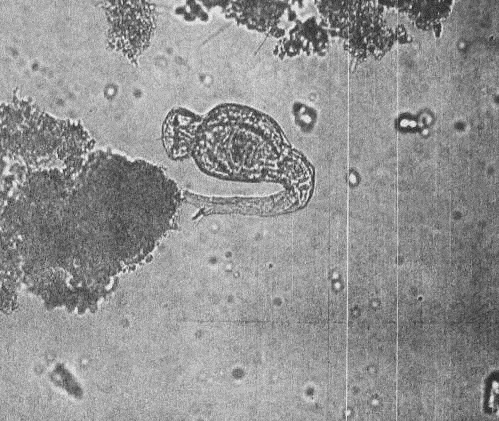
Рис. 13. Разнообразие коловраток
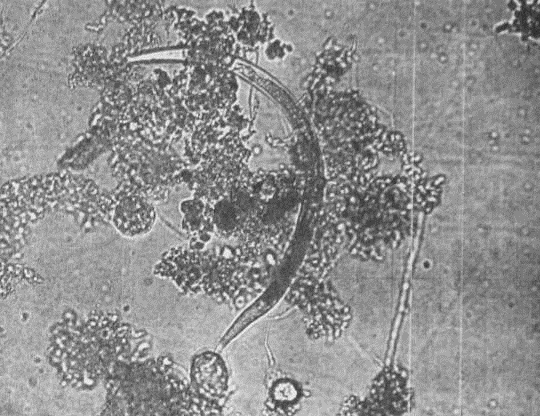
Рис. 14. Nematoda
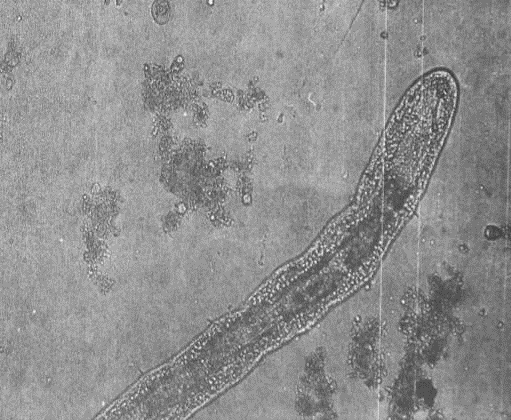
Рис. 15. Oligochaeta
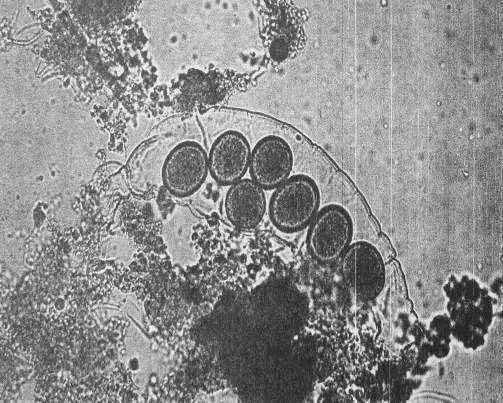
Рис. 16. Яйца в сброшенной тихоходкой кутикуле