|
Состояние
|
Клиническое отличие
|
Наиболее чувствительный
лабораторный метод
|
|
Микобактериальный или
грбковый артрит
|
Неостро проявляющийся
моноартрит
|
Анализ синовиальный
жидкости и биоптата на бактериальной рост, гистология
|
|
Вирусный артрит
|
Полиартрит, лихорадка, сыпь
|
В первую очередь
предполагать БА и/или гемартроз; Серология
|
|
Болезнь Лайма
|
Мигрирующая эритема в анамнезе,
нахождение в ендемичной зоне
|
Серология
|
|
Реактивный артрит
|
Наличие в анамнезе
гастроинтестинальной/мочеполовой инфекции, энтезопатия, поражения кожи,
увеит, коньюктивит
|
Радиологически сакроилиит, HLA-B27
|
|
Эндокардит
|
Лихорадка, аускултативные
шумы, септические или стерильные синовииты
|
Гемокультура; септический
артрит более вероятен у в/в "наркоманов"
|
|
Ревматоидный артрит
|
Редко может выявляться
"псевдосептический артрит"
|
Если острый ревматойидный
артрит, обязательны посев культуры из синовиальной жидкости
|
|
Подагра, Псевдоподагра
|
Наличие острого артрита в
анамнезе, подагры
|
Обнаружение кристалов
мочевой кислоты в синовиальной жидкости
|
Диагностический алгоритм острого инфекционного артрита
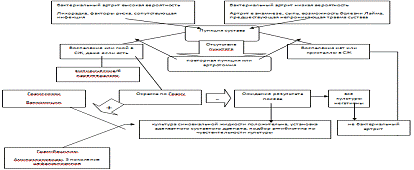
Инфекции протезированного сустава (ИПС)
Инфекция протезированного сустава (ИПС)- бактериальная колонизация одной
или нескольких структур, к которым относятся: области соединения кости с
цементом, оболочка и полость искусственного сустава, остатки синовиальной
оболочки, окружающие сустав мягкие ткани.
Частота инфицирования суставных протезов составляет 0,5-2%. В зависимости
от сроков развития после эндопротезирования выделяют раннюю (до 3 мес),
отсроченную (3-12, иногда 24 мес) и позднюю (>12-24 мес) форму ИПС. Среди
возбудителей преобладают стафилококки, стрептококки, грамотрицательные аэробы и
анаэробы . Ранние и отсроченные формы ИПС вызываются преимущественно
стафилококками (эпидермальным и золотистым) и развиваются вследствие
послеоперационной контаминации или контактного распространения из
инфицированной кожи, подкожных тканей, мышц или послеоперационной гематомы.
Поздние формы возникают при инициировании другими микробами в результате
гематогенной диссеминации.
По данным J. Rodriguez-Bano и соавт. (Rodriguez-Bano J, 2008).наиболее частыми
симптомами инфекций протезированного ТБС являются гнойное отделяемое (79%),
боль в суставе (67%), локальные воспалительные симптомы (63%), лихорадка (46%),
длительно сохраняющийся свищ (33%), поверхностные инфекции кожи (23%). При
поражении протеза КС чаще встречаются боль в суставе (88%), локальные
воспалительные симптомы (78%), гноетечение (59%), лихорадка (41%), длительно
сохраняющийся свищ (22%).
При анализе периферической крови у больных ИПС, как правило, выявляют
лейкоцитоз со сдвигом лейкоцитарной формулы влево и значительное повышение СОЭ.
При развитии ИПС у больного РА, получающего системную терапию глюкокортикоидами
(ГК), число лейкоцитов может быть нормальным. В то же время СОЭ сохраняется
повышенной в раннем послеоперационном периоде без признаков инфекции, а в
случае отсроченной или поздней ИПС может быть нормальной. По данным разных
авторов, чувствительность и специфичность СОЭ как маркера ИПС колеблются от 62
до 83% и от 55 до 85% соответственно.
При отсутствии фоновых воспалительных заболеваний большое диагностическое
значение придается уровню СРБ.
Так, при инфекционном поражении ТБС чувствительность и специфичность СРБ
(>5 мг/л) составили 95 и 62% соответственно (Mu ller M, 2008). По
результатам международного консенсуса Парапротезной инфекции сустава
(Thorsten Gehrke MD. Javad Parvizi MD, 10,2013))85% заседателей согласилось(прочный
консенсус) с тем, что инфекция, вызванная имплантатами, считается
подтвержденной, если выполнены следующие критерии:
· выявление организмов с идентичным фенотипом в не менее чем
двух положительных перипротезных культурах или
· фистула, связанная с суставом, или
· подтверждение не менее 3 перечисленных ниже критериев:
повышенная скорость оседания эритроцитов (СОЭ), а также повышенный
показатель С-реактивного белка (СРБ) в картине сыворотки крови,
повышенный показатель лейкоцитов (WBC) в синовиальной жидкости,
положительная реакция на тест-полоске на эстеразу лейкоцитов,
положительное гистологическое заключение о воспалении в перипротезной
ткани
одна отдельная положительная культура.
Последние исследования показали, что применение
простой тест-полоски для анализа мочи на наличие лейкоцитарной эстеразы в
анализе синовиальной жидкости может маркером ИПС (чувствительность=81%-93%
специфичность=87%-100%) (Parvizi J, 2012)В одном исследовании говорится, что
только в 1\3 взятых пункатов синовиальной жидкости было возможно применить
колориметрические индикаторные полоски. (Wetters NG, 2012)Однако в последней
работе предполагают, что центрифугирование образца синовиалной жидкости на 6600
об\мин в течении 2-3 минут поможет отделить эритроциты, и позволит провести
колриметрическое тестирование более точно. (Aggarwal VK, 2013)
Ориентировочные пороги СОЕ, СРБ, WBC, PMN в сроках не менее 6 недель после операции,
характерные для острого ИПС:
СОЭ для диагностики острого ИПС не специфично
СРБ > 100 mg/L (тазобедренный и коленный суставы),
WBC синовиальной жидкости > 10,000 cells/μL, и
PMN% синовиальной жидкости > 90%.
Для хронической ИПС
СОЭ > 30 mm/hr,
СРБ > 10 mg/L,
WBC синовиальной жидкости > 3,000 cells per μL, и
- PMN% синовиальной жидкости > 80%.
Окончательный диагноз ставится по данным анализов крови, исследования
аспирата из полости искусственого сустава и/или костного биоптата, взятого
вблизи области соединения цемента с протезом.
Лечение
Лечение БА - комплексное, включающее антимикробную и симптоматическую
терапию, дренаж инфицированной СЖ и лечебную физкультуру.
Антимикробная терапия проводится в течение первых 1-2 суток эмпирически с
учетом возраста больного, клинической картины заболевания и результатов
исследования мазков СЖ по Граму, в дальнейшем - с учетом выделенного
возбудителя и его чувствительности к антибиотикам .
Антибиотики следует вводить преимущественно парентерально,
внутрисуставное их применение нецелесообразно. Отсутствие позитивной динамики
через 2 суток диктует необходимость смены антибиотика. Сохраняющаяся ускоренная
СОЭ служит показанием к продлению сроков лечения, которое в среднем составляет
3-4 нед. (иногда до 6 нед.), но не менее 2 нед. после ликвидации всех признаков
заболевания. Дополнительно к антимикробной терапии назначают анальгетики и
нестероидные противовоспалительные препараты (диклофенак, кетопрофен и др.).
В течение первых двух суток сустав иммобилизируют. Начиная с 3-го дня
болезни, осуществляют пассивные движения в суставе. К нагрузкам и/или активным
движениям в суставе переходят после исчезновения артралгии.
Дренаж инфицированного сустава производят (иногда по несколько раз в
день) методом закрытой аспирации через иглу. С целью оценки эффективности
лечения каждый раз выполняют подсчет лейкоцитов, окрашивание по Граму и посевы
СЖ.
Техника проведения пункции различна для разных суставов из-за их
строения, врач должен отчетливо понимать, как и где расположены те или иные
ткани, кости и другие анатомические образования, чтобы максимально точно
проложить путь прокола между ними, не задев ничего лишнего или не уперевшись в
кость.
Пункция плечевого сустава
Принято различать три вида пункций плечевого сустава: переднюю, заднюю и
боковую. Принципиального отличия в технике нет, во всех случаях ориентиром
служит акромиально-ключичное сочленение, а игла вводится соответственно
спереди, сзади и сбоку от него.
Прокол кожи осуществляется строго перпендикулярно ее поверхности, после
чего направление продвижения меняется на нужное. Ввод осуществляется до
появления ощущения, будто игла «провалилась» или пока в шприце не появится
пунктат.
Пункция локтевого сустава
Перед началом руку сгибают в локте под углом 90°. Иглу проводят в полость
сзади, между наружным краем локтевого отростка и нижним краем наружного
надмыщелка, непосредственно над головкой лучевой кости.
Если нужно взять пункцию с заднего заворота сустава, то иглу вкалывают
через сухожилие трицепса, над вершиной локтевого отростка, и осторожно проводят
по направлению к синовиальной оболочке.
Пункция лучезапястного сустава
Прокол производится на задней поверхности, у дистального конца лучевой
кости, между сухожилиями разгибателей большого и указательного пальцев.
Пункция тазобедренного сустава
Осуществляется спереди или сбоку. При первом способе точка прокола
находится на середине линии, проводимой от верхнего края большого вертела к
точке между средней и внутренней третью паховой связки. Иглу вкалывают спереди,
перпендикулярно к верхнему краю головки бедренной кости, у края вертлужной
впадины.
При втором способе иглу вводят снаружи, над верхушкой большого вертела, и
продвигают во фронтальной плоскости по направлению к соответствующей точке
противоположной стороны.
Пункция коленного сустава
Прокол осуществляется около верхнего края надколенника, иглу продвигают
через сухожилие квадрицепса по направлению к кости, совершая вращательные
движения. Возможно выполнение пункции и верхненаружного, верхневнутреннего и
нижненаружного краев надколенника.
Пункция голеностопного сустава
Прокол осуществляется впереди, между наружной лодыжкой и сухожилием
длинного разгибателя пальцев. Продвигают в заднемедиальном направлении, между
лодыжкой и латеральной поверхностью таранной кости.
Применение атроскопии рекомендуется для установки временного дренажа при
инфекции плечевого и коленного сустава, т.к. данный метод обеспечевает более
адекватную санацию и лучшую визуализацию. Если дренаж сустава невозможен
пункционным методом или артроскопией необходима открытое хирургическое
дренирование.
Открытое хирургическое дренирование инфицированного сустава осуществляют при наличии следующих
показаний (Gilliard W.R., 1999):
инфицирование тазобедренного и, возможно, плечевого сустава;
остеомиелит позвонков, сопровождающийся сдавлением спинного мозга;
анатомические особенности, затрудняющие дренирование сустава (например,
грудино-ключичное сочленение)
невозможность удаления гноя при закрытом дренировании через иглу из-за
повышенной вязкости содержимого или спаечного процесса в полости сустава;
неэффективность закрытой аспирации (персистенция возбудителя или
отсутствие снижения лейкоцитоза в синовиальной жидкости);
протезированные суставы;
сопутствующий остеомиелит, требующий проведения хирургического
дренирования;
артрит, развившийся вследствие попадания инородноготела в суставную
полость; - позднее начало терапии (более 7 дней).
Техника проведения артротомий:
Артротомия плечевого сустава
Операцию можно осуществить передним и задним доступом,
однако задний доступ опасен в связи с возможностью повреждения п axillaris.
Техника передней артротомии В положении больного на
спине делают разрез Лангенбека длиной 6-8 см вниз от передней поверхности
акромиального отростка После рассечения фасции тупо отделяют небольшой
медиальный пучок дельтовидной мышцы (по sulcus deltoideopectoralis делать
разрез не рекомендуется, так как здесь проходит v cephalica) и, раздвинув края
раны, обнажают капсулу сустава и влагалище сухожилия двуглавой мышцы плеча
Влагалище рассекают по желобоватому зонду, сухожилие отводят латерально, а
медиально оттягивают m. coracobrachialis и короткую головку двуглавой мышцы
Рассекают капсулу сустава, причем для более широкого доступа к суставу
приходится также рассекать верхнюю часть сухожилия подлопаточной мышцы, которое
прикрепляется к tubercu-lum. m.in.us и частично к crista tuberculi m.in.oris и
под которым лежит сообщающаяся с полостью сустава слизистая сумка.
При наличии гноя в заднем отделе сустава делают
контрапертуру, для этого в полость сустава вводят корнцанг и выпячивают им
задний отдел сумки сустава с мягкими тканями В области выпячивания у заднего
края дельтовидной мышцы рассекают ткани Как сказано выше, артротомия из заднего
доступа сопряжена с опасностью повреждения n. axillaris, основной ствол которого проходит на уровне
хирургической шейки плеча в поперечном направлении и вступает в задний отдел
дельтовидной мышцы. При рассечении тканей по выпяченному концу корнцанга эта
опасность значительно снижается, поскольку эластичный нерв соскальзывает с
корнцанга.
В сустав вводят два катетера (их выводят через кожу
вне раны) для обеспечения приточно-отточного промывания его в послеоперационном
периоде. При такой системе лечения при условии проведения антибактериальной
терапии рану зашивают послойно наглухо. (Гостищев В. К., 1996)
Артротомия тазобедренного сустава:
Особенности этого сустава таковы, что простое вскрытие полости его не
приводит к эффекту, так как дренированию препятствует головка бедра, которая,
как пробка, препятствует оттоку гноя из вертлужной впадины.
При гнойном коксите, когда у больного развивается септическое состояние,
исходным очагом которого является коксит, прибегают к резекции головки бедра и
дренированию сустава. При этом используют один из существующих доступов к
суставу.
По Кохеру. дугообразным разрезом от основания большого вертела через его
верхушку кверху и кзади вдоль волокон большой ягодичной мышцы,обнажением
сустава между средней и малой ягодичными мышцами (спереди) и сухожилием
грушевидной мышцы (сзади), отделением места прикрепления мышц, вскрытием
капсулы сустава и рассечением круглой связки головки бедренной кости.
По Лангебеку. Задний доступ к тазобедренному суставу. Сначала разрезом
кожи длиной 12-14 см обнажают большую ягодичную мышцу. Этот разрез идёт от
уровня верхней задней ости подвздошной кости к заднему краю большого вертела и
затем ниже его на 4-5 см. Задняя поверхность тазобедренного сустава открывается
после разведения в стороны средней ягодичной и грушевидной мышц. (Гостищев В.
К., 1996)
Лечение инфицированного протезированного сустава осуществляют следующим образом: При
ранней ИПС (до 1 месяца) многими авторами рекомендуются протезсохраняющие
санационные перевязки
В случае диагностики позней ИПС прводится хирургическая санация и
реэндопротезирование
. Одномоментное реэндопротезирование с иссечением инфицированных тканей,
установкой нового протеза и последующим 6-недельным курсом антибиотикотерапии
(ванкомицин + амикацин; ванкомицин + цефепим/цефтазидим; оксациллин +
рифампицин).
. Удаление протезных компонентов , загрязненных участков кожи и мягких
тканей(дебридмент), установка цементного спейсера с антибиотиком с последующей
парентеральной антимикробной терапией в течение 6 -18 недель. Через 6 месяцев
после устанвки спейсера проводится реэндопротезирование с продолжением
антибиотикотерапии в течение 5 дней.
Заключение
Прогноз бактериального артрита благоприятный при отсутствии серьезных
фоновых заболеваний и своевременной адекватной антибиотикотерапии при
адекватном дренировании сустава. В противном случае возникает необратимая
утрата функции сустава, которая развивается у 25-50% больных. Частота летальных
исходов при БА существенно не изменилась за последние 25 лет и составляет
5-15%. (Белов Б. С., 2010)
Основу диагностики бактериального артрита составляет развернутый анализ
синовиальной жидкости и бактериальный посев, полученной с помощью пункционной
аспирации из пораженного сустава. Только выявление культуры возбудителя позволяет
поставить окончательный диагноз.
Основное правило в диагностике бактериального артрита "Острый артрит
всегда септический, пока не доказано обратное."
Список
литературы
артрит инфекционный бактериальный
1. Aggarwal VK Tischler E, Ghanem E, Parvizi J. //
Leukocyte esterase from synovial fluid aspirate: a technical note. - [б.м.] : J
Arthroplasty , 2013 r..
. Gilliard W.R. Секреты ревматологии. // Бактериальные
(септические) артриты. - СПБ : Издательство Бином, 1999 r..
. Goldenberg D.L. // Septic arthritis. - [б.м.] :
Lancet, 1998 r..
. Kaandorp CJ Van Schaardenburg D, Krijnen P,Habbema
JD, van de Laar MA. // Risk factors for septic arthritis in patients with joint
disease: a prospective study. - [б.м.] : Arthritis Rheum. , 1995 r..
. Mu ller M (Morawietz L, Hasart O et al. // Diagnosis
of periprosthetic infection following total hip arthroplasty - evaluation of
the diagnostic values of pre- and intraoperative parameters and the associated
strategy to preoperatively select patients with a high probabilty of joint
infection. - [б.м.] : J Orthop Surg Res, 2008 r..
. Parvizi J Jacovides C, Antoci V, et all, //
Diagnosis of periprosthetic joint infection:. - [б.м.] : J Bone Joint Surg AM,
2012 r..
. Petlola H. // Acute Osteomyelitis in Children. -
[б.м.] : The New England Journal of Medicine , 2014 r..
. Rodriguez-Bano J del Toro MD, Lupion C et al, //
Arthroplasty-related infection: incidence, risk factors, clinical features, and
outcome.. - [б.м.] : Enferm Infecc Microbiol Clin, 2008 r..
. Saraux A Taelman H, Blanche P, et al. // HIV
infection as a risk factor for septic arthritis.. - [б.м.] : Br J Rheumatol. ,
1997 r..
. Thorsten Gehrke MD. Javad Parvizi MD Proceedings of
the International. Consensus Meeting on. Periprosthetic Joint Infection.. -
FRCS : [б.н.], 10,2013) r..
. Wetters NG Berend KR, Lombardi AV, Morris MJ, Tucker
TL, Della Valle CJ // Leukocyte esterase reagent strips for the rapid diagnosis
of periprosthetic joint infection.. - [б.м.] : J Arthroplasty., 2012 r..
. Белов Б. С. // Бактериальный (септический) артрит и
инфекция протезированного сустава: современные аспекты. - [б.м.] : Современная
ревматология., 2010 r..
. Гостищев В. К. Оперативная гнойная хирургия. -
Москва : Медицина, 1996 r.