Электрохимическое поведение материалов на основе фосфата железа-лития в водном электролите
Министерство образования и науки
Российской Федерации
Федеральное государственное бюджетное образовательное учреждения высшего профессионально образования
Саратовский государственный
университет имени Н.Г. Чернышевского
Институт химии
Кафедра физической химии
Направление 04.03.01 - Химия
БАКАЛАВРСКАЯ РАБОТА
Электрохимическое поведение
материалов на основе фосфата железа-лития в водном электролите
студентки IV курса 414 группы
Булюкиной Виктории Александровны
Научный руководитель
д.х.н., профессор А.В. Чуриков
Саратов 2015
Содержание
ВВЕДЕНИЕ
1.
Литературный обзор
1.1
Термодинамика равновесий с интеркалируемыми литием материалами и водными
растворами
1.2 Кинетика
интеркаляции/деинтеркаляции иона лития
1.3
Преимущества и недостатки использования водного электролита
1.4 Материалы
1.4.1
Катодные материалы
1.4.2 Анодные
материалы
Заключение
2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1
Характеристики исходных и вспомогательных веществ
2.2 Синтез
образцов
2.3 Методика
эксперимента
2.3.1
Изготовление рабочего электрода
2.3.2
Электрохимические измерения
2.4
Электрохимическое поведение чистого и Mn-содержащего оливина
2.5
Электрохимическое поведение LiFePO4, модифицированного SnO2
и WO3
2.6
Исследование электрохимического поведения LiFePO4/0.05SnO2/C
методом циклической вольтамперометрии
2.7
Электрохимическое поведение фосфата лития-титана в системе с водным
электролитом
3. Инструкция
по охране труда и технике безопасности
ВЫВОДЫ
СПИСОК
ЛИТЕРАТУРЫ
ВВЕДЕНИЕ
Развитие экономики и рост населения в мире привели к увеличению числа
транспортных средств. Большинство из них используют ископаемое топливо, которое
выделяет парниковые газы, такие как CO2,
и серьезно загрязняют воздух и окружающую среду. Одним из возможных способов
обеспечения экологической безопасности окружающей среды является использование
электрических транспортных средств (ЭТС). Понятно, что высокая эффективность
(высокая удельная энергия, высокое напряжение и длительный срок хранения),
низкая стоимость и хорошая безопасность являются ключевыми факторами практического
развития ЭТС. Настоящие технологии аккумуляторных батарей используют
дорогостоящие компоненты и технологии сборки, что является главным недостатком
для коммерциализации и популяризации электромобилей. Только несколько
аккумуляторных систем удовлетворяют необходимым требованиям.
В связи с этим актуальной проблемой является разработка экологически
безопасных и высокоэффективных устройств. Одними из них являются литий-ионные
аккумуляторы (ЛИА) с водным электролитом. Они обладают рядом преимуществ, такими
как пожаро- и взрывобезопасность, высокая ионная проводимость и дешевизна. В то
же время, существуют и недостатки использования водного электролита. К ним
относятся ограниченность рабочего диапазона потенциалов (потенциал разложения
воды 1.23В относительно стандартного водородного электрода) и низкая
циклируемость электродных материалов (50-100 циклов).
В выпускной квалификационной работе приводится литературный обзор
электродных материалов, используемых в водных ЛИА. Целью экспериментальной
части является разработка новых и оптимизация уже имеющихся электродных
материалов, стабильно и приемлемо работающих в водных электролитах.
1.
ЛИТЕРАТУРНЫЙ ОБЗОР
.1
Термодинамика равновесий с интеркалируемыми литием материалами и водными
растворами
Дан (Dahn) и его группа [1] исследовали
термодинамическую стабильность интеркалированных литием соединений в воде и
водных растворах. Энергия связи лития в этих соединениях является хорошим
показателем их стабильности и равна напряжению ячейки Li LixHost (LixHost - соединение внедрения лития). Более
высокое напряжение ячейки соответствует более тесно связанному литию. Когда LixHost реагирует с H2O, O2 и CO2 образуются LiOH, твердый Li2O и
твердый Li2CO3. Свободная энергия образования этих продуктов -51, -134 и
-176 ккал/моль, соответственно. Преобразуя эти свободные энергии образования в
энергии связи (эВ), получим значения: -2.22, -2.91 и -3.82 эВ (по отношению к
атому лития). Соединения внедрения лития, с напряжением больше, чем 3.9В
относительно Li, должны быть термодинамически более
стабильным по отношению к формированию любого из этих продуктов. Тем не менее,
это не так, потому что материалы, с несколько меньшим напряжением, чем 3.9В,
также устойчивы на воздухе. Из работы Маккинона (Makinnon) и Херинга (Hearing) [2], химический потенциал 𝜇Liинт интеркаляции Li в LixHost задается следующим образом:
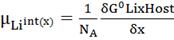 , (1)
, (1)
Где 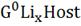 - свободная энергия Гиббса 1 моль
- свободная энергия Гиббса 1 моль 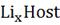 , в стандартном (твердом) состоянии;
, в стандартном (твердом) состоянии;
NA - число Авагадро.
Интегрируя, мы получим:
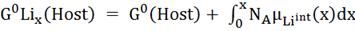 (2)
(2)
Маккинон (Makinnon) и Херинг
(Hearing) показали, что напряжение V(x) ячейки Li/LixHost задается выражением:
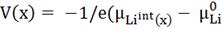 (3)
(3)
Где 𝜇Li0 - химический потенциал
металлического лития, который можно рассчитать по уравнению
𝜇Li0 = (δGLi0/δN);
e -
заряд электрода.
Применяя уравнение (3) для реакции LixHost + H2O → Li+ + OH- + 1/2H2, они получили следующее выражение для
напряжения относительно лития при взаимодействии LixHost с водой.
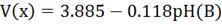 (4)
(4)
В соответствии с вышеуказанным выражением, Li(int), с
напряжением V(x) относительно Li, помещают в воду, и pH будет дано на основе решения уравнения (4). Для LixHost, с напряжением V(x) относительно LiOH, это выражение может быть переписано следующим образом:
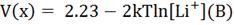 (5)
(5)
Данное выражение является очень важным при выборе электродных материалов
для использования в ЛИА с водным электролитом. Если V(x) > 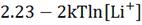 , то Li не будет выделяться из LixHost, и он будет стабильным в щелочных
растворах. На рисунке 1 изображена диаграмма зависимости потенциалов
интеркалируемых литием соединений от pH водных растворов или диаграмма Пурбе. В заключение можно сказать, что
интеркаляция лития из водных растворов возможна в том случае, если концентрация
ионов лития и pH выбираются по диаграмме Пурбе.
, то Li не будет выделяться из LixHost, и он будет стабильным в щелочных
растворах. На рисунке 1 изображена диаграмма зависимости потенциалов
интеркалируемых литием соединений от pH водных растворов или диаграмма Пурбе. В заключение можно сказать, что
интеркаляция лития из водных растворов возможна в том случае, если концентрация
ионов лития и pH выбираются по диаграмме Пурбе.
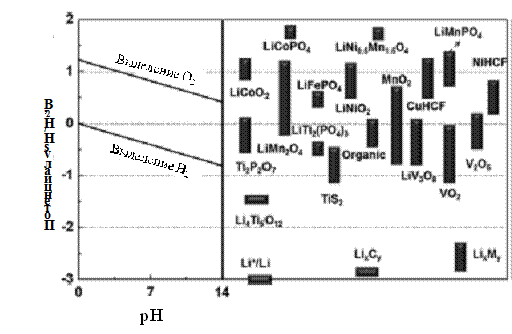
Рисунок 1 - Потенциалы интеркалируемых литием соединений относительно
водородного электрода [6].
1.2
Кинетика интеркаляции/деинтеркаляции иона лития
Кинетика транспорта ионов лития изучается с предположением того, что
диффузия лития является лимитирующей стадией процесса интеркаляции.
Нежелательное восстановление и окисление воды в процессе движения лития может
привести к изменению pH
электролита. Тем не менее, электродные материалы, для ЛИА с водным
электролитом, работают в диапазоне устойчивости воды. Таким образом,
восстановление и окисление воды не оказывает принципиального влияния на
кинетику транспорта лития в электроде. Ли (Lee) и Пюн (Pyun) [3] предложили контролировать механизм транспорта лития методом
импеданса ячейки. Спектр сопротивления переменного тока в водном электролите
показывает только один продукт в высокочастотной области, которая соответствует
переносу заряда реакции, в отличие от двух продуктов, наблюдаемых в неводных
электролитах. В водном электролите поверхностная пленка не образуется и
сопротивление переноса заряда снижается на один порядок по сравнению с тем, что
происходит в неводных электролитах. Это можно объяснить следующим образом. В
водных электролитах электрод «голый», т.е. отсутствует поверхностный слой и
перенос заряда через границу электрод/электролит происходит легко. Высокая ионная
проводимость водного электролита и быстрый перенос заряда являются основными
причинами снижения сопротивления ячейки в ЛИА с водным электролитом. Накаяма (Nakayama) и др. [4] вычислили энергию
активации реакции переноса иона лития на тонкую пленку LiMn2O4 - электрод/водный электролит и
органический электролит, использую формулу:
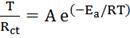 (6)
(6)
Где Ea - энергия активации, Дж/моль;
T -
абсолютная температура, К;
R -
универсальная газовая постоянная (8,314 кДж/моль∙К);
Rct - поверхностное сопротивление перехода иона лития,Ом;
A -
предэкспоненциальный множитель.
Было установлено, что межфазное сопротивление при переносе иона лития
оценивается диаметром полукруглой дуги импеданса около 400 Ом для органических
электролитов и 20 Ом для водных. Энергия активации, рассчитанная для 1М LiNO3, составила 24 кДж/моль, в то время
как для органического электролита это значение составляло 50 кДж/моль. Таким
образом, меньшая энергия активации водной системы имеет тенденцию к повышению
межфазного сопротивления процесса переноса иона лития.
Скорость процесса заряда/разряда сильно зависит от стадии переноса
заряда. По словам Брюса (Bruce)
и Саиди (Saidi), на поверхности электрода
происходит адсорбция [5]. Совсем недавно Накаяма (Nakayama) и др. обнаружили, что присутствие
иона Cu(II) тормозит скорость реакции переноса за счет увеличения
сопротивления процесса передачи лития. Адсорбция ионов Cu(II) на поверхности
электрода будет влиять на взаимодействие гидратированных ионов лития с
поверхностью электрода. Это говорит о том, что адсорбирующиеся ионы должны быть
удалены из электролита, использующегося в водных ЛИА, что может расширить
скоростные возможности батареи.
.3
Преимущества и недостатки использования водного электролита
Преимущества:
. Они имеют высокую ионную проводимость, поэтому могут быть
использованы толстые электроды;
2. Дорогие соли лития, такие как LiPF6, могут быть заменены на дешевые,
такие как LiNO3, Li2SO4;
3. Дорогостоящие сепараторы могут быть заменены на более дешевые;
5. Не требуются строгие технологии конструирования и сборки ячейки.
Недостатки:
. Потенциалы ячейки ограничены потенциалом разложения воды (1.23В
против 3.5В в органическом электролите);
2. Низкая циклируемость. Для большинства материалов она составляет
около 50-100 циклов. Однако, встречаются образцы с циклируемостью до 1000
циклов, но это единичные случаи.
В таблице 1 [6] перечислены свойства различных систем литиевых батарей,
изученных в водных электролитах до этих пор.
Таблица 1
Общая сводка производительности ячеек различных ЛИА в водных электролитах
|
Система
|
Электролит
|
Плотность энергии, Вт/кг
|
Максимальное число циклов
|
Среднее напряжение, В
|
|
VO2(B)/LiMn2O4
|
5M LiNO3
|
55
|
20
|
1.58
|
|
Li2Mn2O9/LiMn2O4
|
6M LiNO3
|
110
|
-
|
1.1
|
|
Li4Mn5O12/
LiMn2O4
|
6M LiNO3
|
110
|
-
|
1.1
|
|
LiV3O8/
LiMn2O4
|
2M Li2SO4
|
64.2
|
400
|
1.04
|
|
V2O5(ксерогель)/ LiMn2O4
|
нас. LiNO3
|
69
|
100
|
1.0
|
|
LiV3O8/LiNi0.8Co0.09O2
|
1M Li2SO4
|
30-60
|
100
|
1.5
|
|
LiTi2(PO4)3/
LiMn2O4
|
5M LiNO3
|
67.5
|
25
|
1.5
|
|
TiP2O7/
LiMn2O4
|
5M LiNO3
|
58.8
|
25
|
1.4
|
|
LiTi2(PO4)3/LiMn0.05Ni0.05Fe0.9PO4
|
нас. Li2SO4
|
78.3
|
50
|
0.9
|
|
Ppy/LiCoO2
|
нас. Li2SO4
|
40
|
120
|
0.85
|
|
LixV2O5-Ppy/
LiMn2O4
|
5M LiNO3
|
49.4
|
60
|
1.15
|
|
LixV2O5-PANI/
LiMn2O4
|
5M LiNO3
|
51.7
|
1.1
|
|
LiV3O8/
LiCoO2
|
нас. LiNO3
|
57.7
|
100
|
1.05
|
|
Zn/TiS2-MnO2
|
нас. LiOH + 1M ZnSO4
|
360
|
-
|
1.5
|
|
Zn/TiB2-MnO2
|
-/-
|
310
|
-
|
1.5
|
|
Zn/Bi2O3-MnO2
|
-/-
|
195
|
-
|
1.5
|
|
Zn/CeO2-MnO2
|
-/-
|
232
|
10
|
1.5
|
|
Zn/LiMnPO4
|
-/-
|
75
|
20
|
1.0
|
1.4
Материалы
.4.1
Катодные материалы
Катодные материалы для водных ЛИА должны быть способны к обратимому
внедрения/извлечению Li+. Таким образом, были рассмотрены
многие из соединений-внедрения лития, используемых в традиционных ЛИА.
Потенциалы извлечения/внедрения Li+ этих соединений должны быть ниже,
чем потенциал выделения кислорода, что обеспечивает стабильность водных
электролитов. Однако, чтобы максимизировать плотность энергии нужно увеличивать
этот потенциал. С этими соображениями были предложены различные катодные
материалы, в том числе оксиды (LiMn2O4, MnO2, LiCoO2, LiNi1/3Co1/3Mn1/3O2), полианионные соединения (LiFePO4, FePO4, LiMnPO4 и др.).
На разных стадиях, катодные материалы, как правило, показывали
ограниченную удельную емкость и серьезную потерю емкости при циклировании
батареи. Исследования показали, что ограничение удельной емкости вызвано (1)
совнедрением H+ в структуру, (2) Li+/H+ обменом в ходе циклирования, (3)
проникновением воды в структуру, и (4) растворением активных материалов в
водных электролитах. Многие исследования решили эти вопросы путем модификации
катодов с использованием присадок или добавок и путем управления поверхностью
раздела материал/электролит, используя всевозможные покрытия или изменяя состав
электролита [7].
Оксиды
Шпинель LiMn2O4
Первый опытный образец ячейки, с катодом из LiMn2O4, показал значительную обратимость со
средним напряжением 1,5 В и плотностью энергии 75 Вт∙ч/кг, которые могли
бы конкурировать с никель-кадмиевыми и свинцово-кислотными аккумуляторами.
Чтобы обеспечить эффективный заряд катодных материалов был важен выбор
электролита с определенным значением pH, т.к. при высоком значении pH в процессе извлечения ионов лития из LiMn2O4 может происходить выделение O2, что ухудшает производительность
цикла. Дальнейшие исследования влияния pH на электрохимические реакции в LiMn2O4 показали, что низком значении pH могут происходить рекции внедрения H+ и обмена Li+/ H+ [8], поэтому для надежной работы катодов LiMn2O4 в водных ЛИА является очень важным поддержание определенного
значения pH электролита. Йаялакшими (Jayalakshimi) и сотрудники установили, что в
нейтральной среде (LiCl в воде) происходит
преимущественное извлечение и внедрение Li+ , а не H+[9].
В [10] было показано, что электрохимические характеристики LiMn2O4 могут быть улучшены путем изменения состава электролита.
Так, ученые обнаружили, что скоростные способности электрода улучшаются в
электролите, с большей концентрацией LiNO3, из-за высокой ионной проводимости. С другой стороны,
обратимость электрода была лучше в электролите с умеренной концентрацией соли
лития. Это указывает на то, что на электрохимические характеристики водных ЛИА
оказывает влияние взаимодействие между электродом и электролитом.
Легирование LiMn2O4 ионами металлов привело к улучшению
структурной целостности LiMn2O4 в водных электролитах. Юань (Yuan) и др. синтезировали ряд Al-легированных LiAlxMn2-xO4 (x = 0, 0.05, 0.10, 0.15) при различных температурах [11]. Проведя
ряд исследований, они выяснили, что в целом легирование Al приводит к улучшению стабильности
циклирования LiMn2O4. Из гальваностатических тестирований
при плотности тока 1000 мА/г видно, что Al-легированные образцы могут приемлемо работать более 4000
циклов, что не достигается даже для обычных систем с органическим электролитом.
Улучшение производительности цикла Al-легированного образца было связано с подавлением эффекта Яна-Теллера и
стабилизацией октаэдров [11].
Недавно был представлен интересный подход к улучшению циклируемости LiMn2O4, в котором в качестве электролита был
использован винил карбонат (ВК) [12]. Добавки ВК приводят к образованию на
поверхности электрода твердоэлектродного слоя. Несмотря на то, что природа
данного слоя в водных системах остается неясной, он может предотвратить
проникновение молекул воды в электродные материалы. В результате этого можно
обеспечить стабильное извлечение/внедрение Li+ из/в LiMn2O4 и лучшую производительность цикла по сравнению с
системами без добавок.
Диоксид
марганца (MnO2)
MnO2 обладает
различными полиморфными модификациями, а именно: α-,β-,γ-,δ-,ε- и λ-MnO2 [7]. Среди этих полиморфных структур, γ-,δ-, и λ-MnO2 способны внедрять Li+ в водном растворе и могут быть использованы в качестве
электродных материалов для водных ЛИА. λ-MnO2 демонстрирует емкость ~160 мА∙ч/г на первом
цикле разряда, при этом наблюдалась возможность последующего
внедрения/извлечения Li+. Тем не менее, деградация емкости
была достаточно быстрой, после 60 циклов оставлось только ~50 мА∙ч/г
[13]. Юанем (Yuan) и др. [14] были рассмотрены
электрохимические свойства γ-MnO2. Приблизительно 35 мА∙ч/г было получено от
ячеек, с анодом из активированного угля и катодом из γ-MnO2, при этом сохранялось 78% от начальной емкости после
1500 циклов. Подобное поведение наблюдается и у δ-MnO2, о чем свидетельствует Цюй (Qu) и др. [15]. Минакши (Minakshi) и др. пытались улучшить
электрохимические свойства MnO2 в водных
ЛИА путем введения нескольких добавок в электроды, таких как TiS2, TiB2, Bi2O3,CaO и CeO [7]. Полагается, что эти добавки
стабилизируют MnO2 в процессе циклирования батареи, подавляя деформации
и уменьшая число побочных реакций в электролитах.
Слоистый
LiCoO2
Слоистый LiCoO2, успешно использующийся в
традиционных ЛИА, был также исследован в качестве катода в водных ЛИА. Однако
первоначальные результаты показали, что в электролите LiOH вместо внедрения Li+ происходит преимущественное внедрение H+ [7]. Позднее было обнаружено, что обратимое извлечение
(внедрение) Li+ из (в) слоистого LiCoO2 может происходить в LiNO3, Li2SO4 электролитах [16]. В ЦВ исследованиях LiCoO2-элктрода было установлено, что
окислительно-восстановительная реакция протекает при потенциале около 0.9В
(относительно стандартного водородного электрода). Важно отметить, что при этом
происходит внедрение Li+, а не H+. Из гальваностатических исследований было обнаружено, что
катод из LiCoO2 циклируется с относительно низкой поляризацией в окне
напряжений 0.55-1.15В (относительно стандартного водородного электрода), при
этом стабильная емкость сохранялась в течение свыше 90 циклов. В диапазоне
напряжений 0.55-1.2В (относительно стандартного водородного электрода)
полученная емкость составляла примерно 115 мА∙ч/г, что соответствовало
0,42 Li+ в LiCoO2. В диапазоне напряжений 0.55-1.4В (относительно
стандартного водородного электрода), около 0.5 Li+ может быть обратимо извлечено из LiCoO2 , что близко к максимальной практической емкости LiCoO2. Тем не менее, кулоновская эффективность значительно
уменьшается с расширением границ потенциалов. Снижение обратимости LiCoO2 выше 1.3В (относительно стандартного
водородного электрода) было связано с побочными электрохимическими реакциями:
разложение воды, окисление субстрата.
Танг (Tang) и др. предложили
высокопроизводительный катод для водных ЛИА на основе нано-структурированного LiCoO2 [17]. Нано-LiCoO2
электроды были протестированы с использованием 0.5М Li2SO4
электролита.
Выяснилось, что нано-LiCoO2
демонстрирует высокую емкость (143 мА∙ч/г) при плотности тока 1000 мА/г и
удерживает 135 и 133 мА∙ч/г при плотностях тока 5000 и 10 000 мА/г,
соответственно. Эти выдающиеся скоростные возможности могут быть результатом
уменьшения размера частиц в сочетании с быстрой диффузией ионов в водном электролите.
Слоистый LiNi1/3Co1/3Mn1/3O2
LiNi1/3Co1/3Mn1/3O2 (NCM) был введен
как альтернативная перспектива LiCoO2 в
традиционных ЛИА, и как возможный катодный материал в водных ЛИА. В [18]
проводилось исследование влияния pH на
электрохимические свойства NCM. По кривым ЦВ опытов, проведенных в водном Li2SO4 с различным уровнем pH, стало ясно, что стабильность NCM в зависит от pH раствора. Было установлено, что при pH 7 и 9 в электролите протекают
побочные реакции, внедрение H+
в NCM-электрод, а при pH 11-13 данный материал работает
стабильно, но все же наблюдается выделение O2. Шивашанкарая (Shivashankaraiah) и др. [19] синтезировали NCM с полипиррольным покрытием и изучили
его электрохимические свойства, используя LiV3O8 в качестве анода и 5М LiNO3 в качестве электролита. NCM с полипиррольным покрытием демонстрирует 70 мА∙ч/г
на первом цикле разряда, при этом сохраняется 55 мА∙ч/г после 150 циклов.
Недавно, Ванг (Wang)
и др. сообщили о высокой производительности водных ЛИА на основе пористого NCM [20]. Нано-структурированный NCM выдает емкость 155 мА∙ч/г на
1,5С (1С=160 мА∙ч/г) и сохраняет обратимую емкость 108 мА∙ч/г при
45С. Стабильность цикла и допустимая мощность значительно повышаются по
сравнению с обычными NCM-электродами.
Более 90% первоначальной емкости может быть сохранено и после 50 циклов при
скорости разряда 3С.
Полианионные
соединения
Оливин LiFePO4
LiFePO4,
со структурой оливина в качестве катода для водных ЛИА, был предложен Маникам (Manickam) и др. [21] Проведя ряд
электрохимических испытаний, ученые выяснили, что электрохимическое окисление LiFePO4 происходит аналогично неводным системам, с
образованием FePO4, однако, восстановление FePO4 не полностью обратимо, т.к. образуется смесь LiFePO4 и Fe3O4 [21]. При этом от цикла к циклу
происходит деградация емкости (70 мА∙ч/г на первом цикле, 50 мА∙ч/г
на втором и 40 мА∙ч/г на пятом). Для выяснения причин этой деградации Хи
(He) и др. исследовали химическую и
электрохимическую стабильность LiFePO4 в водных
ЛИА [22]. Они обнаружили, что O2 и OH- в водных электролитах критически
ухудшают стабильность циклирования LiFePO4, т.к. в присутствие O2 на
поверхности LiFePO4 образуются побочные продукты, которые в отсутствие O2 обнаружены не были. Также Хи (He) и др. выяснили, что углеродное
покрытие эффективно блокирует растворение O2 и OH- в электролите и улучшает стабильность циклирования LiFePO4. Дальнейшие исследования показали,
что легированные LiFePO4, такие как LiMn0.05Ni0.05Fe0.9PO4, проявляли повышенные стабильность
циклирования и скоростные возможности. В системе водных ЛИА в паре с анодом из LiTi2(PO4)3 и насыщенным Li2SO4 в качестве электролита, катод LiMn0.05Ni0.05Fe0.9PO4 может демонстрировать около 87 мА∙ч/г
первоначальной емкости. После 50 циклов было сохранено около 55 мА∙ч/г.
Такие добавки, как CeO2, также обеспечивают лучшие
электрохимические характеристики, чем недопированные материалы, особенно при
повышенных температурах и больших скоростях сканирования.
Тригональный FePO4
Тригональный FePO4, который аналогичен оливину, был
исследован в качестве потенциального катода для водных ЛИА в 2010 г [23]. На
основе XRD-анализа, было выяснено, что
электровосстановление FePO4 происходит
с образованием оливина LiFePO4.
Это указывает на то, что механизм реакции окисления-восстановления для FePO4 в водном LiOH электролите такой же, как и в неводном электролите.
Электрод FePO4 выдает 65 мА∙ч/г емкости со средним потенциалом
0.5В (относительно цинкового анода) на первом цикле разряда. Однако,
достаточных данных циклирования не было.
Оливин LiMnPO4
Минакши (Minakshi) и
сотрудниками [24] провели электрохимические исследования LiMnPO4 в водных ЛИА и вяснили, что внедрение/извлечение Li+ в/из LiMnPO4 происходит
по обратимой двухфазной реакции между LiMnPO4
и MnPO4. В отличие от LiFePO4, который претерпевает частичное
восстановление, LiMnPO4 был стабилен в процессе
окисления/восстановления электрода. LiMnPO4-электрод
выступил с начальной емкостью 70 мА∙ч/г, но продемонстрировал
сравнительно плохую циклируемость, сохраняя меньше, чем 20% от начальной
емкости после 20 циклов. Позже, Мандзуната (Manjunatha) и др. значительно повысили
стабильность цикла варьируя состав и природу электролита [25]. LiMnPO4 с LiTi2(PO4)3, в качестве анода, в 5М LiNO3 демонстрирует 85 мА∙ч/г
емкости. Кроме того, стабильная работа цикла наблюдалась в течение 50 циклов с
незначительной потерей емкости после 5 циклов. Другие исследователи пытались
улучшить электрохимические характеристики LiMnPO4 с помощью легирования, как в случае LiNi0.05Mn0.95PO4
и добавлением всяческих присадок, таких как TiS2 [7]. Однако, были зарегистрированы лишь
незначительные улучшения.
1.4.2
Анодные материалы
В качестве анодных для водный ЛИА были предложены следующие материалы:
оксиды (VO2(B),
шпинель (Li2Mn2O4), слоистый γ-LiV3O8, параморфный VO2, V2O5 и анатаз TiO2), полианионные соединения (пирофосфат TiP2O7 и натрий-суперионные проводники типа NASICON LiTi2(PO4)3),
окислительно-восстановительные реакции которых протекают вблизи потенциала
выделения водорода.
На основании ранних исследований, в большинстве анодных материалов
наблюдалось значительное падение емкости во время электрохимической реакции и
ограничение практического потенциала по сравнению с обычными литий-ионными
аккумуляторами. Исследования анодных материалов выявили причины сохранения
низкого потенциала: (1) растворение активных соединений;(2) необратимые
структурные преобразования, возможно, это происходит из-за внедрения протона и
(3) спонтанная реакция извлечения из литийзамещенных соединений,
сопровождающееся разложением воды, в результате чего формируется LiOH (водный раствор) и водород [7]
LixA + xH2O → A + xLi+
+ OH- + x/2H2↑
Недавние исследования показали, что электрохимические характеристики
анодов могут быть значительно улучшены за счет использования электролита, с
точно контролируемыми pH, типом и концентрацией соли лития, остаточного O2 и покрытием поверхности активных материалов защитными
слоями.
Оксиды
Моноклинный VO2(B)
В первых водных ЛИА в качестве анодного материала использовали VO2(B) с
моноклинной структурой [7]. VO2(B) содержит в структуре туннели, через которые ионы лития
могут быстро и обратимо интеркалироваться и деинтеркалироваться. Кроме того, VO2(B)
показывает умеренный восстановительный потенциал -0.67В относительно
стандартного каломельного электрода и -0.47В относительно стандартного
водородного электрода . Учитывая, что выделение водорода при pH 7.29 происходит при потенциале
-0.47В относительно стандартного водородного электрода, термодинамическая
стабильность литированных VO2(B) в растворах электролитов с pH, большим 7.29, показывает, что VO2(B)
может быть надлежащим анодным материалом для водных ЛИА.
Окислительно-восстановительная реакция VO2(B) включает в себя
реакцию внедрения/извлечения лития (VO2(B) + xLi+ + xe = Lix VO2(B)), в то время
как введение и участие протона и гидроксид-иона не обнаружено. Такой вывод был
сделан на основе независимости окислительно-восстановительного потенциала от pH раствора.
Несмотря на структурно-термодинамическую устойчивость литированных VO2(B),
водные ЛИА, изготовленные из VO2(B), как правило, демонстрируют плохое сохранение емкости при
непрерывном циклировании [7]. Детальные исследования показали, что стабильность
цикла VO2(B)
тесно связана с pH электролита.
Было выяснено, что разрядная емкость и кулоновская эффективность VO2(B)-электродов
увеличиваются при уменьшении pH. С другой стороны, в сильно основных электролитах (pH 11.3), емкость быстро затухала из-за
растворения VO2(B) в
электролите. Чанг (Zhang) и др.
показали, что относительно хорошее удерживание емкости может быть достигнуто в
слегка основных условиях [26]. Тем не менее, остается несколько недостатков
использования VO2(B) в
водных системах. Они включают (1) выделение водорода, снижающее кулоновскую
эффективность, (2) неустойчивость VO2(B) при длительном воздействии воздуха
и (3) утомительная процедура синтеза метастабильного VO2(B) [7].
Многие исследователи сообщают, что электрохимические свойства VO2(B)
могут быть улучшены за счет морфологической оптимизации электрода. Чанг (Zhang) и др. разработали методику синтеза
нанокристаллического VO2(B). Его электрохимическая активность в водных ЛИА была
рассмотрена в сравнении с микро- VO2(B). По мнению авторов, нано- VO2(B), с высокой
площадью поверхности, продемонстрировал более высокую емкость с лучшей
стабильностью цикла по сравнению с двумя другими морфологиями в 2.5М LiNO3 и 0.01М LiOH. Кроме того, Ванг (Wang) и др. применяли углеродное покрытие поверхности VO2(B),
чтобы улучшить стабильность цикла[27].
Орторомбический
парамонтросеит - VO2(P- VO2)
P-VO2
был рассмотрен как возможный анодный материал для водных ЛИА. Как правило, он
проявляет высокую электронную проводимость, которая проистекает из
металлической электронной структуры. Кроме того, кристаллическая структура P-VO2 содержит большие туннели (2.446Å - 4.946Å), что может способствовать диффузии
ионов лития [7]. В 2008 г был разработан синтез P-VO2 и сконструирована ячейка с LiMn2O4, в качестве катода, в 5М LiNO3 и 0.01М LiOH. Было выяснено, что синтезированные образцы могут обратимо
хранить и выделять ионы лития в системах водных ЛИА. Оценка кривых
напряжение-емкость ячеек P- VO2// LiMn2O4 показала, что редокс-потенциал P- VO2 составил ~ -500÷-200 мВ (относительно стандартного
водородного электрода). P-VO2 продемонстрировал емкость ~65 мА∙ч/г при плотности тока 10 мА/г. Кроме
того, он поддерживал 74% от начальной емкости на 50 цикле [28].
Слоистый γ-LiV3O8
Первоначально γ-LiV3O8 был введен как возможный катодный материал для традиционных
ЛИА, как анодный материал в водных ЛИА он был предложен позже Колером (Kohler) и др. [7]. Электрохимические
испытания γ-LiV3O8 свидетельствуют о термодинамической
стабильности литированного Li1+хV3O8, т.к. потенциал
окислительно-восстановительной реакции (-100 мВ относительно стандартного
водородного электрода) выше потенциала выделения водорода при pH 6.2 (-366 мВ относительно
стандартного водородного электрода). Несмотря на это, материал обладает низкой
производительностью (емкость - 45÷90 мА∙ч/г при 230 мА∙ч/г в
органическом электролите и после 100 циклов от начальной емкости сохраняется
только 25-40%). В 2007-2008 гг. Ванг (Wang) изучал электрохимическое поведение анода из LiV3O8 с различными катодными материалами, такими как шпинель,
слоистые оксиды, полианионные соединения, указанные выше) [7]. Он также сообщил
о 70 мА∙ч/г емкости в водных системах с относительно низким сохранением
емкости, ниже 50% после 100 циклов в нейтральной среде. В дальнейшем было
выяснено, что причиной низкой производительности γ-LiV3O8 является ухудшение кристаллической структуры в процессе
циклирования.
Недавние исследования показали, что электрохимические характеристики
анодов из γ-LiV3O8 могут быть значительно улучшены
путем изменения морфологии электрода и состава электролита. Оказалось, что
наноструктурированный Li1+хV3O8 может позволить использовать 70% от теоретической емкости,
обеспечивая 189 мА∙ч/г при 0.1С [29] Чао (Zhao) и др. показали, что устранение кислорода из
электролита и высокая концентрация солей лития (9М LiNO3) значительно увеличили сохранение емкости водных
литий-ионный аккумулятор и стабильность циклирования (сохраняет примерно 90%
начальной емкости после свыше 500 циклов). Исходя из этого, можно предположить,
что необратимая структурная деградация γ-LiV3O8 может быть вызвана растворением ванадий-связанной компоненты
во время циклирования.
Оксид ванадия
(V)
Недавно Ванг (Wang) предложил в
качестве анода для водных ЛИА оксид ванадия(V) (V2O5) [30]. V2O5 был тщательно исследован для применения в качестве
катода в традиционных ЛИА, т.к. он обладает высокой теоретической емкостью (294
мА∙ч/г) и высокой электронной проводимостью из-за смешанной валентности
ванадия при восстановлении [7]. В водных ЛИА V2O5 используется в качестве анода и
демонстрирует адекватный окислительно-восстановительный потенциал, ~ -300мВ
относительно стандартного водородного электрода. Однако, в более ранних
работах, в водных ЛИА, изготовленных с использованием LiMn2O4-катода и 5М LiNO3
электролита, он показал недостаточное сохранение емкости (15% после 40 циклов),
Быстрые потери емкости были вызваны, преимущественно, растворением ионов
ванадия, что сопровождалось изменением кристаллической структуры и аморфизацией
при повторном циклировании. Для решения этой проблемы было предложено
ингибировать растворение ванадия путем покрытия поверхности электрода
полимерными соединениями, такими как полипирролл (Ppy), полианилин (PAn). Следовательно, так можно повысить циклируемость (Ppy, 86% для 40 циклов; PAn, 80% для 40 циклов), не вызывая
аморфизации [7].
Анатаз TiO2
Анатаз TiO2, стабильный анодный материал для
традиционных ЛИА, впервые был применен в водных ЛИА Минакши (Minakshi) и др. ЦВ исследования указывает на
соприсутствие обратимых и необратимых реакций во время циклирования, а также
наблюдается фазовый переход TiO2 в процессе
восстановления, что приводит к образованию различных оксидов титана, таких как LixTiO2, Ti2O3, Ti2O и TiO. Хотя LixTiO2 (формируется с помощью внедрения лития в TiO2) обратимо исчезал после заряда, другие фазы
оставались в течение всего циклирования. Формирование различных фаз было
связано с одновременным введением Li+
и H+ в TiO2.
Позже, исследования нано-структурированного TiO2 показали, что его электрохимическое поведение
отличается от того, что демонстрировал микро-TiO2. Окислительно-восстановительная
реакция электроосажденного наноструктурированного TiO2 протекает при потенциале около 400-500 мВ, что ниже
по сравнению с ранее известными данными о TiO2.
Оксид
лития-марганца
Ли (Li) и др. и Пей (Pei) и др. представили шпинель LiMn2O4 в качестве анодного материала в водных ЛИА [31]. Было
показано, что профиль разряда LiMn2O4 обладает плато напряжения при -100 мВ (относительно
стандартного водородного электрода). Однако плато напряжения анода LiMn2O4 исчезает на последующих циклах, также наблюдается быстрое
падение емкости, что свидетельствует о плохой обратимости.
С начала работ в 1990-х [7] было мало удачных попыток по употреблению
литий-марганец оксида в качестве анода в водных ЛИА. Это, вероятно, обусловлено
следующими внутренними проблемами трехвалетного марганца на стадии
восстановления: (1) большое искажение принимающих структур, вызванное эффектом
Яна-Теллера активного Mn3+, который является частой причиной
снижения емкости в традиционных литий-ионный аккумулятор; (2) растворение ионов
Mn2+ в электролите за счет
диспропорционирование ионов Mn3+; (3) относительно низкая
теоретическая емкость (меньше 200 мА∙ч/г) и высокий
окислительно-восстановительный потенциал Mn4+/Mn3+ по сравнению с другими анодными
материалами.
Полианионные
соединения
В 2007 г. Ванг (Wang)
и др. предложили два полианионных соединения (пирофосфат TiP2O7 и натрий-суперионный проводник типа NASICON LiTi2(PO4)3), в качестве анодных
материалов в водных ЛИА [32]. Электрохимические исследования TiP2O7 и LiTi2(PO4)3 показывают, что
окислительно-восстановительные реакции обоих соединений протекают при
потенциалах примерно от -350 до -450 мВ (относительно стандартного водородного
электрода), соответственно. Первая и вторая разрядные емкости были около 100 и
90 мА∙ч/г для TiP2O7 и 115 и 100 мА∙ч/г для LiTi2(PO4)3 в 5М LiNO3электролите. Тем не менее, емкость быстро падала, и
только 35% было сохранено после 25 циклов. В дальнейшем исследователи выяснили
причину плохой стабильности цикла. Ванг (Wang) и др. установили, что кристалл TiP2O7 во время циклирования разлагаются с образованием новых соединений
[32]. Сан (Sun) и др. также недавно обнаружили, что
поверхность TiP2O7 после циклирования повреждается [33]. Обе работы показывают,
что во время циклирования электрода TiP2O7 происходит сильная структурная
деградация.
Циклические характеристики этих анодов были улучшены несколькими
подходами. Луо (Luo) и др.
получили слои углеродного покрытия (~25нм) на поверхности LiTi2(PO4)3, которое улучшило сохранность емкости
до 80% после 200 циклов [7]. Кроме того, Веселс (Wessells) и сотрудники показали, что для
улучшения стабильности важно поддержание нейтрального pH, исключающего разложение воды [7]. В
отсутствие окислительного разложения воды ячейка LiTi2(PO4)3// Li1-xFePO4 в 2М Li2SO4 при постоянном рН 8 показывают кулоновскую
эффективность выше 98% и 90%-е сохранение емкости после 100 циклов повторного
заряда и разряда.
Заключение:
В литературном обзоре были рассмотрены электродные материалы для
литий-ионных аккумуляторов с водным электролитом. Как к катодным, так и к
анодным относятся оксиды и полианионные соединения. В качестве катодных были
рассмотрены LiMn2O4, MnO2, LiCoO2, LiNi1/3Co1/3Mn1/3O2, LiFePO4, FePO4, LiMnPO4 и др. Главными проблемами использования данных
материалов в водной системе были ограниченная удельная емкость и серьезная
потеря емкости при циклировании батареи. Исследования показали, что ограничение
удельной емкости вызвано (1) совнедрением H+ в структуру; (2) Li+/H+ обменом в ходе циклирования; (3) проникновением воды
в структуру, и (4) растворением активных материалов в водных электролитах.
Многие исследования решили эти вопросы путем модификации катодов с
использованием присадок или добавок и путем управления поверхностью раздела
материал/электролит, используя всевозможные покрытия или изменяя состав
электролита.
В качестве анодных материалов были рассмотрены VO2(B), шпинель (Li2Mn2O4), слоистый γ-LiV3O8, параморфный VO2, V2O5, анатаз TiO2 и полианионные соединения (пирофосфат
TiP2O7 и суперионный проводник типа NASICON LiTi2(PO4)3. Основными проблемами данных анодных
материалов было значительное падение емкости во время электрохимической реакции
и ограничение практического потенциала по сравнению с обычными литий-ионными
аккумуляторами. Исследования анодных материалов выявили причины сохранения
низкого потенциала: (1) растворение активных соединений; (2) необратимые
структурные преобразования, возможно, это происходит из-за внедрения протона и
(3) спонтанная реакция извлечения из литийзамещенных соединений,
сопровождающееся разложением воды, в результате чего формируется LiOH (водный раствор) и водород
LixA + xH2O → A + xLi+
+ OH- + x/2H2↑
Недавние исследования показали, что электрохимические характеристики
анодов могут быть значительно улучшены за счет использования электролита с
точно контролируемыми pH, типом и концентрацией соли лития, остаточного O2 и покрытием поверхности активных материалов защитными
слоями.
электрохимический электродный литий водный электролит
2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
.1
Характеристики исходных и вспомогательных веществ
В качестве исходных веществ для синтеза фосфата железа-лития были выбраны
карбонат лития («ч», НеваРеактив, Россия), оксид железа (III) («ч», Реахим, Россия),
дигидрофосфат аммония («чда», Реахим, Россия), моногидрат лимонной кислоты
(ЛенРеактив, Россия). Для получения марганец замещенных фосфатов железа-лития
применялся Mn(CH3COO)2∙4H2O («ч», ХимРеактивСнаб, Россия). Дополнительная очистка
указанных веществ не производилась. Для синтеза образцов, содержащих оксиды
олова(IV) и вольфрама(VI) были получены β-оловянная кислота, по реакции
взаимодействия гранулированного олова с азотной кислотой (1:1) [34], и желтая
вольфрамовая кислота, по обменной реакции между K2WO4 с HCl (3М раствор) [35]. Полученные кислоты сушились на
воздухе при комнатной температуре до воздушно-сухого состояния.
Для синтеза фосфата лития-титана были выбраны карбонат лития,
дигидрофосфат аммония и оксид титана(IV) (анатаз) и крахмал («чда», Реахим, Россия).
Аргон высокой степени чистоты (Волгоградский кислородный завод, Россия)
использовался для барбатирования электрохимической ячейки пред началом
тестирования.
Вспомогательными веществами также являлись ацетон и этанол. Ацетон
квалификации “техн.” (Саратоворгсинтез, Россия) очищали перегонкой на установке
с ёлочным дефлегматором высотой 0.2 м. Для работы отбирали фракцию с
температурой кипения 56.3-56.5°С и хранили её в эксикаторе над CaCl2. Используемая азеотропная смесь этанола и воды
получалась отбором фракции с температурой кипения 78.2-78.5 °С при перегонке на
подобной установке. Растворители идентифицировали по температуре кипения (табл.
2.1).
Таблица 2.1
Температура кипения растворителей
|
Растворитель
|
Техническая документация
|
tкип, °С
|
|
|
Наши данные
|
Справочные данные [42]
|
|
Ацетон
|
ГОСТ 2603-71
|
56.3-56.5
|
56.24
|
|
Этиловый спирт (азеотроп с
водой)
|
ТУ-6-09-1710-77
|
78.2-78.5
|
78.15
|
2.2 Синтез
образцов
Исходные вещества для синтеза чистого и допированного Mn, SnO2 и WO3 LiFePO4 (Li2CO3, Fe2O3, NH4H2PO4, Mn(CH3COO)2∙4H2O, SnO2, WO3), а также для синтеза фосфата
лития-титана (LiTi2(PO4)3) взвешивались согласно
требуемому соотношению на весах AND GX-600 (Япония) с
точностью 0,001 г и количественно переносились в стальные барабаны с мелющими
телами (стальные шарики диаметром 5 мм). Общая масса исходных веществ
составляла 25 г. Соотношение массы мелющих тел и общей массы исходных веществ
составляло 1:10. В качестве жидкой дисперсионной среды использовался ацетон,
вносимый объём - 42 мл (с помощью мерного цилиндра с максимальным объёмом 100
мл). После этого барабан закрывался, на резьбу крышки для дополнительной
герметизации наматывалась фторопластовая лента.
Механическая активация проводилась на планетарной мельнице-активаторе
АГО-2 («Новиц», Россия) с пультом управления для регулирования скорости
вращения электродвигателя. Если активации подвергалась одна смесь, то во второй
барабан помимо мелющих тел помещался мел для уравновешивания барабанов (с
точностью ± 1 г). Режим активации - 25 Гц, соответствующий вращению барабанов в
переносном движении с частотой 560 мин-1. Время механической
обработки составляло 20 мин.
После механической обработки смеси сушились при комнатной температуре на
воздухе до воздушно-сухого состояния. Смеси до востребования хранились в плотно
закрытых полиэтиленовых пакетах в картонной коробке.
Подготовленная смесь для синтеза образцов LiFePO4 помещалась во взвешенную фарфоровую лодочку для
сжигания, взвешивалась на аналитических весах с точностью ±0,0001 г и
помещалась в трубчатую печь. Печь перед началом нагрева продувалась сухим
аргоном в течение 5 минут, продувка аргона продолжалась до достижения
температуры выдержки. Нагрев образца осуществлялся со скоростью 10 °C/мин до температуры 750 °C, при которой выдерживался в течение
5 часов. Охлаждение - медленное, вместе с печью. Регулировка температуры
осуществлялась терморегулятором ТРМ251 в режиме ПИД с точностью ± 5 °C. Контроль температуры внутри печи
вблизи образца осуществлялся с помощью калиброванной хромель-алюмелевой
термопары (через стенку фарфорового кармана). Готовый продукт в лодочке
взвешивался, по разнице масс до и после отжига определялся выход. Образцы
хранились в плотно закрытых полиэтиленовых пакетах в картонной коробке.
Процедура синтеза LiTi2(PO4)3 была аналогичной. Нагрев образца
осуществлялся со скоростью 2 °C/мин
до температуры 350°С, при которой выдерживался 4 часа, затем продолжался нагрев
со скоростью 2°C/мин до
температуры 400°С, после продолжался нагрев со скоростью 5 °C/мин до температуры 900°С, при
которой образец выдерживался в течение 10 часов.
Фазовый состав конечных продуктов контролировался рентгенофазовым
анализом на рентгеновском диффрактометре Gemeni A (Oxford Diffraction Limited,
Великобритания) с использованием Cu-K излучения.
.3
Методика эксперимента
.3.1
Изготовление рабочего электрода
Образец и электропроводная добавка (сажа) взвешивались с точностью
0,0001г в бюксе в требуемом соотношении, в бюкс приливалось взвешиваемое
количество раствора связующего. Гомогенизация смеси проводилась в
ультразвуковой ванне CT-400D в режиме мощности 60 Вт в течение 16 минут.
Полученная масса наносилась на одну сторону предварительно взвешенной титановой
подложки (рабочая поверхность титановой подложки заворачивалась в пористый никель
и опускалась на 30 мин. в концентрированную соляную кислоту, после промывалась
дистиллированной водой, этиловым спиртом и сушилась при 110 °C не более 30 мин) и размазывалась до
формы квадрата площадью 1 см2. Сушка производилась на воздухе при
температуре 120°C не менее 24
часов. После сушки рабочая масса прессовалась при давлении 2,5 т/см2.
Готовые электроды взвешивались с точностью 0,0001г.
.3.2
Электрохимические измерения
Электрохимические испытания проводились в герметизируемой стеклянной
электрохимической ячейке ЯСЭ-2. В качестве электрода сравнения использовался
хлоридсеребряный электрод с насыщенным раствором KCl. Противоэлектрод - платиновая проволока. В качестве
электролита использовался 1M
водный раствор LiNO3 для материалов на основе оливина и 1M водный раствор Li2SO4 для LiTi2(PO4)3. Объём электролита в ячейке составлял 70
мл, поэтому считали, что концентрация ионов лития в электролите при заряде или
разряде остаётся постоянной. Перед испытанием электролит и ячейка продувались
аргоном в течение 50 мин, после чего ячейка герметизировалась.
Термостатирование (± 0,05°C)
осуществлялось с использованием жидкостного термостата PolyScience “AlexRedCTD” и дистиллированной воды
в качестве термостатирующей жидкости.
Гальваностатическое циклирование проводилось с использованием
разрядно-зарядных модулей УЗР 0.03-10 («Бустер», Россия). Основной режим - 0.1 C, где C = 170 мА/г для LiFePO4
и 138 мА/г для LiTi2(PO4)3. Ток задавался с дискретностью 0,1 мкА,
точность установки составляла ±0,5 мкА. Границы потенциалов задавались согласно
требованию эксперимента. Регистрация времени (±1 c) и потенциала (± 0,001 В) осуществлялась программой Buster. Обработка данных велась с помощью MS Excel 2003. Удельная ёмкость рассчитывалась как
произведение установленного тока на время работы, делённое на массу активного
вещества в рабочем электроде. Погрешность определения ёмкости составляет 3%.
Для исследований LiFePO4 методом
циклической вольтамперометрии применялся программатор ПР-8 в качестве задатчика
потенциала и его развёртки, потенциостат ПИ-50-1 и для регистрации
программно-аппаратный комплекс S-Recorder. Диапазон потенциалов - от -0.5 до
0.8 В. Начальный потенциал - стационарный для каждого электрода, установившийся
после выдержки в электролите. Частота регистрации данных - 1 с-1.
Сглаживание кривой и последующая обработка данных производились с помощью
системы компьютерной алгебры Mathcad
и MS Excel 2003. Расчёт коэффициента диффузии лития для
катодного и анодного процессов из тангенса угла наклона прямой в координатах
ток пика - квадратный корень из скорости развёртки потенциала осуществлялся с
использованием уравнения Рэндлса-Шевчика [36]:
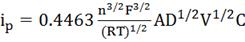 ,
,
Где ip - ток пика, А;
A -
площадь электрода, см2;
C -
концентрация ионов в электроде, мол·дм-3;
D -
коэффициент диффузии, см2·с-1;
V -
скорость развёртки потенциала, мВ·с-1;
n -
число электронов, участвующих в элементарном процессе;
F =
96485,3 - постоянная Фарадея, Кл·моль-1;
R =
8,3144 - универсальная газовая постоянная, Дж·моль-1·K-1;
T -
абсолютная температура, K.
.4
Электрохимическое поведение чистого и Mn-содержащего оливина
Были синтезированы образцы LiFePO4 и LiFe1-xMnxPO4 (x = 0,
0.05, 0.2) термообработкой смесей исходных веществ, активированных в течение 20
минут в среде ацетона. Термообработка велась в течение 5 часов. В 1M водном растворе LiNO3 образцы недопированного и допированного марганцем
оливина показали весьма неплохие начальную удельную ёмкость (158 мА∙ч/г
для x = 0, 160 мА∙ч/г для x = 0.05, 128 мА∙ч/г для x = 0.2) и циклируемость при
повышенных плотностях тока (рисунки 2.1 и 2.2).
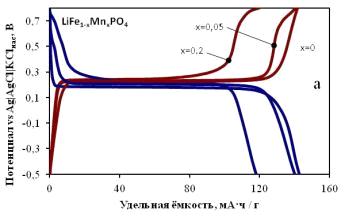
Рисунок 2.1 - Зарядно-разрядные кривые, измеренные в режиме 0,2С,
образцов LiFe1-xMnxPO4 с x = 0;
0.05; 0,2
Диапазон потенциалов от -0,5В до 0,8В vs нас. AgAgCl.
Температура 25°С
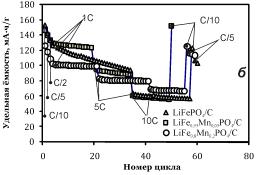
Рисунок 2.2 - Изменение циклируемой емкости электродов на основе LiFe1-xMnxPO4. (x = 0;
0.05; 0,2).
Токовая нагрузка при циклировании последовательно увеличивалась в ряду
0,1С-0,2С-0,5С-10С. Диапазон потенциалов от-0,5В до 0,8В vs нас. Ag AgCl. Температура 25°С.
На кривых гальваностатического заряда и разряда в случае недопированного
образца наблюдается одно потенциостатическое плато при 0,2В vs. Ag|AgCl|KClнас., что соответствует двухфазному
внедрению или извлечению ионов лития. Для допированнных марганцем образцов
вблизи верхней границы потенциалов (0,8В vs. Ag|AgCl|KClнас) наблюдается участок,
соответствующий окислению ионов марганца.
Замечено, что стабильность циклирования марганецсодержащего образца
оливина гораздо выше стабильности циклирования чистого LiFePO4. При этом в выбранном для циклирования диапазоне
потенциалов происходит неполное окисление марганца и, соответственно, только
часть ионов марганца принимает участие в обратимом процессе, в результате чего
начальная удельная ёмкость разряда (126 мА·ч/г) для LiFe0.8Mn0.2PO4
оказывается несколько меньше соответствующей характеристики чистого LiFePO4 (153 мА·ч/г). В связи с этим материал, содержащий
0,05 моль марганца на 1 моль оливина, является оптимальным для системы с водным
электролитом, демонстрируя высокую ёмкость и приемлемую стабильность
циклирования.
2.5
Электрохимическое поведение LiFePO4, модифицированного SnO2 и WO3.
Для дальнейших исследований были синтезированы образцы LiFePO4, модифицированные оксидами олова(IV) и вольфрама(VI). Рентгенофазовым анализом было
установлено, что оба материала представляют собой фазово-чистый оливин (рисунок
2.3).
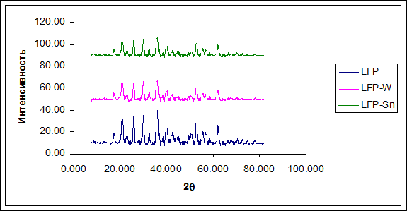
Рисунок 2.3 - Рентгенограммы чистого LiFePO4 и LiFePO4, модифицированного SnO2 и WO3
Гальваностатические тестирования показали, что модифицирование оливина
оксидом олова(IV) приводит к увеличению удельной
емкости и значительному улучшению стабильности циклировния (рисунки 2.4 а, 2.2)
по сравнению с недопированным материалом LiFePO4/C.
Так, образец фосфата железа-лития, модифицированный оксидом олова (IV), при тестировании в водном
электролите демонстрирует высокие удельные характеристики (разрядная ёмкость
147 мА∙ч/г при плотности тока 0.1C; 133 мА∙ч/г при 1C) (рисунок 2.4 б) и показывает чрезвычайную стабильность
ёмкости при циклировании как умеренными (0.1C-1C), так и большими
токами (5C-50C) (рисунок 2.4 а). Что нельзя сказать об образце, содержащем
оксид вольфрама(VI). Он
значительно теряет в емкости при циклировании токовой нагрузкой в 1С (рисунок
2.5 а)
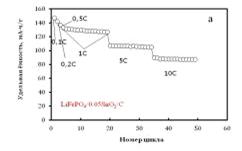

Рисунок 2.4 - (а) Зависимость удельной разрядной ёмкости LiFePO4/0.05SnO2/C от плотности тока (1C соответствует 170 мА∙ч/г) и
номера цикла; (б) Кривые гальваностатического заряда и разряда LiFePO4/0.05SnO2/C в 1M водном растворе LiNO3
Диапазон потенциалов от -0.5В до +0.8В vs. Ag|AgCl|KClнас. Температура 25°C.
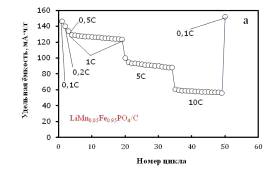
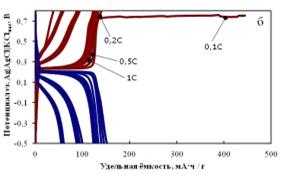
Рисунок 2.6 - (а) Зависимость удельной разрядной ёмкости LiMn0.05Fe0.95PO4 / C от плотности тока (1C соответствует 170 мА∙ч/г) и
номера цикла; (б) Кривые гальваностатического заряда и разряда LiMn0.05Fe0.95PO4/C в 1M водном растворе LiNO3.
Диапазон потенциалов от -0.5 В до +0.8 В vs. Ag AgCl KClнас. Температура 25°C
При сравнении электрохимического поведения марганец- и оловосодержащих
оливинов было замечено, что образец LiFePO4/0.05SnO2/C,
теряет в емкости 60 мАч/г (рисунок 2.4 а), а образец LiMn0.05Fe0.95PO4/C примерно 80 мАч/г (рисунок 2.6 а)
при увеличении токовой нагрузки до 10C. Это свидетельствует об улучшении стабильности циклирования материалов с
оксидом олова(IV) по сравнению с образцом, содержащим
0,05 моль Mn на формульную единицу оливина.
.6
Исследование электрохимического поведения LiFePO4/0.05SnO2/C методом циклической
вольтамперометрии
Для оценки коэффициента диффузии были сняты циклические вольтамперограммы
электрода (80:10:10) на основе LiFePO4/0.05SnO2/C при
разных скоростях развёртки потенциала, в диапазоне потенциалов от -0.5 до 0.8В
(рисунок 2.7). Характер изменения пикового тока с увеличением скорости
развёртки потенциала указывает на диффузионный контроль протекаемых процессов.
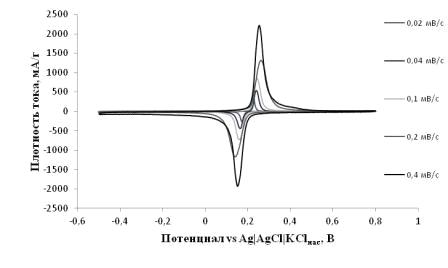
Рисунок 2.7 - Циклические вольтамперограммы образца LiFePO4/0.05SnO2/C, снятые при скоростях развёртки
потенциала 0,02-1 мВ/с в диапазоне потенциалов от -0.5 до 0.8В
Из угла наклона прямых в координатах ток пика - корень квадратный из
скорости развёртки потенциала, воспользовавшись уравнением Рэндлса-Шевчика,
можно оценить коэффициент диффузии ионов лития в объёме материала LiFePO4/0.05SnO2/C. В приближениях, что процессы
подчиняются Нернстовской зависимости, исходные состояния материала для всех
опытов одинаковы, площадь электрода равна видимой и составляет 1 см2,
начальная концентрация подвижных ионов лития (в случае анодного процесса) и
вакантных мест для ионов лития (в случае катодного процесса) в материале
составляет 0.0228 моль/см3 (значение получено с использованием
значения плотности 3.6 г/см3) и других, коэффициент диффузии
составит 2,8·10-15 м2/с и 5,6·10-15 м2/с
для катодного и анодного процессов соответственно.
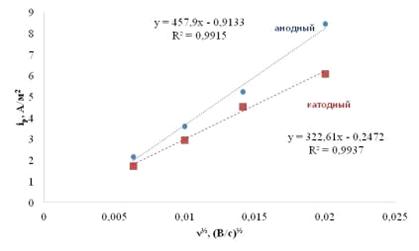
Рисунок 2.8 - Линейные зависимости тока анодного и катодного пиков от
квадратного корня из скорости развёртки потенциала
Анодный пик первого цикла отстранён от последующих по потенциалу и
отличен по форме. Возможно, это вызвано тем, что сначала граничная поверхность
материала с электролитом характеризуется высоким сопротивлением, ответственным
за затруднение перехода ионов лития из оливина в раствор. В результате первого
извлечения поверхностное сопротивление электрода сильно снижается, и создаются
благоприятные условия для перехода ионов лития из электролита в материал и
обратно. Катодный пик первого цикла существенно меньше по ширине и значение
тока для него по абсолютной величине больше, чем для анодного. На втором цикле
положение анодного пика смещается в область менее положительных потенциалов, и
оно сохраняется для последующих циклов. Потенциалы катодных пиков одинаковы для
всех циклов.
От цикла к циклу заметно снижается плотность тока пиков как для анодной,
так и для катодной ветвей, причем, для более высоких скоростей развертки
потенциала снижение более плавное. Можно сказать, что деградация материала
связана с пребыванием в растворе электролита при тестировании, вызывающим
изменение природы электрода.
Детальное изучение вольтамперограмм LiFePO4/0.05SnO2/C показало, что при маленьких
скоростях развертки потенциала (0.02 мВ/с) при потенциалах ниже -0.1 В vs. Ag AgCl KClнас. происходит побочный катодный
процесс, вероятно, восстановление воды с выделением водорода, отражающийся
заметным наклоном на участках катодной и анодной развёрток в соответствующей
области потенциалов (рисунок 2.9).
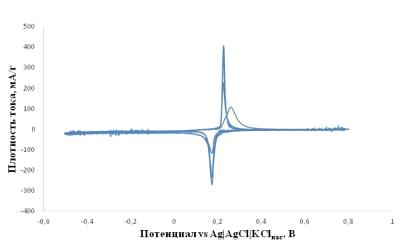
Рисунок 2.9 - Циклические вольтамперограммы электродов на основе LiFePO4/0.05SnO2/C в 1M водном растворе LiNO3
при скорости развертки потенциала 0.02 мВ/с. Диапазон потенциалов от -0,5 до
0,8В vs. Ag|AgCl|KClнас. Температура +25°C
Но при увеличении скорости развертки до 0.04 мв/с и выше (рисунок
2.10-2.12), проявление этого побочного процесса на циклических
вольтамперограммах становится менее заметным. Следовательно, можно
предположить, что побочный катодный процесс, происходящий при длительном пребывании
электрода в состояниях, соответствующих потенциалам ниже определённого
значения, является медленным.
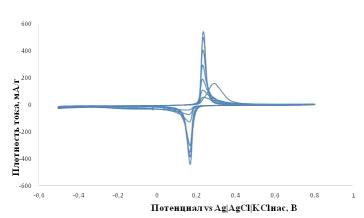
Рисунок 2.10 - Циклические вольтамперограммы электродов на основе LiFePO4/0.05SnO2/C в 1M водном растворе LiNO3
при скорости развертки потенциала 0.04 мВ/с. Диапазон потенциалов от -0,5 до
0,8В vs. Ag|AgCl|KClнас. Температура +25°C
Рисунок 2.11 - Циклические вольтамперограммы электродов на основе LiFePO4/0.05SnO2/C в 1M водном растворе LiNO3
при скорости развертки потенциала 0.2 мВ/с. Диапазон потенциалов от -0,5 до 0,8
В vs. Ag AgCl KClнас. Температура +25°C
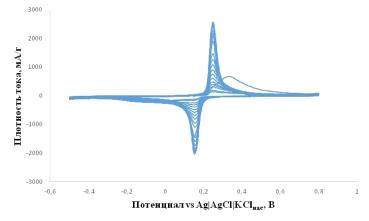
Рисунок 2.12 - Циклические вольтамперограммы электродов на основе LiFePO4/0.05SnO2/C в 1M водном растворе LiNO3
при скорости развертки потенциала 0.4 мВ/с. Диапазон потенциалов от -0,5 до 0,8
В vs. Ag AgCl KClнас. Температура +25°C
Было интересным узнать, какие процессы, химические или электрохимические,
влияют электрохимические характеристики материала в водном электролите. Для
этого один электрод был выдержан в электролите в атмосфере аргона в течение
двух недель, а затем протестирован в тех же условиях, что и предыдущие образцы,
при скорости развертки потенциала 0.2 мВ/с. Можно было бы предположить, что в
водном электролите с материалом происходят какие-то химические процессы,
например, гидролиз.
Но из зависимости тока пика от номера цикла (рисунок 2.13 а, б) видно,
что характеристики материалов, протестированных без и с двухнедельной выдержкой,
мало отличаются друг от друга.
ледовательно, на степень деградации материала оказывает влияние не
химическое взаимодействие материала с водой, а конкурирующий основному
электрохимический процесс, протекающий при циклировании электрода, или
химический, условия для протекания которого создаются только при определённых
потенциалах.
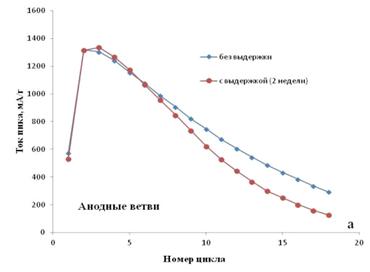

Рисунок 2.13 - Зависимость тока пика от номера цикла для образцов
без и с предварительной (2 недели) выдержкой в электролите перед началом
испытаний. Скорость развертки потенциала 0.2 мВ/с. Диапазон потенциалов от -0,5
до 0,8 В vs. Ag AgCl KClнас. Температура +25°C
.7
Электрохимическое поведение фосфата лития-титана в системе с водным
электролитом
В результате достаточно продолжительных работ был найден катодный
материал, обладающий оптимальными характеристиками для работы в водной системе
литий-ионного аккумулятора. В связи с этим необходимо было найти подходящий
анодный материал. С этой целью был синтезирован LiTi2(PO4)3, выбранный на основе
анализа литературных данных, путем термообработки смеси исходных веществ,
активированной в течение 20 минут в среде ацетона. В общей сложности
термообработка велась в течение 14 часов. Зарядные и разрядные кривые образцов
характеризуются наличием плато около -0.75В, что соответствует двухфазному
внедрению или извлечению ионов лития (рисунок 2.14 б). Гальваностатическое
циклирование показало, что материал обладает небольшой удельной емкостью (79 мА∙ч/г
при 0.5С, при теоретически возможной 138 мА∙ч/г), но динамика емкости
образцов показывает, что образец деградирует при циклировании (20 циклов) с
умеренной потерей емкости (~ 34 мА∙ч/г) (рисунок 2.14 а). При этом
соотношение анодной и катодной емкостей сохраняется примерно одинаковым, и
емкость частично воспроизводится от цикла к циклу. Из этого можно предположить,
что основной электрохимическийй процесс обратим, но отношение зарядной и
разрядной емкостей (рисунок 2.14 б) гораздо меньше единицы, что говорит о
наличии необратимых побочных процессов на катодном полуцикле.
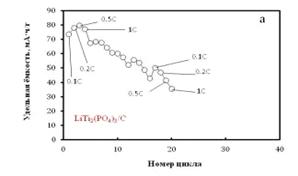

Рисунок 2.14 - (а) Зависимость удельной разрядной ёмкости LiTi2(PO4)3 /C от плотности тока (1C соответствует 138 мА∙ч/г) и
номера цикла; (б) Кривые гальваностатического заряда и разряда LiTi2(PO4)3/C в 1M водном растворе Li2SO4. Диапазон потенциалов от -0.9В до
-0.001В vs. Ag AgClKClнас. Температура 30°C
На настоящий момент данные характеристики не являются приемлемыми, но
принципиальная работоспособность данного материала доказана. Для улучшения
электрохимического поведения LiTi2(PO4)3 в водном электролите можно
усовершенствовать методику синтеза, допировать материал, произвести модификацию
поверхности и это будет являться целью дальнейших исследований.
3.
ИНСТРУКЦИЯ ПО ОХРАНЕ ТРУДА И ТЕХНИКЕ БЕЗОПАСНОСТИ
Работа с электроприборами
Во избежание травм и несчастных случаев при работе с приборами,
находящимися под током, и их включении в сеть необходимо соблюдать определенные
правила.
Запрещается использовать для подключения электроприборов провода с
поврежденной изоляцией или вообще без изоляции, а также провода, не снабженные
штекерами или припаянными клеммами. Нельзя подключать электроприборы к клеммам,
с которых не снято напряжение, и устранять неисправности в приборах,
находящихся под током. Запрещается вскрывать электроплитки и магнитные
пускатели, находящиеся на лабораторных столах. В учебных лабораториях
разрешается использовать электроприборы только заводского производства. Приборы
должны содержаться в чистоте.
Следует заземлять все металлические части электроприборов; при нарушении
изоляции они могут оказаться под током (замыкание «на корпус»).
Во всех случаях, когда возникает возможность поражения электрическим
током, необходимо использовать изолирующие средства: резиновые перчатки,
резиновые коврики, инструмент с изолированными каучуком рукоятками. В тех
случаях, когда возможно образование сильных электрических искр, следует
пользоваться темными защитными очками.
Для проверки наличия напряжения на отдельных участках цепи используют
переносные указатели напряжения.
По окончании рабочего дня надо снять напряжение с отдельных приборов, а
также отключить все щитки на лабораторных столах и общий рубильник за пределами
лаборатории.
Работа с огнеопасными и легко воспламеняющимися жидкостями
К легковоспламеняющимся жидкостями (ЛВЖ) относятся горючие жидкости с
температурой вспышки 61oС и ниже в закрытом сосуде или 65oС
и ниже в открытом сосуде.
При работе с ЛВЖ необходимо соблюдать следующие правила. ЛВЖ и горючие
жидкости должны храниться в лабораторном помещении в толстостенных склянках с
притёртыми пробками. Общий запас, одновременно хранящихся в лабораторном
помещении огнеопасных жидкостей не должен превышать суточной потребности, но не
более одного литра на сотрудника. Запрещается хранить ЛВЖ в вытяжных шкафах, в
которых проводятся работы с использованием нагревательных приборов и
окислителей. Запрещается отгонять эфир и другие ЛВЖ на пламени газовой горелки
или на плите с открытой спиралью. Перегонять и нагревать ЛВЖ следует в
круглодонных колбах из термостойкого стекла, банях, заполненных соответствующим
теплоносителем (вода, глицерин, силиконовое масло). По окончании работы
запрещается выливать ЛВЖ в канализацию, их следует собирать в специальную,
герметически закрывающуюся тару.
Работа с концентрированными кислотами и щелочами
Концентрированные кислоты и щелочи относятся к веществам, вызывающим
химические ожоги при попадании на кожу и слизистые оболочки. Поэтому работать с
этими веществами необходимо только в вытяжном шкафу с использованием средств
индивидуальной защиты (очки и резиновые перчатки).
При химических ожогах пораженное место промывают струей воды из-под крана
в течение длительного времени - не менее 15 мин. Далее при ожогах кислотами и
кислотоподобными прижигающими веществами накладывают примочки 2%-м раствором
бикарбоната натрия, а при ожогах щелочами - 2%-м раствором борной, уксусной,
лимонной или виннокаменной кислот.
При попадании агрессивных веществ в глаза необходимо немедленное
промывание глаз водой с помощью душа или водяного фонтанчика в течение 10-15
мин. Веки пораженного глаза во время промывания должны быть раздвинуты. В
случае попадания в глаза кислоты после промывания водой продолжают промывание
2%-м раствором бикарбоната натрия. При резких болях закапывают 1-2 капли 1%-го
раствора новокаина. Особенно опасны поражения глаз щелочами. После удаления
большей части щелочи с помощью струи воды в течение 5-10 мин продолжают
промывать глаза изотоническим раствором хлорида натрия еще 30-60 мин. После
тщательного промывания глаз следует немедленно обратиться к врачу, даже если
возникло субъективное ощущение, что ожог не опасен.
Работа с газовыми баллонами
Баллоны со сжатыми, сжиженными или растворенными газами требуют соблюдения
особых мер безопасности при их хранении и эксплуатации. Эти меры необходимо
соблюдать во избежание утечки газа через неплотные соединения и образования
взрывоопасных смесей с воздухом; тепловых воздействий на баллон; механических
ударов, способных повредить стенки сосуда.
Для хранения газов применяют баллоны, имеющую определённую
опознавательную окраску. Не допускается совместное хранение баллонов с
кислородом и горючими газами, так как это связано с возможностью образования
взрывоопасных смесей. Баллоны с ядовитыми газами хранят в специальных закрытых
помещениях. Хранение газовых баллонов производится исключительно в вертикальном
положении.
В процессе эксплуатации баллонов со сжатыми газами необходимо выполнять
следующие правила. На баллон в нерабочем состоянии должен быть всегда навинчен
колпак. Передвигать баллон следует осторожно, так как толчки и падение могут
привести к взрыву. При перекатывании кислородных баллонов вручную нельзя
браться руками за вентиль. Баллоны помещают в специальные стойки или крепят к
стене с помощью ремней. Запрещается помещать баллоны в местах, где они могут
нагреваться - от нагревательных приборов баллоны должны быть удалены не менее
чем на 1м.
При работе с баллонами сначала открывают редуктор, затем регулировочный
винт. Для каждого баллона должен быть свой редуктор. Категорически запрещается
смазывать вентили любым жиром или маслом. Расходуя газ, никогда не следует
снижать его давление в баллоне до атмосферного.
Баллоны необходимо периодически испытывать на давление на заводе-производителе.
Запрещается работать с неисправными баллонами или баллонами, которые не
проверялись в течение длительного времени. Запрещается исправлять вентиль
баллона собственными средствами.
ВЫВОДЫ
1. Проведён литературный обзор по электродным материалам, способным
приемлемо работать в литий-ионных аккумуляторах с водным электролитом.
2. Определено оптимальное содержание марганца в синтезированных
ранее материалах на основе оливина LiFePO4.
Электродному материалу LiMn0,05Fe0,95PO4 соответствует высокая удельная ёмкость разряда при
0,1C (160 мА·ч/г), работоспособность при
больших токовых нагрузках (при 10C - 96
мА·ч/г), чрезвычайная стабильность при циклировании.
. Установлено, что вновь синтезированный электродный материал, LiFePO4/0.05SnO2, отличается
большей работоспособностью и стабильностью при циклировании относительно как
чистого, так и марганецсодержащего образца. Электродный материал LiFePO4/0.05WO3 характеризуется пониженными
электрохимическими и эксплуатационными показателями.
. По данным циклической вольтамперометрии, проведённой в водном
электролите, с использованием уравнения Рэндлса-Шевчика получена оценка
коэффициента диффузии ионов лития в материале LiFePO4/0.05SnO2. Для
катодного и анодного процессов коэффициент диффузии составил 2,8·10-15 м2/с
и 5,6·10-15 м2/с соответственно.
. Установлено, что на характеристики материала LiFePO4/0.05SnO2 не
оказывают влияние химические процессы, возможные при контакте материала с
электролитом без изменения электродного потенциала извне.
. Синтезирован анодный материал, LiTi2(PO4)3, способный относительно
стабильно работать в литий-ионной системе с водным электролитом.
СПИСОК ЛИТЕРАТУРЫ
1.
Li W., Mckinnon W.R., Dahn J.R. Lithium Intercalation from Aqueous Solutions //
Journal of the Electrochemical Society, 1994. Vol.141. P.
2310-2316.
2.
Mckinnon W.R., Hearing R.R. Physical Mechanisms of Intercalation // White R.E.,
Bockris J.O’M., Conway B.E. (eds). Modern aspects of electrochemistry. No.15.
// New York: Plenum press, 1983. P.235-304.
.
Lee J.-W, Pyun S.-I1., Investigation of lithium transport through LiMn2O4
film-electrode in aqueous LiNO3 solution // Electrochimica Acta,
Vol.49, 2004. P. 753-761
.
Nakayama N., Nozaw T., Iriyama Y., Abe T., Ogumi Z., Kikuchi K., Interfacial
lithium-ion transfer at the LiMn2O4 thin
film-electrode/aqueous solution interface // Journal Power Sources, Vol. 174,
2007. P. 695-700
.
Bruce P.G., Saidi M.Y., The Mechanism of Electrointercalation // Journal of
Electroanalytical Chemistry, Vol. 322,1992. P. 93-105
.
Manjunatha H., Suresh G.S., Venkatesha T.V., Electrode materials for aqueous
rechargeable lithium batteries // Journal of Solid State Electrochemistry,
Vol.15, 2011. P.431-445
.
Kim H., Hong J., Park K.-Y., Kim H., Kim S.-W., Kang K., Aqueous rechargeable
Li and Na ion batteries // Chemical reviews, Vol.114,2014. P. 11788 - 11827
.
Wang Y.-g., Xia Y.-y., Hybrid aqueous energy storage cells using activated
carbon and lithium - intercalated compounds: I. The C/ LiMn2O4
system //Journal of the Electrochemical Society, Vol. 153, 2006.P. A450 - A454
.
Jayalakshmi M., Mohan R.,M., Scholz F., Electrochemical behavior of solid
lithium manganate (LiMn2O4) in aqueous neutral
electrolyte solutions // Langmuir, Vol. 19, 2003. P. 8403-8408
.
Tian L., Yuan A.J., Electrochemical performance of nanostructured spinel LiMn2O4
in different aqueous electrolytes // Journal Power Sources, Vol. 192, 2009. P.
693-697
.
Yuan, A.; Tian, L.; Xu, W.; Wang, Y. Al-doped spinel LiAl0.1Mn1.9O4
with improved high-rate cyclability in aqueous electrolyte // Journal Power
Sources, Vol. 195, 2010. P. 5032-5038
.
Stojković I.B., Cvjetićanin N.D., Mentus S.V.,
The improvement of the Li-ion insertion behaviour of Li1.05Cr0.10Mn1.85O4
in an aqueous medium upon addition of vinylene carbonate // Electrochemistry
Communications, Vol.12, 2010. P. 371-373
.
Deutscher R.L., Florence T.M., Woods R.J., Investigations on an aqueous lithium
secondary cell // Journal Power Sources, Vol. 55, 1995. P. 41-46
.
Yuan A., Zhang Q., A novel hybrid manganese dioxide/activated carbon
supercapacitor using lithium hydroxide electrolyte // Electrochemistry
Communications, Vol.8, 2006. P. 1173-1178
.
Qu Q., Zhang P., Wang B., Chen Y., Tian S., Wu Y., Holze R., Electrochemical
Performance of MnO2 Nanorods in Neutral Aqueous Electrolytes as a
Cathode for Asymmetric Supercapacitors // The Joulnal of Physical Chememistry
C, Vol. 113, 2009. P. 14020-14027
.
Ruffo R., Wessells C., Huggins R.A., Cui Y., Electrochemical behavior of LiCoO2
as aqueous lithium-ion battery electrodes // Electrochemistry Communications,
Vol.11, 2009. P. 247-249
.
Tang W., Liu L. L., Tian S., Li L., Yue Y. B., Wu Y. P., Guan S. Y., Zhu K.,
Nano-LiCoO2 as cathode material of large capacity and high rate
capability for aqueous rechargeable lithium batteries // Electrochemistry
Communications, Vol.12, 2010. P. 1524 - 1526
.
Wang Y.-g., Luo J.-y., Wang C.-x., Xia Y.-y., Hybrid Aqueous Energy Storage
Cells Using Activated Carbon and Lithium-Ion Intercalated Compounds: II.
Comparison of LiMn2O4 , LiCo1/3Ni1/3Mn1/3O2
, and LiCoO2 Positive Electrodes // Journal of the Electrochemical
Society, Vol. 153, 2006. P. A1425-A1431
.
Shivashankaraiah R.B., Manjunatha H., Mahesh K.C., Suresh G.S., Venkatesha
T.V., Electrochemical characterization of polypyrrole-LiNi1/3 Mn1/3
Co1/3 O2 composite cathode material for aqueous
rechargeable lithium batteries // Journal of Solid State Electrochemistry,
Vol.16, 2012. P. 1279 - 1290
.
Wang F., Xiao S., Chang Z., Yang Y., Wu Y., Nanoporous LiNi1/3Co1/3Mn1/3O2
as an ultra-fast charge cathode material for aqueous rechargeable lithium
batteries // Chemical Communications, Vol. 49, 2013. P. 9209 - 9211
.
Manickam M.; Singh P., Thurgate S., Prince K.J., Nanoporous LiNi1/3Co1/3Mn1/3O2
as an ultra-fast charge cathode material for aqueous rechargeable lithium
batteries // Journal Power Sources, Vol. 158, 2006. P. 646-649
.
He P., Liu J.-L., Cui W.-J., Luo J.-Y., Xia Y.-Y., Investigation on capacity
fading of LiFePO4 in aqueous electrolyte // Electrochimica Acta,
Vol. 56, 2011. P. 2351-2357.
.
Minakshi M., Lithium intercalation into amorphous FePO4 cathode in
aqueous solutions // Electrochimica Acta, Vol. 55, 2010. P. 9174-9178
.
Minakshi M., Singh P., Thurgate S., Prince K., Electrochemical Behavior of
Olivine-Type LiMnPO4 in Aqueous Solutions // Electrochemical and
Solid-State Letters, Vol. 9, 2006. P. A471-A474
.
Manjunatha H., Venkatesha T. V., Suresh G. S., Electrochemical studies of
LiMnPO4 as aqueous rechargeable lithium-ion battery electrode //
Journal of Solid State Electrochemistry, Vol.16, 2012. P. 1941 - 1952
.
Zhang M., Dahn J.R., Electrochemical Lithium Intercalation in VO 2 ( B )
in Aqueous Electrolytes // Journal of the Electrochemical Society, Vol.143,
1996. P. 2730-2735
.
Wang F., Liu Y., Liu C.-y., Hydrothermal synthesis of carbon/vanadium dioxide
core-shell microspheres with good cycling performance in both organic and
aqueous electrolytes // Electrochimica Acta, Vol. 55,2010. P. 2662-2666
.
Wu C., Hu, Z.; Wang W., Zhang M., Yang J., Xie Y., Synthetic paramontroseite VO2
with good aqueous lithium-ion battery performance // Chemical Communications,
Vol. 33, 2008. P. 3891-3893
.
Cheng C., Li Z.H., Zhan X.Y., Xiao Q.Z., Lei G.T., Zhou X.D., A macaroni-like
Li1.2V3O8 nanomaterial with high capacity for
aqueous rechargeable lithium batteries// Electrochimica Acta, Vol. 55, 2010. P.
4627-4631
.
Wang H., Huang K., Zeng Y., Zhao F., Chen L., Stabilizing Cyclability of an
Aqueous Lithium-Ion Battery LiNi1 ∕ 3Mn1 ∕ 3Co1 ∕ 3O2 ∕ Li
x V2O5 by Polyaniline Coating on the
Anode // Electrochemical and Solid-State Letters, Vol. 10, 2007. P. A199-A203
.
Li W., Dahn J.R., Lithium‐Ion Cells with Aqueous
Electrolytes // Journal of the Electrochemical Society, Vol. 142, 1995. P. 1742-1746
.
Sun K., Juarez D.A., Huang H., Jung E., Dillon S.J. Aqueous lithium ion
batteries on paper substrates // J. Power Sources, 2014. Vol.248. P. 582-587.
34. Карякин
Ю.В., Ангелов И. И. Чистые химические вещества. Изд. 4-е. М.: Химия, 1974. 408
с.
. Брауэр Г.
Руководство по неорганическому синтезу в 6 т: Пер. с нем., том 5. М.: Мир,
1985. С. 1668-1669.
. Галюс З.
Теоретические основы электрохимического анализа: Пер. с польск. Каплан Б.Я./
Под ред. И. В. Селищевой. - М.: Мир, 1974. 552 с.