Синтез изонитрильных комплексов палладия
Оглавление
Вступление
. Литературный обзор
.1 Характеристика
изонитрильного лиганда
.1.1 Структура и общие свойства
.1.2 Характер связи с металлом
.1.3 Структура изонитрильных
комплексов Pd
1.2 Cинтез
изонитрильных комплексов
.2.1 Обзор статей по синтезу изонитрильных
Pd комплексов
. Практическая часть
Заключение
Литература
Вступление
В настоящее время изонитрильные комплексы
переходных металлов находят широкое применение в химии. Так, они служат
исходными реагентами для синтеза гетероциклических соединений1,
могут входить в состав полимеров с ценными техническими характеристиками2
и выступать в качестве стабилизаторов наночастиц3. Однако наиболее
широко изонитрилы применяются в металлоорганической химии, входя в состав
катализаторов.
Сейчас активно изучаются каталитические
органические реакции с участием комплексов переходных металлов, в частности,
палладия. Так, в 2010 году Нобелевская премия по химии была присуждена Р. Хеку,
А. Сузуки и Ниямуре за разработку методик палладиевого катализа в реакциях кросс-сочетания.
Реакции кросс-сочетания (см. реакцию Соногаширы в качестве примера на схеме 1),
позволяют точно (с минимумом побочных продуктов) сочетать крупные части
органических молекул с образованием новой углерод-углеродной связи.
изонитрильный лиганда
палладий катализ
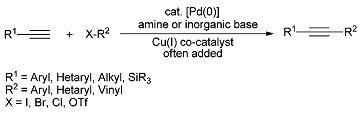
Они имеют значительную препаративную ценность
как удобный способ получения макромолекул, обладающих высокой биологической
активностью4. Поэтому изучение их механизма, равно как и
каталитической роли соединений палладия в них является актуальной задачей.
Перспективными остаются не только исследования
по изучению влияния структуры уже существующих катализаторов на скорость
протекания реакции, но и исследования по поиску новых катализаторов с более
высокой каталитической активностью и большей устойчивостью в условиях реакции,
а также способствующих проведению стереоселективных синтезов.
Исторически первыми в качестве лигандов в
палладиевых комплексах использовались фосфины. Однако фосфиновые комплексы
палладия токсичны, обладают во многих реакциях недостаточной активностью и
низкой стабильностью, что вынуждает проводить реакции в инертной атмосфере. В
связи с расширением круга возможных субстратов остро стоит проблема создания
активных и стабильных катализаторов на основе палладия. Сравнительно недавно, в
2000 годах, было предложено5 использовать циклические(a)
и ациклические(b)
диаминокарбеновые комплексы палладия в качестве альтернативы фосфиновым для
катализа реакций кросс-сочетания (Сузуки и Соногаширы).
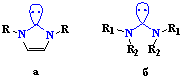
Преимущества диаминокарбенов как лигандов
заключаются в образуемой ими более прочной связи металл-лиганд ввиду более
сильныx σ-донорныx
свойств по сравнению с фосфинами. Также диаминокарбеновые комплексы являются
более устойчивыми к окислению и более стабильными по отношению к природе
растворителя и основания. Однако используемые на сегодняшний день методы
синтеза этих комплексов являются многостадийными и трудоемкими, поскольку
основываются на предварительном получении диаминокарбенового лиганда с
последующим введением его в координационную сферу металлокомплекса, что
ограничивает структурную вариабельность комплексов.
Существует и другой более удобный метод синтеза
диаминокарбеновых комплексов палладия, заключающийся в действии на уже
скоординированную изонитрильную группу N-нуклеофилом
с образованием продукта присоединения - диаминокарбенового лиганда.
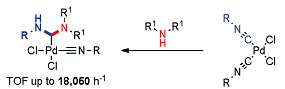
Этот метод более удобен и эффективен за счет
сокращения числа стадий, однако требует изонитрильные комплексы палладия в
качестве субстрата. В свете этого получение изонитрильных комплексов палладия и
изучение реакций их превращения в диаминокарбены представляется актуальной
задачей.
Целью
настоящей работы является синтез бис-изонитрильных комплексов палладия.
Для достижения поставленной цели автор ставит
перед собой следующие задачи:
. Изучить литературу по строению и химической
активности изонитрильных комплексов переходных металлов с упором на соединения
палладия.
. Синтезировать бис-изонитрильные комплексы
дихлорида и дийодида палладия.
В работе автор использует следующие методы:
. Критический анализ литературы по
избранной теме.
. Синтез искомых соединений.
. Физико-химический анализ комплексов
1. Литературный обзор
1.1 Характеристика
изонитрильного лиганда
1.1.1
Структура и общие свойства
Изонитрилы (изоцианиды) относятся к
немногочисленным лигандам, имеющим неподеленную электронную пару на атоме
углерода. Изонитрильная группа во многом схожа с карбонильной и представляет
собой биполярную структуру с тройной связью углерод-азот (рисунок 1, R=alkyl).
В рамках метода валентных связей координированную на металле изонитрильную
функцию можно рассматривать как резонансный гибрид двух структур (рис 3). В
комплексах изонитрильный лиганд считается нейтральным.
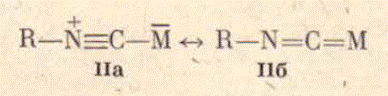
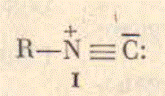
Из-за наличия свободной пары электронов на атоме
углерода, который является формально двухвалентным, изонитрильные лиганды
обладают сильными σ-донорными
свойствами, а их способность принимать d-электроны
металла на свои свободные разрыхляющие π*
орбитали свидетельствует о том, что они являются также π-акцепторами.
Это проявляется в образовании устойчивых комплексов нульвалентных металлов.
Однако по сравнению с монооксидом углерода изонитрилы имеют повышенную
тенденцию к образованию комплексов с переходными металлами в степени окисления
+1,+2 и выше. Для металлов в отрицательной степени окисления более характерно
образование карбонилов. Подобно карбонильной группе, изонитрилы тоже способны
образовывать мостики между 2 атомами металла в комплексе.
Проведенные магнитные исследования говорят о
том, что изонитрилы являются лигандами сильного поля. Изонитрильные
комплексы металлов с четным числом электронов диамагнитны (например, Pd(CNR)2),
а с нечетным числом-парамагнитны и имеют низкоспиновую конфигурацию (CoX2(CNR)4).
.1.2 Характер
связи металл-изонитрил
Длины связей, определяемые рентгеноструктурным
анализом, дают важную информацию о характере связи металл-изонитрил. Отмечают
заметное обратное π-дативное
взаимодействие металл-лиганд в изонитрильных комплексах, что было показано7
на примере комплекса кобальта [Co(CNCH3)5]+СlO4-
(1): длина Сo-C
(1,81 A) значительно
короче ожидаемой (не меньше 2 A).
В комплексе MnBr(CO)3(CNCH3)2
также наблюдается аналогичное укорачивание связи Mn-CNCH3
(на 0,10-0,14A), несмотря на
наличие более сильного карбонильного акцептора. Длина связи Mo-C
в Mo(CN)4(CNСH3)4,9
больше по сравнению с [MoI(CNBu-t)6]+
8 что свидетельствует об ослаблении обратной π-дативной
связи при повышении степени окисления атома металла.
Молекула изонитрила в комплексах обычно
практически линейна. Так, в комплексе (1) угол С≡N-R
составляет 177 гр. Линейность изонитрильного лиганда доказана и на примере
непосредственно комплекса палладия транс-PdI2(CNRtBu)2.10
Однако имеются сообщения о нелинейных изонитрильных группах. Так, в комплексе
железа [С5H5FeCO]2(CO)(CNC6H5)
с мостиковым изонитрильным лигандом изонитрильная группа изогнута под углом 131
гр.11
Из других важных характеристик изонитрильного
лиганда стоит отметить трансвлияние изонитрильного лиганда. Например, в
смешанном изонитрилфосфиновом комплексе cis-[PtCl2(CNEt)(PEt2Ph)]12
длина связи Pt-Cl
(транс к CNEt)
равна 2,314 А, а длина связи Pt-Cl
(транс к P) 2,390 A.Это
указывает на более слабое трансвлияние изонитрильного лиганда по сравнению с
третичным фосфином, сравнимое с трансвлиянием карбонила и хлора.
ИК-спектроскопия, заключающаяся в измерении
частот валентных колебаний NC-группы,
также дает важную информацию о вкладе дативной и донорно-акцепторной компоненты
в связь металл-изонитрил. Полоса поглощения NC
при координации изонитрила с металлом сдвигается по сравнению с полосой
поглощения свободного изонитрила (2000-2200 см-1), причем как в
сторону увеличения частоты, так и в сторону уменьшения в зависимости от
строения комплекса. Повышение частоты свидетельствует об отсутствии или очень
малом вкладе π-дативной связи
металл-лиганд, понижение же говорит о ее значительной роли. Направление сдвига
и его величина определяется валентным состоянием металла, количеством
координированных молекул изонитрила, наличием и характером других связанных с
металлом лигандов и т.д. Роль перечисленных факторов сводится к изменению
вклада структур на рисунке 3 в электронную структуру изонитрила при координации
с металлом.
В катионных комплексах переходных
металлов частота колебания NC
обычно выше, чем в свободном изонитриле, что объясняется слабой обратной π-дативной
связью из-за недостатка электронов на атоме металла, что ведет к повышению
порядка связи M-CNR
(структура (3a)). Так, тетраксис-изонитрильные
комплексы двухвалентных никеля, палладия и платины имеют полосу поглощения NC-
группы в районе 2300 см-1. Повышенным значением частоты также
характеризуются пероксокомплексы никеля и палладия M(O2)(CNR)2.
Однако в изонитрильных комплексах нульвалентных
металлов наблюдается понижение частоты вследствие усиления подачи d-электронов
металла на разрыхляющие орбитали лиганда. Так, в комплексах никеля и хрома Ni(CNR)4
и Cr(CNR)6
наблюдается значительное понижение υNC
(до 100 см-1)13.
С увеличением степени окисления центрального
атома возможности для обратной подачи электронной плотности на лиганд
уменьшаются, в соответствие с этим повышается порядок связи С-N
и частота валентных колебаний изоцианогруппы. Так, ∆υNC
для комплекса одновалентного марганца [Mn(CNR)6]I
составляет -(12-40) cм-1(даже
ниже, чем в свободном изонитриле), тогда как для комплекса Mn(2)
[Mn(CNR)6][CdBr4]
величина ∆υNC
повышается
примерно на 70 см-1 и является уже положительной14.
Частота повышается и при наличии во внутренней
сфере других π-акцепторных
лигандов (СO,PF3),конкурирующих
за обладание d-электронами
металла. Например, в комплексе Fe(CO)4CNC6H11
повышение частоты составляет 28 см-1, а в изонитрильном
комплексе фенилацетелинида золота-103 см-1. 15
Характер заместителей в других лигандах также
играет существенную роль. При изучении влияния различных заместителей в
бензольном кольце на примере комплекса AreneCr(CO)2CNC6H11
было выявлено16, что с введением электродонорного заместителя в
кольцо электронная плотность на металле возрастает, усиливается обратная подача
и понижается значение ∆υ. Введение
электроноакцепторных заместителей вызывает противоположный эффект.
Увеличение числа координированных с металлом
молекул изонитрила приводит к накоплению отрицательного заряда на металле
(донорный эффект), вследствие чего усиливается обратная подача электронной
плотности с металла на лиганд, что выражается в снижении частоты NC.
Так, в бис-изонитрильном комплексе серебра [Ag(CNR)2]+
частота повышена на 60 см-1 по сравнению со свободным изонитрилом14,
а в тетраксис-изонитрильном [Ag(CNR)4]+-всего
на 40 см-1.
Данные ЯМР-спектров подтверждают, что
вклад обратной π-дативной
связи в катионных комплексах незначителен. Результаты ЯМР на ядрах 14N
показывают, что роль обратной подачи возрастает при переходе от
карбонилизонитрильных комплексов к гомолигандным изонитрильным.
Многими авторами (например, Коттоном14)
проводились сравнения σ-донорных
и π-акцепторных
свойств
изонитрильных лигандов с другими лигандами. Доказано, что изонитрил является
более слабым π-акцептором по
сравнению с карбонильной, нитрозильной группой, но более сильным по отношению к
трифенилфосфиновой и цианидной17! Выяснено, что карбеновый
лиганд-более слабый σ-донор. Также
изонитрилы обладают сильным трансвлиянием, превосходящим карбонильную группу,
но уступающим фосфинам и фосфитам.
.1.3 Структура
изонитрильных комплексов Pd
Палладий и платина в
двухвалентном состоянии образуют чрезвычайно устойчивые комплексы типа MX2(CNR)2,
а также устойчивые тетраксис-изонитрильные [M(CNR)4]2+.
Cинтезированы
многочисленные смешанные комплексы типов MX2(CNR)L
и [MCl(CNR)L2]+,
cодержащие в
качестве лигандов L фосфины,
арсины, карбены. Остановимся подробнее на комплексах палладия. Комплексы
Pd(2) c
σ-связью
Pd-C
описываются общей формулой PdX(R")(CNR)2.
Получен смешанный π-аллилизонитрильный
комплекс палладия [PdСl(C3H5)CNR].
Нульвалентный Pd
образует устойчивые бис-изонитрильные комплексы Pd(CNR)2,
а также изонитрилфосфитные комплексы состава Pd(CNR)4-n[P(OR’)3]n
(n=1,2) и комплексы с
разнообразными лигандами (с O2,
TCNE-тетрацианэтиленом,
дифенилацетиленом и др.) c
общей формулой Pd(CNR)2L.
Известны биядерные комплексы одновалентного палладия [PdX(CNR)2]2.Рассмотрим
строение некоторых плоскоквадратных комплексов палладия. Белукко и соавторы18
(1) сообщают о структурных характеристиках синтезированных ими
комплексов типа Pd(RNC)(L)X2. Частота валентных колебаний v(NC) этих
соединений лежит в пределах 2248-2181 см-1, причем наблюдается понижение
частоты в следующем ряду R:
cyclohexyl>phenyl > p-nitrophenyl.
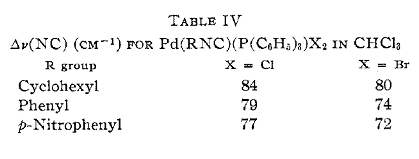
Это связано с понижением электрон-донорного
характера (или положительного индуктивного +I
эффекта) заместителя в данном ряду, что, повышает эффективность π-акцептирования
изонитрилом электронов металла и разрыхляет связь С-N.
Такое расположение заместителей в ряду подтверждает сильный транс-эффект
циклогексильного лиганда. Еще по данным, полученными Белукко (таблица 2), можно
заключить, что наиболее высокие значения ∆v(NC) характерны для
хлорпроизводных палладия.
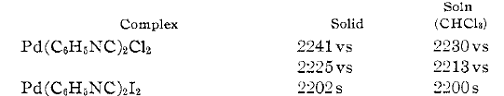
Это объясняется большей по сравнению с бромом и
йодом электроотрицательностью хлора, приводящей к принятию части электронной
плотности металла на себя и формированию эффективного положительного заряда на
атоме палладия, что затрудняет обратную связь металл-изонитрил и повышает
частоту колебаний.
Ямомото и Ямазаки19 (2) исследовали
димерные плоскоквадратные комплексы Pd(1),
такие как (PdX(CNR)2)2,
X=Cl,
I. Два фрагмента
димера соединяются за счет связи Pd-Pd,
а изонитрильный лиганд является терминальным, что было доказано по данным
инфракрасного спектра (С-N
колебания 2155 см-1). Было выяснено, что cвязь
Pd-Pd
в целом остается постоянной по длине (2,53 A)
при замене йода на хлор. Однако длина связи Pd-Cl
в комплексе (PdCl(CNtBu)2)2
(рисунок) составляет 2,403 и 2,416 А, что значительно больше, чем 2,300 и 2,302
в cis- PdCl2(CNtBu)2.
Угол С-Pd-Cl,
как и двугранный угол PdClC2,
близок к прямому (97,2 гр.), фрагмент Pd-Pd-Cl
практически линеен.
Группа Реттига и Кирка20 (3) получила
ионные биядерные комплексы Pd
с 6 изонитрильными группами в молекуле .
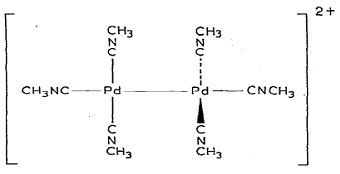
Инфракрасный спектр показал, что в соединении [Pd2(t-BuNC)6](PF6)2
отсутствуют мостиковые изонитрилы (частоты 2230-2260 см-1), а
длина связи Pd-Pd
составляет 2,531 A. Это
позволило предположить структуру, аналогичную ранее синтезированному
неустойчивому на воздухе метильному аналогу, изображенному на рисунке.
Структура сходного комплекса [Pd2(t-BuNC)6]X2
(X=Cl,
Br, I)
подтвердила терминальный характер изонитрильных лигандов и ионную природу
соединения (атомы X не входят во
внутреннюю сферу).
Диамагнитные биядерные комплексы с мостиковым
хлоридным лигандом [PdX(tert-BuNC)2]2
были изучены Otsuka
и Tatsuno21
(4). Низкая частота колебаний связи Pd-X
(X=Cl,Br,I)
подтвердила мостиковую структуру галоидных лигандов.
При обработке [PdI(CNtBu)2]2
трифенилфосфином в толуоле при -78 гр. С были получены оранжевые кристаллы
смешанного димерного комплекса [PdI(PPh3)(t-BuNC)]2
.
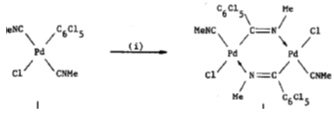
Известны и комплексы палладия с мостиковыми
изонитрильными лигнадами. Uson и Fornies в статье 22 (5) сообщают о
внедрении изоцианида в связь Pd-C6H5
в
комплексе Pd(C6H5)Cl(CNMe)2,
приводящее к образованию [Pd2{μ-C(C6Cl5):NMe}2X2(CNMe)2]
(X = Cl,
Br, I,
SCN) циклической
структуры ( i=бензол, вакуум).
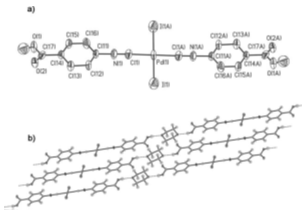
Имеется информация о синтезе бис-изонитрильных
комплексов с кислотными лигандами, способными образовывать аддукты с
растворителем посредством водородной связи. Silverio
Coco, Elisa
Espinet23 (6)
в своей статье описывают структуру trans-[PdI2(CNC6H4COOH)2]
(2), который в перспективе может выступать в роли жидкого кристалла (рентген a).
Выяснено, что каждый атом кислорода диоксана присоединяется посредством
водородной связи к карбоксильной группе металлокомплекса, в результате чего
получается полимерная структура (рисунок b).
Пример кристаллизации палладиевого комплекса с
растворителем-не единственный в литературе. Так, еще в 1981 году Китано и
Кайимото24 (7) сообщили о синтезе комплекса PdCl2(CNC6H11)2*C6H6
c характерной
частотой 700см-1, соответствующей протонам бензольного кольца (cм.
спектр).
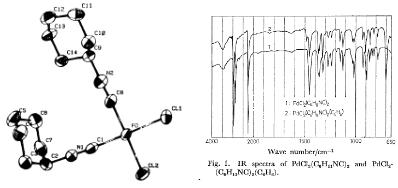
Рентгеноструктурный анализ PdCl2(CNC6H11)2
показал, что один изоцианидный лиганд занимает экватериальную позицию, а
другой-аксиальную позицию по отношению к несущим С-N
связям(см. рентген).
Подобная структура с различным расположением
кольцевых заместителей продемонстрирована Tosbihiro Fukushima и Yasuhiro
Yamamoto25 (8) на примере димерных мостиковых инденильных комплексов
Pd(1) Pd2(μ-In)2(CNR)2
(3a, R = tBu;
3b, R = 2,6-Me2C6H3;3c, R = 2,4,6-Me3C6H2;
3d, R = 2,4,6-tBu3C6H2) (см рентген для R=tBu).
В них два атома палладия симметрично связаны двумя инденильными лигандами в
син-расположении (см. рис). Угол Pd-Pd-CRNС составляет 153.0°, что
говорит о значительном отклонении от линейности. Длина связи Pd-Pd
(2.648(2) A) оказалась длиннее аналогичных димерных комплексов палладия с
немостиковыми лигандами (вероятно, из-за стерических помех объемных инденильных
лигандов). Из рассмотренных соединений был получен тетрамер Pd4(μ-OAc)4(μ-tBuNC)4*С6H6
кластерного типа.
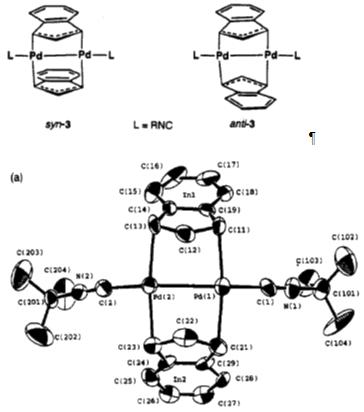
Синтезирован тримерный комплекс палладия [Pd3(CNXyl)6]26
(9). Ввиду крайне низкой устойчивости на воздухе рентгеноструктурный
анализ соединения провести не удалось.
Yuan
Han and
Han Vinh
Huynh27
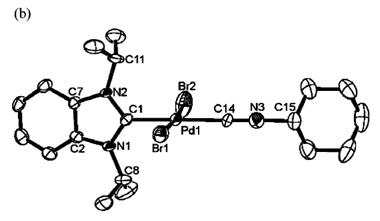
(10) исследовали структуру карбенизонитрильных комплексов палладия [PdBr2(iPr2-bimy)(CNR)]
(2a: R = Cy, на рисунке; 2b: R=nBu; 2c: R=Xy; iPr2-bimy
=1,3-diisopropylbenzimidazolin-2-ylidene). Данные вещества были подвергнуты
рентгеноструктурному анализу.2-а выкристаллизовалось в смеси цис-транс
изомеров, 2b-только
цис,2с-транс. Выяснилось, что плоскость карбеновых колец формируется почти перпендикулярно
плоскости PdC2Br2.
Связь Pd-CNR
в комплексе cis-2a
and cis-2b
составила 1.930(4) и 1.939(3) A˚
соответственно, что значительно короче аналогичной связи в trans-2a
[2.020(9) A˚ ] и trans-2c [2.000(2) A˚].Это говорит о сильном
трансвлиянии карбеновой группы. Длина С-N
в изонитриле во всех 3-х комплексах лежит в пределе 1.130-1.145 A˚, что
близко к значениям для тройной связи и свидетельствует о незначительном π-дативном
влиянии металла. Сам изонитрильный лиганд, как и ожидалось, практически линеен.
.2 Синтез
изонитрильных комплексов
К настоящему времени известно много методов
синтеза изонитрильных комплексов. Одним из самых старых способов получения
является реакция алкилирования цианидов металлов. Так получают
алкилизонитрильные комплексы серебра, железа, платины и других элементов 1,6 и
8 групп. Реакция часто используется в препаративных целях для синтеза свободных
изонитрилов.
Реакция алкилирования цианидов металлов
осуществляется чаще всего галоидными алкилами. Так, при взаимодействии цианида
серебра с алкилйодидом образуется изонитрильный комплекс28.
AgCN+RI=AgCN(CNR)+AgI
Отметим, что в качестве субстрата может
выступать и комплексный цианид. Например, дицианоаргентат калия реагирует с
алкилсульфатом калия, образуя комплекс AgCN(CNR)29
.
[Ag(CN)2]+ROSO3K=AgCN(CNR)+K2SO4
Известны случаев применения олефинов,
диметилсульфата, солей оксония и другиx
алкилирующиx агентов. Например,
алкилирование соединений Fe(2),
Fe(3) и рутения(2)30
проводится диазосоединениями жирного ряда, причем в роли субстрата выступают
свободные комплексные кислоты.
4[M(CN)6]+CH2N2=M(CN)2(CNCH3)4
Реакция алкилирования может быть обратимой31
.
Fe(CN)2(CNCH2Ph)4
[Fe(CN)(CNCH2Ph)5]Br
Имеются сообщения о возможности переалкилирования
получающихся по предыдущей схеме продуктов при введении в реакционную смесь
другого галоидного алкила32 .
[Fe(CN)(CNCH2Ph)5]Br+RBr
= [Fe(CN)(CNCH2Ph)5-n(CNR)n]Br
Наконец, алкилирование может сопровождаться
восстановлением металлокомплекса, что можно видеть на примере получения [Fe(CNCH3)6]2+
по реакции33 Ag3[Fe(CN)6]
c метилйодидом СH3I.
Таким образом, алкилирование цианидов металлов
широко применяется как способ получения изонитрилов. Преимущество метода
заключается в его сравнительной простоте и в отсутствии необходимости
предварительно синтезировать свободный изонитрил. К недостаткам метода
относится образование в ряде случаев смеси продуктов из-за протекания побочных
процессов, таких как восстановление и гидролиз.
Реакция изонитрилов с солями и рядом
других соединений также широко используется для синтеза изонитрильных
комплексов. Обычно реакция протекает по типу присоединения без изменения
валентности металла, однако очень часто она сопровождается восстановительными
процессами. Так, цианид Cu(1)
CuCN присоединяет
изонитрил, образуя34 CuCN(CNR)n
(n=2,3),
однако соли Cu(2) в
условиях реакции немедленно восстанавливаются арилизонитрилами в производные Cu(1).
При действии изонитрила на соединения металлов 6 группы в состоянии окисления
+2 и выше образуются комплексы нульвалентных металлов M(CNR)6.
Реакция восстановления протекает и при кипячении галогенидов трехвалентных
металлов (рутения, осмия, родия).Так, из RuCl3
получен RuCl2(CNR)4,
из Os(3)- комплексы Os(2),
из Rh(3)-Rh(1)
(E.g.[Rh(CNR)4]Cl).
Анион йода может выполнять роль восстановителя в
реакциях йодида металла с изонитрилом. Так35, при действии
изонитрила на йодид марганца (2) образуется йодид и трийодид гексасис-(изонитрил)
марганца (1).
2+RNC=[Mn(CNR)6]I+
[Mn(СNR)6]I3
Аналогично получаются комплексы одновалентного
рения.
Описаны случаи получения биядерных комплексов по
реакции изонитрилов с солями. Так, известен36 комплекс
трехвалентного железа (Fe2Cl4O(CNC2H5)n,
n=4,5), получающийся
при взаимодействии FeCl2
с этилизонитрилом в спирте в присутствии воздуха.
Однако изонитрильные комплексы не всех металлов
можно получить, исходя из их галогенидов. Комплексы иридия не удается
синтезировать исходя из его хлорида IrCl3,
поэтому в качестве субстрата используют гидрид. С солями двухвалентного никеля
изонитрилы реагируют очень энергично, образуя смесь плохо идентефицируемых
продуктов. В присутствии избытка изонитрила или постороннего восстановителя
(например, гидразина) продуктами реакции являются комплексы нульвалентного
никеля37.
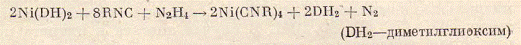
Остановимся подробнее на соединениях палладия и
платины ввиду близости их химических свойств. Соединения двухвалентных палладия
и платины реагируют с изонитрилом при обычных условиях без изменения степени
окисления.
Галогениды Pd(2)
легко реагируют с изонитрилами, образуя устойчивые аддукты PdX2(CNR)2.18
В случае хлоридов комплексы имеют cis-конфигурацию,
в случае йодида-trans.
Из Na2PdCl4
и
избытка MeNC в воде в
присутствии NH4PF6
получен Pd(CNMe)4(PF6)2.
38
Аналогичные бис-изонитрильные комплексы платины
синтезируют из щелочных солей тетрагалоидо-, тетранитро- и тетрацианоплатиновых
кислот по реакции39.
2(PtX4)+2RNC=PtX2(CNR)6+2MX
Эти комплексы существуют как в неионной (PtX2CNR2),
так и в ионной форме ([Pt(CNR)4][PtX4]).
При избытке изонитрила в реакционной смеси бис-изонитрильные комплексы
переходят в тетраксис-изонитрильные [Pt(CNR)4]Cl2.
Реакция димерныx хлоридных
комплексов Pt и Pd
с изонитрилами протекает с разрывом хлоридного мостика. Так, π-аллильный
комплекс Pd [PdCl(C3H5)]2
претерпевает расщепление с образованием PdCl(C3H5)CNR.
Одним из самых распространенных методов синтеза изонитрильных комплексов
является реакция обмена лигандов. Для введения изонитрила наиболее часто
используют замещение карбонильной группы, фосфинов, азотсодержащих лигандов,
органических лигандов. В реакциях такого типа чаще всего вытесняются лиганды,
не несущие заряд. Однако известны случаи замещения анионных лигандов. Так,
взаимодействие изонитрилов с комплексными цианидами никеля протекает с
замещением цианид-иона на изонитрил и приводит к распаду исходного комплекса до
нульвалентного комплекса никеля.41
K4[Ni(CN)4]+4RNC=Ni(CNR)4
При взаимодействии изонитрилов с карбонилами,
как правило, наблюдается лишь частичное замещение карбонильных групп. Это
объясняется упрочнением связи M-CO
за счет усиления обратной подачи при введении в комплекс изонитрила,
обладающего более слабым по сравнению с СO
акцепторными свойствами. Так, в гексакарбонилах Cr,
Mo, W
изонитрилом замещается от 1 до 3 карбонильных групп по механизму SN142.
Однако при обработки арилизонитрилом тетракарбонила никеля обычно наблюдается
полное замещение CO-групп
с образованием Ni(CNR)4.43
Бидентантные лиганды, например,
1,5-циклооктадиен, также способны замещаться изонитрилом 44.
8H12M(CO)4+2RNC
= M(CO)4(CNR)2
Известна реакция45
π-циклопентадиенильного
комплекса железа с трет-бутилизоцианатом, приводящая к образованию смеси
изонитрильных комплексов.
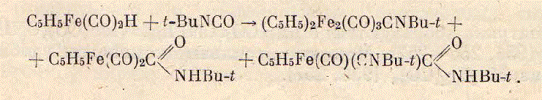
Стоит отметить, что в данной реакции
используется не изоцианид, а изоцианат-его кислородное производное.
При взаимодействии с изоцианидом моноядерные
комплексы могут переходить в биядерные и наоборот. Из карбонилгалогенидов
диродия Rh2Cl2(CO)4
получены46 тетраизонитрильные моноядерные ионные комплексы [Rh(CNR)4]+Сl-.
Взаимодействие изонитрилов с ϭ-производными марганца RMn(CO)5
протекает с замещением карбонильных и ϭ-связанных органических групп с
образованием Mn2(CO)8(CNR)2
или Mn2(CO)9(CNR).47
Получены оптически активные моноизонитрильные
комплексы С5H5FeI(CNC*HMePh)
из С5H5FeI(CO)2
и (+)-α-фенилэтилизонитрила,
разделенные на диастереоизомеры на основании различной растворимости48.
Замещение фосфина и других лигандов на
изонитрил используется в лабороторной практике гораздо реже по сравнению с
карбонильной группой. Так, примером реакции с фосфиновым лигандом может служить
взаимодействие ReI2(PPh3)2
c
пара-толилизонитрилом, сопровождающееся восстановлением Re(2)
до Re(1) и вытеснением
йода во внешнюю сферу комплекса49. Примечательно, что образуется
октаэдрический комплекс, содержащий 6 изонитрильных групп во внутренней сфере.
2(PPh3)2+
RN= [Rе(CNR)6]I
При действии на плоскоквадратный комплекс
платины L2PtX2
(X=Cl,
Br; L=PPh3,AsPh3,P(OPh)3)
метилизонитрила наряду с образованием продуктов присоединения и замещения
атомов галогена наблюдается также образование продуктов замещения
соответствующего лиганда (Ph3E)(MeNC)PtX2
и (MeNC)2PtX2
(E=P,
As)50. В
качестве других лигандов, замещаемых изонитрилом, могут выступать вода (СoX(DН)2(H2O),
DН-диметилглиоксим),
cпирт (MoCl2(NO)2(EtOH)2),
тетрагидрофуран ((С5H5)3U*THF)
и т.д.
Известны случаи замещения π-лигандов
изонитрилом. Так, π-С5H5
лиганды в никелоцене в мягких условиях замещаются на изонитрильные, при этом
образуются либо тетраизонитрильные Ni(CNR)4,
либо смешанные димерные [C5H5Ni(CNR)]2.
Аналогичный комплекс получен в результате вытеснения изонитрилом ацетилена из
его комплекса с никелоценом51 .
(C5H5Ni)2C2H2+
2C6H11NC = [C5H5Ni(CNC6H11)]2
1.2.1 Обзор статей по синтезу изонитрильных
комплексов Pd
Рассмотрим подходы к синтезу изонитрильных
комплексов палладия, обратившись к уже упоминавшимся в разделе "
Структура" статьям.
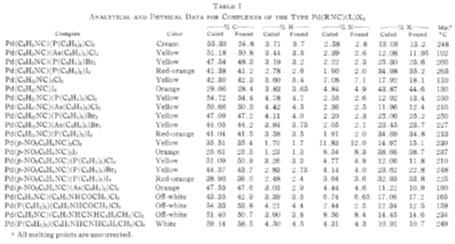
В статье (1) авторы сообщают о синтезе
разнообразных комплексов типа Pd(RNC)2X2 и Pd(RNC)(L)X2.
(X=Cl,
Br, R,
L-см таблицу).
Структура новых соединений была подтверждена элементным анализом.
Хлорпроизводные соединения были получены по
реакции замещения нитрильного лиганда в комплексе Pd(CH3CN)2Cl2
под действием стехиометрического количества изонитрила в хлороформе.
Получающийся продукт осаждается немедленно, и через 15 минут после начала
реакции приступают к очистке. Растворитель отгоняется под вакуумом, вещество
промывается эфиром. Выход составляет 50-60 %.
Cоединения типа
Pd(RNC)(L)X2 были получены из уже синтезированных соединений Pd(RNC)2X2
обработкой их P(C6H5)3
или As(C6H5)3
в минимальном количестве эфира. Осажденное и промытое несколько раз эфиром
вещество дальнейшей очистки не требует. Выход продукта 70-80 %.
Рассмотрим получение комплексов одновалентного
палладия.
В статье (3) авторы описывают синтез Pd2Cl2(tBuNC)4
с мостиковыми атомами хлора по реакции между комплексом Pd(0)
[Pd(dba)2]
(dba=dibenzylideneacetone)
и PdCl2(PhCN)2
при избытке свободного tBuNC.
Реакцию проводят в атмосфере аргона, реакционную смесь помещают в морозильную
камеру на ночь(-35 С) для более полной кристаллизации целевого желто-зеленого
вещества, после чего очищают по стандартной методике (растворение в CH2Cl2,
фильтрация, осаждение смесью CH2Cl2-эфир,
промывка эфиром, сушка).
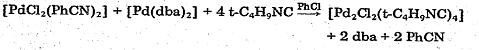
Взаимодействие полученного по предыдущей реакции
[PdCl(tBuNC)2]2
с AgPF6
в ацетоне в присутствии tBuNC
приводит к уже упоминавшемуся в разделе "Структура" комплексу [Pd2(t-BuNC)6](PF6)2
.
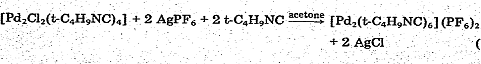
Добавление избытка CH3CN
к [PdCl(СH3NC)2]2
при наличии [Pd(dba)3]
также приводит к аналогичному комплексу [Pd2(СH3NC)6]X2
(X=Cl,Br).
Реакцию проводят инертной атмосфере (N2)
в течении 50 часов.
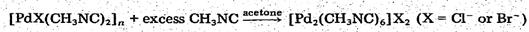
Еще до выхода в свет статьи (3) японские ученые
(4) синтезировали такие же комплексы [PdX(tBuNC)2]2,
но другим путем, посредством реакции конпропорционирования, без использования
свободного изонитрила. В качестве субстрата они использовали соединение
нульвалентного палладия Pd(tBuNC)2
,растворенное в С6H5Сl,
а в качестве реагента- Pd(tBuNC)2X2.
Синтез идет 4 часа при постоянном перемешивании и низкой температуре (- 30 С).
Полученное в виде желтых кристаллов с молекулами растворителя хлорпроизводное [PdCl(tBuNC)2]2*C6H5Cl
(выход-70
%). Оно обладает значительной термической устойчивостью и стойкостью к
окислению на воздухе.
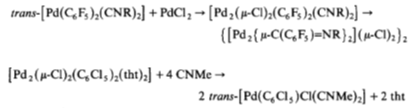
В статье 6 синтез [PdX2(CNC6H4COOH)2]
проводился в течении 30 минут по стандартной схеме обмена лигандов (tht =
tetrahydrothiophene), по проведению похожей на метод Белукко. В качестве
растворителя использовался тетрагидрофуран, в качестве осадителя-гексан (M=Pd,
Pt).
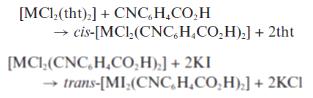
В статье 8 инденильные комплексы образуются по
реакции замещения хлорид-ионов в PdCl2(CNR)2
в течении часа без нагревания при действии на комплекс инденил-лития в бензоле,
в результате чего образуется соединение Pd2(μ2-In)2(RNC)2.
Если подвергнуть продукт обработке уксусной кислотой при 0 С и перемешивать
смесь в течении 48 часов, то образуется Pd4(μ-OAc)4(RNC)4
.
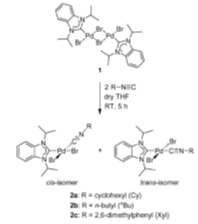
Авторы (10) о синтезе смешанных
карбенизонитрильных комплексах палладия. Действуя на [PdBr2(iPr2-bimy)]2
(1) (iPr2-bimy
= 1,3-diisopropylbenzimidazolin-2-ylidene)
избытком изоцианида, они первоначально получили смесь веществ [PdBr2(iPr2-bimy)(CN-Cy)]
(cis-2a)
и незапланированный димерный комплекс палладия(1) [PdBr(CN-Cy)2]2
, вероятно, возникающий в результате гидролиза карбена. В дальнейшем, используя
стехиометрические количества реагентов, группа смогла получить с высокими
выходами и охарактеризовать целевой продукт. Полученный продукт [PdBr2(iPr2-bimy)(CNR)]
представлял смесь транс и цис изомеров c
преобладанием транс, что подтверждается сигналами ЯМР.
2. Практическая
часть
В рамках данной работы был проведен
двухстадийный (через лабильные нитрильные комплексы) синтез бис-изонитрильных
комплексов Pd: PdCl2(CNR)2
(R=p-CH3C6H4,
tBu)
и PdI2(CNtBu)2.
Из PdCl2(p-CH3C6H4)2
нуклеофильным присоединением 1-бензилпипиразина и 2-аминопиридина
пытались получить 2 соответствующиx
диаминокарбеновыx комплекса PdCl2(CNp-CH3C6H4)C[(NНp-CH3C6H4)(NHX)],
где X=-NН-2-py,
1-benzylpiperazine (py=пиридин).
В качестве исходного сырья брался PdCl2.
. Синтез PdX2(CNR)2.
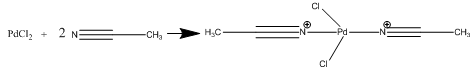
1.1. Синтез PdCl2(CNR)2
На 1 стадии
PdCl2
обработали СNCH3
и получили комплекс PdCl2(CNCH3)2
.
Реакция:
Ход работы:
500 мг PdCl2
помещают в круглодонную колбу на 100 мл и приливают 50 мл ацетонитрила АсСN.
Перемешивают магнитной мешалкой смесь в течении 4-5 часов. Упариваем при
пониженном давлении (отгоняем растворитель на роторе), взвешивают получившийся
комплекс.
Реально отвесили 0,4992 г PdCl2
и получили 0,724 г целевого вещества. Выход продукта составил 98,9 %.
Полученное вещество представляет из себя оранжевый порошок. Данные его ЯМР
спектра полностью совпали с литературными (спектр).
На 2 стадии
к полученному нитрильному комплексу добавляют изоцианид. Протекает реакция
обмена лигандов (R=p-CH3C6H4,
tBu):
Реакция:
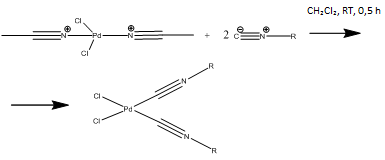
Ход работы:
В виалу на 8 мл помещаем навеску 0,365 г сухого PdCl2(CNCH3)2
и добавляем 5 мл хлористого метилена СH2Cl2
. Комплекс растворяется плохо, поэтому реакционную смесь необходимо
перемешивать магнитной мешалкой. При перемешивании добавляем в виалу жидкий
изонитрил в небольшом избытке (2,1 эквивалента). Через 30 минут перемешивание
прекращают, реакционную смесь отгоняют на роторе почти насухо и добавляют
диэтиловый эфир, чтобы растворить примеси. Далее продукт фильтруют на фильтре
Шотта, тем самым избавляясь от примесей, сушат и перекристаллизовывают,
используя пентан. Получившиеся желтые кристаллы снова промывают диэтиловым
эфиром, дополнительно перекристаллизовывают несколько раз, сушат и взвешивают
конечный продукт.
Результаты:
В случае R=p-CH3C6H4
выход составил 93%, R=tBu-89%.
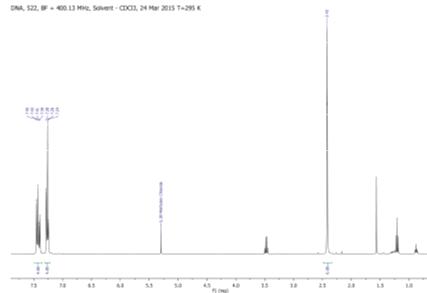
Спектр изонитрильных комплексов совпадает с литературным. Также была проведена
ИК-спектроскопия, которая выявила 2 полосы поглощения, что соответствует цис-конфигурации
(спектры ИК, ЯМР). На рисунке-спектр ЯМР 1H
Синтез PdI2(CNR)2
(R-tBu).
Синтез данного комплекса проводился исходя из
уже полученного PdCl2(CNR)2.
В оригинальной методике Белукко предлагалось использовать в качестве
прекурсоров PdCl2 и свободный
СNR, то есть
предполагалось, что PdCl2(CNR)2
образуется в реакции in
sito, мы же
использовали уже готовый комплекс.
Реакция:
2(CNtBu)2
+KI=PdI2(CNtBu)2+2KCl
Ход
работы:
В виалу добавляют 100 мг сухого PdCl2(CNtBu)2
и избыток КI(
приблизительно 750 мг).Смесь суспензируют в 10 мл ацетона, перемешивают 24 часа
на магнитной мешалке. Далее оранжевый раствор отгоняют на роторе, твердый
остаток растворяют в хлороформе, фильтруют на фильтре Шотта и осаждают
диэтиловым эфиром. Полученный продукт оказывается достаточно чистым и
дальнейшей перекристаллизации не требует.
Результаты:
Выход продукта составил 13,6 мг. Результаты ЯМР
совпали с литературными, Ик-спектр выявил транс-конфигурацию (1 полоса), что
также соответствует источникам. Отличие в конфигурации по сравнению с хлором
объясняется большим радиусом йода по сравнению с хлором и вызванными вследствие
этого стерических затруднений в cis-конфигурации.
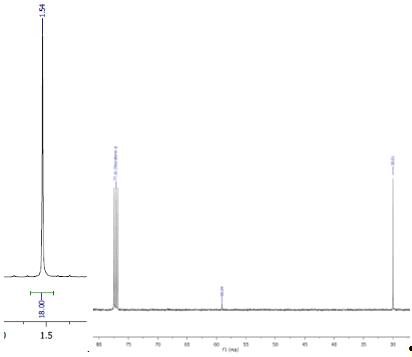
ЯМР 1H
ЯМР 13С
Заключение
В рамках данной работы были синтезированы
бис-изонитрильные комплексы Pd
c ароматическим (R=p-Tolyl)
и алифатическим (R=tBu)
радикалом. Высокие выходы продукта и сравнительно несложная очистка говорят о
перспективности использования данной реакции в препаративных целях. Данные
соединения действительно легко атакуются N-нуклеофилом,
образуя диаминокарбеновые структуры, что уже проверено нашей группой (однако
результаты еще не оформлены).
Литература
1. Zhu, J. P. Eur. J. Org.
Chem.
2003, 1133
2. Suginome, M.; Ito, Y.
Adv. Polym.
Sci. 2004, 171, 77.
. Yamamoto, Y.; Miyachi,
M.; Yamanoi, Y.; Nishihara, H. J. Inorg. Organomet. Polym. Mater.
2014, 24, 208.
. H. B. Bang, S. Y. Han,
Synth. Commun., 2009, 39, 506-515.
. E. Peris, R. H.
Crabtree Coord. Chem. Rev. 2004, 248, 2239
. Sacco A., Gazz. Chim.
Ital., 83, 632, 1953.
. Cotton F.A., Dunne
T.G., Inorg. Chem., 4, 318, 1965
. Sarapu A.C., Fenske
R.F., Inorg. Chem., 11, 3021, 1972.
. Cano F.N., Chem.
Communs, 1617, 1971
. Bailey N.A., Walker
N.W., J. Orgamometal Chem., 37, C49, 1972
. Joshi K.K, Mills O.S.,
Shaw B.W., Chem. Communs., 181, 1965.
. Jovanovic B., J. Chem.
Soc., Dalton, 1176, 1972.
. Otsuka S., Nakamura
A., Tatsuno Y., J. Am. Chem. Soc., 91, 6994, 1969.
. Cotton F., Zingales
F., J. Am. Chem. Soc., 83, 351, 1961.
. Coates G., Parkin C.,
J. Chem. Soc., 3220, 1962.
. Strohmeier W.,
Hellmann H., Chem. Ber., 97, 1877, 1964
. Heldt W. Z., Inorg.
Chem., 2, 1048, 1963.
. Crociani B., Belucco
U., Inorganic Chemistry, Vol. 9, No. 9, 1970
. Y.Yamamoto,
H.Yamazaki, The Chemical Society of Japan, 1985, 58.
. M.F. Rettig, E.A.Kirk,
P.M.Maitlis, Journal of Organwnetallic Chemisfry, 111 (1976) , c.
113-121.
. Otsuka S., Tatsuno Y.,
Journal of the American Chemical Society, 1971
. R. Uson, J. Forni at
al, Journal of Organometallic Chemistry, 299 (1986), 251-258.
. Silverio Coco, Elisa
Espinet, Dalton Trans., 2007, 3267-3272.
24. Сhemical
Society of
Japan, 54, 2672-2674.
25. Inorg.
Chem. 1993, 32, 4578-4584.
. Christofides A., Journal
of Organometallic Chemistry. 259, 355-365, 1983.
. Y. Han and H. V. Huynh
, Dalton Trans., 2201-2209, 2009.
. Guillemard H., Ann.
chim. phys., 14, 344, 1908.
. Malatesta L., Padoa
G., Inst. Lomb., 91, 227, 1957.
. Heldt W.Z., J. Inorg.
Nucl.
Chem.,
22, 305, 1961.
32. Heldt W.Z., Adv. Chem.
Ser., 37, 99, 1963.
. Hartley E.G. J., J.
Chem. Soc.,101, 705, 1912.
. Malatesta L., Gazz.
Chim. Ital., 77, 240, 1947.
. Sacco A., Gazz. Chim.
Ital., 86, 201, 1956.
. Hoffmann K. A., Bugge
G., Ber., 40, 3759, 1907.
. Malatesta L., Sacco
A., Atti Acad. naz. Lincei, 11, 379, 1951.
. Milter J.S., Balch
A.L., Inorg. Chem., 11, 2069, 1972.
. Bonati F., Minghetti
G., J. Organometal. Chem., 24, 251, 1970.
. Fischer E.O., Werner
H., Chem Ber., 95, 703, 1962.
. Nast R., Schulz H.,
Chem. Ber., 103, 777, 1970.
. Werner H., Ptinz. R.,
Chem. Ber., 99, 3582, 1966.
. Cetini G., Gambino A.,
Atti A. Accad. Sci. Torino, 97, 1131, 1963.
. Hieber W., Z.
Naturforsch, 5b, 129, 1950.
. Jetz W., Angelici R.,
J. Organometal. Chem., 35, C37, 1972.
. Vallarino
L., Ist.
Lomb., 91, 397, 1957.
. Joshi K. K., Pauson
P.L., J. Organometal. Chem, 1, 51, 1963.
. Brunner H., Vogel M.,
J. Organometal. Chem., 35, 169, 1972.
. Freni M., Valenty V.,
Gazz. Chim. Ital.,
90, 1445, 1960.
50. Treischel P. M., Hess R.
W., J. Am. Chem. Soc., 93, 5424, 1971.
. Yamamoto Y., Hagihara
N., Bull. Chem. Soc.
Japan, 39, 1084, 1966.
52. Chugaev, L.;
Skanavy-Grigorizeva, M. J. Russ. Chem. Soc. 1915, 47, 776.
53. Rouschias, G.; Shaw, B.
L. J. Chem. Soc. Chem. Comm. 1970, 183-183.
. Vicente, J., Chicote,
M. T., Huertas, S.; G. Inorg. Chem.2003, 42, 4268.
. Han, Y.; Huynh, H. V.
Dalton Trans. 2009, 2201.
56. Martínez-Martínez,
A.-J.; Vicente, J. Organometallics 2012, 31, 3711.
. Luzyanin, K. V.;
Guedes da Silva, M. F. C.; Kukushkin, V. Y.; Pombeiro, A. J. L. Organometallics
2008, 27, 833.
. Kinzhalov, M. A.;
Boyarskiy, V. P.; Luzyanin, K. V.; Kukushkin, V. Y. Dalton Trans. 2013, 10394.
. Yakimanskiy, A.;
Boyarskaya, I.; J. Coord. Chem. 2013, 66, 3592
. Wanniarachchi, Y. A.;
Slaughter, L. M. Chem. Commun. 2007,3294.
. Slaughter, L. M.
Comments Inorg. Chem. 2008, 29, 46.
. Tskhovrebov, A. G.;
Luzyanin, K. V.; Kuznetsov, M. L.;Sorokoumov, V. N.; Balova, I. A.; Haukka, M.;
Kukushkin, V. Y. Organometallics 2011, 30, 863.
. A. Stephen, K. Hashmi,
Christian Lothschutz, Constantin Bohling, and Frank Rominger, Organometallics
2011, 30, 2411.