Получение электролита для суперконденсатора
Введение
суперконденсатор гидроксид никеля
Несмотря на огромные масштабы электрификации во всем мире, роль
химических источников тока (ХИТ) в нашей жизни не только не ослабевает, но и
усиливается с каждым годом. Это связано с таким важным свойством, как автономность
(отсутствует необходимость в протягивании проводов, как это делается в случае
электростанций). Поэтому ХИТ широко используют для энергоснабжения самых
разнообразных мобильных объектов. В последнее время прорабатывается вопрос
использования в качестве накопителя энергии в источниках бесперебойного питания
конденсатора, разработанного на основе использования двойного электрического
слоя. Такие конденсаторы часто называют суперконденсаторами (СК) или
ионисторами. Суперконденсаторы получили широкое применение в транспортной
индустрии (рекуперация торможения, облегченный запуск двигателя, электрическая
стабилизация системы), промышленности (автопогрузчики, лифты), а также
потребительской электронике (мобильные телефоны, компьютерные компоненты). Современные
суперконденсаторы должны обладать высоким ресурсом службы - порядка 700 000
циклов, что соответствует от 5 до 20 лет работы в зависимости от степени
нагрузки; малой себестоимостью при расчете на один цикл использования - как
энергии, так и мощности; возможностью работать в критических условиях (высокая
амплитуда токов, перепады напряжения, экстремальные температурные условия);
экологичностью.
Одним из таких суперконденсаторов является гибридный суперконденсатор с
окисноникелевым электродом. Характеристики таких источников тока, определяются
параметрами окисноникелевого электрода, и соответственно характеристиками
гидроксида никеля. Условия работы суперконденсатора (быстрый заряд-разряд)
предъявляют специальные требования к активному веществу фарадеевского
электрода. Гидроксид никеля, используемый в промышленных гибридных
суперконденсаторах имеет удельную емкость 50-70 Ф/г (27-40 мА·ч/г) [1]. Однако
вопрос получения форм гидроксида никеля с более высокими удельными параметрами
является очень актуальным. Благодаря своим характеристикам среди СК выделяются
асимметричные, в которых один электрод работает на основе заряда - разряда ДЭС,
а на втором происходят электрохимические реакции. В качестве активного вещества
одного из промышленно выпускаемых асимметричных СК используется тот же
гидроксид никеля, что и для производства аккумуляторов, более мелкой фракции.
Заряд - разрядные процессы в режиме суперконденсаторов протекают при очень
высоких плотностях тока, в тонком поверхностном слое частиц, поэтому Ni(OH)2
должен иметь высокую удельную поверхность и аморфную структуру. Однако простые
методы получения таких порошков Ni(OH)2 до сих пор не разработаны.
1.Литературный обзор
.1 Краткая характеристика суперконденсаторов
Иони́стор (суперконденсатор) - электрохимическое устройство,
конденсатор с органическим или неорганическим электролитом, «обкладками» в
котором служит двойной электрический слой на границе раздела электрода и
электролита. Функционально представляет собой гибрид конденсатора и химического
источника тока.
Наиболее часто встречающимися обозначениями для данной группы устройств
являются "электрохимические конденсаторы",
"ультраконденсаторы", "суперконденсаторы",
"сверхъемкие конденсаторы", "двойнослойные конденсаторы".
Электрохимическими конденсаторами являются электрохимические устройства с
протекающими в них квазиобратимыми электрохимическими заряд-разрядными
процессами. Форма гальваностатических зарядных и разрядных кривых близка к
линейной, т.е. близка к форме соответствующих зависимостей для обычных
электростатических конденсаторов [24,25]. Электрохимические конденсаторы могут
быть подразделены на пленочные (диэлектрические), электролитические и
суперконденсаторы (СК) [25].
.1.1Электролитические конденсаторы
В электролитических конденсаторах в качестве диэлектрика используют
тонкую оксидную пленку (толщиной 1.2 нанометров на каждый вольт напряжения),
нанесенную на поверхность одного из металлических электродов - анода. В роли
второй обкладки конденсатора выступает электролит, а токоподводом (катодом) -
второй металлический электрод. В качестве электродов используются металлы,
оксиды которых могут быть диэлектриками, в частности алюминий и тантал. Данные
конденсаторы известны уже несколько десятков лет. Они обладают высокими
емкостями, которые достигаются благодаря присутствию тонкой пленки диэлектрика
на аноде и развитой площади поверхности, полученной методом электрохимического
или химического травления [26,27]. Недостатками алюминиевых электролитических
конденсаторов являются зависимость их параметров от температуры и значительные
утечки тока [28]. Конденсаторы с танталовыми электродами обладают большей
удельной емкостью, меньшими утечками тока, более длительными сроками хранения,
лучшими температурно-частотными характеристиками по сравнению с алюминиевыми
электролитическими конденсаторами [28]. Высокая механическая прочность тантала
позволяет применять его в виде более тонкой фольги, что дополнительно
увеличивает емкость. Однако цена танталовых конденсаторов значительно выше, чем
алюминиевых. Химическая инертность оксида тантала позволяет использовать
растворители, которые невозможно применять в алюминиевых электролитических
конденсаторах. Применение МnО2 в качестве твердого электролита дает
возможность использовать танталовые конденсаторы при низких температурах вплоть
до -55°С.
.1.2 Суперконденсаторы
СК отличает от аккумуляторов в первую очередь существенно более быстрый
заряд и разряд. В настоящее время в суперконденсаторах используются как водные,
так и органические электролиты. Более высокое напряжение разложения последних
(2,5-3 В против 1 В у водных растворов кислот и щелочей) позволяет создавать
суперконденсаторы с высоким рабочим напряжением, тем самым увеличивая их
энергоемкость [29]. В то же время сопротивление большинства неводных электролитов,
представляющих собой сложные органические соединения, растворенные в
органических растворителях, обычно выше, чем у водных, что в большинстве
случаев ведет к снижению удельной мощности устройства. Суперконденсаторы с
водными электролитами (кислоты, щелочи) гораздо проще в изготовлении,
эксплуатации, обладают меньшим удельным сопротивлением, дешевле своих аналогов
с органическим электролитом и могут работать при очень низких температурах.
Встречаются попытки создания суперконденсаторов с твердым полимерным
электролитом [30] на основе перфторсульфополимера под торговой маркой Nafion,
широко применяемого в различных электрохимических системах с твердым полимерным
электролитом [31]. Суперконденсаторы подразделяются на двойнослойные
конденсаторы (ДСК), псевдоконденсаторы и гибридные конденсаторы.
.1.3 Двойнослойные суперконденсаторы
Двойнослойный суперконденсатор состоит из двух пористых электродов из
электронпроводящих материалов, разделенных заполненным электролитом сепаратором
(Рис.1.1). Процесс запасания энергии в ДСК осуществляется за счет разделения
заряда на двух электродах с достаточно большой разностью потенциалов между
ними. Электрический заряд ДСК определяется емкостью двойного электрического
слоя. Двойной электрический слой на поверхности каждого электрода представляет
собой отдельный конденсатор. Между собой они соединены последовательно через
электролит, являющийся проводником с ионной проводимостью.
Рис. 1.1. Схематическое изображение двойнослойного суперконденсатора
Упрощенная эквивалентная электрическая схема такого конденсатора выглядит
следующим образом (Рис.1. 2):
Рис.1. 2. Эквивалентная электрическая схема ДСК, C 1 - емкость двойного
электрического слоя положительного электрода; C 2 - емкость двойного
электрического слоя отрицательного электрода
Процессы, происходящие в двойном электрическом слое на границе раздела
двух проводников, близки тем, которые протекают в обычном конденсаторе, однако
в этом случае расстояние между несущими различный заряд обкладками составляет
несколько межатомных длин. Фактически, одна обкладка представлена электронами в
электронном проводнике, а вторая - сорбированными на поверхности электронного
проводника положительными ионами электролита [25]. На втором электроде слой
формируется за счет обеднения электронами электронного проводника и сорбции
отрицательных ионов электролита. Таким образом, для достижения максимальной
емкости необходимо обеспечить как можно большую поверхность контакта
электролита с электронным проводником. Первое упоминание о строении двойного
слоя и возможности использования запасаемой в нем энергии принадлежит
Гельмгольцу и относится к середине XIX века. Практическое использование энергии
двойного электрического слоя в электрических конденсаторах началось лишь во
второй половине XX века с появлением, с одной стороны, материалов, позволяющих
создавать такие конденсаторы, с другой стороны - возникшей потребности в
мощных, быстро заряжаемых источниках тока с большим ресурсом для решения
множества технических задач. Режимы заряда-разряда суперконденсатора во многом
определяют его мощность и энергоемкость. Разряд большими токами повышает
мощность, однако значительная часть энергии при этом либо теряется на
сопротивлениях электролита и электродов, либо двойной слой не успевает
разрядиться до конца. Для систем с водным электролитом удельная энергоемкость
существенно ниже, чем для органического электролита. Более высокое значение
удельной энергоемкости у систем на основе органических электролитов достигается
преимущественно за счет высокого рабочего напряжения, однако сопротивление
таких электролитов существенно выше (что существенно понижает их КПД на больших
токах и приводит к значительному разогреву). В то же время для органических
систем удельная энергоемкость приближается к таковой для свинцово-кислотных
аккумуляторов и проточных ванадиевых редокс-батарей [34], что вместе с высокими
ресурсными показателями и повышенной глубиной разряда повышает
конкурентоспособность таких суперконденсаторов.
.1.4 Суперконденсаторы на основе псевдоемкости (псевдоконденсаторы)
Электрический заряд в псевдоконденсаторах накапливается за счет двух
процессов: фарадеевской псевдоемкости достаточно обратимых редокс-реакций и
емкости двойного электрического слоя (ДЭС). Можно выделить несколько типов
фарадеевских процессов в электродах псевдоконденсаторов. Примером обратимого
процесса может являться выделение водорода или свинца на поверхности Pt или Аu.
В качестве электродов пвсевдоконденсаторов хорошо изучены оксиды металлов
платиновой группы (например, RuО2,
IrO2 и различных смесей оксидов).
Накопление псевдоемкости связанно с изменением степени окисления Ru в оксидной
пленке. Обратимый окислительно-восстановительный процесс происходит в области
потенциалов от 0,1 до 1,3 В (относительно водородного электрода в том же
растворе) [32].
.1.5 Гибридные конденсаторы
В гибридных конденсаторах используются электроды различных типов. В
качестве положительного электрода выступает оксид металла, а отрицательный
электрод представляет собой активированный углеродный материал. Использование
активированных углей (АУ) в качестве основы для отрицательного электрода в
гибридных системах позволило вдвое расширить область изменения его потенциала
по сравнению с ДСК, т.е. с симметричной системой, состоящей из двух электродов
на основе АУ. Принципиально существует два типа гибридных конденсаторов: с
водным электролитом и неводным. В первом случае один из электродов
(отрицательный) выполнен из активированного угля, а второй - фарадеевский
электрод с водными растворами электролитов (например, NiOOH/КOH/C, PbO2
/H2SO4/С). Все процессы, происходящие в объеме
положительного электрода и на его поверхности, аналогичны процессам,
происходящим в щелочных аккумуляторах. Рабочая область потенциалов конденсатора
составляет 0,6-2,1 В. Во втором случае - один из электродов выполнен из
активированного угля, другой - фарадеевский электрод, обратимо работающий в
неводных электролитах. Удельная энергия гибридных конденсаторов выше, чем у
ДСК, но ниже, чем у аккумуляторов [33].
Суперконденсаторы занимают промежуточную нишу между обычными
конденсаторами и аккумуляторами, что иллюстрирует диаграмма Рагона (Рис.1.3).
Рис. 1.3. Диаграмма Рагона для различных энергетических устройств
(Источник - US Defence Logistics Agency). Наклонные линии отражают характерное
время разряда представленных устройств.
1.2 Фарадеевский и двойнослойный электроды
Электрохимические процессы в СК можно описать следующим образом: во время
заряда электроны перемещаются от положительного электрода к отрицательному
через внешний источник тока. Ионы из объема электролита перемещаются к
электродам. Во время разряда электроны перемещаются от отрицательного электрода
к положительному, ионы возвращаются с поверхности электрода в объем
электролита. Во время заряда и разряда изменяются плотность заряда на границе
раздела электрод-электролит и концентрация электролита. В отличие от
аккумуляторов, заряд и разряд которых ограничен протекающими электрохимическими
реакциями на электродах, суперконденсаторы можно заряжать и разряжать
«накоротко», так как ДЭС образно можно сравнить с пружиной, которая сжимается в
процессе зарядка и отдает накопленную энергию в процессе разряда. При заряде и
разряде суперконденсатор ведет себя как идеальный конденсатор, а именно
заряжается или разряжается через ограничительный резистор - внутреннее
сопротивление.
Величины удельной емкости углеродных материалов существенно зависят от
истории их предварительной обработки, морфологии поверхности, распределения пор
по размерам, смачиваемости поверхности различными электролитами и т.д.
Возможность использования более высоких рабочих напряжений приводит, несмотря
на относительно небольшую удельную емкость, к большим удельным энергиям.
Особенно большой эффект при малых токах разряда, когда низкая
электропроводность электролита с органическим растворителем не вызывает
существенных омических потерь в электродах и сепараторе. Когда электрод, то
есть электронный проводник, погружают в раствор электролита, то есть ионного
проводника, происходит самопроизвольная перегруппировка зарядов на поверхности
электрода и в прилегающем слое электролита. Таким образом, в системе
электрод-электролит формируется двойной электрический слой, в котором один
«слой» находится в проводнике, а другой «слой» - в электролите, как показано на
рис. 1.4.
Упрощенная структура показана на рисунке 1.4a (случай, когда поверхность
электрода заряжена отрицательно). В соответствии с этой простой моделью
Гельмгольца, заряды сконцентрированы на каждой стороне электродной поверхности.
Более сложная модель структуры ДЭС, показана на рисунке 1.4 б, принимает во
внимание различные размеры ионов и их взаимодействие с поверхностью.
Рис. 1.4 - Упрощенная модель ДЭС по Гельмгольцу: а) традиционный
конденсатор; б) схема ДЭС на поверхности отрицательно заряженного электрода [3].
На практике, структура ДЭС более сложная, чем модели, описанные выше.
Двойной слой на поверхности электрода формируется и приходит в состояние
равновесия почти мгновенно. Константа времени его формирования составляет ~ 10-8
секунд. Итак, структура двойного слоя имеет способность быстро отвечать на
изменения потенциала в тот же момент времени. Процесс представляет собой
реорганизацию зарядов, но не химическую реакцию. Такой быстрый отклик на
изменения сильно контрастирует с окислительно-восстановительными электродными
реакциями в аккумуляторах и топливных ячейках.
При погружении углеродных электродов в электролит они обычно получают
потенциал около нулевого уровня заряда ДЭС. Приложив внешнее напряжение,
большие количества ионов и электронов могут попасть в двойной слой, увеличивая
емкость С. Суперконденсатор можно изобразить следующей эквивалентной схеме
(рис.1.5):
Рис.1.5 - эквивалентная схема суперконденсатора Са и Ск - емкости двойных
слоев анода и катода, соответственно; R1 - внутреннее сопротивление ячейки [4].
Для последовательно соединенных конденсаторов справедливо выражение:
/С = 1/Са + 1/Ск (1.1)
Если Са = Ск, как это имеет место быть в ультраконденсаторах, то:
С = 0,5Ск (1.2)
Углеродные нанотрубки и наноструктурированный углерод с высокоразвитой
поверхностью выбирают из-за того, что они имеют огромную площадь поверхности,
смачиваемой электролитом, высокую электронную проводимость, химическую и
электрохимическую устойчивость и низкую цену. Емкость таких устройств может
быть на порядки выше емкости современных сухих и электролитических
конденсаторов (ЭК).
Заряд-разряд симметричного ЭК, состоящий из двух электродов с примерно
одинаковыми массами, погруженных в водный или неводный электролит, показан на
рис.1.6. Когда приложен заряд q равный нулю, потенциал φ
на обоих электродах
ячейки одинаковый. Потенциалы электродов растут в противоположные стороны во
время заряда, поскольку электроды имеют одинаковую емкость.
Рис.1.6 - изображение процесса заряда симметричного конденсатора [5].
Асимметричный ЭК включает в себя в качестве одного электрода
аккумуляторный электрод. Такой электрод, основанный на
окислительно-восстановительной реакции, имеет емкость примерно в 10 раз больше
емкости двойнослойного электрода. Например, заменив углеродный катод симметричного
суперконденсатора катодом из никелевого элемента (NiOOH), и учитывая условие Ск
= 10Са в уравнении, фактически мы получим удвоение емкости ЭК:.
/С = 1/Са + 1/10 Са, С ≈ Са (1.3)
Этот асимметричный тип СК часто называют «гибридным». Типичная кривая
разряда гибридного СК отражена на рис.1.7.
Рис.1.7 - Разрядная кривая СК. А) для симметричной конструкции В) для
асимметричной конструкции [6].
Так как емкость аккумулятора электрода в 3 - 10 раз превышает емкость
двойнослойного электрода, напряжение во время разряда гибридного СК убывает
медленнее, чем в случае углерод-углеродного двойнослойного конденсатора. В
некоторых случаях, окислительно-восстановительные заряд-разрядные процессы
протекают практически так же быстро и обратимо, как в случае с ДЭС.
Существуют гибридные суперконденсаторы на основе различных аккумуляторных
электродов, например:
(-)Ag / Твердый электролит RbAg4I5 / C(+);
(-) С / 30% водный раствор КОН / NiОOH (+);
(-) С / водный раствор КОН / Ni(OH)2(+).
Наиболее высокий интерес вызывают суперконденсаторы на основе гидроксида
никеля (II).[1, 2]
.3 Физико-химические свойства Ni(OH)2 [7]
Гидроксид никеля - неорганическое соединение, гидроокись металла никеля с
формулой Ni(OH)2, светло-зелёные кристаллы, не растворяется в воде,
образует гидраты.
Гидроксид никеля используется для производства щелочных аккумуляторов,
никельсодержащих катализаторов, в качестве пигмента для стекла и керамики, для
очистки электролита при производстве металлического никеля, для получения солей
никеля, в электротехнике, электрохимической, радиотехнической промышленности, в
лабораторной практике для химического анализа, компонент шихты в производстве
цветной керамики, гальванотехнике и гальванических процессах, в аналитической
практике, а также для других отраслях промышленности.
Гидроксид никеля (II) образуется из растворов никелевых солей при
добавлении щелочи (рН> 7) в виде объемного осадка яблочного цвета, который
впоследствии превращается в зеленые гексагональные кристаллы. В зависимости от
метода получения Ni(OH)2 имеет две формы: α-Ni(OH)2 и β-Ni(OH)2 с параметрами решетки а = 3,12 Å,
с = 7,5 Å
и а = 3,12 Å,
с = 4,6 Å
соответственно.
β-Ni(OH)2 получается из концентрированных
растворов щелочи, при заряде β-Ni(OH)2 окисляется в β-NiOOH. В β-форме катион никеля расположен в
центре октаэдра, образованного шестью атомами кислорода гидроксильных групп.
Октаэдры соединяются между собой ребрами, образуя параллельно расположенные
слои, связанные ван-дер-вальсовыми взаимодействиями в трехмерную гексагональную
решетку (рис.1.8).
Рис.1.8 - гексагональная решетка β-Ni (OH) 2 [7].
Рис. 1.9 - упорядоченная (а) и разупорядоченная (б) решетки модификаций
Ni(OH)2 [8].
Другая, α-форма, имеет состав 3Ni(OH)2• 2H2O, так
как содержит два слоя ионов кислорода, разделенных промежуточным слоем молекул
воды. Строение α-Ni(OH)2 представлено на рис.1.10.
Рис.1.10 - Строение α-Ni (OH)2 [9].
Примечание: структура показана без межслоевой воды.
В результате окисления α форма превращается в γ-NiOOH.
В концентрированных
растворах щелочи α-Ni(OH)2 теряет воду из промежуточного слоя и
переходит в безводную β-Ni(OH)2.
Электропроводность Ni(OH)2 равна 10-15 Ом-1
• см-1, характеризует его как диэлектрик. Электропроводность NiOOH
на несколько порядков выше и может быть в пределах 10-6,5 - 10-2,5
Ом-1 • см-1 [10]. Окисление гидроксида никеля в пределах
структуры β-Ni(OH)2 в β-NiOOH вызывает незначительные изменения в
кристаллической решетке, в то время как переход β-Ni(OH)2 в γ-NiOOH приводит к радикальной перестройке
структуры. Плотность β-NiOOH равна 4,15 г/см3, а γ-NiOOH
= 3,85 г/см3,
что при образовании γ - NiOOH приводит к увеличению объема активной
массы [11].
На использование α или β гидрата закиси никеля в качестве
активного вещества существует несколько точек зрения. Одни ученые считают
целесообразным использование β-Ni(OH)2 и циклирование между β-Ni(OH)2 ↔ β-NiOOH, объясняя это тем, что при образовании
γ-NiOOH
существенно
увеличивается объем активного вещества, что приводит к деформации электродов.
Кроме того ними считается, что γ-NiOOH имеет меньшую активность, чем β-NiOOH.
Другая группа ученых
считают перспективным использование в щелочных аккумуляторах α-Ni(OH)2, поясняя это тем, что α-Ni(OH)2 имеет более высокий коэффициент использования и
средний потенциал разряда, чем у β-NiOOH. Однако, нельзя отрицать тот факт, что
исходная структура Ni(OH)2 и наличие межслойной воды влияют на
природу соединений, образующихся при заряде окисноникелевого электрода (ОНЭ).
Механизм этого воздействия не ясен и должен изучаться, очевидно, в неразрывной
связи с процессами, происходящими при старении активной массы.
Определено также, что какой бы ни была начальная фаза гидроксида, α
или β,
все равно в конце после
длительного циклирования, начальная фаза превращается в β
(II) фазу, вероятно за
счет процесса старения. При этом, как указано в литературе [12], коэффициент
диффузии для α - фазы больше чем для β-фазы и составляет 9,27•10-9,
а для β-1•10-11 см2/с. Значительную роль
в образовании той или иной структуры высших гидроксидов никеля играют условия заряда
электрода и природа электролита. Повышение температуры электролита, плотности
тока и продолжительности анодной поляризации способствует возникновению
структуры γ-NiOOH. Этому же способствует увеличение радиуса катиона щелочи:
образование γ-NiOOH облегчается в ряде LiOH - KOH - CsOH. Старение активной массы
и длительное циклирование препятствует получению данной структуры.
.4 Методы получения гидроксида никеля (II)
Существует несколько способов получения Ni(OH)2:
· Промышленные;
· Лабораторные:
. Химические;
. Физико-химические;
. Электрохимические;
.4.1 Промышленные способы синтеза гидроксида никеля
Известен способ получения гидроксида никеля (II) для активной массы
положительных электродов щелочных аккумуляторов путем вливания раствора
сульфата никеля, нагретого до 80-90°С, в раствор щелочи той же температуры.
Полученную суспензию гидроксида никеля отфильтровывают, сушат и после размола
отмывают от сульфата натрия и сушат. Готовый продукт дополнительно кипятят в
16%-ном растворе щелочи в течение одного часа, после чего отмывают водой и
окончательно высушивают. Целевой продукт содержит 56,2% никеля, 0,2%
сульфат-иона и обеспечивает максимальную емкость не менее 1,14 Ач/г Ni. При
этом следует указать, что значение удельной ёмкости явно завышены: 1140 мА·ч/г Ni · 0.562 (содержание никеля в
гидроксиде) = 641 мА·ч/г гидроксида. В тоже время известно, что теоретическая
ёмкость Ni(OH)2 составляет 289 мА·ч/г из расчёта одноэлектронной
реакции
Способ имеет следующие недостатки.
. Стадия отделения маточника от осадка трудоемка, так как осадок
гидроксида никеля является гидрофильным и обладает высоким удельным
сопротивлением при фильтрации.
. Трехкратная сушка требует значительных трудозатрат и увеличивает расход
энергоресурсов.
. Необходимость обработки раствором щелочи готового продукта удлиняет
технологический процесс и увеличивает расход гидроксида натрия[11]
Также известен способ получения гидроксида никеля (II), включающий его
осаждение из предварительно приготовленных исходных растворов гидроксида натрия
и сульфата никеля (II) с добавлением в качестве активирующей добавки ионов
бария. Полученный осадок отделяют фильтрацией, затем сушат, отмывают от
сульфат-ионов, вновь сушат и размалывают. Этот способ имеет следующие
недостатки.
. Отделение маточника от гидрофильного осадка гидроксида никеля (II),
имеющего высокое удельное сопротивление при фильтрации, трудоемко, связано с
большими затратами времени и энергоресурсов.
. Двукратная сушка и необходимость размола также требуют больших
энергозатрат.
. Внесение бария на стадии синтеза гидроксида никеля не приводит к
улучшению качества продукта, но усложняет технологический процесс.[12]
Другой известный способ включает после осаждения гидроксида никеля (II),
так как описано выше, отделение маточного раствора, отжим осадка, сушку до
определенной влажности, отмывку от примесей и вторую сушку. После первой сушки
в пасту вводят раствор, содержащий ионы кобальта. После операции первой сушки
от партии полуфабриката отбирают лабораторную пробу и проводят прогноз качества
получаемой партии продукта. Если лабораторная проба не соответствует
требованиям ТУ по удельному объему, получаемую партию продукта обрабатывают
3%-ным раствором щелочи в соотношении 1 г щелочи на 10-15 г гидроксида никеля и
доводят до готового продукта.
Способ обладает следующими недостатками.
. Высокая трудоемкость, большие затраты времени и энергоресурсов при
отделении маточника от гидрофильного осадка гидроксида никеля (II).
. Большие энергозатраты на двукратную сушку, размол и классификацию
конечного продукта.
. Внесение бария на стадии синтеза гидроксида никеля и пропитка осадка
после первой сушки раствором кобальта не приводят к улучшению качества целевого
продукта, но усложняют технологический процесс.
. Активирование гидроксида никеля добавками бария и кобальта препятствует
использованию продукта в других отраслях техники.
. Введение операции по прогнозу качества и его корректировки повышает
трудоемкость процесса.[13]
Еще один из способов получения гидроксида никеля (II), включающий его
осаждение взаимодействием раствора гидроксида щелочного металла с солью никеля
(II), отмывку осадка от примесей, его отжим и сушку, отличающийся тем, что
осаждение гидроксида никеля (II) ведут введением кристаллогидрата сульфата
никеля (II) в подогретый 15-30%-ный раствор гидроксида щелочного металла,
отмывку проводят обработкой пульпы гидроксида никеля в колонне в режиме
противотока при линейной скорости восходящего потока 5-8 м/ч с наложением
пульсационных возмущений последовательно раствором щелочи и водой, отжатый осадок
гидроксида никеля (II) после сушки просеивают.
При этом гидроксид никеля (II) осаждают раствором гидроксида натрия при
65-80°С при Т:Ж=1:(4-7), осадок гидроксида никеля (II) отмывают от примесей
3-5%-ным раствором щелочи при 45-70°С. Сушку целевого продукта ведут в
электромагнитном поле СВЧ [14]
.4.2 Лабораторные химические методы получения Ni(OH)2
Способ получения гидроксида никеля (II) в щелочной среде с контролем рН.
Это способ получения гидроксида никеля путем введения рассчитанного количества
соли никеля, с концентрацией более или равной однонормальному раствору, в
раствор гидроксида щелочного металла с рН 12-13. Смесь перемешивают,
поддерживая рН 12-13 добавлением раствора щелочи [15].
Метод получения структурномодифицированого гидроксида никеля (II) с
гидроксидом аммония при перемешивании, повышении температуры и давления. Это
метод получения структурно - модифицированного гидроксида никеля, используемого
для положительных электродов в щелочных электрохимических элементах. Процесс
включает: приготовление реакционной смеси из раствора гидроксида аммония,
гидроксида щелочного металла и источника ионов никеля; перемешивания смеси при
повышении температуры и давления и формирования Ni(OH)2.
Способ получения гидроксида никеля (II) вместе с гидроксидом бария в
условиях, которые отличаются от промышленных. Этот способ включает
приготовление исходных растворов гидроксида щелочного металла, соли (II) и
гидроксида бария, смешивания их, осаждения гидроксида никеля (II), отделение
маточного раствора, обработку щелочью в автоклавах в интервале температур от
130º до 200ºC, отмывания осадка и его сушки.
Обработку щелочью ведут при концентрации гидроксидов ионов в жидкой фазе
пульпы, которая равна 0,05-0,3 г - ион / л. Отмывание осадка проводят в три
стадии: на первой стадии водой, на второй - раствором гидроксида бария с
концентрацией 2-6% и в количестве, обеспечивающем массовое соотношение раствора
к осадку (1-2): 1, и на третьей стадии снова водой. Способ простой, исключает
длительную и энергоемкую операцию сушки осадка перед отмыванием. В продукте
уменьшается содержание водорастворимых примесей [16].
.4.3 Лабораторные физико-химические методы получения Ni(OH)2
Получение сферических порошков гидроксида никеля (II) с добавкой
гидроксидов кобальта, кадмия, цинка. Полученные порошки имеют более высокую
плотность, значительно меньший объем пор и меньший размер кристаллов. Порошки
гидроксида никеля, имеющие меньшие размеры кристаллитов, имеют более высокие
электрохимические характеристики. Для обычного использования целесообразно
применять добавку Co2+, а для более широкого температурного
интервала добавку Ca2+. Отмечено улучшение продолжительности
циклирования электрода при добавлении к гидроксиду никеля ионов цинка. Это
связано с уменьшением набухания электрода вследствие снижения образования g-NiOOH [17].
Ультразвуковой метод получения a гидроксида никеля с межплоскостным расстоянием 7,2 Å.
Указанный метод является
самым простым методом получения a гидроксида никеля. Полученный a гидроксид никеля исследовали методами порошковой
рентгенографии, электронной микроскопии, термогравиметрический анализ и FT - IR
спектроскопии. Синтезированный гидроксид имеет высокую устойчивость в среде KOH
и может представлять интерес с точки зрения применения во вторичных щелочных
аккумуляторах [18].
1.4.4 Лабораторные электрохимические методы получения Ni(OH)2
Метод электрохимического синтеза Ni(OH)2 заключается в
осаждении Ni(OH)2 из раствора ионами ОН-, которые
образуются на катоде при электролизе соли никеля. Метод впервые был предложен
для локальной утилизации никеля из разбавленных промывных вод гальванических
производств. Основным преимуществом метода электрохимического синтеза Ni(OH)2
является простая возможность тонкой регулировки и поддержания оптимальных
условий протекания процесса, и в конечном счете качества продукта, путем
варьирования токовой нагрузки. В электрохимическом синтезе имеются широкие
возможности раздельного регулирования концентраций отдельных компонентов и
времени реакции (рост кристаллов).
Важно и то, что анодная камера может содержать вместо щелочи нейтральную
соль, хотя при этом задача усложняется из-за необходимости применения
устойчивых в кислой среде анодных материалов.
Одним из перспективных научных направлений является использование
электрохимического синтеза для конструирования наноструктурных материалов. Суть
его заключается в формировании в ходе кинетически контролируемого
электровосстановления двухмерных (ленгмюровских) монослоев металлических
наночастиц под монослойный матрицами. Основными преимуществами метода является
экспериментальная доступность и возможность контроля и управления процессом
получения наночастиц.
Полуэмпирическая модель электрохимического импрегнирования гидроксидом
никеля (II) катодных пластин щелочных аккумуляторов. Электрохимическое
импрегнирование проводили в 3М растворе Ni(NO3)2 при 55°С
и рН 4,5. Количество катодного Ni(OH)2 определялось как масса
осажденного гидроксида никеля, приходящаяся на единицу объема пор исходной
катодной пластины. Увеличение количества катодного гидроксида никеля приводит к
снижению выхода по току (эффект связан с блокированием пор и вызванным этим
затруднением доступа электролита), а также к росту степени деформации электрода
[19].
Получение электрохимическим путем гидроксида никеля (II) из порошка никеля.
Процесс включает в себя добавление порошка никеля в однородный раствор (и
добавления OH-ионов), содержащий ионы аммония; контроль уровня рН водного
раствора и добавления OH-ионов электролизом воды, формирования Ni(OH)2
[20].
.4.5 Синтез гидроксида никеля с формированием частиц заданной формы и
структуры, которые могут оптимизировать характеристики Ni(OH)2.
Работы, связанные с улучшением характеристик электродов из гидроксида
никеля, сфокусированы на формировании порошка сферической формы. Сферическая форма
частиц порошка гидроксида никеля препятствует развитию внутренней пористой
структуры, увеличивая, таким образом, плотность активного материала. В
суперконденсаторах заряд-разрядные процессы протекают на поверхности частиц, в
отличии от аккумуляторов. Существует метод синтеза гидроксида никеля с
фрактальной геометрией частиц - "Pseudo-Single" Ni(OH)2. Данный
метод синтеза авторами был назван называется синтезом «Монпелье»
[21].
В тефлоновом стакане на 50 мл нагревается до 170°С смесь 50,6 г
гидроксида натрия и 16г воды. Стакан должен быть снабжен обратным холодильником
и магнитной мешалкой. По прошествии полутора часов, когда все гранулы щелочи
растворятся, при интенсивном перемешивании добавляется по каплям водный раствор
2 г Ni(ClO4)2 • 6H2O в 2 г H2O. Эту
смесь необходимо выдержать при 140°С и перемешивании в течение 24 ч. Таким
образом получаем оливково-зеленый грубый кристаллический осадок в нижней части
стакана. Уоллнером и Геттером было заявлено, что эта фаза является никеллатом
натрия - Na2[Ni(OH)4] (промежуточная фаза). После этого
перемешивание отключается и дается некоторое время раствору отстояться. Затем
большая часть жидкости над осадком, т.е. высоко концентрированного раствора
гидроксида натрия, удаляется и добавляется чистая вода (около 30 мл). Эту смесь
выдерживается в течение 24 ч при 170°C и перемешивании. Происходит горячий
гидролиз никелата натрия. По окончании времени гидролиза осадок, т.е.
светло-зеленый порошок, промываем несколько раз водой до достижения нейтральной
реакции рН, а затем этанолом, чтобы удалить избыток воды. И сушим его при 100
°С в течение 1 ч в сушильном шкафу.
Как первоначально сообщили Шолдер и Гислер [22], промежуточная фаза может
быть выделена путем устранения избытка концентрированного раствора NaOH. Полученную
промежуточную фазу промываем с помощью изоамилового спирта во избежание
гидролиза. С помощью электронного сканирующего микроскопа мы можем увидеть
различия в конфигурации частиц никелата натрия и гидроксида никеля (рис 1.11,
1.12).
Рис 1.11 Сканирующая электронная микроскопия Na2[Ni(OH)4].
Микрометрические шестигранные частицы (a) и вид боковой кромки (b).
Рис 1.12 Сканирующая электронная микроскопия β-Ni(OH)2: вид базисной плоскости (a) и (b) и сбоку на
самом высоком увеличении (c).
Из рисунка 1.12 мы видим, что шестигранник основной частицы состоит из
большого количества более мелких шестигранников, то есть обладает весьма
развитой поверхностью.
В развитие описанного метода синтеза был предложен синтезе «Днепр», в
котором в качестве прекурсора используется перхлорат никеля с добавлением
перхлоратов других металлов.
Во многих научных статьях рассматриваются методы получения двойных
слоистых гидроксидов. Основной принцип заключается в том, что смешиваются два
раствора, содержащие ионы металла (Ni и Al, Co, Mn, Fe, Zn) и концентрированная
щелочь. Получаются гидроксиды, в которых часть ионов Ni замещается на ионы
металлов, вводимых вместе с ионами никеля. При добавлении катионов металлов
сильно увеличивается активность гидроксида никеля. Выбор металлов обосновывался
тем, чтобы они могли создавать двойные гидроксиды. Слоистыми они получили
название потому, что слой катионов чередуется со слоем содержащим воду. В
свинцовых аккумуляторах, в электролите, алюминий является ядом, но при
получении двойных гидроксидов увеличивает активность никеля.
Идея получения двойных гидроксидов легла в основу синтеза «Днепр». Было
предложено вводить небольшое количество алюминия, в отличие от метода получения
слоистых двойных гидроксидов, в котором вводилось большое количество каждого
элемента (Ni и Al). Алюминий - трехвалентный металл и попадая в кристаллическую
решетку, создаёт дополнительный заряд, который должен быть компенсирован
большим количеством анионов OH-. Введенный алюминий, даже в
небольших количествах сильно увеличивает активность гидроксида никеля. Алюминий
в отличие от никеля, не переносит заряд и является балластом. Также он самый
легкий металл из тех, которые можно использовать в синтезе. Из выше сказанного
следует, что алюминий, является балластом, не участвующий в заряде-разряде, но
благодаря своему небольшому весу и приданию гидроксиду никеля высокой
активности, был рассмотрен как наилучший металл для использования в данном
синтезе.
В дипломной работе студента нашего университета Ратканова Александра [22]
был рассмотрен синтез «Днепр» с добавкой алюминия (3, 5 и 10% масс). Результаты
анализов и электрохимических исследований показали, что наилучший результат
показал гидроксид никеля с добавлением 3% алюминия, полученный горячим
гидролизом (рис 1.13, 1.14).
Рис 1.13 Емкости различных образцов, мА·ч/г.
а)б)
Рис 1.14 Сканирующая электронная микроскопия β-Ni(OH)2 на самом высоком увеличении (а) Ni-Al 3% горячий гидролиз, (б) Ni-Al 10% горячий
гидролиз.
Так как наилучшие результаты показали образцы с меньшим содержанием
алюминия, то нами было решено исследовать образцы с меньшим содержанием
алюминия, а именно 3% для воспроизведения предыдущих результатов, 1 и 0,5% для
изучения более малых добавок.
Кроме того, уже после завершения исследований по теме дипломной работы
Александра [22], был обнаружен интересный факт. При выполнении исследования
были приготовлены два запасных образца раствора перхлората никеля с добавкой
перхлората алюминия (3% и 5%). Эти образцы не были использованы, и после 3-х
месяцев хранения в закупоренных пробирках на их дне был обнаружен светлый
осадок. Было высказано предположение, что данный осадок - это гидроксид или
гидроксоперхлорат алюминия. И если это так, то данные дипломной работы [22]
необходимо переосмыслить, т.е. вероятнее всего алюминий в исходном растворе
находился уже в виде коллоидной системы, что существенно изменяет и усложняет
его вхождение в решётку гидроксида никеля. Для уточнения этого вопроса
необходимо провести синтез гидроксида никеля с добавкой алюминия, в условиях
предотвращения гидролиза последнего.
.5 Постановка задачи исследования
Поэтому целью настоящей дипломной работы является изучение влияния
доппирования алюминием на свойства гидроксида никеля, полученного синтезом
«Днепр», при условии подавления гидролиза алюминия в исходном растворе. Для
достижения этой цели необходимо решить следующие задачи:
) Приготовить раствор перхлората никеля с добавками 0,5%, 1% и 3%
алюминия, с выпариванием под вакуумом с добавлением избытка хлорной кислоты
(для подавления гидролиза).
) Провести двухступенчатый высокотемпературный синтез (синтез «Днепр»).
) Изучить свойства полученных порошков.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
.1 Методики проведения исследования
.1.1 Синтез прекурсора для получения гидроксида никеля
Для получения β-Ni(OH)2 в качестве прекурсора используем перхлорат никеля,
но, в связи с его высокой стоимостью и сложностью приобретения, мы решили его
предварительно синтезировать.
Для начала получаем основный карбонат никеля (промежуточное вещество):
раствор сульфата никеля смешиваем с карбонатом натрия до получения основного
карбоната никеля (реакция 2.1).
2NiSO4 + Na2CO3 + 2H2O
= Ni2CO3(OH)2 ↓+ Na2SO4
+ H2SO4 (2.1)
Для этого взвешиваем 276,5 г NiSO4•7H2O и
растворяем в 1 л дистиллированной воды. Затем взвешиваем 156,5 г Na2CO3
и растворяем в 1 л дистиллированной воды при нагревании до 95°C и перемешивании
магнитной мешалкой. Раствор сульфата никеля фильтруем с помощью фильтровальной
бумаги. Затем медленно по каплям с помощью делительной воронки (рис 2.1)
добавляем раствор сульфата никеля в раствор карбоната натрия.
Рис 2.1 Установка для получения основного карбоната никеля.
Осадок отстаивается в течение ночи, затем осветленный раствор сливается
методом декантации. Добавляем дистиллированную воду, отстаиваем и снова
декантируем для удаления избытка сульфатов. Затем вновь добавляем воду и
фильтруем на вакуум-фильтре в воронке Бюхнера, периодически добавляя воду.
С помощью полученного основного карбоната никеля и хлорной кислоты
получаем перхлорат никеля. Отфильтрованный осадок растворяем в 132,92 мл
хлорной кислоты при нагревании и интенсивном перемешивании магнитной мешалкой.
При этом наблюдается интенсивное выделение пузырьков углекислого газа (реакция
2.2):
(NiOH)2CO3 + 2HClO4 =
Ni(ClO4)2 + CO2 + 2H2O (2.2)
Основный карбонат берем в полуторном избытке, для того, чтобы хлорная
кислота прореагировала полностью (избыток основного карбоната остается в
осадке). По мере протекания реакции раствор окрашивается в зелёный цвет, что
свидетельствует об образовании перхлората никеля (II). Далее мы фильтруем
полученный раствор на вакуум-фильтре, добавляя небольшое количество воды для
извлечения нужного нам перхлората из осадка и волокон фильтра.
Данный раствор нам нужно разделить на 6 равных частей, поэтому полученный
объём раствора (1024,4 мл) доводим до 1200 мл для упрощения разделения. Далее
разделили раствор на 6 порций по 200 мл раствора в каждую.
Затем готовим перхлорат алюминия, который добавляем к трем порциям
перхлората никеля в процентном соотношении 0,5; 1; 3% алюминия к никелю.
Вначале получаем основный карбонат алюминия. Для этого взвешиваем на
аналитических весах 5,345 г сульфата алюминия 18-ти водного и растворяем его в
воде. Затем взвешиваем 3,83 г карбоната натрия и также растворяем его в воде.
При нагреве до 65 °С и перемешивании добавляем по каплям раствор сульфата
алюминия в раствор соды (реакция 2.3)
Al2(SO4)3 + 2Na2CO3
+ 2H2O = 2AlCO3(OH) ↓+ 2Na2SO4
+ H2SO4 (2.3)
Полученный осадок отфильтровываем на воронке Бюхнера и промываем его
водой. Данный осадок растворяем в 1,63 мл хлорной кислоты с добавлением
небольшого количества воды. Отфильтровываем непрореагировавший осадок на
воронке Бюхнера. Полученный раствор доводим до объема кратного 9 (81 мл) для
удобства разделения на порции. В растворы перхлората никеля добавиляем растворы
перхлората алюминия соответственно 1/9, 2/9 и 6/9 исходного раствора перхлората
алюминия для получения 0,5%, 1% и 3% добавки алюминия соответственно.
Затем необходимо удалить лишнюю воду путём упаривания под вакуумом (рис
2.2). Для предотвращения гидролиза при выпаривании добавляем 2 мл хлорной
кислоты.
Рис 2.2 Схема вакуумной выпарной установки
Выпаривание ведем до массы раствора 80 г. Затем разделили раствор на 2
части массой 40 г для полного и половинного синтезов.
2.1.2 Получение β-Ni(OH)2 двухступенчатым высокотемпературным синтезом
ступень. Синтез никелата натрия.
Взвешиваем 506 г чистого гидроксида натрия и отмеряем 160 мл
дистиллированной воды.
Помещаем щёлочь, магнитную мешалку и воду в тефлоновый стакан с
закручивающейся крышкой. Тефлоновый стакан ставим в алюминиевую емкость,
наполненную силиконовым маслом. В отверстие крышки стакана вставляем нижнюю
часть обратного холодильника, обмотанную фумом для более плотной фиксации.
Холодильник охлаждается проточной водопроводной водой.
Щёлочь нагреваем до 170°C при интенсивном перемешивании магнитной
мешалкой. Достигнув температуры 170°C щелочь должна выстоять некоторое время
(около часа) для полного растворения ее кристаллов. Затем к ней добавляем по
каплям раствор перхлората никеля массой 33,35 г и снижаем температуру среды до
140°C. Данную смесь оставляем при нагревании и перемешивании на 24 часа.
ступень. Гидролиз никелата натрия с получением гидроксида никеля.
В исследовании была принята схема с использованием двух видов гидролиза:
холодный гидролиз и горячий гидролиз. Оба вида гидролиза проводятся в течение
24 часов.
Холодный гидролиз.
По истечении 24 часов синтеза пипеткой через отверстие в крышке отбираем
350 мл раствора и добавляем его в большой объём холодной дистиллированной воды.
Таким образом, проводится холодный гидролиз с образованием гидроксида никеля.
Горячий гидролиз.
После удаления 350 мл раствора из реакционного тефлонового стакана 350 мл
дистиллированной воды медленно добавляется через верхнюю часть обратного
холодильника. Обратный холодильник предотвращает выкипание воды из стакана.
Реакционную смесь оставляем при 140°C и интенсивном перемешивании.
.1.3 Получение порошка гидроксида никеля как готового продукта
После окончания гидролиза, полученные осадки отфильтровываем на
вакуум-фильтре и многократно промываем их от щелочи дистиллированной водой до
нейтральной среды. Полученные осадки сушим в сушильном шкафу при 60°C.
Полученные образцы хранятся в пакетах со струнным замком без доступа воздуха.
.1.4 Способы оценки и изучения свойств полученных образцов гидроксида
никеля
Правильность проведения 1 стадии синтеза возможно контролировать
визуально по цвету маточного раствора, извлекаемого из реакционого стакана.
Раствор в пипетке должен быть оливково-зеленоватого цвета.
По данным ранее проведённых исследований цвет полученных образцов
гидроксида никеля должен быть от белесого светло-салатного до
грязновато-зеленоватого.
Для оценки формы частиц может быть использована электронная микроскопия.
3. Методы анализа
.1 Метод рентгенофазового анализа [35]
Рентгеновский структурный анализ - это методы исследования структуры
вещества по распределению в пространстве и интенсивностям рассеянного на
анализируемом объекте рентгеновского излучения. Рентгеноструктурный анализ
наравне с нейтронографией и электронографией является дифракционным структурным
методом. В основании данного метода лежит взаимодействие рентгеновского
излучения с электронами вещества, в результате чего возникает дифракция
рентгеновских лучей. Дифракция рентгеновских лучей - это рассеяние
рентгеновского излучения кристаллами вещества (или молекулами жидкостей и
газов), при котором из исходного пучка лучей возникают вторичные отклонённые
пучки той же длины волны, которые возникают в результате взаимодействия
первичных рентгеновских лучей с электронами вещества; направление и
интенсивность вторичных пучков зависят от строения рассеивающего объекта.
Дифракционная картина зависит от длины волны используемых рентгеновских
лучей и строения объекта. Для исследования атомной структуры применяют
излучение с длиной волны 1ангстрем, т. е. порядка размеров атомов. Данными
методами изучают металлы, сплавы, минералы, неорганические и органические
соединения, полимеры, аморфные материалы, жидкости и газы, молекулы белков,
нуклеиновых кислот и т.д. Наиболее успешно этот метод применяется для
установления атомной структуры кристаллов. Это обусловлено тем, что кристаллы
обладают строгой периодичностью строения и представляют собой созданную самой
природой дифракционную решётку для рентгеновских лучей.
Метод позволяет определить атомную структуру вещества, включающую в себя
пространственную группу элементарной ячейки, ее форму и размеры, а также
определить группу симметрии кристалла.
Кристаллическая решетка - пространственное периодическое расположение
атомов или ионов в кристалле. В заданном направлении кристаллическая решетка
может рассматриваться как серия параллельных плоскостей, находящихся на
расстоянии d друг от друга. Любое кристаллическое вещество характеризуется
определенным набором межплоскостных расстояний d с различными ориентациями
плоскостей. Когда монохроматизированный рентгеновский луч с длиной волны λ
падает на систему
кристаллических плоскостей под углом θ, дифракция возникает, только если пути
проходимые лучами, отраженными от различных кристаллических плоскостей,
различаются на целое число длин волн. Это явление описано законом Брэгга:
При изменении угла θ, условия закона Брэгга удовлетворяются попеременно для
различных систем плоскостей в поликристаллическом материале, в результате чего,
на дифрактограмме исследуемого вещества последовательно, с изменением угла,
появляются рентгеновские рефлексы - пики (линии дифрактограммы) с явным
максимумом. Высота и координаты пиков характеризуют исследуемое вещество. Эти
данные передаются в программное обеспечение, где обрабатываются в зависимости
от вида исследований.
Идентификация и количественное определение фаз (фазовый анализ)
Наиболее распространенный вид дифрактометрических исследований -
идентификация фаз и количественный анализ фазового состава образца.
Дифрактограмма образца состоит из двух кристаллических фаз с разными размерами
кристаллитов и аморфной фазы. Каждой фазе образца соответствуют свои пики
дифракции рентгеновского излучения. Остроконечные пики получены от
кристаллических фаз образца, а нелинейный фон - от аморфной фазы.
Дифрактограмма содержит пики от всех фаз образца независимо от их числа. По
положению пиков дифрактограммы определяют, какие кристаллические фазы
присутствуют в образце т.е. происходит распознавание фаз. Идентификация
производится путем нахождения в базе данных таких же рентгеновских пиков, как
на дифрактограмме исследуемого образца. По высоте (интенсивности) пиков
производят количественный анализ кристаллических фаз, то есть определяют
концентрацию каждой кристаллической фазы образца. По интенсивности нелинейного
фона определяют суммарное содержание аморфных фаз.
.2 Метод дифференциального термогравиметрического анализа [36-39]
Термогравиметрический анализ (TGA) основан на непрерывной регистрации
изменения массы образца в зависимости от времени или температуры при нагревании
в соответствии с выбранной температурной программой в определенной газовой
атмосфере.
В классических методах термического анализа (ТА) осуществляется прямое
измерение температуры образца в процессе нагревания или охлаждения (T) и
фиксируется изменение какого-либо свойства, например, веса (TG - анализ).
Чувствительность метода можно увеличить, используя дифференциальное устройство.
При этом возникает возможность регистрировать вместо температуры образца
разность температур образца и какого-либо эталона сравнения, находящегося в
аналогичных с образцом условиях. Таким наиболее распространенным методом
является дифференциальный термический анализ (DTA), в котором с помощью
термопар измеряется разность температур образца и эталона. В классическом
варианте образец и эталон находятся в двух камерах. Измерение разности
температур выполняется с помощью термопар, спаи которых погружены в
порошкообразный образец и эталон. Дифференциальный термогравиметрический анализ
(DTG) отлично дополняет традиционную термогравиметрию (TG), позволяя в одном
эксперименте, наряду с изменением веса образца, фиксировать скорость этого
процесса.
Измерительная система разрешает многократно нагревать и охлаждать образец
с контролируемой скоростью, а также проводить изотермические измерения.
.3 Метод дифференциальной сканирующей калориметрии [37]
В методе дифференциальной сканирующей калориметрии (ДСК) теплоту
определяют через тепловой поток - производную теплоты по времени (отсюда в
названии термин «дифференциальный»). Тепловые потоки измеряются по разнице
температур в двух точках измерительной системы в один момент времени :
Φ~ΔT = T(x2)−T(x1)
= f (x). (3.1)
Измерения можно проводить как в изотермических условиях, так и в
динамическом режиме при программируемом изменении температуры оболочки
(нагревателя). Калориметры такого типа называют «сканирующими». В современных
приборах предусмотрена возможность задавать различные температурные программы.
Линейное нагревание/охлаждение с заданной скоростью
β: TF =T0 + β t, (3.2)
где TF -
температура нагревателя (furnace, F), T0 - начальная температура
измерительной системы, β - скорость изменения температуры нагревателя, t -
время. Скорость изменения температуры может варьироваться в широких пределах
(например, от 0.001 до 100º/мин).
Термомодулированный режим (TM-DSC). На линейное изменение температуры
накладываются периодические колебания (ступеньки, зубцы, синусоида):
TF = T0 + β t + TA sin
(wt), (3.3)
где TA -
амплитуда и w - частота колебаний температуры).
Комбинация различных температурных сегментов (изотермических,
динамических, модулированных).
Теория любого экспериментального метода создается на основе
математической модели измерительной системы и протекающих в ней процессов.
Любая теоретическая модель описывает реальную систему в некоторых приближениях.
Нулевое приближение
В нулевом приближении описываются системы, в которых не протекают
химические реакции или фазовые переходы. Ниже перечислены ограничения, которые
накладываются на систему при нулевом приближении.
. Стационарное состояние: Φ ≠ f (t). Исключает из
рассмотрения системы, в которых происходят химические или фазовые превращения,
поскольку в этом случае тепловой поток от образца неизбежно зависит от времени.
. Предполагается абсолютная симметрия измерительной системы:
FS = r FR =
r.
. Предполагается, что теплообмен между ячейкой сравнения и образцом
отсутствует: rSR→∞
.
. Не учитывается наличие нескольких границ раздела фаз между образцом
(эталоном) и нагревателем (образец - тигель, тигель - сенсор, сенсор -
теплопроводящая колонка и т.д.).
.Учитывается теплоемкость только образца и эталона (при наличии
последнего); теплоемкости элементов конструкции измерительной ячейки (тиглей,
теплопроводящей колонки и т.д.), разделяющих образец и нагреватель в расчет не
принимаются.
. Предполагается, что измеряемая температура равна температуре образца
(не учитывается пространственное разделение образца и термопары).
. Принимается, что все тепло от нагревателя к образцу передается только
за счет теплопроводности колонки (не учитываются утечки тепла путем теплового
излучения и конвекции).
Скорость изменения температуры образца (эталона) 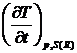 в отсутствии химических или фазовых
реакций приблизительно равна скорости изменения температуры нагревателя β, а производная теплоты по
температуре при постоянном давлении (как правило, эксперименты ДСК проводятся в
изобарном режиме) равна теплоемкости S (R), поскольку теплоемкостями всех
элементов конструкции прибора в нулевом приближении пренебрегают. Получают:
в отсутствии химических или фазовых
реакций приблизительно равна скорости изменения температуры нагревателя β, а производная теплоты по
температуре при постоянном давлении (как правило, эксперименты ДСК проводятся в
изобарном режиме) равна теплоемкости S (R), поскольку теплоемкостями всех
элементов конструкции прибора в нулевом приближении пренебрегают. Получают:
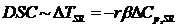 (3.4)
(3.4)
Первое приближение
В первом приближении может нарушаться условие стационарности теплового
потока. Таким образом, в рассмотрение вовлекаются объекты, в которых происходят
фазовые переходы или химические реакции.
Если в образце происходит химическая реакция, то он выделяет или
поглощает теплоту. В результате генерируется дополнительный тепловой поток Фr, причем Фr > 0 для эндотермических реакций
(процессов, протекающих с поглощением теплоты) и Фr < 0 для экзотермических (процессов, протекающих с
выделением теплоты). В этом случае тепловой поток от нагревателя к образцу
определяется двумя факторами: теплоемкостью образца и теплотой протекающего в
нем процесса
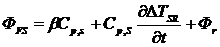 (3.5)
(3.5)
Необходимо обратить внимание на то, что скорость изменения температуры
образца, в котором протекает реакция, 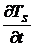 , будет отличаться от скорости
изменения температуры эталона
, будет отличаться от скорости
изменения температуры эталона 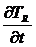 , которую можно считать равной заданной скорости изменения
температуры нагревателя β.
, которую можно считать равной заданной скорости изменения
температуры нагревателя β.
Эталон заведомо выбирается инертным в изучаемом диапазоне температур
(либо ячейка сравнения оставляется пустой), в нем не происходит никаких
экзо/эндотермических процессов.
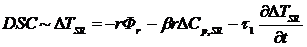 (3.6)
(3.6)
Из формулы 3.3 мы видим, что измеряемый сигнал не пропорционален потоку Фr. Помимо второго слагаемого,
определяющего асимметрию измерительной системы за счет различия теплоемкости S
и R, сигнал запаздывает относительно спровоцировавшего его события (реакции).
Время запаздывания зависит от термической инерционности измерительной системы
(конструкции прибора и природы образца), оно определяется первой константой
времени 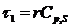 .
.
Второе приближение
Выражения для экспериментального сигнала усложняются при дальнейшем
приближении модели к реальным условиям эксперимента. Во втором
приближении отменяются ограничения 1 и 6 из нулевого приближения.
Датчик термопары, измеряющей температуру, не расположен непосредственно в
образце или эталоне. Он находится на некотором расстоянии и отделен границами
раздела фаз. Таким образом, измеряемая температура несколько запаздывает
относительно реальной температуры образца. Время запаздывания характеризует
вторая константа времени
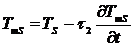 (3.7)
(3.7)
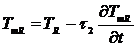 (3.8)
(3.8)
Где TmS, TmR - измеряемая температура образца и
образца сравнения соответственно, TS, TR
- их истинная температура, τ2 = t2 -t1 - вторая константа
времени. Величина τ2 зависит от скорости теплообмена между
образцом и датчиком термопары (теплопроводности и толщины слоя образца,
плотности прилегания образца ко дну тигля и дна тигля к сенсору, толщины дна
тигля и его материала, расстояния от тигля до датчика). Обычно предполагается,
что от характеристик образца и эталона τ2 зависит слабо, и она одинакова для обеих измерительных
ячеек. Тогда из (3.4) и (3.5) получаем:
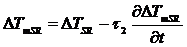 (3.9)
(3.9)
Комбинируя выражения 3.3 и 3.6 получаем выражение для измерения сигнала
ДСК во втором приближении (3.7).
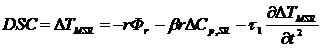 (3.10)
(3.10)
Дальнейшее усложнение модели измерительной системы приводит к усложнению
и уточнению полученных соотношений. На практике обычно ограничиваются вторым
приближением.
Характеристики аномалий на кривых ДСК
Аномалией называется любое отклонение от монотонного изменения зависимости
сигнала от времени. Такие отклонения возможны при протекании в образце
процессов, связанных с выделением или поглощением теплоты (химических реакций,
фазовых переходов первого рода) или с резким изменением теплоемкости образца
(стеклование, фазовые переходы второго рода).
.4 Метод сканирующей электронной микроскопии [45]
Принцип действия сканирующего электронного микроскопа заключается в том,
что электроны, испускаемые нагретым вольфрамовым или LaBe катодом фокусируются
магнитными линзами в точку диаметром ~10 нм. Применение катодов с полевой
эмиссией позволяет получить электронный луч более малого диаметра. Используется
ускоряющее напряжение от 1 до 50 кВ. величина тока пучка электронов на
поверхности варьируется от 10-6 до 10-11 А. Электронный
луч быстро сканирует исследуемый участок поверхности и модулирует яркость
второго электронного луча, двигающегося синхронно с ним по экрану микроскопа.
Увеличение микроскопа регулируется изменением силы тока в обмотках
электромагнитных линз, нормальный диапазон увеличений 10-50 000. Изображение
выводится на высокоразрешающий экран электронно-лучевой трубки с разрешением на
трубке 0,1 мм, что при увеличении 10 000 соответствует 10 нм на поверхности
образца. Яркость каждой точки на телевизионном изображении определяется
величиной сигнала с детектора электронов, который приблизительно равен 10-14
А и поэтому должен быть усилен с помощью электронного умножителя или обычного
усилителя. Четкость изображения поверхности при больших увеличениях
определяется уровнем шумов в электронных схемах.
Обратноотраженные электроны образуются при рассеянии первичных электронов
на большие (до 90°) углы в результате однократного упругого рассеяния или в
результате многократного рассеяния на малые углы. При энергии первичного пучка
от 10 до 20 кэВ примерно 50 % от общего числа образующихся вторичных и
обратноотраженных электронов достигают поверхность.
Распределение вторичных электронов по энергиям зависит от энергии
первичного пучка электронов, числа электронов во внешней оболочке атома,
радиуса атома и наиболее сильно от величины потенциального барьера на
поверхности материала. Максимум распределения вторичных электронов
соответствует энергии на порядок меньшей, чем энергия первичного пучка.
Вероятность вылета низкоэнергетического вторичного электрона экспоненциально
уменьшается с глубиной генерации. Более половины вторичных электронов
излучается с глубины ~0,5 нм. Очевидно, что обратноотраженные электроны имеют
достаточную энергию для выбивания электронов из оболочек атомов и тем самым
увеличивают шумовую составляющую в спектре вторичных электронов и уменьшают
пространственное разрешение. Количество образующихся вторичных электронов слабо
зависит от атомного номера элемента. Основным параметром, определяющим выход
вторичных электронов, является угол падения первичного пучка на поверхность.
При падении первичного пучка под наклоном к поверхности исследуемого образца,
вся возбуждаемая электронным лучом область будет отклонена от нормали и выход
вторичных электронов возрастет. Таким образом, вариации наклона микроучастков
поверхности вызывают резко выраженные изменения в выходе вторичных электронов.
Этот эффект используется для получения информации о топографии поверхности. Ряд
методик обработки сигнала вторичных электронов используется для извлечения
дополнительной информации или повышения качества изображения, например:
методика подавления уровня шумов, состоящая в дифференцированном усилении
сигнала, что дает усиление контраста на телевизионном изображении или на
фотоснимке; методика нелинейного усиления, когда усилие контраста производится
в определенном диапазоне интенсивностей сигнала на телевизионной трубке, что
позволяет наблюдать детали на относительно темных участках изображения. В
методе у-модуляции на телевизионной электронно-лучевой трубке луч отклоняется в
вертикальном направлении пропорционально сигналу с детектора, что улучшает
восприятие незначительных изменений в контрасте на фоне больших. Если
используется какая-либо из описанных методик обработки сигнала, то необходимо
более тщательно подходить к интерпретации изображений.
.5 Метод трансмиссионной микроскопии [46]
Электронная микроскопия, совокупность электронно-зондовых методов
исследования микроструктуры твердых тел, их локального состава и микрополей
(электрических, магнитных и др.) с помощью электронных микроскопов (ЭМ) -
приборов, в которых для получения увеличения изображений используется пучок
электронов. Электронная микроскопия включает также методики подготовки
изучаемых объектов, обработки и анализа результатов. Различают два главных
направления электронной микроскопии: трансмиссионную (просвечивающую) и
растровую (сканирующую), основанных на использовании соответствующих типов ЭМ.
С их помощью можно получить качественно различную информацию об объекте исследования
и часто применяются совместно.
Электронный луч - это направленный пучок ускоренных электронов,
применяемый для просвечивания образцов или возбуждения в них вторичных
излучений (напр., рентгеновского).
Ускоряющее напряжение - напряжение между электродами электронной пушки,
которое задает кинетическую энергию электронного луча.
Разрешающая способность (разрешение) - наименьшее расстояние между двумя
элементами микроструктуры, видимыми на изображении раздельно (зависит от
характеристик ЭМ, режима работы и свойств образцов).
Светлопольное изображение - увеличенное изображение микроструктуры,
сформированное электронами, прошедшими через объект с малыми энергетическими
потерями (структура исследуемого образца изображается на экране
электроннолучевой трубки (ЭЛТ) темными линиями и пятнами на светлом фоне).
Темнопольное изображение формируется рассеянными электронами (основной
пучок электронов при этом отклоняют или экранируют) и используется при изучении
сильно рассеивающих объектов (напр., кристаллов). Изображение, по сравнению со
светлопольным, выглядит как негативное.
Оттенение - физическое контрастирование микрочастиц. На образец в
вакуумной установке напыляется тонкая пленка металла; при этом "тени"
(ненапыленные участки) прорисовывают контуры частиц, чем и позволяют измерять
их высоту.
Негативное контрастирование - обработка микрочастиц на пленке-подложке
растворами соединений тяжелых металлов (U и др.). В результате данной обработки
частицы будут видны как светлые пятна на темном фоне (в отличие от позитивного
контрастирования, делающего темными сами частицы).
Трансмиссионная микроскопия осуществляется с помощью трансмиссионных
(просвечивающих) электронных микроскопов (ТЭМ). С их помощью тонкопленочный
объект просвечивается пучком ускоренных электронов с энергией 50-200 кэВ.
Электроны, отклоненные атомами объекта на малые углы и прошедшие сквозь него с
небольшими энергетическими потерями, попадают в систему магнитных линз, которые
формируют на люминесцентном экране (и на фотопленке) светлопольное изображение
структуры. При этом возможно достичь разрешения порядка 0,1 нм, что
соответствует увеличениям до 1,5 х 106 раз. Рассеянные электроны задерживаются
диафрагмами, от диаметра которых в значительной, степени зависит контраст
полученного изображения. При изучении более рассеивающих объектов большую
информацию можно получить из темнопольных изображений.
Разрешение и информативность ТЭМ-изображений в основном определяются
характеристиками объекта и способом его подготовки. При исследовании тонких
пленок и срезов полимерных материалов контраст возрастает пропорционально их
толщины, но одновременно снижается разрешение полученного изображения. Поэтому
применяют очень тонкие (не более 0,01 мкм) пленки и срезы, контраст же повышают
обработкой соединениями тяжелых металлов (Os, U, Pb и др.), которые
избирательно взаимодействуют с компонентами микроструктуры (хим.
контрастирование). Ультратонкие срезы полимерных материалов (10-100 нм)
получают с помощью ультрамикротомов, а пористые и волокнистые материалы предварительно
пропитывают и заливают в эпоксидные компаунды. Металлы исследуют в виде
получаемой химическим или ионным травлением ультратонкой фольги. Для изучения
формы и размеров микрочастиц (микрокристаллы, аэрозоли, вирусы, макромолекулы)
их наносят в виде суспензий либо аэрозолей на пленки-подложки из формвара
(поливинилформаль) или аморфного углерода, проницаемые для электронного луча, и
контрастируют методом оттенения или негативного контрастирования.
Для анализа металлической фольги, а также толстых (1-3 мкм) срезов
материалов используют высоко- и сверхвысоковольтные ТЭМ с ускоряющими
напряжениями соответственно 200-300 и 1000-3000 кВ. Это позволяет снизить
энергетические потери электронов при просвечивании образцов и получить более
качественные изображения. Структура гелей, суспензий, эмульсий с большим
содержанием воды может быть исследована методами криорепликации: образцы
подвергают сверхбыстрому замораживанию и помещают в вакуумную установку, где
производится раскалывание объекта и осаждение на поверхность свежего скола
пленки аморфного углерода и оттеняющего металла. Полученная реплика,
повторяющая микрорельеф поверхности скола, анализируется в ТЭМ.
ТЭМ обеспечивает также получение дифракционных картин (электронограмм),
позволяющих судить о кристаллической структуре объектов и точно измерять
параметры кристаллических решеток.
.6 Электрохимические методы исследования
.6.1 Общие данные по методике изучения электрохимических свойств
Изучение электрохимических свойств полученных образцов гидроксида никеля
проводилось методами циклической вольтамперометрии и гальваностатического
зарядно-разрядного циклирования. Проведение обоих типов электрохимических
исследований проводим с помощью электронного потенциостата Elins P-8 в ячейке
ЯСЕ-2. В качестве противоэлектрода используется никелевая сетка, электролит -
раствор 6М КОН. Хлор-серебряный электрод сравнения помещается в отдельную
емкость с насыщенным раствором хлорида калия. Эта ёмкость связана с ячейкой
ЭСЭ-2 с помощью электролитического ключа, заполненного 6М КОН. Основа рабочего
электрода - пеноникель, приваренный точечной сваркой к никелевому фольговому
токоотводу. Рабочая площадь электрода составляет 0,5 см2. На
пеноникелевую матрицу наносят активную массу методом намазывания:
Приготовление активной массы электрода согласно массовому составу: 82,5%
Nі(OH)2, 16% графита, 1,5% ПТФЭ. Взвешивание идет на аналитических
весах из расчета получения 0,5 г готовой сухой активной массы. Также учитываем,
что эмульсия ПТФЭ содержит 60% сухого вещества. При этом составляется таблица и
все результаты расчётов и взвешиваний заносятся в эту таблицу. В качестве
примера приведена табл. 3.1:
Таблица 3.1. Ni-Al 3% горячий
|
Компонент
|
% масс.теор.
|
mтеор., г
|
mпракт., г
|
% масс.практ.
|
|
Ni(OH)2
|
82,5
|
0,4125
|
0,4127
|
82,51
|
|
Графит
|
16
|
0,08
|
0,08
|
15,99
|
|
ПТФЭ
|
1,5
|
Сух. - 0,0075 60% - 0,0125
|
Сух. - 0,0075 60% - 0,0125
|
1,5
|
|
Σ
|
100
|
0,5
|
0,03012
|
100
|
. Вещества указанной массы взвешиваются в бюкс и тщательно смешиваются до
удаления «неоднородностей» (до цвета хаки). Далее по каплям добавляется вода,
пока масса не примет консистенцию густой сметаны;
. Электрод перед нанесением активной массы взвешивается на аналитических
весах;
. Полученная активная масса тщательно вмазывается в поры пеноникеля с
одной стороны электрода с помощью шпателя;
. Намазанный электрод сушится в сушильном шкафу при температуре 90
градусов в течение 15 минут;
. Излишки массы, которые «выпирают» за поверхность электрода тщательно
удаляются мягкой кисточкой;
. Электрод взвешивается на аналитических весах и результаты взвешивания
заносятся в таблицу;
Таблица 3.2. Ni-Al 3% горячий, результаты взвешивания
электродов
|
Электрод
|
mдо
|
mпосле
|
Δm
|
m(NiOH)2
|
|
1
|
0,3432
|
0,3558
|
0,0126
|
0,0104
|
|
2
|
0,4036
|
0,4201
|
0,0165
|
0,0136
|
|
3
|
0,3530
|
0,3750
|
0,022
|
0,0182
|
Из одной активной массы изготавливается 3-4 электрода: 2 для
гальваностатического зарядно-разрядного циклирования, 1-2 (с наибольшей массой
намазки) для снятия циклических вольамперограмм.
.7.2 Циклическая вольтамперометрия [40-44]
С целью повышения информативности электрохимического метода исследования
применяют вольтамперометрию - наблюдение за изменением (при изменениях состава
контролируемого раствора) вольтамперной характеристики
("вольтамперограммы"), т.е. зависимости электрического тока через
электрохимический элемент от приложенного напряжения. Циклическая
вольтамперометрия является весьма ценным способом обнаружения числа
присутствующих в растворе электроактивных веществ, одновременно пригодным для
установления обратимости электродного процесса. Этот метод применим для
изучения кинетики электродных процессов и определения устойчивости
присутствующих веществ.
Для записи вольтамперограммы контролируемый раствор заливают в
электрохимическую ячейку с двумя или тремя электродами. Один из них
("измерительный" или "индикаторный") имеет относительно
небольшие размеры. Площадь поверхности второго ("вспомогательного")
намного больше, чтобы при протекании тока перепад потенциала на нем практически
не изменялся. Как правило, в контролируемый раствор добавляют индифферентный
электролит большой концентрации, чтобы уменьшить падение напряжения на его
омическом сопротивлении. Для полной компенсации омического падения напряжения в
электролите иногда применяют третий электрод ("электрод сравнения") и
потенциостатирование. В простейшем случае, пошагово накладывая на электрод всё
большее внешнее напряжение и измеряя протекающий ток, снимают
"статическую" вольтамперную характеристику. По данной характеристике
можно судить о составе исследуемого раствора. Дело в том, что каждый вид ионов
имеет свой характерный электрохимический потенциал. При постепенном повышении
потенциала на измерительном электроде в первую очередь в электрохимическую
реакцию вступают ионы с наименьшим электрохимическим потенциалом. Это приводит
к возрастанию тока. По набору потенциалов, при которых имеет место возрастание
тока, можно судить о видах присутствующих в исследуемом растворе ионов. А по
высоте пиков тока можно судить о концентрации соответствующего вида ионов в
растворе (чем выше их концентрация, тем интенсивнее происходит электродная
реакция, и тем больше протекающий ток). Описанный метод «статической»
вольтамперометрии позволяет определять присутствие в растворе ионов в
концентрациях от 10-5 моль/л и выше.
При использовании вольтамперометрии с линейной разверткой потенциала приложенное
к электродам напряжение линейно возрастает со временем от одного до другого
заданного значения, и отслеживаются изменения тока. Благодаря ускорению
процесса наращивания потенциала и возможности дифференцировать получаемый
сигнал по времени удается повысить чувствительность метода до 10-6
моль/л.
Дальнейшим развитием метода стала так называемая "циклическая
вольтамперометрия". В данном методе приложенное к электродам напряжение
сначала линейно нарастет (рис. 3.1,а), а после достижения максимального значения
- линейно убывает до исходного значения. И в процессе изменений измеряют
зависимость тока от напряжения (рис. 3.1,б). Относительно быстрая
"треугольная" развертка потенциала на измерительном электроде
позволяет изучать кинетику и механизм электродных процессов с участием
интересующих пользователя ионов.
Рис. 3.1. Объяснение метода циклической вольтамперометрии: а) зависимость
приложенного напряжения от времени; б) циклическая вольтамперограмма
При малом напряжении ток остается относительно небольшим. Его иногда
называют "фоновым". Вблизи точки А, когда приложенное напряжение
становится сравнимо с контактной разностью потенциалов для исследуемых ионов,
скорость электродных реакций и вместе с ней электрический ток через элемент
начинают заметно возрастать. Концентрация ионов возле поверхности электрода
снижается. Чем выше скорость электрохимической реакции, тем быстрее эта зона
обедняется, вследствие чего скорость реакции уменьшается. В некоторой точке В
ток достигает своего максимального значения и, несмотря на дальнейший рост
приложенного напряжения, начинает спадать в направлении своего стационарного
значения. При уменьшении напряжения, электрический ток продолжает уменьшаться,
проходя через минимум вблизи от точки С.
Вид циклической вольтамперограммы зависит от всех особенностей
происходящих в ячейке электрохимических реакций. Если электрохимические
превращения возле электродов обратимы, то среднее арифметическое значение от
напряжений, при которых достигаются максимум электрического тока (в точке В) и
минимум (в точке С), равняется электродному потенциалу данного элемента. Если
же реакции являются частично или полностью необратимыми, то вышеуказанное
равенство не выполняется, а минимум тока может вообще отсутствовать. Форма
циклической вольтамперограммы зависит и от скорости изменения напряжения. Все
это может давать исследователю много ценной информации относительно кинетики
электрохимических процессов в исследуемом растворе и о его составе.
Цели вольтамперометрического исследования:
а) определить электрохимическую активность образца по наличию пиков
заряда и разряда на циклических вольтамперограммах, а так же изменению токов
этих пиков от цикла к циклу с постоянной скоростью развёртки;
б) получить циклические вольтамперограммы при шести скоростях развертки и
определить коэффициенты диффузии протона.
Для достижения этих целей использовалось два принципа снятия циклических
вольтамперограмм:
) Циклирование при постоянной скорости развертки потенциала 1 мВ/с.
Проводится 5 циклов в интервале потенциалов 0 - 430 мВ (относительно ХСЭ). При
этом происходила проработка активной массы;
) Циклирование с повышением скорости развёртки. Проводится 6 циклов, со
следующими скоростями развертки:
а)
0,99989 mV/s;
б)
2,1874 mV/s;
в)
4,7786 mV/s;
г)
10,453 mV/s;
д)
22,848 mV/s;
е)
49,564 mV/s.
Следует указать, что процесс циклирования с повышением скорости развёртки
проводится сразу после 5 циклов снятия вольтамперограмм с постоянной скоростью
развёртки без замены электрода.
После снятия вольтамперограмм при постоянной скорости производится
пересчет потенциала на стандартную водородную шкалу и песесчет тока на удельный
(А/г). По полученным данным строятся графики вольтамперных кривых и проводится
их анализ. Отмечается ток и потенциал катодного и анодного пиков и рассчитывается
разность катодного и анодного потенциалов. Из результатов расчета получают
соответствующие данные об электрохимической активности образца и стабильности
его работы во времени.
С помощью вольтамперограмм, полученных при различных скоростях развертки,
находят коэффициент диффузии, используя уравнение Рендлса-Шевчика (уравнение
3.11).
I = 2,69 ·105 · n3/2 · S·C·D1/2 ·ν1/2, (3.11)
где ν - скорость розвертки
потенциала, В/с;
n = 1 - число электронов,
участвующих в реакции;
S - истинная поверхность электрода, см2;
C -
максимальная концентрація протонных вакансий, моль/см2 (0,045моль/см3);
I - ток пика, А.
D - коэффициент диффузии, см2/с.
Вольтамперограммы обрабатывают следующим образом:
. Определяют токи и потенциалы положительных и отрицательных пиков;
. Строят зависимость тока пика от корня скорости развертки (Рис );
. С помощью значения тангенса наклона прямой находят коэффициент
диффузии.
Рис. 3.2 График зависимости тока пика от корня скорости развертки
потенциала.
Преобразуя уравнение Рендлса-Шевчика получают:
 , (3.12)
, (3.12)
где а - тангенс угла наклона прямой.
.7.3 Гальваностатическое зарядно-разрядное циклирование
Заряд-разрядное циклирование в суперконденсаторном режиме проводили на
той же установке, что и для снятия циклических вольтамперограмм, с одним
отличием. Для предотвращения отделения активной массы от рабочего электрода при
заряде из-за выделения кислорода, к лицевой части рабочего электрода прижимали
защитную пустую пеноникелевую матрицу с приваренным фольговым никелевым
токоотводом, и фиксировали капроновой нитью. Оба токоотвода (рабочего электрода
и защитной матрицы) подключали к клемме рабочего электрода ячейки ЯСЭ-2. Для
гальваностатического зарядно-разрядного циклирования использовались следующие
габаритные плотности тока.: 10, 20, 40, 80, 120 мА/см2. Для
циклирования на потенциостате Elins P-8 использовали
режим «Программатор», который даёт возможность ручного переключения между
шагами, в режиме гальваностата. В соответствии с площадью рабочего электрода
выставлялось заданное значение тока. При заряде и разряде использовались
одинаковые плотности тока и проводилось по 10 зарядно-разрядных циклов для
одной плотности тока, начиная с меньшей плотности тока. Об окончании заряда или
разряда свидетельствует практически постоянное значение потенциала.
По результатам зарядно-разрядных кривых рассчитываются емкости (С, Ф/г и
Q, mА·ч/г) согласно формуле:
С =  , (3.13)
, (3.13)
где - I - ток, mА;кон - конец разряда, с;нач- начало
заряда, с;
Ек - конечный потенциал, mV;
Еп - начальный потенциал, mV;гидр - масса
гидроксида никеля на рабочем электроде, г.
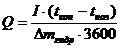 ,mA*час/г (3.14)
,mA*час/г (3.14)
где - I - ток, mА;кон - конец разряда, с;нач-
начало разряда, с;гидр - масса гидроксида, намазанного на электрод,
г.
4.
Полученные результаты и их обсуждение
.1 Метод дифференциального термогравиметрического анализа, метод
дифференциальной сканирующей калориметрии
Гидроксид никеля с добавкой 0,5% алюминия, полученный горячим гидролизом.
Потеря массы составляет 19% , четко выраженный эндотермический пик при
температуре 348,8-345°С, что соответствует распаду кристаллической решетки
гидроксида никеля. Эти данные указывают на кристаллическую β-модификацию.
Гидроксид никеля с добавкой 1% алюминия, полученный горячим гидролизом.
Данные принципиально не отличаются от данных с добавкой 0,5%. Потеря массы
19,32%, одна площадка распада при Т = 297,66-359,07°С.
Гидроксид никеля с добавкой 1% алюминия, полученный холодным гидролизом.
На TG кривой наблюдаются две площадки
потери массы. На первой потери составляют 6,63%, а на второй 18,83%, при этом
на обеих площадках потери массы соответствуют эндотермическим пикам на DTA кривой (первый при Т = 100°С, второй
при Т = 281°С). Можно предположить, что вероятнее всего наличие α-подобной структуры, для которой
характерна потеря кристаллизационной воды, а затем разрушение кристалла. Первый
эндотермический пик можем отнести к сушке материала, однако, величина потери
массы (6,5%) и количество тепла, поглощенное в эндотермическом пике, должны
были соответствовать слишком большому количеству физической воды. На DTA кривой наблюдается ярко выраженный,
но небольшой пик выделения тепла, но мы пока не можем идентифицировать его с
каким либо протекающим процессом.
Гидроксид никеля с добавкой 3% алюминия, полученный горячим гидролизом
также имеет подобные характеристики, как и с добавкой 1% алюминия, как по TG, так и по DTA кривой. Однако, На TG кривой наблюдается небольшая площадка температур в интервале
270-302°С, а потеря массы составляет 1,88%. Возможно это изменение массы
соответствует распаду гидроксида алюминия, но это только гипотеза.
Гидроксид никеля с добавкой 3% алюминия, полученный холодным гидролизом.
Данный образец также, вероятно, характеризуется α-подобной структурой, так как на TG кривой имеется две площадки потери
массы, которым соответствуют два эндотермических пика.
В целом для образцов, полученных холодным гидролизом, TGA кривые для различного содержания
алюминия в прекурсоре подобны. Увеличение содержания алюминия приводит к
меньшей стабильности α-подобной структуры и несколько большей потери массы. DTA кривые также подобны. Второй
эндотермический пик также подтверждает несколько большую стабильность образца,
полученного из прекурсора с 1% алюминия. (Рис 4.1)
При горячем гидролизе TG
кривые всех трех образцов очень подобны, потеря масс одинакова, но разрушение
кристаллов образца с 0,5% алюминия начинается несколько раньше. на DTA кривой можно отметить очень сильные
эндотермические пики разрушения кристаллов для образцов 0,5 и 3% алюминия, в то
время как для образца с 1% добавки этот эндотермический пик менее выражен.
Вероятно, это указывает на меньшую стабильность или большую дефектность решетки
образца с 1% алюминия, однако этот вывод должен быть опровергнут или
подтвержден дальнейшими исследованиями.
.2 Сканирующая электронная микроскопия
Гидроксид никеля с добавкой 0,5% алюминия.
При холодном гидролизе образующиеся частицы более менее равномерны по размеру,
имеют шестигранную форму со скругленными краями. Некоторые из частиц
представляют из себя агрегаты из нескольких слипшихся плоских частиц
гексагональной формы. Размер частиц по диагонали около 12-25 мкм. (Рис 4.2)
Рис 4.2 Сканирующая электронная микроскопия. Гидроксид никеля с добавкой
0,5% алюминия, холодный гидролиз
Образец, полученный с помощью горячего гидролиза представляет из себя
смесь очень мелких частиц гексагональной формы с очень малой толщиной и более
крупных частиц (10-25 мкм). Эти частицы представляют из себя агломераты из
очень тонких мелких частиц (пластин), сросшихся под большими углами друг к
другу. Большие агломераты имеют как сфероидальную, так и гексагональную форму.
По виду частиц можно предположить очень высокую пористость и удельную
поверхность, что может привести к очень высокой электрохимической активности.
(Рис 4.3, 4.4)
Рис 4.3 Сканирующая электронная микроскопия. Гидроксид никеля с добавкой
0,5% алюминия, горячий гидролиз (увеличение х1000)
Рис 4.4 Сканирующая электронная микроскопия. Гидроксид никеля с добавкой
0,5% алюминия, горячий гидролиз (увеличение х2500)
Гидроксид никеля с добавкой 1% алюминия.
Холодный гидролиз. Частицы имеют похожую на гидроксид никеля с добавкой
0,5% алюминия гексагональную форму, также состоят из нескольких слипшихся
частиц (шестигранники частично зализаны по краям, немного меньше размер частиц)
(Рис 4.5)
Рис 4.5 Сканирующая электронная микроскопия. Гидроксид никеля с добавкой
1% алюминия, холодный гидролиз
Горячий гидролиз. Также наблюдается смесь очень мелких, плоских
гексагональных частиц, сросшихся по несколько штук под углами 30-90°, и более
крупных частиц, также состоящих из более мелких. (Рис 4.6)
Рис 4.6 Сканирующая электронная микроскопия. Гидроксид никеля с добавкой
1% алюминия, горячий гидролиз
Гидроксид никеля с добавкой 3% алюминия.
Порошок, полученный холодным гидролизом, имеет более мелкие пластинчатые
гексагональные частицы, плоско сросшиеся из более мелких (рис 4.7)
Рис 4.7 Сканирующая электронная микроскопия. Гидроксид никеля с добавкой
3% алюминия, холодный гидролиз
При горячем гидролизе образец в основном состоит из мелких очень тонких
пластинчатых кристаллов и малого количества небольших агломератов, сросшихся
под большими углами (Рис 4.8).
Рис 4.8 Сканирующая электронная микроскопия. Гидроксид никеля с добавкой
3% алюминия, горячий гидролиз
В целом, образцы, полученные с введением в прекурсор алюминия при горячем
гидролизе, состоят из мелких, очень тонких гексагональных частиц, соединяющихся
между собой под большим углом. Такая форма позволяет предположить высокую
удельную поверхность и высокую удельную емкость в суперконденсаторном режиме.
Данная форма кристаллов не полностью соответствует предыдущим исследованиям,
хотя подобные структуры встречаются. Возможно это объясняется тем, что синтез
вели в присутствии избытка кислоты в прекурсоре.
Увеличение содержания алюминия приводит к уменьшению среднего размера
частиц без принципиального изменения формы.
При холодном гидролизе наблюдаются гексагональные частицы, состоящие из
плоскосцепленных более тонких гексагональных частиц. При этом увеличение
содержания алюминия приводит к более четко выраженной шестигранной форме частиц
и уменьшению размера и общей толщины частиц.
5. Экономическая часть
.1 Экономическое обоснование темы работы
Целью данной работы является изучение зарядно-разрядных характеристик активной массы на
основе синтезированого порошка гидроксида никеля.
Поскольку дипломная работа носит исследовательский характер, и в
результате проведенных исследований не предполагается разработка готовых к
внедрению в производстве технологий, в экономической части проводится расчет
затрат на проведение НИР.
5.2 Расчет затрат на проведение научно-исследовательской работы
В состав затрат на проведение научно-исследовательской работы включают
затраты на:
- электроэнергию;
- оборудование;
- заработную плату руководителей дипломной работы,
консультантов по разделам «Экономики» и «БЖД», исполнителя дипломной работы;
- материалы и реактивы;
- единый социальный налог;
- лабораторные расходы;
- накладные расходы.
Величина затрат определяется суммированием затрат по определенным
статьям.
5.2.1 Расчет затрат на электроэнергию
Энергетические затраты складываются из затрат на электроэнергию,
необходимую для питания используемых в работе приборов и установок.
Расчет затрат на электроэнергию (Зэл) при использовании
основного оборудования проведен по формуле (5.1) и полученные данные сведены в
таблицу 5.1.
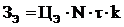 ,(5.1)
,(5.1)
где  - стоимость 1 кВт · ч электроэнергии, руб./кВт, Цэ =
3,58 руб./кВт×ч;
- стоимость 1 кВт · ч электроэнергии, руб./кВт, Цэ =
3,58 руб./кВт×ч;
 - мощность прибора, кВт;
- мощность прибора, кВт;
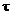 - количество часов работы прибора, ч;
- количество часов работы прибора, ч;
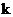 - коэффициент использования мощности;
- коэффициент использования мощности; 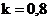 .
.
Qэ- суммарное количество
электроэнергии, кВт×ч.
Qэ
= 0,017 × 10 = 0,17 кВт×ч;
Зэ = 3,58 × 0,017 × 10 × 0,80 =
0,49 руб.
Таблица 5.1 - Затраты на электроэнергию
|
Наименование оборудования
|
Мощность, кВт
|
Количество часов работы, ч.
|
Суммарное количество электроэнергии, кВт×ч
|
Затраты на электроэнергию, руб.
|
|
Весы лабораторные ВЛР -200г - М
|
0,017
|
10
|
0,17
|
0,49
|
|
Весы лабораторные ВН - 600 - М
|
0,015
|
5
|
0,075
|
0,22
|
|
Потенциостат Р-30М
|
0,030
|
20
|
0,6
|
1,72
|
|
Шкаф сушильный SNOL
|
0.475
|
10
|
4,75
|
13,61
|
|
Мешалка магнитная с подогревом C-MAG HS7 IKAMAG Packege
|
0,350
|
240
|
84
|
240,58
|
|
Итого:
|
|
|
|
256,62
|
Таким образом, затраты на электроэнергию равны 256,62 руб.
.2.2 Расчет затрат на реактивы и материалы
Затраты по этой статье включают стоимость материалов, химикатов, воды для
приготовления растворов, мытья посуды и прочее. Они определяются, исходя из
планово-заготовительных цен и количества материалов, израсходованных на
проведение единичного эксперимента.
Расчет затрат (ЗР.М.) производится по формуле:
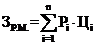 , (5.2)
, (5.2)
где Рi- общий расход i-ого вида материальных ресурсов, кг (л);
Цi - оптовая цена i-ого вида материальных ресурсов, руб/кг;
i=1…n - виды материальных ресурсов.
Данные расчета затрат на необходимые материалы приведены в таблице 5.2.
Таблица 5.2 - Затраты на реактивы, использованные для выполнения
научно-исследовательской работы (НИР)
|
Наименование реактива
|
Единицы измерения
|
Общее количество израсходованного реактива
|
Оптовая цена, руб.
|
Затраты, руб.
|
|
КOH
калий едкий (тв.)
|
кг
|
0,1
|
220,00
|
22,00
|
|
NaOH сода каустическая
|
кг
|
1,518
|
130
|
197,34
|
|
HClО4 кислота хлорная (жидкость)
|
л
|
0,07
|
405
|
28,35
|
|
KCl хлорид калия (тв.)
|
кг
|
0,2
|
84,60
|
16,92
|
|
Графит
|
кг
|
0,002
|
48,00
|
0,09
|
|
Вода дистилированная
|
л
|
40
|
9,00
|
360
|
|
ПТФЭ
|
л
|
0,005
|
570,00
|
2,85
|
|
Итого:
|
|
|
|
627,55
|
Таким образом, затраты на реактивы и материалы составили 627,55 руб.
.2.3 Расчет затрат на лабораторные расходы
В лабораторные расходы входят затраты на отопление, воду, стеклянную
посуду, освещение и вентиляцию.
Расчет затрат на химическую посуду
Химическая посуда относится к материалам и подлежит списанию в размере
30-50% от стоимости в год (в расчетах принимаем 40%). Расчет затрат на
химическую посуду представлен в таблице 4.3.
Из таблицы видно, что общая стоимость используемой посуды составляет
9386,90 руб.
К расчету принимается стоимость затрат на химическую посуду в размере 40%
от общей стоимости и составит 3754,76 руб.
Таблица 5.3 - Затраты на химическую посуду
|
Наименование стеклянной посуды
|
Стоимость, руб./шт.
|
Количество, шт.
|
Общая стоимость посуды, руб.
|
Затраты, руб. (40%)
|
|
1
|
2
|
3
|
4
|
5
|
|
Колба плоскодонная на 1000 мл
|
280,00
|
1
|
280,00
|
112,00
|
|
Колба плоскодонная на 250 мл
|
120,00
|
1
|
120,00
|
48,00
|
|
Воронка Бюхнера
|
203,00
|
1
|
203,00
|
81,2
|
|
Воронка лабораторная
|
38,80
|
1
|
38,80
|
15,52
|
|
Мерный цилиндр на 250 мл
|
228,30
|
1
|
228,30
|
91,32
|
|
Фторопластовый стакан с крышкой на 1000 мл.
|
1184,70
|
1
|
1184,70
|
473,88
|
|
Стакан химический на 50 мл
|
18,40
|
2
|
36,80
|
14,72
|
|
Стакан химический на 150 мл
|
24,60
|
2
|
49,20
|
19,68
|
|
Палочка стеклянная
|
3,40
|
1
|
3,40
|
1,36
|
|
Бюкс
|
43,00
|
1
|
43,00
|
17,2
|
|
Пипетка на 50 мл
|
78,00
|
1
|
78,00
|
31,2
|
|
Стакан пластмассовый на 500 мл
|
150,00
|
1
|
150,00
|
60,00
|
|
Ячейка ЯСЭ-2
|
5200,00
|
1
|
5200,00
|
2080
|
|
Итого:
|
|
|
7615,2
|
3046,08
|
Расчет затрат на отопление помещения
Расчет затрат на отопление определяется по нормам расхода тепла на 1м3
отапливаемого помещения. Общий расход тепла определяется по формуле (5.3):
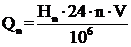 , (5.3)
, (5.3)
где Hn - норма расхода тепла, ккал/м3.ч, Hn =
20 ккал/м3.ч;- число дней в отопительном периоде, дни n = 60;- объем
помещения, м3, V = 48 м3.
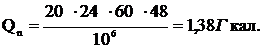
Учитывая, что стоимость теплоносителя Сп = 2056,7 руб./Гкал
рассчитываем затраты на отопление в лаборатории по формуле (5.4):
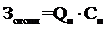 , (5.4)
, (5.4)
где Зотопл- затраты на отопление, руб.;п - расход
теплоносителя, Гкал;
Сп - стоимость теплоносителя, руб./Гкал.
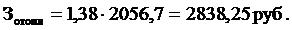
Расчет затрат на воду
В исследовательской работе применялась вода водопроводная для мытья
посуды.
Затраты на воду определяем по нормам расхода воды в сутки на одного
работника по формуле (5.5):
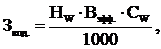 (5.5)
(5.5)
где Звод. - затраты на воду, руб.;
Hw - норма расхода воды, л/чел.дн.; Hw = 30 л./чел.дн.;
Вэфф - эффективное время работы, дней; Вэфф = 120
дн.;
С w-
стоимость 1м3 воды (включая горячую воду, холодную воду и
утилизацию), руб./1м3;
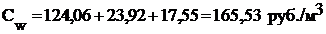 ;
;
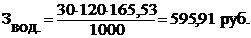
Затраты на освещение лаборатории
Количество электроэнергии, расходуемое на освещение лаборатории,
рассчитываем по формуле:
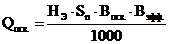 , (5.6)
, (5.6)
где Qосв.- количество электроэнергии, кВт·ч;
Нэ- норма расхода электроэнергии, Вт/м2; Нэ
= 10 Вт/м2;
Sп- площадь помещения, м2; Sп = 16 м2;
Восв.- время освещения в сутки, ч; Восв = 6 ч.;
Вэфф.- эффективное время работы лаборатории, дней; Вэфф.
= 120 дн.
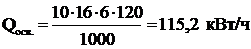
Затраты на освещение, исходя из тарифа 3,58 руб. за 1 кВт·ч
рассчитываются по формуле:
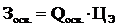 .(5.7)
.(5.7)
Тогда:
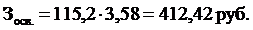
Затраты на вентиляцию
Затраты на вентиляцию лаборатории рассчитываем, исходя из мощности
двигателя, по формуле:
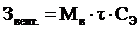 ,(5.8)
,(5.8)
где Звент.- затраты на вентиляцию, руб.;
Мв- мощность двигателя, установленного на вентиляторе, кВт, Мв
= 1 кВт;
τ- время работы вентилятора, ч, τ
= 480 ч;
Сэ- стоимость 1 кВт·ч электроэнергии, руб./кВт·ч, Сэ
= 3,58 руб./кВт×ч.
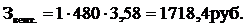
Лабораторные расходы сведены в таблицу 5.4.
Таблица 5.4 -
Лабораторные расходы
|
Вид затрат
|
Расходы, руб.
|
|
Затраты на отопление
|
2838,25
|
|
Затраты на воду
|
595,91
|
|
Затраты на химическую посуду
|
3046,08
|
|
Затраты на освещение лаборатории
|
412,42
|
|
Затраты на вентиляцию
|
1718,4
|
|
Итого:
|
8611,06
|
.2.4 Расчет затрат на оборудование
Затраты на используемое оборудование рассчитываются, исходя из балансной
стоимости прибора и длительности его использования с учетом срока службы и
включаются в состав затрат в виде амортизационных отчислений:
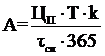 (5.9)
(5.9)
где А - амортизационные отчисления, руб.;
ЦП - инвентарная стоимость приборов, руб.;
Т - время использования приборов, дни;
k -
коэффициент, учитывающий расходы на доставку и монтаж основного оборудования, k = 1,1;
τ - срок службы приборов, лет.
Данные об амортизационных отчислениях по приборам приведены в таблице
5.5.
Пример расчета: 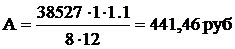
Таблица 5.5 - Инвентаризационная ведомость
|
Наименование
|
Стоимость, руб.
|
Срок службы, лет.
|
Время использования, мес.
|
Сумма амортизационных отчислений, руб.
|
|
Весы лабораторные ВЛР -200г - М
|
38527,00
|
8
|
1
|
441,46
|
|
Весы лабораторные ВН - 600 - М
|
5900,00
|
8
|
1
|
67,60
|
|
Потенциостат Р-30М с ПК
|
114196,90
|
10
|
2
|
2093,61
|
|
Шкаф сушильный SNOL
|
30325,20
|
15
|
2
|
370,64
|
|
Магнитная мешалка с подогревом C-MAG HS7 IKAMAG Packege
|
33023,00
|
7
|
1
|
432,44
|
|
Итого:
|
|
|
|
3405,75
|
Таким образом, сумма амортизационных отчислений равна 3405,75 руб.
.2.5 Расчет затрат на оплату НИР
Расчет затрат на оплату НИР учитывает: оплату работы исследователя,
руководителей дипломной работы, консультантов по экономической части и по
разделу «Безопасность жизнедеятельности», рецензента.
Доход исследователя определяется размером месячной стипендии (С),
умноженной на число месяцев (n),
отводимых на выполнение НИР:
Зисслед-ль = С × n = 2311,5 . 4
= 9246 руб.
Зарплаты руководителей и консультантов определяем исходя из нормы затрат
времени в часах на одну дипломную работу и средней часовой тарифной ставки.
В затраты входят также отчисления на страховые взносы во внебюджетные
фонды в размере 30% (ПФР - 22%, ФСС - 2,9%, ФФОМС - 5,1%).
Часовая тарифная ставка рассчитывается по формуле (5.10):
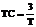 (5.10)
(5.10)
где ТС - часовая тарифная ставка, руб.;
З - зарплата руководителей, консультантов и рецензента, руб./мес.
Т - количество рабочего времени, ч/мес.
Расчет затрат на оплату научно-исследовательской работы представлен в
таблице 5.6.
Таблица 5.6 - Затраты на оплату труда
|
Научно-исследовательский персонал
|
Норма времени, ч.
|
Часовая тарифная ставка, руб.
|
Фонд зарплаты с учетом районного коэффициента, руб.
|
Отчисления на страховые взносы, руб.
|
|
Исполнитель дипломной работы (стипендия)
|
4 мес.
|
2311,5 руб./мес
|
9246,00
|
-
|
|
Руководитель дипломной работы (преподаватель)
|
8,5
|
100
|
850
|
255
|
|
Консультант по разделу «Экономика»
|
3
|
100
|
300
|
90
|
3
|
100
|
300
|
90
|
|
Итого:
|
|
|
10696
|
435
|
Таким образом, фонд заработной платы составит 10696 руб., а страховые
взносы в размере 30% от заработной платы равны 435 руб.
.2.6 Накладные расходы
Накладные расходы включают затраты на содержание учебно-вспомогательного
и административно-управленческого персонала, отчисления на износ и текущий
ремонт зданий, уборку помещений, командировочные, канцелярские и прочие
хозяйственные расходы и принимаются округленно в размере 10-15% от общих затрат
(в расчетах принимаем 10%). Накладные расходы находятся по формуле (5.11):
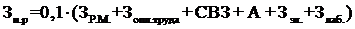 , (5.11)
, (5.11)
где ЗР.М.- затраты на реактивы и материалы, руб.;
Зопл.труда- затраты на оплату труда, руб.;
СВЗ- страховые взносы, руб.;
А- амортизационные отчисления, руб.;
Зэл. - затраты на электроэнергию, руб.;
Злаб. - лабораторные расходы, руб.
Тогда накладные расходы:
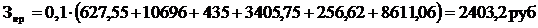 .
.
5.2.7 Смета затрат на выполнение НИР
На основании проведенных расчетов составляем сводную таблицу затрат на
научно-исследовательскую работу (таблица 5.7).
Диаграмма затрат на научно-исследовательскую работу представлена на
рисунке 5.1.
Таблица 5.7 - Смета затрат на проведение НИР
|
Наименование статьи затрат
|
Сумма, руб.
|
Структура затрат, %
|
|
1 Затраты на реактивы и материалы
|
627,55
|
2,37
|
|
2 Лабораторные расходы
|
8611,06
|
32,57
|
|
3 Затраты на электроэнергию
|
256,62
|
0,98
|
|
4 Заработная плата научно-исследовательского персонала
|
10696
|
40,46
|
|
5 Отчисления на страховые взносы
|
435
|
1,65
|
|
6 Затраты на амортизацию
|
3405,75
|
12,88
|
|
7 Накладные расходы (10% от общих расходов)
|
2403,2
|
9,09
|
|
ИТОГО
|
26435,18
|
100,0
|
Таким образом, затраты на НИР составили 26435,18 руб.
Рисунок 5.1 - Относительные затраты на проведение НИР
Из диаграммы расходов, представленной на рисунке 4.1 видно, что основные
расходы приходятся на лабораторные расходы и зарплату научно-исследовательского
персонала.
В данной дипломной работе проведен расчет затрат на исследование
электрохимических свойств синтезированного порошка гидроксида никеля.
Исследование является важной частью разработки новых видов суперконденсаторов,
модернизации и разработки новых ХИТ, для разработки экологически чистых
двигателей, работающих на электрической энергии. В настоящее время ионисторы
часто применяются в бытовой технике. Суперконденсаторы имеют более долгий срок
службы и емкость чем аккумуляторы, что делает их востребованными в современном
обществе. Дальнейшее проведение НИР является экономически целесообразным и
перспективным.
6. Безопасность жизнедеятельности
.1 Экологическое обоснование темы дипломной работы
Целью данной дипломной работы является исследование электрохимических
свойств Ni(OH)2 синтезированного с добавлением гидроксида
алюминия, на основе зарядно-разрядных и вольтамперных кривых.
Изучение свойств гидроксида никеля, как активного вещества одного из
электродов, является одним из важных направлений в разработке современных
суперконденсаторов. В настоящее время ионисторы занимают все большее значение
при использовании в промышленности, технике, а так же в бытовой сфере.
Научно-исследовательская работа выполняется в химической лаборатории, что
в свою очередь сопряжено с риском для жизни и здоровья человека, такими как
поражение электрическим током, ожоги химическими реагентами. В разделе
«Безопасность жизнедеятельности» разработаны основные мероприятия,
обеспечивающие безопасность проектируемого объекта для человека и окружающей
среды.
.2 Свойства применяемых реактивов, исследуемых и получаемых веществ [47,
48, 49, 50]
В процессе работы в лаборатории приходится использовать вредные вещества,
которые оказывают токсичное действие на организм человека. Поэтому для
предупреждения возможных отравлений, получения ожогов или травм, необходимо
знать свойства этих веществ, их ПДК, а также меры защиты и оказание первой
помощи пострадавшему. В таблице 6.1 приведены характеристики токсичных веществ,
используемых в данной работе.
Таблица 6.1 - Свойства веществ по токсичности
|
Вещество
|
Токсичное действие вещества
|
ПДКр.з., мг/м3
|
ПДКм.р., мг/м3
|
ПДКс.с, мг/м3
|
ПДКк.б, мг/л
|
Класс опасности
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
Ni(OH)2
Гидроксид никеля(тв., пыль)
|
Канцерогенное и аллергенное воздействие на организм
|
-
|
-
|
-
|
Ni+2 0,1
|
2
|
|
Ni(ClO4)2, (аэрозоль, жидкость)
|
Отравление сопровождается слабостью, головной болью,
рвотой, одышкой. В тяжелых случаях может развиться отек легких. При
хроническом отравлении наблюдаются частые пневмонии, носовые кровотечения,
нарушение обоняния, поражение слизистой оболочки верхних дыхательных путей
|
1
|
-
|
-
|
0,1
|
2
|
|
C графит (пыль)
|
Вызывает обильное слезоточение, боль в глазах, кашель.
Продолжительное воздействие ведет к заболеванию верхних дыхательных путей и легких.
|
4
|
0,15
|
0,05
|
-
|
4
|
|
KOH (аэрозоль, жидкость)
|
Действует на ткани прожигающим образом, растворяя белки.
При попадании раствора или пыли на кожу образуется мягкий струп. Опасно
попадание даже малых количеств в глаза т.к. поражается роговица, исходом может
быть слепота.
|
0,5
|
-
|
-
|
120 (K+)
|
2
|
|
Политетрафтор-этилен (жидкость)
|
Устойчив и инертен в обычных условиях. Продукты разложения
токсичны
|
-
|
-
|
-
|
-
|
4
|
|
HClО4
Хлорная кислота (аэрозоль, жидкость)
|
При высоких концентрациях вызывает раздражение слизистой
оболочки носа, кашель. При попадании на кожу вызывает ожоги. При длительном
воздействии образуются язвы.
|
5
|
0,2
|
0,2
|
300 (Cl-)
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где ПДКр.з. - предельно допустимая концентрация вредных
веществ в воздухе рабочей зоны (предельно допустимая концентрация, которая при
ежедневной (кроме выходных дней) работе в течение 8 ч и не более 40 ч в неделю,
в течение всего рабочего стажа не должна вызывать заболеваний или отклонений в
состоянии здоровья).
ПДКм.р. - максимально разовая концентрация вредных веществ в
воздухе населённых мест (устанавливается для веществ, оказывающих немедленное,
но временное раздражающее действие).
ПДКс.с. - это среднесуточная предельно допустимая концентрация
вредного вещества в воздухе населённых мест в мг/м³.
При данной концентрации
не должно возникать прямого или косвенного вредного воздействия на организм
человека в условиях долгого круглосуточного вдыхания.
ПДКк.б. - предельно допустимая концентрация вредных веществ в
водоёмах культурно - бытового пользования.
Класс опасности - условная величина, предназначенная для упрощённой
классификации потенциально опасных веществ. Класс опасности устанавливается в
соответствии с нормативными отраслевыми документами.
Взрыво-пожароопасность веществ
Среди используемых в работе веществ горючим является графит, но он
применяется в предельно малых количествах для анализа.
.3 Потенциальные опасности при выполнении экспериментальной части работы
[58]
При выполнении научно-исследовательской работы возможны потенциальные
опасности. Выражены в виде физических и химических опасностей и представлены в
таблицах 6.2.
Таблица 6.2 - Характеристика возможных опасностей
|
Физические опасности и вредные факторы
|
|
Фактор
|
Источник фактора
|
Фактические значения
|
Нормативные значения
|
Характер последствий
|
Способ защиты
|
|
Разрушающиеся конструкции
|
Стеклянная посуда, пипетки и т.д.
|
|
|
Травмирование осколками стекла
|
1) Соблюдение правил работы со стеклянной посудой.
|
|
Повышенное значение напряжения в электрической цепи
|
Электричские весы, потенциостат, сушильный шкаф,
дистиллятор
|
3-5 А, 220 В
|
до 0,5 мА, 12 и 42 В
|
Термический ожог, нарушение работы сердца и легких, потеря
сознания.
|
Проверка перед работой целостности изоляции, заземление
электроустановки.
|
|
повышенная температура поверхностей оборудования.
|
Электрическая плитка, сушильный шкаф
|
60-170°С
|
-
|
Ожоги кожных покровов
|
Соблюдение техники безопасности при работе.
|
|
Токсический
|
Хлорная кислота
|
>1 мл
|
5 мг/м3
|
Химикат попадает через органы дыхания, вызывая отравление.
|
1) Выполнение работ в вытяжном шкафу.2) Соблюдение техники
безопасности
|
|
гидроксид никеля
|
>5 г
|
1 мг/м3
|
|
|
|
Раздражающий
|
хлорная кислота, гидроксид калия
|
>1 мл
|
0,5
|
Ожоги кожных покровов.
|
1)Средства индивидуальной защиты: х/б халат, резиновые
перчатки. 2)Соблюдение техники безопасности
|
.4 Мероприятия по безопасному проведению научно- исследовательской работы
Организация рабочего места [49, 53]
Правильное расположение и компоновка рабочего места, обеспечение удобной
позы и свободы трудовых движений, использование оборудования, отвечающего
требованиям эргономики и инженерной психологии, обеспечивают наиболее
эффективный трудовой процесс, уменьшают утомляемость и предотвращают опасность
возникновения профессиональных заболеваний.
Расположение используемого оборудования должно обеспечивать удобную
рабочую позу человека. Нормальной рабочей позой считается такая, при которой
работнику не требуется наклон перед более, чем на 10-15° , наклоны назад и в
сторону нежелательны. Основное требование к рабочей позе - прямая осанка -
достигается регулированием высоты рабочей поверхности. При частых перемещениях
более целесообразна работа стоя.
Работа считается удобной, если высота рабочей поверхности при работе стоя
составляет 990 мм для женщин и 1025 мм для мужчин. Высота рабочего стола в
лаборатории должна быть равна 1 метру, высота стула 0,5 м.
Для обеспечения удобного близкого подхода к столу должно быть
предусмотрено пространство размером не менее 450 мм по глубине, 150 мм по
высоте и 350 мм по ширине. Очень часто используемые приборы и оборудование (две
или более операции в минуту) должны находиться на расстоянии 280 мм, на уровне
1 метра. Часто используемые приборы (не более двух операций в минуту, но не
менее двух операций в час) - на расстоянии 400 мм. Зона размещения редко
используемых приборов - 520 мм. На рабочем месте должны находиться только
необходимые приборы. Их расположение должно включать возможность их
опрокидывания, а также прикосновения к токоведущим частям.
Большое значение имеет режим работы. Рациональная организация труда и
отдыха позволяет достичь наивысшей производительности. Работа проводилась около
6 часов в день, предусматривался обеденный перерыв (30 мин).
Меры безопасности при работе с вредными веществами [48, 54]
При работе в лаборатории следует исходить из того, что все химические
вещества в той или иной степени оказывают влияние на организм человека.
Обязательным условием безопасной работы с химическими веществами является
знание не только класса опасности всех реактивов и растворителей, которые мы
используем при повседневной работе, но также знание особенностей их
токсического действия, основных мер профилактики отравлений, симптомов
отравления и способов оказания первой помощи при отравлениях.
Результатами воздействия вредных веществ на организм человека могут быть
острые и хронические отравления.
При работе с химическими веществами следует предотвращать возможность их
проникновения в организм человека через дыхательные пути, кожные покровы и
желудочно-кишечный тракт.
Любые работы с газообразными, а так же летучими или пылящими жидкими и
твёрдыми веществами следует проводить в вытяжном шкафу при включенной
вентиляции.
При работе в химической лаборатории необходимо соблюдать общие правила
техники безопасности и правила работы с химикатами, приведенные ниже:
. реактивы в лаборатории должны храниться в четко маркированной
таре. Хранение реактивов без этикеток запрещается;
. работать с концентрированными реагентами следует в защитных
очках и перчатках.
. переносить и поднимать сосуды с агрессивными жидкостями,
следует держа их за горло и дно сосуда;
. при разбавлении концентрированных кислот и щелочей следует
приливать кислоту (щелочь) в воду при постоянном перемешивании, используя
термостойкую посуду;
. химические вещества набирают шпателем или керамической ложкой.
. разлитые кислоты и щёлочи засыпают песком, нейтрализуют содой и
раствором слабой уксусной кислоты соответственно, затем проводят уборку;
. отработанные кислоты и щёлочи следует сливать специальную
посуду и только после нейтрализации производят слив в канализацию;
. запрещается принимать пищу в рабочем халате и на рабочем месте
в лаборатории во избежание попадания токсичных веществ через желудочно-кишечный
тракт.
Необходимые для повседневной работы реактивы в ограниченных количествах
допускается держать в лабораторных помещениях. При этом в шкафах для реактивов,
на открытых полках или в тумбах лабораторных столов можно хранить нелетучие,
непожароопасные и малотоксичные вещества, растворы кислот и щелочей для
титрования. Бутыли с концентрированными минеральными кислотами (соляной,
азотной, серной) следует держать раздельно друг от друга в вытяжном шкафу на
керамических поддонах с песком или в фарфоровых стаканах.
Меры безопасности при работе с высокими температурами [54]
При работе с электронагревательными приборами чаще всего существует
вероятность возникновения аварий в виде пожара, удара током, ожогов. Во
избежание данных ситуаций в зоне нагрева не должны находиться горючие или
легко-воспламеняющиеся вещества и материалы (в данной НИР используется
сушильный шкаф).
При работе с высокими температурами необходимо пользоваться щипцами,
рукавицами с утеплённой основой.
Меры безопасности при работе со стеклянной посудой [48]
В процессе выполнения работы использовалась стеклянная посуда: колбы,
цилиндры, стаканы. Основной недостаток стекла - хрупкость. Большинство несчастных
случаев происходит из-за небрежного обращения со стеклом.
Наиболее часто возникающие травмы:
· ожоги рук при неосторожном обращении с нагретыми стеклянными изделиями;
· порез рук при поломке стеклянной посуды.
Особенно опасны порезы осколками посуды, загрязнённой химическими
соединениями, поскольку в данном случае токсичные вещества попадают
непосредственно в кровь, глаза, что приводит к тяжелым поражениям,
инвалидности.
Кроме травм при поломке стеклянной посуды и аппаратуры возможны и другие
виды аварий и несчастных случаев: пожары и взрывы (при проливе горючих
жидкостей, окислителей и т.д.), отравления и химические ожоги (при попадании
едких веществ в атмосферу или на кожу). Во избежание данных несчастных случаев
необходимо применять посуду без брака (трещин, сколов), периодически
осуществлять визуальный осмотр стеклянной посуды.
Средства индивидуальной защиты [53]
Средства индивидуальной защиты применяются тогда, когда безопасность
работ не может быть обеспечена конструкцией оборудования, организацией
производственного процесса и так далее.
Для защиты от попадания на кожу и одежду человека токсических веществ
применяются хлопчатобумажный халат и резиновые перчатки при работе с кислотами,
щелочами и электроприборами.
Первая доврачебная помощь
При выполнении НИР одной из наиболее вероятных является электротравма.
Исход поражения током зависит от длительности его воздействия на человека и
состояния кожи человека. Поэтому главная задача при оказании первой доврачебной
медицинской помощи - как можно быстрее освободить пострадавшего от действия
тока. В помещениях лабораторий это быстрее и надежнее всего достигается
отключением электроэнергии общим рубильником. Допускается отключение от сети
прибора, вызвавшего поражение.
Запрещается прикасаться голыми руками к обнаженным частям тела
пострадавшего до размыкания электрической цепи. После освобождения от действия
тока пострадавшему оказывают первую медицинскую помощь.
Если пострадавший потерял сознание, в первую очередь следует проверить
пульс и дыхание. При наличии дыхания и пульса необходимо уложить его на спину и
повернуть его голову в сторону, для предупреждения западания языка. Затем нужно
привести пострадавшего в сознание - сбрызнуть лицо холодной водой, дать нюхать
вату, смоченную нашатырем. После того, как он придет в сознание, дать ему
выпить настойки валерианы (15-20 капель) и горячего чая. Если пострадавший
после обморока пришел в сознание, до прихода врача нужно обеспечить ему полный
покой, уложить в теплом помещении, дать теплое питье, расстегнуть стесняющую
дыхание одежду.
Если дыхание и пульс отсутствуют, необходимо немедленно приступить к
искусственному дыханию с одновременным массажем сердца.
Электробезопасность [49]
Выполнение научно-исследовательской работы связано с применением
электрических приборов, которые питаются от сети переменного тока напряжением
220 В, силой тока до 5 А, частотой 50 Гц, опасными для жизни человека.
Характеристика помещения по опасности поражения человека электрическим
током и класс взрывоопасной (пожароопасной) зоны по ПУЭ приведен в таблице 6.3.
Работая с электрическими приборами необходимо соблюдать следующие меры
электробезопасности:
. запрещается вскрывать электрические щитки;
. работу можно проводить только с исправным оборудованием и
приборами;
. в соответствии с ПУЭ разрешается использование закрытых
электрических приборов, пыленепроницаемых светильников;
. большое внимание должно уделяться контролю изоляции и
профилактике её повреждений, провода должны быть изолированы; сопротивление
изоляции должно составлять не менее 500 кОм; изоляцию необходимо проверять не
реже одного раза в три года;
. нельзя оставлять включенные электроприборы без присмотра;
. все приборы должны быть заземлены, наибольшее допустимое
сопротивление заземления для установок - 4 Ом, сопротивление заземления должно
проверяться не реже одного раза в три года;
. избегать попадания на приборы брызг химикатов, воды, защищать
от ударов;
. работа с электроустановками ведётся при наличии рубильника для
отключения всей внутрилабораторной сети.
Таблица 6.3 - Характеристика помещения по опасности поражения человека
электрическим током и класс взрывоопасной зоны по ПУЭ
|
Наименование помещения
|
Характеристика помещения по степени опасности поражения
током
|
Класс взрывопожароопасной зоны по ПУЭ
|
|
Лаборатория
|
Без повышенной опасности, так как нет токопроводящей пыли,
пол деревянный, покрытый линолеумом. Влажность воздуха в лаборатории не
превышает 75%, температура 20°С.
|
II-IIа (твердые горючие вещества и материалы)
|
Средства защиты включают в себя заземление и средства индивидуальной
защиты.
Расчет одиночного заземления [49, 57]
Для предотвращения электрических травм, которые могут быть вызваны при
касании металлических конструкций или корпусов электрооборудования, оказавшихся
под напряжением вследствие повреждения изоляции, а также для защиты аппаратуры
устраиваются защитные заземления, представляющие собой преднамеренное
соединение с землей или ее эквивалентом металлических частей электроустановок,
нормально не находящихся под напряжением.
Расчет заземляющего устройства осуществляют исходя из его максимально
допустимого сопротивления, установленного для соответствующего оборудования.
Так как естественный заземлитель отсутствует (не предусмотрен заданием),
то предусматривается искусственный заземлитель, сопротивление которого
R1
≤ R ≤ 0,5 Ом.
Определим расчетное удельное сопротивление:
ρт =
ρ× φ
(6.1)
где: ρ - удельное сопротивление грунта, Ом·м,
φ
- климатический
коэффициент (выбирается из справочника в соответствии с климатическими
условиями отдельных зон)
Выбираем тип грунта - суглинок с сопротивлением ρ
= 100 Ом·м, а
климатический коэффициент в соответствии с нашей зоной φ
= 1,5. Тогда расчетное
удельное сопротивление будет определено:
ρт =
ρ× φ = 100 × 1,5 = 150 Ом·м
Выберем тип заземлителя и его размеры. Искусственный заземлитель
относится к типу трубчатый или стержневой длиной l = 16 м и диаметром d = 0,05 м. Расстояние от заземлителя до поверхности земли в расчетах
примем равным h = 0,8 м.
Рассчитаем сопротивление растекания одиночного стержневого заземлителя:
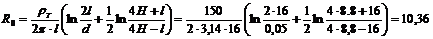 Ом (6.2)
Ом (6.2)
где Н - расстояние от поверхности земли до средины заземлителя.
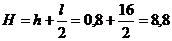 м (6.3)
м (6.3)
Количество параллельно соединенных одиночных заземлителей, необходимых
для получения допустимого значения сопротивления заземления, без учета
сопротивления полосы соединения, будет составлять:
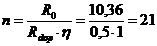 (6.4)
(6.4)
Где - η коэффициент использования группового заземлителя. Согласно
справочным данным, количество параллельно соединенных одиночных заземлителей
должно быть не меньше двух. Так как мы рассчитываем одиночное заземление, то из
справочных таблиц выбираем η = 1.
Рис. 1 Принципиальная схема защитного заземления
- заземлитель, 2- заземляемое оборудование, 3- заземляющие проводники
(магистрали).
Таким образом, для искусственного заземления необходимо ввести 21
параллельно соединенных одиночных заземлителей для обеспечения
электробезопасности.
6.5 Пожарная профилактика [48, 49]
Помещение, в котором проводятся исследования, относится к пожароопасным
помещениям категории «В4», то есть, где используются твёрдые горючие вещества и
материалы.
В лаборатории существует возможность возникновения пожара, так как там
находятся электроприборы, которые могут стать источниками огня. Причинами возникновения
пожара могут быть:
) нарушение правил пожарной безопасности;
) неисправность электрооборудования - неисправная проводка может стать
источником пожара, поэтому работы с электроприборами должны проводиться при
условии исправности проводки и тщательной изоляции токоведущих частей.
Если возникновение пожара произошло в результате неисправности
электроприбора, то необходимо отключить прибор от сети и потушить очаг пожара
песком или асбестовым покрывалом. При возникновении пожара в вытяжном шкафу необходимо
в первую очередь отключить вентиляцию и после этого приступать к тушению
пожара.
На случай возникновения пожара в лаборатории имеются средства
пожаротушения и средства извещения о пожаре.
Выводы по разделу БЖД
Проведен анализ опасных и вредных факторов, возникающих при проведении
НИР в химической лаборатории, рассмотрены основные требования к мерам
безопасности и способы защиты. В дипломной работе большое внимание уделялось
разделу «Электробезопасность», произведен расчет одиночного заземления и
представлен эскиз размещения. В разделе «Пожарная безопасность» была выбрана
категория помещения и рассмотрены возможные источники возникновения пожара.
Список литературы
1. Современная электроника [Текст]. - М. : СТА - Пресс,
2004 - (Шифр: П1780/2006/5). - 2006 г. N 5 Деспотули, А. Суперконденсаторы для
электроники (часть 1) / А. Деспотули, А. Андреева. - С. 10 - 14.
. Современная электроника [Текст]. - М. : СТА -
Пресс, 2004 - (Шифр: П1780/2006/6). - 2006 г. N 6 Деспотули, А.
Суперконденсаторы для электроники (часть 2) / А. Деспотули, А. Андреева. - С.
46 - 51.
. Кузнецов В., Панькина О., Мачковская Р., Шувалов
Е., Востриков И. Конденсаторы с двойным электрическим слоем (ионисторы):
разработка и производство. Компоненты и технологии. 2005. № 6.
4. Деспотули А.Л., Андреева А.В., Веденеев В.В.,
Аристов В.В., Мальцев П.П. Высокоёмкие конденсаторы для ультраплотного
поверхностного монтажа. Нано- и микросистемная техника. 2006. № 3.
. Ball R. Supercapacitors see growth as
costsbfall. www.electronicsweekly.com.
. Pasquier A. Du, Plitz I., Gural J., Menocal
S., Amatucci G. Characteristics and performance of 500F asymmetric hybrid
advanced supercapacitor prototypes. J. Power Sources. 2003. V. 113. Р. 62.
. Wang C.Y., Zhong S., Bradhurst D.H. Ni /Al
/Co - substituted α - Ni(OH) as electrode materials in
the nickel metal hydride cell // Journal of Alloys and Compounds. 2002. V. 330
- 332. P. 802 - 805.11. Bern.
. R.S. Jayashree and P. Vihnu Kamath.
Supperession of the α → β nickel hydroxide
transformation in concentrated alkali: Role of dissolved cations. // Jornal of
Electrochemistry. - 2001. - № 31 . - P. 1315 - 1320.
. Venkat Srinivas, John W. Weidner, Ralph. E.
White. Matematical models of the nickel hydroxide active material. // J. Solide
State Electrochem.- 2000. - № 4. - P. 367. .
. C. Tessier, C. Faure, L. Guerlou -
Demourgues, C. Denage, G. Nabias, C. Delmas. Electrochemical Study of
Zinc-Substituted Nickel Hydroxide. // Journal of The Electrochemical Society. -
2002. - № 149. - P.1136 - 1145.
11. СССР, авт. свидетельство 51380 "Способ обработки
гидрата закиси никеля", МПК C01G 53/04, 12п, 4; 21в, 25, 1937 г.
. М.А. Дасоян, В.В. Новодережкин и др.
"Производство электрических аккумуляторов", М., "Высшая
школа", 1977, 260-277.
. Патент Российской Федерации 2138447 "Способ
получения никеля (II) гидроксида", МПК 6 C01G 53/04, опубл. 27.09.1999.
. Патент Российской Федерации 2208585 "Способ
получения никеля (II) гидроксида", МПК 6 C01G 53/04, опубл. 20.07.2003.
15. Method for producing nickel hydroxide. Заявка 069076 ЕПВ, МПК С01G 53/04 Matsushita Electric Ind.
Co. Ltd. Hayashi Kiyoshi, № 00114662.0; Заявл. 07.07.2000; Опубл. 17.01.2001; Приор. 16.07.1999, №20380599 (Япония). Англ.
16. Un nouveau tupe d’hydroxyde de nickel obtenu
par electrodialyse: Rapp. Colegue «Integretion des membranes dans les
procedes», Lyon, 3 - 5 mai, 2000. Sumbroso R., Bugnet B., Forgeot F. Recents
progr. genil procedes 2000.74, №14. с. 239 - 242. Фр. .
17. Толстогузов В. Д. Улучшение электрохимических
свойств гидроксида никеля для производства аккумуляторов. // Цв. мет. - 1989 -
№ 9 - с.27 - 28. - Рус.
. Xi Xia, Zaiping Guo. Studies on a Novel Secondary Battery:
MH/Mo2 Rechargeable Battery. // J. Electrochem. Sol. - 1997. - Vol. 144, №8. - page 213 - 216. .
. Коток В. А. Отримання електрохімічним способом нікелю (ΙΙ)
гідроксиду, як
активної речовини лужних акумуляторів: Дип. 12.06.04 - Дн - ськ., 2004. с.116.
. Гинделис Я. Е. Химические источники тока.: Издательство
Саратовского университета, 1984 - 174c.
21. dx.doi.org/10.1021/jp203222t |J. Phys. Chem. C 2011, 115, 15067-15074
22. Ратканов А.С. Структура, морфология частиц и
электрохимические свойства "псевдопростого" гидроксида никеля,
синтезированного с добавкой алюминия: ТПЖА.563713.010 ПЗ: Дипл. работа / ВятГУ,
каф ТЭП; рук. Шишкина С.В., Коток В.А., Коваленков В.А. - Киров, 2014. ПЗ 98 с.
. Химические источники тока: Справочник/ под ред.
Н.В. Коровина, А.М. Скудина. - М.: Издательство МЭИ, 2003. - 740с.
24. Conway B.E. Transition from
"Supercapacitor" to "Battery" behavior in electrochemical
Energy Storage // J. Electrochem. Soc. 1991. V.138. P.1539
25. Вольфкович Ю.М., Сердюк Т.М. Электрохимические
конденсаторы // Электрохимическая энергетика. 2001. Т.1 №4. C. 14-28
26. Kovacs Gy., Marai Gy. Az elektrolitkondenzátorok alkalmazási területei
és
új típusai // Hiradastechnika. 1984 .V.35. P.454
. Hand J., Bouling L. // IEEE Intercon.
Technical Paper. 1974. V.4. P.11
28. Ануфриев Ю.А., Гусев В.Н., Смирнов В.Ф. Эксплуатационные
характеристики и надежность электрических конденсаторов. - М.: Энергия, 1976.
29. Kurzweil P., Chwistek M., Electrochemical
stability of organic electrolytes in supercapacitors: Spectroscopy and gas
analysis of decomposition products // Journal of Power Sources. 2008. V. 176.
P. 555-567
. Lufrano F., Staiti P., Minutoli M.,
Evaluation of nafion based double layer capacitors by electrochemical impedance
spectroscopy // Journal of Power Sources. 2003. № 124. P. 314-320
. Tsypkin М., Baranov I., Lizunov A., Samoilov D., Fateev V. Research and
performance improvment of PEMFC electrode // In: Proc. of 14th Intern. Congress
of Chemical and Process Engineering (Praha, 27-31 August 2000). Р. 61
. Hadzi-Jordanov S., Angerstein-Kozlowska H.,
Vikovic M., Conway B.E. // J. Electrochem. Soc. 1978. V.125. P. 1471
. Beliakov A.I., Brintsev A.M. Development and
Application of Combined Capacitors: Double Layer Pseudocapacity. // Proc. 7 th
. Int. Seminar on Double Layer Capacitors and Similar Energy Storage Devices.
Deerfield Beach, Florida. 1997. V.7. Р.120.
34. Попель О.С., Тарасенко А.Б. Современные виды
электрохимических накопителей электрической энергии и их применение в
автономной и централизованной энергетике // Теплоэнергетика. 2011. №11. С. 2-11
. http://www.ibmc.msk.ru/content/Education/w-o_pass/MMoB/11.pdf
. Топор Н. Д., Огородова Л. Н., Мельчакова Л. В.
Термический анализ минералов и неорганических соединений.- М.: Изд-во МГУ,
1987. -190 с.
. Шестак Я. Теория термического анализа: Физико-химические
свойства твердых неорганических веществ: Пер. с англ. - М.: Мир ,1987. - 456 с.
. Методологические основы изучения кинетики
химических реакций в условиях программируемого нагрева/ А. Г. Мержанов, В. В.
Барзыкин, А. С. Штейнберг, В. Т. Гонтковская.- Черноголовка: ОИХФ, 1979.- 37 с.
. Калориметрия. Теория и практика: Пер. с англ./ В.
Хеммингер, Г. Хёне.- М.: Химия, 1990.- 176 с.
. Гейровский Я., Кута Я., Основы полярографии, пер.
с чеш., М., 1965.
. Галюс 3., Теоретические основы электрохимического
анализа, пер. с польск., М., 1974
. Каплан Б. Я., Импульсная полярография, М., 1978
. Брайнина X. 3., Нейман Е. Я., Твердофазные реакции
в электроаналитической химии, М., 1982
. Каплан Б. Я., Пац Р. Г., Салихджанова Р. М.-Ф.,
Вольтамперометрия переменного тока, М., 1985.
. Сканирующая электронная микроскопия и рентгеноспектральный
микроанализ в примерах практического применения / М.М. Криштал, И.С.
Ясников, В.И. Полунин, А.М. Филатов, А.Г. Ульяненков (Серия «Мир физики и техники»
II-15). - М.: Изд-во Техносфера, 2009. - 208 с.
. http://ftfsite.ru/wp-content/files/ProsvecEM.pdf
47. Лазырев, Н.В. Вредные вещества в промышленности
[Текст]: учеб./ Н.В. Лазырев.-М.: Химия, 4.I-IV,1976.
48. Лазырев, Н.В. Вредные вещества в промышленности
[Текст]: учеб./ Н.В. Лазырев.-М.: Химия, 4.I-IV,1976.
49. Захаров, Л.Н. Техника безопасности в химических
лабораториях [Текст]: учеб. Пособие/Л.Н. Захаров.-Л.: Химия, 1995.-528с.
50. Долин, П. А, Справочник по технике безопасности
[Текст]справочник/ П.А. Долин.-М.: Энергоатомиздат, 1985.-823с.
51. ГН 2.2.5.686-98. Предельно допустимые концентрации
(ПДК) вредных веществ в воздухе рабочей зоны [Текст].-М.: Изд-во стандартов,
1998.-9с.
. ГН 2.1.6.686-98. Предельно допустимые концентрации
(ПДК)загрязняющих веществ в атмосферном воздухе населенных мест [Текст].-М.:
Изд-во стандартов, 1998.-8с.
. ГН 2.1.5.689-98. Предельно допустимые концентрации
(ПДК) химических веществ в воде водных объектов хозяйственно -питьевого и
культурно-бытового водоиспользования [Текст].-М.: Изд-во стандартов, 1998.-10с.
. Безопасность жизнедеятельности: учеб.для вузов/под
ред. С.В. Белова.-М.: Высшая школа, 2007.-468с.
. ГОСТ 12.4.113-82 Система стандартов безопасности
труда. Работы учебные, лабораторные. Общие требования безопасности [Текст].-М:
Изд-во стандартов, 1982.-7с.
. СанПиН 2..4.548-96. Гигиенические требования к
микроклимату производственных помещений [Текст].-М.: Изд-во стандартов,
1996.-10с.
. "Правила техники безопасности при
электромонтажных и наладочных работах", Москва, "Энергоатомиздат",
1992.
. ГОСТ 12.0.003-74 (1999) ССБТ Опасные и вредные
производственные факторы. Классификация