Получение нитрата магния
СОДЕРЖАНИЕ
Введение
.
Литературная часть
.1
Магний
.1.1
Общая характеристика
.1.2
Химические свойства
.1.3
Применение
.2
Соединения магния
.3
Нитрат магния
.
Экспериментальная часть
.1
Приборы и реактивы
.2
Методика синтеза
.3
Проведение расчетов
.4
Проведение эксперимента
.5
Расчет выхода
.6
Идентификация
Выводы
Список
литературы
Введение
Соли магния имеют большое значение. Например,
такие соли как: гидроксид магния (Mg(OH)2),
карбонат магния (MgCO3), оксид магния (MgO),
хлорид магния (MgCl2)
и цитрат магния (C6H6O7Mg), используются в
пищевой промышленности в виде пищевых добавок соответственно: E518, E528, E504,
E530, E511, E345. Фторид магния (MgF2)
применяется для защиты металлов от коррозии и изготовления матового стекла и
керамики.
Нитрат магния нашел широкое применение в
сельскохозяйственной деятельности в качестве сложного удобрения, а также в
качестве окислителя в пиротехнических составах.
Целью курсовой работы является получение нитрата
магния.
Глава 1. Литературная
часть
1.1 Магний
.1.1 Общая характеристика
Магний (от лат. Magnesium)
- химический элемент II
А группы, третьего периода периодической системы Д.И. Менделеева. Атомный номер
12, атомная масса 24,305. Электронная конфигурация невозбужденного атома - 1s22s2p63s2.
В природе магний встречается в виде трех
стабильных изотопов: 24Mg(78,60%), 25Mg (10,11%) и 26Mg
(11,29%). Искусственно были получены изотопы с массами 23, 27 и 28.
Простое вещество магний - лёгкий, ковкий металл
серебристо-белого цвета (пл. 1.74 г/см3, т. пл. 650°C, т. кип.
1095°C), хороший проводник тепла и электричества. На воздухе окисляется и
приобретает матовый оттенок. Кристаллическая решетка магния относится к
гексагональной системе. Средне распространён в природе. При горении выделяется
большое количество света и тепла. Магний высокой чистоты пластичен, хорошо
прессуется, прокатывается и поддаётся обработке резанием [1].
Получение:
Впервые получен в 1808 году английским химиком
Гемфри Дэви. Он смешал увлажненную магнезию (MgSO4)
с оксидом ртути, пропустил через смесь ток и получил амальгаму - сплав магния с
ртутью [2].
. Обычный промышленный метод получения
металлического магния - это электролиз расплава смеси безводных хлоридов магния
MgCl2 (бишофит), натрия NaCl и калия KCl. В расплаве
электрохимическому восстановлению подвергается хлорид магния:
2
(электролиз) = Mg + Cl2. (1)
2. Разработан и другой способ получения магния -
термический. В этом случае для восстановления оксида магния при высокой
температуре используют кремний или кокс:
+ C = Mg + CO. (2)
. Применение кремния позволяет получать магний
из такого сырья, как доломит CaCO3·MgCO3, не проводя
предварительного разделения магния и кальция. С участием доломита протекают
реакции:
CaCO3·MgCO3
= CaO + MgO
+ 2CO2,
(3)
2MgO + CaO + Si = CaSiO3
+ 2Mg. (4)
. При углетермическом методе магний получают
восстановлением его из соединений углем в электропечах (при 2100°C). Для
получения чистого магния (99,999% Mg)
технический магний многократно сублимируют в вакууме.
.1.2 Химические свойства
. Взаимодействие с кислородом:
Mg + O2
= 2MgO. (5)
При контакте с воздухом окисляется, покрываясь
тонкой пленкой оксида и гидроксида.
. Взаимодействие с водой:
Mg + 2H2O
+ 2NH4Cl
= MgCl2
+ 2NH4OH
+ H2↑,
(6) + Н2О = MgO + H2↑. (7)
Магний разлагает воду только при нагревании, амальгамировании
его поверхности или введении в раствор хлорида аммония.
. Взаимодействие с кислотами (в результате
получаются соли):
Mg + 2HCl
= MgCl2 +
H2↑,
(8)
Mg + H2SO4(разб.)
= MgSO4 + H2↑, (9)+
2H2SO4(конц.)
= MgSO4 + SO2
+ 2H2O, (10)
Mg + 10HNO3(разб.)
= 4Mg(NO3)2 + NH4NO3+3H2O,
(11)
Mg + 8HNO3(конц.)
=
3Mg(NO3)2
+ 2NO + 4H2O.
(12)
Исключения: магний (т.е. металл, фторид и фосфат
которого малорастворимы в воде) при действии HF
и H3PO4
подвергается пассивации.
. Взаимодействие с неметаллами:
Mg + Cl2
= MgCl2,
(13)
3Mg
+ N2 =
Mg3N2.
(14)
. Взаимодействие с щелочами:
Mg + NaOH
≠
(15)
Щелочи на магний не действуют.
.1.3 Применение
. Магний применяется для восстановления
металлического титана из тетрахлорида титана:
4(газ)
+ 2Mg(ж) = Ti(тв) + 2MgCl2(ж). (16)
. Магний в основном используют для производства
«сверхлегких» сплавов, в металлотермии - для производства: титана (Ti),
циркония (Zr), ванадия (V),
урана (U) и др.
. Сплавы на основе магния являются важным
конструкционным материалом в авиационной и автомобильной промышленности
благодаря их лёгкости и прочности.
. Магний в виде чистого металла, а также его
химические соединения (бромид, перхлорат) применяются для производства очень
мощных резервных электрических батарей (например, магний-перхлоратный элемент,
серно-магниевый элемент, хлористо-свинцово-магниевый элемент,
хлорсеребряно-магниевый элемент, хлористо-медно-магниевый элемент,
магний-ванадиевый элемент и др.) и сухих элементов (марганцево-магниевый
элемент, висмутисто-магниевый элемент, магний-м-ДНБ элемент и др.). Химические
источники тока на основе магния отличаются очень высокими значениями удельных
энергетических характеристик и высоким разрядным напряжением.
5. Оксид магния (MgO) применяется в качестве
огнеупорного материала для производства тиглей и специальной футеровки
металлургических печей.
Перхлорат магния (Mg(ClO4)2)
- (ангидр) применяется для глубокой осушки газов в лабораториях, и в качестве
электролита для химических источников тока с участием магния.
Фторид магния (MgF2) - в виде
синтетических монокристаллов применяется в оптике (линзы, призмы).
Бромид магния (MgBr2) - в качестве
электролита для химических резервных источников тока.
. Свойство магния гореть белым ослепительным
пламенем широко используется в военной технике для изготовления осветительных и
сигнальных ракет, трассирующих пуль и снарядов, зажигательных бомб.
. Оксид и соли магния традиционно применяется в
медицине в кардиологии, неврологии и гастроентерологии (аспаркам, сульфат
магния, цитрат магния. Наиболее интересным природным ресурсом магния является
минерал бишофит).
. Магниевый порошок с окисляющими добавками
(нитрат бария, нитрат аммония, перманганат калия, гипохлорит натрия, хлорат
калия и т. д.) применялся (и применяется сейчас в редких случаях) в фотоделе в
химических фотовспышках (магниевая фотовспышка).
Бромид магния (MgBr2)
- бесцветные гексагональные диамагнитные кристаллы. Т. пл. 710°С, т. кип.
1430°С, пл. 3,72 г/см3. Молярная электропроводность при бесконечном
разведении при 25оС равна 262,2 Cм.см2/моль.
Растворяется в воде, спирте. Легко присоединяет аммиак, пиридин и этилендиамин.
Известен кристаллогидрат MgBr2.6Н2O.
Получение:
Получают взаимодействием магния и брома при
нагревании:
Mg + Br2
= MgBr2.
(17)
Применение:
Применяется для получения элементарного брома,
бромида серебра и других мало растворимых в воде бромидов.
Гептагидрат сульфата магния (MgSO4·7H2O)
- бесцветные кристаллы с ромбической решеткой; пл. 1,68 г/см3;
твердость по Моосу 2-2,5; в воде легко растворяется. Другие названия -
английская соль, горькая соль, магнезия (медицинский жаргон), эпсом (англ.
epsom) соль.
В природе английская соль содержится в воде
многих горьких минеральных источников, из которых её раньше и добывали.
Впервые в 1695 году была выделена английским
ботаником Неемия Грю из воды минерального источника в Эпсоме, отсюда название
минерала того же состава - эпсомит [2].
Применение:
. В пищевой промышленности зарегистрирован в
качестве пищевой добавки E518.
. В медицине используется в качестве слабительного,
а также как успокоительное, в качестве спазмолитика, как противосудорожный
препарат.
. Традиционно используется при принятии лечебных
ванн.
. Очень концентрированный раствор (30%)
английской соли используется в флоатинг-терапии.
Гидрид магния (MgH2)
- твердое белое нелетучее вещество. Молярная масса 26,32 г/моль, т. пл. 320°C.
Содержит 7,66% водорода. Мало растворим в воде. Разлагает воду и спирты.
Распадается на элементы при сильном нагревании. Образуется при взаимодействии
магния с водородом при нагревании.
Гидроксид магния (Mg(OH)2)
- неорганический гидроксид щелочноземельного металла магния. Относится к классу
нерастворимых оснований. Встречается в природе в виде белого волокнистого
вещества, называемого бруситом. Бесцветные тригональные кристаллы со слоистой
решеткой. Плотность равна 2,38 г/см3. Молярная электропроводность
при бесконечном разведении при 25оС равна 502,6 Cм.см2/моль.
При температуре выше 350 C разлагается на оксид магния и воду. Поглощает
углекислый газ и воду из воздуха с образованием основного карбоната магния.
Гидроксид магния практически нерастворим в воде. Является слабым основанием.
Обезвоживается при нагревании. Встречается в природе в виде минерала брусита.
Получение:
. Взаимодействие растворимых солей магния с
щелочами:
MgCl2 + 2NaOH = Mg(OH)2
+ 2NaCl, (18)(NO3)2 + 2KOH = Mg(OH)2 + 2KNO3.
(19)
. Взаимодействие раствора хлорида магния с
обожжённым доломитом:
MgCl2 + (CaO·MgO) + 2H2O
= 2Mg(OH)2 + CaCl2. (20)
. Взаимодействие металлического магния с парами
воды:
Mg + 2H2O
= Mg(OH)2
+H2↑.
(21)
Химические свойства:
. Разложение при нагревании до 350°C:
Mg(OH)2
= MgO + H2O
(22)
. Взаимодействие с кислотами с образованием соли
и воды (реакция нейтрализации):
Mg(OH)2 + 2HCl = MgCl2
+ 2H2O, (23)(OH)2 + H2SO4 = MgSO4
+ 2H2O. (24)
. Взаимодействие с кислотными оксидами с
образованием соли и воды:
Mg(OH)2 + CO2
= MgCO3 + H2O, (25)(OH)2 + SO3 =
MgSO4 + H2O. (26)
. Взаимодействие с горячими концентрированными
растворами щелочей с образованием гидроксомагнезатов:
Mg(OH)2 + 2NaOH = Na2[Mg(OH)4],
(27)(OH)2 + Sr(OH)2 = Sr[Mg(OH)4] . (28)
Применение:
. Гидроксид магния используется в качестве
пищевой добавки, для связывания диоксида серы, как флокулянт для очистки
сточных вод, в качестве огнезащитного средства в термопластических полимерах
(полиолефины, ПВХ), как добавка в моющие средства, для получения оксида магния,
рафинирования сахара, в качестве компонента зубных паст.
. В медицине его применяют в качестве лекарства
для нейтрализации кислоты в желудке, а также как очень сильное слабительное.
. В Европейском союзе гидроксид магния
зарегистрирован в качестве пищевой добавки E528.
. В промышленности извлекается из морской воды
путем осаждения известковым или доломитовым молоком.
Иодид магния (MgI2, магний
йодистокислый) - бесцветные кристаллы, очень гигроскопичные, т. пл. 700°С,
плотность равна 4,25 г/см3. Молярная электропроводность при
бесконечном разведении при 25оС равна 259,6 Cм.см2/моль.
Хорошо растворяется в воде, спирте, эфире, аммиаке, метиловом спирте. Из водных
растворов кристаллизуется в виде октагигидрата MgI2·8Н2O
(при температуре выше 43 °C - гексагидрат MgI2·6Н2O). Из
аммиачных растворов кристаллизуется сольват MgI2·6NН3.
Получение:
. Иодид магния получают взаимодействием оксида
магния и йодистоводородной кислоты:
MgO + 2HI
= MgI2
+ H2O.
(29)
. или непосредственным взаимодействием
элементов:
Mg + I2
= MgI2.(30)
Химические свойства:
На воздухе иодид магния темнеет из-за выделения
иода (поэтому его хранят в водородной атмосфере):
MgI2
+ O2
= 2MgO + 2I2.
(31)
Применение:
Иодид магния используется в некоторых
гомеопатических препаратах.
Гидрокарбонат магния (Mg(HCO3)2)
- молярная электропроводность при бесконечном разведении при 25оС
равна 195 Cм.см2/моль. Получают в растворе при
пропускании углекислого газа через водную суспензию оксида, гидроксида или
карбоната магния. Наличие гидрокарбоната магния в воде обуславливает ее
временную жесткость, которая устраняется кипячением или добавлениям соды.
Карбонат магния (MgCO3) -
магний углекислый, магниевая соль угольной кислоты. Бесцветные тригональные
диамагнитные кристаллы с пл. 3,4 г/см3. Молярная электропроводность
при бесконечном разведении при 25оС равна 244,6 Cм.см2/моль.
Мало растворим в холодной воде. В горячей воде переходит в основные карбонаты.
Растворяется в кислотах. Разлагается при нагревании. При насыщении CO2
водной суспензии MgCO3 последний растворяется вследствие образования
гидрокарбоната Мg(HCO3)2. Из водных растворов в
отсутствие избытка CO2 выделяются основные карбонаты магния. С
карбонатами ряда металлов карбонат магния образует двойные соли, к которым
относится и природный минерал доломит MgCO3·CaCO3.
Применение:
. Основной карбонат магния 3MgCO3·Mg(OH)2·3H2O
(так называемая белая магнезия) применяют как наполнитель в резиновых смесях,
для изготовления теплоизоляционных материалов.
. В медицине и в качестве пищевой добавки E504
используется основной карбонат магния 4MgCO3·Mg(OH)2·nH2O
Оксид магния (MgO
- жжёная магнезия, периклаз) - бесцветные кристаллы, легкий, рыхлый порошок
белого цвета, легко впитывает воду, нерастворимые в воде, пожаро- и
взрывобезопасен. Встречается в природе в виде серовато-зеленых прозрачных
октаэдрических кристаллов. Т. пл. 2850оС, т. кип. 3600оС,
пл. 3,67 г/см3. Мало растворим в воде, растворяется в спирте,
разбавленных кислотах.
Получение:
Получают обжигом минералов магнезита:
MgCO3
= MgO + CO2.
(32)
Химические свойства:
Легко реагирует с разбавленными кислотами и
водой с образованием солей и Mg(OH)2:
MgO + 2HCl(разб.)
= MgCl2
+ H2O,
(33)
MgO + H2O
= Mg(OH)2.
(34)
Применение:
. В промышленности применяется для производства
огнеупоров, цементов, очистки нефтепродуктов, как наполнитель при производстве
резины.
. В медицине применяют при повышенной
кислотности желудочного сока, так как она обусловливается избыточным содержанием
соляной кислоты. Жжёную магнезию принимают также при случайном попадании в
желудок кислот.
. В пищевой промышленности, зарегистрирован в
качестве пищевой добавки E530.
. Является абсолютным отражателем - веществом с
коэффициентом отражения, равным единице в широкой спектральной полосе.
Перхлорат магния (Mg(ClO4)2 -
ангидрон) - белая пористая масса, т. пл. 251 C, очень энергично поглощает влагу
(до 60% от своей массы) с образованием кристаллогидрата, не расплывается
(преимущество перед Р2О5). Ангидрон часто применяют для
глубокой осушки газов от следов воды.
Сульфид магния (MgS)
- бесцветные кубические кристаллы, т. пл. 2000оС, пл. 2,79 г/см3.
Малорастворим в воде. Реагирует с галогенами. Разлагается разбавленными
кислотами с образованием солей и выделением сероводорода. Получают
взаимодействием магния с серой или сероводородом.
Сульфат магния (MgSO4)
- бесцветные ромбоэдрические диамагнитные кристаллы с плотностью 2,66 г/см3,
т. пл. 1185оС. Молярная электропроводность при бесконечном
разведении при 25оС равна 266 Cм.см2/моль.
Растворяется в воде, спирте и эфире. Можно получить в лаборатории
взаимодействием оксида или карбоната магния с серной кислотой или дегидратацией
MgSO4.7Н2O. В промышленности получают из
морской воды или из природных минералов - карналлита и кизерита. Применяется
для отделки тканей, производства огнестойких тканей и бумаги, при дублении
кожи, в качестве протравы в красильной промышленности.
Фторид магния (MgF2) - бесцветные
диамагнитные тетраэдрические кристаллы. Т. пл. 1396°С, т. кип. 2260°С, пл. 3,13
г/см3. Молярная электропроводность при бесконечном разведении при 25оС
равна 216,8 Cм.см2/моль. Мало растворим в воде и ацетоне,
растворяется в растворах фторидов и сульфатов щелочных металлов. Можно
получить, сжигая магний в атмосфере фтора или действуя плавиковой кислотой на
оксид магния. Применяется для защиты металлов от коррозии и изготовления
матового стекла и керамики.
Получение:
Для получения хлорида магния обезвоживают
бишофит до MgCl2·2H2O,
а затем проводят дегидратацию в токе хлороводорода при 100-200 °C.
Применение:
. Хлорид магния применяют главным образом в
производстве металлического магния, MgCl2·6H2O
используется для получения магнезиальных цементов.
. Используется для обработки ледяного и снежного
покрова. В результате реакции со снегом вызывает его таяние.
. Хлорид магния зарегистрирован в качестве
пищевой добавки E511.
Цитрат магния (C6H6O7Mg
- магниевая соль лимонной кислоты) - лекарственное средство, источник магния,
одного из важнейших внутриклеточных макроэлементов в организме. Белый порошок
без запаха, слабокислого вкуса. Медленно растворим в холодной воде, хорошо
растворим в горячей. Получаемый раствор прозрачен и имеет привкус лимонной
кислоты.
Применение:
. В зарубежной медицине цитрат магния эффективно
используется как слабительное для очистки кишечника перед хирургической
операцией или колоноскопией.
. В пищевой промышленности используется в
качестве пищевой добавки E345 как регулятор кислотности, придающий вкус и
аромат, свойственный лимону и лайму.
.3 Нитрат магния
Общая характеристика:
Нитрат магния (Mg(NO3)2)
- NO3--11%,
MgO-15%. Бесцветные
гигроскопичные кристаллы с кубической решеткой; температура плавления 426°C (с
разложением). Молярная электропроводность при бесконечном разведении при 25оС
равна 248,92 Cм.см2/моль. Выше 300°C начинает разлагаться
на оксид магния и оксиды азота. Встречается в природе в небольших количествах в
виде нитромагнезита (гидрат), или магнезиевой селитры. Растворимость в воде (г
в 100 г): 73,3 (20°C), 81,2 (40°C), 91,9 (60°C). Растворим также в этаноле (C2H5OH),
метаноле (CH3OH),
жидком аммиаке (NH3).
Известны кристаллогидраты Mg(NO3)2.9Н2O,
Mg(NO3)2.6Н2O и Mg(NO3)2.2Н2O.
Из водных растворов в зависимости от концентрации кристаллизуются нона-, гекса-
и дигидраты.
Гексагидрат - бесцветные кристаллы. Существует в
трех модификациях. При - 13-66°C устойчива форма с моноклинной решеткой;
температура плавления 90°C, плотность 1,46 г/см3. Выше 90 °C
обезвоживается до дигидрата, затем происходит отщепление воды с частичным
гидролизом и разложение до MgO. Является исходным соединением при синтезе MgO
особой чистоты, нитратов других металлов, а также разложении соединений Mg.
Дигидрат - бесцветные кристаллы с моноклинной
решеткой; температура плавления 130°C, плотность 2,02 г/см3.
Получение:
. В промышленности получают из природного
минерала нитромагнезита.
. В лаборатории получают взаимодействием магния,
оксида магния или гидроксида магния с разбавленной азотной кислотой:
4Mg + 10HNO3(разб.)
= 4Mg(NO3)2 + NH4NO3 +3H2O,
(35)+ 2HNO3(разб.)
= Mg(NO3)2 + H2O. (36)
Химические свойства:
. Растворяется в безводном жидком аммиаке и
абсолютизированном спирте, образуя продукты различного состава:
Mg(NO3)2 + nNH3
= Mg(NO3)2 ·nNH3 (n=1, 2, 4, 6), (37)(NO3)2
+ 6CH3OH = Mg(NO3)2·6CH3OH,
(38)(NO3)2 + 6C2H5OH = Mg(NO3)2·
6C2H5OH. (39)
. При взаимодействии с растворами щелочей
выпадает белый осадок гидроксида магния Mg(OH)2:
Mg(NO3)2
+2NaOH = Mg(OH)2 + 2NaNO3. (40)
. Взаимодействует с растворами плавиковой,
фосфорной, угольной, кремниевой кислот с образованием нерастворимых в воде
солей:
(NO3)2 + 2HF = MgF2
+ 2HNO3, осадок белого цвета, (41)
Mg(NO3)2 + 2H3PO4
= Mg3(PO4)2 + 6HNO3, осадок белого
цвета, (42)(NO3)2 + CO2 + H2O =
MgCO3 +2HNO3, осадок белого цвета, (43)(NO3)2
+ H2SiO3 = MgSiO3 +2HNO3, осадок
белого цвета. (44)
. Водный раствор Mg(NO3)2
имеет кислую среду раствора вследствие гидролиза по катиону:
Mg(NO3)2 + H2O
= Mg(OH)NO3 + 2HNO3, (45)
Mg2+ + H2O = MgOH+
+ H+ (гидролиз по первой ступени), (46)
Mg(OH)NO3 + H2O
= Mg(OH)2 + HNO3, (47)
MgOH+ + H2O = Mg(OH)2
+ H+ (гидролиз по второй ступени). (48)
Применение:
. Компонент сложных удобрений, поскольку магний
входит в состав хлорофилла, который необходим для фотосинтеза, способствует
повышению активности многих ферментов и выступает в роли транспортера фосфора.
Высокая растворимость и низкая электропроводность делают продукт исключительно
подходящим для листовой подкормки, особенно при использовании оросительных вод
с высокой концентрацией солей. Удобрение используется для корневого и
некорневого питания овощных, ягодных, плодовых культур, винограда.
. Окислитель в пиротехнических составах.
магний изотоп соль синтез
Глава 2. Экспериментальная часть
2.1 Приборы и реактивы
Реактивы:
. Оксид магния (химически чистый);
2. 40-50%-й раствор азотной кислоты
(химически чистая).
Приборы:
. Аналитические весы;
2. Химический стакан;
. Шпатель;
. Пипетка;
. Химическая груша;
. Электрическая плитка.
.2 Методика синтеза
Вычисляют объем раствора HNO3
заданной концентрации и массу MgO
или MgCO3,
требуемые для получения 2 г Mg(NO3)2·6H2O.
Оксид или соответственно карбонат магния следует взять на 10% больше
теоретического количества с тем, чтобы избыточная часть их осталась
нерастворенной.
Рассчитанный объем кислоты наливают в стакан и с
помощью шпателя добавляют небольшими порциями оксид или карбонат магния. В
последнем случае необходимо соблюдать осторожность из-за бурного выделения CO2.
Примесь железа, которая может содержаться в
исходном карбонате магния, осаждается избытком его в виде Fe(OH)3:
2Fe(NO3)3 +
3MgCO3 + 3H2O = 2Fe(OH)3 + 3Mg(NO3)2
+ 3CO2 , (49)
а примеси катионов, осаждаемых сероводородом,
удаляют добавлением 1 - 2 мл сероводородной воды.
Смесь фильтруют, осадок отбрасывают, а фильтрат
упаривают до образования на его поверхности кристаллической пленки. Раствор
охлаждают и выпавшие бесцветные кристаллы Mg(NO3)2·6H2O
отсасывают и высушивают при комнатной температуре. Соль взвешивают и определяют
ее выход по отношению к карбонату или оксиду магния [3].
.3 Проведение расчетов
Необходимо получить 2 г. нитрата магния.
Рассчитаем массы исходных реагентов:
MgO + 2HNO3 + 5H2O
= Mg(NO3)2·6H2O (50)
n(Mg(NO3)2)
= 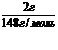 = 0,01моль,
= 0,01моль,
n(MgO) = 0,01моль,(MgO)
= 0,01моль 40 г/моль = 0,4г,
На три параллели опыта, потребуется: 0,4г · 3 =
1,2г,
n(HNO3)
= 0,01моль 2 = 0,02моль,
m(HNO3)
= 0,02моль 63г/моль = 1,26г,
V(HNO3) = 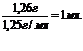
На три параллели опыта, потребуется:
1мл · 3 = 3мл.
Так как кислоты требуется в два раза
больше, то на три параллели опыта, азотной кислоты потребуется: 3мл · 2 = 6мл.
2.4 Проведение эксперимента
Взяли навеску 0,4 г оксида магния (II).
Взяли аликвоту 3 мл азотной кислоты в химическом стакане. Далее вносили навеску
оксида и перемешивали до полного растворения с заметным экзоэфектом. После чего
отфильтровывали избыток оксида магния. Затем упаривали до образования
кристаллов соли. После чего переносили в чашку Петри.
Проведено 3 параллельных синтеза. Массы
образующегося Mg(NO3)2
составляют: m1
= 1,1 г,
m2 = 0,9
г,
.5 Расчет выхода
ω = 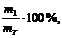
ω1 = 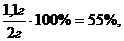
ω2 = 
ω3 = 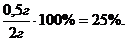
Поскольку выход в третьей параллели
резко отличается, при расчете выхода, его не учитывали.
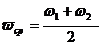
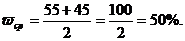
Малый выход объясняется большим
остатком нерастворенной части оксида магния.
2.6 Идентификация
Обнаружение ионов магния
Обнаружение малорастворимого гидроксида магния.
При действии щелочей на синтезированную соль
образовался белый аморфный осадок Mg(OH)2:
Mg2+
+ 2OH-
= Mg(OH)2
. (51)
Обнаружение нитрат - ионов
Восстановление до аммиака цинком или алюминием в
щелочной среде.
Поместили в пробирку 3-5 капель испытуемого
раствора, приблизительно столько же 2н раствора NaOH
или KOH, 1-2
микрошпателя цинковой пыли и слегка нагрели только до начала реакции. Если ионы
NO3-
присутствуют, они восстанавливаются до NH3,
который обнаруживается с помощью лакмусовой бумажки, смоченной каплей
фенолфталеина:
4Zn + NO3- +
7OH- = 4ZnO22- + NH3 + 2H2O
. (52)
После проведения опыта почувствовали резкий
запах и лакмусовая бумажка приобрела синий цвет, следовательно, произошло
выделение аммиака [3].
Выводы
1. Синтезирован нитрат магния по реакции
концентрированной азотной кислоты с оксидом магния. Выход продукта составил
50%.
. Соединение идентифицировано по качественным
реакциям.
Список ЛИТЕРАТУРЫ
1. Ахметов,
Н.С. Общая и неорганическая химия: учеб. для вузов / Н.С. Ахметов. - 3-е изд.,
перераб. и доп. - М.: Высш. шк., 1998. - 743 с.
2. Википедия
- свободная энциклопедия: сайт / Магний
. Гольбрайх,
З.Е. Практикум по неорганической химии: учеб. пособие / З.Е. Гольбрайх. - 4-е
изд., перераб. и доп. - М.: Высш. шк., 2008. - 350 с.
. Павлов,
Н.Н. Общая и неорганическая химия: учеб. для вузов / Н.Н. Павлов. - 2-е изд.,
перераб. и доп. - М.: Дрофа, 2002. 448 с.
. Популярная
библиотека химических элементов: сайт / Библиотека Мошкова. - Магний.
. Угай,
Я.А. Общая и неорганическая химия: учеб. для вузов / Я.А. Угай. - 5-е изд.,
стер. - М.: Высш. шк., 2007. - 527 с.
. Энциклопедический
словарь юного химика / Сост. В.А. Крицман, В.В. Станцо. - М.: Педагогика, 1982.
- 368 с.