Получение и идентификация хлоропентаамминкобальта (III), нитропентаамминкобальта (III), нитритопентаамминкобальта (III)
Контрольная
работа
Получение и
идентификация хлоропентаамминкобальта (III),
нитропентаамминкобальта (III),
нитритопентаамминкобальта (III)
Содержание
Введение
. Литературный обзор
. Экспериментальная часть
.1 Синтез комплекса хлорида хлоропентаамминкобальта
(III)
.2 Синтез комплекса хлорида
нитропентаамминкобальта (III)
.3 Синтез комплекса хлорида
нитритопентаамминкобальта (III)
. Обсуждение результатов
Выводы
Список литературы
Введение
Современная техника
основывается на металлах и металлических сплавах. Прогрессивное развитие
отраслей промышленности основывается на широком применении жаропрочных и
высокопрочных сплавов.
Кобальт
используется в качестве добавки к сталям, при этом повышая жаропрочность стали.
Сплавы кобальта используют для защиты от износа поверхностей деталей,
подверженных высоким нагрузкам, что увеличивает срок службы данных деталей.
Кобальт применяется
при производстве магнитных сплавов; самый известный из них - сталь альнико, как
видно из названия, входят алюминий, никель, кобальт. Этот сплав применяется для
изготовления постоянных магнитов, мощность которых в ~25 раз больше по
сравнению с обычными стальными магнитами.
Кобальт
используется при производстве химикатов для изготовления керамики и красок. При
производстве керамики в настоящее время он служит не для получения синего
цвета, а как компонент белого для компенсации желтого оттенка из-за примесей
железа. Однако синие пигменты используются в красках и чернилах, а соединения
кобальта применяются для ускорения процесса окисления и высыхания красок на
масляной основе.
Соединения кобальта
служат катализаторами некоторых органических реакций, среди которых наибольшее
значение имеют реакции гидроформилирования (т.е. присоединение Н и
формил-группы СНО), гидрирования и дегидрирования:
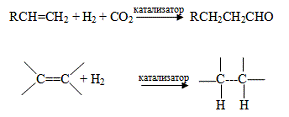
Кобальт влияет на
обмен белка и синтез нуклеиновых кислот, на обмен углеводов и жиров, на
окислительно-восстановительные реакции в животном организме.
Кобальт стимулирует
процессы кроветворения, участвует в синтезе витамина В12 кишечной
микрофлорой, входит в состав В12-зависимых ферментов, является
активатором некоторых ферментативных процессов. При недостатке Кобальта в
рационе снижается продуктивность животных, нарушаются обмен веществ и
кроветворение, у жвачных возникают эндемичные заболевания - акобальтозы.
Кобальт участвует в
ферментных системах клубеньковых бактерий, осуществляющих фиксацию атмосферного
азота; стимулирует рост, развитие и продуктивность бобовых и растений ряда
других семейств.
Целью данной работы является синтез и изучение
свойств комплексов Со(III).
хлорид кобальт углевод окислительный
1. Литературный обзор
Для кобальта степень окисления (III)
дает наибольшее разнообразие соединений, в том числе и широкий спектр
кинетически инертных комплексов. Почти все они имеют октаэдрическую структуру.
Комплексы кобальта(III)
кинетически инертны, поэтому предпочтительно использование непрямых методов
получения. Чаще всего лиганд добавляют к водному раствору соответствующей соли
кобальта(II) и получаемый
комплекс кобальта(II)
окисляют каким-либо удобным окислителем, нередко (при использовании N-донорного
лиганда) в присутствии катализатора (активного древесного угля). Часто в
качестве активного окислителя используют кислород, продувая ток воздуха через
раствор. Во многих случаях тот же результат, но быстрее достигается при
использовании водных растворов Н2О2.
Ион NO2-
образует чрезвычайно устойчивые комплексы, наиболее известный - оранжевый
гексанитритокобальтат(III)
натрия, водные растворы которого использовались для в анализе для
количественного осаждения К+ в виде гексанитритокобальтата(III)
калия. При добавлении фторид-ионов получают K3[CoF6];
его анион примечателен: это единственный гексагалогенокобальтат(III),
этот комплек паромагнитный и высокоспиновый.
Амминные комплексы кобальта, число которых
огромно, были среди первых систематически изученных координационных соединений.
Обычно первым синтезом комплекса кобальта(III)
считают опыты Б.М. Тассаэрта, который в 1798 г. обнаружил, что водные растворы
хлорида кобальта(II)
в аммиаке постепенно становятся коричневыми на воздухе, а при кипячении
приобретают вино-красный цвет. Позднее стало понятно, что в данном случае речь
идет не об одном комплексе и что, варьируя относительные концентрации аммиака и
хлорид-иона, можно выделить комплексы CoCl3*xNH3
(x=6, 5 и 4). Это
наиболее изученный класс комплексов кобальта(III).
Процесс окисления водных смесей CoX2,
NH4X,
NH3
(X = Cl,
NO3
и т.д.) можно, меняя условия и соотношения реагентов, применять для получения
комплексов [Co(NH3)6]3+,
[Co(NH3)5X]2+,
[Co(NH3)4X2]+.
При замещении Х на анионные или нейтральные лиганды, увеличивается число
соединений. Из-за инертности соединений реакции замещения идут медленно,
поэтому их можно изучать обычными аналитическими методами, и они стали
постоянными объектами кинетических исследований. Прямая и обратная реакции
пентаамминов стали наиболее изученными реакциями замещения:
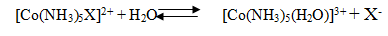
2. Экспериментальная часть
.1 Получение хлорида хлоропентаамминкобальта(III)
Навеску гексагидрата хлорида кобальта(II)
(CoCl2*6H2O
- вещество малинового цвета, 5,079 г) и хлорида аммония (NH4Cl
- вещество белого цвета, 10,055 г) растворили в 10 мл воды, перемешивали на
магнитной мешалке. Продолжая перемешивать, прилили 30 мл концентрированного
раствора аммиака (раствор желто-коричневого цвета), далее по каплям добавляли
15 мл концентрированного раствора пероксида водорода (раствор темно-красного
цвета). Полученный раствор перемешивали при комнатной температуре (t
= 23°С) до окрашивания его в вино-красный цвет. Раствор имел сильно щелочную
среду (рН = 12), нейтрализовали раствор 15 мл концентрированной соляной
кислоты. Для выделения осадка комплекса к полученному раствору добавили 10 мл
концентрированной соляной кислоты и нагрели смесь, затем охладили смесь до
комнатной температуры (осадок - красно-фиолетового цвета). Выпавший осадок
отфильтровали на воронке Бюхнера, промыли сначала 5 мл воды, затем 5 мл
этанола, высушили током воздуха при включенном водоструйном насосе. η([Co(NH3)5Cl]Cl2)=98,3%.
2CoCl2 + 8NH3
+ 2NH4Cl + H2O2 = 2[Co(NH3)5Cl]Cl2
+ 2H2O
.2 Получение хлорида
нитропентаамминкобальта(III)
К навеску хлорида хлоропентаамминкобальта(III)
([Co(NH3)5Cl]Cl2
- 2,008 г) прилили 33,3 мл воды и 4,7 мл 25%-го раствора аммиака (раствор
малинового цвета). Смесь нагрели на водяной бане до растворения исходного
комплекса. Профильтровали полученный раствор через бумажный фильтр «красная
лента» (рН(фильтрата) = 11), приливали раствор хлороводородной кислоты до
достижения рН = 1. Добавили маленькими порциями навеску нитрита натрия (NaNO2
- вещество белого цвета, 5,33 г), наблюдали выпадение красно-оранжевого осадка
и выделение бурого газа. Содержимое колбы нагрели при перемешивании на
магнитной мешалке до растворения осадка, затем добавили 26,7 мл
концентрированного раствора хлороводородной кислоты, наблюдали выпадение
кристаллов кораллового цвета. Отфильтровали кристаллы через стеклянный фильтр с
пористым дном (40 пор), промыли на фильтре 10 мл концентрированного раствора хлороводородной
кислоты и два раза 10 мл этанола. Высушили в сушильном шкафу при 70°С. m
([Co(NH3)5NO2]Cl2)
= 2,74 г. (выход продукта оказался более 100%, скорее всего, вещество было
недостаточно высушено).
[Co(NH3)5Cl]Cl2
+ NaNO2
= [Co(NH3)5NO2]Cl2
+NaCl
.3 Получение хлорида
нитритопентаамминкобальта(III)
К навеску хлорида хлоропентаамминкобальта(III)
([Co(NH3)5Cl]Cl2]
- 2,008 г) прилили 33,3 мл воды и 4,7 мл 25%-го раствора аммиака (раствор
малинового цвета). Смесь перемешали при нагревании на магнитной мешалке до
растворения исходного комплекса. Полученный раствор профильтровали через
бумажный фильтр «красная лента» (рН (фильтрата) = 11,5), нейтрализовали раствор
до рН=5,5 раствором хлороводородной кислоты. К полученному раствору добавили
5,33 г нитрита натрия и прилили 6 мл раствора хлороводородной кислоты
(выделение белого дыма, раствор рыжего цвета). Оставили смесь на 1 час, выпал
оранжевый осадок. Осадок отфильтровали на воронку Бюхнера, промыли 10 мл
ледяной воды и 10 мл этанола. Высушили между листами фильтровальной бумаги. η([Co(NH3)5ОNO]Cl2)=50,527%
[Co(NH3)5Cl]Cl2
+ NaNO2 = [Co(NH3)5ONO]Cl2 + NaCl
3. Обсуждение результатов
Комплексные соединения Со(III)
были получены при взаимодействии соответствующих солей кобальта и лиганда по
схемам:
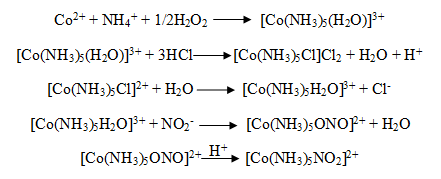
Были проверены отношения водных растворов
комплексов к растворам нитрата серебра, гидроксида и сульфида натрия, серной
кислоты (для [Co(NH3)5NO2]Cl2).
Реакции водного раствора [Co(NH3)5Cl]Cl2:
[Co(NH3)5Cl]Cl2
+ 2AgNO3 = 2AgCl +[Co(NH3)5Cl](NO3)2
Наблюдения: светло-лиловый раствор с белыми
хлопьями.
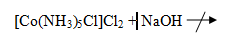
Наблюдения: видимых изменений не произошло, т.к.
амминные комплексы кобальта(III)
очень устойчивы (β6([Co(NH3)6]Cl3)
= 1,6*1035).
2[Co(NH3)5Cl]Cl2
+ 3Na2S = 2CoS + 6NaCl + 10NH3 + S
Наблюдения: черный мелкокристаллический раствор,
это объясняется тем, что произошла окислительно-восстановительная реакция, в
ходе которой кобальт восстановился до сульфида кобальта(II),
а S2-
окислилась до желтой серы, но ее не было видно из-за черного CoS.
Реакции водного раствора [Co(NH3)5NO2]Cl2:
[Co(NH3)5NO2]Cl2
+ 2AgNO3 = 2AgCl + [Co(NH3)5NO2](NO3)2
Наблюдения: образовались белые хлопья.
2[Co(NH3)5NO2]Cl2
+ 3Na2S + 3H2O = Co2O3 + 4NaCl +
10NH3 + 3H2S +2NaNO2
Наблюдения: черный мелкокристаллический раствор.
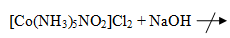
Наблюдения: видимых изменений не произошло.
2[Co(NH3)5NO2]Cl2
+ 9H2SO4 = Co2(SO4)3 +
6(NH4)2SO4 + 4HCl + 4H2O
Наблюдения: обесцвечивание раствора.
Реакции водного раствора [Co(NH3)5ONO]Cl2:
[Co(NH3)5ONO]Cl2
+ 2AgNO3 = 2AgCl + [Co(NH3)5ONO]NO3
Наблюдения: образовались белые хлопья.
2[Co(NH3)5ONO]Cl2
+ 3Na2S + 3H2O= Co2O3 + 4NaCl
+ 10NH3 + 3H2S +2NaNO2
Наблюдения: черный мелкокристаллический раствор.
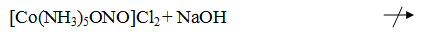
Наблюдения: видимых изменений не произошло.
Были сняты ИК-спктры полученных комплексов.
При снятии ИК-спектра полученного комплекса [Co(NH3)5Cl]Cl2
в
области 4000-400 нм-1 были обнаружены характерные полосы поглощения:
Таблица 1
|
Обозначение
|
Литературные
данные (см-1)
|
Что
характеризует данный пик
|
|
νs(NH3)
|
3288,7
|
3204
|
наличие
симметричных валентных колебаний
|
|
δd(NH3)
|
1601,1
|
1567,9
|
наличие
вырожденных деформационных колебаний
|
|
δs(NH3)
|
1309,5
|
1309,4
|
наличие
симметричных деформационных колебаний
|
|
ρr(NH3)
|
846,3
|
848,6
|
наличие
маятниковых колебаний
|
Можно сделать вывод, что значения данного
спектра близки к литературным данным.
При снятии ИК-спектра полученных комплексов [Co(NH3)5NO2]Cl2
и [Co(NH3)5ONO]Cl2
в
области 4000-400 нм-1 были обнаружены характерные полосы поглощения:
Таблица 2
|
Обозначение
|
[Co(NH3)5NO2]Cl2
экспериментальные данные (литературные), см-1
|
[Co(NH3)5ONO]Cl2
экспериментальные данные (литературные), см-1
|
Что
характеризует данный пик
|
|
ν (NH)
|
3267 (3277)
|
3281 (3283)
|
наличие
валентных колебаний
|
|
δd
(NH3)
|
1629 (1602)
|
1601 (1620)
|
наличие
вырожденных деформационных колебаний
|
|
δas
(N=O)
|
1425 (1415)
|
1428 (1428)
|
наличие
антисимметричных деформационных колебаний
|
|
δs
(NH3)
|
1315 (1307)
|
1314 (1313)
|
наличие
симметричных деформационных колебаний
|
|
νs
(N=O)
|
1315 (1307)
|
1367 (1380)
|
наличие
симметричных валентных колебаний
|
|
ρr
(NH3)
|
849 (837)
|
854 (843)
|
наличие
маятниковых колебаний
|
|
δr
(NO2)
|
825 (813)
|
825 (819)
|
наличие
деформационных колебаний
|
|
ρw
(NO2)
|
595 (590)
|
498 (500)
|
наличие
веерных колебаний
|
Можно сделать вывод, что значения данных
спектров близки к литературным данным.
Были сняты электронные спектры поглощения
полученных комплексов в области 350-800 нм. и были рассчитаны молярные коэффициенты
экстинкции максимумов поглощения по следующей формуле: lgεmax
= lg[D/
(L*C)]
Таблица 3
|
Комплексное
соединение
|
lgεmax (лит.)
|
λmax (лит.)
|
lgεmax
(лит.)
|
λmax
(лит.)
|
lgεmax
(лит.)
|
λmax
(лит.)
|
|
[Co(NH3)5Cl]Cl2
|
1,705(1,72)
|
533
(541)
|
364
(368)
|
|
|
|
[Co(NH3)5NO2]Cl2
|
0,912(1,99)
|
460
(463)
|
1,029
(3,26)
|
325
(326)
|
1,046(4,14)
|
236
(241)
|
|
[Co(NH3)5ОNO]Cl2
|
1,95(1,99)
|
460
(463)
|
1,873
(3,26)
|
325
(326)
|
2,048(4,14)
|
238
(241)
|
Сравнив полученные ИК-спектры и
электронные спектры поглощений с литературными данными, можно сделать вывод,
что синтезированные вещества близки к необходимым, но в них присутствуют
различные примеси. Причины образования примесей: не идеальные условия
проведения, недочеты в технике проведения.
Для водных растворов [Co(NH3)5NO2]Cl2
и
[Co(NH3)5ОNO]Cl2
были
измерены удельные электропроводности (χ) и
рассчитаны молярные электропроводности (μ).
(С= 10-2 моль/литр).
χ([Co(NH3)5NO2]Cl2)
= 4,55 мСм/см.
μ([Co(NH3)5NO2]Cl2)
= 45,5 См*м2/моль.
χ([Co(NH3)5ONO]Cl2)
= 2,28 мСм/см.
μ([Co(NH3)5ONO]Cl2)
= 22,8 См*м2/моль.
Можно сделать вывод, что водные растворы [Co(NH3)5NO2]Cl2
и
[Co(NH3)5ОNO]Cl2
слабые
проводники, проводимость водного раствора [Co(NH3)5NO2]Cl2
сильнее
проводимости водного раствора [Co(NH3)5ОNO]Cl2.
Выводы
· Были получены комплексные соединения
Co(III):
[Co(NH3)5Cl]Cl2,[Co(NH3)5NO2]Cl2,
[Co(NH3)5ONO]Cl2.
· Их свойства были охарактеризованы с
помощью качественных реакций, ИК-спектроскопии, электронной спектроскопии.
· Были идентифицированы нитро- и
нитрито- комплексы Co(III)
с помощью ИК-спектроскопии, удельной электропроводности.
Список литературы
1. Н. Гринвуд, А. Эрншо. Химия
элементов: в 2 томах. Пер. с англ. - М.: БИНОМ. Лаборатория знаний, 2008. Т. 2.
. Ю.Д. Третьяков и др.
Неорганическая химия. Химия элементов: Учебник в 2 томах. Изд-во МГУ; ИКЦ
«Академкнига», 2007. Т.1.
. К. Накамото. Инфракрасные
спектры неорганических и координационных соединений. Пер. с англ. - к.х.н. А.И.
Григорьева и к. х.н. Э.Г. Тетерина. Под редакцией д.х.н. Ю.А. Пентина. Изд-во
«МИР», Москва, 1996.