Основные понятия и объекты неорганической химии
Контрольная работа
Основные понятия и объекты
неорганической химии
Содержание
1. Газообразные фазы
2. Конденсированные фазы
2.1 Способ описания строения кристаллических фаз
2.2 Пределы устойчивости кристаллических структур
2.3 Дефекты твёрдого тела
2.4 Взаимодействие точечных дефектов
2.5 Жидкие фазы
2.6 Аморфные фазы
2.7 Способы получения некристаллических твёрдых фаз
Литература
1.
Газообразные фазы
Как известно, в основе кинетической теории газов лежит
представление об "идеальном газе" - системе состоящей из частиц,
объём которых стремится к нулю, и между которыми возможны только идеально
упругие столкновения. Основные положения этой теории сформулируем в виде
нескольких положений:
Газ состоит из взаимно непроницаемых молекул, заполняющих определённый
объём пространства.
. Диаметр молекул при 100 кПа составляет ≈ 1/10
расстояния между ними (т.е. суммарный объём молекул при указанном давлении
приблизительно равен 1/1000 объёма системы).
. Молекулы в газовой фазе находятся в беспрерывном движении,
что предопределяет их столкновение между собой и стенками сосуда, в котором
заключён газ. Эти столкновения предполагаются идеально упругими, поэтому
суммарный импульс всех молекул системы в результате столкновений не убывает,
несмотря на то, что при отдельных столкновениях происходит передача импульса от
одной движущейся молекулы к другой.
. Число молекул газа в единице объёма системы величина
постоянная при Т = const и р = const.
. Температура газа предопределяется средней кинетической
энергией молекул, а давление в системе является усреднённой силой повторяющихся
столкновений молекул со стенками сосуда.
"Идеальный газ", как система, характеризуется
четырьмя параметрами состояния: объём системы (V), число молей газа в
системе (n),
её температура (Т) и давление (р). Используя положения кинетической теории
газов, выведем уравнение состояния рассматриваемой системы. Для этого выведем
функции, связывающие два параметра системы при фиксированных других параметрах.
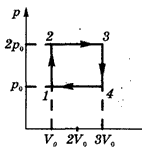
Рис 1.
При Т = const и р = const увеличение числа молекул в системе (согласно п.4
теории газов) должно приводить к росту объёма системы, т.е. между V и n прямо пропорциональная
зависимость: n
= k1V или n/V = k Если теперь
зафиксировать значение V, то при V = const, Т = const и р = const, величина n также будет постоянной: n = k1∙ const, т. е в равных
объёмах газа при одинаковых внешних условиях (Т = const и р = const) содержится равное число
молекул. Последний
вывод есть не что иное, как закон Авогадро.
2. При n = const и р = const находим зависимость V от Т. Согласно п.5
теории газов, температура системы предопределяется кинетической энергией
молекул. Рост энергии отдельных частиц увеличивает энергию столкновений между
ними, что приводит к увеличению среднего расстояния между этими частицами в
системе (к "расширению" системы, т.е. к росту её объёма). Тогда V = k2Т или V/Т = k2 - при неизменном
давлении в системе и фиксированном числе молекул в ней отношение её объёма к
температуре есть величина постоянная - закон Гей-Люссака. Более
привычным выражением этого закона является форма:
Vо /То = V1 /Т1
. При n = const и Т = const рост давления в системе уменьшает расстояние
между образующими её частицами, т.е. между этими параметрами обратно
пропорциональная зависимость: V = k3/р или V∙р = k3 - при неизменном
числе молекул системы и постоянной температуре произведение значения объёма
системы на давление в ней есть величина постоянная - закон Бойля -
Мариотта. Другая математическая форма данного закона: Vо∙ро = V1∙р
. При V = const и n = const, очевидно (п.5), что рост кинетической энергии
молекул (т.е. температуры) будет способствовать росту силы повторяющихся
столкновений молекул со стенками сосуда (т.е. давления). Тогда р = k4Т или р/Т = k4 - при фиксированом
объёме системы и неизменном числе, образующих её молекул отношение давления в
системе к её температуре есть величина постоянная - закон Шарля. Чаще
используется другая форма этого закона: ро/То = р1/Т
Рассуждая подобным образом, можно установить и взаимосвязь между
параметрами состояния системы и её кинетической энергией: Ек=½mv2 и согласно п.5 кинетическая энергия системы
пропорциональна её температуре (т. е Т = k5Ек). В свою
очередь значение температуры пропорциональны, как значениям объёма системы, так
и значениям её давления (см. выше). Математическое правило в теории
пропорциональности гласит: если одна величина одновременно пропорциональна
нескольким величинам, то она пропорциональна произведению этих величин. Для
рассматриваемого случая это означает: Т = k6V∙р, тогда k6V∙р = k5Ек или V∙р = (k5/ k6) Ек,
подставляя расчетные значения k5 и k6, получаем: V∙р = ⅔Ек.
Используя тот же приём, найдём уравнение состояния
"идеального газа": так как значения V пропорциональны Т и n, а также обратно
пропорциональны р, получаем уравнение: V = k7Т∙n/р или V∙р = k7Т∙n, коэффициент
пропорциональности k7 называется газовой постоянной и зачастую обозначается символом R. Тогда окончательный вид
уравнения состояния "идеального газа" (уравнения Менделеева -
Клапейрона): pV = nRТ. Значение R определено
экспериментально путём измерения молярного объёма гелия при н. у.: R = V∙р/Т∙n (Не - реальный газ,
который наиболее близок по характеристикам к "идеальному") - (V в л - экспериментальное
значение, р = 101,3 кПа, Т = 273оК, n = 1). Так как Дж = л∙кПа,
R в этом случае равен
8,3144 Дж/моль∙Ко. При других единицах измерения объёма и
давления значение R будет отличаться от приведённого выше значения: 0,082 л∙ат/моль∙Ко;
62400 мм рт. ст. ∙мл/ моль∙Ко; 1,9872 кал/
моль∙Ко и т.д., однако это не изменит физический смысл данной
величины. Чтобы найти физический смысл R, мысленно повысим
температуру 1 моля "идеального газа" на 1оК от Т до (Т +
1). Учитывая, что по условию задачи n равно единице, получаем: р∙V2 = R (Т + 1) и р∙V1 = RТ, тогда р∙V2 - р∙V1 = R (Т + 1) - RТ или р∙∆V = R, что в соответствии с
термодинамическими представлениями означает работу расширения 1 моля
"идеального газа" при повышении его температуры на 1оК при
р = const. Тогда физический смысл константы Больцмана (k = R/N), где N - число Авогадро -
работа одной частицы газа при тех же условиях (k = 1,38∙10-23
Дж/частица∙Ко). Константа Больцмана является одной из
важнейших физических величин и входит в выражения для энергии теплового
движения частиц, теплоёмкости, связывает значения энтропии с вероятностью
систем и т.д.
Установим теперь зависимость между среднеквадратичной
скоростью частиц (v) и температурой системы: V∙р = ⅔Ек
= ⅔∙½ amv2 = ⅓ amv2, где m - масса частицы, а -
число частиц системы. Для простоты будем считать, что система содержит 1 моль
газа, тогда а = N и pV = ⅓ Nmv2, так как N∙m = М (М - масса моля)
получим: v2 = 3pV/М, учитывая, что для одного моля газа справедливо равенство: pV = RТ, получим: v2 = 3 RТ/М и окончательно: v = √3 RТ/М.
Подстановка в последнее уравнение значений R, Т и М показывает:
а) v при н. у. имеет значения в пределах 1500 - 7000 км/ч;
б) при прочих равных условиях скорость движения частиц газа
тем выше, чем меньше значение их молярной массы.
Очевидно, что все частицы, входящие в состав системы не могут
иметь ни при каких условиях одинаковые значения скоростей, так как при их
столкновениях, носящих хаотический характер, происходит передача импульса от
одной частицы к другой. Реальные системы характеризуются набором частиц с
различной кинетической энергией, а следовательно движущихся с различными
скоростями. На основе законов статистической физики Максвелл в 1860 году
показал, что распределение частиц по скорости (при фиксированной температуре
системы) может быть проиллюстрировано с помощью кривой распределения
представленной на рис.2
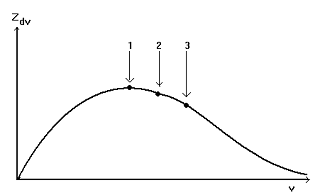
Рис. 2. Распределение частиц в системе по скоростям: Zdv - число частиц, скорость
которых изменяется в интервале v + dv, Z - общее число частиц, (1) - v1 - наиболее вероятная
скорость, (2) - v2 - средняя скорость, (3) - v3 - среднеквадратичная
скорость.
Однако, как показывают экспериментальные данные, классическая
кинетическая теория газов хорошо описывает только состояние систем,
образованных частицами с низкой деформируемостью, имеющими минимальный размер и
минимальную энергию взаимодействия друг с другом (He, H2, Ne, Ar, O2, CO и ряд других). Но даже
поведение этих газов тем больше отличается от идеального, чем ниже температура
и выше давление системы. Это связано с тем, что между частицами газовой фазы
существуют силы притяжения и отталкивания. При этом рост, как среднего диаметра
этих частиц, так и отталкивания между ними приводят к увеличению объёма
системы, по сравнению с объёмом, рассчитанным в рамках модели "идеального
газа". Поэтому для согласования теоретических и экспериментальных данных в
уравнении Менделеева-Клапейрона значение реального объёма (Vр.) необходимо заменить на
величину (Vр. - b), которая соответствует объёму "идеального газа",
с тем же числом частиц в системе. Вычитаемое (b) представляет собой
поправку на увеличение объёма газа за счёт указанных выше причин и является
индивидуальной величиной для молекул определённого вида (табл. 1).
Таблица
Значения поправок а и b в уравнении
Менделеева-Клапейрона для некоторых веществ в газообразном состоянии.
|
молекула
|
а
|
b
|
молекула
|
а
|
b
|
|
СО2
|
3,65
|
42,8
|
HF
|
9,56
|
73,9
|
|
CS2
|
11,24
|
72,6
|
НCl
|
3,70
|
40,6
|
|
CSO
|
6,57
|
61,9
|
HBr
|
4,49
|
44,1
|
|
CSe2
|
15,62
|
91,0
|
HI
|
6,46
|
(а) в см6∙кПа∙моль-2; (b) в см3/моль.
Очевидно, что для однотипных молекул, например, галогенов или инертных
(благородных) газов с ростом объёма частиц значения (b) будут увеличиваться.
Кроме упругих столкновений между частицами, возможны и
взаимодействия, приводящие к образованию ассоциатов, т.е. к уменьшению числа
частиц в системе. Так как давление в системе прямо пропорционально числу
находящихся в ней частиц, то процесс ассоциации снижает давление в системе, по
сравнению с давлением, рассчитанным по уравнению Менделеева-Клапейрона. Это
вызывает необходимость замены в этом уравнении реальных значений рр. на
величину (рр + а/V2). Поправка (а/V2) учитывает влияние
процесса ассоциации на изменение давления в реальной системе по сравнению с
"идеальной". С учётом введённых поправок уравнение состояния реальных
газов может иметь вид: (рр + а/V2) ∙ (Vр. - b) = = nRТ (уравнение
Ван-дер-Ваальса).
Процесс ассоциации в зависимости от состава и строения
молекул связан с различными типами межмолекулярного взаимодействия. Природа
этого взаимодействия была выяснена в начале ХХ века, после того как был решен
вопрос о строении атомов и молекул. Оказалось, что оно имеет электростатическую
природу и являются результатом действия трех эффектов - ориентационного,
индукционного и дисперсионного.
Ориентационный эффект.
Он возникает только между полярными молекулами, которые
обладают собственным дипольным моментом. При этом молекулы вещества
ориентируются друг по отношению к другу разноименными полюсами, и, в результате
такого дипольного взаимодействия, возникает, хотя и лабильная, но все же
относительно упорядоченная структура. В 1912 году Крезом было показано, что
энергия ориентационного взаимодействия может быть выражена следующим
соотношением:
Еор = - 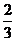
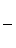
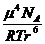 = -
= - 
где
m - собственный дипольный момент молекулы, r - расстояние между центрами диполей, NА - число
Авогадро, R - универсальная газовая постоянная, Т -
абсолютная температура. Таким образом, Еор. тем больше, чем больше
значение m и чем меньше величина r. При этом, с ростом температуры, Еор. уменьшается,
так как усиливающееся тепловое движение нарушает взаимную ориентацию диполей.
Вклад Еор в суммарное межмолекулярное взаимодействие велик для
молекул, обладающих большим дипольным моментом (H2O, NH3 и т.д.).
Индукционный эффект.
Этот эффект возникает также только в том случае полярных молекул
(для индивидуальных веществ), когда диполь-дипольное взаимодействие (за счет
взаимной деформации) приводит к увеличению μ взаимодействующих молекул (смещение
центров положительного и отрицательного заряда диполей). Как показал Дебай
(1920) Еинд может быть рассчитана по формуле:
Еинд = - (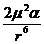 ) = -
) = - 

где α -
поляризуемость (деформируемость) молекулы.
Еинд возрастает по мере увеличения μ и деформируемости молекул и быстро падает
с ростом расстояния между ними. В то же время Еинд от температуры не
зависит, так как наведение диполей происходит при любом пространственном
расположении молекул. Еинд в 10-20 раз меньше Еор. Более
или менее ощутимое влияние индукционного взаимодействия наблюдается только для
частиц, обладающих большой поляризуемостью. Например, вклад Еинд в
суммарную энергию межмолекулярного взаимодействия для NH3 выше,
чем для H2O. Это объясняется тем, что поляризуемость молекул NH3 выше, чем молекул Н2О, хотя μ (NH3) <μ (H2O).
Дисперсионный эффект.
Этот эффект реализуется при взаимодействии любых атомов, а также
молекул, независимо от их строения и полярности, т.е. он является
универсальным. В рамках квантовомеханических представлений дисперсионный эффект
объясняется синхронизацией мгновенных диполей взаимодействующих частиц (Дебай
1920). Рассмотрим систему, состоящую из ядра и движущихся электронов. В любой
момент времени такая система, вследствие несовпадения центров зарядов
электронных облаков и ядра, представляет собой мгновенный диполь. Число таких
диполей равно числу электронов системы. Электрическое поле мгновенных диполей
атомов и молекул индуцирует мгновенные диполи в соседних частицах. Каждый из
диполей будет влиять на ориентацию подобных мгновенных диполей, возникающих в
близлежащих молекулах. В результате этого движение многих мгновенных диполей
перестает быть независимым и становится синхронным. В результате частицы
испытывают притяжение друг к другу и энергия системы снижается.
Едис = - 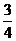
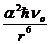 = -
= - 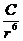
Где h - постоянная Планка, √о - ÷àٌٍîٍà êîëهلàيèé,
îٍâه÷àùèُ يَëهâîé يهًمèè, ïًèٌَùàے êàونîىَ àٍîىَ
èëè ىîëهêَëه
ïًè خîت. دًèلëèوهييî һ√ î= I1, ٍîمنà
إنèٌ = - 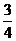
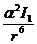 = -
= - 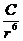
رêëàنûâàے âٌه ًٍè ٌîٌٍàâëےùèه آàي-نهً-âààëüٌîâûُ ٌèë, ïîëَ÷èى:
إ
= - 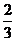
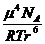 -
- 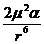 -
- 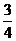
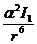 = -
= - 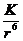
منه
ت = ہ+آ+ر.
آهëè÷èيà âêëàنà îٍنهëüيûُ ٌîٌٍàâëےùèُ â ٌَىىàًيîى ôôهêٍه çàâèٌèٍ îٍ ٌîٌٍàâà è
ًٌٍَêًٍَû ىîëهêَë. دًè÷هى, يàèلîëهه ٌَùهٌٍâهييûىè نëے
ىهوىîëهêَëےًيîمî âçàèىîنهéٌٍâèے ےâëےٌٍے ٍàêèه
èُ ٌâîéٌٍâà êàê ïîëےًيîٌٍü
è ïîëےًèçَهىîٌٍü.
×هى âûّه ïîëےًيîٌٍü ىîëهêَë, ٍهى çيà÷èٍهëüيهه ًîëü îًèهيٍàِèîييûُ ٌèë. آ ٍî
وه âًهىے ٌ ًîٌٍîى
ïîëےًèçَهىîٌٍè
âîçًàٌٍàهٍ
نèٌïهًٌèîييûé
ôôهêٍ. بينَêِèîييûé
ôôهêٍ çàâèٌèٍ îٍ îلîèُ ôàêٍîًîâ, يî ٌàى
ïî
ٌهله èىههٍ ëèّü âٍîًîٌٍهïهييîه
çيà÷هيèه.
رَىىàًيàے يهًمèے
ىهوىîëهêَëےًيîمî âçàèىîنهéٌٍâèے î÷هيü
ىàëà
ïî ًٌàâيهيè ٌ يهًمèهé êîâàëهيٍيîé ٌâےçè (ٍàلë.2). خيà
çà÷àٌٍَ, ىهيüّه يهًمèè êîâàëهيٍيîé ٌâےçè â 10-100 ًàç. زهىïهًàًٍَû ïëàâëهيèے âهùهٌٍâ, îلًàçîâàييûُ يهïîëےًيûىè ىîëهêَëàىè âîçًàٌٍàٍ ïî ىهًه َâهëè÷هيèے نهôîًىèًَهىîٌٍè
ٍèُ ÷àٌٍèِ. حàïًèىهً