Определение характеристик макета БПК-биосенсора на основе дрожжей Debaryamyces hansenii, иммобилизованных в модифицированный ПВС с использованием различных синтетических сточных вод
Введение
Последнее десятилетие отмечено интенсивным
изучением аналитических возможностей и практическим применением биосенсорных
систем. Экспресс-оценка степени загрязнения объектов окружающей среды
органическими соединениями является необходимым компонентом экологического
контроля. Учитывая постоянно растущий перечень веществ, поступающих как
загрязнители в окружающую среду, эффективным инструментом анализа оказываются
методы, основанные на интегральной оценке органических компонентов, а не только
на определении содержания индивидуальных веществ. Потребности медицинской
диагностики, различных областей биотехнологии, промышленности, экологических
служб ставят перед аналитической химией комплекс задач, связанных с разработкой
простых в применении, недорогих, высокочувствительных и специфичных
методов
и приборов на их основе для обнаружения заданных веществ в образце.
Важной характеристикой степени загрязненности
воды органическими веществами является индекс биохимического потребления
кислорода (БПК). Стандартный метод определения БПК, регламентируемый в ПНДФ,
основан на тестах, продолжительность которых составляет 5 или 20 суток. В силу
значительной продолжительности процедуры метод не является адекватным, так как
представляет результаты анализа со значительной задержкой. Вследствие этого
возможно возникновение экологически опасных ситуаций.
Необходимо создание экспресс методов определения
БПК. и реализация их требует разработки биоаналитический систем, основанных на
применении низкоселективных биосенсоров.
Таким образом, создание универсального
биосенсорного анализатора для определения БПК в современных условиях является
важной задачей для биотехнологических производств.
Итак, целью данной курсовой работы является
изучение характеристик кюветного БПК-биосенсора на основе дрожжевого штамма
Debaryamyces hansenii с использованием двух стандартов: глюкозо-глутаматная
смесь (ГГС) и ОЕСD-синтетические сточные воды.
При этом необходимо решить следующие задачи:
Во-первых, изучить метрологические (диапазон
определяемых содержаний, правильность, воспроизводимость, повторяемость,
чувствительность, предел обнаружения) и аналитические характеристики
(длительность единичного анализа, время функционирования биосенсора без замены
рецепторного элемента) кюветного БПК-биосенсора на основе дрожжевого штамма
Debaryamyces hansenii с использованием двух стандартов: глюкозо-глутаматная
смесь (ГГС) и ОЕСD-синтетические сточные воды.
Во-вторых, определить БПК реальных образцов
стандартным методом разбавления.
В-третьих, применить БПК-биосенсор на основе
дрожжевого штамма Debaryamyces hansenii для анализа образцов сточных води
полупродуктов брожения, так же с использованием ГГС и ОЕСD.
1. Литературный обзор
.1 Общая характеристика микробных
биосенсоров
.1.1 Современная концепция биосенсоров
Согласно определению Энтони Тернера биосенсор -
это аналитическое устройство, содержащее биологический материал (ткани, клетки
микроорганизмов, органеллы, клеточные рецепторы, ферменты, иммуноактивные
компоненты, нуклеиновые кислоты и т.д.), находящийся в непосредственном
контакте с физико-химическим преобразователем или преобразующей микросистемой,
представленными оптическим, электрохимическим, термометрическим,
пьезоэлектрическим или магнитометрическим устройствами. Как правило,
преобразователь вырабатывает периодическое либо непрерывные аналоговые/цифровые
сигналы, которые пропорциональны концентрации одиночного вещества или группы
анализируемых соединений.[1]
Биосенсоры можно разделить на различные группы в
соответствии с типом преобразователя (физический сенсор, регистрирующий
изменение физико-химических свойств биоматериала, составляющего биорецептор)
или биорецепторного элемента (основной анализирующий элемент сенсора,
содержащий биологический материал (ферменты, клетки, срезы тканей, органеллы
антитела/антигены, молекулы ДНК, РНК), реакция которого регистрируется
преобразователем). По типу преобразователя биосенсоры можно разделить на
следующие группы: электрохимические, оптические, пьезоэлектрические,
термометрические. По типу биорецепторного элемента биосенсоры классифицируют на
иммунохимические, ферментные, целоклеточные, рецепторные и ДНК-сенсоры.
Микробные сенсоры представляют собой
иммобилизованные на преобразователях различных типов (оптических,
электрохимических) клетками микроорганизмов, что позволяет достаточно простыми
методами производить оценку концентрации многих органических соединений,
осуществимую в ряде случаев лишь с помощью длительных химических процедур
анализа. Наиболее часто используют преобразователи электрохимического типа [2].
Использование микроорганизмов в качестве основы биосенсоров является известным
подходом. В ряде работ показано, что микробные биосенсоры могут быть эффективно
использованы для анализа широкого спектра соединений при биотехнологических
процессах и экологическом мониторинге. Важными моментами, указывающими на
перспективность микробных биосенсоров, является многообразие ферментативного
аппарата микробных клеток, что открывает возможность подбора микроорганизмов
для анализа практически любого соединения, а также тот факт, что ферменты
внутри клеток находятся в "эволюционно оптимизированных условиях" -
это в ряде случаев приводит к высокой стабильности аналитических сигналов.
Немаловажным с практической точки зрения фактором является более низкая
стоимость микробных биосенсоров по сравнению с ферментными ввиду отсутствия
необходимости очистки ферментов и использования кофакторов. Перечисленные факты
обуславливают актуальность исследований, направленных на совершенствование и
получение новых знаний в этой области. Принцип детекции, реализованный в
биосенсорах, основан на том, что биоматериал (ферменты, клетки, антитела и
др.), иммобилизованный на физическом датчике (преобразователе), при
взаимодействии с определяемым соединением генерирует зависимый от его концентрации
сигнал, который регистрируется преобразователем электрохимического, оптического
или иного типа. Эти изменения могут непосредственно быть зарегистрированы
электрохимическими датчиками, например, кислородным электродом или рН -
метром.[3]
При использовании амперометрического
кислородного электрода измерение основано на регистрации тока, полученного при
восстановлении молекулярного кислорода. Сила тока пропорциональна концентрации
кислорода в исследуемом образце.
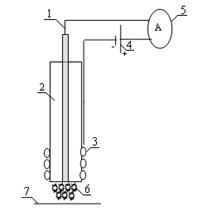
Рис. 1 - Схема кислородного электрода типа
Кларка с рецепторным элементом
Рассмотрим схему кислородного электрода типа
Кларка с рецепторным элементом (рис.1). Электрод типа Кларка представлен
измерительной парой - платиновым катодом и серебряным анодом.
. Платиновый электрод
. Стеклянный корпус
. Электрод сравнения (Ag/AgCl)
. Источник тока (U = -0,7 В)
. Амперметр
. Слой фермента или клеток
. Полупроницаемая мембрана
Потенциал поляризации - 0,7 В, приложенный к
катоду относительно анода, восстанавливает на катоде кислород в соответствии с
реакцией:
Катодная реакция: О2 + 2Н2О + 4ē
→ 4ОН¯
Анодная реакция: 4Ag + 4Cl¯
→ 4AgCl + 4ē
Указанные химические реакции приводят к
протеканию тока, который пропорционален парциальному давлению кислорода.
Кислородный электрод поглощает кислород, который поступает к его поверхности из
раствора
Помимо электродов типа Кларка существуют также
безмембранные (открытые) кислородные электроды, но в сравнении с ними
электрохимической ячейке электродов Кларка есть ряд преимуществ:
возможность измерения кислорода в газах и
растворах
не приводят к взаимному загрязнению среды и
электрода
сигнал в меньшей степени зависит от скорости
потока
В связи с этим электроды типа Кларка получили
широкое распространение в настоящее время. К наиболее важным параметрам
электрода относиться толщина пленки электролита между мембраной и электродом -
она должна быть заключена в довольно узком интервале (рис.1) и в значительной
мере определяет нулевой ток и линейность измерений. Для каждого электрода можно
построить калибровочную зависимость, которые в большинстве случаев имеют
сигмоидальный или гипербоидальный вид, характерный для кинетики ферментативных
реакций. [4]
1.1.2 Биосенсоры на основе целых
клеток.
Микроорганизмы - это живые датчики, которые меняют
чувствительность при адаптации или сенсибилизации. Реакция таких датчиков
зависит от взаимодействия целой группы факторов, отражая множество тонких и
важных изменений в окружающей среде или среде организма.
В результате усвоения микроорганизмами органических
веществ изменяется их дыхательная активность (процессы получения химической
энергии за счет окисления органических веществ)
В начале 70-х годов XX в. исследователи
показали, что не только ферменты, но также и целые клетки, в первую очередь
микроорганизмы, могут успешно использоваться в биосенсорах. Первый микробный
сенсор использован для определения этанола и представлен бактериями Acetobacter
xylinum описан в работе [5].
С точки зрения функционирования клеточного
биосенсора во многом аналогично функционированию ферментативного, вместе с тем
применение целых клеток имеет некоторые преимущества в сравнении с
использованием ферментов. Клетки - доступный биологический материал. Клетки
микроорганизмов культивируются, легко воспроизводятся и поддерживаются в чистой
культуре. В отличие от ферментов клетки не требуют дорогостоящих стадий
очистки. Клетки сохраняют все наиболее важные структуры и проявляют большую
стабильность. В некоторых случаях они обеспечивают жизнеспособность и
активность ферментных систем в течение нескольких лет. Это позволяет проводить
сложные последовательные реакции, осуществляя многостадийные процессы. Для
многих типов клеток, особенно микробных, предложены эффективные методы
генетических операций, что открывает возможность для работы с
высокоэффективными каталитическими системами.
Другим важным преимуществом целых клеток
является возможность использования их чувствительности к взаимодействию целой
группы факторов, отражая множество тонких и важных изменений в окружающей среде
или среде организма.
Таким образом, биосенсоры на основе целых клеток
микроорганизмов могут быть использованы не только для определения содержания
индивидуальных соединений в анализируемых объектах, но и для определения таких
комплексных показателей загрязнения водных сред как биологическое потребление
кислорода (БПК), цитотоксичность, мутагенность и т.д. Так, известно большое
количество лабораторных моделей и несколько промышленно выпускаемых
биосенсорных анализаторов БПК. В Германии, Бельгии, Японии и ряде других стран
этот важный показатель качества воды определяют только экспресс-методом с
использованием биосенсоров. Такие анализаторы позволяют производить определение
БПК в среднем диапазоне 5-300 мг/л за время порядка нескольких минут. [6]
Несмотря на перечисленный положительные качества
клеточных сенсоров, они имеют определенные недостатки:
клетки содержат множество ферментов, часть
которых может взаимодействовать с соединениями, присутствующими в пробе и не
относящимися к целевым. В этом случае возникает сигнал наличия целевого
соединения и соответствующая ошибка анализа;
реакции протекают более медленно, так как
субстраты должны проникнуть в клетку через мембрану, кроме того по такому же
пути продукт должен выйти из клетки. Поэтому некоторые субстраты, в особенности
макромолекулярные, не могут быть использованы для детекции клеточными
биосенсорами;
различные метаболические пути утилизации
субстрата в клетке могут быть источником побочных продуктов, регистрируемых
преобразователем; это приводит к снижению селективности клеточного биосенсора;
- высокая приспособляемость и изменчивость
микроорганизмов;
- проблема биологической устойчивости, связанная
с необходимостью длительного хранения и поддержания жизнедеятельности
микроорганизмов. [7]
Областями наиболее интенсивного применения
микробных сенсоров являются ферментационный и экологический контроль. Например,
Гильбо [8,9] приводит многочисленные примеры использования микроорганизмов для
создания биосенсоров: Neigrospora europea - для определения аммиака, Trichosporon
brassicae - для определения уксусной кислоты, Sarcina flava - для определения
глутамина, Azotobacter vinelaudit - для определения нитратов и другие. Живые
организмы (дрожжи, бактерии, клетки растений) используют в методах биоиндикации
для выявления вредных веществ. По различию характеристик прироста в опыте и
контроле определяют предельную концентрацию вещества, обнаруживаемую
организмами. Для оценки токсичности в питательные среды с микроорганизмами
вводят не только растворы исследуемых химических веществ, но и экстракты,
извлекаемые с помощью растворителей из тканей, почв и т.п [6].
Спектр микроорганизмов, используемых в
биорецепторах, довольно широк, однако эффективное применение микробных клеток
возможно при наличие представлений об особенностях их физиологии, а также
информации о наборе ферментов, присущих выбранному штамму, так как
физиологические свойства микроорганизмов определяют чувствительность,
специфичность, стабильность биорецептора и другие параметры работы биосенсора.
1.2 Особенности биохимии дрожжевых
клеток
Дрожжи представляют собой одноклеточные
неподвижные организмы. Они могут быть различной формы: эллиптической, овальной,
шаровидной и палочковидной (рис 2). Длина клеток колеблется от 5 до 12 мкм,
ширина - от 3 до 8 мкм.
Рис. 2 - Различные формы дрожжей
Необходимую энергию для жизнедеятельности дрожжи
получают в процессе дыхания. Существует два типа дыхания: аэробное, или
настоящее дыхание, и анаэробное, или брожение. По соотношению процессов анаэробного
и аэробного дыхания дрожжи можно разделить на несколько групп:[10]
) Дрожжи, существующие только за счет брожения,
и не способные расти в аэробных условиях. Например, вид Arxiozyma telluris,
обитающий в кишечном тракте грызунов.
) Активные бродильщики: интенсивно сбраживают
различные субстраты, но в аэробных условиях переключаются на дыхательный обмен.
Представители: Saccharomyces cerevisiae, Schizosaccharomyces pombe.
) Слабые бродильщики - в основном существуют за
счет аэробного дыхания, но в анаэробных условиях могут бродить, однако
значительно менее интенсивно, чем виды из предыдущей группы. Например, дрожжи
из родов Pichia, Debaryomyces.
) Дрожжи, существующие только за счет дыхания, и
не способные расти в анаэробных условиях. К этой группе относятся дрожжи из
рода Lipomyces, Cryptococcus, Rhodotorula, Sporobolomyces.
Таким образом, дрожжи используют кислород для
дыхания, однако при его отсутствии многие виды способны получать энергию за
счёт брожения с выделением спиртов (спиртовое, молочнокислое, пропионовокислое,
муравьинокислое, маслянокислое, уксусное брожение). В отличие от бактерий,
среди дрожжей нет штаммов, гибнущих при наличии кислорода в среде. При
пропускании воздуха через сбраживаемый субстрат дрожжи прекращают брожение и
начинают дышать (поскольку этот процесс эффективнее, так как клетка лучше
снабжается энергии, чем при брожении и молекула органического соединения
расщепляется более глубоко), потребляя кислород и выделяя углекислый газ. Это
ускоряет рост дрожжевых клеток (эффект Пастера). Однако даже при доступе
кислорода в случае высокого содержания глюкозы в среде дрожжи начинают её
сбраживать (эффект Кребтри) [11]. При брожении для получения энергии
расходуется большое количество исходного материала, но зато при брожении
создаются условия, в которых не могут развиваться другие микробы, конкурирующие
с дрожжами, вызывающими брожение. Так, продукт спиртового брожения этанол
оказывает губительное действие на многие бактерии и плесени.
Важно также отметить, что все бродящие дрожжи
сбраживают глюкозу и фруктозу, поскольку именно с этих сахаров начинается
гликолитическое расщепление. Кроме глюкозы и фруктозы могут сбраживаться другие
соединения, такие как гексозы и построенные из них олигосахариды. Например,
некоторые виды (Pichia stipitis, Pachysolen tannophilus, Phaffia rhodozyma)
усваивают и пентозы, например, ксилозу.[12] Schwanniomyces occidentalis и
Saccharomycopsis fibuliger способны сбраживать крахмал [13], Kluyveromyces
fragilis - инулин (полифруктозан) [14]. Из моносахаридов наиболее часто
сбраживается галактоза, из дисахаридов - сахароза, мальтоза, трегалоза.
Значительно реже встречаются дрожжи, сбраживающие лактозу и мелибиозу.
В аэробных условиях круг усваиваемых субстратов
шире: помимо углеводов в него входят также жиры, углеводороды, ароматические и
одноуглеродные соединения, спирты, органические кислоты. Так ряд видов дрожжей
рода Candida (Candida tropicalis, Candida intermedia, Candida lipolytica,
Candida guilliermondii) отличается способностью к аэробному росту на длинноцепочечных
жирных кислотах и алканах.
Если в анаэробных условиях лишь единичные виды
дрожжей могут сбраживать пятиатомные сахара, то в присутствии кислорода пентозы
(арабиноза, ксилоза и др.) и метилпентозы (рамноза) могут служить субстратами
для очень многих дрожжей.
Довольно часто встречаются дрожжи,
ассимилирующие крахмал. Более 20 видов дрожжей способны аэробно расти на
метаноле в качестве единственного источника углерода и энергии. Наиболее
активно ассимилируют метанол такие виды, как Pichia polymorpha, Pichia
pastoris, Candida boidinii, Candida methylica.
Тем не менее, сложные соединения (лигнин,
целлюлоза) для большинства дрожжей (за исключением некоторых видов рода
Trichosporon, проявляющих целлюлолитическую активность) недоступны [15].
1.2.1 Общая характеристика рода
Debaryomyces
Род Debaryomyces, назван по имени знаменитого
ботаника А. де Бари.
Клетки рода Debaryomyces имеют чаще круглую реже
яйцевидную или овальную форму. Виды со сферическими клетками размножаются
вегетативно множественным почкованием. Вегетативное размножение происходит
истинным многосторонним почкованием. Мицелий обычно отсутствует, реже
образуется примитивный псевдомицелий.
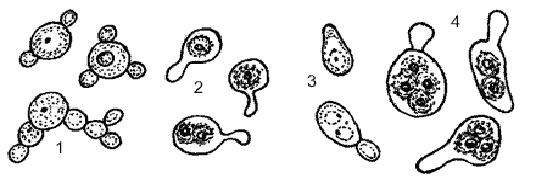
Рис. 3 - Различные типы организации у дрожжей
рода Debaryamyces: 1- почкующиеся клетки Debaryamyces hansenii; 2 - аски с
аскоспорами Debaryamyces hansenii; 3 - почкующиеся клетки Debaryamyces
vanrijiae; 4 - аски с аскоспорами Debaryamyces vanrijiae
Аски образуются в результате
конъюгации между клеткой и ее почкой. Почка превращается в аск с 1-4 круглыми
или слегка овальными аскоспорами с гладкой или бородавчатой поверхностью
<#"876591.files/image004.jpg">
Рис. 4 - Схемы иммобилизации биоматериала на
преобразователе на примере ферментов: а - адсорбция; б - сшивка; в -
ковалентное связывание; г - сшивка и ковалентное связывание; д - включение
1.3.1 Химическая и физическая
адсорбция
Одним из самых распространенных методов
иммобилизации клеток является адсорбция, которая может быть физической или
химической (хемосорбция). Адсорбцией пользуются, главным образом, на стадии
исследований, когда достаточно слабого прикрепления биологического материала к
преобразователю, а от сенсора не требуется длительной эксплуатации.
Ферменты адсорбируются на поверхности многих
материалов. В числе таких материалов - алюминий, уголь, глина, целлюлоза,
каолин, силикагелъ, стекло, коллаген и др. Для адсорбции не требуется ни
дополнительных реагентов, ни отдельной стадии очистки. Метод практически не
нарушает нативной конформации фермента или других белков. Однако белки
располагаются неупорядоченно.
При физической адсорбции биоматериал
удерживается Ван-дер-ваальсовыми силами, реже водородными и множественными
солевыми связями и, в подходящих условиях, за счет образования комплексов с
переносом электронов.
Химические методы иммобилизации клеток основаны
на образовании ковалентных связей между поверхностью клеток и материалом
носителя, то есть клетка химически пришивается к носителю. Это может
осуществляться как на поверхности соответствующего нерастворимого материала,
так и в объеме носителя (если при формировании матрицы в присутствии
иммобилизованных клеток происходят химические реакции присоединения,
затрагивающие функциональные группы биополимеров клеток).
1.3.2 Иммобилизация клеток путем
включения в массу носителя (включение)
В методе включения биологический материал
смешивают с раствором мономера, а затем к раствору добавляют инициатор
полимеризации, в результате чего образуется гель, в который включен
биоматериал. Полимерные гели предотвращают вымывание клеток микроорганизмов и
обеспечивают доступ субстратов и кислорода.
Гель - система полимер-растворитель,
пространственная сетка которой стабилизирована по всему своему объему
устойчивыми во времени межмолекулярными связями. Различают гели 1-го и 2го
рода. Пространственная сетка полимерных гелей 1-го рода образована ковалентными
связями (химические сетки). Хорошо известными примерами таких материалов
являются полиакриламидные гели, силикагель, гели типа сефадексов
(поперечно-сшитые декстраны), полистирольные ионообменные смолы и др. В гелях
2-го рода пространственная сетка поддерживается за счет сил нековалентной
природы (водородные связи, гидрофобные взаимодействия, зона образования
кристаллитов; это - физические сетки). Примерами таких систем являются гели
желатины, агара и агарозы, крахмала и др. Данным гелевым матрицам присуще
обратимое плавление - застудневание при изменении температуры, поэтому их
обычно называют термообратимыми. Существуют полимеры, растворы которых желируют
при охлаждении (наиболее распространены), но есть высокомолекулярные
соединения, растворы которых превращаются в гели при нагревании (например,
водные растворы метилцеллюлозы) [8].
К недостаткам, связанных с использованием
гелевых матриц относится: трудоемкость изготовления рецепторного элемента,
необходимость специального подбора для каждого конкретного микроорганизма
условий иммобилизации, снижение пластической прочности гелей после
иммобилизации. Также через гели часто плохо диффундируют субстраты, что
замедляет ферментативную реакцию. Кроме того, со временем фермент может
вытекать из геля, что приводит к уменьшению биологической активности
распознающего элемента.
Биорецепторные элементы на основе клеток,
иммобилизованных в гелевых матрицах, как правило, характеризуются более низкими
откликами по сравнению с элементами на основе адсорбированных клеток, причем
для отдельных субстратов наблюдается резкое снижение откликов, то есть в
зависимости от метода иммобилизации изменяется и субстратная специфичность
клеток микроорганизмов. Это связано с тем, что при иммобилизации происходит
полная или частичная блокировка активных центров ферментов, отвечающих за
окисление этих субстратов. А так же затрудняется диффузия субстрата к клеткам.
Для иммобилизации биоматериала часто
используется поливиниловый спирт. ПВС - доступный продукт многотоннажного
синтеза, каждая его марка стандартизована, выбор этих марок достаточно широк.
Известно так же что полимер-гелеобразователь поливиниловый спирт химически и
микробиологически стабилен, нетоксичен и биосовместим [20], поэтому может быть
эффективно использован в качестве матрицы для иммобилизации клеток микроорганизмов
с целью увеличения пористости, долговременной и операционной стабильности
биорецепторных элементов. [17]
В работе [21] описана модификация поливинилового
спирта (ПВС) N-Винилпирролидоном (ПВП). Предпополагаемый механизм сшивки
поливинилового спирта N-Винилпирролидоном с участием ионов Се+4 в качестве
инициатора, приводящего к появлению оксильных радикалов, приведен ниже:

Рис. 5 - Предполагаемый механизм
сшивки поливинилового спирта N-винилпирролидоном
Формирование рецепторного элемента
может проведено путем включения клеток микроорганизмов в гель поливинилового
спирта (ПВС), модифицированного N-винилпирролидоном (N-ВП), в силу того что
N-поливинилпирролидон легко образует комплексы со многими соединениями (токсинами,
лекарственными веществами, красителями), совмещается с различными веществами,
лекарственными средствами, нетоксичен, является основой кровезаменителей. [22]
Схема включения клеток в гель на
основе поливинилового спирта, модифицированного N-Винилпирролидоном
представлена на (рис.6)
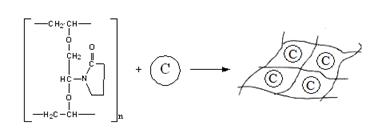
Рис. 6 - Включение клеток в гель на основе
поливинилового спирта, модифицированного N-Винилпирролидоном
1.4 Биохимическое потребление
кислорода
К основным показателям качества воды относят:
органолептические показатели: запах, вкус и
привкус, мутность и прозрачность, пенистость;
- общие и суммарные показатели: температура,
водородный показатель (рН), щелочность и кислотность, растворенный кислород
(РК), биохимическое потребление кислорода (БПК), окисляемость, или химическое
потребление кислорода (ХПК);
- минеральный состав: карбонаты, сульфаты,
хлориды, сухой остаток, кальций, магний, общая жесткость, натрий, калий и т.д.;
- биогенные элементы: аммоний, нитраты, нитриты,
фосфаты и общий фосфор;
- металлы: сумма тяжелых металлов, железо,
алюминий;
- некоторые важнейшие показатели: фтор
(фториды), хлор активный, нефтепродукты, поверхностно-активные вещества,
фенолы.[23]
Биохимическое потребление кислорода (БПК) - один
из часто используемых показателей загрязнения органическими веществами.
Природными источниками органических веществ являются разрушающиеся останки
организмов растительного и животного происхождения. Существуют также
техногенные источники органических веществ: транспортные предприятия
(нефтепродукты), целлюлозно-бумажные и лесоперерабатывающие комбинаты
(лигнины), мясокомбинаты (белковые соединения), сельскохозяйственные и
фекальные стоки и т.д.
В естественных условиях под действием
микроорганизмов происходит биохимическое окисление органических веществ:
окисляемое вещество - субстрат разлагается под действием растворенного в воде
кислорода, при этом выделяющаяся энергия расходуется на поддержание жизненных
процессов и роста клеточных веществ. Биохимическое потребление кислорода (БПК)
- это количество растворенного кислорода (мг), необходимое для окисления всех
биоразложимых органических отходов, находящихся в 1 дм3 воды. Если условно
принять суммарное соотношение жизненно необходимых элементов, входящих в состав
всех органических соединений, загрязняющих сточную воду, за соединение с
простейшей формулой CxHyOzN. Тогда расход кислорода при дыхании будет отвечать
следующей схеме [24]:
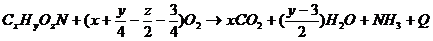
Коэффициенты перед кислородом
означают:
х - на один атом углерода
расходуется одна молекула кислорода;
у - на один атом водорода
расходуется 1/4 молекулы кислорода.
Содержащийся в соединении кислород в
величину БПК не входит, его вычитают, каждый атом составляет половину молекулы
кислорода (z/2); азот восстанавливается до аммиака с затратой трех атомов
водорода, что соответствует уменьшению количества кислорода еще на 3/4
молекулы.
При синтезе клеточных веществ
протекает примерно следующий процесс:
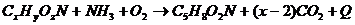 , где
, где
C5H8O2N - среднее соотношение основных элементов
в клеточном веществе бактерий.
Суммарное количество кислорода, израсходованного
при этих процессах, и отвечает величине БПКполн.. В лабораторных условиях
наряду с БПКполн. определяется БПК5 - биохимическая потребность в кислороде за
5 суток. Ориентировочно понимают, что БПК5 составляет около 70% БПКполн., но
может составлять от 10 до 90% в зависимости от окисляющегося вещества.
Биохимическое окисление различных органических
веществ происходит с разной скоростью. Загрязнители различной природы могут
повышать (понижать) значение БПК. Динамика биохимического потребления кислорода
при окислении органических веществ в воде приведена на рис. 7.
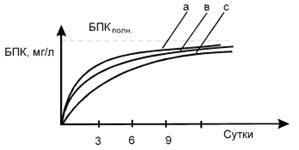
Рис. 7 - Динамика биохимического
потребления кислорода: а - легкоокисляющиеся вещества, в - нормально
окисляющиеся вещества, с - тяжело окисляющиеся вещества
К легкоокисляющимся («биологически
мягким») веществам относятся глюкоза, мальтоза, формальдегид, низшие
алифатические спирты, фенолы, фурфурол. Нормально окисляющиеся вещества -
нафтолы, крезолы, резорцин, анионогенные ПАВ, сульфанол, пирокатехин и т.п. К
тяжело окисляющимся («биологически жестким») веществам - неионогенные ПАВ,
гидрохинон, тимол, сульфонол и т.п. [25]
Искажать характер потребления
кислорода может расходование кислорода на нитрификацию (рис.8)
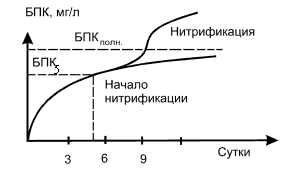
Рис. 8 - Изменение характера
потребления кислорода при нитрификации
Нитрификация протекает под
воздействием особых нитрифицирующих бактерий - Nitrozomonas, Nitrobacter и др.
Эти бактерии обеспечивают окисление азотсодержащих соединений, которые обычно
присутствуют в загрязненных природных и некоторых сточных водах, и тем самым
способствуют превращению азота сначала из аммонийной в нитритную, а затем и нитратную
формы. Соответствующие процессы описываются уравнениями:
2NH4+ + 3O2
= 2HNO2 + 2H2O + 2H+ + Q
2HNO2 + O2 = 2HNO3 + Q
где: Q - энергия, высвобождающаяся
при реакциях.
Процесс нитрификации происходит и
при инкубации пробы в кислородных склянках. Количество кислорода, пошедшее на
нитрификацию, может в несколько раз превышать количество кислорода, требуемое
для биохимического окисления органических углеродсодержащих соединений. Начало
нитрификации фиксируется по минимуму на графике суточных приращений БПК за
период инкубации. Нитрификация начинается приблизительно на 7-е сутки инкубации
(см. рис. 10), поэтому при определении БПК за 10 и более суток необходимо
вводить в пробу специальные вещества - ингибиторы, подавляющие
жизнедеятельность нитрифицирующих бактерий, но не влияющие на обычную
микрофлору (т.е. на бактерии - окислители органических соединений). В качестве
ингибитора применяют тиомочевину (тиокарбамид), который вводят в пробу либо в
разбавляющую воду в концентрации 0,5 мг/см3.[23]
Итак, полным биохимическим
потреблением кислорода (БПКполн.) считается количество кислорода, требуемое для
окисления органических примесей до начала процессов нитрификации.
В поверхностных водах величина БПК
колеблется в пределах от 0,5 до 5,0 мг/дм3; она подвержена сезонным и суточным
изменениям, которые, в основном, зависят от изменения температуры и от
физиологической и биохимической активности микроорганизмов. Весьма значительны
изменения БПК5 природных водоемов при загрязнении сточными водами.[26]
Норматив на БПКполн. не должен
превышать: для водоемов хозяйственно-питьевого водопользования - 3 мг/дм3, для
водоемов культурно-бытового водопользования - 6 мг/дм3. Соответственно можно
оценить предельно-допустимые значения БПК5 для тех же водоемов, равные примерно
2 мг/дм3 и 4 мгО2/дм3. В таблице 1 приведены значения БПК5 для водоемов разных
классов
Таблица 1 - Величины БПК5 в водоемах
с различной степенью загрязненности
|
Степень
загрязнения (классы водоемов)
|
БПК5,
мг/дм3
|
|
Очень
чистые
|
0,5-1,0
|
|
Чистые
|
1,1-1,9
|
|
Умеренно
загрязненные
|
2,0-2,9
|
|
Загрязненные
|
3,0-3,9
|
|
Грязные
|
4,0-10,0
|
|
Очень
грязные
|
10,0
|
Определение БПК5 в поверхностных водах
используется с целью оценки содержания биохомически окисляемых органических
веществ, условий обитания гидробионтов и в качестве интегрального показателя
загрязненности воды. Значение БПК говорит биологу о потенциальной возможности
сточных вод истощать запасы кислорода в реке. Этот показатель - весьма важный
индикатор загрязнения воды, так как недостаток кислорода приводит к гибели рыбы,
а также порождает неприятный запах и развитие популяций нежелательных
организмов, устойчивых к разного рода загрязнениям.
Определение концентрации растворенного кислорода
при анализе воды на БПК может выполняться различными методами.
1.4.1 Определение БПК5 методом
разбавления
Определение БПК5 проводится в первоначальной или
соответственно разбавленной пробе по разности между содержанием кислорода до и
после инкубации в течение пяти суток без доступа кислорода и света. Инкубацию
проводят в режиме постоянной температуры (20±1)°С, причем от точности
поддержания значения температуры зависит точность выполнения анализа на БПК.
Погрешность в определении БПК может внести также освещение пробы, влияющее на
жизнедеятельность микроорганизмов и способное в некоторых случаях вызывать
фотохимическое окисление. Поэтому инкубацию пробы проводят без доступа света (в
темном месте).[23]
Содержание кислорода в первоначальной или
разбавленной пробе должно оставаться в течение всего периода инкубации таким,
чтобы были обеспечены нормальные условия протекания аэробных биохимических
процессов. Эти условия будут соблюдены, если анализируемая проба перед началом
определения будет насыщена кислородом воздуха (приблизительно до 8-9 мг/дм3 при
20°С) и если во время инкубации произойдет снижение концентрации кислорода на 2
мг/дм3 или больше, но так, чтобы спустя пять суток она составляла не менее 2
мг/дм3.
Исследуемую воду (при 20°С) аэририруют путем
встряхивания или продувки воздуха. Далее определяют содержание кислорода в
первоначальной или разбавленной пробе одним из следующих методов -
йодометрическим определением по Винклеру, полярографическим пирофосфатным, или
электрометрическим методами.
Определив содержание растворенного кислорода в
полученной смеси, ее оставляют в закрытой склянке на 5 суток при 20 °С без
доступа воздуха и света. Затем вновь определяют содержание растворенного
кислорода. Уменьшение количества кислорода в воде показывает, сколько его за
это время израсходовано на окисление органических веществ, находящихся в сточной
воде. Это количество, отнесенное к 1 дм3 сточной воды, и является биохимическим
потреблением кислорода сточной водой за данный промежуток времени (БПК5).
1.4.2 Определение БПК
манометрическим методом
Данным метод основан на том, что в сосуде для
определения БПК над жидкостью находится воздух, объем которого четко
определяется объемом пробы воды. На биологическое разрушение органических
примесей воды расходуется кислород, содержащийся в воздухе над жидкостью.
Гранулы гидроксида натрия или калия предназначены для поглощения углекислого
газа, образующегося в результате биологического разрушения. Для интенсивного
массообмена между жидкой и газовой фазами предусмотрено непрерывное
перемешивание. В течение времени количество кислорода в объеме воздуха над пробой
воды уменьшается, в результате чего давление внутри сосуда снижается. Снижение
давления измеряется датчиком в крышке, которой закрывается сосуд. Диапазон
измерений БПК от 0 - 40 до 0 - 4000 мг/дм3, в зависимости от объема пробы и
ожидаемого значения.[27]


Рис. 9 - Манометрические датчики OxiTop для
определения БПК
Вычисление результатов анализа.
Снижение давления, зафиксированное датчиком,
пропорционально количеству поглощенного кислорода, которое пересчитывается в
значение БПК по формуле:
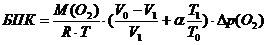 , где
, где
(O2) - молекулярная масса кислорода,
32000мг/моль- универсальная газовая постоянная, 83,144 мбар/к∙моль
Т0 - исходная температура, к
Т1 - температура измерения, к-
теоритический объем бутыли, см3- объем пробы, см3
α - коэффициент адсорбции Бунзена
Δр(О2) - парциальное давление
кислорода
Преимущества манометрического метода
по сравнению с методом Винклера в том что воздействия на образец воды сведено к
минимуму. Использование OxiTop намного упрощает измерение БПК, так как он
автоматически запоминает измеренные значения. Все сохраненные в памяти прибора
значения можно считать в любой день. К разбавлениям приходиться прибегать
редко, что снижает трудо- и времяемкость анализа. Иными словами количество
рутинных операций при использовании OxiTop минимально. Однако метод не
избавляет от главного недостатка - 5-ти суточной инкубации.
1.4.3 Методы определения БПК с
помощью биосенсоров
Большинство описанных в литературе
БПК биосенсоров являются целоклеточными микробными сенсорами биокленочного
типа, которые основаны на измерении скорости дыхания бактерий вблизи
поверхности преобразователя. Первая работа, посвященная созданию подобного
сенсора, была опубликована Karube et al. в 1977 г [28]; в качестве биоматериала
были использованы микроорганизмы, взятые из активного ила очистных сооружений.
К настоящему времени известно значительное количество лабораторных моделей и
несколько промышленно выпускаемых биосенсорных анализаторов БПК. Такие
анализаторы позволяют производить определение БПК в среднем диапазоне 5-300
мг/дм3 за время порядка нескольких минут; в качестве модельного соединения для
калибровки прибора обычно используется смесь растворов глюкозы и глутаминовой кислоты
или другие смеси органических соединений (так называемые синтетические сточные
воды).
Разрабатываемые БПК-биосенсоры
описанные в литературе разлчаются выбранными штаммами микроорганизмов или
аасоциаций [29-38], способами иммобилизации [38], способами фиксации
аналитического сигнала [39-42], а также применяемыми стандартами для калибровки
датчиков [40], что позволяет повысить точность определения БПК.
Например, использование смешанных
культур дает возможность расширения спектра биодеградируемых соединений (и,
следовательно, обеспечивает более полное определение БПК), оборотной стороной
этого подхода в большинстве случаев является сниженная стабильность и
воспроизводимость результатов, что бывает связано с динамикой соотношения
различных культур в биорецепторе. Поэтому, наряду с использованием активного
ила и других смесей микроорганизмов, при конструировании БПК-сенсоров
используют и чистые культуры бактерий и грибов, характеризующихся расширенным
спектром метаболизируемых субстратов (т.е. широкой субстратной специфичностью).
Примерами подобных приборов могут являться сенсоры, описанные в работах [29-37]
и др.
Одним из микроорганизмов, наиболее
часто используемых в составе БПК-сенсоров, является Trichosporon cutaneum
[36-37]. Разными авторами опубликовано не менее десяти работ, посвященных
созданию БПК-сенсоров на его основе; кроме того, он используется в ряде
коммерческих анализаторов БПК. Пример подобного сенсора описан в работе [37].
Созданный прибор позволял определять БПК в диапазоне 0,2-18 мг/дм3. Время жизни
биорецептора составляло 3 сут. Разброс показаний при измерении идентичных
образцов не превышал 8%. Сенсор был использован для анализа промышленных и
муниципальных сточных вод.
В некоторых разработанных БПК -
биосенсорах для повышения корреляции со стандартным методом проводится
предварительная пробоподготовка. Так, например, разработана система для
определения низкого биохимическое потребление кислорода в реках с
предварительным озонированием [44]. Реки содержат много бионедоступных
органических веществ, таких как гуминовые кислоты и лигнин. Свободные радикалы,
образованные саморазложением озона, использовались как мощный оксидант, чтобы
расколоть органические вещества. При значении БПК 1 мг/дм3, ответ датчика после
озонирования был в 1,6 раз выше, чем до озонирования. Время ответа БПК -
биосенсора составляло 5 минут и не зависело от значения БПК, нижний предел
обнаружения составлял 0,5 мг/дм3 БПК. Разработанная система была применена для
определения БПК в реках. Была показана хорошая корреляция между ответом
биосенсора и стандартным методом определения БПК5 (R = 0,989).
Описанные выше сенсоры основаны на
использовании амперометрических кислородных преобразователей, как правило,
электродов Кларка, однако это - не единственный возможный подход к созданию
БПК-сенсоров. Следует отметить, что на значение БПК, определяемого с помощью
микробного дыхания, влияют количество растворенного кислорода в образце.
Известно, что некоторые синтетические соединения (искусственные акцепторы
электронов) способны восстанавливаться определенными микроорганизмами, т.е.
конкурируют за электроны с кислородом (естественным акцептором электронов).
Если эти соединения обладают обратимыми окислительно-восстановительными
свойствами, то они могут служить переносчиками электронов от биокаталитических
систем микроорганизмов на электрод (медиаторами электронного транспорта).
Преимущество использования медиаторов заключается в том что: результаты
измерений становятся практически независимыми от парциального давления
кислорода в среде и, если в процессе окисления восстановленного медиатора не
участвуют протоны, то медиаторный электрод может быть относительно
нечувствителен к изменениям рН. Таким образом, одним из наиболее перспективным
направлением является разработка БПК-биосенсоров с применением медиаторов
электронного транспорта [39-42].
В последнее время большое количество
работ посвящено разработке БПК-биосенсоров оптического типа [45-48].
Это связано с тем, что оптические
биосенсоры обладают высокой чувствительностью и, соответственно, позволяют
определять низкие значения БПК.
Еще один подход к детекции БПК
основан на регистрации изменений температуры, вызванных микробиологической
деструкцией органических соединений. Этот подход основан на использовании
калориметрических преобразователей; биосенсор на основе такого преобразователя
описан в работе [49].
В зарубежной статье [50] на базе
амперометрического датчика кислорода с ограниченной диффузией (кислородный
электрод Кларка) был создан микробный БПК-датчик и исследована зависимость его
выходного сигнала от биохимической потребности в кислороде сточных вод.
Калибровка датчика БПК была выполнена в стационарном и динамическом режимах
измерений с использованием растворах синтетических сточных вод (OECD).
Результаты показали широкий диапазон определяемых концентраций (до 230 мг/дм3
БПК7), а также быстрый ответ и время регенерация раз в динамическом режиме
анализа. Данные, полученные на стационарном метод показали лучшую
воспроизводимость, особенно в оценке БПК7 реальных сточных вод. После калибровки
датчика БПК был использован для быстрой оценки БПК городских сточных вод.
В сточных водах с высоким
содержанием жира был использован Aeromonas hydrophila P69.1 (А. hydrophila)
штамм для создания полуспецифичного биосенсора для оценки биохимического
потребления кислорода(БПК). В данной статье сравнивались биосенсоры на основе
клеток А. hydrophila и P. fluorescens. Клетки А. hydrophila выращивали в среде,
содержащей жир, чтобы вызвать образование необходимые ферменты для транспорта и
деградации жирных веществ. Универсальный биосенсор на основе неспецифических
specific Pseudomonas fluorescens P75 (P. fluorescens) был использован для
проведения экспериментов сравнения. Биосенсоры были откалиброваны с помощью
синтетических сточных вод (OECD) и стационарного метода. Линейный диапазон
биосенсорова на основе А. hydrophila составил до 45 мг/дм3 БПК7, по сравнению с
40 мг/дм3 БПК7 полученных с помощью биосенсора на основе P. fluorescens. Нижний
предел обнаружения обоих биосенсоров составил 5 мг/дм3 БПК7. Срок службы
биосенсоров на основе A. hydrophila и P. fluorescens составил 110 и 115 дней
соответственно. Время отклика биосенсоров зависело от БПК7 и составляло до 20
мин при анализе различных сточных вод. Оба биосенсора занижали БПК в сточных
водах мясоперерабатывающих предприятий с 43% до 71%, но более точные результаты
могут быть получены с помощью биосенсора на основе A. hydrophila.
Полу-специфичным биосенсором на основе A. hydrophila удалось измерить долю жира
в образцах сточных вод, в то время как другие трудноокисляемые соединения не
поддавались обнаружению обоих биосенсоров.
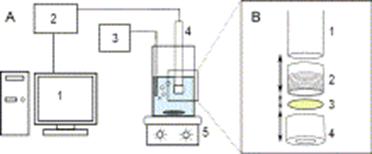
Рис. 10 - (А) Схематическое
представление биосенсорной измерительной системы: 1 компьютер, 2: измерительный
модуль, 3 блок аэрации, 4: биосенсор, 5 магнитная мешалка. (B) устройство
биосенсора: 1: датчик растворенного кислорода, 2: вставочное кольцо, 3:
мембрана, 4 держатель
В данной работе [52] предложен
метод, использующий совместно иммобилизованные клетки Escherichia coli
(E.coli), в качестве биокатализатора и нейтральный красный (NR), в качестве
искусственного акцептора электронов, для модификации стеклоуглеродного
электрода (GCE) для измерения биохимического потребления кислорода (БПК). Два
разных подхода модификации GCE были использованы и сравнены. В одном подходе,
нейтральный красный был элктрополимеризован на поверхности GCE, и клетки E.coli
были смешаны с сополимером PVA-g-PVP (кратко gPVP) и нанесены на пленку NR для
получения комплекса (gPVP/E. coli)/PNR/GCE. Во втором подходе, как клетки
E.coli так и NR были смешаны с сополимером gPVP и нанесены на GCE, образуя
комплекс (gPVP/E. coli/NR)p/GCE. На основе оценки электрохимических свойств,
производительность последнего модифицированного электрода была лучше, что может
быть обусловлено тем, что NR осаждается на поверхности E.coli вызывая хороший
электронный транспорт и проницаемость мембран клеток. Для развития результатов,
полученных с использованием (gPVP/E. coli/NR)p/GCE дальше, были использованы
нанотрубки TiO2, а также различные эффекты на образцах ГГС, OECD, мочевины и
реальных сточных вод. Эти результаты показывают, что данный метод имеет
потенциальное применение для быстрого определения БПК с помощью
биосенсоров.[52]
В стать [53] для контроля очистки
сточных вод от промышленности латекса в качестве рецепторного элемента
БПК-биосенсора использовались иммобилизованная смесь микроорганизмов. Принцип
измерения был основан на определении потребления кислорода вызванного клеточным
дыханием. В качестве смеси для калибровки БПК-биосенсора согласно требованиям
Организация экономического сотрудничества и развития использовались
синтетические сточные воды (OECD). Время ответа биосенсора составляло 10 - 15
минут. БПК втекающих и вытекающих из анаэробного реактора вод измеряли как
методом с использованием биосенсора, так и стандартным методом БПК5 . Был
достигнут высокий уровень корреляции между данными, полученными обоими
методами, разница между значениями составила менее 10%. Однако при
использовании данной смеси культур для анализа сточных вод другого производства
уровень корреляции со стандартным методом был низкий. БПК - биосенсор был
успешно применен для off-line и on-line мониторинга процессов анаэробной
обработки.
Существуют методы быстрого и
медленного определения БПК (BODst). Медленный - основанный на использовании
медиатора феррицианида представлен в работе [54]. Позволяет преодолеть
некоторые проблемы, связанные со стандартным анализом БПК (БПК5), таких как
долгая инкубация (5 дней), необходимость разбавлять образцы и низкая
воспроизводимость. Здесь представлены вариант измерений, где Klebsiella
pneumoniae успешно окисляет феррицианид без деаэрации образцов с линейной
зависимостью БПК5 30 - 500 мг/л или 30 - 200 мг/л, с использованием
глюкозо-глутаматной смеси (ГГС ) и стандарта OECD соответственно. Кроме того,
предложено решение для прекращение анализа, что позволяет увеличить
воспроизводимость и стандартизовать анализ, используя формальдегид (22,7 г/л)
или другие соединения, чтобы остановить восстановление феррицианида без ущерба
для амперометрического обнаружения и, следовательно, заменить
центрифугирование, обычно используемое для остановки реакции феррицианида с
микроорганизмами. Эти усовершенствования привели к точному определению БПК
реальных образцов муниципальных сточных вод.[55]
Данные представленые в статье [56]
описывают быстрый метод определения БПК. Активный ил был успешно использован в
качестве биокатализатора в быстром методе определения БПК с использованием
феррицианида (FM-BOD). Процедура подготовки активного ила были оптимизированы
для трех потенциальных биокатализаторов: ила из аэротенка, ила из осадка
аэробного реактор и регенерированного активного ила. После 24 часов голода
регенерированный активный ил и ил из аэротенка показали самые высокие
показатели окисления стандарта ГГС и регенерированный активный ил также показал
самый низкий уровень эндогенного дыхания. Рабочий диапазон составил до 170 мг/л
БПК5 для стандарта OECD и 300 мг/л БПК5 для ГГС. Это значительное улучшение по
сравнению с другими методами быстрого анализа БПК. Высокие значения
коэффициента корреляция с стандартным методом БПК5 (n = 35, p < 0.001, R =
0.952) наблюдались для широкого разнообразия реальных образцах сточных вод.
Средняя эффективность деградации не отличался от наблюдаемой для стандартного
БПК5 анализа. Эти результаты показывают, что активный ил в FM-BOD анализе может
быть использован для простого ежедневного анализа сточных вод.
1.5 Различные стандарты применяемые
для калибровки БПК-датчиков
Синтетические сточные воды служат основой многих
анализов связанных с определением качества воды. Их применяют для таких
анализов как определение биохимического потребления кислорода (БПК),
химического потребления кислорода (ХПК), TS и TSS. Так, например, при контроле
анаэробных процессов определяют высокий уровень биохимического потребления
кислорода (БПК) в образцах сточных вод от фабрики, обрабатывающей
концентрированный каучук. Эти данные представлены в статье: [53].
Для формирования синтетических сточных вод
используют различные органические и неорганические компоненты. Состав
синтетических вод зависит от того, какие воды моделируются: городские сточные
воды или индустриальные (промышленные) сточные воды. В городских стоках нет
таких веществ, как крахмал, сахар и других легко деградируемых веществ, т.к. для
очистки воды используют бактерии. Для создания более сложных органических
синтетических сточных вод подходят такие компоненты как пептон, дрожжевой
экстракт, мясной экстракт и глюкоза. Для моделирования синтетической
водопроводной воды используют органические и неорганические соединения азота и
фосфора.
Во многих зарубежных статьях описаны методики
приготовления синтетических сточных вод, их состав и свойства. Так в статье
Xiufen Li описано применение синтетической сточной воды на основе следующих
компонентов: глюкоза 360 г/л, протеин 80г/л, NaHCO3 24г/л, KH2PO4 14 г/л, NH4Cl
60 г/л, CaCl2 18 г/л, MgSO4.7H2O 24 г/л. Интервал рН 7,4±0,4. Показатель ХПК
составил 300±150 г/л. . [57].
Для создания синтетических сточных вод
моделирующих сточные воды текстильных предприятий был выбран следующий
компонентный состав: КН2РО4 8,5 г/л, К2НРО4 21,75 г/л, Na2HPO4 .7H2O 50,3 г/л,
NH4Cl 0,5 г/л , NaOH 60 г/л, HCl 0,1 мл/л. А также компоненты: В - CaCl2 27,5
г/л, С - MgSO4. 7H2O 22,5 г/л, D - FeCl3.6Н2О 0,25 г/л которые обновляли каждые
две недели. Приготовление синтетических сточных вод: компонент В 1 мл/л,
компонент С 1 мл/л, компонент D 1 мл/л, NaOH 2 мл/л, NaCl 1,5 г/л, пептон 0,5
г/л, глюкоза 0,5 г/л, КН2РО4 0,5 г/л. [57]
Автор статьи «Practical field application of a
novel BOD monitoring system» показывает возможность использования микробных
топливных элементов для определения индекса БПК. Синтетические сточные воды
были использованы для предварительной работы БПК-сенсора. Синтетической основой
сточных вод явились следующие компоненты: 15 мг/л КН2РО4, 30 мг/л (NH4)2SO4, 50
мг/л MgSO4-7H2O, 3,75 мг/л CaCl2, 0,25 мг/л FeCl3-6H2O, 5,0 мг/л MnSO4-H2O, 105
мг/л NaHCO3 и 10 мл/л микроэлементных компонентов. Микроэлементные компоненты:
1,5 г/л нитрилотриуксусная кислоты, 0,1 г/л FeSO4 -7H2O, 0,1 г/л MnCl2-4H2O,
0,17 г/л CoCl2-6H2O, 0,1 г/л CaCl2-2H2O, 0,1 г/л ZnCl2, 0,02 г/л CuCl2-2H2O,
0,01 г/л H3BO3, 0,01 г/л MoNa2O4, 0,017 г/л Na2SeO3, 0,026 г/л NiSO4-6Н2О, 1
г/л NaCl и 0,1 г/л Na2WO4 -7H2O. Для полного формирования синтетических сточных
воды добавляли соответствующие количества глюкозы и глутаминовой кислоты на
базе раствора буфера с рН 7,0±0,2. Для предотвращения засорения микробных
топливных элементов осадок суспензии частично фильтруется через фильтровальную
бумагу (4 класс, удержание частиц диаметром: 20-25 μm,
Ватман,
США). После проведения измерений с использованием синтетических сточных вод
система была применена к измерению БПК в реальных сточных водах из очистных
сооружений в тех же экспериментальных условиях. Ответы на синтетические сточные
воды были больше, чем ответы на реальные сточные воды с тем же значением БПК.
Автор статьи объясняет этот факт наличием в реальных образцах моющих средств и
токсических веществ [59]
Во многих зарбежных работах для колибровки БПК-биосенсора
используют ОЕСD-синтетическую сточную воду. В работе [60] при создании
БПК-датчика использовали OECD-синтетическую сточную воду. Для приготовления
OECD-синтетической сточной воды в литре водопроводной воды растворяют следующие
компоненты: 160 мг пептона, 110 мг мясного экстракта, 30 мг мочевины, 28 мг
K2HPO4, 7 мг NaCl, 4 мг CaCl2 • 2H2O, 2 мг Mg2SO4 • 7H2O. Значение БПК5 для
данной смеси было определено стандартным методом и составило 14000мг/л. Выбор
OECD-синтетической сточной воды, а не раствора на основе глюкозы и глутаминовой
кислоты, основан на том, что реальные образцы сточных вод содержат различные
виды органических веществ с широким диапазоном молекулярных масс. Линейный
диапазон ответа сенсора от значения БПК5 составил от 15 до 260 мг/л. После
калибровки датчика с использованием OECD-синтетических сточных вод, был
проведен анализ реальных образцов сточных вод. Средний коэффициент корреляции
составил 0, 8713.
Таким образом, актуальным направлением
применения биосенсоров может являться анализ интегральных характеристик водных
сред. Как видно из представленных в обзоре данных, биосенсорная детекция БПК
является достаточно развитым направлением аналитической биотехнологии.
Биосенсорные анализаторы БПК представляют собой надежные аналитические
инструменты и с успехом используются для контроля водных экосистем наряду с
традиционными методами определения БПК.
В то же время в Российской Федерации отсутствует
опыт промышленного выпуска анализаторов этого типа, а исследования по данной
проблеме начали проводиться сравнительно недавно и не продемонстрировали
существенных успехов.
Следует отметить, что несмотря на полученные
зарубежными исследователями положительные результаты, поиск новых решений,
обеспечивающих более высокую точность оценки индекса БПК, оперативность и
воспроизводимость анализа, продолжаются.
Основными тенденциями являются повышение
стабильности, увеличение степени корреляции данных, полученных биосенсорным
методом, с данными, полученными стандартным методом оценки БПК.
2. Экспериментальная часть
.1 Культивирование клеток
микроорганизмов
Для работы использовали: клетки штамма
Debaryamyces hansenii BKM-Y-2482, полученные во Всероссийской коллекции
микроорганизмов Института биохимии и физиологии микроорганизмов РАН (Пущино).
Клетки штамма Debaryamyces hansenii BKM-Y-2482 выращивали на богатой
минеральной среде (жидкая глюкозо-пептонная питательная среда). Состав жидкой
среды: глюкоза - 10 г/дм3, пептон - 5 г/дм3, дрожжевой экстракт - 0,5 г/дм3
(Sigma, США). Среду для выращивания клеток стерилизовали автоклавированием при
давлении в 1 атмосферу в течение 45 минут. Клетки выращивали аэробно 18-20
часов в качалочных колбах объемом 750 см3 при температуре 29 оС. Затем
полученную биомассу центрифугировали при комнатной температуре при 8000 об/мин
10 минут. Далее центрифугат промывали 20 мМ фосфатным буфером рН 6,8. Осевшие
клетки рассуспендировали в свежей порции буфера, распределяли по порциям и
осаждали на центрифуге «Eppendorf» 5 минут при 8000 об/мин. Промытую биомассу
взвешивали и хранили в микропробирках при температуре -25 °С.
2.2 Иммобилизация клеток
Debaryamyces hansenii в модифицированный ПВС
Для формирования рецепторного элемента к 40 мг
дрожжей Debaryamyces hansenii добавляли 200 мкл модифицированного ПВС. Для
распределения дрожжей в пленки проводили встряхивание в течение 5 минут на
центрифуге «Sky Line». Полученную субстанцию переносили на предметное стекло и
оставляли на воздухе до полного высыхания. Последующие измерения проводились
при комнатной температуре.
2.3 Биосенсорные измерения
Принцип работы микробного сенсора на основе
кислородного электрода основан на том, что при окислении субстрата
иммобилизованными на поверхности кислородного электрода микроорганизмами
возрастает их дыхательная активность, и в приэлектродном пространстве снижается
концентрация кислорода, что регистрируется с помощью электрода (рис.11).
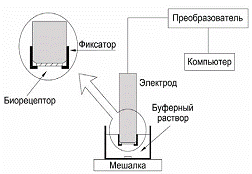
Рис. 11 - Схема биосенсора кюветного типа
Основным элементом биосенсорного анализатора
является кислородный электрод Кларка, на поверхности которого располагали
рецепторный элемент.
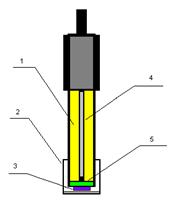
Рис. 12 - Электрод с рецепторным элементом: 1 -
раствор KCl - 30 мМ, 2 - защитный колпачок, 3 - рецепторный элемент, 4 -
платиновый электрод, 5 - полупроницаемая целлофановая мембрана
В качестве преобразователя использовали
многофункциональный анализатор Эксперт-001, в режиме «термооксиметр», что
позволило производить непрерывную регистрацию сигнала.

Рис. 13 - Внешний вид лабораторной модели
микробного биосенсора кюветного типа
Управление прибором проводилась с помощью
встроенной программы «EXP2PR». Перед непосредственным измерением проводили
промывку системы натрий-калиевым фосфатным буферным раствором рН = 6,8
(концентрация солей 33 мМ). Ввод пробы осуществлялся автоматическими
микропипетками переменного объема (1-10мкл, 20-200мкл, 200-1000мкл, 1-5 мл)
(«ЛИНПИПЕТ» Россия) После окончания измерений систему снова промывали буферным
раствором в течение 3 мин., до восстановления начальных параметров
(концентрации кислорода).
Обработка данных проводилась в программе Exel. В
ходе измерения на мониторе компьютера отображались изменения параметров
системы, таких как зависимость концентрации кислорода от времени. Измеряемым
параметром (ответом биосенсора) являлась максимальная скорость изменения
выходного сигнала биосенсора при добавлении субстратов.
2.4 Заполнение и проверка качества
электрода
Кислородный электрод заполняли 30 мМ раствором
хлорида калия. Полупроницаемая мембрана электрода - целлофан. Проверка качества
электрода осуществлялась с помощью свежеприготовленного 20% раствора сульфита
натрия. Данная операция носит название сульфидный тест.
При растворении сульфита натрия в воде
происходит восстановление свободного кислорода по реакции:
Na2SO3+O2=2Na2SO4
Электрод подключали к прибору «Эксперт-001» в
режиме «термоокиметр» в кювету добавляли 20% раствор сульфита натрия и
запускали процесс измерения пробы. Критерием пригодности электрода к измерениям
являлось снижение содержания кислорода в кювете до 0 мг/дм3.
2.5 Формирование рецепторного
элемента
Полученную пленку разрезали на одинаковые части
размером 3×3 мм. Биорецепторный
элемент помещали на поверхность кислородного электрода типа Кларка и
фиксировали с помощью капроновой сетки.
2.6 Определение БПК5 методом
разбавления
Определение БПК стандартным методом проводили по
методике описанной в ПНДФ [61]. Для определения БПК образцов браги проводили
предварительное разбавление, сточные воды анализировали без предварительного
разбавления.
2.6.1 Приготовление разбавляющей
воды и растворов
Приготовление разбавляющей воды
Разбавляющую воду готовят из дистиллированной
воды, полученной накануне анализа, выдержанной при температуре 20 °С; ее
насыщают кислородом воздуха, аэрируя до концентрации растворенного кислорода не
менее 8 мг/дм3 и не более 9мг/дм3. В разбавляющую воду добавляют фосфорные и
аммонийные соли, гексагидрат хлорида железа, хлорид кальция и сульфат магния для
создания устойчивой буферной системы, которая позволяет поддерживать постоянное
значение рН в течение любого времени инкубации, не изменяющееся при выделении
СО2 (продукт метаболизма бактерий).
Растворы солей для приготовления разбавляющей
воды
Фосфатный буферный раствор рН = 7,2: 8,5 г
однозамещенного фосфорнокислого калия (KH2PO4), 21,75 г двузамещенного
фосфорнокислого калия (K2HPO4), 33,4 г двузамещенного фосфорнокислого натрия
7-водного (Na2HPO4·7H2O) и 1,7 г хлорида аммония (NH4Cl) растворяют в дистиллированной
воде и доводят объем до 1 дм3.
Сульфат магния: 22,5 г MgSO4·7H2O ч.д.а.
растворяют в дистиллированной воде, доводят объем до 1 дм3.
Хлорид железа: 0,25 г. FeCl3·6H2O ч.д.а.
растворяют в дистиллированной воде, доводят объем до 1 дм3.
Хлорид кальция: 27,5 г. CaCl2 ч.д.а. безводного
растворяют в дистиллированной воде, доводят объем до 1 дм3.
Растворы хранят в темноте, при комнатной
температуре не более месяца. Не используют при появлении осадка.
В день анализа к 1 дм3 разбавляющей воды
прибавляют 1 см3 фосфатного буферного раствора, 1 см3 раствора сульфата магния,
1 см3 раствора хлорида кальция, 1 см3 раствора хлорида железа.
Заражение микрофлорой.
В разбавляющую воду в день анализа добавляют
бактериальную затравку. (При анализе сточных вод сооружений биологической
очистки такой затравки не требуется). Бактериальную затравку добавляют при
исследовании искусственно приготовленных растворов, производственных сточных,
олиготрофных поверхностных пресных, грунтовых, глубоко очищенных и
обеззараженных сточных вод.
Бактериальная затравка может отбираться из
разных источников, приготовлений разбавляющей воды используется один из
предлагаемых вариантов:
а) Сточные воды с городских сооружений
биологической очистки, отобранные после песколовок. Добавляют 0,3-1,0 см3 на 1
дм3 разбавляющей воды.
б) Аквариумная вода. Добавляют 5,0-10,0 см3 на 1
дм3 разбавляющей воды.
в) Речная вода. Добавляют 10,0-20,0 см3 на 1 дм3
разбавляющей воды.
Проверка степени чистоты разбавляющей воды
холостым опытом. При определении БПК5 две кислородные колбы заполняют
разбавляющей водой, в первой определяют кислород сразу в день исследования
(«нулевой» день), время между разбавлением пробы и определением кислорода в
«нулевой» день не должно превышать 15 мин. В во второй, которую помещают в
термостат вместе с анализируемыми пробами, - через 5 суток.
Разница средней концентрации кислорода в пробе
холостого опыта нулевого дня и через 5-суточный срок инкубации не должна
превышать 0,5 мг/дм3 кислорода.
2.6.2 Выполнение измерений с
разбавлением пробы
Для загрязненных речных и сточных вод с БПК5
выше 6 мг/дм3 требуется предварительное разбавление пробы. Определение
производят в разбавленной пробе по разности содержания кислорода до и после
инкубации в стандартных условиях. Для разбавления пробы применяют искусственно
приготовленную разбавляющую воду (п. 3.5.1). При приготовлении разбавлений
температура исследуемой пробы должна соответствовать температуре 18-20 °С.
Для расчета необходимых разбавлений пробы
следует ожидаемое содержание БПК в пробе разделить на 4-5 (поскольку в воде
после инкубации при правильном разбавлении должно остаться 4-5 мг/дм3
кислорода). Если нельзя предположить ожидаемое разбавление рассчитывается по
результатам определения пермонганатной окисляемости (ХПК). Условно принимают
биохимическое потребление кислорода 50% ХПК, а поскольку в воде после инкубации
должно остаться 4-5 мг/дм3 кислорода, вычисленное значение (ХПК:2) делят на 4
или 5. Полученный результат показывает, во сколько раз надо разбавить
анализируемую воду.
В мерную колбу вместимостью 1 дм3 наливают
хорошо перемешанную испытуемую жидкость, отбирают пипеткой определенный объем и
вносят в другую колбу (цилиндром отмеряются объемы больше 50 см3). Затем
доливают до метки разбавляющей водой и хорошо перемешивают; полученную смесь
сифоном, опущенным до дна колбы, наливают в шесть кислородных колб объемом 250
см3, закрывают пробкой, следя за тем, чтобы внутри не осталось пузырьков
воздуха. Затем оставшейся смесью заполняют колпачки от колб и, наклонив колбу,
вставляют их в колпачки с водой, вытесняя из них воду, чтобы не осталось
пузырьков воздуха. Для каждого разбавления заполняют две колбы.
В первых двух кислородных колбах немедленно
определяют кислород. Все остальные колбы помещают в термостат при 20 °С для
инкубации.
Через 2, 5 сут от начала инкубации вынимают из
термостата по две колбы с испытуемой водой, определяют в них растворенный
кислород и содержание нитритов.
.6.3 Расчет БПК при определении с
разбавлением пробы
X = [(Cx1 - Cx2) - (Cy1 - Cy2)] N,
где, X - БПК, мг/дм3;
Сx1 - содержание растворенного кислорода в
исследуемой воде до инкубации, мг/дм3;
Сx2 - то же, после инкубации, мг/дм3;
Сy1 - содержание растворенного кислорода в
разбавляющей воде до инкубации, мг/дм3;
Сy1 - то же, после инкубации, мг/дм3;- величина
разбавления.
2.7 Определение перманганатной
окисляемости
Определение перманганатной окисляемости
проводили согласно ПНДФ [62]. Метод основан на окислении веществ,
присутствующих в пробе воды, известным количеством перманганата калия в
сернокислой среде при кипячении в течение 10 минут. Не вошедший в реакцию
перманганат калия восстанавливают щавелевой кислотой. Избыток щавелевой кислоты
оттитровывают раствором перманганата калия.
При определении перманганатной окисляемости
после реакции должно оставаться не менее 40 % введенного перманганата калия,
так как степень окисления зависит от его концентрации.
Для получения достоверных и сравнимых между
собой результатов необходимо строго придерживаться условий проведения анализа.
2.7.1 Подготовка дистиллированной
воды
Перед использованием воду проверяют на
отсутствие восстановителей. При холостом опыте расход раствора перманганата
калия на титрование не должен превышать 0,5 см3, в противном случае следует
провести процедуру очистки или использовать воду с меньшим содержанием
органических соединений.
Для очистки от восстановителей к 1 дм3
дистиллированной воды добавляют 10 см3 серной кислоты (1:15) и небольшой
избыток (до образования розового цвета) основного раствора перманганата калия,
а затем перегоняют. Первую порцию дистиллята объемом 100 см3 отбрасывают.
Перегнанную дистиллированную воду хранят в стеклянной бутыли со стеклянной
пробкой.
Приготовление растворов вели согласно методике
прописанной в ПНДФ [62].
2.7.2 Выполнение измерений
В колбу помещают 100 см3 хорошо перемешанной
пробы (при необходимости разбавленной дистиллированной водой до 100 см3),
несколько капилляров или стеклянных шариков, приливают 5 см3 разбавленной
серной кислоты (1:3) и 10 см3 раствора перманганата калия (0,01 моль/дм3
эквивалента). Смесь нагревают так, чтобы она закипела не позднее чем через 5
минут, и кипятят 10 ± 2 мин, закрыв маленькой конической воронкой для
уменьшения испарения. Если в процессе кипячения содержимое колбы потеряет
розовую окраску или побуреет, то определение надо повторить, разбавив
исследуемую воду. К горячему раствору (80 - 90 °С) прибавляют 10 см3 раствора
щавелевой кислоты (0,01 моль/дм3 эквивалента). Обесцвеченную горячую смесь
титруют раствором перманганата калия (0,01 моль/дм3 эквивалента) до слабо-розового
окрашивания. Если при титровании пробы расходуется перманганата калия более 60
% от добавленного количества, т.е. если при обратном титровании израсходовано
более 7 см3 раствора титранта, то пробу разбавляют и повторяют определение.
Если при анализе предварительно разбавленной
пробы на титрование расходуется менее 2 см3 раствора перманганата калия, то
определение повторяют с менее разбавленной или неразбавленной пробой.
Холостое определение
Одновременно проводят холостой опыт со 100 см3
дистиллированной воды и обрабатывают ее так же, как анализируемую воду. Расход
раствора перманганата калия при холостом определении не должен превышать 0,5
см3. В противном случае проводят дополнительную очистку используемой
дистиллированной воды и посуды.
2.7.3 Обработка результатов
эксперимента
Величину перманганатной окисляемости, выраженную
в мгО/дм3, рассчитывают по формуле:
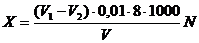
где V1 - объем раствора перманганата
калия (0,01 моль/дм3 эквивалента), израсходованного на титрование исследуемой
пробы, см3;- объем раствора перманганата калия (0,01 моль/дм3 эквивалента),
израсходованного на титрование холостой пробы, см3;- объем пробы, взятой для
анализа (100), см3;- коэффициент разбавления пробы;
- эквивалент кислорода.
2.8 Результаты определения
перманганатной окисляемости и расчет величины разбавления
Для определения перманаганатной
окисляемости проведено предварительное разбавление образцов браги. Образец №1
(до начала бражения) разбавлен в 500 раз, образец №2 (24 часа от начала
брожения) - в 500 раз, образец №3 (48 часов от начала брожения) - в 500 раз,
образец №4 (72 часа от начала брожения) разбавлен в 750 раз.
Расчет перманганатной окисляемости
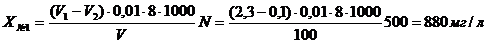 №1: 880 ± 90, мгО/дм3 (P = 0,95)
№1: 880 ± 90, мгО/дм3 (P = 0,95)
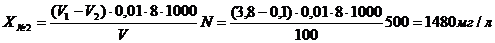 №2:1500 ± 100, мгО/дм3 (P = 0,95)
№2:1500 ± 100, мгО/дм3 (P = 0,95)
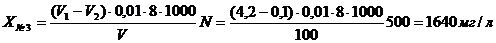 №3: 1600 ± 200, мгО/дм3 (P = 0,95)
№3: 1600 ± 200, мгО/дм3 (P = 0,95)
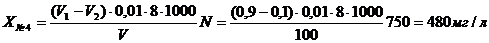 №4: 480 ± 50, мгО/дм3 (P = 0,95)
№4: 480 ± 50, мгО/дм3 (P = 0,95)
Применяя то, что перманганатная
окисляемость составляет 50% от ХПК, и остаточный кислород в кювете должен
составлять 4-5 мг/л, то предварительное разбавление для определения БПК для
образца №1 нужно провести в 200 раз. Образец №2 необходимо разбавить в 300 раз,
образец №3 - в 350 раз, образец №4 нужно разбавить в 100 раз.
3. Обсуждение результатов
Анализ литературных данных
показывает, что наиболее экспрессным методом определения БПК является метод на
основе биосенсора. Для калибровки БПК-датчиков используют различные стандарты.
В связи с этим, целью наших исследований был подбор оптимального стандарта для
калибровки датчика БПК-биосенсора.
Для формирования рецепторного
элемента сенсора использовали дрожжевой штамм Debaryamyces hansenii ВКМ Y-2482.
Согласно литературным данным штамм обладает широкой субстратной специфичностью
и способен окислять многие спирты, углеводы, аминокислоты и другие органические
вещества [статьи про дрожжи]. Также штамм Debaryamyces hansenii устойчив к
высоким концентрациям солей и к высокому осмотическому давлению. Данные
особенности позволяют использовать данный штамм для анализа технологических
сточных.
Формирование рецепторного элемента
проведено включением клеток микроорганизмов в гель модифицированного
поливинилового спирта (ПВС).
3.1 Определение характеристик макета
БПК-биосенсора на основе клеток Debaryamyces hansenii, иммобилизованных в
модифицированный ПВС на основе ГГС и ОЕСD
Операционная стабильность
Операционная стабильность является
одной из важнейших характеристик биосенсора. Она показывает устойчивость ответа
сенсора на одну и ту же концентрацию субстрата при проведении большого числа
последовательных измерений и тесно связана с метрологической характеристикой
сходимостью (повторяемостью).
Операционная стабильность сенсоров
характеризуется относительным стандартным отклонением при многократном
измерении стандартного образца и остаточной активностью (% от исходной)
биосенсора после нескольких последовательных измерений в течение определенного
периода времени.
Операционная стабильность на основе
ГГС
Для определения операционной
стабильности на основе ГГС было проведено 15 последовательных измерений ответа
сенсора на 20 мкл 3 г/дм3 раствора глюкозо-глутаматной смеси (ГГС)
(концентрация в кювете 19,9 мг/дм3). Смесь ГГС была выбрана, так как её
применение как стандарта при анализе БПК определено в ПНДФ [61].
При введении субстрата в
измерительную ячейку микроорганизмы окисляют его. При этом возрастает
дыхательная активность клеток, и в приэлектродном пространстве снижается
концентрация кислорода, что регистрируется с помощью электрода Кларка (рис.13).
На монитор выводится графическое отображение изменения концентрации кислорода
от времени (рис. 14). По полученному отклику вычисляется ответ сенсора как
максимальная скорость изменения концентрации кислорода от времени (первая
производная).
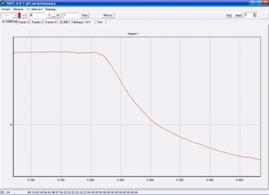
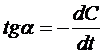
Рис. 14 - Ответ биосенсора на основе дрожжевого
штамма Debaryamyces hansenii, иммобилизованного в модифицированный ПВС на
добавление 35 мкл ГГС
Время между последовательными измерениями
составляло около 7 минут. Данные по операционной стабильности были получены на
четвертый день после иммобилизации. Результаты представлены на рисунке 15 и в
таблице 2
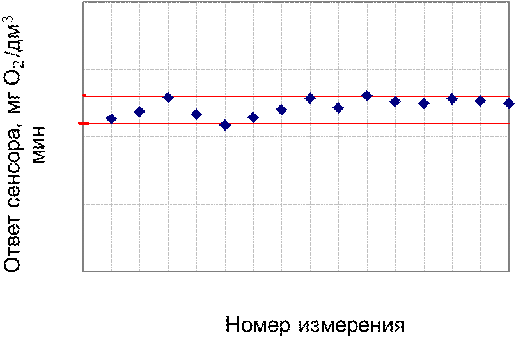
Рис. 15 - Операционная стабильность биосенсора
на основе иммобилизированных клеток Debaryamyces hansenii
Таблица 2 - Данные по операционной стабильности
на основе ГГС
|
Стандартное
отклонение S, мг/(дм3∙мин)
|
Относительное
стандартное отклонение Sr, %
|
|
Обсчет
в ручную
|
6,611∙10-3
|
2,4
|
|
Обсчет
в Excel
|
6,611∙10-3
|
2,4
|
Операционная стабильность на основе OECD
Для определения операционной стабильности на
основе ГГС было проведено 15 последовательных измерений.
Таблица 3 - Данные по операционной стабильности
на основе ОЕСD
|
Стандартное
отклонение S, мг/(дм3∙мин)
|
Относительное
стандартное отклонение Sr, %
|
|
Обсчет
в ручную
|
5,332∙10-3
|
2,7
|
|
Обсчет
в Excel
|
5,332∙10-3
|
2,7
|
Данные операционной стабильности представлены на
рис. 16
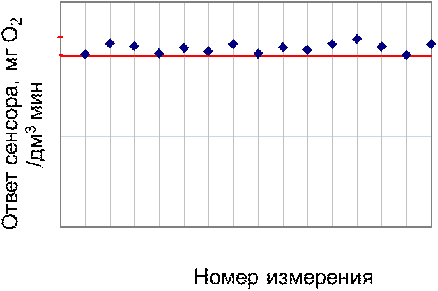
Рис. 16 - Операционная стабильность биосенсора
на основе иммобилизованных клеток Debaryamyces hansenii
Как видно из графиков ответы изучаемых
биорецепторов оставались стабильными на протяжении всех 15 измерений.
Стандартное отклонение, рассчитанное с помощью двух программ и вручную
(приложение 1), составило 6,611∙10-3 мг/(дм3∙мин) на основе ГГС,
относительное стандартное отклонение - 2,4%, среднее значение равняется 0,272
±0,004 мг/(дм3∙мин). С использованием стандарта ОЕСD стандартное
отклонение составило 5,332∙10-3 .относительное стандартное отклонение -
2,7%, среднее значение равняется 0,198 ±0,003 мг/(дм3∙мин).
Устойчивость ответа сенсора на одну и ту же
концентрацию субстрата с использованием двух стандартов составляет менее 3% и
различается незначительно.
Долговременная стабильность на основе ГГС
Долговременная стабильность является
характеристикой самого рецепторного элемента. Она зависит от природы биомассы и
от способа иммобилизации клеток. Долговременная стабильность характеризует
устойчивость работы сенсора в течение длительного периода времени.
Долговременную стабильность определяли путём
ежедневного определения величины ответа сенсора на одну и ту же концентрацию
раствора глюкозо-глютаматной смеси (рис. 17). Между измерениями сенсор хранился
в буферном растворе при температуре 20 ºС.
За время стабильной работы рецепторного элемента принимали время, в течение
которого величина сигнала составляла не менее 30% от начальной. Для определения
долговременной стабильности микробных сенсоров использовали ГГC тех же
концентраций, что и для определения операционной стабильности. За 100%
принимается ответ биосенсора в первый день измерений.
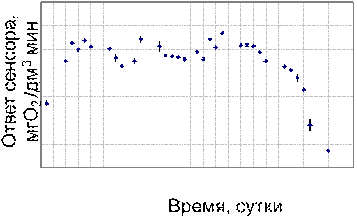
Рис. 17 - Долговременная стабильность биосенсора
на основе дрожжевого штамма Debaryamyces hansenii
В первый день после формирования рецепторного
элемента дорожи D. hansenii иммобилизованные в модифицированный поливиниловый
спирт имеют низкую активность. К четвертому дню активность возрастает (на %)
что можно объяснить адаптацией микроорганизмов к изменившимся условиям внешней
среды. К пятому дню дыхательная активность иммобилизованных дрожжей
стабилизируется. Высокая активность клеток D. hansenii сохраняется до 36 дня
посли формирования рецепторного элемента. К 43 дню активность дрожжей упала на
21 % от первоначальной, а к 46 дню снизилась до 75 %. Таким образом
долговременная стабильность рецепторного элемента на основе дрожжей Debaryamyces
hansenii иммобилизованных в модифицированный ПВС составила 43 дня.
Определение зависимости ответа биосенсора от
концентрации
Для получения количественной информации о
содержании анализируемых веществ в образце необходимо знать калибровочные
характеристики биосенсора, то есть зависимость аналитического сигнала от
концентрации в случае использования ГГС - стандарта, и зависимость
аналитического сигнала от БПК в случае ОЕСD - стандарта. Поэтому градуировочная
зависимость ответа сенсора от концентрации (БПК) определяемого вещества
является важнейшей метрологической характеристикой.
Зависимость ответа сенсора от концентрации на
основе ГГС
По полученным экспериментальным данным была
построена градуировочная зависимость отклика биосенсора от концентрации ГГС в
измерительной кювете.
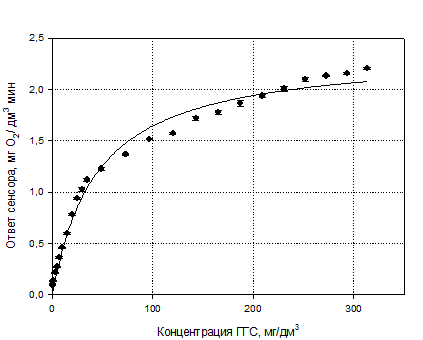
Рис. 18 - Зависимость ответа сенсора
от концентрации субстрата
Биорецепторы на основе целых клеток
микроорганизмов относятся к каталитическому типу, т.е. биологический ответ в
таких системах обеспечивается ферментативными реакциями микроорганизмов.
Поэтому зависимость, приведенная на рис. 18 хорошо описывается уравнением типа
Михаэлиса-Ментен:
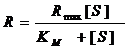 , где
, где
- максимальная скорость потребления
кислорода иммобилизованными микроорганизмами, при которой все молекулы фермента
участвуют в образовании фермент-субстратного комплекса. Достигается при [S]→∞;
- скорость.
КM - эффективная константа Михаэлиса
численно равна концентрации субстрата, при которой скорость ферментативной
реакции достигает половины максимального значения (R=Rmax/2).
Была произведена аппроксимация
зависимости ответа сенсора от концентрации субстрата с помощью уравнения
Михаэлиса - Ментен. Параметры были рассчитаны с помощью программы Sigma Plot
(см. приложение 2). Параметры уравнения для биосенсоров на основе используемых
штаммов приведены в таблице 3.
Таблица 4 - Параметры уравнения
Михаэлиса - Ментен зависимости ответа сенсора от концентрации ГГС
|
Эффективная
константа Михаэлеса К´М,мг/дм3
|
Максимальная
скорость потребления кислорода Rmax, мг/(мин∙дм3)
|
Коэффициент
смешанной корреляции R
|
|
44±2
|
2,37±0,06
|
0,9936
|
Полученные зависимости величины ответа сенсора
от концентрации субстрата имеют гиперболический вид.
Согласно уравнению Михаэлиса - Ментен концентрация
субстрата будет пропорциональна отклику биосенсора только при концентрациях,
гораздо меньших KM. Тогда уравнение приобретает следующий вид:
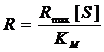
Для снижения ошибок анализа нередко
ограничиваются использованием линейного участка градуировочной кривой.
Верхняя граница линейной зависимости
была определена из уравнения Михаэлеса-Ментен. Численное значение верхней границы
определяемых концентраций равно константе Михаэлеса, К´м. Итак,
верхняя граница определяемых концентраций клеток Debaryamyces hansenii,
иммобилизованных в модифицированный поливиниловый спирт, составляет 44±2
мг/дм3.
Далее были проведены дополнительные
опыты по определению зависимости ответа сенсора от концентрации субстрата на
линейном участке градуировочной прямой. По полученным данным построен график
зависимости ответа сенсора от концентрации ГГС. (рис. 19)

Рис. 19 - Линейный участок
зависимости ответа сенсора от концентрации субстрата
Обсчет уравнения прямой был сделан с
помощью двух программ и вручную (приложение 2). Параметры уравнения прямой,
аппроксимирующей линейный участок зависимости ответа сенсора от концентрации
субстрата для биосенсора на основе клеток Debaryamyces hansenii,
иммобилизованных в модифицированный ПВС, представлены в таблице 4
Таблица 5 - Параметры уравнения
прямой, аппроксимирующей линейный участок калибровочной зависимости: R = a×C + b
|
параметры
|
Excel
|
Ручной
обсчет
|
|
коэффициент
чувствительности а, мин-1
|
0,031±0,008
|
0,031±0,008
|
0,031±0,008
|
|
Коэффициент
b, мг/(мин∙дм3)
|
0,12±0,04
|
0,12±0,04
|
0,12±0,04
|
|
Уравнение
прямой
|
R=0,031×C+0,12
|
R=0,031×C+0,12
|
R=0,031×C+0,12
|
|
Коэффициент
корреляции R
|
0,9946
|
0,9949
|
0,9948
|
Верхняя граница линейной зависимости была
определена из уравнения Михаэлеса-Ментен. И составляет 44±2 мг/дм3 на основе
ГГС-стандарта.
Зависимость ответа сенсора от концентрации для
ОЕСD- синтетических сточных вод
О содержании анализируемых веществ в образце
необходимо знать калибровочные характеристики биосенсора, то есть зависимость
аналитического сигнала от БПК.
По полученным экспериментальным данным была
построена градуировочная зависимость отклика биосенсора от БПК в измерительной
кювете.
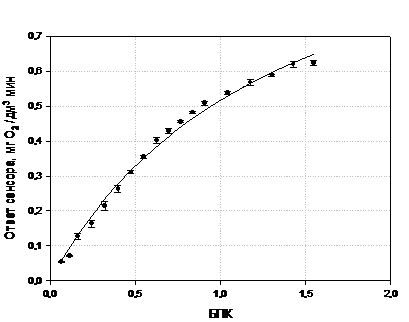
Рис. 20 - Зависимость ответа сенсора
от БПК
Была произведена аппроксимация
зависимости ответа сенсора от БПК субстрата с помощью уравнения Михаэлиса -
Ментен. Параметры были рассчитаны с помощью программы Sigma Plot (см.
приложение 2). Параметры уравнения для биосенсоров на основе используемых
штаммов приведены в таблице 6.
Таблица 6 - Параметры уравнения
Михаэлиса - Ментен калибровачной зависимости
|
Эффективная
константа Михаэлеса К´М,мг/дм3
|
Максимальная
скорость потребления кислорода Rmax, мг/(мин∙дм3)
|
Коэффициент
смешанной корреляции R
|
|
1,21±0,08
|
0,9±0,2
|
0,9962
|
Полученные зависимости величины ответа сенсора
от БПК имеют гиперболический вид.
Далее были проведены дополнительные опыты по
определению зависимости ответа сенсора от БПК на линейном участке
градуировочной прямой. По полученным данным построен график зависимости ответа
сенсора от БПК. (рис. 21)
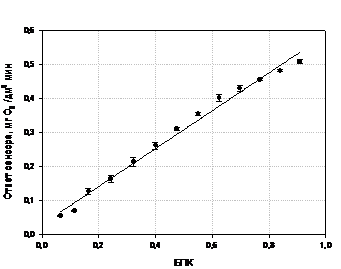
Рис. 21 - Линейный участок
зависимости ответа сенсора от БПК
Обсчет уравнения прямой был сделан с
помощью двух программ и вручную (смотри приложение 2). Параметры уравнения
прямой, аппроксимирующей линейный участок зависимости ответа сенсора от БПК для
биосенсора на основе клеток Debaryamyces hansenii иммобилизованных в
модифицированный поливиниловый спирт представлены в таблице 7.
Таблица 7 - Параметры уравнения
прямой, аппроксимирующей линейный участок калибровочной зависимости для
OECD-синткетических сточных вод: R = a×C + b
|
параметры
|
Sigma
Plot
|
Excel
|
Ручной
обсчет
|
|
коэффициент
чувствительности а, мин-1
|
0,56±0,02
|
0,56±0,02
|
0,56±0,02
|
|
Коэффициент
b, мг/(мин∙дм3)
|
0,03±0,04
|
0,03±0,04
|
0,03±0,04
|
|
Уравнение
прямой
|
R=0,56×C+0,03
|
R=0,56×C+0,03
|
R=0,56×C+0,03
|
|
Коэффициент
корреляции R
|
0,9940
|
0,9948
|
0,9948
|
Высокие значения коэффициента корреляции
рецепторного элемента характеризует то, что выбранный участок с большой
достоверностью может быть аппроксимирован линейной зависимостью.
С использованием ОЕСD - синтетических сточных
вод верхняя граница определяемых БПК составляет 1,21±0,08 мг/дм3.
Коэффициент чувствительности биосенсора
Простейшей численной характеристикой
чувствительности служит коэффициент чувствительности. Он определяется как
производная аналитического сигнала по концентрации определяемого компонента:
Если градуировочная функция линейна
(R=а×C+b),
то
коэффициент чувствительности - это тангенс угла наклона градуировочной прямой
a. Чем выше коэффициент чувствительности, тем меньшие количества компонента
можно обнаруживать и определять, получая один и тот же аналитический сигнал,
тем точнее можно определить одно и то же количество вещества.
В настоящей работе чувствительность
сенсоров находили как тангенс угла наклона калибровочной прямой в координатах
ответ сенсора - концентрация субстрата. При использовании ГГС-стандарта
чувствительность составила 0,031±0,008 мин-1. При применение ОЕСD -
синтетических сточных вод для калибровки БПК-датчика чувстительность составила
0,56±0,02 мин-1. Таким образом чувствительность сенсора на основе дрожжей
Debaryamyces hansenii к OECD-синтетическим сточным на порядок превышает
чувствительность к ГГС.
В случае амперометрических
биосенсоров повысить чувствительность датчика оказывается, возможно путем
увеличения количества иммобилизованного фермента либо за счет увеличения
истинной поверхности индикаторного электрода на микро уровне (увеличение
фактора шероховатости) [63].
Однако использование величины а для
описания чувствительности имеет ряд недостатков. Во-первых, коэффициент
чувствительности -величина размерная, поэтому сопоставление коэффициентов
чувствительности для принципиально разных (различающихся природой
аналитического сигнала) методов невозможно. Во-вторых, сопоставление величин а
даже одинаковой размерности имеет смысл действительно только "при прочих
равных условиях", т.е. в первую очередь при одинаковой точности измерения
аналитических сигналов. Поэтому для характеристики чувствительности используют
еще две величины, называемые пределом обнаружения и нижней границей
определяемых содержаний.
Предел обнаружения
Предел обнаружения (Cmin) - это
наименьшее содержание вещества которое может быть обнаружено данной методикой с
заданной степенью достоверности. Таким образом, предел обнаружения
характеризует методику с точки зрения возможностей качественного анализа.
Предел обнаружения соответствует
наименьшей концентрации, которая дает сигнал, отличимый от значения холостого
опыта. При доверительной вероятности Р = 0,95 данный параметр можно определить
по формуле:
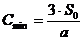 , где
, где
- стандартное отклонение холостого
опыта, а - коэффициент чувствительности
Из этой формулы следует, что предел
обнаружения зависит не только от коэффициента чувствительности а, но и от S0,
т.е. точности измерения аналитических сигналов. Чем она выше, тем меньше Сmin.
Также величина предела обнаружения имеет одну и ту же размерность -
концентрации - независимо от природы аналитического сигнала.
Стандартное отклонение холостого
опыта рассчитывалось для семи последовательных измерений. Производили
регистрацию отклика биосенсора на 50 мкл дистиллированной воды. Ответ сенсора
определяли как первую производную отклика.
Результаты холостого опыта приведены
в таблице 8. Расчеты минимального предела обнаружения приведены в приложении 3.
Таблица 8 - Результаты холостого
опыта биосенсора на основе иммобилизированных клеток Debaryamyces hansenii в
пленку из сополимера ПВС с ПВП.
|
Номер
опыта
|
Ответ
сенсора, мг/(мин∙дм3)
|
|
1
|
0,0288
|
|
2
|
0,02634
|
|
3
|
0,03222
|
|
4
|
0,02742
|
|
5
|
0,03144
|
|
6
|
0,02622
|
|
7
|
0,0321
|
Таким образом, минимальный предел обнаружения
ГГС биосенсором на основе клеток Debaryamyces hansenii иммобилизованных в ПВС
составил 0,02 мг/дм3. минимальный предел обнаружения OECD составил 0,01 мг/дм3.
3.1.6 Нижняя граница определяемых
содержаний
Для характеристики возможностей методики с точки
зрения количественного анализа используют величину, называемую нижней границей
определяемых содержаний (Cн). Это минимальное содержание компонента, которое
можно определить с заданной степенью точности, характеризуемой предельно
допустимой величиной относительного стандартного отклонения. Очевидно что Сн
> Cmin.
Для нахождения Сн определили ряд значений
стандартного отклонения при различных БПК Sr(БПК), по полученным значениям
построили экспериментальную зависимость относительного стандартного отклонения
от БПК (имеющую вид убывающей кривой - обычно близкой к гиперболе) и нашли БПК,
начиная с которой величины Sr(БПК) становятся меньше, чем заданное предельное
значение Sr(C)max = 0,33[64].
Нижняя граница определяемых содержаний по ГГС
Для расчета нижней границы использовали
грудуировку в коордринатах ответ сенсора - БПК. Пересчет проводили по формуле:
БПК=0,687×С(ГГС)
Детальный расчет нижней границы определяемых
содержаний приведен в приложении 3.
На рисунке 22 представлен результат
аппроксимации зависимости относительного стандартного отклонения от БПК(ГГС)
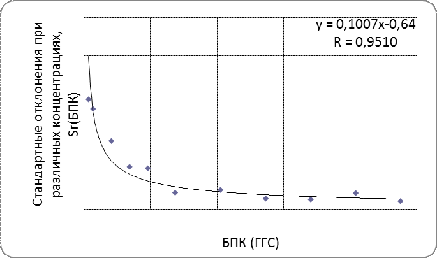
Рис. 22 - Экспериментальная зависимость
относительного стандартного отклонения ответа биосенсора от БПК (ГГС)
Нижняя граница определяемых содержаний для ОЕСD
На рисунке 23 представлен результат
аппроксимации зависимости относительного стандартного отклонения от БПК (ОЕСD)
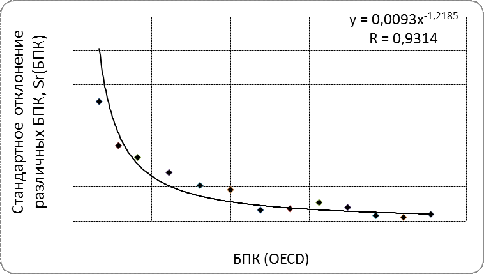
Рис. 23 - Экспериментальная зависимость
относительного стандартного отклонения ответа биосенсора от БПК (ОЕСD)
Таким образом нижняя граница определяемых
содержаний БПК на основе ГГС-стандарта составила 0,157 мл О2/дм3, а нижняя граница
определяемых содержаний БПК на основе OECD-стандарта составила 0,05 мл О2/дм3.
Применение OECD-стандарта позволит анализировать
образцы с очень низким значением БПК.
Рабочий диапазон
Для любого аналитического метода важно знать
диапазон концентраций определяемого вещества, в котором этот метод работает -
рабочий диапазон. Рабочий диапазон определяется из калибровочной зависимости
биосенсора. Рабочий диапазон не всегда ограничен лишь линейным участком, но для
снижения ошибок анализа ограничиваются использованием линейного участка
калибровочной зависимости (линейный диапазон).
Для калибровочных зависимостей гиперболического
вида линейный диапазон ограничен снизу нижней границей определяемых содержаний,
сверху - концентрацией, равной КМ. Так для биосенсора на основе дрожжей
Debaryamyces hansenii линейный диапазон зависимости ответа биосенсора от
концентрации ГГС составил 0,23 - 44 мг/дм3. Учитывая, что теоретическая
зависимость БПК от концентрации ГГС имеет вид: БПК = 0,687×С,
линейный диапазон зависимости ответа биосенсора от БПК составил 0,16 - 30
мг/дм. Для биосенсора на основе дрожжевого штамма Debaryamyces hansenii
иммобилизированного в модифицированный ПВС линейный диапазон зависимости ответа
биосенсора от БПК (ОЕСD-синтетических сточных вод) составил 0,05 -1,21мг/дм3 .
При калибровке БПК-датчика по ГГС-стандарту
диапазон линейности в 30 раз превышает диапазон линейности в случае калибровки
по OECD-синтетическим сточным водам.
3.2 Экспрессность биосенсора
Важной аналитической характеристикой любого
метода является его экспрессность, т.е. быстрота проведения анализа. Временные
затраты метода определяются в первую очередь длительностью единичного
измерения. Для биосенсора этот параметр складывается из времени развития ответа
и времени восстановления активности рецепторного элемента (промывки сенсора).
Для биосенсора на основе дрожжей Debaryamyces hansenii, иммобилизованных в ПВС,
на развитие ответа сенсора требуется 1-2 минуты в зависимости от концентрации
субстрата, время восстановления активности рецепторного элемента после
измерения (промывание) - 3-5 минут. Таким образом, длительность одного
измерения 4-7 минут.
3.3 Анализ образцов вод
Проведен анализ реальных образцов воды и
полупродуктов брожения с использованием разработанного макета БПК-биосенсора и
стандартным методом разбавления.
Определение БПК5 образцов вод стандартным
методом разбавления проводилось согласно действующим в РФ нормативным
документам [61]. Содержание растворенного кислорода до и после пятидневной
инкубации определялось с помощью анализатора жидкости «Эксперт - 001».
3.3.1 Анализ образцов, калибровка
БПК-датчика по ГГС-стандарту
Для определения БПК анализируемых образцов воды
по ГГС-стандарту с помощью биосенсора на основе клеток Debaryamyces hansenii,
иммобилизованных в модифицированный ПВС была построена градуировочная
зависимость в координатах ответ сенсора - БПК:
БПК = 0,68×C(ГГС)=
0,031C(ГГС) +0,12
После ряда математических операций было получено
уравнение зависимости ответа сенсора от БПК:
БПК = 22,14R-2,67
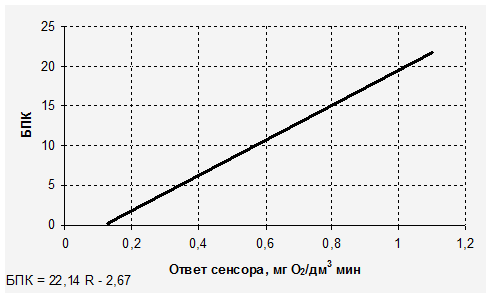
Рис. 24 - Зависимость ответа сенсора от БПК по
ГГС
Образцы воды (Упа, парк, талые) анализировали
без предварительного разбавления. Объем вносимых образцов (Упа и талые воды)
составил 200 мкл, а для образца «парк» - 400 мкл.
При непосредственном определении БПК с помощью
биосенсора проводили предварительное разбавление образцов браги. Величина
разбавления подбиралась таким образом, чтобы ответ сенсора лежал внутри
линейного участка калибровочной зависимости. Для образца браги №1 проведено
разбавление в 50 раз, образца браги №2 - 70 раз, образца браги №3 - 85 раз, а
для образца №4 - 25 раз. Объем образцов вносимых в кювету составил 250 мкл.
3.3.2 Анализ образцов, калибровка
БПК-датчика по OECD-стандарту
Аналогично, для определения БПК по ОЕСD сточных
вод с помощью биосенсора на основе иммобилизованных клеток Debaryamyces
hansenii была построена градуировочная зависимость в координатах ответ сенсора
- БПК:
= 0,56БПК +0,03
БПК = 1,77 R - 0,05
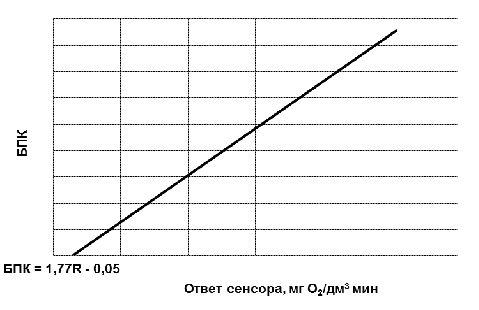
Рис. 25 - Зависимость ответа сенсора от БПК по
OECD
Образцы воды (Упа, парк, талые) анализировали
без предварительного разбавления. Объем вносимых образцов составил 100 мкл.
При непосредственном определении БПК5 с помощью
биосенсора проводили предварительное разбавление образцов браги. Величина
разбавления подбиралась таким образом, чтобы ответ сенсора лежал внутри
линейного участка калибровочной зависимости. Для образца браги №1 проведено
разбавление в 50 раз, образца браги №2 - 70 раз, образца браги №3 - 85 раз, а
для образца №4 - 25 раз. Объем образцов вносимых в кювету составил 100 мкл.
Результаты измерения БПК анализируемых образцов
с использованием биосенсора на основе клеток Debaryamyces hansenii,
иммобилизованных в модифицированный ПВС, представлены в таблице 9
Таблица 9 - Результаты измерения БПК полученные
с использованием биосенсора и стандартным методом
|
Анализируемые
образцы сточных вод
|
БПК,
измеренное с помощью биосенсора по ГГС, мг/дм3
|
БПК,
измеренное с помощью биосенсора по ОЕСD, мг/дм3
|
БПК5,
измеренное стандартным методом, мг/дм3
|
|
Вода
из р. Упа
|
7,8±0,6
|
8,0±0,1
|
7,6±0,8
|
|
Вода
из парка
|
2,7±0,7
|
2,5±0,1
|
2,4±0,3
|
|
Талая
вода
|
3,0±0,5
|
3,2±0,2
|
3,0±0,3
|
|
Образец
№1 до брожения
|
1030±70
|
1100±20
|
1100±100
|
|
Образец
№2 24 ч от начала брожения
|
1480±90
|
1590±20
|
1500±100
|
|
Образец
№3 48 ч от начала брожения
|
1740±70
|
1670±20
|
1700±100
|
|
Образец
№4 72 ч от начала брожения
|
530±20
|
596±9
|
600±80
|
По методике ПНДФ [61] допускается ошибка в
определении БПК5 не более 11%.
Таким образом, значение БПК, определенное с
помощью биосенсора на основе дрожжевого штамма Debaryamyces hansenii
иммобилизованного в модифицированный ПВС совпадает со значением БПК,
полученными стандартным методом с учетом доверительных интервалов.
Применение OECD-синтетических сточных вод в
качестве стандарта для калибровки БПК-датчика позволяет на порядок повысить
чувствительность сенсора, в сравнении с применением в качестве стандарта
глюкозо-глутаматной смеси. Данная особенность позволяет анализировать образцы
сточных вод с низкими значениями БПК.
Выводы
Определены аналитические и метрологические
характеристики БПК-биосенсора на основе дрожжевого штамма Debaryamyces hansenii
иммобилизованного в химически модифицированный ПВС на основе двух стандартов.
Относительное стандартное отклонение операционной стабильности для обоих
стандартов составляет менее 3%. Долговременная стабильность рецепторного
элемента составила 43 дня. Чувствительность сенсора на основе дрожжей
Debaryamyces hansenii к OECD-синтетическим сточным водам на порядок превышает
чувствительность к ГГС. При калибровке БПК-датчика по ГГС-стандарту диапазон
линейности в 30 раз превышает диапазон линейности в случае калибровки по
OECD-синтетическим сточным водам. Применение OECD-стандарта позволяет
анализировать образцы с очень низкими значениями БПК, т.к. нижняя граница
определяемых содержаний БПК составляет 0,05 мг О2/дм3.
Проведено определение БПК стандартным методом
разбавления и с помощью разработанного БПК-биосенсора. Значения БПК,
определенные с помощью биосенсора на основе дрожжевого штамма Debaryamyces
hansenii иммобилизованного в модифицированный ПВС совпадают со значениями БПК,
полученными стандартным методом с учетом доверительных интервалов.
Список литературы
1.
Тернер Э., Карубе И., Уилсон Д. Биосенсоры: основы и приложения. М.: Мир. 2012.
- 614 с.
.
Каттрал В.Р. Химические сенсоры. М.: Научный мир, 2000. - 123с.
.
Эггинс Б. Химические и биологические сенсоры. М.: Техносфера, 2005г. - 336с.
.
А. Н. Решетилов. Микробные, ферментные и иммунные биосенсоры для экологического
мониторинга и контроля биотехнологических процессов. // Прикладная биохимия и
микробиология, 2005, т. 41, №5, с. 504-513.
.
Divies C. Ethanol oxidation by an acetobacter xylinum microbial electrode.//
Ann.Microbial (Paris).- 1975.- Vol.126A.- P.175-186.).
.
Биосенсоры. Принципы функционирования и практическое применение.Учебное пособие
,Понаморева О.Н., Решетилов А.Н., Алферов В.А.
.
Racek J. Cell-based biosensors. Lancaster. Technomic: Publishing Company, Inc.
2009. 107 p.
.
Иммобилизованные клетки и ферменты. Под ред. Дж. Вудворда. М.:Мир, 1988. 215с.,
ил.
9.
Guilbault G.G. Handbook of Immobilized Enzymes. - N.Y.: Marcel Dekker, 1984.
10.
Бабьева И.П., Чернов И.Ю. Биология дрожжей. Учебное пособие для университетов,
электронная версия, 2011.
.
Шлегель Г. Общая микробиология. - М.: Мир, 1987. - 567 с.
12.
Palágyi Zs., Ferenczy L., Vágvölgyi Cs. Carbon-source
assimilation pattern of the astaxanthin-producing yeast Phaffia rhodozyma (англ.)
// World Journal of Microbiology and Biotechnology. 2012.
V. 17. № 1. p. 95 - 97
13.
McCann A. K., Barnett J. A. Starch utilization by yeasts: mutants resistant of
carbon catabolite repression (англ.)
// Current Genetics. 1984. V. 8. № 7. p. 525 - 530
14.
GrootWassink J. W. D. , Fleming S. E. Non-specific β-fructofuranosidase
(inulase) from Kluyveromyces fragilis: Batch and continous fermentation, simple
recovery method and some industrial properties (англ.)
// Enzyme and Microbial Technology. 2010. V. 2. № 1. p.
45 - 53
15.
Pereira M. S. A Portait of State-of-the-Art Research at the Technical
University of Lisbon Part VII. :Springer Netherlands, 2007, p.457-464.
16.
Большая статья Debaryomyces hansenii: Osmotolerant
17.
Immobilization of enzyme and cells. / Edited by Jose M. Guisan. - 2nd ed. New
Jersey: Humana Pres inc. 2006. 449 p.
.
Синицын А.П., Райнина Е.И., Лозинский В.И., Спасов С.Д. Иммобилизованные клетки
микроорганизмов. М.: Изд-во МГУ. 1994. 288с
.
Handbook of Biosensors and Biochips. / Edited by Marks R. S., Cullen D. C.,
Karube I., Lowe C. R., Weetall H. 2012. 356 p.
.
Понаморева О.Н., Решетилов А.Н., Алферов в.А. Биосенсоры. Принципы
функционирования и практическое применение. - Тула: Изд-во ТулГУ, 2007. - 255с.
ил.
.
Базилюк Т.Н., Мельник Н.П., Менжерес Г.Я. Модификация поливинилового спирта
поли-N-винилпирролидоном.// Вопросы химии и химической технологии, 2003-№1.-
с.57- 60.
.
Сидельковская Ф.П., Огибина Т.Я., Аракелян В.Г. Ж. прикл. хим.,37, 182 (1964)
.
Муравьев А.Г. Руководство по определению показателей качества воды полевыми
методами. 3-е издание, дополненное и переработанное - СПб.: «Крисмас+», 2004. -
248 с.
.
Ввозная Н. Ф. Химия воды и микробиология. М.: Высш. школа, 1979. - 361 с.
.
Методы охраны внутренних вод от загрязнения и истощения. Под ред. И.К. Гавич,
М.: Агропромиздат, 1985. - 220 с.
.
Кастальский А.А., Минц Д.М. Подготовка воды для питьевого и промышленного
водоснабжения. М.: Высшая школа, 1962. - 367 с.
.
Лурье Ю.Ю. Аналитическая химия промышленных сточных вод. М.: Химия. 1984. 289
с.
.
Karube I., Mitsuda S., Matsunaga T., Susuki S. Microbial electrode BOD sensors
// Biotechnol. Bioeng. 1977. V. 19. №10. p. 1535-1547.
.
Kim M.N., Kwon H.S. Biochemical oxygen demand sensor using Serratia marcescens
LSY 4 // Biosens. Bioelectron. 1999. V. 14. №1. p. 1-7.
.
Kim M.-N., Park K.-H. Klebsiella BOD sensor. // Sensors and Actuators B. 2001.
№ 80. p. 9-14.
.
Chan C., Lehmann M., Tag K., Lung M., Kunze G., Riedeld K., Gruendige B.,
Renneberg R. Measurement of biodegradable substances using the salt-tolerant
yeast Arxula adeninivorans for a microbial sensor immobilized with
poly(carbamoyl)sulfonate (PCS). Part II: Application of the novel biosensor to
real samples from coastal and island regions. // Biosens Bioelectron. 1999.
V.14. №3. p. 295-302.
.
Tag K., Lehmann M., Chan C., Renneberg R., Riedel K., Kunze G., Measurement of
biodegradable substances with a mycelia-sensor based on the salt tolerant yeast
Arxula adeninivorans LS3. // Sensors and Actuators B. 2000. № 67. p. 142-148.
.
Воронова Е.А., Ильясов П.В., Кучивкина Т.Н., Китова А.Е., Емельянова Е.В.,
Решетилов А.Н. Использование дрожжей рода Arxula для определения БПК.//
Институт микробиологии им. С.Н. Виноградского РАН, международная научная
конференция «Микроорганизмы и биосфера», основные тезисы, 2007 г.
.
Голубев В.И. Таксономическая характеристика дрожжей, используемых в
гидролизно-дрожжевых производствах. // Прикладная биохимия и микробиология.
2010. Т. 30. Вып. 1. С. 132-136.
.
Chee, G.-J., Y. Nomura, and I. Karube. // Analytica Chimica Acta, 1999. 379: p.
185-191.
.
Suriyawattanakul L., Surareungchai W., Sritongkam P.,·Tanticharoen M.,
Kirtikara K. The use of co-immobilization of Trichosporon cutaneum and Bacillus
licheniformis for a BOD sensor. Appl Microbiol Biotechnol. 2002. V. 59. № 1. p.
40-44.
.
Yang Z., Suzuki H., Sasaki S., Karube I. Disposable sensor for biochemical
oxygen demand // Appl. Microbiol. Biotechnol. 1996. V. 46. p 10 - 14.
.
Jianbo J., Tang M., Chen X., Qi L., Dong S. Co-immobilized microbial biosensor
for BOD estimation based on sol-gel derived composite material // Biosens.
Bioelectron. 2003. V. 18. №8. p. 1023-1029.
.
Trosok S.P., Driscoll B.T., Luong J.H. Mediated microbial biosensor using a
novel yeast strain for wastewater BOD measurement. // Appl Microbiol
Biotechnol. 2001. № 56. p. 550-554.
40.
Kumlanghan A., Kanatharana P., Asawatreratanakul P., Mattiasson B.,
Thavarungkul P. Microbial BOD sensor for monitoring treatment of wastewater
from a rubber latex industry
<#"876591.files/image040.gif">
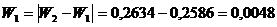
Тестовая статистки рассчитывается по
формуле:
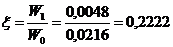
Критической величиной является
табличное значение Q(P,n)=0,41.
Так как 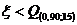 , то промаха
нет, данное значение принадлежит выборке.
, то промаха
нет, данное значение принадлежит выборке.
Аналогично проверяется значение
0,2802
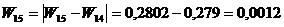
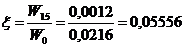
Так как 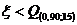 , то промаха
нет, значение 0,2802 принадлежит выборке.
, то промаха
нет, значение 0,2802 принадлежит выборке.
Чтобы оценить случайные погрешности
анализа рассчитаем среднее значение и характеризующие воспроизводимость
дисперсию, стандартное отклонение и отностительное стандартное отклонение.
)Расчет среднего значения:
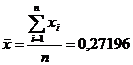 мг/(дм3∙мин)
мг/(дм3∙мин)
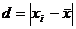 - отклонение от среднего
- отклонение от среднего
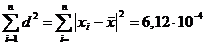 [мг/(дм3∙мин)]2
[мг/(дм3∙мин)]2
Дисперсия и стандартное отклонение
характеризуют рассеяние результатов относительно среднего. Дисперсию выборки
(V) вычисляют по формуле:
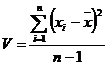
Число степеней свободы f это число
независимых переменных в выборочной совокупности за вычетом числа связей между
ними, таким образом, в формуле f=n-1, так как рассматривается рассеяние данных
относительно среднего, то есть на результаты наложена одна связь.
) Рассчитаем дисперсию:
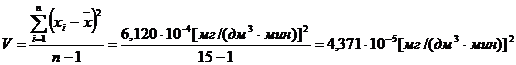
Стандартное отклонение представляет
собой квадратный корень из дисперсии, взятый с положительным знаком, и имеет
размерность измеряемой величины
) Рассчитаем стандартное отклонение:
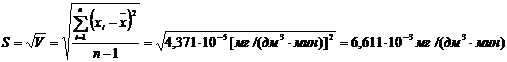
) Стандартное отклонение в процентах
находим относительно среднего значения:
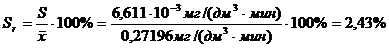
Также при обработки данных
необходимо определить интервал, в котором при заданной вероятности (и при
отсутствии систематических погрешностей) лежит истинное значение. Доверительный
интервал находиться по формуле:
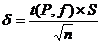 , где f=n-1=15-1=14
, где f=n-1=15-1=14
Р - это вероятность попадания внутрь
рассматриваемого интервала.
Доверительный интервал характеризует
воспроизводимость и в определенной степени правильность результатов химического
анализа.
) Найдем доверительный интервал:
Коэффициент Стьюдента t(0,95;14)=2,15
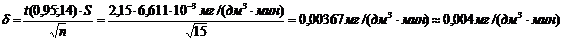
Среднее значение 0,272±0,004 мг/(дм3∙мин)
В таблице П2 приведен расчет
операционной стабильности в программе Excel.
Таблица П2 - Расчет операционной
стабильности в программе Excel
|
Определяемая
величина
|
Название
функции в среде Excel
|
Значение
|
|
Среднее
значение
|
СРЗНАЧ
|
0,27196
|
|
Дисперсия
|
ДИСП
|
7,3687E-05
|
|
стандартное
отклонение
|
СТАНДОТКЛОН
|
6,61E-03
|
|
доверительный
интервал
|
ДОВЕРИТ
|
0,003
|
Таким образом, среднее значение составило
0,272±0,004 мг/(дм3∙мин)
Расчет операционной стабильности
ОЕСD-синтетических сточных вод
Экспериментальные данные - ответ сенсора мг/(дм3∙мин)
на основе дрожжевого штамма Debaryamyces hansenii Y-2482 на добавление 100 мкл
раствора ОЕСD - синтетических сточных вод (Концентрация в кювете 32,2 мг/дм3)
на протяжении 15 измерений - приведены таблице П3.
Таблица П3 - Экспериментальные данные и расчет
отклонения и квадрата отклонения от среднего
|
номер
измерения
|
Ответ
сенсора, мг/дм3∙мин)
|
Отклонение
от среднего, d мг/(дм3∙мин)
|
d2,
[мг/(дм3*мин)]2
|
|
1
|
0,1914
|
7,08×10-03
|
5,013×10-06
|
|
2
|
0,2034
|
4,92×10-03
|
2,421×10-05
|
|
3
|
0,201
|
2,52×10-03
|
6,350×10-06
|
|
4
|
0,1926
|
5,88×10-03
|
3,457×10-05
|
|
5
|
0,1986
|
1,2×10-04
|
1,44×10-08
|
|
6
|
0,195
|
3,48×10-03
|
1,211×10-05
|
|
7
|
0,2028
|
4,32×10-03
|
1,866×10-05
|
|
8
|
0,192
|
6,48×10-03
|
4,199×10-05
|
|
9
|
0,1992
|
7,2×10-04
|
5,184×10-07
|
|
10
|
0,1962
|
2,28×10-03
|
5,198×10-06
|
|
11
|
0,2028
|
4,32×10-03
|
1,866×10-05
|
|
12
|
0,2088
|
1,032×10-02
|
1,065×10-04
|
|
13
|
0,1998
|
1,32×10-03
|
1,742×10-06
|
|
14
|
0,1908
|
7,68×10-03
|
5,898×10-05
|
|
15
|
0,2028
|
4,32×10-03
|
1,866×10-06
|
Прежде чем обрабатывать данные с применением
методов математической статистики, необходимо выявить промахи и исключить их из
числа рассматриваемых результатов выборочной совокупности.
) Выявление грубой погрешности по Q-критерию.
Упорядочим серию данных в порядке возрастания
мг/(дм3∙мин): 0,1908 0,1914 0,192 0,1926 0,195 0,1962 0,1986 0,1992
0,1998 0,201 0,0,2028 0,2028 0,2028 0,2034 0,2088
Проверяем значение 0,1908 , для этого найдем
размах варьирования (диапазон выборки) W0, используя формулу:


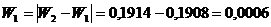
Тестовая статистки рассчитывается по
формуле:
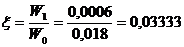
Критической величиной является табличное
значение Q(P,n)=0,41.
Так как  , то промаха
нет, данное значение принадлежит выборке.
, то промаха
нет, данное значение принадлежит выборке.
Аналогично проверяется значение 0,2802

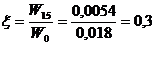
Так как 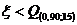 , то промаха
нет, значение 0,2802 принадлежит выборке.
, то промаха
нет, значение 0,2802 принадлежит выборке.
Чтобы оценить случайные погрешности
анализа рассчитаем среднее значение и характеризующие воспроизводимость
дисперсию, стандартное отклонение и отностительное стандартное отклонение.
)Расчет среднего значения:
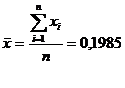 мг/(дм3∙мин)
мг/(дм3∙мин)
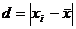 - отклонение от среднего
- отклонение от среднего
Дисперсия и стандартное отклонение
характеризуют рассеяние результатов относительно среднего. Дисперсию выборки
(V) вычисляют по формуле:
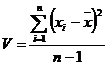
Число степеней свободы f это число
независимых переменных в выборочной совокупности за вычетом числа связей между
ними, таким образом, в формуле f=n-1, так как рассматривается рассеяние данных
относительно среднего, то есть на результаты наложена одна связь.
) Рассчитаем дисперсию:
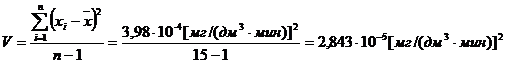
Стандартное отклонение представляет
собой квадратный корень из дисперсии, взятый с положительным знаком, и имеет
размерность измеряемой величины
) Рассчитаем стандартное отклонение:
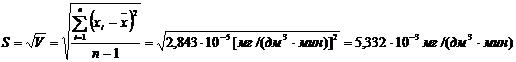
) Стандартное отклонение в процентах
находим относительно среднего значения:
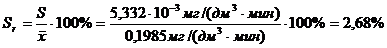
Также при обработки данных
необходимо определить интервал, в котором при заданной вероятности (и при
отсутствии систематических погрешностей) лежит истинное значение. Доверительный
интервал находиться по формуле:
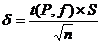 , где f=n-1=15-1=14
, где f=n-1=15-1=14
Р - это вероятность попадания внутрь
рассматриваемого интервала.
Доверительный интервал характеризует
воспроизводимость и в определенной степени правильность результатов химического
анализа.
) Найдем доверительный интервал:
Коэффициент Стьюдента
t(0,95;14)=2,15
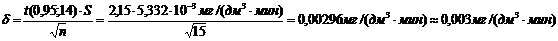
Среднее значение 0,198±0,003 мг/(дм3∙мин)
В таблице П4 приведен расчет операционной
стабильности в программе Excel.
Таблица П4 - Расчет операционной стабильности в
программе Excel
|
Определяемая
величина
|
Название
функции в среде Excel
|
Значение
|
|
Среднее
значение
|
СРЗНАЧ
|
0,19848
|
|
Дисперсия
|
ДИСП
|
2,84503E-05
|
|
стандартное
отклонение
|
СТАНДОТКЛОН
|
0,005334
|
|
доверительный
интервал
|
ДОВЕРИТ
|
0,003
|
Таким образом, среднее значение составило
0,198±0,003 мг/(дм3∙мин)
Приложение 2
Расчет параметров зависимости ответа биосенсора
от ГГС
Расчет из программе Sigma Plot.: Hyperbola;
Single Rectangular, 2 Parameter
=a*x/(b+x)
Results for the Overall Best-Fit
Solution:
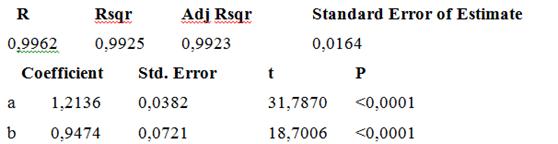
Доверительный интервал для коэфициентов а и b
рассчитывали по формуле:
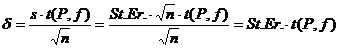
где s - стандартное отклонение;
t(P,f) - коэффициент Стюдента; Р=0,95 - доверительная вероятность; f - число
степеней свободы; n - число измерений; St.Er. - стандартная ошибка,
определяемая отношением стандартного отклонения к 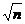 .
Cтандартной ошибки, рассчитанная в программе SigmaPlot, обозначается - Std.
Error.
.
Cтандартной ошибки, рассчитанная в программе SigmaPlot, обозначается - Std.
Error.
При n=24 t(0,95;22)=2,10
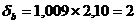
Таким образом, a ± Δa
= 2,37 ± 0,06± Δb = 44 ± 2
Расчет параметров уравнения прямой в программе
Sigma Plot : Polynomial; Linear
= y0+a*x
Results for the Overall Best-Fit
Solution:

Рассчитаем доверительные интервалы для а и b
(при P=0,95; f=n-2=11-2=9)=2,26
Δa = 0,0035×2,26= 0,00791≈0,008
Δb = 0,0103×2,26=0,023278≈0,02
a = a ± Δa = 0,031 ± 0,008= b ± Δb = 0,13
± 0,04
Расчет параметров уравнения линейного участка в
ручную
Зависимость аналитического сигнала (y), в данном
случае ответ сенсера в мг/(мин∙дм3), от концентрации (х) в мг/дм3, можно
выразить линейным уравнением:
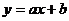
Коэффициенты a и b можно найти методом наименьших
квадратов. Для их вычисления используют следующие формулы:
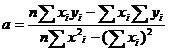
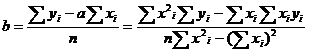
Экспериментальные данные:
|
Концентрация
ГГС, мг/дм3
|
0,4999
|
0,9997
|
2,9970
|
4,992
|
6,984
|
9,967
|
|
Ответ
биосенсора, мг/(мин×дм3)
|
0,09447
|
0,1345
|
0,2125
|
0,2694
|
0,3627
|
0,4568
|
|
Концентрация
ГГС, мг/дм3
|
14,93
|
19,87
|
24,79
|
29,70
|
34,61
|
|
|
Ответ
биосенсора, мг/(мин×дм3)
|
0,5970
|
0,7830
|
0,9377
|
1,027
|
1,117
|
|
Расчет сумм:
|
xi
|
xi2
|
yi
|
yi2
|
xiyi
|
|
0,499917
|
0,249917
|
0,094467
|
0,008924
|
0,047225
|
|
0,999667
|
0,999334
|
0,134467
|
0,018081
|
0,134422
|
|
2,997003
|
8,982027
|
0,212467
|
0,045142
|
0,636763
|
|
4,991681
|
24,91687
|
0,2694
|
0,072576
|
1,344759
|
|
6,983705
|
48,77213
|
0,362667
|
0,131527
|
2,532757
|
|
9,966777
|
99,33665
|
0,456833
|
0,208697
|
4,553156
|
|
14,9253
|
222,7646
|
0,597033
|
0,356449
|
8,910902
|
|
19,86755
|
394,7195
|
0,783033
|
0,613141
|
15,55695
|
|
24,79338
|
614,7117
|
0,937667
|
0,879219
|
23,24793
|
|
29,70297
|
882,2664
|
1,027
|
1,054729
|
30,50495
|
|
34,59638
|
1196,909
|
1,117
|
1,247689
|
38,64415
|
|
∑xi
|
∑xi2
|
∑yi
|
∑yi2
|
∑xiyi
|
|
150,3243
|
3494,628
|
5,992033
|
4,636174
|
126,114
|
Таким образом,
∑xi = 150,3243
∑xi2 = 3494,628
∑yi = 5,992033
∑yi2 = 4,636174
∑xiyi = 126,114=11
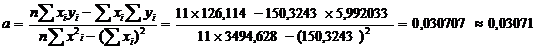
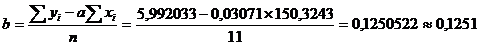 =0,03071x+0,1251 - линейное
уравнение калибровочной прямой
=0,03071x+0,1251 - линейное
уравнение калибровочной прямой
Рассчитаем доверительные интервалы
для параметров а и b градуировочного графика. Дисперсия, характеризующая
рассеяние экспериментальных значений у для n образцов сравнения относительно
рассчитанной прямой y = ax + b, определяется выражением:
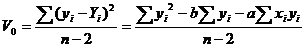
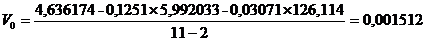
Дисперсии параметров а и b равны:
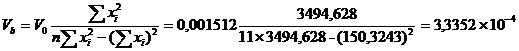
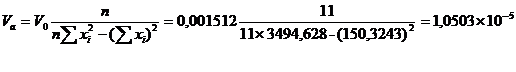
Из дисперсии рассчитываем
стандартные отклонения:
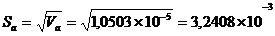
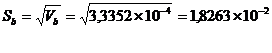
Рассчитаем доверительные интервалы для а и b:
Δa = Satpf
Δb = Sbtpf
где P=0,95; f=n-2=11-2=9=2,26
Δa = 0,0033352×2,26= 0,007538≈0,008
Δb = 0,018263×2,26=0,04127≈0,04
a = a ± Δa = 0,031 ± 0,008= b ± Δb = 0,13
± 0,04
Рассчитаем коэффициент корреляции:
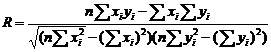
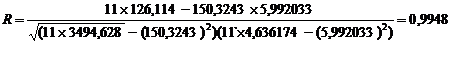
Приложение 3
Расчет предела обнаружения и нижней границы
определяемых содержаний
Минимальный предел обнаружения при доверительной
вероятности Р = 0,95 можно рассчитать по следующей формуле:
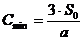 , где
, где
- стандартное отклонение холостого
опыта, а - коэффициент чувствительности
Экспериментальные данные холостого
опыта биосенсора на основе иммобилизованных клеток Debaryamyces hansenii в
пленку из сополимера ПВС с ПВП.
|
Номер
опыта
|
Ответ
сенсора, мг/(мин∙дм3)
|
|
1
|
0,0288
|
|
2
|
0,02634
|
|
3
|
0,03222
|
|
4
|
0,02742
|
|
5
|
0,03144
|
|
6
|
0,02622
|
|
7
|
0,0321
|
Найдем среднее значение по формуле:
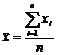
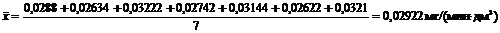
Рассчитаем отклонение от среднего:
|
|xi-x|,
мг/(мин∙дм3)
|
|xi-x|2,
[мг/(мин∙дм3)]2
|
|
0,00042
|
1,764×10-07
|
|
0,00288
|
8,294×10-06
|
|
0,003
|
9,0×10-06
|
|
0,0018
|
3,24×10-06
|
|
0,00222
|
4,928×10-06
|
|
0,003
|
9,0×10-06
|
|
0,00288
|
8,294×10-06
|
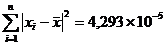 [мг/(мин∙дм3)]2
[мг/(мин∙дм3)]2
Рассчитаем дисперсию:
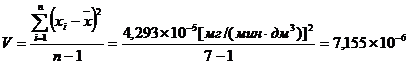 [мг/(мин∙дм3)]2
[мг/(мин∙дм3)]2
Рассчитаем стандартное отклонение:
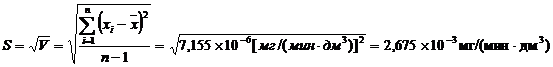
Далее рассчитаем минимальный предел
обнаружения по ГГС:
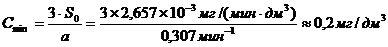
Рассчитываем минимальный предел
обнаружения по ОЕСD:
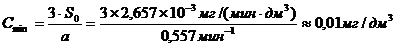
Величина предела обнаружения имеет
одну и ту же размерность - концентрации - независимо от природы аналитического
сигнала.
Нижняя граница определяемых
содержаний Сн для ГГС
Экспериментальные данные, обработанные
в среде Excel.
|
БПК
мгО₂/дм³(ГГС)
|
Ответ
биосенсора y, мг/(мин×дм3)
|
среднее
значение ответа биосенсора ӯ, мг/(мин×дм3)
|
стандартное
отклонение относительно среднего S(y), мг/(мин×дм3
|
Доверительный
интервал при Р=95%, δy
|
|
0,3434428
|
0,0946
|
0,0922
|
0,0966
|
0,094467
|
0,002203
|
0,002493
|
|
0,6867711
|
0,13
|
0,1378
|
0,1356
|
0,134467
|
0,004022
|
0,004551
|
|
2,0589411
|
0,2036
|
0,214
|
0,2198
|
0,212467
|
0,008208
|
0,009288
|
|
3,4292845
|
0,2608
|
0,2696
|
0,2778
|
0,2694
|
0,008502
|
0,00962
|
|
4,7978051
|
0,3516
|
0,3619
|
0,3745
|
0,362667
|
0,011469
|
0,012978
|
|
6,8471761
|
0,464
|
0,4556
|
0,4509
|
0,456833
|
0,006637
|
0,00751
|
|
10,253681
|
0,6078
|
0,5847
|
0,5986
|
0,597033
|
0,011629
|
0,01316
|
|
13,649007
|
0,7745
|
0,7831
|
0,7915
|
0,783033
|
0,0085
|
0,009619
|
|
17,033052
|
0,9389
|
0,9274
|
0,9467
|
0,937667
|
0,009709
|
0,010986
|
|
20,40594
|
1,023
|
1,01
|
1,048
|
1,027
|
0,019313
|
0,021855
|
|
23,76771
|
1,104
|
1,123
|
1,124
|
1,117
|
0,011269
|
0,012752
|
Для каждой концентрации ГГС определили
стандартное отклонение относительно концентрации S(БПК) и относительные
стандартные отклонения относительно концентрации Sr(БПК)по формулам:
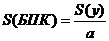 ,
,
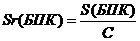
Результаты вычисления:
|
S(БПК),
мг/дм3
|
Sr(БПК)
|
|
0,049285
|
0,143502
|
|
0,089969
|
0,131003
|
|
0,183627
|
0,089185
|
|
0,190196
|
0,055462
|
|
0,256582
|
0,053479
|
|
0,148468
|
0,021683
|
|
0,260166
|
0,025373
|
|
0,190161
|
0,013932
|
|
0,217202
|
0,012752
|
|
0,432063
|
0,021173
|
|
0,252112
|
По полученным данным построили экспериментальную
зависимость относительного стандартного отклонения от концентрации,
аппроксимировали степенной функцией, имеющее уравнение(БПК)=0,1007×БПК-0,64
Используя это уравнение найдем концентрацию,
начиная с которой величины Sr(БПК) становятся меньше, чем заданное предельное
значение Sr(БПК)max = 0,33.(Sr(БПК)max) = lg(0,1007) - 0,64×lg(Cн)
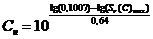
микробный биосенсор
клетка окисляемость
Сн=0,157 мг/дм3
Нижняя граница определяемых
содержаний Сн для ОЕСD-синтетических сточных вод
Экспериментальные данные,
обработанные в среде Excel.
|
БПК
мгО₂/дм³(ГГС)
|
Ответ
биосенсора y, мг/(мин×дм3)
|
среднее
значение ответа биосенсора ӯ, мг/(мин×дм3)
|
стандартное
отклонение относительно среднего S(y), мг/(мин×дм3
|
Доверительный
интервал при Р=95%, δy
|
|
0,066225
|
0,054
|
0,0551
|
0,0529
|
0,054
|
0,0011
|
0,001245
|
|
0,115321
|
0,072
|
0,0701
|
0,06847
|
0,07019
|
0,001767
|
0,001999
|
|
0,163934
|
0,12822
|
0,1345
|
0,1176
|
0,126773
|
0,008542
|
0,009666
|
|
0,243902
|
0,16206
|
0,1745
|
0,1549
|
0,16382
|
0,009918
|
0,011223
|
|
0,322581
|
0,216
|
0,2259
|
0,2005
|
0,214133
|
0,012802
|
0,014487
|
|
0,4
|
0,264
|
0,2509
|
0,2711
|
0,262
|
0,010247
|
0,011596
|
|
0,47619
|
0,306
|
0,3146
|
0,3105
|
0,310367
|
0,004302
|
0,004868
|
|
0,551181
|
0,354
|
0,3604
|
0,3493
|
0,354567
|
0,005572
|
0,006305
|
|
0,625
|
0,40284
|
0,4107
|
0,3918
|
0,40178
|
0,009494
|
0,010744
|
|
0,697674
|
0,4218
|
0,4374
|
0,4297
|
0,429633
|
0,0078
|
0,008827
|
|
0,769231
|
0,4566
|
0,4583
|
0,4516
|
0,4555
|
0,003483
|
0,003941
|
|
0,839695
|
0,4848
|
0,4798
|
0,4809
|
0,481833
|
0,002627
|
0,002973
|
|
0,909091
|
0,5052
|
0,5057
|
0,5143
|
0,5084
|
0,005116
|
0,005789
|
|
|
|
|
|
|
|
|
|
Для каждой концентрации ГГС определили
стандартное отклонение относительно концентрации S(БПК) и относительные
стандартные отклонения относительно концентрации Sr(БПК)по формулам:
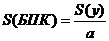 ,
,
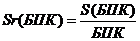
Результаты вычисления:
|
S(БПК),
мг/дм3
|
Sr(БПК)
|
|
0,001975
|
0,1756
|
|
0,003172
|
0,1109
|
|
0,015339
|
0,093569
|
|
0,017809
|
0,073017
|
|
0,022989
|
0,071265
|
|
0,018401
|
0,046002
|
|
0,007724
|
0,016221
|
|
0,010005
|
0,018152
|
|
0,017049
|
0,027278
|
|
0,014006
|
0,020076
|
|
0,006254
|
0,00813
|
|
0,004718
|
0,005619
|
|
0,009186
|
0,010105
|
По полученным данным построили экспериментальную
зависимость относительного стандартного отклонения от концентрации,
аппроксимировали степенной функцией, имеющее уравнение
(БПК)=0,0093×С-1,2185
Используя это уравнение найдем концентрацию,
начиная с которой величины Sr(БПК) становятся меньше, чем заданное предельное
значение Sr(БПК)max = 0,33.
(Sr(БПК)max) = lg(0,0093) - 1,2185×lg(Cн)
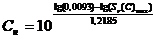
Сн= 0,053мг/дм3