Дезинфекция и стерилизация
ВВЕДЕНИЕ
В последние годы разработке современных методов
стерилизации и дезинфекции в практическом здравоохранении посвящено большое
количество работ, однако эта проблема остается крайне актуальной. Чрезвычайно
важно значение для биологической безопасности в лаборатории имеют базовые
знания деконтаминации.
Ни одна биологическая отрасль деятельности
немыслима без особого гигиенического режима, который обеспечивал бы
относительную чистоту помещений, связанных с работой ее специалистов,
оборудования. Комплекс мероприятий по предотвращению распространения инфекций,
включающий стерилизацию и дезинфекцию, является общим для всех действующих
лабораторий. Его цель - обрыв путей передачи, опосредованных оборудованием и
действиями работников, и снижение риска передачи инфекционных заболеваний.
Лабораторные специалисты постоянно сталкиваются
с необходимостью выбора того или иного метода деконтаминации. В некоторых
случаях трудно выбрать уровень дезинфекции или провести грань последней со
стерилизацией. Это возможно лишь при тщательном анализе категорий риска, а
также при оценке характера микробного агента.
В связи с тем, что сильно загрязненные предметы
не могут быть быстро дезинфицированы или стерилизованы, также важно знать
основные принципы предварительной чистки.
Таким образом, дезинфекция, стерилизация и
предварительная очистка лабораторных помещений, оборудования и инвентаря
являются важнейшим комплексом мер, препятствующих возникновению и
распространению патогенных микроорганизмов.
Исходя из вышеизложенного, целью нашей курсовой
работы являлось изучение основных правил и методов процесса деконтаминации.
В данной работе были поставлены следующие
задачи:
Изучить основные методы и положения процесса
деконтаминации;
Рассмотреть детально процесс дезинфекции;
Изучить основные правила и методы, используемые
в стерилизации.
ГЛАВА 1. ДЕКОНТАМИНАЦИЯ
Процесс уничтожения микробов в каких-либо
объектах получил название деконтаминации, то есть удаления микробов. Для
осуществления этого процесса разработаны и применяются разнообразные методы
стерилизации и дезинфекции.
Стерилизация-это уничтожение всех форм жизни в
веществе и на поверхности стерилизуемого объекта. По определению академика
РАМН, профессора Воробьева, «стерилизация - полное обеспложивание объектов, при
котором уничтожаются все формы микроорганизмов» (Кулешова, Л.И. 2005).
Составной частью деконтаминантных мероприятий
также является дезинфекция.
Дезинфекция-это комплекс мер, направленных на
уничтожение патогенных микробов (т.е. возбудителей инфекционных болезней) и
резкое снижение общей микробной обсемененности материала или объекта.
Разумеется, дезинфекция может проводиться в отношении различных объектов в
окружающей человека среде.
Конкретные требования в отношении деконтаминации
зависят от вида экспериментальной работы и характера используемого
инфекционного агента или агентов. Общую информацию можно использовать для
разработки как стандартных, так и более специфических процедур, предназначенных
для устранения биологических опасностей, имеющихся в каждой конкретной
лаборатории. Время контакта с дезинфицирующим средством зависит от материала и
завода-изготовителя, поэтому все рекомендации в отношении использования
дезинфицирующих средств должны соответствовать спецификациям
заводов-изготовителей (Перфильева, Г.М. 2010).
Предварительная очистка
Процесс очистки - это удаление грязи,
органических веществ и пятен. Очистка может производиться с помощью щетки,
пылесоса, сухой протирки, мойки, влажной протирки с водой, содержащей мыло или
моющее средство. Грязь, почва и органические вещества могут предохранять
микроорганизмы и препятствовать воздействию деконтаминирующих средств
(антисептиков, химических гермицидов и дезинфицирующих средств).
Предварительная чистка имеет большое значение для обеспечения надлежащей дезинфекции
или стерилизации. Многие гермицидные препараты являются активными только в
отношении предметов, прошедших предварительную чистку. Такую предварительную
чистку следует проводить с осторожностью, чтобы не подвергнуться воздействию
инфекционных агентов. Впоследствии следует применять материалы, которые
являются химически совместимыми с гермицидами. Чаще всего один и тот же
химический гермицид используется как для предварительной чистки, так и для
дезинфекции (Новикова, И.А. 2013).
Местная деконтаминация окружающей среды
Деконтаминация лабораторных помещений, мебели и
оборудования требует сочетания жидких и газообразных дезинфицирующих средств.
Поверхности могут быть деконтаминированы с помощью раствора гипохлорита натрия
(NaOCl); для обеспечения общих санитарно-гигиенических условий может подойти
раствор, содержащий 1 г/л активного хлора, но для ситуаций, сопряженных с
высоким риском, рекомендуются более концентрированные растворы (5 г/л). Для
деконтаминации окружающей среды готовые растворы, содержащие 3 % перекиси
водорода (H2O2), могут вполне заменить растворы гипохлорита натрия (Мейнелл,
Дж. 1967).
Помещения и оборудование можно деконтаминировать
с помощью фумигации газообразным параформальдегидом или кипящим формалином. Это
очень опасная процедура и ее должен проводить специально обученный персонал. До
обработки газом все двери, окна и т.п. должны быть герметизированы с помощью
липкой ленты или иного материала. Фумигация должна проводиться при температуре
окружающей среды не менее 21 °C и относительной влажности воздуха 70%
(Скорикова, Л.А. 2002).
После фумигации, прежде чем разрешить вход
персоналу, помещение следует хорошо проветрить. До проветривания входить в
помещение можно только в соответствующем респираторе. Для нейтрализации
формальдегида можно использовать газообразный гидрокарбонат аммония.
Фумигация небольших пространств парами перекиси
водорода также может быть эффективной, но для получения паров требуется
специальное оборудование (Воробьев, А.А. 2004).
Деконтаминация боксов биологической безопасности
Для деконтаминации боксов биологической
безопасности классов I и II существует оборудование, которое автоматически
производит, обеспечивает циркуляцию и нейтрализует газообразный формальдегид. В
качестве альтернативы можно использовать соответствующее количество
параформальдегида (конечная концентрация в воздухе -0,8%), которое следует
подогреть в сковороде на электрической плитке. Другую сковороду, содержащую
гидрокарбонат аммония в количестве, на 10% превышающем количество
параформальдегида, следует также поместить на второй электрической плитке в
бокс. Электрические плитки должны подключаться снаружи бокса, с тем, чтобы
можно было контролировать операцию, включая и выключая плитки по мере
необходимости. Если относительная влажность воздуха ниже 70%, то внутрь бокса,
до герметичного заклеивания клейкой лентой передней дверки, следует поместить
емкость с горячей водой. Для того чтобы газ не мог попасть в помещение,
переднюю открытую часть и выпускное отверстие следует закрыть плотной
пластиковой пленкой. Место прохождения электрошнуров также следует
герметизировать с помощью клейкой ленты. Затем включают в сеть электроплитку с
параформальдегидом. Ее следует выключить из сети после испарения всего
параформальдегида. Бокс оставляют закрытым, по меньшей мере, на 6 часов. Затем
включают в сеть электроплитку со второй сковородой, чтобы испарить
гидрокарбонат аммония, после чего плитку выключают и включают вытяжку бокса с
двумя интервалами около 2 сек. с целью обеспечить циркуляцию гидрокарбоната
аммония. Бокс следует оставить закрытым на 30 минут, после чего можно открыть
переднюю дверку (или снять пластиковую пленку). Перед использованием
поверхности бокса следует протереть с целью удаления остаточного материала
(Обуховец, Т.П. 2006).
Деконтаминация рук
По возможности, при работе с биологически
опасными материалами следует надевать подходящие перчатки, но это не исключает
необходимости регулярного и правильного мытья рук. Руки следует мыть после
работы с биологически опасными материалами и животными, а также перед выходом
из лаборатории. В большинстве случаев тщательного мытья рук водой с обычным
мылом достаточно для их деконтаминации, однако в ситуациях высокого риска
рекомендуется использовать гермицидное мыло. Следует тщательно мылить руки
мылом в течение не менее 10 сек., сполоснуть чистой водой и высушить с помощью
чистого бумажного или тканевого полотенца (при наличии, можно использовать
сушилки для рук теплым воздухом (Практическое руководство 2004).
Рекомендуется использовать краны, включающиеся
ногой или предплечьем. Если они отсутствуют, то для включения крана следует
использовать бумажные/тканевые полотенца, чтобы предотвратить повторную
контаминацию вымытых рук.
Как указано выше, если отсутствует возможность
надлежащим образом вымыть руки, для деконтаминации незначительно загрязненных
рук их можно протереть средствами, содержащими спирт (Царев, В.Н. 2010).
Сжигание
Сжигание является полезным методом уничтожения
останков животных, а также анатомических и других отходов с предварительной
деконтаминацией или без нее. Сжигание является альтернативой автоклавированию
только в том случае, если мусоросжигатель находится под контролем лаборатории.
Правильное сжигание предполагает необходимость
эффективных средств контроля температуры и камеры вторичного сжигания. Многие
мусоросжигатели, особенно имеющие только одну камеру сжигания, не подходят для
работы с инфекционными материалами, останками животных и предметами из
пластмассы. Такие материалы уничтожаются не полностью, в результате чего с
исходящим потоком может происходить загрязнение атмосферы микроорганизмами,
токсичными химическими веществами и дымом. Тем не менее, существует много
конструкций камер сжигания. В идеале, температура в первичной камере должна
быть не менее 800 °C, а во вторичной камере - не менее 1000 °C (Герхардт, Ф.
1984).
Материалы для сжигания, даже если они прошли
предварительную деконтаминацию, должны переноситься в мусоросжигатель в мешках,
желательно в пластиковых. Сотрудники, работающие с мусоросжигателем, должны
быть надлежащим образом проинструктированы относительно загрузки и контроля
температуры. Следует также отметить, что эффективное функционирование
мусоросжигателя в значительной степени зависит от правильного сочетания
сжигаемых материалов.
В настоящее время многие обеспокоены тем, что
существующие и проектируемые мусоросжигатели могут оказывать отрицательное
воздействие на окружающую среду, поэтому сейчас проводится работа по улучшению
экологических характеристик мусоросжигателей и повышению их эффективности с
точки зрения затрат энергии (Мороз, Б.Т. 2008).
Удаление отходов
Удаление лабораторных и медицинских отходов
регулируется различными региональными, национальными и международными нормами,
поэтому до разработки и осуществления программы по обработке, транспортировке и
удалению биологически опасных отходов, следует ознакомиться с самыми последними
изданиями документов по этому вопросу. Как правило, с золой, образующейся в
мусоросжигателе после сжигания отходов, можно обращаться как с обычными
бытовыми отходами и вывозить силами местных служб. Автоклавированные отходы
можно сжигать во внешних мусоросжигателях или вывозить на мусорные свалки
(Венцель, Р. 2003).
Химические гермициды
Многие виды химических веществ могут
использоваться в качестве дезинфицирующих и/или антисептических средств.
Поскольку количество и разнообразие коммерческих препаратов постоянно
возрастает, следует тщательно подбирать состав для конкретных нужд.
Гермицидная активность многих химических веществ
увеличивается и быстрее проявляется при более высоких температурах. Но в то же
время более высокие температуры могут ускорить их испарение и разрушение.
Особая осторожность необходима при использовании и хранении таких химических
веществ в тропических районах, где срок их годности может быть меньшим из-за
высоких температур внешней среды (Кулешова , Л.И. 2005).
Многие гермициды могут быть вредными для
человека или окружающей среды. Их следует отбирать, хранить, использовать и
удалять, применяя меры предосторожности в соответствии с инструкциями завода-изготовителя.
Для обеспечения личной безопасности при подготовке растворов химических
гермицидов рекомендуется надевать перчатки и передники и защищать глаза.
Для регулярной чистки полов, стен, оборудования
и мебели обычно нет необходимости применять химические гермициды. Однако в
некоторых случаях для борьбы со вспышками их использование может быть
целесообразным (Новикова, И.А. 2013).
Правильное использование химических гермицидов
способствует безопасности на рабочем месте и снижает риск, сопряженный с
инфекционными агентами. По экономическим причинам, а также для облегчения
контроля запасов и уменьшения загрязнения окружающей среды количество
используемых химических гермицидов следует ограничивать в максимально возможной
степени.
Ниже приводятся широко используемые классы
химических гермицидов наряд с общей информацией об их применении и мерах
безопасности. Если не указано иное, концентрации гермицидов даются в виде
соотношения веса к объему. В таблице 1 кратко приведены рекомендованные
концентрации хлорсодержащих растворов (Перфильева, Г.М. 2010).
Хлор (гипохлорит натрия). Хлор,
быстродействующий окислитель, является легкодоступным химическим гермицидом с
широким спектром действия. Обычно он продается в виде отбеливателя - водного
раствора гипохлорита натрия (NaOCl), который можно разбавлять в воде для
получения различных концентраций активного хлора.
Таблица № 1
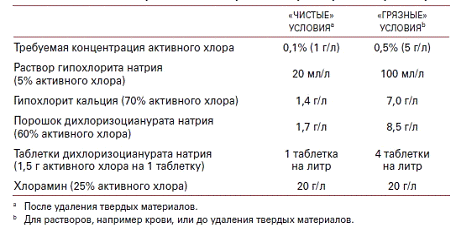
Хлор, особенно в виде отбеливателя, является
сильно щелочным и может вызывать коррозию металлов. Его активность можно сильно
снизить с помощью органического материала (белка). При хранении запасов рабочих
растворов гипохлорита натрия в открытых контейнерах, особенно при высоких
температурах, хлор выделяется в виде газа, что уменьшает гермицидный потенциал
таких растворов. Частота смены растворов гипохлорита натрия зависит от их
начальной концентрации, вида контейнера (с крышкой или без) и его размеров,
частоты и вида использования и окружающих условий. Как правило, растворы, в
которые добавляются материалы с высоким содержанием органических веществ
несколько раз в день, следует менять ежедневно, а менее часто используемые
растворы можно менять раз в неделю (Практическое руководство 2004).
Раствор универсального лабораторного
дезинфицирующего средства для общих целей должен иметь концентрацию 1 г/л
активного хлора. Более высокая концентрация раствора с содержанием 5 г/л
активного хлора, рекомендуется для обработки разлившегося биологически опасного
материала и больших количеств органических веществ. Растворы гипохлорита
натрия, имеющиеся в качестве бытовых отбеливателей, содержат 50 г/л активного
хлора, поэтому для получения концентраций 1 г/л и 5 г/л их следует разбавлять в
соотношении 1:50 или 1:10, соответственно. В случае промышленных растворов
концентрация гипохлорита натрия составляет почти 120 г/л, поэтому для получения
указанных выше уровней их следует разбавлять соответствующим образом (Обуховец,
Т.П. 2006).
Гранулы или таблетки гипохлорита кальция
(Ca(ClO)2) обычно содержат приблизительно 70% активного хлора. Растворы,
полученные при растворении гранул или таблеток, содержащих 1,4 г/л и 7 г/л,
будут содержать 1,0 г/л и 5 г/л активного хлора соответственно.
Отбеливатель не рекомендуется использовать в
качестве антисептического средства, но его можно использовать как
дезинфицирующее средство общего назначения, а также для вымачивания
контаминированных неметаллических материалов. В чрезвычайных ситуациях
гипохлорит натрия можно использовать также для дезинфекции питьевой воды с
конечной концентрацией 1-2 мг/л активного хлора.
Газообразный хлор является высокотоксичным
веществом. Поэтому гипохлорит натрия следует хранить и использовать только в
хорошо вентилируемых помещениях. Кроме того, для предотвращения быстрого
высвобождения газообразного хлора гипохлорит натрия не следует смешивать с
кислотами. Многие побочные продукты хлора могут быть вредными для человека и
окружающей среды, поэтому следует избегать смешанного использования
хлорсодержащих дезинфицирующих средств, особенно гипохлорита натрия (Скорикова,
Л.А. 2002).
Дихлоризоцианурат натрия. Дихлоризоцианурат
натрия (NaDCC) в виде порошка содержит 60% активного хлора. Растворы,
приготовленные из порошкообразного NaDCC в концентрациях 1,7 г/л и 8,5 г/л,
будут содержать, соответственно, 1 г/л и 5 г/л активного хлора. Одна таблетка
NaDCC обычно эквивалентна 1,5 г активного хлора. Растворение одной или четырех
таблеток в одном литре воды дает необходимые концентрации 1 г/л и 5 г/л,
соответственно. NaDCC в виде порошка или таблеток можно легко и безопасным образом
хранить. В твердом виде NaDCC можно применять для обработки пролившейся крови
или других биологически опасных жидкостей и оставлять, по меньшей мере, на 10
минут, прежде чем удалять. Затем можно производить дальнейшую чистку пораженной
зоны (Мейнелл, Дж. 1967).
Хлорамины. Хлорамины имеются в виде порошка,
содержащего приблизительно 25% активного хлора. Хлорамины выделяют хлор
медленнее, чем гипохлориты. Поэтому для обеспечения такой же эффективности,
какую дают гипохлориты, требуются более высокие начальные концентрации. С
другой стороны, растворы хлорамина не дезактивируются органическими веществами
в той же степени, что и растворы гипохлорита, поэтому как для «чистых», так и
для «грязных» условий рекомендуются концентрации 20 г/л.
Растворы хлорамина практически не имеют запаха.
Тем не менее, предметы, замоченные в таких растворах, следует тщательно промыть
и удалить любые остатки наполнителей, добавленных к порошку хлорамина-Т
(тозилхлорамида натрия) (Царев, В.Н. 2010).
Диоксид хлора. Диоксид хлора (ClO2) - это
сильный и быстродействующий гермицид, дезинфицирующее средство и окислитель,
который часто проявляет активность при более низких концентрациях, чем
концентрации, необходимые при использовании гипохлорита натрия. В газообразном
состоянии диоксид хлора является нестойким и быстро разлагается на газообразный
хлор (Cl2) и газообразный кислород (O2) с выделением тепла. Однако диоксид
хлора растворяется в воде и в виде водного раствора является стабильным.
Диоксид хлора можно получить двумя способами: (1) смешать на месте два
компонента - соляную кислоту (HCl) и хлорит натрия (NaClO2); и (2) заказать его
в стабилизированном виде и затем активировать на месте, когда в этом возникнет
необходимость (Герхардт, Ф. 1984).
Из всех биоциодов-окислителей диоксид хлора
является наиболее селективным. Озон и хлор являются гораздо более химически
активными, чем диоксид хлора, и будут расходоваться в результате реакции с
большинством органических соединений. Однако диоксид хлора вступает в реакцию
только с восстановленными соединениями серы, вторичными и третичными аминами, а
также с некоторыми другими в значительной степени восстановленными и сильно
реагирующими органическими соединениями. Поэтому более стабильный остаток можно
получить при использовании диоксида хлора в гораздо меньших дозах, чем при
использовании хлора или озона. В случаях более высокой органической нагрузки
диоксид хлора, при его правильном получении, может быть использован более
эффективно, чем озон или хлор, в связи с его более выраженной селективностью
(Мороз, Б.Т. 2008).
Формальдегид. Формальдегид (HCHO) - это газ,
убивающий все микроорганизмы и споры при температуре выше 20 °C. Однако он не
действует против прионов.
Формальдегид является относительно медленно
действующим веществом и нуждается в относительной влажности воздуха около 70%.
Он продается в виде твердого полимера - параформальдегида, в виде хлопьев или
таблеток или в виде формалина - раствора газа в воде в концентрации
приблизительно 370 г/л (37%), содержащего в качестве стабилизатора метанол (100
мл/г). И в том, и в другом виде его нагревают до образования газа, который
используется для деконтаминации и дезинфекции замкнутых пространств, таких как
боксы безопасности и помещения. Формальдегид (5-процентный раствор в воде)
может использоваться как жидкое дезинфицирующее средство.
Предполагается, что формальдегид является
канцерогенным. Он представляет собой опасный газ раздражающего действия с
острым неприятным запахом, его пары могут раздражать глаза и слизистые
оболочки, поэтому его следует хранить в вытяжном шкафу или в хорошо
вентилируемом помещении. В работе с формальдегидом следует соблюдать
национальные правила химической безопасности (Венцель, Р. 2003).
Глутаральдегид. Подобно формальдегиду,
глутаральдегид (OHC(CH2)3CHO) также действует против вегетативных бактерий,
спор, грибков, а также содержащих и не содержащих липиды вирусов. Он не
вызывает коррозии и действует быстрее, чем формальдегид. Однако для того, чтобы
убить споры бактерий, ему требуется несколько часов.
Глутаральдегид обычно поставляется в виде
раствора в концентрации приблизительно 20 г/л (2%) и в некоторых случаях до
применения его необходимо «активировать» (сделать щелочным) путем добавления
содовых компонентов, которые прилагаются к препарату. Активированный раствор
можно повторно использовать в течение 1-4 недель в зависимости от состава, вида
и частоты его использования. Измерительные стержни, прилагаемые к некоторым
препаратам, дают лишь приблизительную информацию об уровнях активного
глутаральдегида в используемых растворах. При помутнении растворы
глутаральдегида должны быть уничтожены.
Глутаральдегид является токсичным и раздражает
кожу и слизистые оболочки, поэтому следует избегать контактов с ним. Его
следует применять в вытяжном шкафу или в хорошо вентилируемой зоне. Не
рекомендуется использовать его в виде аэрозоля или раствора для деконтаминации
поверхностей в окружающей среде. В работе с глутаральдегидом следует соблюдать
национальные правила химической безопасности (Воробьев, А.А. 2004).
Фенольные соединения. Фенольные соединения -
широкая группа препаратов - относятся к самым ранним гермицидам. Однако в
результате возникшего в последнее время беспокойства по поводу безопасности их
использование является ограниченным. Они действуют против вегетативных форм
бактерий и содержащих липиды вирусов и при правильном приготовлении проявляют
также активность против микобактерий. Они не действуют против спор, а их
действие против нелипидных вирусов носит неоднозначный характер. Многие
фенольные препараты используются для деконтаминации поверхностей в окружающей
среде, а некоторые из них (триклосан и хлороксиленол) являются широко
используемыми антисептиками (Новикова, И.А. 2013).
Триклосан широко применяется для добавления в
продукты, предназначенные для мытья рук. Он действует против вегетативных
бактерий и безопасен для кожи и слизистых оболочек. Однако в ходе лабораторных
исследований было обнаружено, что бактерии, которые стали резистентными к
низким концентрациям триклосана, начинают проявлять резистентность и к
некоторым видам антибиотиков. Значение этого открытия для практической работы
пока не установлено.
Некоторые фенольные соединения чувствительны к
жесткости воды и могут терять активность, поэтому их следует разбавлять
дистиллированной или деионизированной водой.
Фенольные соединения не рекомендуется
использовать для дезинфекции поверхностей, вступающих в контакт с пищевыми
продуктами и в местах нахождения маленьких детей. Они могут абсорбироваться
тканью и резиной и могут также проникать в кожу. В работе с фенольными
соединениями следует соблюдать национальные меры химической безопасности
(Кулешова, Л.И. 2005).
Четвертичные аммониевые соединения. Многие виды
четвертичных аммониевых соединений используются в смесях и часто в сочетании с
другими гермицидами, например, со спиртом. Они обладают хорошей активностью
против некоторых вегетативных бактерий и содержащих липиды вирусов. Некоторые
виды (например, хлорид бензалкона) используются в качестве антисептиков.
Гермицидная активность ряда четвертичных аммониевых
соединений значительно снижается за счет органических веществ, жесткости воды и
анионных моющих средств. Поэтому необходимо обращать внимание на выбор средств
для предварительной чистки, если затем для дезинфекции будут использоваться
четвертичные аммониевые соединения. В растворах четвертичных аммониевых
соединений могут развиваться потенциально вредные бактерии. В связи с медленным
биологическим разложением эти соединения могут также накапливаться в окружающей
среде (Перфильева, Г.М. 2010).
Спирты. Этанол (этиловый спирт, C2H5OH) и
2-пропанол (изопропиловый спирт (CH3)2CHOH) имеют одинаковые дезинфицирующие
свойства. Они действуют против вегетативных бактерий, грибков и содержащих
липиды вирусов, но не против спор. Их действие на нелипидные вирусы носит
неоднозначный характер. Для достижения наибольшей эффективности их следует
разбавлять водой в концентрации приблизительно 70%: большие или меньшие
концентрации могут оказаться не столь гермицидными. Основным преимуществом
водных растворов спирта является то, что они не оставляют осадка на
обработанных предметах.
Поскольку этанол сушит кожу, его часто смешивают
со смягчающими средствами. Протирание рук средствами, содержащими спирт,
рекомендуется для деконтаминации незначительно загрязненных рук в тех случаях,
когда невозможно или неудобно вымыть их надлежащим образом. Однако следует
помнить о том, что этанол не эффективен против спор и не может убивать
нелипидные вирусы всех видов.
Спирт является летучим и легковоспламеняющимся
веществом, поэтому его не следует применять вблизи открытого огня. Рабочие
растворы следует хранить в надлежащих контейнерах, чтобы избежать испарения
спирта. Спирт может вызывать затвердение резины и растворять некоторые виды
клея. Для предотвращения использования этанола в иных целях, помимо
дезинфекции, необходимо наладить его правильный учет и хранение в лаборатории.
На бутылках с растворами, содержащими спирт, должны быть наклеены четкие
этикетки с предупреждением о том, что их нельзя автоклавировать (Мороз, Б.Т.
2008).
Йод и йодофоры. Действие этих дезинфицирующих
средств подобно действию хлора, но они несколько менее ингибируются органическими
веществами. Йод может оставлять пятна на ткани и окружающих поверхностях и
обычно не подходит для использования в качестве дезинфицирующего средства. С
другой стороны, йодофоры и йодные настойки являются хорошими антисептиками.
Поливидониодин является надежным и безопасным чистящим средством в хирургии и
антисептиком для дооперационной обработки кожи. Антисептики, изготовленные на
основе йода, как правило, не подходят для использования на
медицинских/стоматологических инструментах и устройствах. Йод не следует
применять на алюминии или меди.
Йод может быть токсичным. Органические препараты
на основе йода следует хранить при температурах 4-10 °C , чтобы избежать роста
в них потенциально вредных бактерий (Воробьев, А.А. 2004).
Перекись водорода и надкислоты. Подобно хлору,
перекись водорода (H2O2) и надкислоты являются сильными окислителями и могут
быть сильными гермицидами широкого спектра действия. Они также являются более
безопасными, чем хлор, для человека и окружающей среды.
Перекись водорода выпускается либо в готовом для
использования виде (3-процентный раствор), либо в виде 30-процентного водного
раствора, который можно применять после разведения стерилизованной водой в
пропорции 1 часть перекиси на 5-10 частей воды по объему. Однако действие таких
3-6-процентных растворов только перекиси водорода в качестве гермицидов
является медленным и ограниченным. Имеющиеся в настоящее время препараты
содержат другие ингредиенты для стабилизации содержания перекиси водорода,
ускорения его гермицидного действия и снижения его коррозионной активности
(Обуховец, Т.П. 2006).
Перекись водорода может использоваться для
деконтаминации рабочих поверхностей лабораторных столов и боксов
биобезопасности, а более концентрированные растворы могут подходить для дезинфекции
чувствительных к теплу медицинских/стоматологических инструментов и устройств.
Использование паров перекиси водорода или надуксусной кислоты (CH3COOOH) для
деконтаминации чувствительных к теплу медицинских инструментов и устройств
требует специального оборудования.
Перекись водорода и надкислоты могут быть
коррозийными для таких металлов, как алюминий, медь, латунь и цинк, и могут
также обесцвечивать ткани, волосы, кожу и слизистые оболочки. Обработанные ими
предметы следует тщательно промыть до контакта с глазами и слизистыми
оболочками. Их всегда следует хранить вдали от источника тепла и предохранять
от воздействия света (Царев, В.Н. 2010).
ГЛАВА 2. ДЕЗИНФЕКЦИЯ
Задача дезинфекции - предупреждение или
ликвидация процессов накопления, размножения и распространения возбудителей
заболеваний путем их уничтожения или удаления на предметах и объектах, то есть
дезинфекция обеспечивает прерывание путей передачи заразного начала.
Различают профилактическую и очаговую
дезинфекцию.
Профилактическая осуществляется с целью
предупреждения инфекций.
Очаговая инфекция делится на очаговую текущую
дезинфекцию, которая осуществляется в очаге инфекции, проводится многократно, и
очаговую заключительную дезинфекцию, которая проводится однократно с целью
полного освобождения инфекционного очага от возбудителей заболевания.
Различают физические и химические методы
дезинфекции (Мейнелл, Дж. 1967).
Физические методы дезинфекции
Физические методы просты, надежны, являются
экологически чистыми и безопасными для персонала, поэтому, если позволяют
условия, этим методам следует отдавать предпочтение. Их подразделяют на:
Механические (проветривание, влажная уборка,
стирка с моющим средством);
Действие высокой температуры (кипячение,
пастеризация);
УФО (облучение бактерицидными лампами).
В настоящее время наиболее популярны следующие
физические методы:
Кипячение в дистилированной воде используют для
дезинфекции изделий из стекла и металла, термостойких полимеров и резин.
Экспозицию (не менее 30 мин) выдерживают, начиная с момента закипания воды при
полном погружении изделий, а при кипячении в воде с 2 % двууглекислого натрия
(содой) время экспозиции - не менее 15 мин (Практическое руководство 2004).
Пастеризация - это однократное кратковременное
прогревание при температуре ниже 100° С с последующим быстрым охлаждением.
Прогревание проводят при 65-95° С в течение 20-30 минут, что ведет к частичному
обеспложиванию объектов. Как и кипячение, пастеризация не является методом
стерилизации. После пастеризации сохраняются живыми споры и часть вегетативных
форм, поэтому пастеризованный продукт (молоко, соки и т.д.) хранят в
холодильнике.
УФО (облучение бактерицидными лампами) -
используют в медицине для обработки воздуха и поверхностей. Расчет необходимого
количества бактерицидных облучателей и времени экспозиции ведут, исходя из
кубатуры помещения и характера контаминации (Венцель, Р. 2003).
Химические методы дезинфекции
При дезинфекции химическим методом применяют
следующие дезинфицирующие средства:
Хлорсодержащие препараты (хлорная известь,
хлорамин Б, гипохлорит кальция, гипохлорит натрия, получаемый электрохимическим
путем);
Окислители (перекись водорода с моющим средством
и без него, перманганат калия);
Фенолы (карболовая кислота, лизол);
Йод и йодофоры (йод+поверхностно-активные вещества);
Соли тяжелых металлов (сулема, диоцид,
мертиолят);
Пав (сульфанол);
Четвертично-аммониевые соединения (мирамистин,
роккал, бензалкония хлорид и др.);
Спирт;
Формальдегид;
) Красители (бриллиантовый зеленый, метиленовый
синий);
Кислоты (салициловая, борная и т.д.);
Альдегиды (глутаровый); (Герхардт, Ф. 1984).
Комбинированные методы дезинфекции
При комбинированном методе дезинфекция
осуществляется в специальных дезинфекционных камерах.
Паровоздушный- увлажненным воздухом при
температуре дезинфекции t-110° С, давлении 0,5 атм., экспозиции 20 минут;
пароформалиновый: в режиме 0,5 атм., t- 90° С, экспозиция 30 минут.
Сущность камерной дезинфекции заключается в
прогревании содержимого камер горячим воздухом (паром) до определенной
температуры и при избыточном давлении, а при необходимости усиления воздействия
пара-в дополнительном введении в камеру формальдегида (формалина) (Обуховец,
Т.П. 2006).
Контроль эффективности дезинфекции
Для контроля работы дезинфекционных камер
используют эталонные культуры, например стафилококк - при дезинфекции вещей из
очагов инфекций, вызванных неспорообразующими микроорганизмами. Споры
антракоидной палочки - при дезинфекции вещей из очагов инфекций, вызванных
спорообразующими микробами. О качестве изделий судят по отсутствию после
обработки золотистого стафилококка (S. aureus), синегнойной палочки
(P.aeruglnosa) и бактерий группы кишечной палочки. Для этого методом смывов
исследуют 1 % (не менее 3-5 единиц) одновременно обработанных изделий одного
наименования. По 0,1 мл смывов, взятых марлевыми салфетками (5*5 см), наносят
на поверхность желточно-солевого, кровяного агаров и среды Эндо и инкубируют
засеянные чашки при 37 С. Дезинфекцию считают эффективной, если через 48 часов
на чашках не вырастают колонии указанных микроорганизмов.
Правила пользования дезинфекционными средствами
Четко следовать методическим указаниям по
применению препарата
Перед дезинфекционным мероприятием, где
возможно, удалить мусор
Для приготовления раствора использовать чистую,
сухую емкость
Правильно отмерять количество дезсредства
Разводить дезсредство в нужном количестве воды,
добавляя дезсредство в воду
Пользоваться дезсредством только по назначению
Не хранить в дезсредствах инструменты и
приспособления для чистки
Не добавлять дезсредство в старый раствор
(Скорикова, Л.А. 2002).
ГЛАВА 3. СТЕРИЛИЗАЦИЯ
Стерилизация - полное обеспложивание объектов,
при котором уничтожаются все формы микроорганизмов (вегетативные формы, споры и
вирусы). Для стерилизации применяются физические и химические методы. Выбор
метода определяется видом стерилизуемого материала, который после стерилизации
должен сохранить свои основные свойства (форму, эластичность, активность и
др.).
Методы стерилизации
Физические методы стерилизации включают действие
высокой температуры, ионизирующего излучения, фильтрование (Кулешова, Л.И.
2005).
Высокотемпературная стерилизация
Тепло является наиболее распространенным
физическим агентом, используемым для деконтаминации патогенов. «Сухой» жар не
оказывает никакого коррозийного воздействия и используется для обработки многих
лабораторных предметов, которые выдерживают температуру 160 °C или выше в
течение 2-4 часов. Сжигание или прокаливание (см. ниже) также является одной из
форм сухого жара. «Влажный» жар наиболее эффективен при использовании в
процессе автоклавирования.
Кипячение не обязательно убивает все
микроорганизмы и/или патогены, но его можно использовать в качестве минимальной
обработки для дезинфекции, если другие методы (химическая дезинфекция или
деконтаминация) неприменимы или отсутствуют.
Со стерилизованными предметами следует
обращаться и хранить их таким образом, чтобы они оставались чистыми до их
использования (Мороз, Б.Т. 2008).
Использование насыщенного пара под давлением
(автоклавирование) является наиболее эффективным и надежным способом
стерилизации лабораторных материалов. Для большинства целей стерилизацию
правильно загруженных автоклавов обеспечат следующие циклы:
. Выдержка в течение 3 минут при температуре 134
°C
. Выдержка в течение 10 минут при температуре
126 °C
. Выдержка в течение 15 минут при температуре
121 °C
. Выдержка в течение 25 минут при температуре
115 °C.
Ниже приводятся примеры различных автоклавов.
Паровые автоклавы вытеснительного типа. На
рисунке 1 показан общий принцип работы автоклавов вытеснительного типа. Пар
поступает в камеру под давлением и вытесняет более тяжелые слои воздуха вниз
через клапан в дренажную трубу, оборудованную фильтром НЕРА (Перфильева, Г.М.
2010).
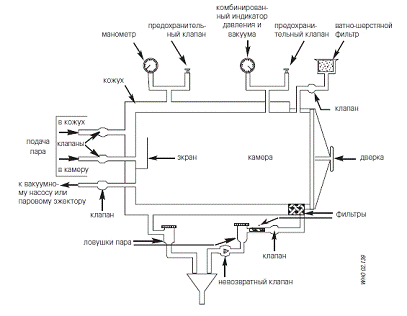
Рис. 1 Автоклав вытеснительного типа
Предвакуумные автоклавы. Автоклавы этого вида
обеспечивают удаление воздуха из камеры до поступления пара. Воздух удаляется
через клапан, оборудованный НЕРА-фильтром. В конце цикла пар автоматически
удаляется. Такие автоклавы могут функционировать при температуре 134 °C, в
связи с чем цикл стерилизации может быть сокращен до 3 минут. Они идеально
подходят для пористых материалов, но из-за вакуума их нельзя использовать для
обработки жидкостей.
Материалы следует размещать в камере неплотно,
чтобы пар мог легко проникать, а воздух - легко выходить. Пластиковые пакеты
следует открыть, чтобы дать пару доступ к их содержимому (Венцель, Р. 2003).
Меры предосторожности при работе с автоклавами
Соблюдение следующих правил может свести к
минимуму опасности, возникающие при работе с емкостями, находящимися под
давлением.
. Ответственность за использование и регулярное
обслуживание следует возложить на подготовленных сотрудников.
. Программа профилактики должна включать
регулярную инспекцию квалифицированным персоналом камеры, герметичности дверец
и всех измерительных и контрольных устройств.
. Пар должен быть насыщенным и не содержать
химических веществ (например, ингибиторов коррозии), которые могут
контаминировать стерилизуемые предметы.
. Все материалы, подлежащие автоклавированию,
должны быть помещены в контейнеры, обеспечивающие беспрепятственное удаление
воздуха и хорошую проводимость тепла; камера должна быть загружена неплотно,
чтобы дать пару равномерный доступ ко всем загруженным предметам.
. Если автоклав не оборудован внутренними
предохранительными запорами, препятствующими открыванию двери при повышенном давлении,
то в этом случае необходимо предусмотреть возможность открытия дверки только
после закрытия основного клапана подачи пара и снижения температура до 80 °C.
дезинфекция стерилизация деконтаминация автоклав
. При автоклавировании жидкостей устройство
выпуска пара следует установить на медленный режим, так как жидкости при их
выгрузке могут выкипать из-за перегрева.
. При открывании автоклава оператор должен
надеть подходящие перчатки и защитные козырьки, даже если температура упала
ниже 80 °C.
. В ходе обычной проверки эффективности
автоклава индикаторы биологической стабильности и термопары должны помещаться в
центр каждой загрузки. Для определения правильных циклов функционирования
настоятельно рекомендуется проводить регулярный контроль «наихудших случаев»
загрузки с использованием термопар и регистрирующих устройств.
. Дренажный экранирующий фильтр камеры (в случае
наличия) следует ежедневно снимать и чистить.
. Следует обращать особое внимание на то, чтобы
выпускной клапан пара не был закрыт бумагой или другими материалами (Царев,
В.Н. 2010).
Газовая стерилизация
Газовая стерилизация требует специального
оборудования и применяется для обработки изделий из стекла, металлов.
Используют окись этилена или смесь ОБ (окись этилена с бромистым метилом),
озон, а также пары раствора формальдегида в этиловом спирте, которыми наполняют
стационарные газовые стерилизаторы.
Для поддержания температуры (35 или 55° С)
стерилизаторы помещают в термостат или водяную баню. Для упаковки используют
полиэтиленовую пленку, пергамент и специальный упаковочный материал.
Стерилизованные газом изделия применяют после их выдержки (в течение 1-21
суток) в вентилируемом помещении.
Срок сохранения стерильности для изделий в
упаковке из полиэтиленовой пленки - 5 лет, из пергамента - 20 суток.
Контроль процесса ведут по показаниям приборов
(Герхардт, Ф. 1984).
Плазменная стерилизация
Плазменная стерилизация, являясь принципиально
новым методом обработки инструментов, имеет ряд преимуществ:
высокую эффективность эрадикации микроорганизмов
разных групп (от анаэробных бактерий до спорообразующих бацилл, грибов);
возможность эффективной комбинации с химической
обработкой;
кратковременность экспозиции - от 10 до 15 мин в
зависимости от степени загрязнения и проведения предварительной химической
обработки;
малые габариты аппарата;
компьютерное программирование режима
стерилизации.
Для стерилизационной обработки инструментов, в
частности, применяется стримерный разряд в аргоне при атмосферном давлении.
Данный тип разряда обеспечивает наивысшую концентрацию возбужденных атомов, а
следовательно, и скорость процесса стерилизации. Оборудование (плазменный
стерилизатор), предложенное для реализации этой цели, не требует наличия
вакуумной системы и является экологически безопасным (т.к. в качестве рабочего
газа применяется аргон).
Проблема создания относительно однородного
стримерного разряда наиболее просто решается использованием стерилизационных
камер небольшого объема (порядка 1л), поэтому развитие метода в настоящее время
идет в направлении использования стерилизационных камер относительно небольших
объемов, что весьма удобно для нужд лаборатории (Воробьев, А.А. 2004).
Контроль эффективности стерилизации
Контроль эффективности стерилизации осуществляют
несколькими методами:
По показаниям приборов (мановакууметров,
термометров, таймеров) максимальные термометры, физико-химические и биотесты
помещают в определенные точки аппарата;
С использованием физико-химических тестов
(вместе со стерилизуемым материалом в аппарат закладывают ампулы с кристаллами
веществ или специальные бумажные термохимические индикаторы; при нужной
температуре вещества расплавляются, а индикаторы меняют цвет);
Постановкой биологических тестов (в аппарат
помещают флакончики с салфетками или бумажными дисками, пропитанными взвесью
термостойкого спорообразующего микроба - Bacillus stearotermophilus для
контроля паровых или Bacillus licheniformis для контроля воздушных
стерилизаторов, и после стерилизации их инкубируют в МПБ - прозрачный бульон,
если споры погибли, не должен мутнеть);
Молекулярно-генетическими методами контроля
(геноиндикация) - могут использоваться в случае оценки стерилизации в отношении
труднокультивируемых бактерий (анаэробная группа) или вирусов. С этой целью
применяют ПЦР или обратную гибридизацию ДНК с праймерами соответствующих видов
микробов (Новикова, И.А. 2013).
Показателями эффективной работы стерилизационной
аппаратуры являются отсутствие роста тест-культуры в сочетании с
удовлетворительными результатами физического и химического контроля либо отсутствие
маркерных генов по данным ПЦР и гибридизации ДНК.
Контроль стерильности изделий проводят в
специально оборудованных боксах, соблюдая асептические условия, исключающие
возможность вторичной контаминации изделий микробами. В боксах поверхности
обрабатывают моющими и дезинфицирующими средствами. Перед входом в бокс
сотрудники лаборатории тщательно моют руки, надевают стерильную спецодежду,
шапочку, перчатки. В процессе работы в боксе проверяют обсемененность воздуха:
на рабочем столе на 15 мин открывают 2 чашки с питательным агаром, которые
затем инкубируют 48ч в термостате при 32° С (допускается рост не более 3
колоний неспорообразующих сапрофитов) (Практическое руководство 2004).
Пробы для исследования (не менее 1% из числа
одновременно простерилизованных изделий в той же упаковке) отбирает лаборант
центра государственного санитарно-эпидемиологического надзора, дезинфекционной
станции.
Контроль стерильности бактериологическим методом
проводят путем прямого посева изделий в питательные среды или методом смывов.
Материалом обязательно засевают две среды: тиогликолевую (для роста бактерий) и
среду Сабуро (для роста грибов). Посевы на тиогликолевой среде выдерживают при
32° С, на среде Сабуро - при 22° С в течение 7 суток. При отсутствии роста во
всех пробирках (флаконах) делают заключение о стерильности изделий (Мейнелл,
Дж. 1967).
ЗАКЛЮЧЕНИЕ
Дезинфекция и стерилизация имеют большое
значение в системе профилактических и противоэпидемических мероприятий.
Без применения качественных гермицидных средств
невозможно произвести эффективную уборку и деконтаминацию лаборатории. А ведь
от этого напрямую зависит здоровье обслуживающего персонала, граждан и
окружающей среды.
Неблагоприятное воздействие различных факторов
внешней среды на микроорганизмы используют для борьбы с ними при разработке
методов и способов стерилизации и дезинфекции.
Дезинфекция - уничтожение патогенных микробов в
окружающей человека среде. Методы и способы дезинфекции различны, но они
преследуют цели уничтожения не всех микроорганизмов, а только патогенных.
Уничтожение возбудителей инфекционных заболеваний в переносчиках называют
дезинсекцией, а в организме грызунов - источников инфекции - дератизацией.
С учетом роли дезинфекции ее делят на
профилактическую и очаговую.
В отличие от дезинфекции в результате
стерилизации объект становится свободным как от патогенных, так и от
сапрофитных микробов. Существуют различные методы и способы стерилизации, в
основе которых лежит действие физических или химических факторов. Критерием
гибели микроорганизмов является необратимая утрата способности к размножению,
что можно оценить путем количественного подсчета числа колоний после высева
смывов на чашки с питательными средами.
При выполнении различных видов дезинфекции и
стерилизации применяют механические, физические и химические способы и
средства.
ВЫВОДЫ
Под деконтаминацией понимают полное или
частичное удаление микроорганизмов с объектов внешней среды или из организма
человека с помощью факторов прямого повреждающего действия. Составными частями
деконтаминации является стерилизация и дезинфекция. Предшествует этим процессам
предварительная чистка, так как при наличии, к примеру, грязи на лабораторном
оборудовании действие химических гермицидов подавляется.
Деконтаминация лабораторных помещений, мебели и
оборудования требует сочетания жидких и газообразных дезинфицирующих средств.
Существует большое многообразие химических
гермицидов, применение каждого из которых зависит от конкретных условий
деконтаминации, то есть категории риска в помещении лаборатории и характера
микробного агента.
Дезинфекция - уничтожение патогенных
микроорганизмов с помощью различных методов. Ее целью является прерывание путей
передачи заразного начала. Лабораториям рекомендуется использовать физические
методы дезинфекции, так как они являются более безопасными, надежными и
простыми в использовании. При отсутствии же условий, позволяющих применить
физические методы, прибегают к методам химической или комбинированной
дезинфекции. Сущность камерной дезинфекции при комбинированном методе
заключается в прогревании содержимого камер горячим воздухом (паром) до
определенной температуры и при избыточном давлении, а при необходимости
усиления воздействия пара в дополнительном введении в камеру формальдегида
(формалина).
Стерилизация - это уничтожение не только
патогенных форм микроорганизмов, но и спор, которые, как известно, отличаются
особой устойчивостью к воздействию внешней среды. Существуют различные методы
стерилизации, но наиболее распространенным является высокотемпературная стерилизация.
Использование насыщенного пара под давлением (автоклавирование) является
наиболее эффективным и надежным способом стерилизации лабораторных материалов.
Несмотря на это, существуют определенные правила и меры предосторожности при
работе с автоклавами.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
Венцель,
Р. Руководство по инфекционному контролю в стационаре: учебник/ Р. Венцель, Т.
Бревер, Ж-П. Бутцлер;- Смоленск: МАКМАХ, 2003.- 131с.
Воробьев,
А.А. Медицинская микробиология, вирусология и иммунология: учебник/ А.А.
Воробьев;- М.: Медицинское информационное агенство, 2004.-690с.
Герхардт,
Ф. Методы общей бактериологии: учебник/ Ф. Герхардт;- М.: «Мир», 1984.-264с.
Кулешова,
Л.И.Инфекционная безопасность в лечебно-профилактических учреждениях:
учебник/Л.И. Кулешова, Е.В. Пустоветова; - 4-е изд., доп. и перераб.-Ростов
н/Д: «Феникс», 2005.-317с.
Мейнелл,
Дж. Экспериментальная микробиология (теория и практика): учебник/Дж. Мейнелл,
Э. Мейнелл;- М.: «Мир», 1967.-347с.
Мороз,
Б.Т. Особенности дезинфекции и стерилизации в амбулаторной стоматологии:
практическое руководство/ Б.Т. Мороз, О.В. Мироненко; СПб.: Человек, 2008. -
128 с.
Новикова,
И.А. Введение в клиническую лабораторную диагностику: учебное пособие/ И.А.
Новикова, А.С. Прокопович;- М., Медицина, 2013.-189с.
Обуховец,
Т.П. Основы сестринского дела: Практикум/Т.П. Обуховец; - 4-е изд., доп. и
перераб.-Ростов н/Д: «Феникс»,2006.-530с.