Визначення кислотності молока
МІНІСТЕРСТВО
ОСВІТИ ТА НАУКИ УКРАЇНИ
Житомирський
державний технологічний університет
Кафедра
екології
КУРСОВА
РОБОТА
з
аналітичної хімії
на
тему: Визначення кислотності молока
Студент 2 курсу групи
ЕО-34 Поліщук М. В.
Керівник: Скиба Г. В.
м.
Житомир - 2015рік
АНОТАЦІЯ
У курсовій роботі було встановлено,
що активна кислотність молока - рН - зумовлена логарифмом концентрації іонів і
в середньому становить 6,5. Кислотність свіжого молока зумовлена наявністю в
ньому фосфорнокислих, лимоннокислих солей і розчиненої вуглекислоти, а також
кислотним характером казеїну. Кислотність молока виражається в градусах Тернера
(°Т).
ЛОГАРИФМІЧНА КОНЦЕНТРАЦІЯ ІОНІВ,
МОЛОКО, БУФЕРНИЙ РОЗЧИН, ГРАДУСИ ТЕРНЕРА.
ЗМІСТ
Вступ
. Літературний огляд
.1 Хімічний склад коров’ячого молока
.2 Фізико-хімічні властивості молока
.3 Значення рН молока
. Експериментальна частина
.1 Визначення титрованої кислотності незбираного молока
.2 Методика визначення кислотності молока
.3 Техніка безпеки ведення аналізу
Висновки
Список літератури
Додатки
ВСТУП
Молоко - повноцінний і корисний
продукт харчування. Воно містить всі необхідні для життя живильні речовини,
потрібні для розвитку організму. Природне призначення молока в природі полягає
в забезпеченні живленням молодого організму після народження. Молоко є
незамінним джерелом найважливіших фізіологічно активних речовин, необхідних для
нормальної життєдіяльності людини.
З точки зору фізіології харчування
цінність молока як продукту пояснюється його універсальним складом. Молоко
вміщує більше основних поживних речовин, ніж будь-який інший харчовий продукт.
Воно являється важливим джерелом для задоволення потреб організму в кальції,
фосфорі і рибофлавіні. Крім того, в нього входить повноцінний білок, особливо
багатий на амінокислоти.
Молоко має різні призначення, а
саме:
як продукт харчування для населення;
як засіб для вигодовування молодняку
і корму в тваринництві;
як джерело отримання окремих
компонентів молока, які служать сировиною для фармакології та інших галузей
промисловості.
Молоко відвіку використовується як
лікувальний засіб від багатьох хвороб: при лікуванні серця, нирок і інших
органів. По науково обґрунтованим нормам молоко і молочні продукти повинні
складати одну третину харчового раціону.
Включення молочних продуктів в
будь-який харчовий раціон підвищує його повноцінність, істотно змінює якість
їжі, сприяє кращому засвоєнню інших компонентів раціону. Молоко сприятливо діє
на секрецію травних залоз. Воно засвоюється при мінімальній їх напрузі. При
цьому енергії вимагається в 3-4 рази менше, ніж для засвоєння, наприклад,
хлібу.
Крім того, молоко є сировиною для
виробництва харчових продуктів. З молока виробляють кисломолочні продукти, такі
як кефір, сметану, ряжанку, морозиво, кисломолочний сир, різні солодкі сирки та
сиркову масу. [1]
1. ЛІТЕРАТУРНИЙ ОГЛЯД
.1 Хімічний склад коров'ячого молока
Питне молоко характеризується
високими споживними властивостями, які визначаються його хімічним складом,
засвоюваністю, енергетичною цінністю, органолептичними показниками,
використанням. Вміст білків і цукрів у питному молоці такий як в
свіжовидоєному. Кількість жирів в окремих видах питного молока нормується
стандартами. Жири питного молока засвоюються краще, ніж свіжовидоєного. Це
пояснюється їх дрібнодисперсним станом. Енергетична цінність молока невисока.
Вона залежить, насамперед, від вмісту жиру і коливається від 50 до 80 ккал/100
г. Біологічна цінність питного молока визначається вмістом повноцінних білків,
полі ненасичених жирних кислот, фосфатидів, мінеральних речовин, вітамінів.
У харчуванні людей в основному
використовується коров’яче молоко. Його хімічний склад може суттєво коливатись
залежно від породи тварини, стадії лактації, віку, умов годування й
утримування, стану здоров’я, пори року та інших факторів. Молоко містить від 83
до 89% води. тобто сухий залишок становить 11…17%. Загальний хімічний склад
молока наведено в табл. 1.1.
Таблиця 1.1 Складові частини молока
|
Складові частини молока
|
Кількість
|
|
у середньому
|
коливання (від…до)
|
|
Вода
|
87,5
|
83…89
|
|
Жири
|
4,5
|
2,8…5,0
|
|
Білки
|
3,3
|
2,5…4,0
|
|
Молочний цукор
|
3,7
|
4,0…5,0
|
|
Мінеральні речовини
|
0,7
|
0,6…0,8
|
Молоко утворюється в молочній залозі
із тих поживних речовин, які приносяться з потоком крові. Для утворення 1 л
молока через вим’я корови має пройти 500 л крові. Деякі складові молока не
переходять у молоко безпосередньо із крові, деякі синтезуються в молочній
залозі із речовин, властивих крові. [2, 128 с]
.2 Фізико-хімічні властивості молока
питний якість
Властивості молока як єдиної фізико
- хімічної системи обумовлюються властивостями компонентів, що містяться в
ньому. Отже, будь - які зміни у вмісті чи стані складових частин молока мають
супроводжуватися змінами його фізико - хімічних властивостей.
Складові частини молока по різному
впливають на фізико - хімічні властивості молока. Так, наприклад, від кількості
білків в найбільшій степені залежать в’язкість та кислотність молока, але майже
не залежить його електропровідність. Мінеральні речовини молока сильно
впливають на його кислотність, електропровідність, але не змінюють в’язкості і
т. ін.
Головними фізико - хімічними
властивостями молока є кислотність, густина, осмотичний тиск, температура
замерзання та електропровідність.
Кислотність молока виражають в
одиницях титрованої кислотності (в градусах Тернера) і величиною рН при 20° С.
Титрована кислотність є критерієм
оцінки якості молока при його заготівлі. У молоці та молочних продуктах (крім
вершкового масла) вона виражається в умовних одиницях - градусах Тернера (° Т).
Градуси Тернера - це кількість мілілітрів 0,1н розчину лугу, яка необхідна для
нейтралізації 100 мл молока.
Кислотність свіжовидоєного молока
становить 16…18°Т. Така кислотність зумовлена кислотними солями -
дигідрофосфатами та дигідроцитратами (близько 9…13°Т), білками - казеїном та
сироватковими білками (4…6°Т), вуглекислим газом, кислотами (молочною,
лимоновою, аскорбіновою, вільними жирними) та іншими компонентами молока (у
сумі близько 1…3°Т).
Кислотність молока змінюється у
доволі значних межах залежно від обміну речовин в організмі тварин, який
визначається кормовим раціоном, породою, віком, фізіологічним станом,
індивідуальними особливостями тварин і таке інше. Особливо змінюється
кислотність молока протягом лактаційного періоду і при захворюваннях тварин. У
перші дні після отелення кислотність молока є підвищеною завдяки високому
вмісту білків та солей. Потім (через 40…60 днів) вона знижується до
фізіологічного рівня, а перед кінцем лактації суттєво спадає. При захворюваннях
тварин кислотність молока, як правило, спадає, особливо це відчутно при
захворюванні на мастит.
При зберіганні сирого молока
титрована кислотність зростає відповідно із розвитком у ньому молочнокислих
бактерій, які перетворюють лактозу в молочну кислоту. Підвищення кислотності
спричиняє небажані зміни властивостей молока, зокрема знижує стійкість білків
молока до нагрівання. Тому молоко з кислотністю 21°Т приймають як несортове.
У Німеччині, Чехії, Словаччині та
інших країнах титровану кислотність виражають не у градусах Тернера, а у
градусах Сокслета - Хенкеля (°SH). Її визначають титруванням молока 0,25н
розчином лугу. Тому 1°SH = 2,5°Т.
Густина (або об’ємна маса) - це
відношення маси молока при температурі 20°С до маси того ж об’єму води при
температурі 4°С. Таким чином, густина молока показує, наскільки молоко важче за
воду і коливається в межах 1,027…1,032 г./см³.
Густина молока визначається
аерометричним методом і виражається у гс/м³, кг/м³ або в градусах аерометра. Вона залежить від вмісту жиру та всіх
сухих речовин молока. Густина молочного жиру менше, ніж води, а тому при
збільшенні вмісту жиру в молоці його густина зменшується. Зі збільшенням вмісту
білків, лактози, мінеральних речовин густина молока збільшується, а при
розбавленні його водою - зменшується. Протягом лактаційного періоду густина
молока змінюється відповідно до змін його складу.
Осмотичний тиск і температура
замерзання. Осмотичний тиск молока залежить від наявності солей та молочного
цукру. Вміст жиру та білкових речовин значення не має. Осмотичний тиск молока -
Росм - є близький за величиною до осмотичного тиску крові тварин і в середньому
дорівнює 0,66МПа. У зв’язку з постійним осмотичним тиском молока існує зворотна
залежність між вмістом молочного цукру і солей в ньому. Збільшення вмісту цукру
в молоці супроводжується зниженням в ньому вмісту мінеральних солей.
Температура замерзання молока
пов’язана з осмотичним тиском і знаходиться в межах від -0,54… -0,58°С. Чим
більше молекул цукру та іонів солей в молоці, тим вищим є осмотичний тиск і
нижчою температура замерзання молока.
Електропровідність молока прямо
залежить від солевого складу. Розведення молока водою знижує його
електропровідність, а додавання соди (для пониження кислотності) різко її
підвищує. Тому за електропровідністю, яка в середньому дорівнює 46х10-4Ом,
можна визначити натуральність молока.[2, 128 с.]
.3 Значення pH молока
Від величини рН залежать багато
виробничих показників:
колоїдний стан білків молока;
умови зростання корисної і шкідливої
мікрофлори з її впливом на процеси дозрівання;
швидкість утворення типових
компонентів смаку і аромату окремих молочних продуктів;
стан рівноваги між іонізованим і
колоїдний розподіленим фосфатом кальцію і обумовлене цим термостійкість
білкових речовин;
активність бактеріальних ферментів;
очисно-дезинфікуюча здатність різних
миючих і дезинфікуючих засобів;
корозійна дія золей і миючих
розчинів, а також ступінь забрудненості стічних вод молочних підприємств.
РН для сирого молока - показник
якості, а для молочних продуктів є показником якості і чинником управління
виробничим процесом.
рН - як показник якості.
Встановлений достатній чітко, проте застосування рН як показника якості ще не
повною мірою передбачено національними стандартами окремих країн. У світовому
масштабі спостерігається тенденція до включення рН молочних продуктів, головним
чином кунжутних сирів, в оцінку їх якості. Молочні продукти задовільної якості
характеризуються певним значенням рН, наприклад, цільне молоко - 6,6 - 6,8;
згущує - 6,1 - 6,4; йогурти - 4,0 - 4,3; сирна сироватка - 4,3 - 4,6 і т.д.
По величині рН можна судити про
здібність молока до згортання:
нормальне свіжіше - 6,6 - 6,8;
починає скисати - 6,3;
згортання при нагріванні - 5,7;
згортання з утворенням згустка - 5,3
- 5.5.
Величина рН міняється при раптових
коливаннях температури, причому перепад температури викликає відхилення рН в
кислу зону. Раптове підвищення температури веде до відхилення рН в лужну зону.
При різних технологічних процесах
рекомендується стежити за зміною величини рН, т. до. від цього залежать якість
і вихід готового продукту. Наприклад, при регулюванні дозрівання вершків при
виробництві кислосливочного масла необхідна величина рН повинна лежати в межах
4,7 - 4,95. Якщо вона скорочена, то продукт переквашений, з'являється
прочуханок - кислий металевий присмак, якщо перевищено рН, то утворюється
недостатня кількість диацетила - прочуханок порожній, сирний смак; або сычужное
згортання проводять при рН 6,1 - 6,4; в свіжому сирі 4,7 - 5,3; зрілий сир -
5,2 - 57; скороченні або перевищення викликає вади консистенції і т.д.
Активність водневих іонів істотно
впливає на життєві функції мікрофлори. Оптимум зростання мікроорганізмів лежить
у вузькому діапазоні рН, і його треба підтримувати на заданому рівні, особливо
при підготовці необхідних живильних середовищ для мікробіологічного контролю
якості і в цілях створення найбільш сприятливих умов для зростання
мікроорганізмів в системі біологічного самоочищення стічних вод молочних
підприємств.
Визначення величини рН необхідне не
тільки в цілях підтримки оптимального середовища для зростання м. о., але і для
запобігання мікробіологічних вад якості.
Діапазон активності водневих іонів,
який для мікроорганізмів при біологічному самоочищенні вважається не
небезпечним, лежить в межах рН від 6,0 до 8,5. Більш високі і низькі значення
рН можуть привести до порушень в процесі біологічного розпаду, особливо в тому
випадку, якщо у відстійнику відбувається швидка зміна сильно кислих і сильно
лужних стічних вод. Оскільки стічні води з рН6,5 надають корозійну дію на
бетонні споруди, то залишається тільки вузький діапазон рН від 6,5 до 8,5 при
якому стічні води молочних підприємств можна відводити в каналізаційну систему
і відстійники, не боячись при цьому їх руйнуючої дії. [3]
2. ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
.1 Визначення титрованої кислотності
незбираного молока
Визначення титрованої кислотності
молока та молочних продуктів проводять згідно з ГОСТ 3624-92.
Кислотність молока та молочних
продуктах визначають у градусах Тернера, під яким розуміють об’єм водного
розчину гідроксиду натрію (калію) концентрацією ОД моль/дм3, необхідного для
нейтралізації 100 см3, або 100 г продукту.
Свіже молоко не містить кислот у
вільному стані. Кислотний характер молока зумовлюється наявністю у ньому
білків, кислих солей фосфорної, лимонної та інших кислот, розчинених газів.
Для визначення кислотності у конічну
колбу місткістю 150 або 200 см3 за допомогою піпетки відміряють 10 см3 молока,
додають 20 см3 дистильованої води та три краплини 1%-го спиртового розчину
фенолфталеїну, ретельно перемішують і титрують розчином гідроксиду натрію
(калію) концентрацією 0,1 моль/дм3 до появи слабко-рожевого забарвлення, яке
відповідає контрольному еталону і не зникає протягом І Хвилини.
Контрольний еталон готується так: у
конічну колбу місткістю 150 або 200 см3 за допомогою піпетки відміряють 10 см3
молока, додають 20 см3 дистильованої води та 1 см3 2,5%~го розчину
сірчанокислого кобальту, ретельно перемішують. Еталон придатний для роботи
протягом однієї зміни.
Кислотність молока у градусах
Тернера визначається об’ємом розчину гідроксиду натрію (калію) концентрацією ОД
моль/дм3 у сантиметрах кубічних, витраченого на титрування, помноженого на 10.
Розбіжність між двома паралельними
вимірюваннями не повинна перевищувати 1ОТ. Перевірка приладу за стандартним
буферним розчином повинна проводитись щодоби.
У склянку місткістю 50 або 100 см3
приливають (40±5) см3 молока або рідких кисломолочних продуктів температурою
(20±2) °С і занурюють електроди, через 3-5 с після повного зупинення стрілки
знімають показання за шкалою.
Наважку сиру кисломолочного 60 г у
пергаментному папері розтирають до однорідної консистенції, потім у пробу
вносять датчики і проводять вимірювання, постійно притискаючи пробу до
електродів.
Наважку сиру твердого у кількості 20
г вміщують у ступку, додають 20 см3 дистильованої води температурою 40 °С,
ретельно розтирають товкачиком, охолоджують до температури 20 °С і проводять
вимірювання рН.
Наважку порошку какао у кількості 5
г подрібнюють, змішують у склянці з 50 см3 дистильованої води. Прискорити
розчинення можна нагріванням суміші до температури не вище 70 °С з Наступним
охолодженням до (20-1) °С, У пробу занурюють електроди і проводять вимірювання,
не звертаючи уваги на наявність осаду.
Після кожного вимірювання електроди
промивають дистильованою водою. Після закінчення роботи електроди занурюють у
дистильовану воду.
Причому, виявлено чітко виражену
залежність між активною та титрованою кислотністю продукту. Таким чином за
результатами вимірювань активної кислотності можна визначити його титровану
кислотність за даними довідкових таблиць.
Опрацювання результатів вимірювань,
визначання загальної похибки. За кінцевий результат вимірювань беруть середнє
арифметичне значення результатів обчислень двох паралельних визначень.
Визначають відносну і абсолютну похибки.
Аналіз отриманих результатів,
висновки і рекомендації. Провести аналіз отриманих результатів, дати
порівняльну характеристику застосовуваних методів, оцінити точність аналізу.
[4]
2.2 Методика визначення кислотності
молока
молоко кислотність титрований
Кислотність свіжого молока зумовлена
наявністю в ньому фосфорнокислих, лимоннокислих солей і розчиненої
вуглекислоти, а також кислотним характером казеїну. Кислотність молока
виражається в градусах Тернера (°Т). Під умовним градусом розуміють кількість
мілілітрів 0,1 н. розчину їдкого натрію, яка необхідна для нейтралізації 100 мл
молока.
Мета досліду: ознайомитися з
методикою визначення кислотності молока.
Для роботи необхідно: 0,1 н. розчин
їдкого натрію, 0,1%-й розчин фенолфталеїну, колби ємністю 50-100 мл, піпетки,
бюретки.
Хід роботи. У колбу наливають 10 мл
молока, 20 мл дистильованої води і 2-3 краплі 0,1%-го розчину фенолфталеїну.
Старанно перемішують вміст колби і титрують 0,1 н. розчином їдкого натрію до
появи слаборожевого забарвлення, яке не зникає протягом 2 хв.
Кількість їдкого натрію, яка пішла
на титрування 10 мл молока, перемножують на 10 (перерахунок на 100). Це й буде
кислотність молока в градусах Тернера: Кислотність свіжого молока корови
складає 15-18; що постояло, - 20-22; те, що не зсілося, але зсідається при
кип’ятінні - 24-26°Т. [5]
Визначення кислотності молока шляхом
вимірювання рН (активна кислотність)
Визначення кислотності молока шляхом
вимірювання рН (активна кислотність) Кислотність молока може бути виражена
величиною рН при температурі 20 °С. Під величиною рН розуміють від’ємний
десятковий логарифм концентрації іонів водню в продукті. При використанні цього
методу у виробничих умовах для контролю кислотності користуються таблицями
співвідношення рН та титрованої кислотності. Необхідність такого порівняння
зумовлена тим, що кислотність молока у чинних технологічних інструкціях та
стандартах виражається в одиницях титрованої кислотності.
Для визначення величин рН
використовують прилад типу рН-340 та іономір універсальний ЗВ-74. Прилад
включають за 30 хв до початку перевірки. Налагоджують прилад за буферним
розчином зі значенням рН, що дорівнює 6,88 та 4,00 при температурі (20 ± 1) °С.
Перед перевіркою приладу за буферним розчином електроди необхідно ретельно
промити дистильованою водою, залишки води з електродів треба вилучити
фільтрувальним папером. У склянку місткістю 50 або 100 см3 наливають (40 ± 5)
см3 буферного розчину температурою (20 ± 1) °С, після чого занурюють у нього
електроди на 10-15 с, знімають показання приладу. Якщо показання приладу
відрізняються від стандартного значення рН еталонного буферного розчину більше
ніж на 0,05, то прилад налагоджують за допомогою регулятора. Перевірка приладу
за стандартним буферним розчином повинна виконуватись щоденно. У склянку
місткістю 50 або 100 см3 наливають (40 ± 5) см3 молока температурою (20 + 2) °С
та занурюють електроди приладу. Електроди не повинні дотикатись стінок і дна
склянки. Через 10-15 с знімають показання за шкалою приладу. Для швидкого
встановлення показань приладу вимірювання проводиться при коловому
перемішуванні склянки з молоком. Показання приладу знімають через 3-5 с після
встановлення стрілки. Після кожного вимірювання електроди датчика промивають
дистильованою водою. У разі масових вимірювань рН молока залишки попередньої
проби видаляють з електродів наступною пробою, а електроди промивають через
кожні 3-5 вимірювань. У проміжках між вимірюваннями електроди датчика занурюють
у склянку з дистильованою водою. [6]
2.3. Техніка безпеки ведення аналізу
Загальні вимоги. Студенти можуть
починати роботу лише після ознайомлення з правилами техніки безпеки, знання
яких викладач перевіряє і фіксує в журналі. При виконанні аналізів потрібно
бути уважним, обережним, всі операції проводити акуратно, не поспішаючи, в
спецодязі (робочий халат, біла хустинка з марлі або бязі). Категорично
забороняється вживати їжу за лабораторним столом та смакувати хімічні речовини.
Правила роботи зі скляним посудом.
Лабораторний посуд (прилади, склянки, колби тощо) потребує обережного
ставлення. При перемішуванні сумішей, рідин скляною паличкою потрібно
запобігати ударам по стінках посуду. Не можна нагрівати хімічний посуд на вогні
без азбестової сітки. Товстостінний посуд не витримує нагрівання, тому в нього
не можна наливати гарячу рідину, треба заздалегідь ополіскувати стінки і дно
посуду. Правила роботи з основними реактивами. Ті, хто працюють у лабораторії,
повинні знати основні властивості реактивів, особливо ступінь їх шкідливості та
здатність до утворення вибухо- і вогненебезпечних сумішей з іншими реактивами.
На всіх склянках з реактивами обов’язково повинні бути наклеєні етикетки із
зазначенням найменування та концентрації розчину. Якщо на склянці з реактивом
немає напису, його не можна використовувати. З ацетоном, етиловим і петролейним
ефірами та іншими вогненебезпечними речовинами потрібно працювати подалі від
вогню, дуже нагрітих предметів, увімкнених електронагрівальних приладів, у
витяжній шафі. Легкозаймисті речовини не можна нагрівати на відкритих
електроплитках або пальниках. Якщо вогненебезпечну рідину випадково розлито, її
засипають піском або накривають листом азбесту. З легкозаймистими речовинами,
що виділяють леткі, отруйні, кислі пари, а також неприємні запахи, слід
працювати тільки у витяжній шафі, причому голова і корпус студента повинні
залишатися поза шафою. Спостерігати за роботою треба через скло спущеної
стулки. Правила поводження з концентрованими речовинами. Розлиті кислоти та
луги слід негайно нейтралізувати, а потім добре змити водою. Для нейтралізації
лугів застосовують розчини борної або 8 %-ої оцтової кислоти, для нейтралізації
кислот - 5 %-й розчин питної соди. Хромову суміш, застосовувану для миття
посуду, та інші міцні розчини не можна всмоктувати піпеткою та виливати в
раковину. Запобіжні заходи для роботи з сірчаною кислотою. Потрапляючи на тіло,
руки, обличчя, сірчана кислота дає сильні опіки, а на одяг - спалює його до
дірок. Тому з нею слід працювати обережно і виконувати такі правила: надівати
окуляри під час відбирання проб сірчаної кислоти, її перемішування, розведення,
визначення жиру; не всмоктувати сірчану кислоту з піпетки ротом; вставляти в
патрони жироміри, лише закриті пробками, і для збовтування загортати їх у
рушник; не тримати при вилученні пробки жиромір отвором до себе або у бік
людей; мати біля робочого місця посудину із 1-2 л 0,5 % -го розчину питної
соди; відразу змити чистою водою бризки сірчаної кислоти в разі їх випадкового
потрапляння на руки або обличчя, після чого промити останні слабким розчином
питної соди, а потім знову чистою водою.
ВИСНОВКИ
За допомогою методів якісного та
кількісного аналізу були проведені експериментальні дослідження по визначенню
кислотності олока. На основі проведеної роботи можна зробити наступні висновки:
Молоко - повноцінний і корисний
продукт харчування. Воно містить всі необхідні для життя живильні речовини,
потрібні для розвитку організму.
Головними фізико - хімічними
властивостями молока є кислотність, густина, осмотичний тиск, температура
замерзання та електропровідність.
Кислотність молока виражають в
одиницях титрованої кислотності (в градусах Тернера) і величиною рН при 20° С.
Кислотність свіжовидоєного молока
становить 16…18°Т. Така кислотність зумовлена кислотними солями -
дигідрофосфатами та дигідроцитратами (близько 9…13°Т), білками - казеїном та
сироватковими білками (4…6°Т), вуглекислим газом, кислотами (молочною, лимоновою,
аскорбіновою, вільними жирними) та іншими компонентами молока (у сумі близько
1…3°Т).
Активна кислотність молока - рН -
зумовлена дисоціацією кислот та кислих солей. Вона виражається від’ємним
логарифмом концентрації іонів і в середньому становить 6,5 (відповідає
слабокислій реакції). Величина рН молока є відносно стійкою завдяки буферній
ємності, що утворюється білками та солями. При розвитку в молоці молочнокислих
бактерій суттєво зростає
Визначення титрованої кислотності
молока та молочних продуктів проводять згідно з ГОСТ 3624-92.
Свіже молоко не містить кислот у
вільному стані. Кислотний характер молока зумовлюється наявністю у ньому
білків, кислих солей фосфорної, лимонної та інших кислот, розчинених газів.
Кислотність свіжого молока зумовлена наявністю в ньому фосфорнокислих,
лимоннокислих солей і розчиненої вуглекислоти, а також кислотним характером
казеїну.
СПИСОК ЛІТЕРАТУРИ
1. Рудавська Г.Б.,
Тищенко Є. В. Молочні та яєчні товари: Підручник. / - К.: Книга, 2004. - 392 с.
. Шепелев А.Ф.,
Кожухова О.И. Товароведение и экспертиза молока и молочных продуктов: учебное
пособие. - Ростов н/Д: издательский центр «Март», 2001. - 128 с
. Инихов Г. С.
Биохимия молока и молочных продуктов. - 2 изд.. - М., 1962.
. ГОСТ 3624-92
Молоко и молочные продукты. Титриметрические методы определения кислотности
. Електронний
ресурс:
#"875839.files/image001.gif">
Звідси знаходимо концентрацію
аналізованого розчину:
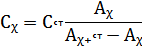
Концентрацію аналізованого речовини
в методі добавок можна знайти також за графіком в координатах A x + ст = f (c
ст). Рівняння (18) показує, що якщо відкладати A x + ct як функцію з ст, то
вийде пряма, екстраполяція якої до перетину з віссю абсцис дасть відрізок,
рівний - x.