Перспективы внедрения трансплантации костного мозга в Республике Узбекистан
ДИССЕРТАЦИЯ
ПО ТЕМЕ:
ПЕРСПЕКТИВЫ
ВНЕДРЕНИЯ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА В РЕСПУБЛИКЕ УЗБЕКИСТАН
ВВЕДЕНИЕ
Известно, что химиотерапия является базисным
средством лечения гематологических больных. Химиотерапия представляет собой
использование с лечебной целю препаратов, обладающих способностью блокировать
пролиферацию или уничтожить опухолевые клетки. При создании новых
противоопухолевых препаратов безоговорочным условием является их максимальное
ингибирующие действие на опухолевые клетки при минимальном повреждении
нормальных.
Долгое время поиск противоопухолевых средств
осуществлялся чисто эмпирически. С открытием молекулярной биологии стало
возможным создавать противоопухолевые препараты направленного, нацеленного
действия (таргетные), которые создаются с учетом не только клеточного цикла, но
и созданием механизма их контроля и поддержанием генетической определенности.
Совершенствование химиотерапии как этапа комплексного лечения лейкозов
продолжается. Большим достижением терапии лейкозов и депрессий кроветворения
является трансплантация костного мозга [14]. И хотя история трансплантации
костного мозга насчитывает уже не один десяток лет, успешное развитие
молекулярно-генетических исследований опухолевых заболеваний, позволило
мониторировать полноценность и эффективность терапии, значительно улучшило
прогноз и повысило вероятность приживляемости трансплантата и процент
выздоровления[22,29,48].
Рассматривая возможные варианты внедрения
трансплантации костного мозга в Узбекистане, самым приемлемым для начала на
данном этапе мы видим аутологичную пересадку стволовых клеток костного мозга
(далее ТКМ и/или СКК). Смысл аутологичной пересадки - сократить время
постхимиотерапевтической аплазии костного мозга и обеспечить рост здоровых,
жизнеспособных, полноценных клеток.
По мировым данным при проведении аутологической
пересадки костного мозга длительность жизни, а также безсобытийный период
болезни можно значительно удлинить[23,34,84,110,]. Иначе говоря, аутологическая
пересадка костного мозга влияет на продолжительность и качество жизни.
Преимуществом аутологической пересадки костного мозга является и экономическая
выгодность. [5,6] Один курс химиотерапии вместе с сопроводительной терапией
обходится государству в миллионы сум, и таких курсов больной вынужден получать
всю жизнь для поддержания стойкой ремиссии.
В случае аутологической пересадки проводят 2-4
курса ПХТ (кроме использования препарата мельфолан т.к. мельфолан сильный
миелотоксичный препарат и сбор аутологических стволовых клеток становится невозможным),
до достижения хотя бы частичной ремиссии, производится сбор собственных
стволовых клеток и затем следует немиелоаблятивный режим кондиционирования. В
режиме кондиционирования предусматриваются высокие дозы цитостатических
препаратов, которые обеспечивают гибель всех опухолевых клонов. И на
опустошенный от опухолевых клеток костный мозг «всаживают» собственные
стволовые клетки, полученные в момент ремиссии. Обычно инграфмант «приживление»
происходит на 14-16 день после пересадки. [15,20,] Далее больной наблюдается в
течение 100-120 дней, после чего возвращается к обычной жизни, избегая
ежемесячных курсов химиотерапии. Конечно, есть вероятность, что произойдет
рецидив заболевания через несколько лет. [28,40,90] Однако огромная разница
между тем, что получать химиотерапевтические препараты, имеющие особое
негативное влияние на внутренние органы, особенно печень, почки,
желудочно-кишечный тракт и непрерывно наблюдаться в клинике и тем, чтобы
вернуться к обычной жизни, пусть даже на определенный срок, и не зависеть от
препаратов.
Актуальность выбранной темы: За последние 10-15
лет в мировой гематологии произошли разительные перемены, позволяющие
добиваться колоссальных результатов в лечении потенциально смертельных, в
прошлом, заболеваний системы крови. Так, при лечении острых лейкозов удается
добиваться полного выздоровления в 20-30% случаев среди взрослых, а у детей
этот показатель достигает 70%, тогда как ранее этот показатель имел значительно
более низкое значение. [17,19,] При лимфатических опухолях частота полных
выздоровлений достигает в среднем 70-80%[32,86,117]. Это достигается благодаря
внедрению современных диагностических и лечебных методик, требующих больших
капиталовложений, обеспеченности квалифицированными кадрами и совместной работы
целого перечня различных служб. Лечение онкологических заболеваний кроветворных
органов заключается в применении высокодозной химиотерапии, лучевой терапии,
пересадки периферических стволовых клеток крови или костного мозга, что
сопровождается высокой вероятностью развития различных, порой, фатальных
осложнений. [26.]
Ввиду повреждения родоначальных клеток
кроветворения, наблюдается дисбаланс и дезориентация кроветворения. [8,25,62] В
случае с лейкозами, потомство изначально мутировавшей, озлокачествленной клетки
благодаря безудержному опухолевому росту, заполняет как костный мозг, так и
метастазирует во все органы и ткани. [38,96] В случае с апластической анемией,
депрессия кроветворения приводит к опустошению костного мозга[73]. То есть,
костный мозг в таких случаях либо продуцируют избыточное количество дефектных
или незрелых клеток крови (в случае лейкоза), или резко уменьшает выработку
клеток кроветворения (при аплазии кроветворения).
При лейкозах для эррадикации опухолевых клеток
крови и костного мозга требуются большие дозы химиотерапии и/или радиотерапии.
[19,44,114] Агрессивная химиотерапия, используемая для лечения лейкозов,
разрушает клетки костного мозга. Такое лечение повреждает не только
«дефектные», но и здоровые клетки[53,54,82].
На сегодняшний день в Республике Узбекистан
насчитывается порядка 6870 больных с различными гемобластозами и депрессией
кроветворения. По статистическим данным НИИГ и ПК МЗ РУз показатель
заболеваемости в Узбекистане на 100 тыс. населения в год составил 13 случаев,
что составляет около 2.500 первичных больных по Узбекистану. За 2010 гг. в
клинику НИИГ и ПК было госпитализировано 792 больных с острыми лейкозами, 653
больных с хроническими лейкозами и 55 больных с апластической анемией. На
сегодняшний день на диспансерном учете в НИИГ и ПК состоит около 4.500 больных
с гемобластозами (в среднем 4-5 первичных больных в день).
Эмпирические пересадки костного мозга,
осуществленные в НИИГиПК МЗ РУз в 60-70 гг. не были облечены в стройную
последовательную и технологически выверенную систему, в связи с чем не получили
дальнейшего развития и этот опыт надолго остался эпизодом в
трансплантации[1,10].
К сожалению, анализ показателей заболеваемости
гемобластозами за последние годы не имеет тенденции к снижению, что обусловлено
многими причинами, в том числе недостаточной изученностью патогенетических
механизмов, недостаточной эффективностью проводимой терапии.
Европейская группа по трансплантации костного
мозга (ЕГТКМ) была основана в 1975 году, и с этого времени количество центров,
объединяемых этой группой, выросло с 10 до 361. За последние 25 лет в базу
данных ЕГТКМ поступила информация о 75 000 пациентов, которым была проведена
высокодозная химиотерапия с последующей трансплантацией костного мозга.
[33,92,117] К настоящему времени около 30 % проведенных трансплантаций -
аллогенные, а 70 % - аутологичные [42,68,]. Ежегодно отмечается прирост
количества выполненных трансплантаций: аутологичных - на 4 % и аллогенных - на
8-9 % в год [16]. Помимо ведения регистра трансплантаций, ЕГТКМ участвует в
разработке и проведении проспективных исследований, обучении персонала и
создании стандартов высокодозного лечения в Европе [78,113]. В настоящее время
в мире ежегодно проводится более 10000 операций, а пятилетняя безрецидивная
выживаемость больных после трансплантации костного мозга достигает 50-80% [13].
Опыт ведущих центров по трансплантации костного
мозга показывает, что метод ТКМ приводит к радикальному излечению больных с
такими грозными диагнозами как гемобластозы и депрессии кроветворения [15,83].
Пересадка костного мозга позволяет врачам лечить такие болезни с интенсивной
химиотерапией или облучением с последующей заменой больного или поврежденного
костного мозга здоровым [11]. ТКМ является неотъемлемой частью программы
лечения ряда гематологических заболеваний, которая обеспечивает полное
выздоровление или более стойкую ремиссию, меньшую токсичность ПХТ, а также
меньшие затраты на лечение по сравнению с больными, получающими стандартную
ПХТ. [12] Исходя из вышесказанного, внедрение в клиническую практику ТКМ
является необходимой частью программного лечения гематологических заболеваний.
Таким образом, трансплантация гемопоэтических стволовых клеток это безусловный
прогресс современной биомедицины, так как благодаря только этому методу многие
злокачественные болезни крови стали принципиально излечимыми (например,
некоторые формы гемобластозов). Сегодня современная гематология уже не мыслима
без трансплантации гемопоэтических стволовых клеток и список болезней, где этот
метод применим, включает более 50 позиций. [16,69,108] В настоящее время на
базе НИИГиПК открыт центр по пересадке костного мозга, где созданы условия для
проведения ТКМ с учетом мировых требований.
Центр по пересадке костного мозга (стволовых
клеток) на базе НИИ Гематологии и переливания крови МЗ РУз позволит адекватно
обеспечить соответствующей медицинской лечебной помощью больных с
гемобластозами и гемодепрессиями в Республики Узбекистан.
Вышеизложенное позволяет сформулировать цель
диссертации и её задачи.
Цель: Подготовить больного с Множественной
миеломой (ММ) к аутологичной трансплантации костного мозга в условиях НИИГ и ПК
МЗ РУз.
Задачи исследования:
Разработать и определить этапы для осуществления
аутологичной трансплантации костного мозга (ТКМ) в условиях НИИГ и ПК.
Разработать и определить показания и
противопоказания к проведению аутоТКМ у больных с ММ.
Определить круг необходимых исследований для
отбора больных ММ на аутоТКМ.
Подготовить больного с Множественной Миеломой к
аутоТКМ и разработать критерии определения эффективности аутоТКМ.
Научная новизна:
Впервые определены условия и этапы для
осуществления ТКМ в условиях НИИГиПК.
Впервые определены показания и противопоказания
к проведению аутоТКМ у больных ММ.
Впервые определен круг необходимых исследований
для отбора больных на аутоТКМ и мониторинг основных систем.
Впервые разработаны критерии эффективности ТКМ.
Материалы и методы:
Было обследовано 50 больных с верифицированным
по основным критериям диагнозом ММ. 11 больных получили полихимиотерапию по
внедренному протоколу. Четверым из этих больных планируется проведение
аутологичной пересадки костного мозга с целью полного выздоровления, увеличения
безсобытийного периода заболевания или с уменьшением клинических признаков
заболевания, отсутствием необходимости в проведении курсов полихимиотерапии,
что в целом улучшает качество жизни и прогноз.
Исследование и разработка программы проводятся в
ТМА и в единственном в Центральной Азии Центре трансплантации костного мозга на
базе НИИ Гематологии и Переливания крови МЗ РУз, г. Ташкент, в котором
проводится диагностика, лечение больных с заболеваниями крови, обучение
медицинских кадров, научная работа, координация работы службы крови на местах.
Практическая значимость
Разработка, осуществление и широкое внедрение
метода аутологичной трансплантации костного мозга в практическую гематологию
позволит повысить эффективность лечения, прогноз, качество жизни и выживаемость
больных с лейкозами и гемодепрессиями, что также имеет прямую экономическую
выгоду.
ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ
.1 Исторические аспекты ТКМ
Первая попытка применить донорский костный мозг
для лечения пациентов, больных лейкозами, была предпринята в позапрошлом
столетии. В 1891 г. двое французских врачей Brown- Sequard и d'Arsonaval давали
таким больным человеческий костный мозг перорально [4, 7].
Следующее упоминание способа лечения с
использованием костного мозга встречается после почти пятидесятилетнего
перерыва. Так, в 1937 г. Schretzenmayer предложил внутримышечные инъекции
свежеаспирированного аутологичного или аллогенного костного мозга от случайных
доноров больным анемиями, в 1939 г. описано внутривенное и внутрикостное
введение больным костномозговой взвеси [10, 18, 97]. А год спустя (в 1940 г.) в
журнале JAMA Morrison и Samwack опубликовали наблюдение за больным апластической
анемией, картина крови которого полностью нормализовалась после инъекции в
грудину 13 мл костного мозга от брата.
В середине 40-х гг. Jean Bernard впервые
показал, что трансплантат костного мозга целесообразно вводить внутривенно, так
как при внутрикостном введении его клетки все равно сразу вымываются в кровь, и
хотя в последующие годы проводились неоднократные попытки внутривенного
введения донорского костного мозга больным, приживления трансплантата и
образования «химеры» не достигалось. [97] Причиной тому была иммунологическая
несовместимость, о существовании которой уже было известно. В 1948 г. появились
факторы, способные привести к супрессии иммунной системы реципиента,
достаточной для приживления трансплантата, одним из которых стала ионизирующая
радиация. В 1948 г. L. Jacobson впервые показал, что введение стронция [91,97]
приводит к аплазии костного мозга у мышей, а в 1951 г. Е. Lorenz
продемонстрировал, что мыши, облученные в летальной дозе, могут пережить
костномозговую аплазию, если им внутривенно инфузировать сингенные
костномозговые клетки [2,10].
К середине 50-х гг. в эксперименте были
обнаружены некоторые химические вещества, способные разрушать костный мозг
подобно радиации. Ими оказались диметилмилеран и циклофосфан [9].
Результаты исследований ТКМ у животных
стимулировали интерес к этой проблеме клиницистов, занимающихся лечением
гемобластозов. При лейкозах химиолучевая терапия вполне могла оказаться
эффективной, если бы пациенту удалось при помощи ТКМ пережить период пост цитостатической
аплазии кроветворения. Но естественно, не было доказательств, что лечение,
проводимое на животных, может быть применено у человека. [75,89,] Неясен был
даже вопрос, можно ли перелить пациенту внутривенно без осложнений достаточное
количество (400-600 мл!) костномозговой взвеси. [24,37] Поэтому в течение 10
следующих лет наряду с продолжением исследований в лабораториях ТКМ постепенно,
но все более широко изучается в клинике. Будучи экспериментальным, этот метод
лечения выполнялся главным образом у пациентов в терминальной стадии болезни
[3, 13].
Первая публикация по использованию ТКМ в клинике
[7] появилась в 1957 г. [Thomas E.D. et al]. В статье рассматривались
технические подробности аспирации костного мозга из подвздошной кости донора,
приготовление костномозговой взвеси, возможность ввести взвесь больному без
эмболии легких. Делались попытки установить достаточную для приживления
трансплантата дозу облучения реципиента. Впервые приживление трансплантата
получено в 1959 г. Томасом с соавт. у двоих детей после тотального облучения в
дозах 1140 и 850 рад и ТКМ от сингенных доноров. Оба ребенка вскоре погибли от
рецидива лейкоза [8].
В 1968 г. G. Mathe. отмечая, что некоторые
«технические» проблемы ТКМ у человека решены, характеризует общий десятилетний
итог использования этого метода лечения в клинике как крайне не
удовлетворительный. К этому времени в литературе описаны 417 случаев аллогенных
ТКМ, из них только в трех случаях трансплантат существовал достаточное
количество времени [9,17,35]. Лишь 10% больных имели временное улучшение
течения болезни, связанное с ТКМ [27,94,100]. Большинство реципиентов умирали
до появления признаков приживления костного мозга. Новая «волна» интереса к ТКМ
возникла с открытием законов гистосовместимости и возможностей тканевого
типирования. О существовании лейкоцитарных антигенов было известно с 1926 г.
[93,97]
Большинство иммунологических правил,
использующихся при ТКМ были открыты и разработаны в опытах па мышах в период
1967 по 1972 1г. (van Bekkiim. Trenlin) и на собаках к 1972 г. (Thomas.
Storb,). Опираясь на эти правила, группа врачей под руководством Thomas с 1969
г. по 1973 г. выполнила около 50 аллогенных ТКМ при апластической анемии и
лейкозах; приблизительно каждый третий больной пережил год после операции, сохраняя
функционирующий трансплантат. [1,76]
Трансплантация костного мозга (ТКМ) применяется
во многих странах, в том числе и в России с 1974г. [10,97] За этот срок в
России накоплен значительный опыт аутологичной трансплантации (т.к. эта
операция сравнительно проста и безопасна, улучшает качество жизни, внедрена в
клиническую практику), а также отмечены первые успехи трансплантации
аллогенной. Применение этой процедуры может значительно продлить жизнь
(добиться клинического излечения) при ряде гемобластозов, однако сопряжено со
значительными техническими, организационными и материальными проблемами,
высоким (в среднем до 25%) риском непосредственного летального исхода. (Из
материалов конференции онкологического научного центра им.Н.Н. Блохина 2009г)
Еще в 1999 г. в материалах конференции по
проблемам трансплантации КМ констатировалось: «Мучительно медленно продвигается
этот метод в России… Причины - медицинская и научная бедность, общий низкий
уровень биологического и медицинского образования и технологий, недостаточный
опыт исследования эффективности новых, редких и дорогостоящих методов
лечения…». [3,7] За 1970-е - 2000-е гг. в России, менее чем в 10
высокоспециализированных трансплантационных центрах, выполнено порядка тысячи
аллогенных трансплантаций КМ у взрослых (В Западной Европе - более 7 тысяч в
год.). [72,114] Причины столь редкого выполнения аллогенной трансплантации в
России - это не только недостаточное финансирование (затраты на проведение
лечебной процедуры в РФ соответствуют (500-1500 тыс. руб.; стоимость такого
лечения за рубежом достигает $200-300.000), но и высокий риск развития реакции
трансплантат против хозяина, который нередко ведет к гибели больного. В
здравоохранении нет национального регистра доноров-добровольцев, отсутствуют
сертифицированные лаборатории типирования (соответствия антигенной структуры
донора и реципиента); недостаточен опыт ведения больных после трансплантации;
нуждается в совершенствовании материально-техническая база трансплантационных
центров. [10,11] Отделение трансплантации костного мозга и интенсивной
химиотерапии РОНЦ им. Н.Н. Блохина создано в 1989 г. Благодаря значительной
модернизации в 2000-х гг., (оборудование палат с ламинарным потоком стерильного
воздуха, применение воздушных фильтров и др. аппаратуры), значительно возросли
его лечебные возможности. Вдвое увеличилось число аутологичных трансплантаций
(с 20 до 40 в год), внедрена в клиническую практику методика аллогенных
трансплантаций с миелоаблативным режимом кондиционирования. Снизилась
летальность, непосредственно связанная с аутотрансплантацией (16% в 2005 г. с
последующим нулевым показателем). [19,97].
.2 Гемопоэтические стволовые клетки
Известно, что все гемопоэтические клетки,
лимфоидные или миелоидные, происходят от одной общей плюрипотентной стволовой
клетки, способной как к непрерывному самовоспроизводству, так и к
поступательной дифференцировке [1,2]. Как только указанная клетка созревает,
она изначально сохраняет способность к самовозобновлению, но при этом
становится детерминированной (т.е. способной дифференцироваться) в направлении
одной или нескольких гемопоэтических линий, например, в направлении
гранулоцитарно-моноцитарной или лимфоидной линии. Эти частично
детерминированные клетки-предшественники впоследствии становятся полностью
детерминированными, т.е. способными дифференцироваться в один тип клеток,
теряют способность к самовозобновлению и в конце концов созревают в зрелые
гемопоэтические клетки, такие как гранулоциты, моноциты, В-клетки и Т-клетки. В
моделях на животных показано, что менее чем 10 плюрипотентных стволовых клеток
способны восстановить полный гемопоэз реципиента в течение нескольких недель
после трансплантации. [79,95] На рис. 1 представлена общая схема
дифференцировки гемопоэтических стволовых клеток.
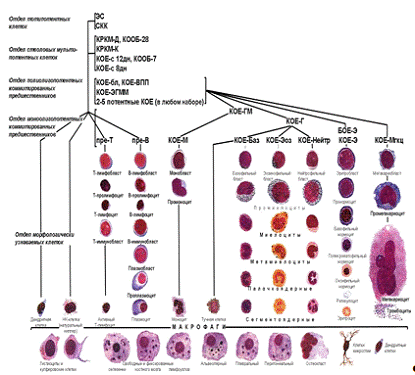
Рис 1
1.3 Пролиферация гемопоэтических
стволовых клеток: роль микроокружения
Доказано, что сложная структура костного мозга
обеспечивает тесное взаимодействие кроветворных клеток с регуляторным
микроокружением. Быстроделящиеся колониеобразующие единицы селезенки
располагаются вдоль костных балок, в то время как медленноделящиеся - ближе к
центру. Можно думать, что такое распределение клеток не случайно и
поддерживается веществами, выделяемыми микроокружением - липоцитами,
фибробластами, эндотелиальными клетками, макрофагами и Т-лимфоцитами.
[21,77,108] Однако роль этих клеток пока не ясна и неизвестно даже, входят ли
они в состав микроокружения in vivo. [31,80,88]
Имеются данные, что долгосрочных культурах
костного мозга созревающие клетки-предшественники и окончательно
дифференцированные клетки располагаются в культуральной среде, в то время как
стволовые клетки и ранние клетки-предшественники тесно связаны со стромой.
[36,97] Поэтому агрегаты клеток стромы и кроветворных клеток, выделенные из
свежезаготовленного костного мозга, богаты ранними кроветворными клетками. Их
контакт со стромой обеспечивают молекулы адгезии. [99] Обилие адгезивных
взаимодействий свидетельствует об их важной роли в регуляции кроветворения.
[111]
Процессы, отвечающие за состояние покоя,
самоподдержание и коммитирование стволовых клеток, пока изучены плохо.
Вероятно, в этом участвуют как внешние, так и внутренние факторы. [81,103]
CD-34 специфические клетки костного мозга адсорбируются к строме и обогащены
предшественниками гранулоцитов/ макрофагов (Liesveld J.l., ea, 1989).
1.4 Источники стволовых клеток
Стволовые клетки костного мозга. Большинство
гемопоэтических клеток-предшественников находится в костном мозге, поэтому
костный мозг является традиционным источником этих клеток для целей
трансплантации (см. табл. 1). [43] Важно представлять, что в нормальных
условиях только 1-3% клеток костного мозга имеют маркеры CD34. [39,65] Когда
забирается костный мозг для диагностики или в целях трансплантации, 25-75% полученного
материала фактически составляет периферическая кровь; поэтому подсчет
количества CD34 костного мозга в значительной степени зависит от качества
полученного материала. [11,30]
Практически целью забора костного мозга в
операционной, как правило, является получение достаточного общего объема или
общего числа ядросодержащих клеток в большей степени, чем получение общего
числа исключительно CD34. [67] Именно по этой причине, а также и потому, что
затраты времени на подсчет количества CD34 значительны, это исследование в
таких условиях относительно бессмысленно. Обычно костный мозг забирается из
расчета 10 мл/кг массы тела реципиента, что позволяет получить окончательную
дозу ядросодержащих клеток в пределах 1-4 х 109 клеток/кг. [85] Это количество
составляет только 1-5% общего объема костного мозга и не приводит к снижению
числа лейкоцитов и тромбоцитов у донора. Изменение гематокрита у донора
пропорционально тому, что произошло бы при потере аналогичного объема
периферической крови. Серьезные осложнения в результате забора костного мозга
встречаются редко (составляют 2-3 на 1000), и свыше 90% добровольных
неродственных доноров заявляют, что они хотели бы стать донорами во второй раз
[1].
Таблица 1 - Источники гемопоэтических стволовых
клеток
|
Характеристика
|
|
Костный
мозг
|
•
«Традиционный» источник клеток-предшественников • Требует проведения забора в
операционной (под общей или местной анестезией), 10-15 мл/кг веса реципиента
• Очень низкий уровень осложнений (осложнения анестезии, местные нейропатии,
боль, локальная инфекция) • Возможные преимущества включают относительно
низкое содержание Т-клеток •Используется преимущественно при
аллотрансплантации
|
|
Периферическая
кровь Кровь
|
•
Требует мобилизации клеток-предшественников донора с помощью химиотерапии,
гемопоэтических ростовых факторов или того и другого, в среднем 1-3 процедуры
афереза (конечная доза 2-10х 10^9 СD 34 клеток/кг)
|
|
•Очень
низкий уровень осложнений (тромбоз катетера или инфекция, тромбоцитопения,
гипокалийемия, артериальная гипотензия, осложнения, обусловленные
использованием ростовых факторов) Преимущества включают более быстрое
приживление и при проведении аутологической трансплантации возможность более
низкого уровня контаминации опухолевыми клетками: поэтому наиболее часто
используется при аутотрансплантации Используется преимущественно при
аутотрансплаитацни
|
|
Пуповинная
кровь
|
Забирается
из пуповинного остатка или плаценты после родов (50-150 мл) Хранится для
возможного использования у ЭТОГО же человека в дальнейшей жизни или криоконсервируется
в «банке» после HLA- тнпирования для использования у других реципиентов
|
Известно, что костный мозг представляет собой
мягкое, губчатое вещество, находящееся в центре большинства крупных костей
человеческого скелета. Костный мозг это кроветворный орган и производит все
клетки составляющие кровь, такие как красные и белые кровяные тельца,
тромбоциты. [2,7,9]
Все эти клетки происходят из
клеток-предшественниц, находящихся в костном мозге и называемых кроветворными
стволовыми клетками. Организм человека может управлять развитием стволовых
клеток в зависимости от текущих потребностей в определенных компонентах крови.
Этот процесс чрезвычайно активен, т.к. в костном мозге в час производятся
миллионы разных клеток. [71,112] Большая часть кроветворных стволовых клеток
находятся в костном мозге до их превращения в различные клетки крови, которые
затем попадают в кровоток. [111] Однако небольшое количество стволовых клеток
может быть найдено в циркулирующей крови, что позволяет выделять их оттуда при
определенных условиях. Существуют различные способы для увеличения количества
стволовых клеток в периферической крови перед их забором. [14]
Стволовые клетки из периферической крови.
Гемопоэтические предшественники циркулируют в периферической крови обычных людей
в нормальном состоянии, хотя в очень небольшом количестве (около 0,5-5,0 CD34
клеток на миллилитр с очень большим стандартным отклонением). [35,98] При
некоторых заболеваниях, таких, как хронический миелолейкоз, количество
циркулирующих стволовых клеток увеличивается в 20 - 100 раз. Для клинической
практики более важно, что предшественники также мобилизуются в кровь после
проведения химиотерапии. Степень мобилизации после химиотерапии, похоже,
коррелирует со степенью миелосупрессии, что также является важным для выбора
препаратов с относительно небольшой по продолжительности токсичностью в
отношении стволовых клеток, таких, как циклофосфамид или этопозид. [93,101]
Соответственно гемопоэтические ростовые факторы,
такие, как Г-КСФ или ГМ-КСФ, также эффективно мобилизуют клетки-предшественники
в кровь, в результате увеличивается количество циркулирующих CD34 (также в
пределах 20-100 раз, но опять же с сильным индивидуальным колебанием). [14,76]
Отсюда следует, что применение одной или обеих этих стратегий мобилизации
делает более целесообразным использование стволовых клеток периферической крови
(СКПК), забранных путем афереза, нежели использование стволовых клеток костного
мозга.
Отмечено что, различные факторы влияют на успех
и неудачу мобилизации стволовых клеток периферической крови. Наиболее
критические включают основное заболевание, наличие опухолевых клеток или
фиброза в костном мозге, предшествующее облучение костей таза и предшествующую
химиотерапию с использованием клеточных токсинов, таких, как алкилирующие
агенты или производные нитрозомочевины. [45,51,102] Забор СКПК проводится с
учетом общего количества мононуклеарных клеток или количества CD34. [46]
Среднее предполагаемое количество составляет 2-8 х 10б CD34+ клеток/кг.
Количество CD34 периферической крови хорошо коррелирует с количеством CD34,
полученных в конечном продукте афереза. [49] Некоторые исследования показывают,
что у пациентов, получивших дозу CD34 свыше 5 х 106/кг, приживление
трансплантата наступает значительно быстрее. [104,108] Возможно, требуется
значительно большая доза забираемых клеток, если конкретный клинический
протокол включает дальнейшие манипуляции с костным мозгом; например, отбор
положительных стволовых клеток или удаление опухолевых клеток или клеток,
участвующих в реакции «трансплантат-против-хозяина» (РТПХ) (Т-клеток). [109]
Этот принцип справедлив независимо от того, производится забор стволовых клеток
костного мозга или периферической крови.
При аутологической трансплантации СКПК
теоретически имеют второе преимущество перед стволовыми клетками костного
мозга, а именно: вероятность того, что будет меньшая степень контаминации
опухолевыми клетками. [57,58] Хотя инфузат СКПК обычно содержит значительно
большее количество ядросодержащих клеток по сравнению с таковым костного мозга,
было выявлено, что процент содержащихся в крови опухолевых клеток значительно
ниже, поэтому абсолютное число переливаемых опухолевых клеток зачастую меньше
для этого продукта. Более того, результаты нескольких исследований показали
увеличение выживаемости без признаков заболевания при использовании СКПК в
противоположность использованию клеток-предшественников костного мозга.
[41,107] Таким образом, хотя все положения еще достаточно спорны, эти данные
предполагают возможные дополнительные преимущества СКПК при аутологической
трансплантации.
Стволовые клетки пуповинной крови. В течение
последних лет к наиболее важным потенциальным источникам ГСК относят пуповинную
кровь [8, 9,50]. Хотя среднее количество пуповинной крови, остающейся в
плаценте после родов, относительно мало (50-150 мл), концентрация
клеток-предшественников (и, возможно, примитивных стволовых клеток) является
достаточной для успешного приживления трансплантата у детей с массой до 40 кг и
у некоторых взрослых без дополнительного забора стволовых клеток даже при
аллогенной трансплантации. За рубежом уже существуют банки для хранения
образцов HLA-типированной криозаконсервированной пуповинной крови для
использования в качестве источника клеток-предшественников у неродственных
реципиентов (Лондонский, Нью-Йорский, Парижский и др.). [55, 106] Не исключено,
что создание таких банков окажется потенциально полезным в будущем, особенно
для пациентов, которые имеют относительно редкие HLA типы [15]. Кроме того,
экономически выгодно обеспечить криоконсервированной пуповинной кровью людей в
качестве источника аутологических клеток для возможного индивидуального
использования. Об отдаленных результатах использования стволовых клеток
пуповинной крови в клинической практике в качестве источника аутологических
клеток-предшественников говорить еще рано, история использования этой
разновидности клеток насчитывает 15 лет, причем, только в течение последних 6
лет начали работать банки пуповинной крови [10, 11, 12].
Гемопоэтические ростовые факторы. Для развития и
дифференцировки гемопоэтическим стволовым клеткам необходимы специфические
растворимые белки, известные как ростовые факторы, а также специфическое
клеточное окружение. Клеточное окружение, необходимое для роста, может
определяться как кроветворная строма или микроокружение. [7,8,105]
Соответствующие тины клеток и необходимые для микроокружения трехуровневые
структуры находятся в костном мозге, однако другие органы, такие, как печень и,
возможно, селезенка, могут также обеспечивать рост ГСК внутриутробно или, при
определенных обстоятельствах, во взрослой жизни. Растворимые вещества,
отвечающие за нормальный миело- и лимфопоэз, в совокупности известные как
гемопоэтические ростовые факторы, включают цитокины, которые оказывают
преимущественное действие на наиболее примитивные стволовые клетки (например,
интерлейкин-3, flt-З лиганд и фактор стволовых клеток), т.е., которые действуют
на многих уровнях, например, гранулоцитарно-макрофагальный колониестимулирующий
фактор (ГМ-КСФ) и гранулоцитарный колониестимулирующий фактор (Г-КСФ), и те,
которые преимущественно влияют на рост и дифференцировку более зрелых
предшественников (например, эритропоэтин и тромбопоэтин). [115] Применение
некоторых из этих цитокинов в качестве фармакологических препаратов оказало значительное
влияние на клиническую практику и позволило использовать периферическую кровь в
качестве источника ГСК [3].
1.5 Трансплантация стволовых
кроветворных клеток по мировым данным
Миелотрансплантация -
метод лечения гематологических, онкологических и аутоиммунных заболеваний, при
котором пациенту после индукции глубокой депрессии иммунной системы,
обусловленной применением режимов кондиционирования (большие дозы цитостатиков ±
общее облучение тела), вводят предварительно заготовленные костный мозг или
стволовые кроветворные клетки (СКК) периферической крови. [10,11,47,56,90]
Выделяют следующие основные виды
миелотрансплантации:
) аллогенную трансплантацию, при которой
больному вводятся СКК от родственного или неродственного донора, совместимого
по системе HLA;
) аутологичную трансплантацию, когда реципиент
получает предварительно заготовленные собственный костный мозг (АТКМ) или СКК
периферической крови (АТСКК).
Разновидностями аллогенной трансплантации
являются: а) аллогенная трансплантация костного мозга (АлТКМ); б) аллогенная
трансплантация СКК периферической крови (АлТСКК); в) сингенная трансплантация
(трансплантация костного мозга или СКК периферической крови от однояйцевого
близнеца); г) аллогенная трансплантация СКК пуповинной крови (используется у
детей). [10, 60,113]
Аутологическая трансплантация. При
аутологической трансплантации в качестве источника клеток используются
собственные клетки-предшественники пациента (собранные и криоконсервированные
до трансплантации). Такие трансплантации обычно имеют меньшую частоту острой и
подострой смертности и вследствие этого предлагаются пожилым пациентам, а также
детям, особенно раннего возраста. Терапевтическое обоснование применения таких
трансплантаций в лечении злокачественных новообразований основано на
наблюдении, что многие цитостатические препараты имеют дозазависимую кривую, и
что главной дозолимитирующей токсичностью большинства этих препаратов является
миелосупрессия, т.е. угнетение костного мозга. Иными словами длительная
панцитопения может быть уменьшена путем использования инфузии аутологических
клеток-предшественников для поддержки («rescue») системы кроветворения. Поэтому
этот терапевтический подход часто обозначается как «высокодозная терапия с
поддержкой» (с - «rescue»). Он, несомненно, применим в любой ситуации, когда
источник аутологических клеток - предшественников абсолютно не содержит
опухолевых клеток, что определено in vivo путем клонирования, или может быть
очищен от таких клеток путем специальной обработки взвеси стволовых клеток. Последняя
манипуляция называется очисткой и может проводиться с использованием
центрифугирования, химиотерапии моноклональных антител или других ex vivo
методов. Как альтернатива может быть использовано переливание назад небольшого
количества опухолевых клеток пациенту, если существует вероятность их
разрушения хозяином и/или если целью терапии является увеличение длительности
ремиссии, а не «излечивание». [3,8, 52]
Аутологическая трансплантация, конечно же, не
подходит для генетических заболеваний (например, серповидно-клеточной анемии,
талассемии, болезней накопления и врожденных иммунодефицитов), а также обычно
не приемлема в ситуациях, когда большая часть популяции клеток-предшественников
является патологической в результате приобретенных заболеваний (например, при
миелодисплазии, апластической анемии и миелопролиферативных заболеваниях).
[10,59]
Сингенная трансплантация. Сингенная
трансплантация возможна тогда, когда у потенциального реципиента есть
однояйцовый близнец, который способен стать донором стволовых
клеток-предшественников. При этом отсутствует иммунологической барьер для
трансплантации, поскольку хозяин и донор генетически идентичны. Когда такой
выбор существует, сингенная трансплантация обычно более предпочтительна, чем
аутологическая, поскольку при ней отсутствует риск опухолевой контаминации
стволовых клеток. [11,61,63]
Аллогенная трансплантация. Главным барьером на
пути рутинного использования других доноров для трансплантации (обозначается
как аллогенная трансплантация) является существование различий в
гистосовместимости между индивидуумами. Гистосовместимость обозначает, будет
или нет иммунная система одного индивидуума узнавать ткани другого индивидуума
как «чужеродные» и, таким образом, пытаться разрушить чужеродные ткани. Когда
индивидуум (обозначаемый как хозяин), получающий новую ткань (в данном случае
ГСК), распознает новую трансплантируемую ткань (обозначаемую как трансплантат)
как чужеродную, он (хозяин) пытается отторгнуть новые клетки-предшественники.
[36,92] Это явление известно как реакция «хозяин-против-трансплантата» (РХПТ)
или как отторжение трансплантата. С другой стороны, новые трансплантированные
гемопоэтические стволовые клетки (трансплантат) рассматривают хозяина как
чужеродного, тогда развивается реакция РТПХ. Любое из этих состояний приводит к
тяжелой патологии и смертности. [50,109]
Главный определяющий фактор гистосовместимости у
людей основывается на том, имеют ли хозяин (реципиент) и трансплантат (донор)
идентичный набор генов в составе главного комплекса гистосовместимости (МНС).
Тип МНС индивидуума также обозначается как HLA (человеческий лейкоцитарный
антиген) тип. HLA-типирование определяет, являются ли донор и реципиент
идентичными по главным антигенам гистосовместимости. Тем не менее, важно
понимать, что существует также значительное число второстепенных локусов
гистосовместимости, которые влияют на исход трансплантации, но которые остаются
относительно плохо определяемыми на молекулярном уровне. Таким образом, даже
если донорами являются сиблинги, которые полностью генотипически HLA-совместимы
по всем определяемым МНС (HLA) локусам, частота острой и хронической РТПХ
остается на уровне 30-60%.[66,112]
Эксфузия гемопоэтических стволовых клеток. Для
успешной миелотрансплантации необходимо: 1) обеспечить глубокую депрессию
иммунной системы реципиента для успешного приживления трансплантата и
профилактики реакции “трансплантат против хозяина” (РТПХ) после проведения
АлТКМ/АлТСКК; 2) ввести реципиенту аллогенные или аутологичные СКК в
количестве, необходимом для восстановления гемопоэза; 3) при АлТКМ/АлТСКК -
проводить иммуносупрессивную терапию с целью профилактики: а) РТПХ; б) реакции
“хозяин против трансплантата” (РХПТ), которая может привести к отторжению
костного мозга донора. [50,93]
Основное преимущество АлТКМ/АлCКК -
низкий риск рецидива. Это связано, во-первых, с тем, что пациенту вводится
костный мозг здорового донора, а при онкологических заболеваниях, кроме того, -
с развитием РТПО. Главный недостаток АлТКМ/АлCКК - высокая
летальность (до 20-30%). [49,64,95]
Главным преимуществом АТКМ/АТCКК является
относительно низкая летальность (не более 5-10%), а недостатком
-
высокий риск рецидива из-за возможного наличия опухолевых клеток в
трансплантате. Очистка аутологичного трансплантата с помощью МКА или физических
методов приводит к уменьшению частоты рецидивов. [75]
Важным достижением явилось внедрение в практику
трансплантации СКК периферической крови. [3,8,10] Установлено, что СКК
находятся не только в костном мозге, но и в ряде случаев (назначение КСФ,
”выход” из постцитостатического агранулоцитоза) появляются в периферической
крови. (Моноклональные антитела МКА) позволяют идентифицировать популяцию
клеток с иммунофенотипом СКК (CD34+), а автоматический сепаратор клеток крови -
получить их в достаточном количестве. Это дает возможность выполнить
АлТСКК/АТСКК, которая занимает все большее место. [3]
Основные преимущества АлТСКК/АТСКК: 1)
отсутствует необходимость в общей анестезии; 2) меньшая длительность периода
цитопении; 3) более быстрое восстановление иммунной системы; 4) возможность
проведения при фиброзе костного мозга (например, после лучевой терапии на
лимфатические узлы и органы брюшной полости). [9]
Основные показания к трансплантации СКК
представлены в таблице №.2
Таблица 2
|
АлТКМ/АлТСКК
|
АТКМ/АТСКК
|
|
1)
Острый миелоидный лейкоз, первая ремиссия; 2) Острый лимфобластный лейкоз,
вторая ремиссия или первая ремиссия при наличии факторов риска); 3)
Хронический миелолейкоз, хроническая стадия; 4) Тяжелая апластическая анемия;
5) Тяжелые врожденные заболевания (гемоглобинопатии, болезни накопления).
|
1)
Лимфогранулематоз, вторая ремиссия или первая ремиссия при наличии факторов
риска; 2) Неходжкинские лимфомы, вторая ремиссия или первая ремиссия при
наличии факторов риска; 3) Множественная миелома; 4) Солидные опухоли (рак
молочной железы, яичек, яичников, мелкоклеточный рак легкого и др.).
|
Больной, которому планируется
миелотрансплантация, должен отвечать следующим требованиям:
) возраст менее 55 лет при аллогенной и менее 65
лет - при аутологичной трансплантации;
) хорошее общесоматическое состояние: индекс ВОЗ
0-I (таблица № 3);
) сохраненные функции печени, почек, сердца и
легких;
) отсутствие очагов инфекции.
Таблица 3 - Определение общесоматического
статуса в модификации ВОЗ
|
Индекс
ВОЗ
|
Показатели
|
|
0
|
Может
нести нормальную нагрузку без ограничений
|
|
I
|
Ограничен
в физической активности, но может лечиться амбулаторно и выполнять легкую
работу.
|
|
II
|
Амбулаторный
больной, способный полностью себя обслуживать, но утративший
работоспособность; на ногах не менее 50% дневного времени.
|
|
III
|
Способен
лишь к ограниченному самообслуживанию; проводит в постели или кресле более
50% дневного времени.
|
|
IV
|
Полностью
беспомощен, не может себя обслуживать и полностью прикован к постели или
креслу.
|
При ТКМ/ТСКК можно выделить несколько этапов:
. Эксфузия СКК. Для успешной трансплантации
необходимо заготовить не менее 2-8х109/л миелокариоцитов на 1 кг массы
больного, в зависимости от вида патологии. Гемопоэтические клетки получают в
условиях операционной под общей анестезией путем повторных аспираций из задних
бугров и гребней подвздошной кости. Суммарное количество заготовленного
костного мозга рассчитывается исходя из массы тела больного. Альтернативным
вариантом является взятие СКК из периферической крови с помощью клеточных сепараторов
после предварительной мобилизации колониестимулирующими факторами (чаще всего -
Г-КСФ). [67,85]
. Фракционирование. Фракционирование
заключается в удалении плазмы и эритроцитов путем дифференцированного
центрифугирования с целью получения концентрата костного мозга (СКК). При
аллогенной трансплантации СКК реинфузируются реципиенту ex tempore, при
аутологичной - через 2-3 недели, а в ряде случаев -
через несколько лет после эксфузии. Для сохранения аутологичные СКК
консервируются в жидком азоте под защитой криопротектора, чаще всего
диметилсульфоксида. [29,40,113]
. Кондиционирование. Задача данного этапа -
максимальная депрессия иммунной системы, а при онкогематологических
заболеваниях и солидных опухолях, кроме того, - эрадикация
остаточной опухолевой массы. Это достигается при помощи сверхвысоких доз
цитостатических препаратов ± лучевой терапии. [93] Режимы
кондиционирования дифференцированы в зависимости от нозологической формы. Дни
до реинфузии костного мозга или СКК периферической крови обозначаются со знаком
“минус” (Д-7, Д-6 и т.д.), день реинфузии - как Д- 0, дни
после трансплантации - со знаком “плюс” (Д+1, Д+2 и т.д.).
Для уменьшения побочных эффектов высокодозной терапии во время
кондиционирования проводится инфузия кристаллоидных растворов (в среднем 4-5
литров в сутки), вводятся антиэметики и седативные препараты. [8]
. Реинфузия. При аллогенной трансплантации
пациенту вводятся заготовленные в Д-О костный мозг или СКК, при аутологичной -
размораживаются и реинфузируются криоконсервированные гемопоэтические клетки.
Реинфузия проводится внутривенно капельно после премедикации антигистаминными
препаратами и большими дозами глюкокортикостероидов. [115]
. Профилактика и лечение осложнений периода
цитопении. Через несколько дней после завершения кондиционирования (обычно от
Д+5 до Д+10) у всех больных развивается глубокая цитопения (нейтрофилов менее
0,5х109 /л, тромбоцитов менее 20-30х109 /л). Данный
период характеризуется опасностью развития тяжелых инфекционных и
геморрагических осложнений (таблица № 4).
Таблица 4 - Основные осложнения
миелотрансплантации
|
Ранние
(до 100 дней)
|
Поздние
(после 100 дней)
|
|
1.
Инфекционные. 2. Геморрагические. 3.Веноокклюзионная болезнь. 4.
Кардиоваскулярные. 5. Нефрологические. 6. Острая РТПХ.
|
1.
Инфекционные. 2.Хроническая РТПХ. 3.Последствия кондиционирования (катаракта,
полигландулярная эндокринная недостаточность, обструктивные заболевания
легких). 4. Вторичные опухоли.
|
Основными мероприятиями в период цитопении
являются:
) профилактика, ранняя диагностика и лечение
инфекционных осложнений;
) профилактика и лечение геморрагического
синдрома.
Профилактика инфекционных осложнений включает
комплекс санитарно-гигиенических мероприятий (изоляция больного в асептической
палате, ежедневная смена белья, полоскание полости рта и обработка кожи
дезинфицирующими растворами, использование персоналом стерильной одежды,
дополнительная термическая обработка пищи). Для профилактики эндогенного
инфицирования проводится частичная деконтаминация кишечника (прием
неабсорбируемых антибактериальных препаратов в сочетании с противогрибковыми
средствами). [7,10,15]
Основой профилактики и лечения геморрагического
синдрома являются трансфузии тромбомассы (аутологичной или донорской). [13]
Показанием к трансфузии является снижение уровня тромбоцитов ниже 20х109/л или
наличие геморрагического синдрома. Коррекция анемии проводится при снижении
уровня гемоглобина ниже 70 г/л и/или клинических признаках гипоксии.
Веноокклюзионная болезнь (ВОБ) возникает у 5-10%
больных и обусловлена обструкцией синусоидального кровотока и дегенерацией
гепатоцитов. [118] Развитие ВОБ характеризуется асцитом, желтухой и
гипербилирубинемией. Лечение включает парентеральное питание, малые дозы
допамина, спиронолактоны, экстракорпоральные методы детоксикации, однако летальность
достигает 40-50%. Профилактика ВОБ включает в себя применение
антикоагулянтов и гепатопротекторов. [13,16]
Изменения со стороны почек и мочевыводящих путей
обычно ограничиваются временным нарушением функции почек на фоне
кондиционирования, в некоторых случаях развивается острая почечная
недостаточность. Другим осложнением является геморрагический цистит. [47,73]
При благоприятном течении
посттрансплантационного периода через 3-4 недели количество
нейтрофилов превышает 0,5х109/л, тромбоцитов - 20х109/л,
что означает окончание периода цитопении (при использовании
колониестимулирующих факторов и проведении ТСКК длительность цитопении
уменьшается в 1,5-2 раза). [13,16]
Несмотря на возможность развития многочисленных
осложнений, отдаленные результаты миелотрансплантации при многих заболеваниях
существенно лучше, чем при стандартном лечении (таблица № 5) [28].
Таблица 5 - Сравнительные результаты
стандартного лечения и миелотрансплантации при гематологических заболеваниях
(5-летняя безрецидивная выживаемость)
|
Заболевания
|
Стандартное
лечение
|
АлТКМ/АлСКК
|
АТКМ/АТСКК
|
|
Острый
миелоидный лейкоз, первая ремиссия
|
20-25%
|
50-60%
|
30%
|
|
Острый
лимфобластный лейкоз, вторая ремиссия или первая ремиссия при наличии
факторов риска
|
20%
|
50-60%
|
30%
|
|
Хронический
миелолейкоз, развернутая стадия (медиана выживаемости при химиотерапии -
3-4
года)
|
0%
|
50-80%
|
-
|
|
Хронический
миелолейкоз, фаза акселерации (медиана выживаемости при химиотерапии -
6 месяцев)
|
0%
|
20-30%
|
-
|
|
Неходжкинские
лимфомы (вторая ремиссия или первая ремиссия при наличии факторов риска)
|
10%
|
40%
|
30%
|
|
Лимфогранулематоз
(вторая ремиссия или первая ремиссия при наличии факторов риска)
|
20%
|
50%
|
40-50%
|
|
Тяжелая
апластическая анемия (медиана выживаемости при стандартном лечении -
6 месяцев)
|
0%
|
50-80%
|
-
|
Таким образом, за последние 30 лет
миелотрансплантация превратилась в широко распространенный метод лечения: в
настоящее время в мире ежегодно выполняется более 50 000 ТКМ/ТСКК, причем их
количество непрерывно увеличивается. Расширился и спектр показаний к
миелотрансплантации: наряду с гематологическими заболеваниями ТСКК применяется
при солидных опухолях (мелкоклеточный рак легкого, герминогенные опухоли яичка,
рак яичников) и аутоиммунной патологии (рассеянный склероз, диффузные болезни
соединительной ткани). [11,39,74,76]
1.6 Перспективы лечения миеломной
болезни аутологичной пересадкой костного мозга
Миеломная болезнь (болезнь Рустицкого-Калера,
множественная миелома, генерализованная плазмоцитома) является заболеванием
системы крови и относится к парапротеинемическим лейкозам с преимущественной
локализацией процесса в костном мозге. [3,8]
Частота миеломной болезни составляет 4 случая на
100000 населения в год, женщины заболевают в 3-4 раза чаще мужчины. Более часто
она развивается в пожилом возрасте. Средний возраст больных составляет около 60
лет. [119]
Природа миеломной болезни до сих пор неизвестна.
Она относится к низкопролиферативным опухолям. Допускается, что предшественники
миеломных клеток мигрируют из герминальных центров лимфатических узлов через
кровь в костный мозг. Опухолевая пролиферация обусловлена клональной экспансией
постгерминальных В-клеток с инвариабельным типом гипермутации генов
иммуноглобулинов. [12,18]
В развитии миеломной болезни значение придается
взаимодействию неопластических клеток со стромальным микроокружением в костном
мозге, играющем решающую роль в опухолевой адгезии и неоангиогенезе с
нарушением баланса между остеобластами и остеокластами, а также цитокиновой
стимуляцией опухолевого роста (интерлейкин-6 (ИЛ-6) и его рецепторы (sИЛ-6). Вместе
с другими цитокинами (ИЛ-1β, ФНП-альфа,
ИЛ-11 - ИЛ- 6) он стимулирует чрезмерную активность остеокластов, что
имеет следствием резорбцию костной ткани. Важная роль принадлежит усилению
взаимодействия между рецептором (RANK) активатора ядерного фактора-В (NF-κВ),
экспрессируемым остеокластами и хондроцитами, и его лигандом (RANKL),
экспрессируемым остеобластами, активированными Т-клетками и стромой костного
мозга. Как результат, стимулируются вызревание и активация остеокластов. Кроме
того, остеопротегерин (OPG) клеток стромы конкурентно связывается с RANKL
вместо RANK, подавляя дифференцировку и активацию остеокластов. Значение
принадлежит также макрофагальному воспалительному протеину-1альфа (MIP-1альфа),
стимулирующего миелоцито- и подавляющего эритроцитопоэз. Среди других факторов
значение имеют сосудистый эндотелиальный фактор роста (VEGF), основной фактор
роста фибробластов (bFGF), фактор роста гепатоцитов (HGF). [11,19]
При миеломной болезни поражаются, главным
образом, плоские кости (череп, рёбра, таз) и позвонки с резорбцией и
остеопорозом с образованием полостей в местах разрастания миеломной ткани по
типу (на рентгенограммах) гладкостенных пробоин. Такие изменения могут
обнаруживаться кроме плоских костей и в других тканях. [11,12]
Классификация миеломной болезни по ВОЗ 1979г
Таблица 6
|
По
распространённости в костном мозге
|
По
клеточному составу
|
По
способности секретировать парапротеины и их виду
|
|
Диффузная
|
плазмоцитарная,
|
несекретирующая,
|
|
диффузно-узловатая
|
плазмобластная,
|
диклоновая,
|
|
множественно-узловатая
|
полиморфно-клеточная,
|
Бенс-Джонса,
|
|
Мелкоклеточная
|
G-,
A-, M-миелома.
|
Наиболее часто встречаются G-, A и Бенс-Джонса
миелома, на которые приходится около 75%, 20% и 15 % все случаев.
Резорбция и остеопороз в плоских костях,
позвоночнике, проксимальных отделах длинных трубчатых костей с деструкцией
костной ткани вызывают локальные боли, снижение прочности костей, что приводит
к развитию самопроизвольных переломов, в частности, компрессионных переломов
позвоночника. Компрессионным переломам со стороны позвоночника чаще всего
подвергаются его торакальный и люмбальный отделы, с возможными деформациями по
типу "рыбьего рта". При этом может развиваться компрессия спинного
мозга с клиническими проявлениями в виде радикулярной боли, усиливающейся при
кашле и чихании, моторных и сенсорных нарушений функций мочевого пузыря,
кишечника, и даже параплегией.[7,8]
С разрушением костной ткани и увеличением в
крови концентрации кальция (гиперкальциемия) последний, в виде конкрементов
откладывается в выделительных органах (почки, легкие, слизистая желудка). Важен
уровень не общего, но ионизированного кальция, так как длительная бессимптомная
гиперкальциемия может быть обусловлена его связыванием с парапротеином, когда
уровень ионизированного кальция остается нормальным. Гиперкальциемия
сопровождается полиурией, запорами, тошнотой, рвотой, может приводить к
летаргии, мозговым нарушениям, коме. [2,17]
Поражение почек носит название миеломной
нефропатии и обусловлено в значительной мере поступлением через почечный фильтр
парапротеинов. Она свидетельствует о неблагоприятном прогнозе заболевания. В ее
основе, помимо протеинурии, гиперкальциемия, гиперурикемия, инфекции, амилоидоз
(наиболее часто при миеломе Бенс-Джонса). [13]
Нарушения кроветворения имеют следствием анемию
и снижение неспецифической и специфической иммунологической реактивности с
высоким риском бактериальных инфекций. [7]
Диагностика предполагает полноценное
рентгеновское, ядерно-магнитно-резонансное и/или позитронэмиссионное
томографическое исследование скелета. Лабораторная и патоморфологическая
диагностика основывается на общем анализе крови и мочи (с определением белка
Бенс-Джонса), определении белка и белковых фракций сыворотки крови или суточной
мочи, уровней иммуноглобулинов сыворотки крови (нефелометрия), аспирационной
биопсии костного мозга с подсчетом миелограммы, гистологическом исследовании
костного мозга путем трепанобиопсии.
При установлении диагноза множественной миеломы
основными являются три критерия:
) обнаружение клональных плазматических клеток в
миелограмме и (или) плазмоклеточной опухоли в биопсийном материале пораженной
ткани;
) наличие моноклонального Ig в сыворотке крови
и/или в моче;
) выявление признаков поражения органов и
тканей, связанных с миеломой (1 и более):
[С] - гиперкальциемия (уровень кальция сыворотки
крови на 0,25ммоль/л выше верхней границы нормы или выше 2,75 ммоль/л);
[R] - почечная недостаточность (уровень
креатинина в сыворотке крови выше 177 мкмоль/л);
[А] - анемия (уровень гемоглобина на 2 г/дл ниже
нижней границы нормы или ниже 10 г/дл);
[В] - очаги лизиса в костях или остеопороз.

Для диагностики множественной миеломы
обязательно наличие плазмоклеточного опухолевого поражения. Использование этой
диагностической системы позволяет выделить группу пациентов с активной или
симптоматической миеломой, которым необходимо лечение. [8]
В диагностике миеломной болезни важно помнить,
что секреция парапротеина характерна также для костной и экстрамедуллярной
плазмоцитомы, макроглобулинемии Вальденстрема, болезни тяжелых цепей.
Полное излечение больных с миеломной болезнью
сегодня под большим вопросом, равно как и редкость длительные ремиссии. Вне
высокодозовой химиотерапии с последующей трансплантацией красного костного
мозга средняя продолжительность жизни составляет около 8 лет. (Н.И.
Яблучанский, Н.В. Лысенко, О.Ю. Бычкова, Л.А. Мартимьянова, Н.В. Макиенко)
В рандомизированном исследовании, выполненном во
Франции, участвовало 200 пациентов с установленным диагнозом множественной миеломы.
[117] Было показано, что метод высокодозной химиотерапии с трансплантацией
периферических стволовых клеток крови увеличивает ответ на лечения до 81 % (в
сравнении с 57% при стандартном методе лечения), также как и вероятность
5-летней выживаемости больных. В другом рандомизированном исследовании,
проведенном в Великобритании, участвовало 407 пациентов с множественной
миеломой. Было показано увеличение общей выживаемости при проведении
высокодозной химиотерапии с трансплантацией периферических стволовых клеток
крови: достигнута медиана 54,8 месяцев в сравнении с 42,3 при стандартной
химиотерапии. Данные, полученные в онкологическом центре Ontario Cancer Center
в США, также подтверждают эффективность высокодозной химиотерапии с
трансплантацией периферических стволовых клеток крови, особенно у пациентов
младше 55 лет. В настоящий момент проходят исследования об эффективности
двойных (повторных) трансплантаций периферических стволовых клеток крови у
пациентов с множественной миеломой. Получены предварительный данные,
свидетельствующие о высокой эффективности таких "тандемных"
трансплантаций периферических стволовых клеток крови у определенных групп
пациентов с множественной миеломой. [10,17,98]
Известно, что в настоящее время высокодозная
химиотерапия с трансплантацией клеток-предшественников гемопоэза от донора или
самого больного остается наиболее эффективным методом лечения части больных с
острыми нелимфобластными лейкозами, хроническим миелолейкозом, миеломной
болезнью, лимфогранулематозом и неходжкинскими лимфомами высокой и
промежуточной степени злокачественности. Применение моноклональных антител к
CD20 (Мабтера, Ритуксимаб) вместе с аутоТКМ после высокодозной химиотерапии у
больных с неходжкинскими лимфомами низкой степени злокачественности представляется
перспективной возможностью полного излечения этого фатального на сегодняшний
день заболевания. Трансплантация костного мозга после немиелоаблятивных режимов
(минитрансплантация) позволяет надеяться на длительный контроль опухоли у
больных с распространенными солидными новообразованиями (светлоклеточный рак
почки, рак молочной железы и др.).
Таким образом, необходимо отметить, что
применение трансплантации периферических стволовых клеток крови у пациентов с
множественной миеломой позволило значительно улучшить результаты лечения.
Однократная или тандемная (двукратная) аутологическая трансплантация
гемопоэтических клеток позволяет увеличить безрецидивную выживаемость на 20-25
месяцев и улучшить качество жизни пациентов с ММ. И в настоящее время широко
применяется во многих странах.
ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ
В течении года нами было обследовано 50 больных
с верифицированным по основным критериям диагнозом ММ. Среди больных было 18
мужчин и 32 женщины в возрасте от 43 до 70 лет (медиана возраста составила
56,5). Всем больным был проведен весь спектр необходимых исследований и по
результатам полученных данных отобраны 11 пациентов для подготовки к аутоТКМ. В
отношении лиц анализируемой группы (11 пациентов с ММ) перечня необходимых
исследований были предприняты оптимально возможные общеклинические,
клинико-биохимические, морфологические и некоторые другие их виды обследования,
характер и полнота которых регламентировались как клиническими показаниями, так
и необходимостью получения научно-аналитической информации в целях решения
задач исследования.
2.1 Заготовка образцов крови для
исследования
Изучение периферической крови и костного мозга
производилось рутинным методом в клинической лаборатории НИИГиПК МЗ РУз г.
Ташкент. Забор венозной крови осуществляли в специальные пробирки с гепарином
(для гемограммы) и хранили в сумках холодильниках до проведения анализа,
который осуществляли не позднее 24 часов от момента взятия крови из вены. Кровь
без гепарина служила для биохимических и иммуноферментных анализов, в том числе
на феррокинетику - сывороточное железо, ферритин - FER, и трансферрин - TF).
Заготовленную кровь центрифугировали, отделяли сыворотку и хранили в
замороженном виде до проведения исследований при температуре -70˚С.
2.2 Метод исследования клинического
анализа крови на гематологическом анализаторе
Определение клинического анализа крови проводили
на гематологическом анализаторе «MINDRAY BC-2300» 2007 года. Проводили забор
венозной крови у пациента используя пробирку с ЭДТА. ЭДТА- предпочтительный антикоагулянт
для подсчета форменных элементов крови в гематологических анализаторах.
Концентрация должна быть постоянной и составлять 7.5% раствор ЭДТА. Взятую в
пробирку кровь плавно перемешивали переворачиванием. Пробу отстаивали 3 минуты.
Затем снова перемешивали и помешали в пробоотборочный зонд аппарата, так чтобы
наконечник зонда был хорошо погружен в пробу, и нажимали клавишу забора
жидкости для подсчета. Результаты получали в распечатанном виде.
2.3 Метод исследования костного
мозга
Подсчет миелограммы проводится из мазков
костного мозга, полученных при пункционной биопсии грудины или крыла
подвздошной кости. Пункцию проводили у больных при первичном обследовании, и
далее при каждом повторной госпитализации для оценки эффективности проводимой
терапии. Предварительной подготовки больных не требуется.
Техника стернальной пункции: Больной
укладывается на спину на твердую кушетку. Пункцию проводят в области рукояти
или тела грудины. Наиболее удобное место пункции между местом прикрепления 2 и
3 ребра к телу грудины. Кожу предварительно обрабатывают раствором йода и
спирта 70 градусного. Проводят инфильтрационную анестезию Новокаином 0.5%-5мл.
Через 3-5 минут делают пункцию грудины стернальной иглой Кассирского. Выводят
мандрен и шприцом аспирируют 1-2мл костномозговой взвеси. Иглу извлекают. Место
пункции покрывают асептической повязкой и оставляют компрессию на 10 мин.
Техника приготовления мазков костного мозга.
Применяют обычные лабораторные стекла. Стекла должны быть чистые и сухие. Из
костномозговой взвеси с помощи шлифовального стекла делаются тонкие мазки, как
при мазке из крови. Концы мазка должны оканчиваться каемочкой. После подсыхания
мазков на стекла карандашом наноситься Фамилия и инициалы пациента.
Подсчет миелограммы: Мазки костного мозга окрашиваются
стандартной техникой окраски по Романовскому-Гимзе. Под световым микроскопом
проводиться подсчет форменных элементов на 500 клеток костного мозга.
Оценивается содержание мегакариоцитов и состояние красного ростка.
Диагноз ММ устанавливали по общепринятым
критериям на основании жалоб пациентов, анамнеза заболевания и жизни,
объективных и лабораторно-инструментальных данных. Морфологический диагноз
ставился в соответствии с классификацией острых лейкозов FAB. Сопутствующая
патология определялась с использованием стандартных диагностических подходов,
характерных для каждой нозологической формы.
Для оценки состояния системы гемостаза были
использованы стандартизованные методы. Исследования проводились в НИИГ и ПК в
лаборатории гемостаза. Скрининговая оценка включала общепринятые тесты -
активированное парциальное тромбопластиновое время (АПТВ), протромбиновое время
с выражением результатов в % по Квику и в виде МНО, фибриноген, тромбиновое
время. Исследования выполнялись на полуавтоматическом коагулометре Sysmex
SE-560, Япония.
Трепанобиопсии костного мозга у больных ММ
выполняли на следующих этапах лечения: в момент диагностики заболевания, после
выполнения схемы индукции, после мобилизации ГСКК. Также необходимо её
проведение перед 1-ой аутотрансплантацией и через 3 месяца после завершения
высокодозной трансплантационной методики.
Для решения поставленной задачи при
гистологическом исследовании биоптатов костного мозга визуально оценивали
следующие параметры:
) состояние костных структур (истончение/утолщение
костных балок, наличие признаков рассасывания и тип резорбции костной ткани),
) соотношение между кроветворной и жировой
тканью костного мозга,
) соотношение между клетками гранулоцитарного и
эритроидного ростков,
) локализацию клеток каждого из 3-х ростков
кроветворной ткани,
) степень дифференцировки клеток
гранулоцитарного ростка,
) количество мегакариоцитов,
) наличие и выраженность диспластических
изменений в клетках каждого из 3-х ростков кроветворной ткани,
) состояние стромы (отек, кровоизлияния, фиброз,
синусы).
Содержание CD34+ клеток в лейкоконцентратах, а
также в периферической крови до начала мобилизации и в дни проведения
лейкоцитаферезов определяются методом проточной цитофлоуриметрии.
2.4 Иммуноферментный метод
определения вирусов гепатита В,С, ВИЧ, TORCH - инфекции в крови
Цель - Определить в крови пациентов содержание
HbSAg, HCV, ЦМВ. Концентрация вируса гепатита В, С, а также ВИЧ инфекции в
пробах крови высчитывалась по оптической плотности образцов и сопоставляются с
калибровочным стандартом. Для их определения использовались реагенты фирмы
HUMAN, «Вектор-БЕСТ». Аппарат иммуноферментного анализа «MR-96A» производства
Китай.
Приготовление образцов для процедуры: отделяем
сыворотку крови центрофугированием со скоростью 2.500 оборотов в мин на 15
минут. Срок хранения образцов - не более 48 часов при 2-8 градусов. При
необходимости образцы могут храниться при минус 20 градусах в течении 3
месяцев. Стандартная схема анализов не предусматривает предварительного
разведения исходного образца. Если ожидаемая концентрация выше максимальной в
калибровочной кривой, то рекомендуется предварительно развести в 2,4,8 раз.
Приготовление реагентов: все реагенты должны быть готовы к использованию. В
соответствии с исследуемым числом анализов отобрать в чистый флакон необходимое
количество реагента.
Проведение ИФА анализа:
Внести во все лунки 100мкл раствора для
разведения сывороток
Инкубировать при температуре 37 градусов в
течении 45 мин в термостатируемом шейкере с частотой 700 об/мин.
Промывка. По окончании снять липкую ленту и с
помощью промывочного раствора промыть лунки планшета 5 раз. В каждую лунку
вносить не менее 350 мкл жидкости. Добиться полного удаления жидкости из лунок
путем постукивания перевернутым планшетом по фильтровальной бумаге.
Внесение коньюгата.
Инкубировать при температуре 37 градусов в
течении 45 мин в термостатируемом шейкере с частотой 700 об/мин.
Промывка как описано выше.
Внести тетраметилбензидин (ТМБ) входит в набор
реагентов.
Инкубация 15 минут при температуре 18-25 градусов.
Внесение стоп реагента. Внести реагент в той же
последовательности что и ТМБ.
Проведение измерений. Измерить оптическую
плотность при волне 450 нм. Время измерений после внесения стоп реагента не
должно превышать 10 минут. Оптимально 2-3 минуты.
По результатам измерения вычислить среднее
арифметическое значение оптической плотности (ОП) в лунках с анализируемыми
образцами. Построить калибровочный график зависимости оптической плотности (ось
ординат) от концентрации HbSAg, HCV, ЦМВ (ось абсцисс) в калибровочных
образцах.
Количество CD34+ клеток в периферической крови
осуществляли при помощи метода проточной цитофлуориметрии с использованием
моноклональных антител на проточном цитофлуориметре фирмы “Becton Dickenson”.
Проточная цитометрия - метод оптического измерения параметров клетки, ее
органелл и происходящих в ней процессов.
Методика заключается в выявлении рассеяния света
лазерного луча при прохождении через него клетки в струе жидкости, причём,
степень световой дисперсии позволяет получить представление о размерах и
структуре клетки. Кроме того, в ходе анализа учитывается уровень флуоресценции
химических соединений, входящих в состав клетки (аутофлуоресценция) или
внесённых в образец перед проведением проточной цитометрии. Клеточная
суспензия, предварительно меченная флюоресцирующими моноклональными антителами
или флуоресцентными красителями, попадает в поток жидкости, проходящий через
проточную ячейку. Условия подобраны таким образом, что клетки выстраиваются
друг за другом за счет т. н. гидродинамического фокусирования струи в струе. В
момент пересечения клеткой лазерного луча детекторы фиксируют:
рассеяние света под малыми углами (от 1° до 10°)
(данная характеристика используется для определения размеров клеток).
рассеяние света под углом 90° (позволяет судить
о соотношении ядро/цитоплазма, а также о неоднородности и гранулярности
клеток).
интенсивность флуоресценции по нескольким
каналам флуоресцентности (от 2 до 18-20)- позволяет определить субпопуляционный
состав клеточной суспензии и др.
Этот метод позволяет осуществить:
анализ субпопуляционного состава клеток
периферической крови,
подсчет ретикулоцитов, анализ тромбоцитов по
специфическим маркерам,
дифференциальная диагностика
лимфопролиферативных заболеваний и реактивных лимфоцитозов,
диагностика лимфопролиферативных заболеваний,
диагностика острых лейкозов,
оценка минимальной резидуальной болезни.
Для проведения исследований выбраны
общеклинические методы исследования: общий и биохимический анализ крови, ИФА
исследования крови, рентгенография в прямой проекции, общий анализ мочи; и
специальные методы исследования: подсчет миелограммы, проточная цитофлоуметрия,
иммунноэлектрофорез белков плазмы, определение белка Бенс-Джонса в моче.
Дизайн исследования был сформирован по четырем
точкам: исходный уровень, после проведения режима кондиционирования (Д0), через
две недели после трансплантации (Д+14) и на момент восстановления гемопоэза.
Критерием приживления будет считаться увеличение количества лейкоцитов более
1,0х109/л в течение 20 дней.
ГЛАВА 3. РЕЗУЛЬТАТЫ СОБСТВЕННЫХ
ИССЛЕДОВАНИЙ
.1 Этапы для осуществления
аутологичной трансплантации костного мозга (ТКМ) в условиях НИИГ и ПК
Трансплантацию стволовых клеток проводят только
в центре, аккредитованном Европейской исследовательской группой по трансплантации
костного мозга и стволовых клеток крови, оснащенном всем необходимым для
оказания онкогематологическим больным высокоспециализированной помощи.
Успех стационарного лечения больных во многом
зависит от оптимизации больничной среды. Сюда можно отнести оптимальные
палатные гигиенические условия, способствующие быстрейшему выздоровлению
больных. Гигиенические условия препятствуют возникновению и распространению
внутрибольничных инфекций, как самого грозного фактора, влияющего на
санитарно-гигиенический комфорт отделений больницы. Гигиены больницы должна
обеспечить оптимальные условия для работы медицинского персонала, защитить его
от действия профессиональных вредностей (как-то нервно-психическое
переутомление, напряжение скелетной мускулатуры, ночные дежурства, химические и
физические агенты, внутрибольничная инфекция и т.д.). Внедрение новых
технологий в медицину неразрывно связано с достижениями гигиенической науки,
нормы и правила которой позволяют обеспечить должный уровень технологии и
безопасности при проведении сложных процедур (работа с радионуклидами,
лазерами, барооперационные, трансплантация органов).
3.1.1 Требования к отделению
1.Поверхность стен, полов и потолков помещений
должна быть гладкой, без дефектов, легкодоступной для влажной уборки и
устойчивой к обработке моющими и дезинфицирующими средствами. При использовании
панелей их конструкция также должна обеспечивать гладкую поверхность.
.Покрытие пола должно плотно прилегать к
основанию. Сопряжение стен и полов должно иметь закругленное сечение, стыки
должны быть герметичными. При использовании линолеумных покрытий края линолеума
у стен могут быть подведены под плинтуса или возведены на стены. Швы,
примыкающих друг к другу листов линолеума, должны быть пропаяны.
. Допускается применение подвесных, натяжных,
подшивных и других видов потолков, обеспечивающих гладкость поверхности и
возможность проведения их влажной очистки и дезинфекции
. В целях профилактики внутрибольничного
легионеллеза в отделениях (палатах) для лечения иммунокомпрометированных
пациентов (трансплантологии, онкогематологии, ожоговых и т.п.) при температуре
горячей воды в точках разбора (душевые сетки) ниже 60 градусов рекомендуется
применять дополнительные средства защиты (специальные фильтры).
Микробиологический контроль на наличие легионелл в этих учреждениях
осуществляется 2 раз в год, точка отбора - перед поступлением в
распределительную сеть. При температуре горячей воды выше 65 градусов и
холодной воды ниже 20 градусов микробиологический контроль не проводится.
3.1.2 Требования к отоплению,
вентиляции, микроклимату и воздушной среде помещений
1.Системы отопления, вентиляции и
кондиционирования воздуха должны обеспечивать нормируемые параметры
микроклимата и воздушной среды помещений, в которых осуществляется медицинская
деятельность.
.Нагревательные приборы должны иметь гладкую
поверхность, исключающую адсорбирование пыли и устойчивую к воздействию моющих
и дезинфицирующих растворов. Их следует размещать у наружных стен, под окнами.
Расположение нагревательных приборов у внутренних стен в палатах не
допускается.
.При устройстве ограждений отопительных приборов
должен быть обеспечен свободный доступ для текущей эксплуатации и уборки.
.Здания отделения трансплантации (ОТ) должны
быть оборудованы системами приточно-вытяжной вентиляции с механическим и/или
естественным побуждением.
.Системы механической приточно-вытяжной
вентиляции должны быть паспортизированы. Эксплуатация (обслуживание)
механической приточно-вытяжной вентиляции и кондиционирования осуществляется
ответственным лицом организации или другой специализированной организацией.
Один раз в год проводится проверка эффективности работы, текущие ремонты (при
необходимости), а также очистка и дезинфекция систем механической
приточно-вытяжной вентиляции и кондиционирования.
.Кратность воздухообмена определяется исходя из
расчетов обеспечения заданной чистоты, температуры и относительной влажности
воздуха. Скорость движения воздуха в палатах и лечебно-диагностических
кабинетах принимается от 0,1 до 0,2 м/сек. В помещениях класса чистоты А и Б
относительная влажность не должна превышать 60%.
.При наличии централизованных систем
кондиционирования и увлажнения воздуха в целях профилактики внутрибольничного
легионеллеза микробиологический контроль данных систем на наличие легионелл
проводится 2 раза в год. Отбор проб производится в соответствии с действующими
требованиями. Кондиционирующие установки небольшой мощности без увлажнения
воздуха и сплит-системы контролю на легионеллы не подлежат.
3.1.3 Подготовка пациентов к ТКМ
Пациенты с установленным с диагнозом ММ в стадии
CR, PR, VGPR госпитализируются за 15-20 дней до ТГСК. Начиная с момента
проведения режима кондиционирования целесообразно соблюдение следующих условий:
изоляция пациента в ламинарном боксе;
проведение постоянного клинического и
лабораторного мониторинга;
имплантация многолинейного (2-х или 3-х
канального) центрального венозного катетера, устанавливаемого заблаговременно
(день - 10);
введение лекарственных средств с использованием
инфузионных насосов;
применение тромбоконцентрата, полученного на
сепараторе клеток крови и облученного на гамма-установке перед трансфузией;
консультация психолога, психологическая
подготовка к предстоящей процедуре.
Консультация смежных специалистов (гинеколога,
стоматолога, терапевта и др.).
Этапы выполнения аутологичной трансплантации
костного мозга:этап - Предтрансплантационная подготовка.
Трансплантацию стволовых клеток проводят только
в центре, аккредитованном Европейской исследовательской группой по
трансплантации костного мозга и стволовых клеток крови, оснащенном всем
необходимым для оказания онкогематологическим больным высокоспециализированной
помощи (BCSH, 1995).
Необходимо, чтобы на всех этапах лечения
поддерживалась тесная связь между гематологической бригадой, прочими специалистами
и врачом общей практики.
В подготовке больного к ТГСК необходимо участие
специализированных и диагностических служб, которые представлены в таблице № 7.
Таблица 7

Рутинные исследования для всех больных с гемобластозами:
ОАК, Биохимический анализ крови, исследование
функции почек, исследование функций печени, глюкоза крови, электролиты,
тотальный белок (альбумин), коагулограмма, ультразвуковое исследование органов
брюшной полости и почек.
Специфические для больных ММ: Электрофорез
белков плазмы, электрофорез белков мочи на М протеин (в суточной),
Иммунофиксация протеинов плазмы и мочи, легкие цепи в плазме и моче (каппа и
лямда), свободные легкие цепи. Рентген в прямой проекции костей черепа,
позвоночника, грудной клетки, бедер и плечевых костей или МРТ туловища.
В2макроглобулин. Цитогенетическое исследование. FISH [del 13, del 13p17, t
(4:14), t(11:14), t(14:16), (1q21). Биопсия костного мозга и иммуногистохимия
или цитофлоурометрическое исследование костного мозга. Биопсия плазмацитомы
(если имеется).
Перечень превентивных исследований перед
трансплантацией включает общемедицинские и специальные методы исследования:
|
Рутинные
|
Специфические
|
|
Определение
групп крови по системам АВО и резус;
|
Аспират
костного мозга
|
|
ОАК
(19 параметров)
|
иммуноглобулины
крови;
|
|
Биохимический
анализ крови (стандартное исследование +белковые фракции)
|
Электрофорез
белковых фракций
|
|
Коагулограмма
|
Белок
Бенс -Джонса в моче и крови
|
|
Анализ
мочи включая клиренс креатинина
|
Рентгеногрфия
костей скелета в прямой проекции;
|
|
Спирометрия
|
Психологическая
подготовка, беседа с родителями о возможных осложнениях от операции забора
КМ, получение письменного согласия донора или родителей (опекунов) - у
несовершеннолетних;
|
|
Имунно-ферментный
анализ (ВИЧ, гепатит А,В,С. цитомегаловируса (CMV); вируса Эпштейна-Барр
(EBV); вируса простого герпеса (HSV);
|
|
|
ЭКГ
|
|
|
ЭХО-КГ
|
|
|
УЗИ
органов брюшной полости и почек;
|
|
|
Неврологический
статус;
|
|
|
Комплекс
серологических реакций на сифилис (микрореакция преципитации с сывороткой
крови или тест быстрых плазменных реагинов+реакция пассивной
гемагглютинации+реакция иммунофлюоресценции с абсорбцией)
|
|
|
Гормоны
щ\ж - по показаниям
|
|
|
CRP,
RF, Ig [M.M] RW,бруцелез.
|
|
|
Определение
роста и массы тела
|
|
|
Консультации
узких специалистов (с заключением): • хирурга (перенесенные операции,
настоящая патология) • стоматолога (санация полости рта) • гинеколога (УЗИ
матки, придатков) • уролога (УЗИ предстательной железы) • проктолога по
показаниям • терапевта (с изложением полного медицинского анамнеза
объективного статуса, принимаемых препаратов), наличие артериальной
гипертензии. • эндокринолога
|
|
Исследования у больного ММ готовящегося к
аутотрансплантации
|
Предварительные
исследования внутренних органов
|
Исследования,
подтверждающие диагноз
|
Исследования
для определения массы опухоли
|
Исследования
для - оценки поражения и прогноза
|
Исследования,
показанные отдельным больным
|
|
Общий
анализ крови; СОЭ
|
Стернальная
пункция± трепанобиопсия подвздошной кости.
|
Цитогенетическое
исследование костного мозга флюросцентная гибридизация insitu
|
Общий
анализ крови (анемия)
|
Концентрация
витамина В12 и фолиевой кислоты, иммуногистохимическое исследование костного
мозга или проточная цитофлоуметрия
|
|
Сывороточные
уровни электролитов, креатинина, кальция, альбумина и мочевой кислоты; АМК;
электрофорез белков сыворотки и мочи; содержание нормальных (поликло-нальных)
иммуноглобулинов
|
Иммунофиксационный
электрофорез белков сыворотки или мочи
|
Содержание
парапротеина в сыворотке и моче; кальций; альбумин; В2-микроглобулин
|
АМК
и креатинин сыворотки; клиренс креа-тинина (измеренный или рассчитанный по
формуле); кальций; альбумин; лактатдегид- рогеназа; С-реактив- пый белок;
содержание нормальных (поликло- нальных) иммуноглобулинов
|
|
|
Прицельная
рентгенография при местных симптомах
|
Рентгенография
скелета
|
Рентгенография
скелета
|
|
МРТ,КТ
|
Этап - Индукция ремиссии
Индукция ремиссии 4 курсами химиотерапии. При
достижении полной ремиссии (CR), частичной ремиссии (PR), гематологического
ответа (HR) следующий курс является мобилизационным. После его проведения на
фоне применения гранулоцитарного колониестимулирующего фактора (далее-Г-КСФ)
производят введение гемопоэтических стволовых клеток периферической крови
(далее-ГСК).
Индукционные курсы проводили с помощью
программы: VAD 1-2 курса0.4 mg + 1000 ml - 0.9 % NaCl (или 5 % Glucosae) 24
часовая инфузия 1-4 дни9 mg/m2 + 1000 ml - 0.9 % NaCl (или 5 % Glucosae) 24
часовая инфузия 1-4 днихametazon 40 mg/сут po. 1-4, 9-12, 17-20 дни
После второго курса контроль достижения
ремиссии. При отсутствии ответа на химиотерапию переход на альтернативные схемы
либо повторить курс еще 2-4 раза (всего суммарно 4 курсов).
Консолидация ремиссии включает 4 курса терапии с
интервалом 3 месяца.
Критерии достижения полного ответа, частичного
гематологического ответа:
|
sСR
самый полный ответ
|
|
CR
полный ответ
|
Отрицательный
результат на иммунофиксации белков плазмы и мочи, отсутствие плазмацитомы
мягких тканей, содержание плазматических клеток в костном мозге <5%.
|
|
VGRP
очень хороший частичный ответ
|
Снижение
М градиента в моче и в плазме на иммунофиксации более чем на 90% и снижение
белка Бенс-Джонса в моче менее 100 мг за 24 часа
|
|
PR
частичный ответ
|
Снижение
М градиента в моче и в плазме на иммунофиксации на 50% и снижение белка
Бенс-Джонса в моче до 200 мг за 24 часа, сокращение плазмацитомы мягких
тканей на 50%, и плазматические клетки в костном мозга менее 30%.
|
* Примечание: Этапы индукции ремиссии (за
исключением мобилизационного курса), консолидации ремиссии, поддерживающую
терапию, терапию в рецидиве или при первичной химиорезистентности проводят в
гематологических отделениях. Курс мобилизации ГСК с последующей их коллекцией,
а также курс кондиционирования (предтрансплантационный) с трансплантацией ГСК
проводят в центре трансплантологии.
этап. Мобилизация и коллекция (сбор) ГСК
Курс мобилизации проводится при достижении
ответа на терапию и принятии решения о трансплантации ГСК. Минимальный срок
после окончания последнего курса химиотерапии 2 недели.- 600 мг/м2 поверхности
тела в сутки внутривенно, 4-х дневная непрерывная инфузия;- 15 мг/м2
поверхности тела в сутки внутривенно, 4-х дневная непрерывная инфузия;- 40
мг/сутки внутрь в дни 1-4.- 4000мг/м2 поверхности тела в сутки 1 день,6g/m2
сутки 1 день.
С четвертого дня курса мобилизации начинают
введение Г-КСФ в дозе 5мкг/кг х 2раза в сут подкожно ежедневно до завершения
сбора достаточной для двух трансплантаций дозы ГСК (мононуклеарных клеток в
трансплантате - не менее 5х108/кг, CD34+ клеток - не менее 2х106/кг для одной
трансплантации). Коллекцию ГСК начинают при уровне CD34+ клеток в
периферической крови 20-40x109/л или в начале периода отстройки гемопоэза (на
уровне лейкоцитов периферической крови менее 5х109/л).этап - Фракционирование и
криоконсервация костного мозга.
После получения костно-мозговой суспензии
проводят ее фракционирование, которое заключается в удалении плазмы и
эритроцитов (аутоэритромаса на следующий день реинфузируется), с целью
получения концентрата костного мозга, который используется ех tempore для
криоконсервации (при аутотрансплантации костного мозга). Для криоконсервации
применяются программные охладители, в которых автоматически регулируется
процесс замораживания костного мозга. Для хранения чаще всего используется
жидкий азот с температурой -196 °С.
Замораживание и хранение ПСКК. Забранный
трансплантат подвергается сепарации путем седиментации с использованием
декстранов и криоконсервированию в жидком азоте с использованием 10% раствора
диметилсульфоксида (ДМСО) на программном замораживателе. Для оценки качества
ПСКК проводятся:
) определение количества CD34+ клеток методом
проточной цитофлуориметрии с использованием моноклональных антител;
) тест на колониеобразование CFU-GEMM;
) посев на стерильность.этап - Кондиционирование
и реинфузия костного мозга.
Через 24-48 ч по окончании кондиционирования
внутривенно (через центральный катетер) вводится размороженный (при аутотрансплантации)
костный мозг.
В день трансплантации (день 0) пакеты с
замороженным трансплантатом, находящиеся в емкости с жидким азотом,
доставляются в палату. Размораживание пакетов производится в асептических
условиях в водяной бане при температуре 37oС непосредственно перед реинфузией
взвеси гемопоэтических стволовых клеток пациенту. Реинфузия осуществляется
шприцами емкостью 50 мл в центральный венозный катетер струйно в течении
8-10мин. В связи с низкой температурой инфузируемых клеток и угрозой развития
осложнений необходимо проведение мониторинга показателей деятельности
сердечно-сосудистой системы. Реинфузия размороженных клеток часто
сопровождается незначительным гемолизом, требующим контроля уровня гемоглобина
и эритроцитов крови, а также выполнения серии общих анализов мочи.этап -
Возобновление костно-мозгового кроветворения.
Это сложный и длительный период (в среднем от 3
до 6 недель). Приживлення костного мозга контролируется проведением стернальных
пункций и трепанобиопсий. Данный этап характеризуется развитием глубокой
нейтропении, тромбоцитопении и высоким риском осложнений, в первую очередь
инфекционных и геморрагических.
В этой главе мы определили необходимые условия
для проведения аутологичной трансплантации гемопоэтических стволовых клеток, адаптированные
для центра трансплантации костного мозга на базе Научно-Исследовательского
Института Гематологии и Переливания Крови в Республике Узбекистан
Исходя из выше изложенного, нами в полном объеме
разработаны поэтапно и пошагово все этапы проведения аутологичной
трансплантации:
Предтрансплантационная подготовка
Индукция ремиссии - проведение курсов ПХТ
больным с ММ
Мобилизация гемопоэтических стволовых клеток
Фракционирование и криоконсервация
Реинфузия гемопоэтических стволовых клеток
Возобновление костно-мозгового кровообращения
Все этапы проведения ТГСК будут включены в
Положение о проведении трансплантации костного мозга в Республике Узбекистан.
3.2 Показания и противопоказания к
проведению аутоТКМ у больных множественной миеломой
Не существует экстренных показаний к выполнению
того или иного вида ТГСК. Всегда необходима подготовка, в том числе
психологическая, пациента и его родственников. При этом выбор метода лечения
часто бывает сложным за счет того, что методы ТГСК, приводящие к полному излечению
пациента, более опасны, особенно на ранних этапах, по сравнению с
полихимиотерапией (ПХТ) - менее интенсивной и безопасной терапией, но
неэффективной в плане долгосрочного прогноза.
Современные показания к ТКМ в общем виде
формулируются следующим образом:
Острый и хронический миелолейкоз в первой
клинико-гематологической ремиссии являются показаниями для аллоТКМ.
Множественная миелома. В программе терапии
первой линии (у больных до 70 лет) применяется аутоТКМ при ММ неблагоприятного
прогноза (у больных до 60 лет) стандартом лечения является аллоТКМ от
HLA-совместимого родственного донора.
Хронический лимфолейкоз не имеет стандартных
показаний для высокодозной химиотерапии, но в связи с появлением пациентов, у
которых удается достигать ремиссию современными схемами терапии, включающими
моноклональные антитела, в рамках исследовательских протоколов возможна
консолидация первой ремиссии аутоТКМ и аллоТКМ (в возрастных группах до 55 и до
45 лет соответственно).
Индолентные лимфомы. Стандартные показания к проведению
аутоТКМ имеются у всех пациенты (до 60 летнего возраста) во второй ремиссии. В
рамках исследовательского протокола для консолидации первой ремиссии аутоТКМ
может выполняться в возрасте до 55 лет, аллоТКМ - до 45 лет.
Лимфома мантийной зоны. Все больные до 60 лет
имеют стандартные показания к аутоТКМ в программе терапии первой линии. Если
больной моложе 55 лет имеет родственного HLA-совместимого донора, должна быть
выполнена аллоТКМ.
Агрессивные неходжкинские лимфомы. Стандартными
показаниями к аутоТКМ является вторая ремиссия (у больных до 60 лет), к аллоТКМ
- первичная рефрактерность или рецидив после аутоТКМ (у больных до 55 лет).
АутоТКМ в рамках исследовательского протокола может выполняться для
консолидации первой ремиссии заболевания у пациентов до 60 лет, имеющих III-IV
стадию болезни и IPI >2.
Лимфогранулематоз. Стандартными показаниями к
аутоТКМ является первый ранний химиочувствительный рецидив (сроки рецидива 3-12
мес.) и первая ремиссия, полученная на химиотерапии второй линии.
В качестве «терапии отчаяния» АутоТКМ может
рассматриваться при нехимиочувствительных рецидивах, первичной рефрактерности,
в третьей и более ремиссии любого лимфопролиферативного заболевания. Решение о
проведении лечения принимается индивидуально в связи с малой эффективностью и
высокой токсичностью данного метода.
Показания к проведению аутологичной
трансплантации для больного множественной миеломой
. Подтвержденный клинически и лабораторно
диагноз ММ
. Достижение полной ремиссии (CR), частичной
ремиссии (PR), гематологического ответа (HR).
. Возраст от 18 до 65 лет.
. Нормальные показатели клинико-лабораторного
Обследования (ОАК (19 параметров), Б\х, элeктролиты (К, Na, Mg, Ca, P),
Коагулограмма, Стернальная пункция и трепанобиопсия, Белок Бенс-Джонса мочи,
Маркеры гепатита. ВИЧ. TORCH, ЭКГ, ЭХО-КГ,CRP, RF, Ig [M.M] RW,бруцелез.
. Способность к самообслуживанию и передвижению
в пространстве без посторонней помощи.
. Достаточная мотивация пациента.
Противопоказания к проведению аутологичной
трансплантации
. Беременность.
. Кормление грудью.
.Тяжелые сопутствующие заболевания (застойная
сердечная недостаточность, нестабильная стенокардия, нарушения ритма сердца и
проводимости миокарда, инфаркт миокарда, пневмония, почечная, печеночная
недостаточность, сепсис, кровотечения, психические нарушения,
декомпенсированный сахарный диабет, физическая несостоятельность, кахексия).
. Выраженные отклонения от нормальных
возрастно-половых показателей клинико-лабораторного обследования
. Угрожающие жизни кровотечения (желудочно-кишечного
тракта, маточные, кровоизлияния в головной мозг).
. Тяжелые психические нарушения (бред,
выраженный депрессивный синдром).
. Сопутствующие онкологические заболевания.
. Наличие любого острого либо обострение
хронического воспалительного процесса.
3.3 Круг необходимых исследований
для отбора больных с ММ на аутоТКМ и мониторинг основных систем
Обследование больного перед трансплантацией ГСК
Обследование проводится не позднее, чем за 3
недели до ТГСК:
.Группа крови
.ОАК (19 параметров)
.Б\х, АК (билирубин, аспартат-аминотрансфераза
(АсАТ), аланин-аминотрансфераза (АлАТ), мочевина, креатинин, глюкоза, общий
белок, лактатдегидрогеназа (ЛДГ) К, Na, Mg, Ca, P)
. Коагулограмма
. Стернальная пункция и трепанобиопсия
. Белок Бенс-Джонса мочи, элетрофорез белков
. Обязательные исследования на наличие: антител
к вирусам иммунодефицита человека (HIV); гепатита С (анти-HCV);
цитомегаловируса (CMV); вируса Эпштейна-Барр (EBV); вируса простого герпеса
(HSV); антигена вируса гепатита В (HBsAg);
. ЭКГ
. ЭХО-КГ
. УЗИ органов брюшной полости и почек;
. Неврологический статус;
. Рентгеногрфия легких. черепа
. Исследования по особым показаниям:
количественное или качественное определение ДНК/РНК вирусов гепатита А, В, С,
D, G; ДНК цитомегаловируса; вируса Эпштейн-Барр; антител к вирусам гепатита В
(анти-HBsAg) и другим вирусам или бактериям.
. Комплекс серологических реакций на сифилис
(микрореакция преципитации с сывороткой крови или тест быстрых плазменных
реагинов+реакция пассивной гемагглютинации+реакция иммунофлюоресценции с
абсорбцией)
. Гормоны щ\ж - по показаниям
. CRP, RF, Ig [M.M] RW, бруцелез.
. Электрофорез белков [M.M]
. Рост и вес
. Консультации узких специалистов (с
заключением): • хирурга (перенесенные операции, настоящая патология) •
стоматолога (санация полости рта) • гинеколога (УЗИ матки, придатков) • уролога
(УЗИ предстательной железы) • проктолога по показаниям • терапевта (с
изложением полного медицинского анамнеза объективного статуса, принимаемых
препаратов), наличие артериальной гипертензии. • эндокринолога
. психологическая подготовка донора, беседа с
родителями о возможных осложнениях от операции забора КМ, получение письменного
согласия донора или родителей (опекунов) - у несовершеннолетних;
Мониторинг состояния пациентов
Терапия кондиционирования, обладая высокой
цитостатической и иммуносупрессивной активностью, вызывает токсические эффекты,
что требует обязательного динамического наблюдения за состоянием органов и
систем организма. С целью минимизации токсических осложнений применяется
алгоритм мониторного наблюдения за состоянием пациента в течение проведения
протокола кондиционирования и последующего нейтропенического периода,
включающий:
температура тела, пульс, артериальное давление,
частота дыхания, центральное венозное давление - 4-6 раза/сут;
масса тела пациента - 1-2 раза в сутки;
подсчет объемов пищи и выпитой жидкости за сутки
- ежедневно;
суточный диурез - ежедневно;
стул - объем и кратность в течение суток -
ежедневно;
анализ крови общий - ежедневно;
анализ мочи общий - ежедневно;
биохимическое исследование крови: билирубин,
мочевина, креатинин; АсАТ, АлАТ, глюкоза, натрий, калий, магний, кальций -
ежедневно;
исследование показателей гемостаза - 2 раза в
неделю; с агрегацией - по показаниям;
уровень калия, натрия, мочевины, при необходимости
- глюкозы, в суточной моче - ежедневно;
гемоглобин плазмы, ЛДГ, щелочная фосфатаза
(далее-ЩФ), ГГТП, С-реактивный белок, мочевая кислота, метаболизм железа,
амилаза, клиренс креатинина - 1 раз в неделю;
протеинограмма, иммуноглобулины крови - 1 раз в
неделю;
ЭКГ; рентгенография органов грудной полости - 1
раз в неделю и по показаниям;
маркеры гепатитов В, С, дельта; ЦМВ, ЭБВ, вируса
простого герпеса;
бактериологическое исследование - посевы из 7
эпитопов (зев; надключичная, подмышечная, паховая, перианальная области;
область препуциального кольца или влагалища; ануса) - 1 раз в неделю;
дополнительные методы обследования - по
показаниям.
Рекомендуемый режим мониторинга
клинико-лабораторных показателей у больного в посттрансплантационном периоде
|
Клинико-лабораторный
показатель
|
Продолжительность
периода мониторирования (месяцы)
|
Кратность
|
Примечание
|
|
ОАК
(19 параметров)
|
12
|
4
раз в месяц
|
Далее
по показаниям
|
|
Б\х,
элeктролиты (К, Na, Mg, Ca, P)
|
12
|
2
раза в месяц
|
по
показаниям
|
|
Коагулограмма
|
12
|
2
раза в месяц
|
по
показаниям
|
|
Стернальная
пункция и трепанобиопсия
|
12
|
По
показаниям
|
по
показаниям
|
|
Белок
Бенс-Джонса мочи, элетрофорез белков мочи
|
12
|
2
раза в месяц
|
по
показаниям
|
|
ЭКГ
|
12
|
2
раза в месяц
|
по
показаниям
|
|
УЗИ
|
12
|
1
раз в месяц
|
по
показаниям
|
|
Консультации
узких специалистов
|
12
|
по
показаниям
|
по
показаниям
|
Таким образом, мы разработали все необходимые
параметры для обследования больного с ММ до проведения ТКМ, а также мониторинг
основных систем проводимый после процедуры ТГСК (которые соответствуют с
рекомендациями Европейской Ассоциации трансплантологов EBMT).
3.4 Подготовить больного с
Множественной Миеломой к аутоТКМ и разработать критерии определения
эффективности аутоТКМ
Подготовка больного к проведению аутологичной
пересадки костного мозга
Гематологической трансплантационной бригадой
НИИГ и ПК было обследовано 50 пациентов с верифицированным по основным
критериям диагнозом ММ из них было отобрано 11 первичных больных, по
результатам обследования была определена стадия и форма заболевания. Всем
больным были проведены следующие обследования: определение обще-соматичекого
статуса, общий анализ крови, мочи, биохимический анализ крови, коагулограмма,
стернальная пункция, электрофорез белковых фракций, определение иммунного
статуса, УЗИ внутренних органов, ЭКГ, рентгенограмма.
Клинико-лабораторные исследования больных при
установлении диагноза ММ
|
Больные
Критерии
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
|
ОАК:
Гемоглобин г/л
|
70
|
110
|
118
|
86
|
120
|
76
|
88
|
105
|
115
|
86
|
77
|
|
Эритроциты
10^12
|
2.2
|
3.6
|
2.8
|
3.1
|
2.5
|
4.0
|
2.7
|
2.9
|
3.3
|
2.8
|
3.1
|
|
Тромбоциты
1:1000, тыс
|
63
138
|
50
180
|
42
117
|
56
173
|
58
145
|
46
184
|
50
135
|
55
160
|
45
149
|
65
182
|
30
93
|
|
Лейкоциты
10^9
|
4.9
|
3.8
|
2.7
|
5.3
|
6.2
|
3.5
|
2.9
|
3.4
|
2.8
|
9.6
|
12.2
|
|
СОЭ
мм/час
|
25
|
40
|
45
|
38
|
18
|
28
|
40
|
45
|
70
|
65
|
80
|
|
Костный
мозг: плазматические клетки %
|
73
|
78
|
26
|
37
|
42
|
71
|
65
|
46
|
49
|
56
|
58
|
|
Биохимия:
Общий белок г/л
|
123
|
118
|
98
|
137
|
110
|
115
|
112
|
125
|
100
|
119
|
114
|
|
Кальций
ммоль/л
|
5.0
|
4.6
|
3.3
|
6.8
|
4.8
|
6.1
|
3.2
|
4.9
|
7.1
|
6.2
|
6.5
|
|
Мочевина
ммоль/л
|
6.8
|
8.0
|
12.0
|
7.3
|
5.9
|
4.8
|
6.0
|
5.1
|
14.3
|
16.8
|
14.0
|
|
Креатинин
мкмоль/л
|
76.8
|
82.2
|
115.2
|
98.3
|
167.9
|
68.1
|
84.9
|
100.7
|
164.3
|
156.0
|
147.0
|
|
Остаточный
азот ммоль/л
|
2.7
|
1.8
|
4.1
|
4.5
|
7.2
|
2.5
|
3.4
|
4.7
|
6.9
|
6.2
|
8.4
|
|
Белок
Бенс -Джонса +++
|
-
|
-
|
++
|
+
|
-
|
-
|
-
|
-
|
+
|
++
|
++
|
В данной таблице приведены клинико -
лабораторные изменения у 11 исследуемых нами больных, в таблицу включены
показатели характерные для установления диагноза множественной миеломы а также
стадии заболевания. У всех исследуемых больных имеется анемический синдром, у 3
больных отмечалась анемия средней степени. У 10 обследованных больных - СОЭ
более 30мм/час. У 4 больных имела место изменение почечных показателей, которое
выражалось в виде повышения уровня мочевины, креатинина, остаточного азота в
крови. При изучении миелограммы у всех 11 больных - пунктат костного мозга был
умеренно или достаточно клеточен, тип кроветворения - нормобластический,
увеличено количество плазмоцитов и лимфоцитов, мегакариоцитов - достаточно. У 5
больных из 11 был выявлен белок Бенс Джонса в моче.
Электофорез белковых фракций больной
Рис. 2
На изображении первый пик - фракция альбумина,
второй - альфа 1, третий - альфа 2, четвертый - М градиент в гамма фракции,
который в норме не должен присутствовать.
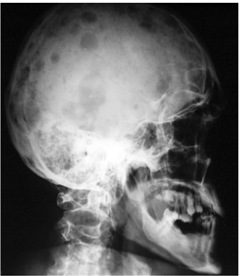
Рис. 3
Изменения в костях черепа у больной. На рентгенограмме
отчетливо видны очаги деструкции плоских костей черепа.
Клинико-лабораторные исследования 11 больных
отобранных на аутоТКМ после получения ПХТ
|
Больные
Критерии
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
|
ОАК:
Гемоглобин г/л
|
86
|
100
|
120
|
110
|
126
|
70
|
90
|
105
|
125
|
90
|
65
|
|
Эритроциты
10^12
|
3.2
|
2.7
|
3.8
|
3.2
|
3.5
|
3.0
|
2.9
|
4.1
|
3.0
|
2.6
|
2.1
|
|
Тромбоциты
1:1000, тыс
|
53
169
|
48
129
|
52
197
|
50
160
|
58
203
|
44
132
|
50
145
|
50
225
|
46
138
|
55
143
|
38
80
|
4.6
|
1.8
|
5.7
|
5.9
|
6.0
|
2.5
|
1.9
|
5.4
|
11.8
|
9.0
|
10.7
|
|
СОЭ
мм/час
|
30
|
45
|
30
|
18
|
26
|
18
|
50
|
15
|
65
|
50
|
80
|
|
Костный
мозг: плазматические клетки %
|
73
|
78
|
5
|
28
|
20
|
71
|
65
|
5
|
49
|
56
|
58
|
|
Биохимия:
Общий белок г/л
|
120
|
108
|
78
|
100
|
90
|
110
|
92
|
86
|
100
|
95
|
70
|
|
Кальций
ммоль/л
|
4.0
|
5.6
|
3.3
|
2.8
|
3.8
|
5.2
|
4.3
|
2.9
|
7.0
|
6.1
|
6.6
|
|
Мочевина
ммоль/л
|
8.0
|
8.7
|
10.0
|
7.9
|
6.0
|
11.8
|
12.0
|
5.9
|
14.1
|
16.6
|
14.9
|
|
Креатинин
мкмоль/л
|
76.0
|
80.2
|
115.0
|
98.1
|
127.9
|
108.7
|
168.9
|
100.9
|
184.3
|
196.0
|
157.0
|
|
Остаточный
азот ммоль/л
|
2.8
|
2.0
|
3.1
|
3.5
|
4.2
|
2.5
|
3.4
|
4.1
|
6.8
|
7.2
|
8.4
|
|
Белок
Бенс -Джонса +++
|
-
|
-
|
-
|
+
|
-
|
-
|
-
|
-
|
+
|
++
|
++
|
Из данной таблицы видно, что 2 пациента после 4
курсов VAD находятся в состоянии частичной (PR) ремиссии - пациент 4 и 5,
оценка проводилась по уменьшению плазматических клеток в пунктате костного
мозга до 30%, и уменьшению патологического белка Бенс -Джонса в моче более чем
на 50% от исходного уровня. А также 2 пациента в состоянии полной ремиссии
(CR). У них наблюдалось полная нормализация всех показателей, плазматеческие
клетки в миелограмме составили менее 5%, и отсутствие патологического белка в
моче. У оставшихся пациентов наблюдалось клинико - гематологическое улучшение.
Одной больной был произведен контрольный режим
мобилизации стволовых клеток с помощью гранулоцитарного колоние -
стимулирующего фактора (G-CSF).
|
Показатели
|
1
день
|
2
день
|
3
день
|
4
день
|
5
день
|
|
Лейкоциты,
109/л
|
5,4
|
17,1
|
18,7
|
20,3
|
23,5
|
|
Гранулоциты,
%
|
72
|
76
|
72
|
84
|
84
|
Введение G-CSF больная перенесла относительно
удовлетворительно. G-CSF вводился 2 раза в день из расчета на массу тела -
5мг/кг в сутки п/к. ОАК проводился ежедневно утром, целевым уровнем было достижение
лейкоцитов более 20х10^9. Необходимое количество лейкоцитов было достигнуто к 4
дню.
Таким образом, представленные нами схемы
обследования больных и предтрансплантационной ПХТ для осуществления
аутологичной трансплантации гемопоэтических стволовых клеток показали их
обоснованность, целесообразность и высокую эффективность, что доказано на
примере 11 больных с Множественной миеломой, которые получили индукционный курс
по протоколу VAD, 2 больных достигли CR и 2 больных достигли PR. 4 больным
выбран режим мобилизации стволовых клеток G-CSF.
Эффективность определения проводимой ауто ТГСК
Высокодозная химиотерапия, и следующая за ней
аутологичная пересадка костного мозга, увеличивает общую выживаемость по
сравнению со стандартной ПХТ, что доказано в проспективных рандомизированных
исследованиях, проведенных французскими (IFM) и английскими (MRC) группами
исследователей. То же самое доказано американской группой исследователей
(SWOG9321).
Под восстановлением гемопоэза понимают
достижение абсолютного числа нейтрофилов >0,5x10^9/л и уровня тромбоцитов
>20x10^9/л, независимого от трансфузий, в течение как минимум 3-х
последовательных дней. Медиана восстановления числа нейтрофилов и тромбоцитов
при использовании клеток предшественников гемопоэза из периферической крови
приходится на 14 и 20 дни.
Восстановление числа гранулоцитов и тромбоцитов
являются двумя ключевыми показателями, свидетельствующими об успешном
восстановлении гемопоэза после пересадки стволовых гемопоэтических клеток.
День переливания ГСК обозначается как день 0
трансплантации. Восстановление гранулоцитов определяется как первые три
последовательных дня, когда абсолютное число нейтрофилов превышает 500/мм^3.
Восстановление тромбоцитов может определяться как первый день в который число
тромбоцитов достигает и остается свыше 20:1000 без переливания, или первый
день, когда число тромбоцитов достигает 50:1000 без трансфузии тромбоцитов
|
Дни
Критерии
|
14-18
|
21-25
|
35-40
|
60-65
|
90-120
|
|
Нейтрофилы.
х 10^9
|
0,5
|
1
|
4
|
4-9
|
4-9
|
|
Тромбоциты.
:1000
|
Ед
5-10:1000
|
10-20:1000
|
20-50:1000
|
50:1000
|
50:1000
|
Эффективность лечения также оценивают по
изменению уровня парапротеина в сыворотке или по экскреции легких цепей
иммуноглобулинов с мочой. Обязательный критерий - отсутствие новых очагов
поражения в органах и тканях. Критерии, представленные в таблице составлены на
основе критериев Международной рабочей группы по множественной миеломе (Bladé
et al., 1998). Признак полной ремиссии -
исчезновение парапротеина по данным иммунофиксационного электрофореза. Если
парапротеин не выявляется при обычном электрофорезе, но по-прежнему
обнаруживается при электрофорезе с иммунофиксацией, прогноз такой же, как и у
больных с частичной ремиссией, в то время как при отрицательном результате
электрофореза с иммунофиксацией прогноз значительно лучше (Lahuerta et al,
2000; Davies et al, 2001). Таким образом, если при обычном электрофорезе
парапротеин не определяется, проводят иммунофиксационный электрофорез.
Исследование костного мозга необходимо только
для подтверждения полной ремиссии и для оценки эффективности лечения при
несекретирующей форме множественной миеломы. В таблице содержатся также
критерии рецидива и прогрессирования. Рецидив - это возобновление заболевания
после полной ремиссии; если полной ремиссии не было, говорят о прогрессировании
болезни.
Критерии достижения полного ответа и частичного
гематологического ответа:
|
sСR
самый полный ответ
|
Нормальное
содержание легких цепей, отсутствие плазматических клеток в костном мозге,
отсутствие отклонений по данным иммуногистохимического и
иммунофлюоресцентного анализов.
|
|
CR
полный ответ
|
Отрицательный
результат на иммунофиксации белков плазмы и мочи, отсутствие плазмацитомы
мягких тканей, содержание плазматических клеток в костном мозге < 5%.
|
|
VGRP
очень хороший частичный ответ
|
Снижение
М градиента в моче и в плазме на иммунофиксации более чем на 90% и снижение
белка Бенс-Джонса в моче менее 100 мг за 24 часа.
|
|
PR
частичный ответ
|
Снижение
М градиента в моче и в плазме на иммунофиксации на 50% и снижение белка
Бенс-Джонса в моче до 200 мг за 24 часа, сокращение плазмацитомы мягких
тканей на 50%, и наличие плазматических клеток в костном мозге - менее 30%.
|
|
Отсутствие
эффекта
|
Не
отвечает ни критериям частичного ответа ни критериям прогрессирования
|
|
Стабилизация
|
Нет
признаков продолжающегося поражения органов и тканей; изменение уровня
парапротеина в сыворотке и экскреции легких цепей с мочой менее чем на 25% в
течение 3 мес
|
|
Прогрессирование
|
Нарастание
поражения органов и тканей (несмотря на лечение или после достижения
стабилизации); повышение уровня парапротеина в сыворотке более чем на 25%
(более 5 г/л), либо увеличение экскреции парапротеина с мочой более чем на
25% (более 200 мг/сут), либо увеличение доли плазматических клеток в костном
мозге более чем на 25% (абсолютное число - не менее10%)в
|
|
Рецедив
|
Повторное
появление признаков заболевания, включая повышение уровня парапротеина,
определяемого с помощью иммунофиксационного электрофореза, на фоне полной
ремиссии
|
В соответствии с критериями Европейской
исследовательской групп по трансплантации костного мозга и стволовых клеток
крови, Регистра Международного общества по трансплантации костного мозга и
Регистра по аутотрансплантации костного мозга и стволовых клеток.
Хотя полная ремиссия после аутоТКМ -
благоприятный прогностический фактор для продолжительности ремиссии и
выживаемости (Lahuertaetal., 2000; Daviesetal, 2001), пока не доказано, что
целью лечения должно быть именно достижение полной ремиссии. У каждого
четвертого больного со снижением уровня парапротеина менее чем на 50% на фоне
стандартной химиотерапии и у каждого десятого больного со снижением уровня
парапротеина менее чем на 25% достигается стабилизация; прогноз в таких случаях
не хуже, чем при снижении уровня парапротеина на 50% и более (Olojohun-gbe et
al, 1996; Durie et al, 2004a).
Таким образом, нами определены условия и этапы
проведения трансплантации костного мозга, показания и противопоказания к ней,
разработаны в полном объеме критерии определения эффективности аутологичной
пересадки гемопоэтических стволовых клеток, а также критерии достижения
полного, частичного эффектов, критерии прогрессирования и рецидива заболевания.
Каждый из этих и будущих этапов важен для
грамотной оценки результатов работы. С этой целью должны вестись записи каждого
этапа лечения пациентов, которым проводится трансплантация ГСК. Это включает
мониторинг деталей забора, обработки, тестирования, криоконсервирования,
хранения, инфузии или использования препаратов ГСК. Вся информация о пациентах
составляет врачебную тайну, является конфиденциальной и должна быть защищена;
публикации исследований не должны раскрывать личности больного.
В ходе работы были определены необходимые
условия для проведения аутологичной трансплантации гемопоэтических стволовых
клеток, адаптированные для центра трансплантации костного мозга на базе
Научно-Исследовательского Института Гематологии и Переливания Крови в
Республике Узбекистан.
Совместно с Минестерством Здравоохранения
Республики Узбекистан и ТИКА открыто отделение соответствующее требованиям
Европейской исследовательской группой по трансплантации костного мозга и
стволовых клеток крови, оснащенное всем необходимым для оказания
онкогематологическим больным высокоспециализированной помощи.
Разработан алгоритм преемственности лечения,
поддерживалась тесная связь между гематологической бригадой, диагностическими и
специализированными службами помощи.
Из протоколов лечения и мобилизации клеток для
ауто ТКМ при ММ рекомендованных Британской Ассоциацией гематологов и Российской
Научной Иссследовательской группой по ММ выбраны курсы ПХТ наиболее доступные в
условиях Узбекистана. Учитывались региональные особенности страны, перечень
зарегистрированных препаратов и клинические условия. Разработаны совместно с
научной группой НИИГ и ПК методы фракционирования и криоконсервации стволовых
клеток.
ВЫВОДЫ
. Для проведения аутологичной пересадки костного
мозга нами были определены и адаптированы для условий центра ТКМ при НИИГ и ПК
6 последовательных этапов данной операции:Этап. Предтрансплантационная
подготовка.Этап. Индукция ремиссииэтап. Мобилизация и коллекция ГСКэтап.
Фракционирование и криоконсервация
костного мозга.этап. Консолидация и реинфузия
костного мозгаэтап Возобновление костно-мозгового кроветворения
. Нами были выбраны показания и противопоказания
для пациентов с ММ по которым они могут быть выбраны для операции ТКМ
. Проведенные нами исследования показали что
следующие критерии: подтвержденный клинически и лабораторно диагноз ММ; больные
с ММ которые в индукционном курсе терапии ПХТ не получали препараты: Мелфалан, Леналидомид,
так как они утяжеляют сбор ГСК; достижение полной ремиссии (CR), частичной
ремиссии (PR), гематологического ответа (HR); Возраст от 18 до 65 лет; больные
с ММ без тяжелой сопутствующей патологии (заболевания сердца; заболевания
бронхо-легочной системы; с неврологической и/или психиатрической патологией; в
острый период инфекционных заболеваний; с профессиональными патологическими
заболеваниями - которые сопровождаются снижением иммунного статуса организма;);
нормальные возрастно-половые показатели клинико-лабораторного обследования;
способность к самообслуживанию и передвижению в пространстве без посторонней
помощи; достаточная мотивация пациента; - являются показаниями для проведения
аутологичной трансплантации гемопоэтических стволовых клеток при ММ (что
совпадает с данными зарубежных исследователей)
. Представленные нами схемы обследования больных
и предтрансплантационной ПХТ для осуществления аутологичной трансплантации
гемопоэтических стволовых клеток показали их обоснованность, целесообразность и
высокую эффективность, что доказано на примере 11 больных с Множественной
миеломой, которые получили индукционный курс по протоколу VAD, 2 больных
достигли CR и 2 больных достигли PR. 4 больным выбран режим мобилизации
стволовых клеток G-CSF.
Нами разработана схема для врачей гематологов, с
помощью которой они смогут направить пациента с Множественной миеломой на
аутотрансплантацию гемопоэтических стволовых клеток.
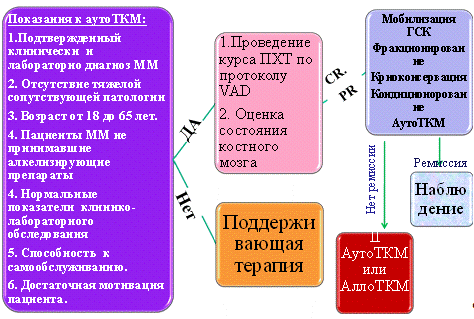
Рис. 4
Диагностика множественной миеломы
|
1.
|
MGUS
|
Секреция
моноклональных белков < 3 г/дл, плазматические клетки костного мозга
<10%, и отсутствие поражения органов-мишеней, таких как остеолитические
поражения костей, анемия, гиперкальциемия, или почечная недостаточность,
которые служат симптомами пролиферации плазматических клеток.
|
|
2.
|
SMM
(также называется бессимптомная множественная миелома)
|
Секреция
моноклональных белков (IgG и IgA) ≥ 3 г/дл и/или содержание
плазматических клеток костного мозга ≥ 10%, и отсутствие поражения
органов-мишеней, таких как остеолитические поражения костей, анемия,
гиперкальциемия, или почечная недостаточность, которые служат симптомами
пролиферации плазматических клеток.
|
|
3.
|
Множественная
миелома
|
Содержание
плазматических клеток костного мозга <10%, с наличием в сыворотке крови и
/ или моче моноклональных белков (за исключением больных с истинной
несекретирующей миеломой), а также свидетельства остеолитических поражений
костей, анемия, гиперкальциемия или почечная недостаточность, которая может
быть отнесена к основным симптомам пролиферативного расстройства плазмацитов.
|
|
4.
|
Одиночная
плазмоцитома
|
Доказанное
биопсией изолированное поражение костей или мягких тканей плазмоцитами и
отсутствие МРТ поражения позвоночника и таза, а также отсутствие симптомов,
таких как анемия, гиперкальциемия, почечной недостаточности, или
дополнительных литических поражений костей, которые могут быть отнесены к
основным симптомам пролиферативного расстройства плазмацитов.
|
* Примечание: лечение требуется для ММ(3) и
плазмацитомы (4). В случае SMM (2) MGUS (1) тактика наблюдения.
костный мозг трансплантация
Система стадирования при множественной миеломе
(Таблица № 2)
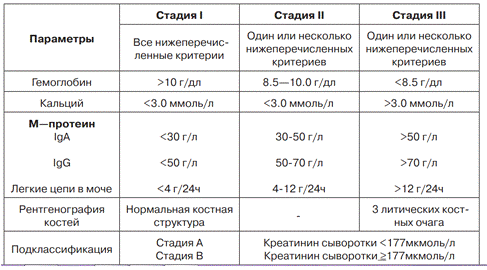
СПИСОК СОКРАЩЕНИЙ
Ауто-ТГСКК - трансплантация аутологичных
гемопоэтических стволовых клеток крови
Алло-ТГСКК - трансплантация аллогенных
гемопоэтических стволовых клеток крови
ВОЗ - Всемирная организация здравоохранения
Г-КСФ - гранулоцитарный колониестимулирующий
фактор
ГСКК - гемопоэтические стволовые клетки крови
ЕГТКМ - европейская группа трансплантации
костного мозга
ИГХ-исследование - иммупогистохимическиое
исследование
КМ - костный мозг
МКА - Моноклональные антитела
ММ - множественная миелома
МПО - миелопероксидаза
НИИГиПК - научно исследовательский институт
гематологии и переливания крови
ОЛЛ - острый лимфобластный лейкоз
ОМЛ - острый миелобластный лейкоз
охЧР - очень хорошая частичная ремиссия
ТКМ - трансплантация костного мозга
ПР(CR) - полная ремиссия
ПХТ - полихимиотерапия
ЧР (PR)- частичная ремиссиякластер
дифференцировки- иммнуглобулин- гематологический ответ- курс ПХТ: винкристин,
доксорубицин, дексаметазон
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Абдулкадыров
К.Т., Шебалин В.Н. Трансплантация костного мозга. Медицина - 2004г №7 С21-28.
. Андреева
Л.Ю., Тупицын H.H., Кадагидзе З.Г. и соавт. Стволовые гемопоэтические клетки в
крови онкологических больных: экспрессия CD34 и колониеобразование/ЛГематология
и трансфузиология.- 1999.-Т.44,№4.-С.З-11.
. Гайдамака
Н.В. Гистологический мониторинг кроветворной ткани у больных острыми лейкозами
на фоне современной химиотерапии: Автореф. дис. . канд. мед.
наук.-М.,2010.-24С.
. Голышевская
В.И., Егорова О.В., Севастьянова Э.В. и соавт. Люминесцентная микроскопия.
Учебное пособие для проведения курсов обучения. М.,2008. - 36С.
. Зубаровская
Л.С., Семенова Е.В., Бабенко Е.В и соавт. Эффективность мобилизации
периферических стволовых клеток крови с помощью препарата лейкостим у больных
злокачественными новообразованиями /Юнкогематология.-2008.-№1.-С.70-75.
. Краевский
H.A., Неменова Н.М., Хохлова М.П. Патологическая анатомия и вопросы патогенеза
лейкозов.-М.,1965.-С.246-259.
. Менделеева
Л.П., Митиш Н.Е., Клясова Г.А. и соавт. Инфекционные осложнения после
трансплантации аутологичных гемопоэтических клеток при
гемобластозах//Терапевтический архив.-2005.-Том77,№7.-С.33-39.
. Менделеева
Л.П., Савченко В.Г., Павлова O.A. и соавт. Мобилизация гранулоцитарным
колониестимулирующим фактором аутологичных гемопоэтических клеток крови у
больных лимфомами и раком молочной железы/Проблемы
гематологии.-1999.-№4.-С.5-12.
. .Менделеева
Л.П, О.С.Покровская, Е.О.Грибанова, Т.В.Гапонова, Е.И.Желнова, М.В.Анухина,
Е.С.Урнова, Е.Ю.Варламова, Н.Н.Кали нин, Е.М.Грецов, В.Г.Савченко. Высокодозная
химиотерапия с последующей аутотрансплантацией у пожилых больных множественной
миеломой// Клиническая геронтология.-2007.- №4.- С. 20-24.
. Павлова
O.A. Мобилизация и трансплантация аутологичных гемопоэтических клеток у больных
лимфопролиферативными заболеваниями: Автореф. дис.канд. мед.
наук.-М.-2001.-24С.
. Покровская
Покровская О.С., Менделеева Л.П., Урнова Е.С., Гапонова Т.В., Грибанова Е.О.,
Алексеева И.В., Дроков М.Ю., Калинин Н.Н., Грецов Е.М., Клясова Г.А., Савченко
В.Г. Оптимизация режимов мобилизации гемопоэтических стволовых клеток крови у
больных множественной миеломой//Терапевтический архив.-2011.-Т.83.-№7.- С.
50-57
. Рощина
JI.C. Патоморфология множественной миеломы по данным трепанобиопсий костного
мозга (диагностическое и прогностическое значение): Автореф. дис. .канд. мед.
наук.-М.,1992.-25С.
. Руководство
по гематологии. Под редакцией академика А.И. Воробьева.-М.,2007.-С.57.
. Румянцев
А.Г., Масчан A.A. Трансплантация гемопоэтических стволовых клеток у детей:
Руководство для врачей. - М.,2003.-С.86-99.
. Румянцев
С.А., Владимирская Е.Б., Румянцев А.Г. Механизмы Г-КСФ-индуцированной
мобилизации гемопоэтических стволовых клеток // Вопросы гематологии/онкологии и
иммунопатологии в педиатрии. - 2003. - Т.2, №4.-С.5-9.
. Савченко
В.Т. Терапевтический архив 2009 №5 С 12-17
. Усс
Л.Г. Перспективы трансплантации костного мозга. Медицина 2005 №3 С. 19-22
. Чертков
И.Л., Дризе Н.И., Воробьев А.И. Схема кроветворения: 2005//Терапевтический
архив.-2006.-Т.77,№7.-С.5-11.
19. Aceñero
M.J., Gonzales J.F., Gallego G.M. et al. Vascular enumeration as a significant
prognosticator for invasive breast carcinoma//J. Clin. Oncol.-1998.-Vol. 165,№5
.-P. 1684-1688.
. Adams
G.B., Martin R.P., Alley I.R. et al. Therapeutic targeting of a stem cell
niche//Nat. Biotechnol.-2007.-Vol.25,№2.-P.23 8-243.
. Adler
B.K., Salzman D.E., Carabasi M.H. et al. Fatal sickle cell crisis after
granulocyte colony-stimulating factor
administration//Blood.-2001.-Vol.97,№10.-P.3313-3314.
. Aguayo
A., Kantarjian H., Estey E.H. et al. Plasma vascular endothelial growth factor
levels have prognostic significance in patients with acute myeloid leukemia but
not in patients with myelodysplastic
syndromes//Cancer.-2002.-Vol.95,№5.-P.1923-1930.
. Alegre
A., Tomas J.P., Martfnez-Chamorro C. Comparison of peripheral blood progenitor cell
mobilization in patients with multiple myeloma: highdose cyclophosphamide plus
GM-CSF vs. G-CSF alone/ZBone Marrow Transplant.-1997.-Vol.20,№3 .-P.211-217.
. Alvares
C.L., Davies F.E., Horton C. et al. The role of second autografts in the
management of myeloma at first
relapse//Haematologica.-2006.-Vol.91,№l.-P.141-142.
. Anderlini
P., Przepiorka D., Seong C. et al. Factors affecting mobilization of CD34+
cells in normal donors treated with
filgrastim//Transfusion.-1997.-Vol.37,№5.-P.507-512.
. Attal
M., Harousseau J.L., Stoppa A.M. et al. A prospective, randomized trial of
autologous bone marrow transplantation and chemotherapy in multiple myeloma.
Intergroupe Français du Myelome//N. Engl. J. Med.-1996.-Vol.335,№2.-P.91-97.
. Aznavoorian
S., Murphy A.N., Stetler-Stevenson W.G. et al. Molecular aspects of tumor cell
invasion and metastasis//Cancer.-1993.-Vol.71,№4.-P. 1368-1383.
. Barlogie
B., Pineda-Roman M., van Rhee F. et al. Thalidomide arm of Total Therapy 2
improves complete remission duration and survival in myeloma patients with
metaphase cytogenetic abnormalities//Blood.-2008.-Vol. 112,№8 P.3115-3121.
. Bensinger
W., DiPersio J.F., McCarty J.M. Improving stem cell mobilization strategies:
future directions//Bone Marrow Transplant.-2009.-Vol.43,№3.-P.181-195.
. Bensinger
W., Appelbaum F., Rowley S. et al. Factors that influence collection and
engraftment of autologous peripheral blood stem cells//J. Clin.
Oncol.-1995.-Vol.l3,№10.-P.2547-2555.
. Bishop
M.R., Anderson J.R., Jackson J.D. et al. High-dose therapy and peripheral blood
progenitor cell transplantation: effects of recombinant human
granulocyte-macrophage colony-stimulating factor on the
autograft/ZBlood.-1994.-Vol.83 ,№2.-P.610-616.
. Bishop
N.J., Williams D.M., Compston J.C. et al. Osteoporosis in severe congenital
neutropenia treated with granulocyte colony-stimulating factor//Br. J.
Haematol.-1995.-Vol.89,№4.-P.927-928.
. Blume
K.G., Thomas E.D. A review of autologous hematopoietic cell
transplantation//Biol. Blood Marrow Transplant.-2000.-Vol.6,№ 1 .-P. 1-12.
. Bojko
P., Waschek S., Seeber S. et al. Comparison of G-CSF and GM-CSF in combination
with chemotherapy for peripheral blood stem cell (PBSC)
mobilization//Blood.-2001 .-Vol.98, №11 .-P.81.
. Carmeliet
P. Mechanisms of angiogenesis and arteriogenesis//Nat.
Med.-2000.-Vol.6,№4.-P.-389-395.
. Carrai
A., de la Rubia J., Martin G. et al. Factors influencing the collection of
peripheral blood stem cells in patients with acute myeloblasts leukemia and
nonmyeloid malignancies//Leuk. Res.-2003.-Vol.27 ,№1.-P.5-12.
. Child
J.A., Morgan G.J., Davies F.E. et al. High-dose chemotherapy with hematopoietic
stem-cell rescue for multiple myeloma//N. Engl. J. Med.-2003 .-Vol.348,№ 19.-P.
1875-1883.
. Civin
C., Strauss L. Antigenic analysis of haematopoesis III. A haematopoetic
progenitor cell surface antigen defined by a monoclonal antibody reside against
KG-1 cells//J. Immunol.-1984.-Vol.l33,№l.-P.157-165.
. Conti
J.A., Scher H.I. Acute arterial thrombosis after escalated-dose methotrexate,
vinblastine, doxorubicin and cisplatin chemotherapy withrecombinant granulocyte
colony-stimulating factor//Cancer.-1992.-Vol.70,№l 1 .-P.2699-2702.
. Dale
D.C., Bonilla M.A., Davis M.W. et al. A randomized controlled phase III trial
of recombinant human granulocyte colony-stimulating factor (filgrastim) for
treatment of severe chronic neutropenia//Blood.-1993.-Vol.81 ,№
10.-P.2496-2502.
. De
Boer F., Drager A.M., Van Haperen MJ. et al. The phenotypic profile of
CD34-positive peripheral blood stem cells in different mobilization
regimens//Br. J. Haematol.-2000.-Vol.l 11,№4.-P.l 138-1144.
. Demirer
T., Buckner C.D., Gooley T. et al. Factors influencing collection of peripheral
blood stem cells in patients with multiple myeloma//Bone Marrow
Transplant.-1996.-Vol.l7,№6.-P .937-941.
. Dincer
A.P., Gottschall J., Margolis D.A. Splenic rupture in a parental donor
undergoing peripheral blood progenitor cell mobilization//J. Pediatr. Hematol.
Oncol.-2004.-Vol.26,№ 11 .-P.761 -763.
. EbiharaY.,
Xu M.I., Manabe A. et al. Exclusive expression of G-CSF receptor on myeloid
progenitors in bone marrow CD34+-cells//Br. J. Haematoli-2000.-Vol. 109,№
1.-P.153-161.
. Faderl
S., Do K.A., Johnson M.M. et al. Angiogenic factors may have a different
prognostic role in adult acute lymphoblastic leukemia//Blood.-2005.-Vol. 106,№
13 .-P.4303-4307.
. Fleming
D.R., Goldsmith J., Goldsmith G.H. et al. Mobilization of peripheral blood stem
cells in high-risk breast cancer patients using G-CSF after standard dose
doxetaxel//J. Hematother. Stem Cell Res.- 2000.-Vol.9,№6.-P.855-860.
. Folkman
J. Seminars in Medicine of the Beth Israel Hospital, Boston. Clinical
applications of research on angiogenesis//N. Engl. J.
Med.-1995.-Vol.333,№26.-P. 1757-1763.
. Fruehauf
S., Klaus J., Huesing J. et al. Efficient mobilization of peripheral blood stem
cells following CAD chemotherapy and a single dose of pegylated G-CSF in
patients with multiple myeloma//Bone Marrow
Transplant.-2007.-Vol.39,№12.-P.743-750.
. Fu
S., Liesveld J. Mobilization of hematopoietic stem cells//Blood Rev.-2000.-Vol.
14,№4.-P.205-218.
. Gazitt
Y. Comparison between granulocyte colony-stimulating factor and
granulocyte-macrophage colony-stimulating factor in the mobilization of
peripheral blood stem cells//Curr. Opin. Hematol.-2002.-Vol.9,№3.-P.190-198.
. Goldman
J.M., Horowitz M.M. The international bone marrow transplant registry//Int. J.
Hematol.-2002.-Vol.76,Suppl. 1 .-P.393-397.
. Gordan
L.N., Sugrue M.W., Lynch J.W. et al. Poor mobilization of peripheral blood
stem; cells is a risk factor for worse outcome
in ¡lymphoma patients undergoing autologous stem cell
transplantation//Leuk. Lymphoma.-2003.-Vol.44,№5.-P.815-820.
. Grignani
G., Perissinotto E., Cavalloni G. et al. Clinical use of AMD3100 to mobilize
CD34+ cells in patients affected by non-Hodgkin's lymphoma or multiple
myeloma//J. Clin. 0ncol.-2005.-Vol.23,№ 16.-P.3 871-3 872.
. Hari
P., Pasquini M.C., Vesole D.H. Cure of multiple myeloma-more hype, less
reality//Bone Marrow Transplant.-2006.-Vol.37,№l.-P.l-18.
. Harousseau
J.L., Moreau P; Role of bone marrow transplantation in the disease pathway of
myeloma//J. Natl. Compr. Cane. Netw.-2007.-Vol.5,№2.-P. 163-169.
. Heldal
D., Tjonnfjord G., Brinch L. et al. A randomized study of allogeneic
transplantation with stem cells from blood or bone marrow/ZBone Marrow
Transplant.-2000.-Vol.25,№l l.-P.l 129-1136.
. Hibbin
J.A., Njoku O.S., Matutes E. et al. Myeloid progenitor cells in the circulation
of patients with myelofibrosis and other myeloproliferative disorders//Br. J.
Haematol.-1984.-Vol.57,№3 .-P.495-503.
. Hilbe
W., Nussbaumer W., Bonatti H. et al. Unusual adverse events following
peripheral blood stem cell (PBSC) mobilization using granulocyte colony
stimulating factor (G-CSF) in healthy donors/ZBone Marrow
Transplant.-2000.-Vol.26,№7.-P. 811-813.
. Hosing
C., Qazilbash M.H., Kebriaei P. et al. Fixed-dose single agent pegfilgrastim
for peripheral blood progenitor cell mobilisation in patients with multiple
myeloma//Br. J. Haematol.-2006.-Vol. 133,№5.-P.533-537.
. Jansen
J., Thompson J., Dugan M. et al. Impaired PBPC collection in patients with
myeloma after high-dose melphalan//Cytotherapy.-2004.-Vol.6,№5.-P.498-504.
. Jillella
A.P., Ustun C. What is the optimum number of CD34+ peripheral blood stem cells
for an autologous transplant?//Stem Cells Dev.2004.-Vol.l3,№6.-P.598-606.
. Kang
E., Areman E., David-Ocampo V. et al. Mobilization, collection and processing
of peripheral blood stem cells in individuals with sickle cell
trait//Blood.-2002.-Vol.99,№3.-850-855.
. Kiel
K., Cremer F.W., Ehrbrecht E. et al. First and second apheresis in patients
with multiple myeloma: no differences in tumor load and hematopoietic stem cell
yield//Bone Marrow Transplant.-1998.-Vol.21,№l 1 .-P.l 109-1115.
. Knudsen
L.M., Rasmussen T., Nikolaisen K. et al. Mobilization of tumor cells along with
CD34+ cells to peripheral blood in multiple myeloma//Eur. J. Haematol.-2001
.-Vol.67,№5-6.-P.289-295.
. Knudsen
L.M., Rasmussen T., Jensen L. et al. Reduced bone marrow stem cell pool and
progenitor mobilisation in multiple myeloma after melphalan treatment//Med.
Oncol.-1999.-Vol. 16,№4.-P.245-254.
. Kotasek
D., Sherpherd S.M., Sage R.E. et al. Factors affecting blood stem cell
collections following high-dose cyclophosphamide mobilisation in lymphoma,
myeloma, and solid tumors//Bone Marrow Transplant.-1992.-Vol.9,№ 1 .-P. 11 -17.
. Krause
D., Fackler M., Civin C. et al. CD34: structure, biology and clinical
utility//Blood.-1996.-Vol. 87,№ 1 .-P. 1 -13.
. Kumar
S., Hayman S., Buadi F. et al. Phase II trial of lenalidomide (RevlimidTM) with
cyclophosphamide and dexamethasone (RCd) for newly diagnosed myeloma//Blood:
ASH Annual Meeting Abstracts.-2008.-Vol. 112,№11 .-P.40.
. Kurnick
JE, Robison WA. Colony growth of human peripheral white blood cells in
vitro//Blood.-1971.-Vol.37,№2.-P.136-141.
. Lapidot
T., Petit I. Current understanding of stem cell mobilization: the roles of
chemokines, proteolytic enzymes, adhesion molecules,, cytokines, andstromal
cells//Exp. Hematol.-2002.-Vol.30,№9.-P.973-981.
. Lemoli
R.M., Martinelli G., Olivieri A. et al. Selection and transplantation of
autologous CD34+ B-lineage negative cells in advanced-phase multiple myeloma
patients: a pilot study//Br. J. Haematol.-1999.-Vol. 107,№2.-P.419-428
. Levesque
J.P., Bendall L.J., Hendy J. et al. Neutrophil enzymes degrade CXCR4 on CD34+
progenitors: implications for progenitor cell mobilization//Blood.-2002.-Vol.
100.-P. 107.
. Levesque
J.P., Hendy J., Takamatsu Y. et al. Disruption of the CXCR4-CXCL12 chemotactic
interaction during hematopoietic stem cell mobilization induced by GCSF or
cyclophosphamide//!. Clin. Invest.-2003.-Vol. Ill ,№2.-P. 187-196.
. Levesque
J.P., Hendy J., Takamatsu Y. et al. Mobilization by eitheer cyclophosphamide or
granulocyte colony-stimulating factor tfansforms the bone marrow into a highly
proteolitic environment//Exp. Hematol.- 2002.-Vol.3 0,№5 .-P.440-449.
. Liu
F., Poursine-Laurent J., Link D.C. Expression of the G-CSF receptor on
hematopoietic progenitor cells is not required for their mobilization by
G-CSF//Blood.-2000.-Vol.95 ,№ 10.-P.3 025-3 031.
. Ludwig
H., Beksac M., Blade J. et al. Current multiple myeloma treatment strategies
with novel agents: a European perspective//The
Oncologist.-2010.-Vol.l5,№l.-P.6-25.
. Maeda
K., Chung Y-S., Takatsuka S. et al. Tumor angiogenesis as a predictor of
recurrence in gastric carcinoma//J. Clin. Oncol.- 1995.-Vol. 13,№2.-P.477-481.
. Mahe
B., Milpied N., Hermouet S. et al. G-CSF-alone mobilizes sufficient peripheral
blood CD34+ cells for positive selection in newly diagnosed patients with
myeloma and lymphoma//Br. J. Haematol.-1996.-Vol.92,№2.-P.263-268.
. Mark
T., Stern J., Furst J.R. et al. Stem cell mobilization with cyclophosphamide
overcomes the suppressive effect of lenalidomide therapy on stem cell
collection in multiple myeloma//Biol. Blood Marrow Transplant.-2008.-Vol.
14,№7.-P.795-798.
. Martinez
C., Urbano-Ispizua A., Marin P. et al. Efficacy and toxicity of a high-dose
G-CSF schedule for peripheral blood progenitor cell mobilization in healthy
donors//Bone Marrow Transplant.-1999.-Vol.24,№12.-P.1273-1278.
. McCredie
K.B., Hersh E.M., Freireich E.J. Cells capable of colony formation in the
peripheral blood of man//Science.-1971.-Vol.l71,№968.-P.293-294.
. Mele
A., Leopardi G., Sparaventi G. et al. Mini-ICE effectively mobilises peripheral
blood stem cells after fludarabine-based regimens in acute myeloid
leukemia//Eur. J. Haematol.-2005.-Vol.74,№4.-P.277-281.
. Montgomery
M., Cottier-Fox M. Mobilization and collection of autologous hematopoietic
progenitor/stem cells//Clin. Adv. Hematol. Oncol.- 2007.-Vol.5,№2.-P. 127-136.
. Morris
C., Siegel E., Barlogie B. et al. Mobilization of CD34+ cells in elderly
patients (>/= 70 years) with multiple myeloma: influence of age, prior
therapy, platelet count and mobilization regimen//Br. J. Haematol.-2003 .-Vol.
120,№3 .-P.413-423.
. Narayanasami
U., Kanteti R., Morelli J. et al. Randomized trial of filgrastim versus
chemotherapy and filgrastim mobilization of hematopoietic progenitor cells for
rescue in autologous transplantation//Blood.-2001.-Vol.98,№7.-P.2059-2064.
. Olin
R.L., Vogl D.T., Porter D.L. et al. Second auto-SCT is safe and effective
salvage therapy for relapsed multiple myeloma//Bone Marrow
Transplant.-2009.-Vol.43 ,№5 .-P.417-422.
. Orlic
D., Kajstura, J. Chimenti S. et al. Mobilized bone marrow cells repair the
infarcted heart, improving function and survival//Proc. Natl. Acad. Sci.
USA.-2001 .-Vol.98,№ 18 .-P. 10344-10349.
. Pitini
V., Ciccolo A., Arrigo C. et al. Spontaneous rupture of spleen during
peripheral blood stem cell mobilization in a patient with breast cancer//
Haematologica.-2000.-Vol.85,№5.-P.559-560.
. Ponisch
W., Leiblein S., Edel E. et al. Mobilization of peripheral blood progenitor
cells (PBPC) in normal donors for allogeneic PBPCtransplantation: comparison
between once a day vs. twice a day G-CSF
administration/ZBlood.-1999.-Vol.94.-P. 13 7.
. Prince
H.M., Imrie K., Sutherland D.R. et al. Peripheral blood progenitor cell
collections in multiple myeloma: predictors and management of inadequate
collections//Br. J. Haematol.-1996.-Vol.93,№ 1 .-P. 142-145.
. Prosper
F., Stroncek D., McCarthy J.B. et al. Mobilization and homing of peripheral
blood progenitors is related to reversible downregulation of alpha4 betal
integrin expression and function//.!. Clin. Invest.-1998.-Vol. 101 ,№11
.-P.2456-2467.
. Pruneri
G., Ponzoni M., Ferreri A.J. et al. Microvessel density, a surrogate marker of
angiogenesis, is significantly related to survival in multiple myeloma
patients//Br. J. Haematol.-2002.-Vol. 118,№3 .-P.817-820.
. Rajkumar
S.V., Fonseca R., Witzig T.E. et al. Bone marrow angiogenesis in complete
responders after stem cell transplantation for multiple myeloma//
Leukemia.-1999. Vol. 13 ,№3 .-P.469-472.
. Rajkumar
S.V., Mesa R:A., Fonseca R. et al. Bone Marrow Angiogenesis in 400 Patients
with Monoclonal Gammopathy of Undetermined Significance, Multiple Myeloma, and
Primary Amyloidosis//Clinical Cancer Reaearch.-2002.-Vol.8,№7.-P.2210-2216.
. Reeder
C.B., Reece D.E., Kukreti V. et al. Cyclophosphamide, bortezomib and
dexamethasone induction for newly diagnosed multiple myeloma: high-response
rates, in a phase II clinical trial//Leukemia.-2009.-Vol.23,№7.-P.1337-1341.
. Richman
C.M:, Weiner R.S., Yankee R.A. Increase in circulating stem cells following
chemotherapy in man//Blood.-1976.-Vol.47,№6.-P.1031-1039.
. Ringden
O., Remberger Mi, Runde V. et al; Faster engraftment of neutrophils
and-platelets with peripheral blood stem cells from unrelated donors: a
comparison with marrow transplantation/ZBone Marrow Transplant.-2000:-Volt25
,№2.-P;36-3 8.
. Rosenfeld
C.S., Bolwell M., LeFever A. et al. Comparison of four cytokine regimens for
mobilization of peripheral blood stem cells: IE-3 alone and in combination with
GM-CSF for G-CSF//Bone Marrow Transplant.-1996.-Vol.l7,№2.-P.179-183:
. Santos:
G.W. Histoiy of bone marrow transplantation//Clin. Haematol.-1983 .-Vol. 12,№3
.-P.611 -639.
. Schimoda
K., OkamwmS;, Harada N. et al. Identification of a functional receptor for
granulocyte colony-stimulating factor on platelets//J. Clin. Invest.-1993 .-Vol
.91 ,№4.-P. 1310-1313.
. Serefhanoglu
S., Goker II., Buyukasik Y. et al. Changes in vascular endothelial growth
factor, angiopoietins, and Tie-2 levels with G-CSF stimulation in healthy
donors//Ann. Hematol.-2009.-Vol.88,№7.-P.667-671.
. Sezer
O., Niemoller K., Eucker J. et al. Bone marrow microvessel density is a prognostic
factor for survival in patients with multiple myeloma//Ann.
Hematol.-2000.-Vol.79,№10.-P.574-577.
. Shinjo
K., Takeshita A., Ohnishi K. et al. Expression of granulocyte
colony-stimulating factor receptor increases with differentiation in myeloid cells
by a newly devised quantitative flow-cytometric assay//Br. J.
Haematol.-1995.-Vol.91,№4.-P.783-794.
. Shintani
S., Murohara T., Ikeda H. et al. Augmentation of postnatal neovascularization
with autologous bone marrow transplantation//Circulation.-2001 .-Vol.
103,№6.-P.897-903.
. Sonneveld
P., van der Holt B., Segeren C.M. et al. Intermediate-dose melphalan compared
with myeloablative treatment in multiple myeloma: long term follow-up of the
Dutch Cooperative Group Hovon 24 trial// Haematologica.-2007.-Vol.92,№7.-P.928-935.
. Srivastava
A., Laidler P., Davies R. et al. The prognostic significance of tumor
vascularity in intermediate-thickness (0.76-4.0 mm thick) skin melanoma: a
quantitative histological study//Am. J. Pathol.-1988.-Vol.l33,№2.-P.419-423.
. Steidl
U., Fenk R., Bruns I. et al. Successful transplantation of peripheral blood
stem cells mobilized by chemotherapy and a single dose of pegylated G-CSF in
patients with multiple myeloma/ZBone Marrow
Transplant.-2005.-Vol.35,№l.-P.33-36.
. Stockerl-Goldstein
K.E., Reddy S.A., Horning S. J. et al. Favorable treatment outcome in
non-Hodgkin's lymphoma patients with 'poor' mobilization of peripheral blood
progenitor cells//Biol. Blood Marrow Transplant.-2000.-Vol.6,№5.-P.506-512.
. Stroncek
D., Shawker T., Follmann D. et al. G-CSF-induced spleen size changes in
peripheral blood progenitor cell donors//Transfusion.-
2003.-Vol.43,№5.-P.609-613. ;
. Sugrue
M.W., Williams K., Pollack B.H. et al. Characterization and outcome of 'hard to
mobilize' lymphoma patients undergoing autologous stem cell
transplantation//Leuk. Lymphoma.-2000.-Vol.39,№ 5-6.-P.509-519.
. Sutherland
H.J., Eaves C .J., Lansdorp P.M. et al. Kinetics of committed and primitive
blood progenitor mobilization after chemotherapy and growth factor treatment
and their use in autotransplants//Blood.-1994.-Vol.83,№12.-P.3808-3814.
. Tegg
E.M., Tuck D.M., Lowenthal R.M. et al. The effect of G-CSF on the composition
of human bone marrow//Clin. Lab. Haematol.-1999.-Vol.21,№4.-P.265-270.
. The
International Myeloma Working Group. Criteria for the classification of
monoclonal gammopathies, multiple myeloma and related disorders: a report of
the International Myeloma Working Group//Br. J.
Haematol.-2003.-Vol.l21,№5.-P.749-757.
. To
L.B., Haylock D.N., Simmons P.J. et all The biology and clinical uses of blood
stem cells//Blood.-1997.-Vol.89;№17.-P.2233-2258.
. Travlos
G.S. Normal Structure, Function, and Histology of the Bone Marrow//Toxicologic.
Pathology.-2006.-Vol.34,№5.-P.548-565.
. Tricot
G., Jagannath S., Vesole D. et al. Peripheral blood stem cell transplants for
multiple myeloma: identification of favorable variables for rapid engraftment
in 225 patients//Blood.-1995.-Vol.85,№2.-P.588-596.
. Uchida
N., He D., Friera A.M. et al. The unexpected Go/Gj cell cycle status of
mobilized hematopoietic stem cells from peripheral
blood//Blood.-1997.-Vol.89,№4.-P. 1189-1196.
. Vacca
A., Ribatti D., Roncali L. et al. Bone marrow angiogenesis and progression in
multiple myeloma//Br. J. Haematol.-1994.-Vol.87,№ 1 .-P.503-508.
. Van
de Velde H. J., Liu X., Chen G. et al. Complete response correlates with
long-term survival and-progression-free survival in high-dose therapy in
multiple myeloma//Haematologica.-2007.-Vol.92,№10.-P. 1399-1406.