Проект организации производства серной кислоты
МИНОБРНАУКИ
РОССИИ
Федеральное
государственное бюджетное образовательное учреждение
Высшего
профессионального образования
«Санкт-Петербургский
государственный экономический университет»
Факультет
экономики и управления в нефтегазохимическом комплексе и экологической
безопасности
Кафедра
экономики и менеджмента в нефтегазохимическом комплексе
КУРСОВОЙ ПРОЕКТ
по дисциплине
Организация производства на
предприятиях химической промышленности
на тему
«Проект организации производства
серной кислоты»
Выполнил:
Абдуллаев И.Б.
студент IV курса 5лет 10мес. спец. 080502/н
Преподаватель:
Неклюдова М.А
Санкт-Петербург
2012
Введение
Организация производства, комплекс мероприятий, направленных на
рациональное сочетание процессов труда с вещественными элементами производства
в пространстве и во времени с целью повышения эффективности, т. е. достижения
поставленных задач в кратчайшие сроки, при наилучшем использовании
производственных ресурсов.
Основные требования, предъявляемые к организации производства: достижение
непрерывности процессов, пропорциональности всех звеньев и ритмичности выпуска
продукции. Непрерывность включает использование средств труда с минимальными
потерями времени, безостановочное продвижение предметов труда через все стадии
производства. Пропорциональность - это взаимное соответствие пропускной
способности смежных участков, позволяющее полностью использовать их
производственной мощности. Ритмичность означает равномерный выпуск продукции и
выполнение одинакового объёма работ в равные периоды времени. Организация
производства охватывает основное, вспомогательное и обслуживающее производство
и процессы управления как гармонически увязанные звенья единого процесса
изготовления продукции.
Основной задачей организации производства как науки является изучение
закономерности форм и принципов создания и функционирования производственных
систем, исследование оптимального сочетания элементов производственного
процесса с учетом особенностей химической технологии и аппаратурного оформления
химических производств.
1. Характеристика рассматриваемой продукции
фасовка
нитрозный кислота серный
Серная кислота - один из важнейших продуктов основной химической
промышленности. Очень сильная двухосновная кислота, отвечает высшей степени
окисления серы (+6). Безводная серная кислота - вязкая, малообразная,
бесцветная жидкость (плотность - 1,84 г/см3, темп. плавления - 10,45 гр. С,
темп. кипения - 296,2 гр. С). Смешивается с водой и SO3 во всех соотношениях.
Если молярное отношение SO3:H2O < 1, то это водный раствор серной кислоты,
если > 1,- раствор SO3 в серной кислоте (олеум).
Серная кислота - наиболее сильная и самая дешевая кислота. Она является
одним из важнейших компонентов в производстве многих товаров: минеральных
удобрений, химических волокон, красителей, цветных металлов, резинотехнических
изделий и пластмасс, всевозможных химикатов и бумажно-целлюлозных изделий, а
так же используется в нефтяной промышленности.
О важном месте серной кислоты в мировой экономике говорит тот факт, что
за четверть столетия ее производство выросло более чем в три раза и в настоящее
время составляет более 200 млн. тонн в год.
Потребление серной кислоты, наряду с потреблением нефти, черных и цветных
металлов, является важнейшим индикатором, характеризующим экономическую мощь
государства. Неслучайно крупнейшими потребителями серной кислоты являются США и
Китай с долями, соответственно, 21% и 19%.
В настоящее время в России насчитываются 37 предприятий химической,
нефтехимической и металлургической промышленности, производящих серную кислоту.
Суммарная их мощность составляет 11, 67 млн. тонн.
Как показывает статистика, крупнейшими производителями серной кислоты
являются предприятия по производству фосфорных удобрений, так как именно для
производства такой продукции требуется максимальное количество серной кислоты.
Так, например, чтобы получить одну тонну оксида фосфора, необходимо 2,4-3,4 т
серной кислоты, а для производства аммиачной селитры - всего 0,75 тонн.
Серная кислота и олеум - чрезвычайно агрессивные вещества, поражают
дыхательные пути, кожу, слизистые оболочки, вызывают затруднение дыхания,
кашель, нередко-ларингит, трахеит, бронхит и т. д. ПДК аэрозоля серной кислоты
в воздухе рабочей зоны 1,0 мг/м3, в атм. воздухе 0,3 мг/м3 (макс. разовая) и
0,1 мг/м3 (среднесуточная). Поражающая концентрация паров серной кислоты 0,008
мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин). Класс опасности 2.
Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов
химических и металлургических производств, содержащих оксиды S, и выпадать в
виде кислотных дождей.
Поэтому, учитывая подобные небезопасные свойства, серная кислота
нуждается в специальных условиях хранения и транспортировки, а также требует
соблюдения мер предосторожности при работе с ней.
1.1 Кислота серная техническая
Стандарт качества - ГОСТ 2184-77
Описание
Серная кислота - бесцветная, непахучая, негорючая, вязко маслянистая
жидкость. Кислота растворима в воде, обладает повышенной активностью при
взаимодействии с восстанавливающими агентами, органическими материалами,
металлами, щелочами, является агрессивной средой для цветных металлов и легких
сталей (при концентрации 90%). При нагревании выше 296°C начинает разлагаться
на SO3 и воду.
Применение
Техническая серная кислота предназначается для производства удобрений,
искусственного волокна, капролактама, двуокиси титана, этилового спирта,
анилиновых красителей и целого ряда других производств.
Серную кислоту применяют:
в производстве минеральных удобрений;
как электролит в свинцовых аккумуляторах;
для получения различных минеральных кислот и солей;
в производстве химических волокон, красителей, дымообразующих веществ и
взрывчатых веществ;
в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях
промышленности;
в пищевой промышленности - зарегистрирована в качестве пищевой добавки
E513 (эмульгатор);
в промышленном органическом синтезе в реакциях: дегидратации (получение
диэтилового эфира, сложных эфиров);
гидратации (этанол из этилена);
сульфирования (синтетические моющие средства и промежуточные продукты в
производстве красителей);
алкилирования (получение изооктана, полиэтиленгликоля, капролактама) и
др.
Химически чистая кислота применяется для производства продукции
специальной и тонкой химии.
Особо чистая кислота применяется для производства высокотехнологичных
продуктов и аналитических материалов.
Аккумуляторная кислота применяется для производства электролита в
свинцовых аккумуляторных батареях.
Марка К применяется для производства продукции промышленной и специальной
химии.
Упаковка
Химически чистую кислоту упаковывают в кварцевые или стеклянные ёмкости в
зависимости от марки кислоты.
Транспортировка
Техническую серную кислоту 1-го и 2-го сортов, башенную и
регенерированную кислоты транспортируют в железнодорожных сернокислотных
цистернах, а также в стальных контейнерах, стальных бочках по ГОСТ 6247 или
поставляют потребителю перекачкой по кислотопроводу из стали марки Ст3 по ГОСТ
380.
В качестве транспортной тары особо чистой кислоты используют обрешётки из
полимерных материалов.
Аккумуляторную кислоту транспортируют в ж/д цистернах, предназначенных
для H2SO4, а также в стеклянных бутылках. Допускается перевозка
автотранспортом.
Марка К транспортируется в цистернах из кислостойкой стали СтЗ с
установкой фторопластовой прокладки или другого коррозиестойкого материала по
отношению к кислоте.
Технические характеристики
Серная кислота должна быть изготовлена в соответствии с требованиями
настоящего стандарта по технологическому регламенту, утвержденному в
установленном порядке.
По физико-химическим показателям серная кислота должна соответствовать
нормам, указанным в таблице:
|
Наименование показателя
|
Норма
|
|
Контактная
|
Олеум
|
Башенная
|
Регенерированная
|
|
улучшенная
|
техническая
|
улучшенный
|
технический
|
|
|
|
|
1-й сорт
|
2-й сорт
|
|
|
|
|
|
1.Массовая доля моногидрата
(H2SO4), %
|
92,5-94,0
|
не менее 92,5
|
не нормируется
|
не менее 75
|
не менее 91
|
|
2.Массовая доля свободного
серного ангидрида (SO3), % не более
|
-
|
-
|
-
|
24
|
19
|
-
|
-
|
|
3.Массовая доля железа
(Fe), %, не более
|
0,006
|
0,02
|
0,1
|
0,006
|
не нормируется
|
0,05
|
0,2
|
|
4.Массовая доля остатка
после прокаливания, %, не более
|
0,02
|
0,05
|
не нормируется
|
0,02
|
не нормируется
|
0,3
|
0,4
|
|
5.Массовая доля окислов
азота (N2O3), %, не более
|
0,00005
|
не нормируется
|
0.0002
|
не нормируется
|
0,05
|
0,01
|
|
6.Массовая доля
нитросоединений, %, не более
|
не нормируется
|
0,2
|
|
7.Массовая доля мышьяка
(As), %, не более
|
0,00008
|
не нормируется
|
0,00008
|
не нормируется
|
|
8.Массовая доля хлористых
соединений (Cl), %, не более
|
0,0001
|
не нормируется
|
|
9.Массовая доля свинца
(Pb), %, не более
|
0,001
|
не нормируется
|
0,0001
|
не нормируется
|
|
10.Прозрачность
|
прозр.без разбав.
|
не нормируется
|
|
11.Цвет, см3 раствора
сравнения, не более
|
1
|
6
|
не нормируется
|
Безопасность
Серная кислота пожаро- и взрывоопасна. При соприкосновении с водой
происходит бурная реакция с большим выделением тепла, паров и газов.
Кислота токсична. По степени воздействия на организм человека относится к
веществам второго класса опасности по ГОСТ 12.1.007-76.
Предельно допустимая концентрация паров в воздухе рабочей зоны
производственных помещений 1 мг/м3.
Работающие с кислотой люди должны быть обеспечены специальной одеждой и
обувью, а так же средствами индивидуальной защиты.
.2 Кислота серная реактивная
Применение
Значительные объёмы серной кислоты расходуются на производство фосфорной
кислоты из природных фосфатов. В дальнейшем полученная фосфорная кислота
расходуется на производство удобрений и моющих средств (например,
тринатрийфосфат);
для улавливания аммиака из отходящих газов коксохимических производств с
целью получения сульфата аммония, используемого в качестве удобрения;
для производства сульфата алюминия - исходного соединения для получения
коагулянтов для очистки питьевой и промышленной воды - по реакции серной
кислоты с природным бокситом;
при промышленном получении взрычатых веществ - как компонент нитрующих
смесей;
в промышленном органическом синтезе как дегидратирующий агент при
получении диэтилового эфира, в реакциях этерификации и прочих процессах;
в реакциях сульфирования органических соединений, используемых в
дальнейшем в качестве фармацевтических препаратов, исходных соединений для
получения синтетических красителей и прочих органических интермедиатов;
как катализатор в синтетическом и индустриальном органическом синтезе, в
том числе в реакциях алкилирования, например, получения изооктана из изобутилена
и изобутана, а также превращении циклогексаноноксима в капролактам;
в нефтехимической промышленности для очистки масел;
как электролит в свинцовых аккумуляторах;
как осушающий агент для газов в промышленности и в лабораторных условиях;
в металлообработке для очистки металлических поверхностей от оксидов, а
также в процессах электролиза.
Технические характеристики
|
Наименование показателей
|
Нормы по ГОСТ 4204-77,
мас.%
|
|
Внешний вид
|
вид. испытания
|
|
H2SO4
|
93,5-95,6
|
|
Остаток после прокаливания
|
<6*10-4
|
|
Аммонийные соли (NH4)
|
<1*10-4
|
|
Железо (Fe)
|
<2*10-5
|
|
Мышьяк (As)
|
<1*10-6
|
|
Нитраты (NO3)
|
<2*10-5
|
|
Свинец (Pb)
|
<1*10-4
|
|
Селен (Se)
|
<1*10-4
|
|
Хлориды (Cl)
|
<2*10-5
|
|
Вещества, восcтанавливающие
КмnO4
|
<2*10-4
|
2. Производство серной кислоты
Серную кислоту в промышленности производят двумя способами: контактным и
нитрозным.
.1 Контактный способ производства серной кислоты
Серную кислоту контактным способом производят в больших количествах на
сернокислотных заводах.
Сырьё, используемое для производства серной кислоты:
· Самородная сера S
· Пирит (серный колчедан) FeS2
· Сероводород H2S
· Сульфиды цветных металлов ZnS, Cu2S
Подготовка сырья. Разберём производство серной кислоты из пирита FeS2.
) Измельчение пирита. Перед использованием большие куски пирита измельчают
в дробильных машинах. Вы знаете, что при измельчении вещества скорость реакции
увеличивается, т.к. увеличивается площадь поверхности соприкосновения
реагирующих веществ.
) Очистка пирита. После измельчения пирита, его очищают от примесей
(пустой породы и земли) методом флотации. Для этого 1й измельчённый пирит
опускают в огромные чаны с водой, перемешивают, пустая порода всплывает наверх,
затем пустую породу удаляют.
Химизм производства. Производство серной кислоты из пирита состоит из
трёх стадий.
) Первая стадия - обжиг пирита в печи для обжига в "кипящем
слое".
Уравнение реакции первой стадии:
t =
800°C
4FeS2 + 11O2  2Fe2O3
+ 8SO2 + Q
2Fe2O3
+ 8SO2 + Q
Измельчённый
очищенный влажный (после флотации) пирит сверху засыпают в печь для обжига в
"кипящем слое". Снизу (принцип противотока) пропускают воздух,
обогащённый кислородом, для более полного обжига пирита. Температура в печи для
обжига достигает 800°С. Пирит раскаляется до красна и находится в
"подвешенном состоянии" из-за продуваемого снизу воздуха. Похоже это
всё на кипящую жидкость раскалённо-красного цвета.
За
счёт выделяющейся теплоты в результате реакции поддерживается температура в
печи. Избыточное количество теплоты отводят: по периметру печи проходят трубы с
водой, которая нагревается. Горячую воду используют дальше для центрального
отопления рядом стоящих помещений.
Образовавшийся
оксид железа Fe2O3 (огарок) в производстве серной кислоты не используют. Но его
собирают и отправляют на металлургический комбинат, на котором из оксида железа
получают металл железо и его сплавы с углеродом - сталь (2% углерода С в
сплаве) и чугун (4% углерода С в сплаве).
Таким
образом выполняется принцип химического производства - безотходность
производства.
Из
печи выходит печной газ, состав которого: SO2, O2, пары воды (пирит был
влажный!) и мельчайшие частицы огарка (оксида железа). Такой печной газ
необходимо очистить от примесей твёрдых частиц огарка и паров воды.
Очистка
печного газа от твёрдых частичек огарка проводят в два этапа в циклоне
(используется центробежная сила, твёрдые частички огарка ударяются о стенки
циклона и ссыпаются вниз) и в электрофильтрах (используется электростатическое
притяжение, частицы огарка прилипают к наэлектризованным пластинам
электрофильтра, при достаточном накоплении под собственной тяжестью они
ссыпаются вниз), для удаления паров воды в печном газе (осушка печного газа)
используют серную концентрированную кислоту, которая является очень хорошим
осушителем, поскольку поглощает воду.
Осушку
печного газа проводят в сушильной башне - снизу вверх поднимается печной газ, а
сверху вниз льётся концентрированная серная кислота. На выходе из сушильной
башни печной газ уже не содержит ни частичек огарка, ни паров воды. Печной газ
теперь представляет собой смесь оксида серы SO2 и кислорода О2.
2) Вторая стадия - окисление SO2 в SO3 кислородом. Протекает в
контактном аппарате.
Уравнение реакции этой стадии
2SO2
+ O2 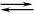 2SO3 + Q
2SO3 + Q
Сложность
второй стадии заключается в том, что процесс окисления одного оксида в другой
является обратимым. Поэтому необходимо выбрать оптимальные условия протекания
прямой реакции (получения SO3).
а)
температура;
Прямая
реакция является экзотермической +Q, согласно правилам по смещению химического
равновесия, для того, чтобы сместить равновесие реакции в сторону
экзотермической реакции, температуру в системе необходимо понижать. Но, с
другой стороны, при низких температурах, скорость реакции существенно падает.
Экспериментальным путём химики-технологи установили, что оптимальной
температурой для протекания прямой реакции с максимальным образованием SO3
является температура 400-500°С. Это достаточно низкая температура в химических
производствах. Для того, чтобы увеличить скорость реакции при столь низкой
температуре в реакцию вводят катализатор. Экспериментальным путём установили,
что наилучшим катализатором для этого процесса является оксид ванадия V2O5.
б)
давление;
Прямая
реакция протекает с уменьшением объёмов газов: слева 3V газов (2V SO2 и 1V O2),
а справа - 2V SO3. Раз прямая реакция протекает с уменьшением объёмов газов,
то, согласно правилам смещения химического равновесия давление в системе нужно
повышать. Поэтому этот процесс проводят при повышенном давлении.
Прежде
чем смесь SO2 и O2 попадёт в контактный аппарат, её необходимо нагреть до
температуры 400-500°С. Нагрев смеси начинается в теплообменнике, который
установлен перед контактным аппаратом. Смесь проходит между трубками
теплообменника и нагревается от этих трубок. Внутри трубок проходит горячий SO3
из контактного аппарата. Попадая в контактный аппарат смесь SO2 и О2 продолжает
нагреваться до нужной температуры, проходя между трубками в контактном
аппарате.
Температура
400-500°С в контактном аппарате поддерживается за счёт выделения теплоты в
реакции превращения SO2 в SO3. Как только смесь оксида серы и кислорода
достигнет слоёв катализатора, начинается процесс окисления SO2 в SO3.
Образовавшийся
оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в
поглотительную башню.
3) Третья стадия - поглощение SO3 серной кислотой. Протекает в
поглотительной башне.
Уравнение реакции этого процесса
nSO3
+ H2SO4  H2SO4·nSO3
H2SO4·nSO3
Образовавшийся
олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом
заполняют цистерны, формируют железнодорожные составы и отправляют потребителю.
2.2
Нитрозный способ производства серной кислоты
В
нашей стране используется и другой, так называемый нитрозный, способ её
получения.
На
первой стадии, одинаковой для обоих методов, получают сернистый ангидрид SO2.
Исходным сырьём может быть, в принципе, любое вещество, содержащее серу:
природные сульфиды железа (прежде всего, пирит FeS2), а также
сульфиды меди и никеля, сульфидные полиметаллические руды, гипс CaSO4.2H2O и
элементарные сера. Всё больше и больше используют газы, которые выделяются при
переработке и сжигании горючих ископаемых (угля, нефти), содержащих соединения
серы.
Полученный
SO2 окисляют до H2SO4,
используется для этого в нитрозном методе используется окислы азота. С этой
стадии оба метода отличаются друг от друга.
В
специальной окислительной башне 3 смешивают окись азота NO и NO2 с
воздухом в таком соотношении, чтобы половина имеющихся NO и NO2.
NO + O2
2NO2
В
результате газовая смесь содержит равные NO и NO2.
Она подаётся в башни 4 и 5, орошаемые 75% - ной серной кислотой; здесь смесь
окислов азота поглощается с образованием нитрозиллерной кислоты:
+ NO2 + 2H2SO4 2NO(HSO4) + H2O
Раствор
нитрозиллерной кислоты в серной кислоте, называемый нитрозой, орошает башни 1 и
2, куда противотоком поступает SO2 и добавляется вода. В результате
гидролизанитрозиллерной кислоты образуется азотная кислота:
NO(HSO4)
+ H2OH2SO4 + HNO2
Она
- то и окисляет SO2 по уравнению:
2
+ 2HNO2H2SO4 + 2NO
В
нижней части башен 1 и 2 накапливается 75%-ная серная кислота, естественно, в
большем количестве, чем её было затрачено на приготовление нитрозы (ведь
добавляется «новорождённая» серная кислота). Окись азота NO
возвращается снова на окисление. Поскольку некоторое количество её меряется с
выхлопными газами, приходится добавлять в систему HNO3, служащую
источником окислов азота.
Недостаток
башенного метода состоит в том, что полученная серная кислота имеет
концентрацию лишь 75% (при большей концентрации плохо идёт гидролиз
нитрозиллернойкислоты). Концентрирование же серной кислоты упариванием
представляет дополнительную трудность. Преимущество этого метода в том, что
примеси содержащиеся в SO2, не влияют на ход процесса, так что исходный SO2
достаточно очистить от пыли, т.е. механических загрязнений. Естественно,
башенная серная кислота бывает недостаточно чистой, что ограничивает её
применения.
.3
Охрана окружающей среды, связанная с производством серной кислоты
Основным
сырьем для производства серной кислоты, является сера. Она относится к числу
наиболее распространенных числу химических элементов на нашей планете.
Производство
серной кислоты происходит в три стадии на первой стадии получают SO2,
путем обжига FeS2, затем SO3, после чего на третьей стадии
получают серную кислоту.
Научно-техническая революция и связанный с ней интенсивный рост
химического производства, вызывает существенные негативные изменения в
окружающей среде.Например отравление пресных вод, загрязнение земной атмосферы,
истребление животных и птиц. В результате мир оказался в тисках экологического
кризиса.
Вредные выбросы сернокислых заводов следует оценивать не только по
действию содержащегося в них оксида серы на расположенные вблизи предприятия
зоны, но и учитывать другие факторы - увеличение количества случаев
респираторных заболеваний человека и животных, гибель растительности и
подавление ее роста, разрушение конструкций из известняка и мрамора, повышение
коррозионного износа металлов. По вине “кислых” дождей повреждены памятники
архитектуры (Тадж-Макал).
В зоне до 300 км от источника загрязнения (SO2) опасность представляет серная кислота, в зоне до 600 км. -
сульфаты. Серная кислота и сульфаты замедляют рост с/х культур. Закисление
водоемов (весной при таянии снега, вызывает гибель икр и молоди рыб. Помимо
экологического ущерба налицо экономический ущерб - громадные суммы каждый год
теряются при раскисление почв.
Рассмотрим химические метода отчистки от наиболее распространенных
газообразных загрязняющих воздух веществ. Известно более 60 методов. Наиболее
перспективны методы, основанные на поглощение оксида серы известняком,
раствором сульфита - гидросульфита аммония и щелочным раствором алюмината
натрия. Интерес также представляют каталитические методы окисления оксида серы
в присутствии оксида ванадия. Особое значение имеет очистка газов от
фторсодержащих примесей, которые даже в незначительной концентрации вредно
влияют на растительность. Если в газах содержится фтороводород и фтор, то их
пропускают через колоны с насадкой противотоком по отношению к 5-10% раствору
гидроксида натрия. В течении одной минуты протекают следующие реакции:
F2+2NaOH-> O2+H2O+2NaF
HF+NaOH->NaF+H2O;
Образующийся фторид натрия обрабатывают для регенерации гидроксида
натрия:
NaF+CaO+H2O->CaF2+2NaOH
.4 Хранение
Для уменьшения возможности кристаллизации серной кислоты при перевозке и
хранении установлены стандарты на товарные сорта серной кислоты, концентрация
которых соответствует наиболее низким температурам кристаллизации. Содержание
серной кислоты в техн. сортах (%): башенная (нитрозная) 75, контактная
92,5-98,0, олеум 104,5, высокопроцентный олеум 114,6, аккумуляторная 92-94.
Серную кислоту хранят в стальных резервуарах объемом до 5000 м3. Олеум и серную
кислоту перевозят в стальных железнодорожных цистернах. Концентрированную и
аккумуляторную серную кислоту перевозят в цистернах из кислотостойкой стали.
Цистерны для перевозки олеума покрывают теплоизоляцией и перед заливкой олеум
подогревают.
2. Расчетная часть
Основные технико-экономические характеристики технологического
оборудования
|
Наименование
|
Тип оборудования
|
Производительность тонн/час
|
Продолжительность ремонта,
час.
|
Период между ремонтами
|
|
|
|
средний
|
текущий
|
капитальный
|
средний
|
текущий
|
капитальный
|
|
Контактный аппарат
|
К-39-4
|
2,92
|
96
|
8
|
600
|
17280
|
720
|
34560
|
|
К-39-4
|
9,34
|
96
|
8
|
600
|
17280
|
720
|
34560
|
|
К-85-5
|
14,00
|
96
|
8
|
600
|
17280
|
720
|
34560
|
|
Печь для сжигания серы
|
КС-200
|
5,79
|
300
|
12
|
720
|
17280
|
720
|
34560
|
|
ДКСМ
|
3,76
|
300
|
12
|
720
|
17280
|
720
|
34560
|
|
Брызгоулавливатель
|
ПБ
|
3,45
|
240
|
12
|
720
|
8640
|
720
|
34560
|
|
Сушильная башня
|
СБ
|
3,45
|
96
|
8
|
360
|
8640
|
720
|
34560
|
|
Абсорбер для технич.
кислоты
|
АТ
|
3,45
|
120
|
8
|
600
|
17280
|
720
|
86400
|
|
Абсорбер для реакт. кислоты
|
АР
|
0,14
|
48
|
8
|
120
|
8640
|
2160
|
17280
|
Планируемая производственная программа
|
Наименование продукции
|
Ед.измер.
|
Плановый годовой объём
производства продукции
|
|
Серная кислота, техническая
|
т.
|
15000
|
|
Серная кислота, реактивная
|
т.
|
27500
|
Исходные данные для проектирования участка фасовки и комплектации готовой
продукции
|
Наименование показателей
|
Ед. измер.
|
Вар. 10
|
|
Объем заказываемой партии
|
тыс. литр
|
2,25
|
|
Емкость тары (бутыли)
|
15
|
|
Вместимость контейнера
|
бут.
|
12
|
|
Грузоподъемность транспорта
|
конт.
|
1
|
|
Емкость исходного сборника
|
литр
|
400
|
|
Продолжительность
выполнения операций:
|
|
Розлив в тару
|
мин/литр
|
0,4
|
|
Закупорка и маркировка тары
|
мин/бут
|
0,5
|
|
Укладка в контейнер
|
сек./бут.
|
25
|
|
Погрузка и доставка
контейнера на склад
|
мин./конт.
|
8
|
|
Установка контейнера
|
мин./конт.
|
1,2
|
|
Возврат транспорта
|
мин.
|
6
|
Технической серной кислоты планируется выпустить 15000 т. в год, как и
рективной - 27500 т.
Пересчет на 100% моногидрат:
Техническая: 15000 * 0,925 = 13875 т.
Реактивная: 27500 * 0,94 = 25850 т.
Вгод = 13875 + 25850 = 39725 т. (в пересчете на 100% моногидрат H2SO4)
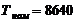 ч.
ч.
1. Контактный аппарат К-39-4
Расчетное
количество ремонтов 1 - го типа (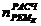 ) в
течение ремонтного цикла (РЦ) определяется по формуле:
) в
течение ремонтного цикла (РЦ) определяется по формуле:
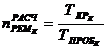
где
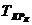 - продолжительность ремонтного цикла,
- продолжительность ремонтного цикла,
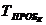 - пробег
между двумя смежными ремонтами одного типа.
- пробег
между двумя смежными ремонтами одного типа.
) 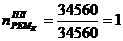
) 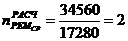
Общее
количество планируемых средних ремонтов ( ) в
течение ремонтного цикла, не совмещенных с проведением более крупных ремонтов
может быть рассчитано следующим образом:
) в
течение ремонтного цикла, не совмещенных с проведением более крупных ремонтов
может быть рассчитано следующим образом:
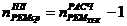
где 1 - количество капитальных ремонтов в межремонтном цикле.
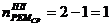
) 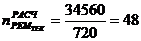
Общее
количество планируемых текущих ремонтов (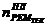 ) в
течение ремонтного цикла расчитывается:
) в
течение ремонтного цикла расчитывается:
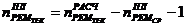
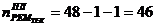
4) m - продолжительность ремонтного цикла (лет)
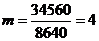
) 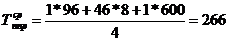 ч.
ч.
) Эффективный
фонд времени работы оборудования в среднем за год (Тэф) определяется по формуле:
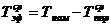
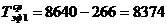 ч.
ч.
)
Расчет требуемого количества оборудования j-го типа для
выполнения производственной программы (Вгод) может производиться по следующей
формуле:
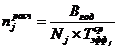
где:
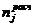 - расчетное количество оборудования j-го
типа,
- расчетное количество оборудования j-го
типа,
Nj - часовая
производительность единицы оборудования j-го типа,
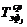 -
эффективный фонд времени работы оборудования j-го типа в среднем
за год в течение межремонтного цикла.
-
эффективный фонд времени работы оборудования j-го типа в среднем
за год в течение межремонтного цикла.
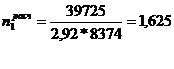
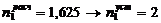
2. Печь для сжигания серы КС-200
1) 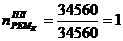
) 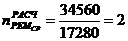
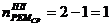
) 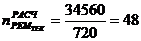
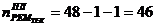
) 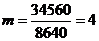
) 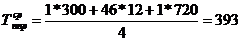 ч.
ч.
) 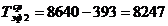 ч.
ч.
) 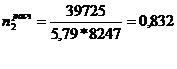
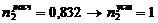
3. Промывная башня
1) 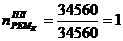
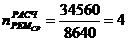
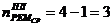
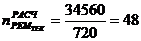
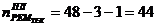
) 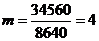
) 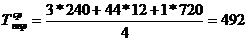 ч.
ч.
) 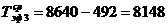 ч.
ч.
) 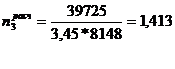
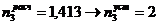
4. Сушильная башня
1) 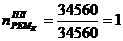
) 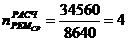
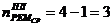
) 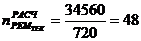
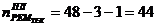
) 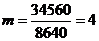
) 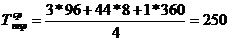 ч.
ч.
) 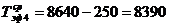 ч.
ч.
) 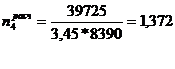
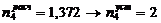
5. Абсорбер для кислоты технической
1) 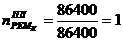
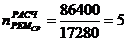
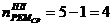
) 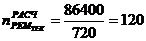
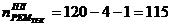
) 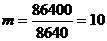
) 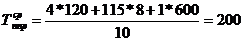 ч.
ч.
) 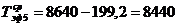 ч.
ч.
) 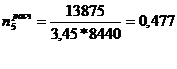
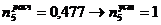
6. Абсорбер для кислоты реактивной
1) 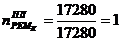
) 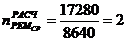
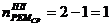
) 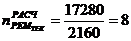
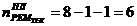
) 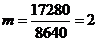
) 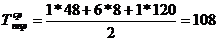 ч.
ч.
) 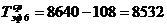 ч.
ч.
) 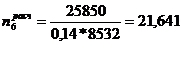
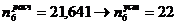
График ППР основного технологического оборудования
|
Наименование оборудования
|
Остановы оборудования для
проведения ремонтов
|
|
1-й год РЦ
|
2-й год РЦ
|
3-й год РЦ
|
4-й (последний) год РЦ
|
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
Контактный аппарат:
К-39-4
|
3Т
|
3Т
|
3Т
|
3Т
|
3Т
|
3Т
|
3Т
|
2Т С
|
3Т
|
3Т
|
3Т
|
3Т
|
3Т
|
3Т
|
3Т
|
2Т К
|
|
Печь для сжигания
серы:КС-200
|
3Т
|
3Т
|
3Т
|
3Т
|
3Т
|
3Т
|
3Т
|
2Т С
|
3Т
|
3Т
|
3Т
|
3Т
|
3Т
|
3Т
|
3Т
|
2Т К
|
|
Промывная башня
(брызгоулавливатель)
|
3Т
|
3Т
|
3Т
|
2Т С
|
3Т
|
3Т
|
3Т
|
2Т С
|
3Т
|
3Т
|
3Т
|
2Т С
|
3Т
|
3Т
|
3Т
|
2Т К
|
|
Сушильная башня
|
3Т
|
3Т
|
3Т
|
2Т С
|
3Т
|
3Т
|
3Т
|
2Т С
|
3Т
|
3Т
|
3Т
|
2Т С
|
3Т
|
3Т
|
3Т
|
2Т К
|
|
Абсорбер для кислоты
технической
|
3Т
|
3Т
|
3Т
|
3Т
|
3Т
|
3Т
|
3Т
|
2Т С
|
3Т
|
3Т
|
3Т
|
3Т
|
3Т
|
3Т
|
3Т
|
2Т C
|
|
Абсорбер для кислоты
реактивной
|
2Т
|
2Т
|
2Т
|
СК
|
2Т
|
2Т
|
2Т
|
КС
|
2Т
|
2Т
|
2Т
|
СК
|
2Т
|
2Т
|
2Т
|
КС
|
Расчет производственной мощности производственных участков (стадий) и
цеха в целом
Для условий непрерывного производства следует руководствоваться следующей
формулой расчета производственной мощности участка (отдельной технологической
стадии):
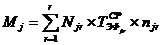
где:
Мj - среднегодовая производственная мощность j-го
участка в течение межремонтного цикла;
Njr - часовая
производительность единицы r-го вида однотипного оборудования j-го
участка;
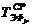 -
эффективный фонд времени единицы r-го вида оборудования j-го участка
(стадии);
-
эффективный фонд времени единицы r-го вида оборудования j-го участка
(стадии);
njr - количество
единиц r-го вида однотипного оборудования, установленного на j-ом
участке;
r - количество
видов однотипного оборудования j-го участка.
Стадия
контактирования (ведущее оборудование):
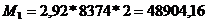 т.
т.
Стадия
очистки печных газов:
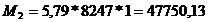 т.
т.
Стадия
сжигания серы:
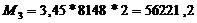 т.
т.
Стадия
сушильной башни:
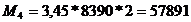 т.
т.
Стадия
абсорбера для технической кислоты:
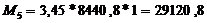 т.
т.
Стадия
абсорбера для реактивной кислоты:
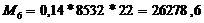 т.
т.
Мцех
= Мвед
Мцех
= 48904,16 т.
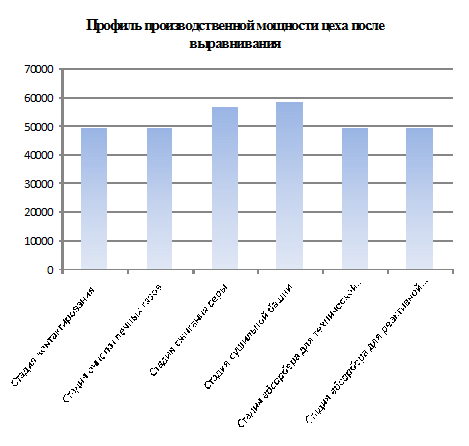
Построение
профиля производственной мощности и его анализ
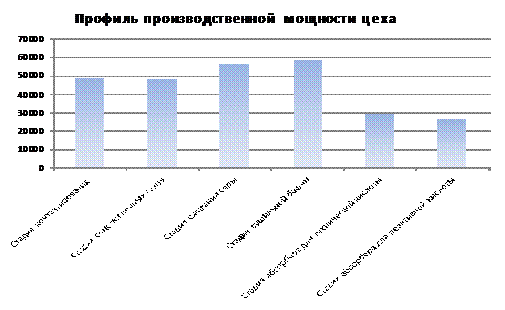
Анализ
профиля производственной мощности сводится к определению коэффициентов
сопряженности отдельных j-х участков производства (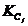 ), рассчитываемых как отношение мощности отдельного j-го
участка (Mj) к мощности ведущего участка (Мв):
), рассчитываемых как отношение мощности отдельного j-го
участка (Mj) к мощности ведущего участка (Мв):
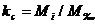
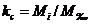 - ведущее
оборудование
- ведущее
оборудование
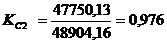 <1 -
узкое место
<1 -
узкое место
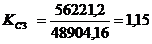 >1 -
резерв производственной мощности
>1 -
резерв производственной мощности
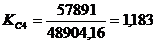 >1 -
резерв производственной мощности
>1 -
резерв производственной мощности
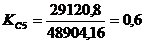 <1 -
узкое место
<1 -
узкое место
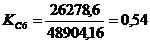 <1 -
узкое место
<1 -
узкое место
Важнейшим
показателем оценки уровня организации производства является коэффициент
использования производственной мощности цеха (КИМ), определяемый по формуле:
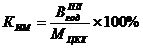
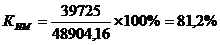
Так
как мощность ведущего оборудования используется не полностью, можно увеличить
объем выпуска серной кислоты на 9 179,16 т.
Необходимо
избавиться от узких мест, какими являются стадия очистки печных газов и стадия
абсорбции кислоты технической и реактивной. Для этого увеличим
производительность до 5,93 т/ч в стадии очистки печных газов и до 5,8 т/ч в
стадии абсорбции технической кислоты, а так же до 0,261 т/ч в стадии абсорбции
реактивной кислоты. Это можно сделать за счет введения новых прогрессивных
технологий. Тогда:
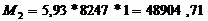 т.
т.
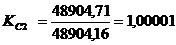
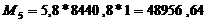 т.
т.
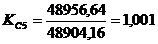
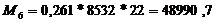 т.
т.
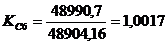
Рассчитывается
окончательный (итоговый) показатель использования производственной мощности
цеха (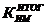 ) по формуле:
) по формуле:
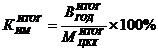
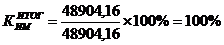
В
заключении необходимо дать оценку изменений рассчитываемых показателей,
происшедших в результате проведения предлагаемых мероприятий:
абсолютный
прирост (уменьшение) производственной мощности цеха (DМ):

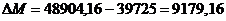
относительное
изменение производственной мощности цеха (DМ%):
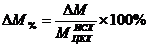
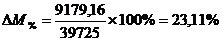
индекс
изменения производственной мощности (IM):
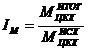
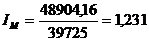
абсолютное
изменение коэффициента использования производственной мощности цеха (DКИМ):
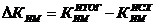
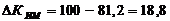
относительное
изменение коэффициента использования производственной мощности цеха (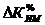 ):
):
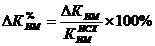
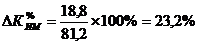
индекс
изменения коэффициента использования производственной мощности цеха (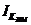 ):
):
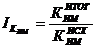
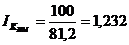
Организация
работы участка фасовки и комплектации готовой продукции (ГП)
.
Размер заказываемой партии
в
количестве бутылей заданной емкости (Збут):
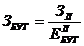
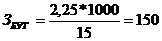 бут.
бут.
в
количестве контейнеров заданной вместимости (Зконт):
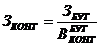
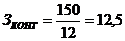 конт.
конт.
.
Количество загрузок исходного сборника (резервуара) готовой продукции для
выполнения заказа соответствующего объёма готовой продукции:
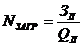
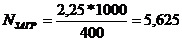
.
Продолжительность производственного цикла в расчете на размер заказываемой
партии, измеренной количеством контейнеров (Зконт). Расчеты производятся для
различных вариантов его организации: при последовательном, параллельном и
смешанном выполнении технологических операций на основе аналитических формул:
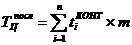
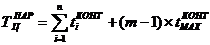
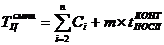
где:
 - продолжительность i-ой
технологической операции в расчете на обработку количества единиц тары
(бутылей), входящих в один контейнер, при этом:
- продолжительность i-ой
технологической операции в расчете на обработку количества единиц тары
(бутылей), входящих в один контейнер, при этом:
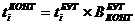
Продолжительность
производственного цикла при последовательном проведении операций:
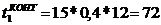 мин.
мин.
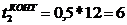 мин.
мин.
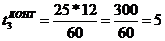 мин.
мин.
 мин.
мин.
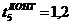 мин.
мин.
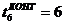 мин.
мин.
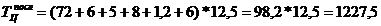 мин.
мин.
Продолжительность
производственного цикла при параллельном проведении операций:
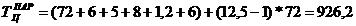 мин.
мин.
Продолжительность
производственного цикла при смешанном проведении операций:
t1>t2 С2
= 12,5*72 - (12,5 -1)*6 = 831 мин.
t2>t3 С3
= 6*12,5 - (12,5-1)*5 = 17,5 мин.
t3<t4 С4
= 5 мин.
t4>t5 С5
= 100-13,8=86,2мин.
t5<t6 С6
=1,2мин.
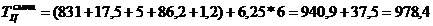 мин.
мин.
Наиболее
оптимальным вариантом организации процесса фасовки и комплектации готовой
продукции является параллельный, т. к. он он является меньшим среди прочих.
4. Ритм потока (r) в
расчете на выход с конвейера на склад одного контейнера:
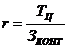
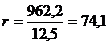 мин.
мин.
.
Число рабочих мест на каждой i-ой технологической стадии (mi) для
синхронизации работы конвейера:

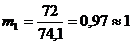 чел.
чел.
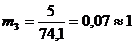 чел.
чел.
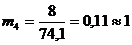 чел.
чел.
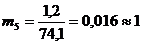 чел.
чел.
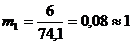 чел.
чел.
общее
число рабочих мест на конвейере (mобщ):
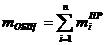
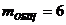 чел.
чел.
.
Коэффициент загрузки рабочих мест:

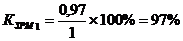
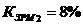
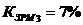
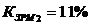
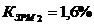
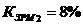
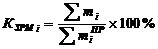
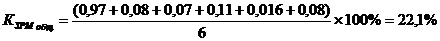
Основные
параметры работы участка фасовки и комплектования ГП в расчете на заданный
объём заказа
|
№ п/п
|
Наименование показателя
|
Ед. измер.
|
Значение показателя
|
|
1
|
Объём заказываемой партии
|
литр
|
2250
|
|
|
бут.
|
150
|
|
|
конт.
|
12,5
|
|
2
|
Емкость бутыли
|
литр
|
15
|
|
3
|
Вместимость контейнера
|
бут.
|
12
|
|
|
литр
|
180
|
|
4
|
Количество загрузок
сборника ГП
|
раз
|
5,625
|
|
5
|
Продолжительность
производственного цикла на выполнение заказа при его организации:
|
|
|
|
- последовательно
|
мин
|
1227,5
|
|
- параллельно
|
мин
|
1248,2
|
|
- смешанным образом
|
мин
|
978,4
|
|
6
|
Ритм потока
|
мин/конт
|
99,86
|
|
7
|
Общее число рабочих мест
|
чел.
|
6
|
|
8
|
Коэффициент загрузки
рабочих мест по i-м стадиям
|
%
|
|
|
1 стадия
|
%
|
97
|
|
2 стадия
|
%
|
8
|
|
3 стадия
|
%
|
7
|
|
4 стадия
|
%
|
11
|
|
5 стадия
|
%
|
1,6
|
|
6 стадия
|
%
|
8
|
|
Коэффициент загрузки общий
|
%
|
22,1
|
Приложение
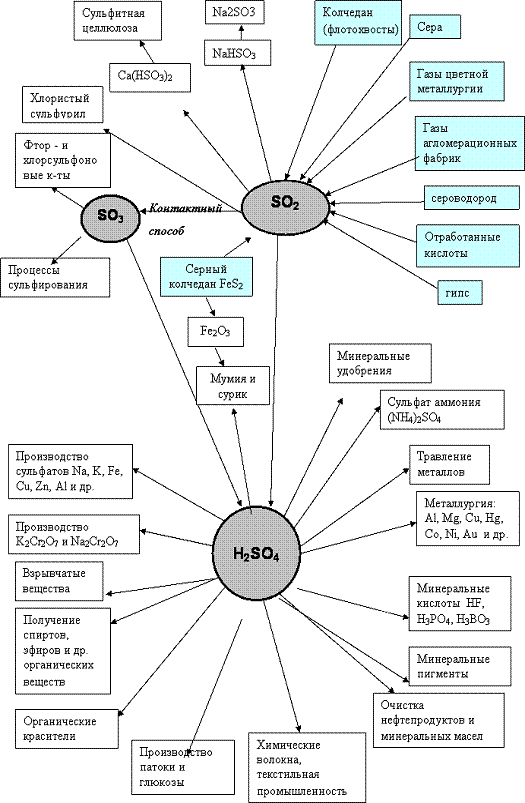
Рис. 1. Схема применения серной кислоты
Производственная структура цеха по производству серной кислоты
Рис. 2. Схема производства серной кислоты из серы: 1-серная печь;
2-котел-утилизатор; 3 - экономайзер; 4-пусковая топка; 5, 6-теплообменники
пусковой топки; 7-контактный аппарат; 8-теплообменники; 9-олеумный абсорбер;
10-сушильная башня; 11 и 12-соотв. первый и второй моногидратные абсорберы;
13-сборники кислоты
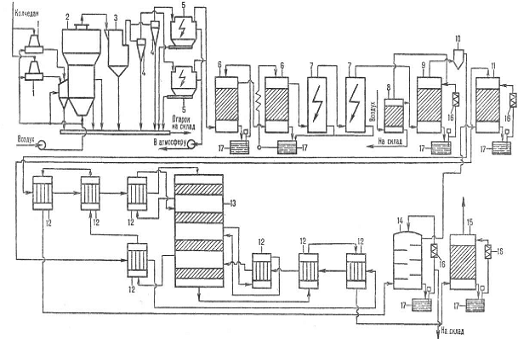
Рис. 3. Схема производства серной кислоты из пирита: 1-тарельчатый
питатель; 2-печь; 3-котел-утилизатор; 4-циклоны; 5-электрофильтры; 6-промывные
башни; 7-мокрые электрофильтры; 8-отдувочная башня; 9-сушильная башня;
10-брызгоуловитель; 11-первый моногидратный абсорбер; 12-теплообмен-вики; 13 -
контактный аппарат; 14-олеумный абсорбер; 15-второй моногидратный абсорбер;
16-холодильники; 17-сборники
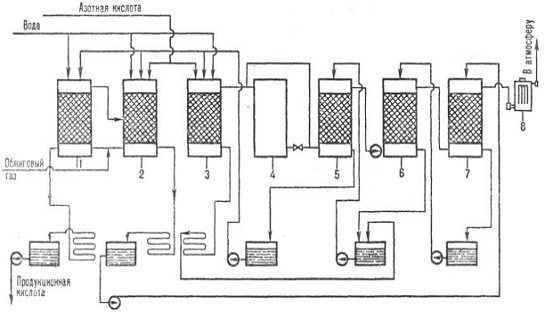
Рис. 4. Схема производства серной кислоты нитрозным методом: 1 -
денитрац. башня; 2, 3-первая и вторая продукц. башни; 4-окислит. башня; 5, 6,
7-абсорбц. башни; 8 - электрофильтры
Заключение
В результате проделанной курсовой работы были закреплены полученные
теоретические знания в области дисциплины “организация производства на
предприятиях отрасли”.
В теоретической части были рассмотрены основные методы производства
серной кислоты, ее назначение и применение, а также соответствующие ГОСТы,
содержащие физико-химическим показатели, которым должна соответствовать серная
кислота того или иного качества, способы ее хранения и защиты окружающей среды.
В расчетной части были проведены расчеты по определению количества
текущих, средних и капитальных ремонтов для каждой единицы оборудования,
расчеты производственной мощности производственных участков и цеха в целом, а
также организация работы участка фасовки и комплектации готовой продукции. В
процессе выполнения была обнаружена диспропорция производственной мощности, то
есть отсутствовала одинаковая пропускная способность всех подразделений по выпуску
готовой продукции: где-то присутствовали «узкие места». Их устранили путем
повышения производительности аппарата, за счет введения новых прогрессивных
технологий.
Список литературы
1. Амелин
А. Г. Производство серной кислоты, издание 2 -Изд. Высшая школа, 1980, с
изменениями.
2. Труды Н. И.
-Экономика и организация труда на предприятиях основной химической
промышленности Выпуск 223
<http://ochem.ru/book_view.jsp?idn=024050&page=1&format=djvu>,
1973.
3. Соколов
Р. С. Химическая технология. - М: Гуманит. изд. Центр БЛАДОС, 2000.
4. Организация
производства на предприятиях химической промышленности. Методические указания к
выполнению курсового проекта для студентов всех форм обучения.
5. Организация
производства и управление предприятием. Учебник под ред. О.Г. Туровца - М.:
ИНФРА-М, 2002.