Физическая химия и кристаллофизика
СОДЕРЖАНИЕ
Введение
Задание
1
Задание
2
Заключение
Список
использованных источников
ВВЕДЕНИЕ
Растворы, макроскопически однородные смеси двух
или большего числа веществ (компонентов), образующие термодинамически
равновесные системы. В растворах все компоненты находятся в
молекулярно-дисперсном состоянии; они равномерно распределены в виде отдельных
атомов, молекул, ионов или в виде групп из сравнительно небольшого числа этих
частиц. С термодинамической точки зрения растворы - фазы переменного состава, в
которых при данных внешних условиях соотношение компонентов может непрерывно
меняться в некоторых пределах. Растворы могут быть газообразными, твёрдыми.
Чаще же всего термин «растворы» относят к жидким растворам.
Простейшие составные части растворов (компоненты)
обычно могут быть выделены в чистом виде; их смешением можно вновь получить
растворы любого допустимого состава. Количественное соотношение компонентов
определяется их концентрациями. Обычно основной компонент называют
растворителем, а остальные компоненты - растворенными веществами. Если одним из
компонентов является жидкость, а другим - газы или твёрдые вещества, то
растворителем считают жидкость.
В соответствии с термодинамическими свойствами
растворы подразделяют на те или иные классы, прежде всего - на идеальные и
неидеальные (называемые также реальными). Идеальными растворами называют такие
растворы, для которых химический потенциал mi каждого компонента i имеет
простую логарифмическую зависимость от его концентрации (например, от мольной
доли xi):
mi = (p, T) + RT lnxi (1)
где через обозначен химический потенциал чистого
компонента, зависящий только от давления р и температуры Т, и где R - газовая
постоянная. Для идеальных растворов энтальпия смешения компонентов равна нулю,
энтропия смешения выражается той же формулой, что и для идеальных газов, а
изменение объёма при смешении компонентов равно нулю. Эти три свойства
идеального раствора полностью характеризуют его и могут быть взяты в качестве
определяющих для идеального раствора. Опыт показывает, что раствор идеален
только в том случае, если образующие его компоненты сходны друг с другом прежде
всего в отношении геометрической конфигурации и размера молекул. Наиболее
близки к идеальным растворам смеси соединений с изотопозамещёнными молекулами.
Как правило, для идеальных растворов соотношение
(1) справедливо во всей области изменения концентраций. Концентрации, при
которых в данном растворе начинают обнаруживаться заметные отклонения от
идеальности, очень сильно зависят от природы образующих его веществ.
Большинство достаточно разбавленных растворов ведут себя как идеальные.
Растворы, не обладающие свойствами идеальных
растворов, называются неидеальными. Для них выполняется соотношение,
аналогичное (1) при замене концентрации на активность: ai = gixi, где ai -
активность компонента i, gi - коэффициент активности, зависящий как от
концентрации данного компонента, так и от концентраций остальных компонентов, а
также от давления и температуры. Среди неидеальных растворов большой класс
составляют регулярные растворы, которые характеризуются той же энтропией
смешения, что и идеальные растворы, однако их энтальпия смешения отлична от
нуля и пропорциональна логарифмам коэффициентов активности. Особый класс
составляют атермальные растворы, у которых теплота смешения равна нулю, а
коэффициенты активности определяются только энтропийным членом и не зависят от
температуры. Теория таких растворов часто позволяет предсказывать свойства
неидеальных растворов, например в случае неполярных компонентов с сильно
различающимися молекулярными объёмами. Близки к атермальным многие растворы
высокомолекулярных соединений в обычных растворителях.
Строение раствора определяется прежде всего
характером компонентов, его образующих. Если компоненты близки по химическому
строению, размерам молекул и т.п., то строение раствора принципиально не
отличается от строения чистых жидкостей. Молекулы веществ, заметно отличающихся
по своему строению и свойствам, обычно сильнее взаимодействуют друг с другом,
что приводит к образованию комплексов в растворах, которые вызывают отклонения
от идеальности. Энергии образования этих комплексов достигают величин
нескольких кДж/моль, что позволяет говорить о существовании в растворах слабых
химических взаимодействий и образовании тех или иных химических соединений -
новых компонентов растворов.
Задание №1
раствор химический термодинамический квазирегулярный
Суть задания №1 заключатся в построение диаграмм
плавкости квазирегулярных растворов с использованием параметров расчетов,
которые приведены в Таблице 1, 2.
Таблица 1 - Параметры взаимодействия жидких и
твердых растворов в системе Si-Al
|
Элемент
|
Si
|
|
Ws, кДж/моль
|
Wl, кДж/моль
|
|
Al
|
63,16
|
-17,33 + 5,1·10-3Т
|
Таблица 2 - Температура и энтальпия плавления
компонентов
|
ΔHo, Дж/мольT,
K
|
|
|
|
Al
|
10800
|
933,3
|
|
Si
|
49800
|
1693
|
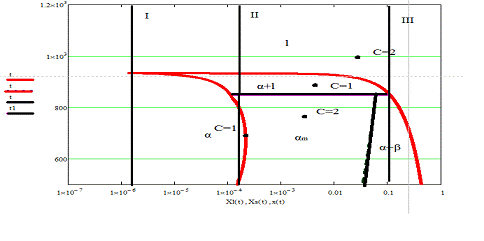
Диаграмма состояния системы алюминий - кремний
(Al-Si)
Координаты линий солидуса и ликвидуса при
заданной температуре рассчитываются по формулам:
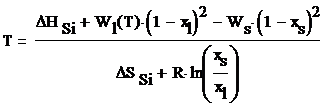
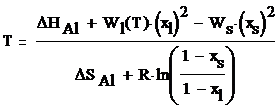
где ΔHAl
- стандартная энтальпия образования элемента Al,
ΔHSi
- стандартная энтальпия образования элемента Si,
xl - мольная доля компонента Al
в жидкой фазе, xs - мольная доля компонента Al
в твердой фазе, Т - температура, R
- универсальная газовая постоянная.
Линию спинодали строим по уравнению химической
спинодали
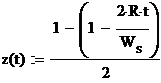
где t
- температура.
На диаграмме плавкости системы Si-Al
- Линия ликвидуса
- Линия солидуса
- Эвтектическая изотерма
- Линия спинодали
Система имеет ретроградный характер
растворимости.
Степени свободы, обозначенные на диаграмме,
являются условными т.к. взят двумерный срез трехмерной диаграммы плавкости
системы Si-Al
при постоянном давлении.
Фазы:
α - компонент А с
примесью В
β - компонент B
с примесью A
l - жидкий раствор
компонентов А и В
αm-
метастабильная фаза α
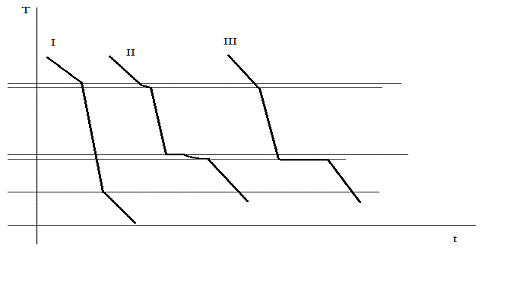
График линий охлаждений системы Al-Si
Задание №2
Заданием №2 является:
. Расчёт зависимость теплового эффекта
реакции от температуры в заданном диапазоне.
. Нахождение температурной зависимость
энергии Гиббса реакции в заданном диапазоне.
. Нахождение температурной зависимость
стандартной константы равновесия К°, Kx, KP и KC в заданном диапазоне. Считать,
что в момент смешения относительные парциальные давления каждого реагента равны
единице (все вещества вступают в реакцию при давлении 1 атм.). Отразить
рассчитанные зависимости в масштабе lg(К) - Т.
Задание выполнено с использованием параметров
расчетов которые приведены в Таблице 1, 2.
Таблица 1
- Температурные
коэффициенты веществ
|
Элемент
|
Температурный
коэффициент
|
|
a
|
b
|
c
|
d
|
17.45
|
60.46*10^-3
|
1.117*10^-6
|
-7.2*10^-9
|
|
O2
|
31.46
|
3.39*10^3
|
-3.77*10^5
|
|
|
CO2
|
44.14
|
9.04*10^-3
|
-8.53*10^5
|
|
|
H2O
|
30
|
10.71*10^-3
|
0.33*10^5
|
|
Таблица 2 - Стандартные энтальпии и энтропии
образования веществ
|
Элемент
|
ΔS, Дж/К
|
ΔH, Дж/моль
|
|
CH4
|
186.19
|
-74.85*10^3
|
|
O2
|
205.03
|
0
|
|
CO2
|
213.6
|
-393.51*10^3
|
|
H2O
|
188.74
|
-241.84*10^3
|
. Для расчёта зависимости теплового эффекта
реакции от температуры в заданном диапазоне нужно воспользоваться формулой:
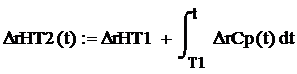
где ΔrHT1 -
стандартная энтропия реакции
ΔrCp(t) - функция
зависимости теплоемкости реакции от температуры
Стандартная энтропия реакции
находится как разность энтропий образования продуктов реакции и энтропий образования
компонентов.
Функция зависимости теплоемкости
реакции находится как разность функций зависимости теплоемкости продуктов и
функций зависимости теплоемкости компонентов реакции.
Они в свою очередь находятся по
формулам:
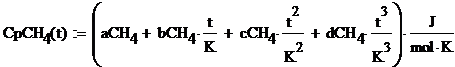

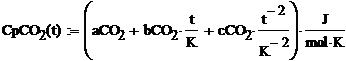
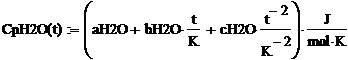
где a, b, c, d -
коэффициенты, взятые из таблицы 1.
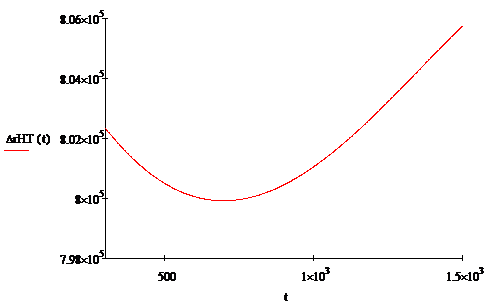
График зависимости теплового эффекта
реакции от температуры
. Для нахождения температурной
зависимость энергии Гиббса реакции в заданном диапазоне воспользуемся формулой:
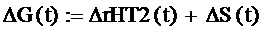
где ΔrHT2(t) - функция
зависимости теплового эффекта реакции от времени
ΔS(t) - функция
зависимости энтальпии реакции от температуры
Функция зависимости энтальпии
реакции находится по формуле:
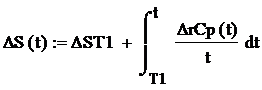
где ΔrCp(t) -
функция зависимости теплоемкости реакции от температуры
ΔST1 -
стандартная энтальпия реакции.
Стандартная энтальпия реакции
находится как разность энтальпий компонентов и продуктов реакции.
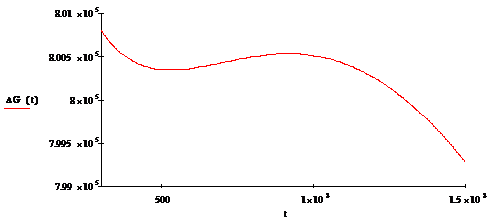
График зависимости энергии Гиббса от температуры
. Для нахождения температурной зависимость
стандартной константы равновесия К°, Kx, KP и KC в заданном диапазоне можно
воспользоваться формулой:
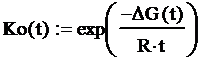
где ΔG(t) - функция
зависимости энергии Гиббса реакции от времени
R -
постоянная Больцмана
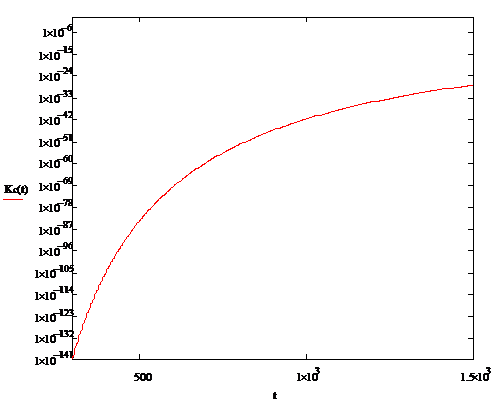
График зависимости стандартной
константы равновесия от температуры
Для расчёта стандартной константы равновесия Кх
используем следующую формулу:
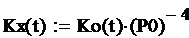
где P0 - нормальное
давление
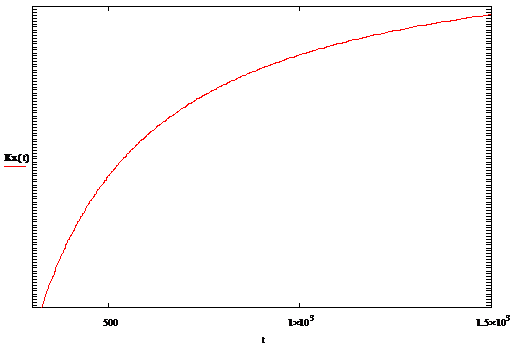
График зависимости стандартной константы
равновесия от температуры
Для расчёта стандартной константы равновесия Кp
используем следующую формулу
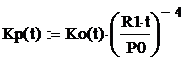

График зависимости стандартной константы
равновесия от температуры
Для расчёта стандартной константы равновесия Кc
используем следующую формулу:
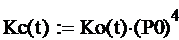
где P0
- нормальное давление
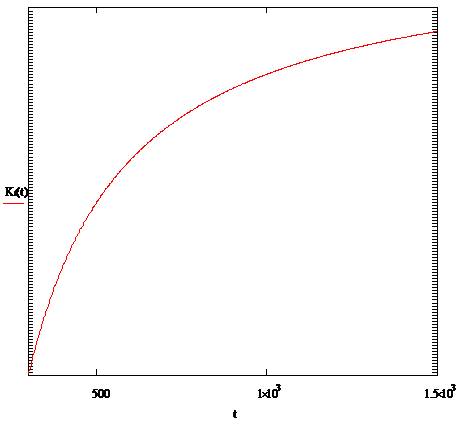
График зависимости стандартной константы
равновесия от температуры
Заключение
В результате выполнения заданий была построена
двумерная диаграммы плавкости системы Al-Si,
на которой явно виден ретроградный характер растворимости. Отмечены также
фазовый состав системы и точки, показывающие степени свободы в данной области
системы. Были построены кривые охлаждения по этой диаграмме, которые походят по
трем точкам.
Были построены графики зависимости: энтальпии
заданной реакции, энергии Гиббса, стандартной константы равновесия от
температуры.
Список использованных
источников
1.
Годнев И.Н., Краснов К.С., Воробьев Н.К. и др. Физическая химия: Учеб. пособие
// М.: Высш. Шк., 1982. - 687 с.
.
Краткий справочник физико-химических величин. Изд. 8, перераб. // Под. ред.
А.А. Равделя и А.М. Пономаревой. - Л. Химия, 1983. - 232 с.