Расчет значений ЛПЭ в радиобиологических экспериментах с тяжелыми ионами
Государственное
бюджетное образовательное учреждение
высшего
образования Московской области
«Международный
университет природы, общества и человека «Дубна»
ВЫПУСКНАЯ
КВАЛИФИКАЦИОННАЯ РАБОТА
БАКАЛАВРСКАЯ
РАБОТА
Тема Расчет
значений ЛПЭ в радиобиологических экспериментах с тяжелыми ионами
ФИО студента Нуршаева Фариза
Сейсенбаевна
Направление «Физика»
Выпускающая кафедра Ядерная
физика
г. Дубна
Аннотация
В данной дипломной работе с помощью программ Lise++
и TRIM выполнены расчеты
характеристик пучков тяжелых ионов, которые можно использовать в
радиобиологических экспериментах на изохронном циклотроне У400М Лаборатории
ядерных реакций ОИЯИ. С учетом наличия набора различных поглотителей (мишеней)
на пути ионов определены их энергии на входе в биологические образцы и
рассчитаны продольные распределения ЛПЭ в образцах периферической крови
человека толщиной 2 мм. С целью расширения диапазона доступных значений ЛПЭ
рассмотрена возможность дополнительного торможения ионов в алюминиевых фильтрах
толщиной 200, 500, 1000, 1500 и 2000 микрон и рассчитаны характеристики ионов
при наличии указанных фильтров. Показано, что возможно провести эксперимент по
облучению биологических образцов ионами с различными значениями Z
и энергии, но с одинаковыми значениями ЛПЭ. Выполненные расчеты будут
востребованы при планировании радиобиологических экспериментов на установке
“Геном-М” циклотрона У400М ЛЯР.
Abstract
this diploma thesis, with the use of
the Lise++ and TRIM programs, calculations are performed of the characteristics
of heavy ion beams that are suitable for radiobiological experiments at the
U400M isochronous cyclotron (the Laboratory of Nuclear Reactions, the Joint
Institute for Nuclear Research). For a set of different targets on the ion
pathway, ion energies are calculated at the entrance into biological samples,
and longitudinal LET distributions in 2 mm thick human peripheral blood samples
are calculated. To broaden the available LET range, a possibility is considered
of the additional slowdown of ions in aluminum filters with a thickness of 200,
500, 1000, 1500, and 2000 мm, and ion characteristics are calculated for the
presence of these filters. It is shown that it is possible to conduct an
experiment on irradiating biological samples with ions of different Z and
energy values but the same LET. The performed calculations will be needed for
planning radiobiological experiments at the Genome-M facility of the U400M
cyclotron.
Содержание
Введение
Глава 1. Постановка
радиобиологических экспериментов в ОИЯИ
.1 Циклотрон У-400М Лаборатории
ядерных реакций
.2 Облучательная установка ЛРБ
“Геном -М” на канале масс-сепаратора ACCULINNA
циклотрона У-400М
Глава 2. Моделирование прохождения
ионов пучка от ускорителя до облучаемого образца
.1 Расчет значений энергии ионов на
программе Lise++
.2 Применение дополнительных
алюминиевых фольг
.3 Использование программу TRIM
для пространственного распределения ЛПЭ
Глава 3. Применение теоретических
расчетов
.1 Мутаций в локусе HPRT
.2 Цитогенетический анализ препаратов
.3 Метод ДНК-фокусов
Результаты и выводы
Заключение
Литературы
Введение
В Лаборатории радиационной биологии
Объединенного института ядерных исследований проводятся широкомасштабные
экспериментальные исследования механизмов мутагенного действия ионизирующих
излучений, различающихся по физическим характеристикам, на клетки с различным
уровнем организации генетического аппарата. Тяжелые заряженные частицы являются
эффективным инструментом при решении вопросов, связанных с выяснением
механизмов биологического действия ионизирующей радиации. Радиобиологические
эксперименты проводятся на ускорителях заряженных частиц ОИЯИ с пучками
протонов, легких и тяжелых ионов различных энергий. В качестве биологических
объектов облучения используются различные клетки млекопитающих и растений,
микроорганизмы, белки, дрожжи и т.д. Первопричиной возникновения радиационных
эффектов является передача энергии от частицы веществу. Результаты воздействия
ионизирующей радиации на биологические объекты зависят от многих факторов, в
том числе от дозы поглощенной в объекте энергии и от качества излучения. В
первом приближении качество излучения характеризуется значением линейной
передачи энергии (ЛПЭ) частицы в объекте. От величины ЛПЭ зависит, главным
образом, относительная биологическая эффективность ионизирующего излучения.
Линейная передача энергии (linear
energy transfer)
LD
для заряженных частиц - отношение dE/dl,
где dE
- средняя энергия, потерянная заряженной частицей
на длине трека dl
в таких столкновениях с электронами оболочек атомов среды, при которых
переданная им энергия меньше D. Эту величину
также называют ограниченной ЛПЭ в отличие от неограниченной ЛПЭ, т. е. L∞
при D ®
∞.
Неограниченная L равна
линейной тормозной способности вещества, обусловленной электронными столкновениями,
т.е. dE/dxel.
Электроны, выбиваемые с орбит атомов за счет кулоновских сил при взаимодействии
с ними заряженной частицы и вылетающие из трека частицы в среде называются d-электронами.
Максимальная кинетическая энергия Тmax,
которая может быть передана частицей d-электрону,
зависит, главным образом, от скорости (энергии) частицы и в первом приближении
может быть оценена по следующей зависимости, справедливой для тяжелых частиц и
сравнительно небольших энергий:
Тmax
= 2mec2b2/(1-b2)
(1)
где me
-
масса электрона (МэВ), b - относительная
скорость частицы v/c.
Наиболее энергичные d-электроны образуются при малых
параметрах удара. Большая часть д-электронов
с малыми энергиями вылетает под углами, близкими к р/2
относительно направления движения частицы, а наиболее энергичные д-электроны
образуются под малыми углами к траектории частицы. Скорость частицы в
нерелятивистском случае связана с её кинетической энергией T
и массой M простым
соотношением:
v = (2T/Mc2)0,5
(2)
Скорость заряженного тяжелого иона с суммарным
числом нуклонов М и энергией Т равна скорости одного его нуклона с энергией Т/М
(МэВ/нуклон). На рис. 1 приведена зависимость скорости протона от энергии (иона
от энергии на нуклон), а на рис. 2 - зависимость от энергии протона (иона на нуклон)
максимально возможной энергии d-электронами по формуле (1).
Энергетический спектр д-электронов:
dNe/dTe
= Q/Te2,
где Te
- кинетическая энергия д-электронов,
а Q на длине пути частицы dx
выражается следующей формулой через заряд z
и скорость частицы v, атомную
массу вещества М, атомный номер вещества Z
и плотность r:
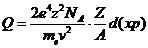
Таким образом, энергетический спектр
д-электронов
есть обратно квадратичная зависимость и очень быстро спадает с ростом энергии д-электрона.
Поэтому подавляющая часть д-электронов имеет малые значения
энергии - единицы и десятки кэВ.
Рис.1. Зависимость относительной
скорости от энергии частицы
Налетающая заряженная частица может
взаимодействовать кулоновским полем как с орбитальными электронами атомов, так
и с ядрами атомов. При этом она теряет часть своей энергии, передаваемой
электронам и ядрам. Помимо этого имеют место еще и радиационные потери энергии
частицы на образование тормозного излучения. Ядерные потери энергии заряженных
частиц в веществе пренебрежимо малы по сравнению с потерями за счет
взаимодействия с атомными электронами (электронных или ионизационных потерь).
Интенсивность тормозного излучения обратно пропорциональна квадрату массы
частицы и прямо пропорциональна квадрату заряда. Поэтому учет этого вида
излучения важен только для электронов, а для тяжелых частиц становится
сколько-нибудь заметным только при очень больших энергиях. Если пролетающая
через вещество частица имеет энергию большую, чем энергия связи ядра, то
удельные ионизационные потери энергии для тяжелых заряженных частиц описываются
известной формулой Бете-Блоха:
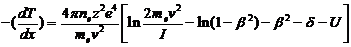 (3)
(3)
где mе - масса электрона
(mес2 = 511 кэВ -
энергия покоя электрона); v - скорость частицы; z - заряд частицы в единицах
заряда позитрона; n - плотность электронов в веществе; I - средний ионизационный
потенциал атомов вещества среды, через которую проходит частица. I = 13,5
эB*Z', где Z' - заряд ядер вещества среды в единицах заряда позитрона.
Качественная зависимость удельных ионизационных потерь от энергии частицы
показана на рис. 3. Участок ВС соответствует области зависимости потерь
согласно закону 1/v2 (описываемому формулой Бете-Блоха). На участке
CD происходит релятивистское увеличение потерь, которое на участке DE начинает
компенсироваться эффектом плотности. Участок BA соответствует уменьшению
ионизационных потерь с уменьшением скорости частицы, связанному с эффектом
перезарядки, причём в окрестности точки B скорость частицы сравнивается с
орбитальными скоростями атомных электронов. При ещё меньших скоростях частицы
основную роль в потерях энергии частицей начинают играть упругие столкновения с
атомом как с целым и, в конечном счете, частица входит в равновесное состояние
с атомами среды (термализуется).
При пролете заряженной частицы на расстоянии,
при котором кулоновских сил недостаточно для отрыва атомных электронов с
оболочек, может происходить их возбуждение, т.е. квантованное изменение орбит
электронов c увеличением их
расстояния от ядра, что равносильно увеличению потенциальной энергии
электронов. Эти процессы называют "возбуждением атома или молекулы”.
Возбуждение затем снимается испусканием электромагнитного излучения
сравнительно низкой энергии. При движении заряженной частицы через вещество
примерно 30 % своей энергии она тратит на ионизацию и 70 % на возбуждение
атомов. Однако возбуждение атомов и молекул не приводит к прямым эффектам
воздействия ионизирующего излучения на биологические объекты. Главным
механизмом прямого действия излучений является именно ионизация атомов
биологического объекта.
В конечном счете, можно считать, что вся
энергия, потерянная частицей в веществе равна энергии образовавшихся d-электронов
и энергии, отданной на возбуждение атомов, и если пробег всех d-электронов
будет укладываться в объекте, то поглощенная в объекте энергия будет равна
ионизационной потери энергии частицы. Величину поглощенной энергии,
нормированную на единицу массы вещества, принято называть поглощенной дозой.
Единица поглощенной дозы 1 Грей равна энергии 1 Дж поглощенной в 1 кг вещества.
Поглощенная доза наряду с качеством излучения определяет радиационные эффекты в
веществе, и зависит не только от излучения, но и от типа вещества. Определение
переданной веществу энергии основывается на представлении о том, что
главенствующую роль в физических, химических и радиобиологических эффектах
ионизирующего излучения играет передача энергии при ионизации и возбуждении
атомов среды.
В случае моноэнергетического заряженного
излучения одного типа для определения поглощенной дозы целесообразно
использовать понятие симы C (cema - converted energy
per unit mass). Величина С определяется как суммарные потери энергии тяжелых
заряженных частиц с флюенсом Ф в электромагнитных взаимодействиях со средой
плотностью r деленные на единицу массы среды:
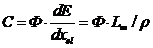 (4)
(4)
Здесь - массовая электронная
тормозная способность вещества для частицы с энергией Е. При условии
существования электронного равновесия значение С численно равно значению
поглощенной дозы D и может быть получено расчетным путем в случае
моноэнергетических частиц.
Используя соотношение 1 Гр = 6,241×109
МэВ/г, можно легко определить необходимый флюенс моноэнергетических
частиц (частиц×см-2) Ф1Гр,
которые должны пройти через образец для получения им определенной поглощенной
дозы 1 Гр.
Ф1Гр = 6,241×109/(dE/dxel)
(5)
где dE/dxel
в
единицах МэВ×см2/г.
Если пробег образовавшихся d-электронов
будет превышать размер облучаемого объекта, то электронное равновесие будет
нарушено и часть энергии частицы, потерянной ею при прохождении через объект,
будет вынесена из него вышедшими d-электронами. В
результате этого поглощенная в объекте энергия будет меньше энергии, потерянной
в нем частицей. В таком случае в расчет поглощенной дозы по формуле (3) надо
внести поправку на вынесенную из объекта энергию. Объемы и толщины биологических
образцов, используемых в экспериментах, как правило малы (1-3 см3 и
1-5 мм соответственно). Материалом биологических образцов, в хорошем
приближении, можно считать воду. Экстраполированный пробег Rэкс,
г/см2, электронов в диапазоне энергий от 0,3 кэВ до 30 МэВ для
материалов с атомными номерами от 5,3 до 82 при нормальном падании на образец
может быть определен по формуле [1]:
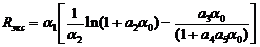 (6)
(6)
где aо
= Ео/moc2
(Ео - энергия электрона, МэВ; moc2
= 0,511 МэВ - энергия покоя электрона); a1
= 0,2335×М/Z1,209;
a2
= 1,78×10-4Z;
a3
=
0,9891-3,01×10-4Z;
a4
= 1,468-1,18×10-2Z;
a5
=
1,232/Z0,109
(М - атомная масса вещества, Z
- атомный номер вещества). Для молекул используется Zэфф
= SZi×ki/SМi
(Zi - атомные номера
всех атомов молекулы, ki
-
их количество в молекуле, Мi
- атомные массы). В случае воды Zэфф = 8×16/18
+ 1×2/18
= 130/18 = 7,222. Максимальная погрешность аппроксимирующей формулы (6) для Ео
< 1 МэВ - 8,4%, для Ео > 1 МэВ - 4,5%. На рис. 4
представлена зависимость экстраполированного пробега электронов в воде по
формуле (6). Видно, что для тяжелых заряженных частиц с энергией до 50
МэВ/нуклон значение пробега в воде д-электронов
с максимальной энергией (см. рис. 2) не превысит ~ 0,2 мм. С
учетом очень малого числа д-электронов
с большими энергиями из всего спектра и тот факт, что покинуть облучаемый
объект могут лишь д-электроны с
максимальной энергией, рожденные в последних слоях объекта толщиной менее 0,2
мм, можно сделать вывод, что при облучении объектов частицами с энергией до 50
МэВ/нуклон в них с большой точностью соблюдается условие электронного
равновесия. Точные расчеты показали, что для биологических образцов,
используемых в радиобиологических экспериментах ЛРБ, погрешность расчетного
значения D за счет неточности
выполнения условия электронного равновесия при энергии частиц 1 ГэВ/нуклон
составляет ~ 1,4 %, при энергии частиц 0,5
ГэВ/нуклон - 0,33 %, а при энергии 50 МэВ/нуклон
пренебрежимо мала.
Рис.2. Зависимость удельных ионизационных потерь
от энергии частиц (в единицах отношения их кинетической энергии к энергии
покоя)
Рис. 3. Зависимость экстраполированного пробега д -электронов в воде от их энергии
Глава 1. Постановка радиобиологических
экспериментов в ОИЯИ
Радиобиологические эксперименты по облучению
различных биологических объектов тяжелыми заряженными частицами проводятся на
ускорителях ОИЯИ - фазотроне Лаборатории ядерных проблем, ускоряющем протоны до
энергии 660 МэВ, Нуклотроне Лаборатории высоких энергий, ускоряющем протоны до
энергии 10 ГэВ и ионы с массой до углерода до энергии 4 ГэВ/нуклон (в настоящее
время) и изохронном циклотроне У400М Лаборатории ядерных реакций, ускоряющем
тяжелые ядра до энергии 50 МэВ/нуклон. Возможность использования пучков
заряженных частиц с большим диапазоном Z
различной энергии создает уникальную вариабельность радиобиологических
экспериментов по значениям ЛПЭ.
Рис. 4. Диапазон ЛПЭ тяжелых заряженных частиц,
пригодных для проведения радиобиологических экспериментов в ОИЯИ. Синий цвет -
протоны фазотрона ЛЯП, черный цвет - ионы Нуклотрона
ЛФВЭ, красный цвет - ионы циклотрона У400М ЛЯР
В совокупности ускорители ОИЯИ предоставляют
возможность проводить эксперименты в ЛПЭ от долей кэВ×мкм-1
(протоны высоких энергий) до нескольких сотен кэВ×мкм-1
(тяжелые ионы низких энергий). Рис. 4 демонстрирует возможности пучков
тяжелых заряженных частиц с различными ЛПЭ для проведения радиобиологических
экспериментов на вышеперечисленных ускорителях. В настоящее время ионы тяжелее
углерода на Нуклотроне ЛФВЭ не ускоряются, поэтому наибольшие значения ЛПЭ
достигаются при облучении биологических образцов тяжелыми ионами на изохронном
циклотроне У400М.
.1 Циклотрон У-400М Лаборатории ядерных реакций
Изохронный циклотрон У400М с диаметром магнита
400 см был создан в ЛЯР путем радикальной реконструкции в 1989-1991 гг.
циклотрона У300. Работа циклотронов, как и других ускорителей, основана на
особенностях движения заряженных частиц в электромагнитном поле. В циклотроне
однородное магнитное поле создает большой электромагнит, а электрическое поле
возникает между двумя полыми электродами -
«дуантами». К электродам приложено переменное напряжение, которое меняет
полярность всякий раз, когда частица делает пол-оборота. Благодаря этому
электрическое поле ускоряет частицы. Хотя их скорость с ростом энергии растет,
период обращения остается постоянным, поскольку диаметр траектории
увеличивается в том же отношении. Именно это свойство циклотрона и позволяет
использовать для ускорения постоянную частоту электрического поля. Циклотрон
существенно ограничен нерелятивистскими энергиями частиц, в обычных циклотронах
протоны можно ускорять до 20 - 25 МэВ. Для ускорения тяжёлых частиц до
существенно больших значений энергии используют изохронные циклотроны или же
синхроциклотроны.
В отличие от синхроциклотрона изохронный
циклотрон обеспечивает непрерывность ускоренного пучка частиц. В изохронных
циклотронах для сохранения неизменной частоты обращения создаётся неоднородное,
нарастающее по радиусу магнитное поле. Постоянство частоты обращения
обеспечивается сложным законом изменения магнитного поля магнита по радиусу и
азимуту. Aзимутальная
вариация поля реализуется обычно с помощью секторной структуры магнита.
Равновесная орбита частицы в изохронном циклотроне не является точной
окружностью. Недостатком изохронных циклотронов является то, что в них орбиты
частиц неустойчивы в вертикальном направлении. Преимуществом -
сравнительно большие значения тока пучка, характерные для всех типов
циклотронов. На рис. 5 представлена фотография циклотрона У-400М. Циклотрон У-400М
позволяет ускорять частицы различных типов с различными отношениями числа
стандартных единиц атомной массы к числу элементарных зарядов (A/Z
= 2 ¸
5) до энергии ~ 50 МэВ/нуклон. Список доступных на циклотроне
тяжелых ионов и характеристики их пучков приведены в таблице 1 [2].
Рис. 5. Внешний вид изохронного циклотрона У400М
ЛЯР
Таблица 1. Список тяжелых ионов, доступных на
У400М.
|
Ион
|
A/Z
|
E
MэВ/A
|
F
частота
|
I
мкА
|
Ион
|
A/Z
|
E
MэВ/A
|
F
частота
|
I
мкА
|
|
7Li2+
|
3.5
|
34
|
15
550
|
1.4
|
20Ne6+
|
3.33
|
46
|
16
080
|
|
|
6Li2+
|
3.0
|
50
|
17
500
|
|
22Ne6+
|
3.66
|
|
15
012
|
|
|
40Ar10+
|
4.0
|
|
13
840
|
|
22Ne7+
|
3.14
|
|
16
930
|
0.7
|
|
40Ar11+
|
3.63
|
38
|
15
100
|
2.4
|
12C2+
|
6.0
|
|
14
500
|
|
|
40Ar12+
|
3.33
|
37
|
16
080
|
0.4
|
12C4+
|
3.0
|
|
17
500
|
0.5
|
|
40Ar6+
|
6.66
|
|
14
900
|
|
32S16+
|
2.0
|
|
16
710
|
|
|
14N5+
|
2.8
|
|
18
230
|
0.3
|
11B3+
|
3.66
|
34
|
15
012
|
21.0
|
|
14N4+
|
3.5
|
34
|
15
550
|
0.5
|
DT1+
|
|
|
|
0.2
|
|
15N
5+
|
3.0
|
|
17
500
|
0.5
|
32S10+
|
3.2
|
|
16
710
|
0.12
|
|
16O5+
|
3.2
|
48
|
16
710
|
1.5
|
4He2+
|
2.0
|
|
|
|
|
18O5+
|
3.6
|
35
|
15
230
|
1.0
|
13C4+
|
3.25
|
|
16
480
|
1.7
|
|
16O5+
|
3.2
|
48
|
|
|
86Kr9+
|
9.55
|
|
12
768
|
0.3
|
|
20Ne2+
|
|
6
|
|
|
|
|
|
|
|
|
20Ne5+
|
4.0
|
|
13
840
|
|
|
|
|
|
|
Транспортировка тяжелых ионов из циклотрона
осуществляется по вакуумированному ионопроводу, оборудованному элементами
магнитной оптики (квадрупольными линзами для изменения апертуры пучка и
поворотными магнитами). Облучение биологических образцов производится после
выпуска пучка ионов из ионопровода в атмосферу через тонкую разделительную
фольгу. По пути до биологического образца ионы теряют часть энергии в различных
поглотителях и на входе в образец имеют энергии, отличные от указанных в таблице.
Начальная энергия ионов также может несколько отличаться от указанной. С целью
расширения энергетического диапазона ионов, падающих на мишень, на их пути
могут устанавливаться дополнительные поглотители (фильтры) из алюминия. Толщина
биологических образцов также может меняться от 1 до 3 мм при необходимости. Все
вышеупомянутое приводит к значительному разбросу по ЛПЭ в зависимости от
конкретных условий эксперимента даже для ионов одного типа.
Целью настоящей работы является расчет средних
значений ЛПЭ в биологических образцах на пучках ионов циклотрона У400М при
типичном наборе поглотителей в канале транспортировки пучка и за ним, а также
при использовании дополнительных фильтров из алюминия.
1.2 Облучательная установка ЛРБ “Геном -М” на
канале масс-сепаратора ACCULINNA
циклотрона У-400М
На отводе масс-сепаратора ACCULINNA
в зале изохронного циклотрона У400М размещена установка ЛРБ “Геном-М”,
предназначенная для быстрого автоматизированного облучения большого числа
биологических образцов. ACCULINNA
является сепаратором вторичных пучков экзотических ионов высокой интенсивности.
Сепаратор представляет собой специальный канал транспорта пучков в
экспериментальном зале У400М, оборудованный мишенью для производства фрагментов
ионов, необходимой магнитной оптикой и время-пролетным спектрометром (рис. 6).
В канале ионопровода поддерживается глубокий
вакуум, поэтому потерями энергии выведенных из ускорителя ионов на пути до
выпускной фольги можно пренебречь. Однако в начале канала находится
стационарная фольга из Та толщиной 4 мкм, а также стационарная мишень для
производства фрагментов ионов из Ве толщиной 300 мкм. В радиобиологических
сеансах при работе на установку “Геном-М” питание поворотного магнита D2
отключается, и ионы пучка прямо направляются через отвод канала на установку
“Геном-М" [3]. Поскольку для облучения биологических образцов необходимо
иметь плоское однородное поле в районе их расположения, пучок немного
расфокусируется с помощью квадрупольных магнитных линз D5,
6, и апертура пучка на выходе отвода канала увеличивается.
Автоматизированная установка “Геном-М” реализует
несколько задач:
1) производит последовательное автоматическое
облучение до 12 биологических образцов по заданной программе;
2) управляет проводкой пучка ионов на
установку;
) выполняет измерение поглощенной дозы в
каждом образце за период его экспозиции на пучке ионов;
) осуществляет непрерывный невозмущающий
контроль качества пучка ионов в процессе облучения образцов.
Рис. 6. Общий план зала У400М с размещением
каналов экспериментальных установок. D1,
D2 -
поворотные магниты, М -
фрагментообразующая мишень, Q5,6
- дублет квадрупольных линз, LTOF
- база времяпролетного спектрометра. Красным
прямо-угольником обозначено место расположения установки "Геном-М" на
отводе канала
В соответствии с задачами в состав установки
входят: фланец-коллиматор, формирующий поле ионов за пределами ионопровода,
набор плоскопараллельных воздушных ионизационных камер для контроля
однородности ионного поля и измерения поглощенной в образце дозы, реверсивный
двигатель и вращающийся сменный барабан с фиксированными в нем биологическими
образцами, тонкая рассеивающая мишень и сцинтилляционный детектор для
невозмущающего контроля качества пучка по упруго рассеянным в мишени ионам,
оборудование для градуировки дозиметрической ионизационной камеры, необходимая
электроника и программное обеспечение.
Выпуск пучка ионов в атмосферу осуществляется
через фланец-коллиматор с пятью отверстиями диаметром 14 мм, закрытыми общей
разделительной вакуумно-плотной фольгой из нержавеющей стали толщиной 6 мкм.
Этой фольги достаточно для поддержания в ионопроводе глубокого вакуума. Толщина
стального фланца коллиматора достаточна для полного торможения в нем самых
энергетичных ионов. Непосредственно за отверстиями во фланце-коллиматоре
имеются пять идентичных ионизационных камер, Центральная из камер является
дозиметрической, т.е. биологические образцы облучаются ионами, проходящими
через центральный коллиматор и эту камеру.
Плоскопараллельные воздушные камеры выполнены из
3 электродов (фольг из нержавеющей стали толщиной 6 мкм и диаметром 16 мм,
перекрывающим размер коллиматора). На центральный электрод подается постоянное
напряжение - 300 В, с двух крайних электродов снимается заряд. Зазоры между
электродами - по 6 мм воздуха. В отсутствии ионизирующего излучения темновой
ток камер составляет около 1 пА. Назначение остальных 4-х камер вокруг
центральной - оценка пространственного распределения плотности потока ионов на
выходе из ионопровода. На рис. 7 показана схематически конструкция
фланца-коллиматора и размещение за ним блока ионизационных камер, а на рис. 8 -
фотография этого блока. Чувствительности камер предварительно выровнены по их
показаниям с изотопным альфа-источником. Поэтому, если оператором ускорителя
режим проводки пучка ионов по каналу подобран так, что показания всех камер
отличаются не более, чем на 10 %, то равномерность поля в пределах центрального
коллиматора диаметром 14 мм будет заведомо много лучше.
Рис. 7. Конструкция фланца-коллиматора и блока
проходных ионизационных камер
Рис. 8. Фотография блока из 5 проходных
ионизационных камер (без сменного барабана)
Биологические образцы помещаются в контейнеры,
монтируемые в отверстия в сменном поворотном барабане. Вращение барабана
осуществляется реверсивным электродвигателем постоянного тока (24 В). Всего в
барабане можно разместить 12 контейнеров с образцами, но обычно 1 отверстие
контейнера не заполняется контейнером, а остается пустым для контроля. С
помощью поворотного барабана образцы поочередно устанавливаются напротив
центрального коллиматора и дозиметрической камеры на пути пучка ионов. После
набора заданной дозы, измеряемой дозиметрической камерой, пучок ионов
прерывается с помощью чоппера ускорителя по команде программы. Чоппер,
представляет собой пластины, на которых создается потенциал достаточный для
резкого отклонения пучка в сторону. Чоппер отклоняет пучок ионов источника еще
в канале инжекции, в результате чего не происходит их ускорения. Отключение
пучка при смене позиции барабана выполняется для повышения точности облучения
образцов заданной дозой, и особенно важно при её малых значениях. Затем
производится быстрый поворот барабана на один шаг реверсивным электродвигателем
постоянного тока по команде программы. Для точного позиционирования барабана
применен «мальтийский крест» с концевыми контактами, сигналы с которых
используются для управления работой электродвигателя. После срабатывания
концевых контактов чоппер выключается и начинается облучение нового образца.
Для визуального контроля работы установки с пульта ускорителя используется IP
видеокамера, монтируемая рядом с установкой. Схематическая конструкция
установки показана на рис. 9А и 9Б, а её фотография на рис. 9В.
Показания ионизационных камер не несут
информации о составе пучка. Поэтому для облучения биологических образцов ионами
с заявленными характеристиками необходим постоянный (on-line)
контроль параметров пучка, причем сами средства контроля не должны возмущать
пучок и менять его параметры.
Для этого в ионопроводе на расстоянии 50 см от
выпускной фольги установлена тонкая танталовая мишень-рассеиватель толщиной 4
мкм и диаметром 8 см.
Рис. 9. Схематическая конструкция установки
“Геном-М”. А - вид сбоку, Б - вид с торца (СД -
сцинтилляционный датчик с пластическим сцинтиллятором, ЭД - реверсивный
электродвигатель постоянного тока), В - фотография
установки со сменным барабаном
Основной канал взаимодействия ионов с этой
фольгой это кулоновское (упругое) рассеяние ионов на ядрах мишени (Та), при
котором происходит изменение энергии ионов и траектории их движения.
Дифференциальное сечение упругого рассеяния нерелятивистской заряженной частицы
в кулоновском поле ядра-мишени описывается формулой Резерфорда:
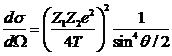 (7)
(7)
где Z1 и Z2 - заряды налетающей частицы и
ядра-мишени, e - элементарный заряд, T - кинетическая энергия
налетающей частицы, и -
угол рассеяния. Число ионов, взаимодействующих с мишенью очень мало, и мишень
пучок не возмущает.
Внутрь ионопровода на расстоянии 30
см по пучку вставлен детектор из пластического сцинтиллятора Æ 1,5 см и
высотой 2 см, соединенный световодом с фотоумножителем. Угол, под которым виден
детектор из центра мишени составляет 14о. Импульсы с этого
сцинтилляционного счетчика подаются на амплитудно-цифровой преобразователь и
далее на многоканальный анализатор импульсов. Поскольку детектор счетчика
находится вне пучка основных ионов, то в него попадают только ионы пучка,
рассеянные на Та фольге. Таким образом счетчик измеряет в процессе облучения
спектр упруго рассеянных в Та мишени ионов. Если основной пучок ионов является
моноэнергетическим и не имеет примесей других ионов, то аппаратурный спектр
рассеянных на фольге ионов представляет собой одиночный пик. В случае, если
основной пучок портится (появляются другие ионы, меняется энергия и т.д.), то
форма спектра рассеянных ионов меняется. Схематическая конструкция системы
невозмущающего контроля качества пучка приведена на рис. 10. На этом же рисунке
справа показаны средства градуировки дозиметрической ионизационной камеры путем
прямого измерения спектра основного пучка ионов при сниженной интенсивности
пучка (сцинтилляционный счетчик с детектором CsI(Tl) или
полупроводниковый DЕ-Е
спектрометр тяжелых ионов).
Рис. 11. Конструкция системы
мониторирования качества пучка ионов установки “Геном-М”. S1, S2 - сцинтилляторы, DЕ, Е - соответственно пролетный
кремниевый детектор и детектор полного поглощения полупроводникового
спектрометра ионов
Глава 2. Моделирование прохождения
ионов пучка от ускорителя до облучаемого образца
Наличие различных поглотителей по
тракту транспортировки пучка ионов из ускорителя до установки “Геном-М” и
поглотители в самой установке снижают энергию ионов на входе в биологического
образец по отношению энергии ионов, выводимых из ускорителя. Ниже приведен
список всех возможных поглотителей (мишеней) вдоль всего тракта и в установке:
· Фольга Ta
4 мкм между камерой ускорителя и трактом пучка;
· Мишень Be
300 мкм для производства фрагментов;
· Фольга Та 4 мкм*;
· Выпускная фольга Fe
3 мкм из ионопровода в атмосферу;
· Воздух 6000 мкм;
· 1-й электрод ионизационной камеры Fe
3 мкм;
· Воздух 6000 мкм;
· 2-й электрод ионизационной камеры Fe
3 мкм;
· Воздух 6000 мкм;
· 3-й электрод ионизационной камеры Fe
3 мкм;
· Воздух 12000 мкм;
· Пленка из лексана
10 мкм**.
Примечание: *фольга-рассеиватель для
контроля качества пучка, **защитное покрытие биологических образцов.
.1 Расчет значений энергии ионов на программе Lise++
Расчет изменения энергии ионов на перечисленных
поглотителях производился с помощью программы Lise++
[4]. Программа была разработана для прогнозирования интенсивности и чистоты
пучков фрагментов ядер, исследуемых на масс-сепараторах. В неё включено много
полезных блоков, в том числе, так называемый “физический калькулятор” для
расчета транспорта ионов через элементы сепаратора. В “физическом калькуляторе”
есть возможность задания последовательного прохождения иона заданного типа и
энергии через ряд поглотителей из простых элементов и соединений и вычисления
соответствующих потерь энергии в каждом поглотителе и значения остаточной
энергии иона. На рис. 11 показан скриншот окна “физического калькулятора”
программы Lise++ c
заданием параметров иона и последовательности мишеней и скриншот окна задания
параметров мишеней.
Рис. 11. Скриншоты окон физического калькулятора
программы Lise++
При постановке радиобиологических экспериментов
на У400М чаще всего используются тонкие кюветы с жидкими образцами (рис. 12) и
реже - монослои клеток, закрепленные на подложке. Во всех случаях биологические
образцы закрыты тонкой лексановой пленкой толщиной 10 мкм.
Рис. 12. Конструкция кюветы для облучения жидких
биологических образцов
При расчетах потерь энергии пучка все
биологические образцы можно имитировать водой с хорошей точностью. При
облучении монослоев клеток энергия ионов за установкой “Геном-М” должна быть
достаточной для проникновения через лексановую пленку и слой воды толщиной 2
мм. Для проведения облучения биологических образцов в кюветах необходимо, чтобы
энергия иона после прохождения лексановой пленки была достаточна для
проникновения через слой воды толщиной 2 мм (меньшую толщину образца трудно
использовать по техническим причинам). Этим требованиям удовлетворяют не все
ионы из таблицы 1, которые может ускорять циклотрон У400М.
Расчет значений энергии ионов из таблицы 1 с
учетов всех указанных выше поглотителей дает возможность определить энергию
ионов на входе в монослой клеток и на выходе из него, т.е. определить потерю
энергии в нем и среднее значение ЛПЭ. Результаты такого расчета представлены в таблице
2.
Таблица 2. Расчет значений ЛПЭ для образцов -
монослоев клеток
|
Ион
|
Е0 МэВ/н
|
Е
на входе в образец толщиной 2 мм, МэВ
|
Е
на выходе из образца толщиной 2 мм, МэВ
|
Среднее
значение ЛПЭ, кэВ/мкм
|
|
6Li
|
50
|
293,73
|
293,5
|
11,505
|
|
7Li
|
34
|
228,94
|
228,62
|
15,89
|
|
11B
|
34
|
347,27
|
346,36
|
45,478
|
|
16O
|
48
|
715,15
|
713,39
|
87,89
|
|
14N
|
34
|
422,25
|
420,41
|
92,26
|
|
18O
|
35
|
561,42
|
559,07
|
117,265
|
|
20Ne
|
52
|
962,24
|
959,65
|
129,3
|
|
20Ne
|
46
|
833,93
|
831,03
|
144,93
|
|
40Ar
|
38
|
1187,7
|
1175,8
|
595,05
|
|
40Ar
|
37
|
1139,5
|
1127,3
|
612,7
|
Таким образом, диапазон изменения ЛПЭ в монослое
клеток при облучении различными ионами на У400М может варьироваться в широких
пределах от 11,5 до 612,7 кэВ/мкм. Из-за малой толщины монослоя погрешности
указанных ЛПЭ (отличие среднего значения ЛПЭ от значения ЛПЭ на входе в образец
и на выходе) очень малы. Так, даже для наиболее тяжелых ионов 40Ar
с энергией 37 МэВ/нуклон эта погрешность составляет ±
0,43%.
.2 Применение дополнительных алюминиевых фольг
Применение алюминиевых дополнительных
поглотителей позволит проводить сравнительное облучение ионами с различными
значениями Z и энергии, но с
одинаковыми значениями ЛПЭ. Например, использование дополнительного Al
поглотителя толщиной 1895 мкм позволит в эксперименте на монослое клеток на
пучке ионов 11B
с Z = 5 и энергией 34
МэВ/нуклон получить практически то же значение ЛПЭ (129,9 кэВ/мкм), что и ионы 20Ne
с Z = 10 и энергией 52
МэВ/нуклон (129,3 кэВ/мкм). Сравнительные эксперименты с такими ионами позволят
исследовать более тонкие биологические эффекты, а именно: влияние структуры
трека заряженных частиц на формирование радиационных повреждений. В приведенном
примере скорости движения ионов 11B
и 20Ne
будут различаться на ~ 24%, соответственно изменится и
распределение d-электронов по энергии.
В экспериментах с образцами крови в кюветах
толщиной 2 мм использование алюминиевых фольг значительно расширяет диапазон
значений ЛПЭ, доступных на пучках ядер циклотрона У400М. Однако при этом
значения ЛПЭ на входе в образец крови и на выходе могут значительно
различаться. В таких случаях приходится говорить о диапазоне линейных передач
энергии, или же указывать среднее значение с максимальным разбросом. Для ионов,
доступных в экспериментах на циклотроне У400М, были рассчитаны с учетов всех
поглотителей на пути ионов их энергии на входе и на выходе из образцов
периферической крови человека толщиной 2 мм, а также соответствующие им
значения ЛПЭ ионов на входе и выходе образцов. Кровь моделировалась водой с
плотностью 1,06 г/см3. Рассмотрены варианты введения в пучок ионов
дополнительных алюминиевых поглотителей (фильтров) толщиной 0,2; 0,5; 1,0; 1,5
и 2,0 мм для расширения диапазона доступных значений ЛПЭ. Результаты расчетов
приведены в таб. 3.
В таб. 3 в последней колонке приведены значения
ЛПЭ, усредненные по всей толщине образца. Эти средние значения получены путем
деления полных ионизационных потерь энергии ионов в образце (DE
= Eвх
- Евых) на толщину образца (2 мм).
ион поглотитель клетка энергия
Таблица 3. Значения энергии ионов на входе и
выходе образцов крови человека толщиной 2 мм, значений ЛПЭ ионов на входе и
выходе образцов и средние значения ЛПЭ в крови
|
Ион,
фильтр
|
Eнач/A,
MэВ/н
|
Енач,
MэВ
|
Ена
входе в образец, MэВ
|
Ена
выходе из образца, MэВ
|
ЛПЭ
на входе, кэВ/мкм
|
ЛПЭ
на выходе, кэВ/мкм
|
, кэВ/мкм
|
|
6Li
|
50
|
300
|
293,65
|
268,39
|
12,291
|
13,118
|
12,63
|
|
+0,2
мм Al
|
50
|
300
|
288,88
|
263,26
|
12,364
|
13,263
|
12,81
|
|
+0,5 мм
Al
|
50
|
300
|
281,61
|
255,43
|
12,572
|
13,635
|
13,09
|
|
+1,0
мм
Al
|
50
|
300
|
269,17
|
241,93
|
13,087
|
14,214
|
13,62
|
|
+1,5 мм
Al Al
|
50
|
300
|
256,27
|
227,8
|
13,596
|
14,884
|
14,29
|
|
+2,0
мм
Al
|
50
|
300
|
242,83
|
212,95
|
14,165
|
15,802
|
14,94
|
|
7Li
|
34
|
238
|
228,88
|
192,87
|
16,829
|
19,368
|
18,01
|
|
+0,2 мм
Al
|
34
|
222,32
|
185,31
|
17,270
|
19,955
|
18,505
|
|
+0,5 мм
Al
|
34
|
238
|
212,18
|
173,47
|
17,913
|
21,062
|
19,36
|
|
+1,0
мм
Al
|
34
|
238
|
194,39
|
152,17
|
19,240
|
23,459
|
21,11
|
|
+1,5 мм
Al Al
|
34
|
238
|
175,26
|
128,16
|
20,871
|
27,102
|
23,55
|
|
+2,0
мм
Al
|
34
|
238
|
154,38
|
99,765
|
23,211
|
33,465
|
27,308
|
|
11B
|
34
|
374
|
347,18
|
236,43
|
48,157
|
65,682
|
55,38
|
|
+0,2 мм
Al
|
34
|
374
|
328,26
|
209,92
|
50,363
|
72,548
|
59,17
|
|
+0,5 мм
Al
|
34
|
374
|
298,18
|
163,95
|
54,442
|
88,816
|
67,12
|
|
+1,0
мм
Al
|
34
|
374
|
242,09
|
36,048
|
64,298
|
282,66
|
103,02
|
|
+1,5 мм
Al
|
34
|
374
|
173,35
|
0
|
84,95
|
0
|
|
|
+2,0
мм
Al
|
34
|
374
|
68,21
|
0
|
180,47
|
0
|
|
|
16O
|
48
|
768
|
714,94
|
503,59
|
93,075
|
123,10
|
105,68
|
|
+0,2mm Al
|
48
|
768
|
678,16
|
453,95
|
96,998
|
133,40
|
112,11
|
|
+0,5mm Al
|
48
|
768
|
619,83
|
370,08
|
104,33
|
157,46
|
124,88
|
|
+1,0 mm
Al
|
48
|
768
|
511,65
|
174,12
|
121,47
|
289,04
|
168,77
|
|
+1,5mm Al Al
|
48
|
768
|
381,87
|
0
|
153,31
|
0
|
|
|
+2 mm Al
|
48
|
768
|
202,16
|
0
|
257,66
|
0
|
|
|
14N
|
34
|
476
|
422,12
|
154,68
|
97,625
|
221,69
|
133,72
|
|
+0,2 мм
Al
|
34
|
476
|
383,2
|
27,047
|
105,61
|
679,51
|
178,08
|
|
+0,5 мм
Al
|
34
|
476
|
318,39
|
0
|
122,45
|
0
|
|
|
+1,0 мм
Al
|
34
|
476
|
177,04
|
0
|
198,39
|
0
|
|
|
+1,5 мм
Al Al
|
34
|
476
|
0
|
0
|
0
|
0
|
|
|
+2,0 мм
Al
|
34
|
476
|
0
|
0
|
0
|
0
|
|
|
18O
|
35
|
630
|
561,26
|
231,76
|
124,10
|
252,95
|
164,75
|
|
+0,2 мм
Al
|
35
|
630
|
511,87
|
106,86
|
133,19
|
450,53
|
202,505
|
|
+0,5 мм
Al
|
35
|
630
|
430,09
|
0
|
153,19
|
0
|
|
|
+1,0 мм
Al
|
35
|
630
|
256,41
|
0
|
234,40
|
0
|
|
|
+1,5 мм
Al Al
|
35
|
630
|
0
|
0
|
0
|
0
|
|
|
+2,0 мм
Al
|
35
|
630
|
0
|
0
|
0
|
0
|
|
Таблица 4. Значения энергии ионов на входе и
выходе образцов крови человека толщиной 2 мм, значений ЛПЭ ионов на входе и
выходе образцов и средние значения ЛПЭ в крови.
|
Ион,
фильтр
|
Eнач/A,
МэВ/н
|
Енач,
МэВ
|
Е
на входе в образец, МэВ
|
Е
на выходе из образца, МэВ
|
ЛПЭ
на входе, кэВ/мкм
|
ЛПЭ
на выоде, кэВ/мкм
|
, кэВ/
|
|
20Ne
|
46
|
920
|
833,68
|
457,6
|
153,42
|
246,31
|
188,04
|
|
+0,2 мм
Al
|
46
|
920
|
772,58
|
352,14
|
163,02
|
304,53
|
210,22
|
|
+0,5 мм
Al
|
46
|
920
|
673,14
|
102,31
|
181,68
|
744,03
|
285,415
|
|
+1,0 мм
Al
|
46
|
920
|
475,4
|
0
|
239,08
|
0
|
|
|
+1,5 мм
Al Al
|
46
|
920
|
168,95
|
0
|
535,1
|
0
|
|
|
+2,0
мм
Al
|
46
|
920
|
0
|
0
|
0
|
0
|
|
|
40Ar
|
38
|
1520
|
1187,3
|
0
|
628,45
|
0
|
|
|
+0,2 мм Al
|
38
|
1520
|
925,1
|
0
|
757,29
|
0
|
|
|
+0,5 мм
Al
|
38
|
1520
|
372,22
|
0
|
1441,3
|
0
|
|
|
+1,0
мм
Al
|
38
|
1520
|
0
|
0
|
0
|
0
|
|
|
+1,5 мм
Al Al
|
38
|
1520
|
0
|
0
|
0
|
0
|
|
|
+2,0
мм
Al
|
38
|
1520
|
0
|
0
|
0
|
0
|
|
|
40Ar
|
37
|
1480
|
1139,1
|
0
|
646,7
|
0
|
|
|
+0,2 мм
Al
|
37
|
1480
|
867,22
|
0
|
794,35
|
0
|
|
|
+0,5 мм
Al
|
37
|
1480
|
259,6
|
0
|
1765,6
|
0
|
|
|
+1,0 мм
Al
|
37
|
1480
|
0
|
0
|
0
|
0
|
|
|
+1,5 мм
Al Al
|
37
|
1480
|
0
|
0
|
0
|
0
|
|
|
+2,0 мм
Al
|
37
|
0
|
0
|
0
|
0
|
|
2.3 Использование программу TRIM
для пространственного распределения ЛПЭ
Для расчета пространственного
распределения ЛПЭ ионов по толщине образца используется программа TRIM (Transport of Ions in Matter) в составе
пакета программ SRIM-2013, разработанного Дж. Ф.
Зиглером [5, 6]. TRIM представляет собой программу
транспорта ионов в некристаллическом веществе методом Монте-Карло без учета
неупругих ядерных реакций. Первый вариант TRIM был создан
еще в 1983 году. В программе моделируются все процессы взаимодействия
налетающей частицы и атомов мишени. Возможно задание кинетической энергии ионов
в широком диапазоне энергий от 10 кэВ до 2 ГэВ, моделирование сложных веществ
мишени, состоящей из нескольких слоев и т.д. SRIM позволяет с
высокой точностью моделировать ионизационные потери энергии частиц в веществе,
энергетические спектры ядер отдачи, 3D-траектории
частиц с учетом многократных столкновений с атомами, процессы имплантации
ионных примесей в вещество и имеет ряд других опций. На рис. 13 показан
интерфейс программы SRIM (Stopping and Range of Ions in Matter) для
расчета пробега и значений dE/dx для
заряженных частиц в веществе произвольного химического состава, а на рис. 14 -
интерфейс программы TRIM для моделирования взаимодействия
частиц с веществом.
Рис. 13. Интерфейс программы SRIM
для расчета пробегов и ионизационных потерь тяжелых заряженных частиц в
веществе
Рис. 14. Интерфейс программы TRIM
с окнами расчета траекторий ионов 11В на Z
в слое воды толщиной 2 мм и распределения ионизационных потерь энергии ионов в
воде
На рис. 15 показаны для примера результаты
расчета по программе TRIM
пространственных распределений ионизационных потерь ионов в слое крови толщиной
2 мм для некоторых вариантов облучения из таблицы 3.
Видно, что использование ионов различной энергии
и алюминиевых фильтров позволяет, в принципе, достичь весьма больших значений
ЛПЭ, однако при этом различие в ЛПЭ частиц (и, соответственно, поглощенной
дозы) на входе и на выходе из образца велико. Не все доступные на циклотроне
У400М ионы можно использовать для облучения сравнительно толстых образцов (2
мм). Так, на двух последних графиках рис. 15 показаны случаи полного торможения
ионов в образце, т.е. пик Брегга лежит внутри образца. Из-за этого ионы аргона
можно использовать только для облучения монослоев клеток.
Обращает на себя внимание тот факт, что
результаты расчета значений ЛПЭ по программам Lise++
и TRIM несколько
расходятся с уменьшением энергии ионов. В программе Lise++
значения ЛПЭ на входе и выходе считались следующим образом: образец разбивался
по толщине на 3 слоя - 1 мкм + 1998 мкм + 1 мкм (в сумме 2 мм). Тогда
энерговыделение в первом слое 1 мкм соответствует входному значению ЛПЭ,
энерговыделение в последнем слое 1 мкм соответствует выходному значению ЛПЭ. На
рис. 15 значения ЛПЭ на входе и выходе определяются по графикам с
использованием соотношения 1 эВ/А = 10 кэВ/мкм. В целом, результаты расчета по
программе TRIM дают
большие значения ЛПЭ на выходе, например, по программе Lise++
для ионов 18O
с начальной энергией 35 МэВ/н и с использованием фильтра 0,2 мм Al,
значение ЛПЭ на выходе составляет 450,5 кэВ/мкм, а по программе TRIM
(график 5 на рис. 16) значение выходного ЛПЭ ~ 540
кэВ/мкм. Однако из-за значительного градиента ЛПЭ по толщине образца, это
различие не столь существенно.
Выполненные расчеты позволят осуществить
планирование радиобиологических экспериментов на пучках тяжелых ионов
циклотрона У400М с учетом возможного использования алюминиевых фильтров для
расширения диапазона доступных значений ЛПЭ.
Рис. 16. Графики пространственных распределений
ионизационных потерь ионов на толщине образцов крови (2 мм), рассчитанные по
программе TRIM
Глава 3. Применение теоретических расчетов
Как известно, ионизирующая радиация приводит к
появлению и увеличению количества хромосомных нарушений, генных и геномных
мутаций, которые представляют реальную угрозу для здоровья и жизни человека, и
оказывают негативное влияние на последующие поколения. Наименее изученным остается
мутагенное действие радиации на клетки млекопитающих и человека, особенно
воздействие ускоренными тяжелыми ионами.
В Лаборатории радиационной биологии ОИЯИ
проводятся исследования мутагенного действия ионизирующих излучений с разными
линейными потерями энергии на клетки млекопитающих, в частности мутаций в
локусе HPRT,
индуцируемых ускоренными тяжелыми ионами.
.1 Мутаций в локусе HPRT
HPRT (Гипоксантин-гуанин
фосфорибозилтрансферазa) - цитоплазматический фермент, находящийся во многих
тканях человека. Наибольшая активность гипоксантин-гуанин
фосфорибозилтрансферазы отмечается в тканях мозга
<http://medbiol.ru/medbiol/physiology/001bf156.htm>. Расположен в X-хромосоме. hprt-ген
составляет 2,5 kb геномной ДНК в клетках
млекопитающих и содержит 9 экзонов. HPRT-фермент катализирует взаимодействие
5`- фосфорибозил-1-пирофосфата (ФРПФ) и пуриновых оснований гипоксантина и
гуанина. В результате чего образуются мононуклеотиды, которые используются
клеткой при синтезе ДНК (рис. 16).
Следствием дефицита HPRT-фермента в
организме человека является возникновение ряда заболеваний. Частичный дефицит
приводит к развитию подагры. Для этого заболевания характерно отложение
кристаллов солей мочевой кислоты (уратов) в суставных хрящах, околосуставных
тканях, почках и других органах. В последующем в них развиваются
воспалительные, а затем деструктивные изменения, проявляющиеся острым и
рецидивирующим артритом, образованием подкожных узелков, симптомами
мочекаменной болезни. Полный дефицит ферментов приводит к синдрому Лёша-Нихена
(Елисеев, 2010). Этот синдром проявляется умственной отсталостью, различными
неврологическими расстройствами, почечной недостаточностью, нарушениями
моторики и повышенным содержанием мочевой кислоты, а также различными
аномалиями поведения, в том числе навязчивым агрессивным поведением и
склонности к самоповреждению.
Рис. 16. Синтез и структура мононуклеотидов.
В эксперименте была использована культура клеток
китайского хомячка V-79. За двое
суток перед облучением клетки высевали по 200 тыс. клеток на флакон. За этот
период их количество увеличивалось в ~10 раз. Затем снимали монослой и готовили
клеточную суспензию для облучения.
Облучение проводилось в Лаборатории ядерных
реакций им. Г. Н. Флерова на циклотроне У-400M,
на установке «Геном». Для облучения использовались специально изготовленные
цилиндрические камеры диаметром 14 мм и высотой 2 мм. Что соответствует
расчетным параметрам бакалаврской работы. Размеры определялись параметрами
пучка и пробегом частиц. Камеры закрывались поликарбонатной пленкой толщиной 6
мкм, через которую и осуществлялось облучение клеток. Клеточная суспензия в
концентрации 106 клеток/мл вводились в камеры через специальные
отверстия. Камеры с суспензией закреплялись в отверстиях диска-барабана (Рис.
17). Поворотом закрепленного на установке барабана образцы последовательно
вводились в зону облучения. Схема эксперимента представлена на рис.18.
Рис. 17. Закрепление образцов с клеточной
суспензией в гнезда контейнера.
После облучения клетки переносили на питательную
среду по 300 тыс. на флакон для дальнейшего роста. По истечению времени
экспрессии (3-5 дней) клетки пересаживали по 30 тыс. на флакон с питательной
средой, содержащей 6-тиогуанин для селекции HPRT-мутантов.
По мере вырастания клеточные колонии снимали, фиксировали продолжительность их
роста, ресуспендировали и пересевали для получения мутантных субклонов. Для
контроля за выживаемостью клетки высаживали по 500 клеток на флакон с
питательной средой без 6-тиогуанина.
Рис. 18. Схема проведения эксперимента
.2 Цитогенетический анализ препаратов
Цитогенетический анализ клеток проводили
общепринятым метафазным методом с помощью бинокулярного светового микроскопа Olympus
CX22 под иммерсией
при увеличении 100х10. Данный метод широко применяется для оценки повреждения
генома при воздействии ионизирующей радиации (IEAE).
При цитогенетическом анализе наблюдалась гетерогенность спонтанных и
радиационно-индуцированных HPRT-мутантных
субклонов по исследованным цитогенетическим показателям (митотической
активности, анеуплоидии, уровню хромосомных аберраций). При цитогенетическом
анализе фиксировали частоту клеток с хромосомными аберрациями, а также общее
число и частоты разных видов аберраций хромосом. Учитывали все виды хромосомных
аббераций, выявляемых без кариотипирования: хроматидные и хромосомные
фрагменты, соединения сестринских хроматид, дицентрики, кольца (центрические и
ацентрические), интерстициальные делеции, обмены хромосом. Дицентрики показаны
на рис. 19.
Рис. 19. Хромосомные аберрации (дицентрики)
клетки китайского хомячка линий V-79
.3 Метод ДНК-фокусов
Метод ДНК-фокусов основан на использовании
меченных флуоресцентными красителями отдельных ферментов, участвующих в
репарации ДР ДНК. При использовании конфокального лазерного микроскопа можно
регистрировать отдельные места - «фокусы» связывания этих ферментов с сайтами
репарации образующихся ДР ДНК. С использованием этого метода проводится
изучение закономерностей формирования и репарации ДР ДНК в широком диапазоне
ЛПЭ излучений. На рисунке 20 показаны: а) ядра клеток китайского хомячка линий V-79;
б) ДНК-фокусы, которые учитываются при анализе степени поврежденности ДНК.
а) б)
Рис. 20. а) Ядра клеток китайского хомячка линий
V-79 под
конфокальным лазерным микроскопом; б) ДНК- фокусы в ядрах клеток китайского
хомячка
Результаты и выводы
1. С помощью программы Lise++
рассчитаны энергии доступных на циклотроне У400М многозарядных ионов на входе в
биологические образцы с учетом наличия в канале транспортировки ионов различных
поглотителей, а также значения ЛПЭ в образцах, представляющих собой монослои
клеток;
. По программе TRIM
рассчитаны продольные распределения ЛПЭ в образцах периферической крови
человека толщиной 2 мм и определены средние значения ЛПЭ;
. С целью расширения диапазона доступных
значений ЛПЭ рассмотрена возможность дополнительного торможения ионов в
алюминиевых фильтрах толщиной 200, 500, 1000, 1500 и 2000 микрон и рассчитаны
по указанным программам энергии и ЛПЭ ионов в биологических образцах;
. Показана возможность постановки
экспериментов по облучению биологических образцов ионами с различными
значениями Z и энергии, но с
одинаковыми значениями ЛПЭ (например, с Al
поглотителем толщиной 1895 мкм в эксперименте на монослое клеток на пучке ионов
11B с Z
= 5 и энергией 34 МэВ/нуклон можно получить практически то же значение ЛПЭ
(129,9 кэВ/мкм), что и c
ионами 20Ne
с Z = 10 и энергией 52
МэВ/нуклон (ЛПЭ = 129,3 кэВ/мкм));
. Показана практическая значимость
выполненных расчетов для планирования радиобиологических экспериментов на
установке “Геном-М” циклотрона У400М ЛЯР.
Заключение
Бакалаврская работа выполнена в Лаборатории
радиационной биологии Объединенного института ядерных исследований. В дипломной
работе с помощью программ Lise++
и TRIM выполнены расчеты
характеристик пучков тяжелых ионов, которые можно использовать в
радиобиологических экспериментах на изохронном циклотроне У400М Лаборатории
ядерных реакций ОИЯИ. С учетом наличия набора различных поглотителей на пути
ионов определены их энергии на входе в биологические образцы и рассчитаны
продольные распределения ЛПЭ в образцах периферической крови человека толщиной
2 мм. С целью расширения диапазона доступных значений ЛПЭ рассмотрена
возможность дополнительного торможения ионов в алюминиевых фильтрах толщиной
200, 500, 1000, 1500 и 2000 микрон и рассчитаны характеристики ионов при
наличии указанных фильтров. Показано, что возможно провести эксперимент по
облучению биологических образцов ионами с различными значениями Z
и энергии, но с одинаковыми значениями ЛПЭ. Выполненные расчеты будут
востребованы при планировании радиобиологических экспериментов на установке
“Геном-М” циклотрона У400М ЛЯР.
Литература
1. Баранов В.Ф.
Дозиметрия электронного излучения. - М.: Атомиздат, 1974.
2. J.P. Biersack and L.G.
Haggmark. A Monte Carlo computer program for the transport of energetic ions in
amorphous targets. Nucl. Instr. Meth., 174:257, 1980
. A.A. Bezbakh, V.B. Zager, G.
Kaminski, A.I. Krylov, V.A. Krylov, Yu.G. Teterev, G.N. Timoshenko. Upgrading
the Genome Facility for Radiobiological Experiments with Heavy Ion Beams,
Physics of Particles and Nuclei Letters, 2013, Vol. 10, No. 2, pp. 175-178.
. D. Bazin et al., Preprint
NSCL MSU, MSUCL-1187; Preprint JINR, E13-2001-18, Dubna, 2001; submitted to NIM
B; "LISE++: “Radioactive beam production with in-flight
separators”, O.B. Tarasov and D. Bazin, NIM B (2008) 4657-4664
. J.F. Ziegler, J.P. Biersack
and U. Littmark (1985 (new edition in 1996)). The Stopping and Range of Ions in
Solids. New York: Pergamon Press.