Представление о мембранной теории происхождения биопотенциалов и ионных каналах
Реферат
ПРЕДСТАВЛЕНИЕ
О МЕМБРАННОЙ ТЕОРИИ ПРОИСХОЖДЕНИЯ БИОПОТЕНЦИАЛОВ И ИОННЫХ КАНАЛАХ
Основные положения мембранной теории были
сформулированы Бернштейном (1902), а затем развиты Бойлем и Конвеем (1941) и
Ходжкиным, Катцем и Хаксли (1949, 1952). Современные
электронно-микроскопические исследования говорят о том, что на поверхности
клетки имеется двуслойная структура толщиной около 10 нм. Эта мембрана и
обусловливает характер имеющих место электрофизиологических свойств нейронов. В
покое только ионы калия способны проникать через мембрану. При этом
концентрация ионов калия в цитоплазме значительно выше, чем в наружном
растворе. Ионы калия, диффундируя через мембрану, выносят на поверхность
нейрона положительный заряд до тех пор, пока не уравняются потоки калия внутрь
и наружу. Следующее уравнение выражает равновесный мембранный потенциал:
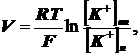 (1)
(1)
где: V - разность потенциалов между
наружной и внутренней поверхностями мембраны, - газовая постоянная,
Т - абсолютная температура, - число
Фарадея,
[K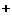 ]
] и [K
и [K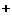 ]
]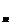 - соответственно внутренняя и
наружная концентрации ионов калия.
- соответственно внутренняя и
наружная концентрации ионов калия.
Затем было обнаружено, что возбудимые мембраны
хорошо проницаемы не только для ионов калия, но и для ионов хлора и, таким
образом, мембранный потенциал является потенциалом равновесия не только для
калия, но и для хлора, т.е.:
мембрана клетка ион насос
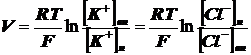 (2)
(2)
Когда же было показано, что и натрий способен
проникать через мембрану, то пришлось отказаться от представлений мембраны как
пассивной структуры. Дэном (1941) была высказана идея о том, что постоянный
концентрационный градиент ионов натрия между клеткой и наружной средой
поддерживается благодаря тому, что натрий выталкивается из клетки с помощью
особого механизма, связанного с метаболизмом клетки. И в физиологии начали
различать два типа распределения ионов между клеткой и наружной средой:
пассивный - обусловленный диффузионными и электростатическими силами, и
активный - обусловленный деятельностью «насосов» и связанный с метаболизмом.
Таким образом, прохождение ионов через
поверхностную мембрану осуществляется посредством двух различных механизмов. С
одной стороны, ионы разных видов проходят свободно благодаря диффузии, причем
«полезное» прохождение ионов через единицу поверхности мембраны определяется
проницаемостью мембраны для ионов данного вида и их электрохимическим
градиентом. С другой стороны, ионы могут передвигаться против своего
электрохимического градиента, т.е. термодинамически, они как бы выкачиваются с
усилием, и этот процесс требует затраты работы, которая в конечном счете
обеспечивается энергией обмена веществ (см. выше)
Отрицательные ионы хлора, пересекая
поверхностную мембрану снаружи внутрь, передвигаются против электрохимического
градиента, в направлении от положительно заряженной к отрицательно заряженной
поверхности, т.е. они двигаются как бы «в гору». Наоборот, движение ионов хлора
в противоположном направлении имеет характер эквивалентного «падения» по
градиенту, т.е. они двигаются как бы «с горы». Следует ожидать, что при равных
концентрациях по обе стороны мембраны количество ионов, пересекающих мембрану
снаружи внутрь, т.е. двигающихся «в гору», будет значительно меньше количества
ионов, пересекающих мембрану изнутри кнаружи, т.е. двигающихся «с горы».
Однако, увеличивая наружную концентрацию ионов хлора, а следовательно и число
попыток проникновения их внутрь, можно уменьшить это расхождение. Количества
ионов хлора, пересекающих мембрану в двух противоположных направлениях, равны в
том случае, когда отношение внутренней и наружной концентраций 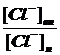 связано с мембранным
потенциалом E
связано с мембранным
потенциалом E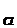 (в мВ),
согласно уравнению Нернста (при 38 град.):
(в мВ),
согласно уравнению Нернста (при 38 град.):
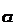 = 61,5 lg
= 61,5 lg 

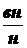 . (3)
. (3)
Таким образом, когда по обе стороны
мембраны наблюдается такое соотношение концентраций, для ионов хлора создается
устойчивое состояние, и тогда E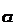 , будет потенциалом равновесия для
ионов хлора. Экспериментально показано, что для мотонейрона E
, будет потенциалом равновесия для
ионов хлора. Экспериментально показано, что для мотонейрона E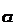 = -70мВ,
т.е. при нормальном потенциале покоя ионы хлора находятся в электрохимическом
равновесии и при этом, согласно уравнению Нернста, существует 14-кратная
разница в концентрациях ионов Cl
= -70мВ,
т.е. при нормальном потенциале покоя ионы хлора находятся в электрохимическом
равновесии и при этом, согласно уравнению Нернста, существует 14-кратная
разница в концентрациях ионов Cl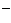 снаружи (125мМ) и внутри (9мМ)
клетки, что и создает разность потенциалов в -70мВ.
снаружи (125мМ) и внутри (9мМ)
клетки, что и создает разность потенциалов в -70мВ.
В отношении ионов калия экспериментально
показано, что в норме величина E
величина E достигает
примерно -90мВ. Таким образом, при потенциале покоя -70мВ электрохимический
потенциал для ионов калия должен быть равен -20мВ. Внутренняя концентрация
ионов калия (150мМ) приблизительно в 2 раза больше той, которая необходима для
диффузионного равновесия при мембранном потенциале покоя. Следовательно, при
потенциале покоя -70мВ выходящий из клетки диффузионный поток ионов калия должен
быть вдвое больше потока, входящего в клетку. Устойчивое состояние для ионов
калия может быть сохранено лишь в том случае, если недостаточность входящего
потока будет компенсироваться работой какого-то механизма, нагнетающего ионы
калия внутрь клетки и создающего ионный поток такой же интенсивности, какую
имеет поток, обусловленный диффузией.
достигает
примерно -90мВ. Таким образом, при потенциале покоя -70мВ электрохимический
потенциал для ионов калия должен быть равен -20мВ. Внутренняя концентрация
ионов калия (150мМ) приблизительно в 2 раза больше той, которая необходима для
диффузионного равновесия при мембранном потенциале покоя. Следовательно, при
потенциале покоя -70мВ выходящий из клетки диффузионный поток ионов калия должен
быть вдвое больше потока, входящего в клетку. Устойчивое состояние для ионов
калия может быть сохранено лишь в том случае, если недостаточность входящего
потока будет компенсироваться работой какого-то механизма, нагнетающего ионы
калия внутрь клетки и создающего ионный поток такой же интенсивности, какую
имеет поток, обусловленный диффузией.
Что касается ионов натрия, то при
мембранном потенциале покоя электрохимический потенциал для ионов натрия
противоположен по направлению электрохимическому потенциалу для ионов калия и
гораздо больше его по величине (составляя примерно 130мВ). Вследствие этого для
ионов натрия входящий диффузионный поток превышает выходящий в 100 раз, и
устойчивое равновесие достигается в том случае, когда выкачивание ионов натрия из
клетки фактически равно диффузии этих ионов внутрь клетки.
Есть основание считать, что действие
насоса, нагнетающего калий внутрь клетки, связано с действием насоса,
выкачивающего натрий из клетки. При этом избыток анионов внутри клетки
сохраняется, благодаря сочетанному действию Na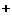 -K
-K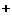 насоса.
насоса.
Значение потенциала покоя для разных
возбудимых клеток составляет: в мотонейронах спинного мозга - -50-70мВ, в
пирамидных клетках коры больших полушарий - -60мВ, в скелетно-мышечных волокнах
- -90мВ.
Потенциал покоя формируется благодаря действию
следующих факторов: 1) трансмембранным градиентам концентраций ионов натрия и
калия (при преобладании внеклеточной концентрации ионов натрия над внутриклеточной
в 8-10 раз и преобладании внутриклеточной концентрации ионов калия над
внеклеточной в 40-60 раз); 2) высокой проницаемости мембраны в покое для ионов
калия; 3) низкой проницаемости мембраны в покое для ионов натрия.
Рис.1. Схематическое изображение потоков ионов
калия и натрия, проходящих через поверхностную мембрану в состоянии покоя (из: J.C.
Eccles «The
Physiology
of Nerve
Cells», 1957).
Под влиянием каких-либо воздействий может
происходить либо уменьшение трансмембранной разности потенциалов (т.е.
деполяризация мембраны), либо ее увеличение (т.е. гиперполяризация мембраны).
Кратковременная и обратимая деполяризация
мембраны при действии подпорогового стимула представляет собой локальный ответ,
который в случае синаптического процесса превращается в возбудительный
постсинаптический потенциал (ВПСП). Если деполяризация мембраны достигает
критической величины (около -50 мВ), то на вершине локального ответа (равно как
и на вершине ВПСП) возникает распространяющийся потенциал действия,
представляющий собой быстрое деполяризационное колебание с последующей
электрической перезарядкой возбудимой мембраны. Потенциал действия (ПД)
является непременным признаком распространяющегося возбуждения. Формирование ПД
на определенном участке мембраны возникает тогда, когда амплитуда локального
ответа достигает критического уровня и деполяризация приобретает регенеративный
характер. При этом прогрессивно усиливается входящий ток ионов натрия, что
проявляется в виде крутого подъема исходного мембранного потенциала до нулевого
значения (быстрая деполяризация) и далее - в зону положительных значений («овершут»).
Затем наступает быстрая реполяризация мембраны (возврат к исходному уровню);
при этом возможны следовые процессы (следовая деполяризация, т.е. сменяющее
быструю реполяризацию продолжающееся медленное возвращение к исходному уровню,
и возможное увеличение отрицательного значения мембранного потенциала -
следовая гиперполяризация). Фрагмент колебания, включающий в себя быструю
деполяризацию, овершут и быструю реполяризацию называется пиком (спайком)
потенциала действия. Важным параметром потенциала действия является его
амплитуда, т.е. разность между исходным уровнем мембранного потенциала и
экстремальной точкой пика. Амплитуда ПД в мотонейронах спинного мозга
составляет 100-120 мВ, в скелетно-мышечных волокнах - 120-130 мВ. Следовые де-
и гиперполяризационные потенциалы могут быть разной выраженности.
В основе описанных процессов лежат следующие
мембранные механизмы. Деполяризация, достигшая критического уровня, приобретает
регенеративный характер. При этом происходит лавинообразное открытие ворот натриевых
каналов и формирование циклического взаимодействия с положительной обратной
связью. Однако такой характер процесса сохраняется лишь до момента закрытия
натриевых каналов (натриевая инактивация). Поскольку эта инактивация в каждом
канале происходит со стабильной (но различной для разных возбудимых клеток)
задержкой, то этот процесс закрытия натриевых ворот должен иметь такой же
лавинообразный характер, как и открытия ворот. Инактивация предотвращает
дальнейший рост внутриклеточной позитивности. Последующая быстрая реполяризация
обусловлена не только продолжающейся натриевой инактивацией, но и активацией
калиевых каналов, реагирующих на деполяризацию мембраны медленнее, чем
натриевые каналы. Усиливающийся при этом выходящий ток ионов калия способствует
негативизации внутренней поверхности мембраны. Описанная динамика ионных токов
характерна для формирования ПД в нервных клетках и скелетно-мышечных волокнах.
Следовые потенциалы, в тех случаях, когда они возникают, отражают соотношения
деполязизующего натриевого и реполяризующего калиевого токов на этом этапе
развития потенциала действия.
Натрий-калиевый насос.
Механизм, поддерживающий разность
вне- и внутриклеточных концентраций ионов натрия и калия возбудимых клеток
посредством активного транспорта этих ионов против их концентрационного
градиента, и представляет собой натрий-калиевый насос. Работа этого механизма
требует затрат энергии, что принципиально отличает его от механизмов
формирования потенциалов покоя и действия, в основе которых лежат пассивные ионные
токи, обусловленные трансмембранными градиентами концентраций этих ионов.
Активность натрий-калиевого насоса, по существу, компенсирует результаты
пассивного трансмембранного транспорта ионов Na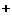 и K
и K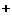 . Эффективность этой компенсации
обнаруживается в том, что внутриклеточная концентрация этих ионов и их
трансмембранные концентрационные градиенты поддерживаются на постоянном уровне,
несмотря на то, что, во-первых, в процессе формирования мембранного потенциала
покоя происходит мощный отток ионов калия из клетки и слабый, но непрерывный,
приток в клетку ионов натрия, и, во-вторых, в процессе формирования каждого
потенциала действия возникают кратковременные, но мощные входящие токи ионов
натрия.
. Эффективность этой компенсации
обнаруживается в том, что внутриклеточная концентрация этих ионов и их
трансмембранные концентрационные градиенты поддерживаются на постоянном уровне,
несмотря на то, что, во-первых, в процессе формирования мембранного потенциала
покоя происходит мощный отток ионов калия из клетки и слабый, но непрерывный,
приток в клетку ионов натрия, и, во-вторых, в процессе формирования каждого
потенциала действия возникают кратковременные, но мощные входящие токи ионов
натрия.
Внутренний механизм переноса ионов
против концентрационного градиента окончательно не выяснен, однако известен
общий принцип его работы. В качестве транспортного элемента выступает белковая
макромолекула, фиксированная в плазматической мембране. Кроме транспортной
функции она выполняет роль фермента Na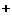 -K
-K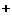 -АТФазы, участвующего в
энергетическом обеспечении активного транспорта ионов. Посредством своего
натрий-селективного центра, расположенного на внутренней стороне мембраны, она
связывает 3 иона натрия, который переносится на ее наружную сторону, где
освобождается в межклеточную среду. Затем, в результате конформационных
изменений, макромолекула приобретает сродство к калию и присоединяет 2 его
иона. Образование этой связи стимулирует переход носителя на внутреннюю сторону
мембраны и выделение ионов калия в цитоплазму. На этом этапе АТФазная
активность макромолекулы, способствуя гидролизу АТФ до АДФ, энергетически
обеспечивает процесс преобразования переносчика и приобретения им вновь
сродства к натрию, на чем и заканчивается очередной транспортный цикл.
-АТФазы, участвующего в
энергетическом обеспечении активного транспорта ионов. Посредством своего
натрий-селективного центра, расположенного на внутренней стороне мембраны, она
связывает 3 иона натрия, который переносится на ее наружную сторону, где
освобождается в межклеточную среду. Затем, в результате конформационных
изменений, макромолекула приобретает сродство к калию и присоединяет 2 его
иона. Образование этой связи стимулирует переход носителя на внутреннюю сторону
мембраны и выделение ионов калия в цитоплазму. На этом этапе АТФазная
активность макромолекулы, способствуя гидролизу АТФ до АДФ, энергетически
обеспечивает процесс преобразования переносчика и приобретения им вновь
сродства к натрию, на чем и заканчивается очередной транспортный цикл.
АТФазная активность и активность
ионного насоса увеличивается при возрастании концентрации ионов калия во
внешней среде и ионов натрия во внутренней. Эта зависимость имеет большое
функциональное значение, т.к. указанные изменения концентрации ионов калия и
натрия возникают как результат усиления активности нейронов, учащающих
генерацию потенциалов действия.
То обстоятельство, что на каждые 3
иона выведенного натрия насос «закачивает» в клетку только 2 иона калия,
приводит к усилению поляризации мембраны. В этом заключается электрогенный
эффект деятельности натрий-калиевого насоса. Энергия, затрачиваемая
натрий-калиевым насосом «запасается» в виде концентрационных и
электрохимических градиентов ионов натрия и калия, чтобы реализоваться
пассивными ионными токами, формирующими потенциал покоя и потенциал действия
возбудимой клетки. Этот механизм активного транспорта ионов натрия и калия через
мембрану возбудимой клетки обеспечивает поддержание внутриклеточного ионного
осмотического гомеостаза.
Ионные каналы.
Это белковые макромолекулы,
погруженные в липидный бислой плазматической мембраны (трансмембранные белки),
образующие заполненные водой поры, через которые проникают неорганические ионы.
Эти каналы обладают селективностью, т.е. через каждый из них могут проходить
только ионы определенного вида. Движение этих ионов обусловлено градиентами их
концентраций по обе стороны мембраны и трансмембранно разностью электрических
потенциалов (мембранным потенциалом). Сочетанное влияние этих двух факторов
обозначается как электрохимический градиент. Такой механизм переноса ионов
через мембрану называется пассивным транспортом, т.к. это движение осуществляется
без непосредственной затраты энергии за счет энергии, «запасенной» ранее в виде
потенциальной энергии концентрационных градиентов транспортируемых ионов.
Единичный ионный канал может быть в одном из
двух состояний: либо открытым, либо закрытым. Эти изменения состояния
происходят в результате конформационных изменений макромолекулы, открывающих
или закрывающих канал на определенном его участке, называемом воротами. На
рис.2 представлена клеточная мембрана и ионный канал.
Рис.2. Клеточная мембрана и ионный канал (А).
Клеточные мембраны состоят из жидкой фазы липидов и встроенных в липиды
белковых молекул. Пронизывающие мембрану (трансмембранные) белки образуют
ионные каналы (B).
Схематичное представление ионного канала с центральной водной порой и воротным
механизмом (G) (Из Николс и др.,
2003)
Ионные каналы состоят из нескольких субъединиц.
Каждая субъединица ионного канала представляет собой интегральный мембранный
белок, содержащий трансмембранные сегменты, каждый из которых имеет
альфа-спиральную конфигурацию в пределах мембраны. Несколько таких субъединиц
формируют ионный канал.
Различают две группы ионных каналов -
потенциалуправляемые (потенциалзависимые) и рецепторуправляемые. К последним
относятся две подгруппы - лигандуправляемые (хемозависимые) и
механоуправляемые.
За проведение ионов ответственны белковые
компоненты мембраны. Одна субъединица интегрального мембранного белка содержит
четыре трансмембранных сегмента. Некоторые белки имеют в составе одной
субъединицы 12 трансмембранных сегментов. Среди ионных каналов есть селективные
каналы (например, калиевый канал, натриевый канал) и неселективные (например,
натрий-калиевый канал).
Белковые структуры могут менять проводимость,
закрывая либо открывая ворота канала - это «механизм ворот канала». Этот
механизм различен у потенциалуправляемых, лигандуправляемых и механоуправляемых
каналов. Так, потенциалуправляемые каналы закрываются и открываются в
результате изменения мембранного потенциала нервной клетки (т.е. белковые
структуры внутри канала могут открывать/закрывать канал). Что касается
лигандуправляемых ионных каналов, то они меняют свою проводимость в связи с
конформационными изменениями белка канала в результате его связывания со
специфической молекулой - лигандом. Особое место занимают механоуправляемые
ионные каналы, которые закрываются или открываются в результате изменения
натяжения мембраны, переданного через цитоскелет, вследствие механического
воздействия на клетку.
Характерной чертой потенциалуправляемых каналов
является способность активироваться и инактивироваться только под влиянием
трансмембранного электрического поля. Потенциалуправляемые ионные каналы
состоят из устья, селективного фильтра, активационных и инактивационных ворот,
состояние которых позволяет либо не позволяет ионам проходить через канал, и
сенсора напряжения, управляющего работой ворот. Потенциалуправляемый канал
может находиться в трех состояниях: покоя, активации и инактивации. Обычно он
селективен для каждого сорта ионов.
В то же время лигандуправляемые каналы, как уже
говорилось выше, меняют свою проницаемость в результате конформационных
изменений белка канала после его связывания с лигандом.
Что же касается механоуправляемых каналов, то,
как уже отмечалось выше, их состояние закрытия/открытия зависит от изменения
натяжения мембраны, передающегося через мембранный бислой или цитоскелет,
вследствие механического воздействия на клетку. Если вероятность открытого
состояния механоуправляемого канала больше, чем закрытого, то этот канал
называется stretch-activated channel, если же наоборот (т.е. вероятность
закрытого состояния канала больше, чем открытого), то этот канал называется
stretch-inactivated channel. Растяжение механоуправляемого ионного канала не
изменяет ни его ионной селективности, ни его ионной проводимости. Изменения,
вызванные растяжением, влияют лишь на вероятность того, будет ли канал открыт,
либо закрыт. (рис. 3)
Потенциалзависимые натриевые каналы находятся в
мембране нейронов (преимущественно аксонов) и мышечных волокон. В них имеются
ворота двух видов: активационные, расположенные вблизи внеклеточного полюса
макромолекулы, и ворота инактивационные, находящиеся в области ее
внутриклеточного полюса. На уровне потенциала покоя у подавляющего большинства
натриевых каналов активационные ворота закрыты, а инактивационные - открыты.
Этим объясняется низкая натриевая проницаемость мембраны в покое.
Деполяризация мембраны приводит к открытию
активационных ворот, благодаря чему повышается натриевая проницаемость
мембраны. Однако такое состояние продолжается недолго, т.к. открытие
активационных ворот автоматически включает инактивационный механизм, приводящий
к закрытию инактивационных ворот. Таким образом, канал способен пропускать
натрий лишь в течение определенного короткого времени (различного для мембран
разных возбудимых клеток), после чего вновь резко снижается натриевая
проницаемость мембраны. Это - состояние натриевой инактивации. При этом
повторная деполяризация не способна при закрытых инактивационных воротах
восстановить проницаемость этого канала. Возвращение мембранного потенциала к
исходному уровню покоя, способствуя закрытию активационных и открытию
инактивационных ворот, восстанавливает способность канала открываться под
влиянием деполяризации мембраны.
Потенциалзависимые калиевые каналы также
встроены в мембрану аксонов и мышечных волокон и обладают воротным механизмом.
На уровне потенциала покоя большинство этих каналов открыты, чем обеспечивается
высокая калиевая проницаемость. Деполяризация мембраны приводит к открытию дополнительных
калиевых каналов, за счет чего увеличивается ее проницаемость для ионов калия.
Однако активация калиевых каналов протекает медленнее, чем натриевых и,
соответственно, усиление выходящего калиевого тока при деполяризации мембраны
оказывается сдвинутым во времени по отношению к усилению натриевого тока.
Инактивационных механизмов у калиевых каналов не обнаружено.
Потенциалзависимые кальциевые каналы расположены
в мембране пресинаптических терминалей аксонов, оканчивающихся на других
нейронах или клетках иннервируемых органов. Деполяризация мембраны этих
терминалей, наступающая в результате прихода потенциала действия, открывает эти
каналы, и кальций входит внутрь окончания по концентрационному градиенту
(внеклеточная концентрация кальция больше, чем в 1000 раз, превышает
концентрацию свободного кальция в цитоплазме). Этот входящий ток кальция играет
ключевую роль в процессе выделения медиатора.
Потенциалзависимые кальциевые каналы имеются
также и в мембране сомы и дендритов нейронов, при деполяризации которой они
открываются. Их активация протекает медленнее, чем натриевых каналов. Входящий
по градиенту концентрации кальциевый ток играет существенную роль в метаболизме
нейрона.
Хемозависимые (лиганд-зависимые) ионные каналы,
которые открываются в результате специфического связывания наружного
полисахаридного компонента макромолекулы-канала с определенной молекулой
(медиатором, трансмиттером) или с ее активной группой, расположены на
постсинаптических участках мембраны нейронов и клеток иннервируемых органов.
Они открываются под действием медиаторов, выделяемых пресинаптическим
окончанием. Медиаторная специфичность таких каналов обеспечивается «узнаванием»
специфического медиатора внеклеточным полюсом хемозависимого канала
(рецептором). Связывание медиатора с этим рецептором вызывает конформационные
изменения макромолекулы, в результате которых открывается ионный канал.
Установлены каналы, пропускающие ионы калия, натрия и калия, хлора, кальция и
др. Каналы этого типа не обладают потенциалзависимостью, т.е. не могут
открываться при изменении мембранного потенциала.
Литература
1. РАН, Отделение биологических
наук. под ред. М.В. Угрюмова; рец.: Е.В. Гришин, А.А. Кубатеев:
Нейродегенеративные заболевания - М.: Наука, 2010
. Батуев А.С.: Физиология высшей нервной
деятельности и сенсорных систем. - СПб.: Питер, 2009
. Горелов А.А. Концепции
современного естествознания. - М.: Юрайт, 2009
. Горелов А.А. Концепции
современного естествознания. - М.: Юрайт, 2009
. Батуев А.С. Физиология высшей
нервной деятельности и сенсорных систем. - СПб.: Питер, 2006
. В.Н. Цыган, М.М. Богословский,
В.Я. Апчел, И.В. Князькин: Физиология и патология сна. - СПб.: СпецЛит, 2006
. Батуев А.С. Физиология высшей
нервной деятельности и сенсорных систем. - СПб.: Питер, 2005
. Под ред.: В.В. Гнездицкого, А.М.
Шамшиновой: Опыт применения вызванных потенциалов в клинической практике. - М.:
Научно-медицинская фирма "МБН", 2001
. Смирнов В.М. Нейрофизиология и
высшая нервная деятельность детей и подростков. - М.: Академия, 2000