Особенности биологической активности тамоксифена: проблемы, связанные с его токсичностью, поиск их решения
МИНОБРНАУКИ РОССИИ
Федеральное государственное
автономное образовательное учреждение высшего образования
Новосибирский национальный
исследовательский государственный университет
Факультет естественных наук
Реферат
Особенности биологической активности
тамоксифена: проблемы, связанные с его токсичностью, поиск их решения
Романов Илья Игоревич
Новосибирск - 2014
Оглавление
1. Гормон-зависимая и
гормон-независимая формы рака молочной железы
2. Применение
тамоксифена в лечении гормонзависимых форм рака молочной железы
3. Проблема
направленного действия тамоксифена в тканях рака молочной железы
1.
Гормон-зависимая и гормон-независимая формы рака молочной железы
Проблему непрерывного роста и пролиферации опухолевых клеток непременно
нужно искать в регуляции транскрипции этих клеток. Большой интерес представляют
деацетилазы гистонов, так как они активируют соответствующие гистоновые и
негистоновые субстраты, участвующие в регуляции транскрипции, клеточного цикла
и апоптоза. Поддержание равновесия между ацетилированием и деацетилированием
необходимо для нормального роста клетки. Отклонение в активности гистоновых
деацетилаз может привести к эпигенетическим нарушениям и активной пролиферации
клеток во многих видах рака. В частности, сверхэкспрессия деацетилаз классов 1,
6 и 8 связана с развитием рака молочной железы. Отсюда вытекает основной способ
борьбы с этой проблемой, заключающийся в ингибировании гистоновых ацетилаз
специальными ингибиторами [17]. Однако наиболее важную роль в развитии рака
молочной железы играют половые гормоны. В исследованиях разных лабораторий
показано повышение у женщин в постменопаузный период содержания в плазме
половых гормонов и снижение уровня гормон-связывающего глобулина (Sex Hormone
Binding Globulin). Эти изменения связывают с возрастающим риском возникновения
рака молочной железы и в большей степени объясняются значимостью жировой ткани
в биосинтезе половых стероидов. Более или менее признанных данных о состоянии
женщин в предменопаузный период пока нет, частично из-за сложности измерений
уровня гормонов в плазме, сильно изменяющегося во время менструальных циклов
[18].
Одним из наиболее характерных гормональных показателей, связанных с
риском развития рака молочной железы, является эстроген. Эстроген играет роль
фактора роста и размножения клеток эпителия молочных желез [7]. Очевидно, что
увеличение числа эстрогеновых рецепторов (ЭР) приводит к большей степени
суммарного связывания эстрогена с ними. Таким образом, возрастание экспрессии
эстрогеновых рецепторов, которое наблюдается даже в доброкачественных
образованиях, может послужить причиной расширения очага опухоли [9]. Здесь
стоит отметить, что существуют гормон-зависимая и гормон-независимая формы рака
молочной железы. Согласно статистике, четверть ER + / PR + опухолей, две трети
ER + / PR- и примерно половина из ER- / PR + опухолей не реагируют на
тамоксифен вообще, либо развивают резистентность на ранней стадии. Как в
здоровых, так и в опухолевых клетках присутствует фермент O6-метилгуанин
ДНК метилтрансфераза, участвующий в репарации поврежденных метилированием
участков ДНК.
Было замечено, что у пациентов, обладающих сопротивляемостью тамоксифену
(эстрогеновому антагонисту), повышен уровень экспрессии этого фермента. Группа
ученых с помощью специального ингибитора снизила активность фермента, вернув,
таким образом, эстроген-зависимый характер опухоли. Отсюда, очевидно, может
следовать зависимость механизма противоопухолевого действия тамоксифена от
поврежденности гуанинов ДНК. Такая функция тамоксифена может играть как
положительную роль в химиотерапии, так и отрицательную, о чем будет сказано
подробнее в следующих главах. Кроме того, было отмечено кооперирование
антагонистических эффектов ингибитора метилтрансферазы и тамоксифена [19].
В то же время было обнаружено участие метилтрансферазы гистона Н3К36 в
регуляции сигнального пути эстрогеновых рецепторов α в тамоксифен-резистивных клетках (ЭРα)-положительного рака молочной железы
MCF-7. Фермент вовлекается в регуляцию под действием BET-белка BRD3/4 и способствует
генной экспрессии эстрогенового рецептора α. Низкомолекулярный ингибитор JQ1
упомянутого BET-белка тормозит сигнальный путь ЭРα и замедляет рост и размножение
опухолевых тамоксифен-резистивных клеток. На мышах, которым была вживлена ткань
рака молочной железы, была продемонстрирована in vivo противоопухолевая активность JQ1 и выраженный и продолжительный эффект от комбинированной
терапии ингибитором JQ1 и разрушающим
эстрогеновые рецепторы α фульвестрантом. [20]
Существует множество лечебных и профилактических средств от
эстроген-зависимых форм рака груди, но все механизмы сводятся к подавлению
экспрессии эстрогеновых рецепторов в пораженных клетках.
Естественная регуляция ЭР-α в клетках аденокарциномы молочной
железы происходит за счет прогестерона опосредованно через прогестероновые
рецепторы (ПР-б). Увеличение числа ПР-б подавляет экспрессию ЭР, кроме того
прогестерон по структуре сам схож с эстрогенами и, возможно, связываясь с ЭР-α,
ингибирует их
экспрессию. Установлено, что в клетках рака молочных желез идет накопление
некоторых видов микроРНК и уровень их содержания зависит от экспрессии генов ЭР
и ПР. МикроРНК - это короткие олигонуклеотидные некодирующие цепочки РНК (около
20 нуклеотидов), которые участвуют в посттранскрипционной регуляции, взаимодействуя
по принципу комплементарности с мРНК, разрушая ее. Эти виды микроРНК
синтезируются в результате транскрипции опухолевых генов-супрессоров, реагируя
на мутации ДНК, которые фенотипически реализуются в виде опухоли [21].
Предыдущие исследования показали, что микроРНК-34b имеет важные функции в клеточной пролиферации и апоптозе, а
также служит прямой транскрипционной целью белка р53 [21].
Исследователи в своей работе [21] показали способность микроРНК-34b ингибировать клеточный рост за счет
направленного действия на циклин-D1 и JAG1, которые являются важнейшими генами
в различных типах рака молочных желез. Более того, сверхэкспрессия микроРНК-34b
ведет к ингибированию клеточного роста в клетках рака молочных желез с разным
уровнем экспрессии и состоянием эстрогеновых рецепторов и повышенной
концентрацией опухолевого белка-супрессора p53, хотя конкретных цифр не
называется [21].
Регуляция клеточного цикла, конечно, осуществляется не только посредством
микроРНК. БТШ90 шапероны образуют комплексы с рецепторами половых стероидных
гормонов, в частности с прогестероновыми. Полифенольное соединение, найденное в
зеленом чае, называемое галлат эпигаллокатехина (ЭГКГ, рис. 1),
продемонстрировало химико-профилактические и противоопухолевые свойства [22].

Рис.
1. Галлат эпигаллокатехина
Авторы
установили, что ЭГКГ способен подавлять сверхэкспрессию ЭР-α через специфичное взаимодействие с БТШ90 и БТШ70
шаперонами, переводя свободные ПР-б из цитоплазмы в ядро. В ядре ПР-б связываются
с ДНК, не представляя возможности транскрипционным факторам ЭР-α связаться со своим сайтом. Кроме этого, ЭГКГ
ингибирует функции шаперонов [22].
2.
Применение тамоксифена в лечении гормонзависимых форм рака молочной железы
Уже в течение более 20 лет практикуется лечение тамоксифеном больных
эстроген-зависимой формой рака молочных желез. Тамоксифен (рис. 2) является
селективным модулятором ЭР-α. Он конкурирует с 17α-эстрадиолом за связывание с
эстрогеновыми рецепторами, конформационно предотвращая возможность связывания
кофакторов транскрипции, таким образом, инициируя начало запрограммированной
гибели клеток [3].

Рис.
2. Тамоксифен, 1-[4-(2-диметиламиноэтокси)фенил]-1,2-дифенилбут-1(Z)-ен
В
некоторых работах указывается о выявлении у тамоксифена только цитостатических
свойств, поскольку связываясь с ЭР-α, он лишь временно блокирует клеточное деление. В этом случае его сочли
удобным для использования в качестве специфичного реагента, направленно
доставляющего цитотоксичные препараты в комплексе с ним. А именно, был создан
аддукт ТАМ с ферроценом (рис.3), инициирующим образование перекиси водорода в
клетках карциномы груди и не влияющим на способность ТАМ взаимодействовать с ЭР
[4].
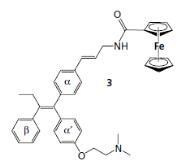
Рис.
3. Комплекс ферроцена с тамоксифеном
Другие
исследователи показали способность производных тамоксифена к ингибированию
экспрессии эстрогена в клетках рака молочной железы и к остановке роста очага
опухоли. Авторы создавали разные производные тамоксифена (рис. 5), содержащие
постоянный заряд, и определили, что алкиламиноэтокси-группа в этих производных
является важным регионом, как для активности молекулы, так и для способности
связывания с ЭР-α.
При низких концентрациях (2-6 мкмоль/л)
производные тамоксифена обладали лучшей связывающей способностью к ЭР-α по сравнению с обычным тамоксифеном [23]. В работе
указываются несколько противоречивые данные, заключающиеся в увеличении степени
связывания производных тамоксифена с постоянным зарядом с эстрогеновыми
рецепторами по убыванию длины алкильного заместителя и одновременно в усилении
ингибиторных (имеется ввиду подавление роста и пролиферации опухолевых клеток)
свойств модифицированного препарата по возрастанию длины алкильного заместителя
[23]. Поскольку опубликованная работа не закончена, нужно с осторожностью
относиться к приведенным данным. Прежде всего, нужно отметить, что доказана
способность тамоксифена, модифицированного по третичной аминогруппе,
связываться и проявлять свойства модулятора эстрогеновых рецепторов. Так группа
ученых анализировала комплекс 4'-гидрокситамоксифена и эстрогенового рецептора-α [17].
Врачи
совместно с учеными, исследовавшими производные метаболиты тамоксифена,
установили, что в постменопаузный период у некоторых женщин происходит
увеличение потребления изофлавон-содержащих продуктов [24]. По большей части
это происходило из-за того, что часть женщин проходила испытания
гормон-заместительной терапией. У больных раком молочных желез проблема
необходимости альтернативного лечения является более актуальной, поскольку рак
молочной железы в эстроген-зависимой форме делает невозможной гормональную
терапию, создавая риск искусственного стимулирования разрастания опухоли и ее
метастазов. Авторы [24] пришли к выводу, что комбинация изофлавонов и
тамоксифена могла бы быть приемлемым препаратом в виду предполагаемой
синергичности их цитотоксических и антипролиферативных свойств по отношению к
опухоли молочной железы. В результате исследования влияния изофлавонов и
тамоксифена на мышиные печеночные микросомы в вышеуказанной работе было
показано, что скорость образования α-гидрокситамоксифена, который является одним из
метаболитов тамоксифена, более того, обладающего бόльшим сродством к эстрогеновым рецепторам, чем
непосредственно тамоксифен, обратно пропорциональна концентрации изофлавона,
хотя остальные метаболиты образуются независимо от количества последнего. Более
того, инкубируя исследуемые микросомы, наряду с тамоксифеном и изофлавонами, с
ингибиторами цитохрома Р4502В, авторы показали общий путь метаболизма двух
препаратов и возможность контролирования онкогенеза с такой комбинацией лечащих
препаратов [24].
Как
уже было указано, с возникновением рака молочной железы связано возрастание
экспрессии отдельных классов гистоновых деацетилаз. Специфичные ингибиторы
гистоновых деацетилаз (далее «ингибиторы») могут быть включены в состав
коньюгатов в качестве адресующих групп, приводя к модулированию активности
эстрогеновых рецепторов [17]. Например, группа ученых сконструировала коньюгаты
тамоксифена и 17α-этинилэстрадиола с ингибитором гистоновых деацетилаз,
чтобы проанализировать изменение и агонистических, и антагонистических действий
препаратов на эстрогеновые рецепторы. В результате был отмечен кооперативный
эффект аддукта ТАМ-ингибитор в плане подавления роста и пролиферации опухолевых
клеток [17].
Выше
рассматривались случаи, в которых тамоксифен выступал в качестве ингибитора
экспрессии эстрогеновых рецепторов, пролиферации опухолевых клеток. Однако ТАМ
известен тем, что в зависимости от условий в клетке он может проявлять не
только свойства эстрогенового антагониста, но и агониста ЭР. Главная проблема,
вызываемая его двойственными свойствами, состоит в том, что в эндометрии TAM
служит в качестве агониста активации транскрипции генов и, тем самым,
способствует повышенному риску заболеваемости раком эндометрия у женщин [22].
Риск
развития рака эндометрия, обусловленный TAM-терапией, как и риск развития рака
молочной железы, обусловленный гормональной заместительной терапией, связан с хроническим
введением эстрогенов или эстрогеноподобных соединений [25].
Cуществуют
разные механизмы, по которым ТАМ вызывает рак эндометрия. Метаболиты
тамоксифена, усваивающиеся в клетках эндометрия, могут напрямую
взаимодействовать с ДНК, создавая точечные мутации генома [26]. Показано, что
ТАМ метаболизируется в виде трех производных (рис 4): N-дезметилтамоксифен
(соединение 3, N-desTAM), 4-гидрокситамоксифен (4) и N-окись тамоксифена
(соединение 5, N-окись тамоксифена).
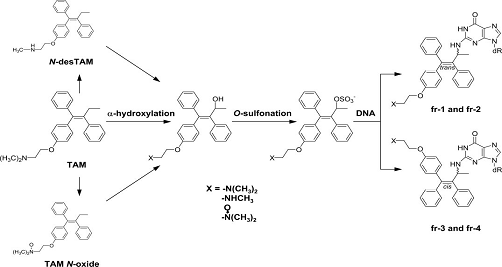

Рис. 4. Метаболиты тамоксифена и аддукты ТАМ-ДНК (fr-1, fr-2, fr-3, fr-4) [25]
Сначала метаболиты гидроксилируются по этильному остатку, не входящему в
ароматическую систему. Это осуществляется за счёт катализа цитохромами CYP3A2 и
CYP3A4 (у крыс и людей, соответственно). Затем идет реакция образования
сульфокислоты (6) и, наконец, продукт реагирует с дезоксигуанозиловыми
остатками ДНК, образуя по два транс- и цис-изомера (7 и 8). Получающиеся
аддукты обладают большой мутагенной активностью, заменяя Уотсон-Криковские пары
Г-А на Г-Т. Кроме того, эти комплексы интенсивнее образуются в клетках с
дефицитом белков репарирующей системы, и сами по себе труднее разрушаются этими
белками в отличие от других крупных ДНК комплексов (например,
дезоксигуанозин-N2-бенз[α]пирен). Для исследований in vivo этих превращений использовали радиоактивную метку 32Р
и хемолюминесцентный анализ [25 - 26].
Как уже отмечалось выше, тамоксифен может выступать в качестве как
эстрогенового антагониста, так и агониста [22]. Эстрогеновая стимуляция одним
только эстрогеном дает 20% вероятность возникновения эндометриоза, а лечение
тамоксифеном как эстрогеновым агонистом в эндометрии может повлечь за собой
возникновение широкого спектра пролиферативных поражений эндометрия. Это
связано с тем, что ТАМ в данном случае инициирует экспрессию ЭР и синтез
эстрогена в клетках эндометрия. Параллельно происходит подавление
прогестероновых рецепторов. Таким образом, начинается неограниченный рост и
пролиферация пораженных клеток [25].
Переход через G1-S межфазовый промежуток и S-фазу клеточного цикла
опосредуется циклин-зависимой киназой 2 (cdk2), которая взаимодействует с
несколькими из циклинов. Два из них: циклин Е и циклин А, активно
экспрессируются во многих видах рака. Экспрессия и прогностическое значение
этих циклинов в солидных опухолях является предметом исследования, но точно
установлено, что экспрессия циклинов А и E вовлечена в канцерогенез эндометрия.
Как оказалось [27], сверхэкспрессия регуляторов клеточного цикла (циклины А и
Е) в клетках эндометрия появляется после 11 месяцев от времени воздействия
тамоксифена. Таким образом, было предложено использовать цилины А и Е в
качестве биомаркеров рака эндометрия [27].
В целом, можно суммировать данные о свойствах и функциях тамоксифена в
опухолевых клетках. В наглядной форме информация представлена на схеме (рисунок
5) ниже.
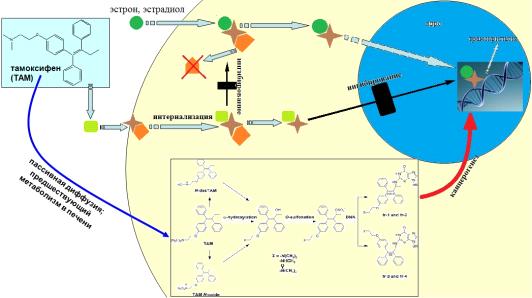
Рис. 5 Схема действия тамоксифена в опухолевых клетках эстроген-зависимой
формы рака
. Проблема
направленного действия тамоксифена в тканях рака молочной железы
эстрогеновый рак грудь тамоксифен
Поиск эффективных средств лечения при химиотерапии непременно связан с
исследованием химических свойств и модификацией изучаемых препаратов. С помощью
химических модификаций можно целенаправленно модулировать необходимые свойства
вещества, присоединять разные функциональные группы, создавать новые комплексы
и коньюгаты на основе уже имеющихся терапевтических соединений [28]. Очевидно,
что устранение канцерогенных свойств тамоксифена заключается в такой
модификации ТАМ, при которой препарат вообще не способен к трансфекции, что
ограничит его мутагенное влияние на ДНК и обеспечит только
рецептор-опосредованное действие [29].
Молекула тамоксифена (рис. 2) обладает несколькими местами, по которым
возможно вести химическую модификацию. Наиболее распространенными являются
работы, в которых производится модификация третичной аминогруппы препарата. Все
способы модификации данной аминогруппы можно разделить на реакции присоединения,
реакции нуклеофильного замещения и реакции отщепления одной из метильных групп.
Хотя присоединение алкилирующих реагентов к азоту аминогруппы может, без
сомнения, сопровождаться отщеплением метильного заместителя, если не
стабилизировать в растворе образовавшееся четвертичное аммониевое основание
[28].
Как уже было сказано, ТАМ в организме преобразуется в разные
метаболические формы под действием пероксидаз, аминотрансфераз и окисления
цитохромами [25]. В своих метаболических формах ТАМ усваивается в гладких
мышцах эндометрия. Наиболее часто встречаемая форма ТАМ в организме -
4-гидрокситамоксифен - обладает худшей проницаемостью в через клеточную
мембрану, имеет меньшее сродство к ЭР [30]. Группа исследователей [23] получила
несколько алкилированных по алкиламиноэтокси-группе производных ТАМ. Было
показано, что эффективность ингибирования экпрессии эстрогена напрямую зависит
от длины алкильного заместителя, введенного по аминогруппе: чем заместитель
длиннее, тем эффективность ингибирования лучше (рис. 6).
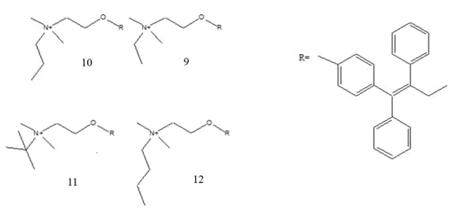
Рис. 6. Алкилированные производные тамоксифена: этилбромид ТАМ (9),
пропилбромид ТАМ (10), трет-бутилбромид ТАМ (11), н-бутилбромид ТАМ (12)
Также было отмечено, что в отличие от липофильного ТАМ, обладающего
высокой степенью трансфекции, у модифицированного по аминогруппе тамоксифена
образуется заряд, вследствие чего он, возможно, теряет свою липофильность и
способность к трансфекции [30].
Во многих видах рака, в том числе и в агрессивных формах рака молочной
железы, наблюдается сверхэкспрессия фолиевых рецепторов, соответственно,
имеющих большое сродство к коньюгатам, содержащим остаток фолиевой кислоты
[31], вследствие чего, группа ученых сконструировала коньюгат наногеля,
фолиевой кислоты и ТАМ [32]. Наногель представляет собой разновидность
полимерных наночастиц коллоидных размеров (100-1000 нм в диаметре). Он
конструируется из разных мономеров, что позволяет наногелю сохранять
устойчивость в любых условиях (pH и температура). Присоединение к такому наногелю
фолиевой кислоты осуществили через диаминолинкер (рис.7) [32].
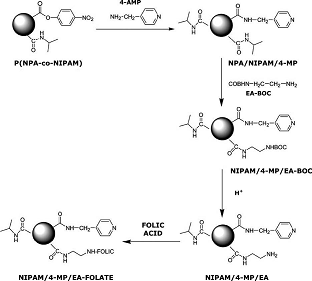
Рис. 7. Схема синтеза коньюгата фолиевой кислоты с наногелем [32]
В результате авторы получили препарат, который направленно доставлялся в
клетки рака груди. Они достигли накопления препарата в тканях карциномы
молочной железы, избежав концентрирования его в крови и других нецелевых
тканях. [32] Однако в нескольких работах было показано наличие фолиевых
рецепторов как в пораженных тканях многих видов опухолей, например, молочных
желез, яичников, эндометрия, легких, так и в здоровых тканях. В частности,
следует заметить, что фолиевая кислота и рецепторы к ней содержатся в больших
количествах в плоде в период его развития и в матке. [33] Таким образом, использование
коньюгатов ТАМ с фолиевой кислотой для направленного взаимодействия с клетками
рака молочной железы оказалось нецелесообразным в связи с широким спектром
«маршрутов» доставки такого коньюгата.
Другой группой ученых изучалась реакция образования N-глюкуроната
тамоксифена, также приводящая к образованию устойчивой соли четвертичного
аммониевого основания. [34] В данном исследовании показано, что тамоксифен
становится биологически активным в глюкозилированной форме в микросомах печени
человека. [34]
В ранних работах было отмечено, что большая часть тамоксифена, как и
любого ксенобиотика, метаболизируется в печени. В печени же метаболиты
тамоксифена могут играть роль сильных канцерогенов [25-26]. Группа
исследователей из университетов США смотрели свойства метаболитов in vitro и in
vivo для изучения влияния изофлавонов на метаболизм тамоксифена [24]. Например,
для определения и идентификации N-оксида
тамоксифена в микросомах печени они получали его путем окисления аминогруппы
3-хлорпероксибензойной кислотой (рис. 8).
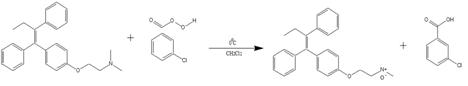
Рис. 8. Схема получения N-оксида
тамоксифена по методике Chen J. [24]
Группа ученых из университета в Торонто синтезировала α-гидрокситамоксифен in vitro с целью дальнейшего подробного исследования кинетики
и механизма реакции образования аддукта ТАМ-ДНК [35]. Проводя опыты на мышиных
клетках печени, они выяснили, что после образования из тамоксифена α-гидрокситамоксифен (4) подвергается
действию сульфотрансфераз, и образовавшийся продукт α-сульфотамоксифен (6) может давать
относительно устойчивый и долго живущий карбокатион (рис. 4 и 9).
Примечательно, что при этом происходит вращение молекулы, наступает равновесие
Z- и E-форм катиона.
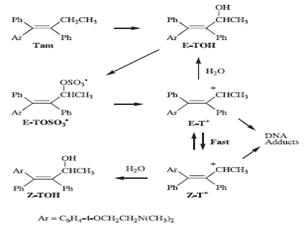

Рис. 9. Метаболические превращения α-гидрокситамоксифена
Дальнейшее исследование позволило авторам [35] заключить, что карбокатион
тамоксифена способен к циклизации с образованием ароматического кольца с
алкокси-группой в качестве заместителя. Внутримолекулярная циклизация
образующегося карбокатиона тамоксифена конкурирует с взаимодействием с водой в
водных растворах. Реакции образования карбокатиона и циклизации относятся к
реакциям второго порядка и зависят от концентрации ионов Н+ в
растворе. Циклизация происходит параллельно при взаимодействии с водой при
кислых и нейтральных значениях pH [35]. Таким образом, полученные результаты
помогают глубже понять механизм канцерогенеза, запускаемый непосредственно
тамоксифеном, и найти способы преодоления нежелательных эффектов при
химиотерапии.
Список использованной литературы
1. Tamoxifen
Adjuvant Treatment Duration in Early Breast Cancer: Initial Results of a
Randomized Study Comparing Short-Term Treatment With Long-Term Treatment
Thierry Delozier, Marc Spielmann, Josette Mace´-Lesec’h, etc. // Journal of Clinical
Oncology, Vol 18, No 20 (October 15), 2000: pp 3507-3512
2. GPR30,
the Non-Classical Membrane G Protein Related Estrogen Receptor, Is
Overexpressed in Human Seminoma and Promotes Seminom a Cell Proliferation
Nicolas Chevalier, Aurelie Vega, Adil Bouskine, etc. // PLoS ONE 7(4): e34672
. Tamoxifen-Poly(ethylene
glycol)-Thiol Gold Nanoparticle Conjugates: Enhanced Potency and Selective
Delivery for Breast Cancer Treatment Erik C. Dreaden, Sandra C. Mwakwari,
Quaovi H. Sodji, etc. // Bioconjug Chem. 2009 December; 20(12): 2247-2253
. Hydrogen
peroxide overproduced in breast cancer cells can serve as an anticancer prodrug
generating apoptosis-stimulating hydroxyl radicals under the effect of
tamoxifen-ferrocene conjugate Wjatschesslaw A. Wlassoff, Craig D. Albright,
Michael S. Sivashinski, etc.// JPP 2007, 59: 1549-1553
. M.L.
Asp, J.J. Martindale, J.M. Metzger Direct, Differential Effects of Tamoxifen, 4-Hydroxytamoxifen,
and Raloxifene on Cardiac Myocyte Contractility and Calcium Handling // PLOS
ONE October 2013, Volume 8, Issue 10, e78768
. Endometrial
surveillance of women on tamoxifen Lhommé
C, Pautier P, Zagamé L, etc. // Gynecol Obstet Fertil. 2003
Jul-Aug;31(7-8):647-56
. Discovery
of estrogen receptor α target genes and response
elements in breast tumor cells Chin-Yo Lin,
Anders Ström, Vinsensius Berlian Vega, etc. // Genome Biology 2004, Volume 5,
Issue 9, Article R66
. In
Vivo Assay Of Folate Receptors In Nonfunctional Pituitary Adenomas With
99mtc-Folate Receptors In Nonfunctional Pituitary Adenomas With 99mtc-Folate
SPECT/CT James R. Galt, Raghuveer K. Halkar, Chheng-Orn Evans, etc. // The
Journal Of Nuclear Medicine Vol. 51 No. 11 November 201
. Endometriosis:
novel etiopathogenetic concepts and clinical perspectives Mario Vignali, M.D.,
Mirco Infantino, M.D., Roberta Matrone, M.D., etc. // University of Milan,
Milan, Italy
. R.
Moro, J. Gulyaeva-Tcherkassova, and P. Stieber Increased Alpha-Fetoprotein
Receptor In The Serum Of Patients With Early-Stage Breast Cancer // Curr Oncol,
Vol. 19, pp. e1-8
. C.P.
Leamon, J.A. Reddy Folate-Targeted Chemotherapy // Advanced Drug Delivery
Reviews 56 (2004) 1127- 1141
. Mariette
Gerber Omega-3 fatty acids and cancers: a systematic update review of
epidemiological studies // British Journal of Nutrition (2012), 107, S228-S239
. R.
Moro, J. Gulyaeva-Tcherkassova and P. Stieber Increased alpha-fetoprotein
receptor in the serum of patients with early-stage breast cancer // Curr
Oncol, Vol. 19, pp. e1-8
. Prodrug
Strategies In Anticancer Chemotherapy F. Kratz, I.A. Muller, C. Ryppa,
A. Warnecke // ChemMedChem 2008, 3, 20-53
. Polymeric
nanoparticles for drug delivery Chan JM, Valencia PM, Zhang L, etc. // Methods
Mol Biol 624:163-175
. Effective
Non-Viral Delivery of siRNA to Acute Myeloid Leukemia Cells with Lipid-
Substituted Polyethylenimines Landry B, Aliabadi HM, Samuel A, etc. // PLoS ONE
7(8): e44197 doi:10.1371/journal.pone.0044197
. Histone
Deacetylase Inhibitors Equipped With Estrogen Receptor Modulation Activity B.E.
Gryder, M. K. Rood, K.A. Johnson, etc. // J. Med. Chem. 2013, 56, 5782−5796
. Circulating
Hormones And Breast Cancer Risk In Premenopausal Women: A Randomized Trial Of
Low-Dose Tamoxifen And Fenretinide H. Johansson, B. Bonanni, S. Gandini, Al.
Guerrieri-Gonzaga // Breast Cancer Res Treat (2013) 142:569-578
. MGMT
Inhibition Restores ERα Functional Sensitivity To
Antiestrogen Therapy G.C. Bobustuc, J.S. Smith, S. Maddipatla, etc. // mol
med 18: 913-929, 2012 bobustucetal. 913
. An
epigenomic approach to therapy for tamoxifen-resistant breast cancer Qin Feng,
Zheng Zhang, Martin J Shea, etc. // Cell Research advance online publication 30
May 2014; doi:10.1038/cr.2014.71
. miRNA-34b
as a tumor suppressor in estrogen-dependent growth of breast cancer cells Yee-Ming
Lee, Jen-Yi Lee, Chao-Chi Ho, etc. // Breast Cancer Research 2011, 13:R116
. In
vitro mechanism for down regulation of ER-expression by epigallocatechin
gallate in ER+/PR+ human breast cancer cells Francesca De Amicis, Alessandra
Russo, Paola Avena, etc. // Mol. Nutr. Food Res. 2013, 00, 1-1
. Genomic
action of permanently charged tamoxifen derivatives via estrogen receptor-a Claudia
Rivera-Guevara, Victor Purez-Alvarez, Rocнo Garcнa-Becerra, etc. //
Bioorganic&Medicinal Chemistry 18 (2010) 5593-5601
. Potential
Beneficial Metabolic Interactions Between Tamoxifen and Isoflavones via
Cytochrome P450-Mediated Pathways in Female Rat Liver Microsomes Jun Chen,
Steven C. Halls, Joshua F. Alfaro, etc. // Pharmaceutical Research, Vol.21, No.
11, November 2004
. Nilesh
W. Gaikwad, William J. Bodell Peroxidase-mediated dealkylation of tamoxifen,
detected by electrosprayionization-mass spectrometry, and activation to form
DNA adducts // Free Radical Biology&Medicine 52 (2012) 340-347
. Inefficient
Repair Of Tamoxifen-Dna Adducts In Rats And Mice Sung Yeon Kim, Naomi Suzuki,
Y.R. Santosh Laxmi, and Shinya Shibutani // Drug Metabolism And Disposition Dmd
34:311-317, 2006
. Role
Of Cyclins A And E In Endometrial Carcinogenesis In Breast Cancer Patients
Under Tamoxifen Treatment A.M. Metwally, L.A. Refaat, H.A. Shaaban, etc. //
Journal of the Egyptian National Cancer Institute (2013) 25, 193-198
28. Марч
Дж. Органическая химия. Реакции механизмы и структура. Углубленный курс для
университетов и химических вузов // 1987, 1(4), ст. 358-375
29. Tamoxifen-loaded
folate-conjugate poly[(p-nitrophenylacrylate)-co-(N-isopropylacrylamide)]
sub-microgel as antitumoral drug delivery system M. Dolores Blanco, Sandra Guerrero,
Marta Benito, etc. // Wiley Online Library (wileyonlinelibrary.com). DOI:
10.1002/jbm.a.32929
. Quaternary
ammonium-linked glucuronidation of trans-4-hydroxytamoxifen, an active
metabolite of tamoxifen, by human liver microsomes and UDP- glucuronosyl
transferase 1A4 Kenichiro Ogura, Yuko Ishikawa, Teppei Kaku, etc. //
Biochemical pharmacology 71 (2006) 1358-1369
. Folic
acid modified gelatine coated quantum dots as potential reagents for in vitro
cancer diagnostics Valérie A Gérard,
Ciaran M Maguire, Despina Bazou, Yurii K Gun’ko // Gérard et al. Journal
of Nanobiotechnology 2011, 9:50
. Tamoxifen-loaded
folate-conjugate poly[(p-nitrophenylacrylate)-co-(N-isopropylacrylamide)
sub-microgel as antitumoral drug delivery system M. Dolores Blanco, Sandra
Guerrero, Marta Benito, etc. // Wiley Online Library (wileyonlinelibrary.com).
DOI: 10.1002/jbm.a.32929
. Emanuela
I. Sega, Philip S. Low Tumor detection using folate receptor-targeted imaging
agents // Cancer Metastasis Rev (2008) 27:655-664
. Quaternary
ammonium-linked glucuronidation of tamoxifen by human liver microsomes and
UDP-glucuronosyltransferase 1A4 T. Kaku, K. Ogura, T. Nishiyama, etc. //
Biochemical Pharmacology 67 (2004) 2093-2102
. Cristina
Sanchez, Robert A. McClelland The tamoxifen cation reacts to give indene
products // Can. J. Chem. 78: 1186-1193 (2000)