Влияние качества воды и условий технологического процесса на экстрактивность пивного сусла
Министерство образования и науки
Российской Федерации
Федеральное государственное бюджетное
образовательное учреждение
высшего профессионального образования
ИВАНОВСКИЙ ГОСУДАРСТВЕННЫЙ
ХИМИКО-ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ
Кафедра
Технологии пищевых продуктов и
биотехнологии
КВАЛИФИКАЦИОННАЯ РАБОТА БАКАЛАВРА
Тема: Влияние качества воды и условий
технологического процесса на экстрактивность пивного сусла
Дипломник
М.И. Ерова
Руководитель
Е. В. Найденко
Зав. кафедрой
С. В. Макаров
г. Иваново, 2015 г.
АННОТАЦИЯ
Квалификационная работа Масевой О.А. на тему: «Влияние качества воды и
условий технологического процесса на экстрактивность пивного сусла»
представлена на 44 страницах машинописного текста и состоит из введения,
аналитического обзора литературы, экспериментальной части, результатов и их
обсуждения и списка литературы. Работа содержит 10 таблиц и 4 рисунка и 22
ссылки на отечественные и зарубежные источники литературы.
В данной исследовательской работе исследовано влияние воды различного
качества на экстрактивность пивного сусла и количество редуцирующих сахаров, а
так же влияние технологических условии и продолжительности процесса затирания
на качественные показатели пивного сусла.
В результате работы установлены оптимальные способ водоподготовки для
предприятий пивоваренной отрасли и условия проведения процесса затирания.
Выявлено, что использование в процессе приготовления сусла воды,
прошедшей обработку катионитом, положительно сказывается на его качественных
показателях. Так же было установлено, что положительное влияние на
экстрактивность пивного сусла и количество редуцирующих сахаров оказывает
перемешивание на белковой и мальтозной паузах. При изучении влияния
продолжительности мальтозной паузы было установлено, что наилучшей является
пауза продолжительностью 15 минут.
Оглавление
АННОТАЦИЯ
ВВЕДЕНИЕ
. АНАЛИТИЧЕСКИЙ ОБЗОР ЛИТЕРАТУРЫ
.1 История пивоварения
.2 Сырье
.2.1 Солод
.2.2 Вода
.3 Влияние состава воды на технологический процесс
.4 Способы обработки воды
.5 Основы процесса затирания
. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
.1 Методика постановки эксперимента
. Результаты и их обсуждение
.1 Результаты эксперимента №1
.2 Результаты эксперимента №2
.3 Результаты эксперимента №3
. ВЫВОДЫ
СПИСОК ИСПОЛЬЗОВАННЫХ
ИСТОЧНИКОВ
ВВЕДЕНИЕ
Пиво представляет собой игристый, освежающий напиток с характерным
хмелевым ароматом и приятным горьковатым привкусом, насыщенным углекислым
газом, образовавшимся в процессе брожения. Оно не только утоляет жажду, но и
повышает общий тонус организма человека, способствует лучшему обмену веществ
[2].
Получение высококачественного продукта в первую очередь достигается за
счет применения сырья хорошего качества и наиболее рационального способа его
переработки, а также зависит от точного соблюдения технологии. Основным сырьем
для производства пива служит ячменный солод, хмель, вода и дрожжи [1].
Широкое распространение этого напитка и его популярность обуславливается
своеобразным сочетанием в пиве хмелевой горечи, специфического аромата и
насыщенности растворенной углекислоты при небольшом содержании алкоголя [3].
Производство пива состоит из следующих этапов: очистка и дробление
солода, приготовление сусла, брожение сусла, дображивание сусла, фильтрование и
розлив [3].
Приготовление сусла является основной технологической операцией,
определяющей качество готового продукта.
Приготовление сусла включает в себя такие процессы как: затирания сырья,
фильтрования затора, кипячение сусла с хмелем и отделение хмелевой дробины [1].
Затирание осуществляют в целях перевода в растворимое состояние
максимального количества экстрактивных веществ солода и несоложенных материалов
[1].
Цель фильтрования - отделение жидкой фазы (сусла) от твердой (дробины) с
последующим вымыванием водой экстракта, удержанного дробиной [1].
Кипячение сусла с хмелем предусматривает концентрирование сусла до
заданной массовой доли сухих веществ в начальном сусле, перевод ценных
составных веществ хмеля в раствор, инактивацию ферментов, коагуляцию белковых
веществ и стерилизацию сусла [2].
Для подготовки сусла к осветлению и охлаждению его отделяют от хмелевой
дробины, чтобы в дальнейшем устранить отрицательное влияние ее на цвет и вкус
готового продукта [2].
На протекание технологических процессов при затирании влияют следующие
факторы: температура и pH среды, продолжительность проведения биохимических
реакции, концентрация затора [2].
Процесс затирания ведут в варочном агрегате двухотварочным способом. На
данном этапе контролируются качественные показатели сусла: его плотность и
степень сбраживания. После затирания охмеленное сусло поступает на осветление.
Целью данной работы является изучение влияния качества воды и технологии
затирания на концентрацию экстрактивных веществ в сусле.
.
АНАЛИТИЧЕСКИЙ ОБЗОР ЛИТЕРАТУРЫ
1.1 История пивоварения
В истории, к сожалению, не сохранилось точных сведений о времени и месте
зарождения пивоварения, благодаря которому человечество получило возможность
наслаждаться прекрасным пенным напитком. Полагают, что произошло это около VII
тысячелетия до н. э. - в эпоху неолита, у народов Ближнего Востока в
Месопотамии - плодородном южном междуречье между Евфратом и Тигром, на
территории, которую ныне занимает Ирак [1].
Высокий уровень культуры древних народов южного Междуречья −
шумеров и вавилонян - оказывал благотворное влияние на ближайшие страны,
которые перенимали у более развитых соседей знания и ремесла. Все это
способствовало постепенному распространению пивоварения среди народов малой
Азии, северной Африки, Закавказья и др. [1].
Одними из первых пивоварение заимствовали египтяне. Об этом
свидетельствуют, сохранившиеся до наших дней, барельефы с изображением основных
стадий соложения и пивоварения в древнем Египте, которые археологи относят ко
времени правления пятой династии фараонов −около 2400 г. до н. э.[1].
Пивоварение все шире распространялось среди древних государств южной
Европы: Фригии, Фракии, Иберии, Иллирии, Галлии, Паннонии, а затем начало
углубляться в центральную и северную части Европы [1].
В Европе пиво было любимым напитком уже у древних германцев, а также у
скифов и кельтов. Как и повседневная пища, пиво варилось в домашнем хозяйстве
женщинами - ведь варка пива и выпечка хлеба считались женской работой у всех
первобытных народов [5].
Особую популярность пиво получило в Чехии и Германии. В средние века
пивоварение проникает за монастырские стены, где технология пива доводится
монахами до совершенства. В современной Германии до сих пор в некоторых
монастырях действуют пивоварни, оснащенные самым современным технологическим
оборудованием [1].
Пиво, получаемое по древнейшей технологии, лишь из ячменного солода,
представляло собой кислую бражку и существенно отличалось от современных сортов
специфическим вкусом. Позднее технология постепенно совершенствовалась [1].
Так, для придания аромата и улучшения вкуса древние пивовары начали
добавлять к солоду различные растения: багульник, ежевику, люпин, полынь,
шафран и др. Однако только с началом применения хмеля произошел качественный
скачок в развитии пивоварения и, по сути, были заложены основы современной
технологии пива [1].
Изучая историю развития пивоварения, невозможно обойти вниманием
баварский закон чистоты, явившийся важной исторической вехой в становлении
пивоварения, как отрасли производства. Этот закон, пожалуй, следует считать
старейшим из всех законодательных предписаний в мире, не утративших свое
практическое значение и на сегодняшний день [1].
Как и в прошлом, данный закон скрупулезно выполняется каждым немецким
пивоваром. В соответствии с этим законом пиво в Германии варят исключительно с
применением солода, хмеля, дрожжей и воды [1].
Пивовары средневековой Европы для улучшения пива и придания ему особого
вкуса и большей стойкости на разных этапах его приготовления добавляли
всяческие посторонние ингредиенты. Бесконтрольные эксперименты в этой области
зашли очень далеко. Например, в Германии, ‚ добавляли бычью желчь, дубовые
листья, ядовитые дурманящие травы, смолу, а в Чехии древесную труху и даже (!)
истертые в порошок кости казненных преступников. Все это зачастую приводило к
нарушению здоровья и потере работоспособности [1].
На эти дурные начинания не мог одобрительно взирать герцог баварский
Вильгельм III. Именно по его настоянию 23 апреля
1516 г. местным органом власти был принят закон о чистоте пива, в соответствии
с которым баварским пивоварам для изготовления пенистого напитка
строго-настрого предписывалось использовать лишь ячменный солод, хмель и воду.
И никаких добавок! Дрожжи в этом законе не упоминались, так как в те времена о
них еще не было известно [1].
С конца ХХ в. заповедь чистоты, длительное время защищавшая немецких
производителей пива от иностранной конкуренции, официально больше не действует.
При объединении развитых европейских стран в Европейское Сообщество (ЕС) в 1987
г. заповедь чистоты была упразднена. Однако в силу устоявшихся традиций немецкие
пивовары по-прежнему продолжают следовать ей неукоснительно [1].
В настоящее время заповедь чистоты весьма умело используется германскими
пивоварами как убедительный рекламный ход и гарантия превосходного пива [1].
Предпосылками к началу производства стойкого пива являются работы
француза Луи Пастера. Он доказал, что процессы брожения - это результат
деятельности микроорганизмов. Он сформулировал тезис «La fermentation est la
vie sans loxygene» («Брожение - жизнь без кислорода») [1].
Благодаря работам Эмиля Христиана Хансена, который в 1883 г. в
Карлсбергской лаборатории (г. Копенгаген) разработал метод получения чистой
культуры дрожжей, усовершенствованный позднее в 1893 г. Паулем Линднером в его
«капельном методе», были заложены основы для биологически чистых методик и дана
возможность получать расы дрожжей и снижать влияние контаминантов [5].
На Руси пиво было ритуальным напитком, который употребляли на пирах. Со
временем на Руси появлялось все больше пивоварен. На рубеже XVIII - XIX вв. пользовалось известностью пиво московских
пивоварен [1].
В середине XX в. пивоваренная
промышленность в России была полностью технически реконструирована. В это время
было построено много новых заводов [1].
После декларирования рыночной экономики в 1992 г. российские пивоваренные
предприятия сразу же почувствовали острейшую конкуренцию со стороны зарубежных
производителей пива. На прилавках можно было найти менее качественное, но
намного более стойкое импортное пиво, существенно потеснившее отечественное
[1].
С конца 1990-х гг. в России возобновилось строительство новых
пивоваренных заводов [1].
Большинство российских пивоваренных предприятий в этот период постепенно
подтягиваются по технической оснащенности к современному уровню, что заметно
сказалось на повышении стойкости пива, позволив предприятиям существенно
расширить рынок сбыта своей продукции.
За последние 10 лет пивоваренная индустрия России прошла путь от одной из
отсталых отраслей пищевой промышленности до эффективно работающего
аграрно-промышленного комплекса [4].
Пивоваренная отрасль - одна из наиболее эффективных отраслей российской
экономики. В отрасли насчитывается 760 предприятий, из них 330 крупных (свыше 6
млн. дал. в год), остальные средней и малой мощности. Появление 1 рабочего
места дает 15 дополнительных мест в смежных отраслях. Отечественное пивоварение
вносит существенный вклад в укрепление здоровья населения, выступая в качестве
устойчивой альтернативы крепким алкогольным напиткам и наркотикам [4].
С 2001 г. отрасль стабильно увеличивает объемы производства и уверенно
развивается [4].
На сегодняшний день процесс приготовления пива на современных
пивоваренных предприятиях практически полностью автоматизирован. Контроль
качества изготавливаемого пива проводится грамотными специалистами-технологами
[1].
.2
Сырье
1.2.1 Солод
Солод - важнейшее сырье, используемое в пивоварении.
Пивоваренным солодом называют зерно, искусственно пророщенное и
высушенное в определенных температурных условиях. В процессе приготовления
солода в зерна протекают сложные биохимические процессы, в результате которых:
· синтезируются и активизируются ферменты;
· при участии этих ферментов осуществляются изменения различных
групп зерна [1].
Солод получают из различных злаков, например, пшеницы, ржи, сорго, но
основным сырьем для производства пивоваренного солода является ячмень [1].
Влияние характеристик солода на качественные показатели пива
общеизвестно. Некоторые показатели солода, такие, как цвет, вкус и запах,
являются главными в установлении типа пива, а количество экстрактивных веществ
и степень растворения белков оказывают существенное влияние на качество
конечного продукта. Солод приобретает свои характеристики в процессе
солодоращения, но многие из них зависят от свойств применяемого ячменя. Поэтому
уже долгое время на предприятиях большое внимание уделяется качеству ячменя,
так как многие его сорта по причине высокого содержания белков, стекловидности
зерен или слишком толстой оболочки не пригодны для солодоращения [9].
Ячмень, предназначенный для солодоращения, должен быть здоровым и
хранится определенное время, т. е. отлежавшимся, чтобы его свойства выровнялись
по всей массе. При соложении он должен быть хорошо проращен и высушен. Любой
дефект сырья или солодильного процесса отрицательно отражается на качестве
солода [9].
Большое внимание уделяется исследованиям качества солода, с одной
стороны, для того, чтобы удостоверится в правильности проведения процесса
солодоращения, а с другой - чтобы установить качественные показатели солода
перед обработкой и определить пригодность его для получения пива заданного
сорта [9].
Пивоваренный ячменный солод проращивают 5-6 суток, затем его высушивают,
в результате чего он приобретает требуемые органолептические качества и
способность к продолжительному хранению [1].
Качество светлого солода оценивают по органолептическим, физическим,
механическим, физиологическими химическим (технохимическим) показателям [6].
Качество солода должно соответствовать ГОСТ 29294-2014 «Солод
пивоваренный. Технические условия» [7]. По органолептическим показателям солод
должен соответствовать требованиям, приведенным в таблице 1.
Таблица 1- Органолептические показатели солода
|
Наименование показателя
|
Характеристика для солода
|
|
Ячменного (светлого и
темного) и пшеничного
|
Ячменного карамельного
|
Ячменного жженого
|
|
1
|
2
|
3
|
4
|
|
Внешний вид
|
Однородная зерновая масса,
не содержащая плесневелых зерен и зерновых вредителей
|
|
Цвет
|
От светло-желтого до
желтого. Не допускаются тона зеленоватые и темные. Для пшеничного солода
допускается красноватый оттенок
|
От светло-желтого до буроватого
с глянцевым отливом
|
Темно-коричневый. Не
допускается черный
|
|
Вкус
|
Солодовый, сладковатый. Не
допускаются посторонние привкусы
|
Сладковатый. Не допускаются
горький и пригорелый как самого солода, так холодной и горячей вытяжек
|
Кофейный. Не допускаются
горький и пригорелый как самого солода, так холодной и горячей вытяжек
|
|
Запах
|
Солодовый, более выраженный
у ячменного темного солода. Не допускаются посторонние запахи: плесени,
кислый, затхлый и другие, не свойственные продукту
|
Солодовый. Не допускаются
посторонние запахи: плесени, кислый, затхлый и другие, не свойственные
продукту
|
Напоминающий кофе. Не
допускается пригорелый
|
Солод на ощупь должен быть сухим и беспыльным [9].
По физико-химическим показателям ячменный и пшеничный солод высокого
качества должны соответствовать требованиям, указанным в таблице 2 карамельный
и жженый солод - в таблице 3 [7].
Таблица 2 - Физико-химические показатели ячменного и пшеничного солода
высокого качества
|
Наименование показателя
|
Значение показателя для
солода
|
|
светлого
|
темного
|
|
ячменного
|
пшенично-го
|
ячменно-го
|
пшенич-ного
|
|
Высшего качества
|
I класса
|
II класса
|
|
|
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
Количество мучнистых зерен,
%, не менее
|
85,0
|
80,0
|
|
90,0
|
|
Количество стекловидных
зерен, %, не более
|
3,0
|
5,0
|
10,0
|
5,0
|
|
Массовая доля сорной
примеси, %
|
Не допускается
|
0,3
|
0,5
|
0,3
|
|
Проход через сито (2,2 х
20) мм, %, не более
|
3,0
|
5,0
|
8,0
|
-
|
8,0
|
0
|
|
Массовая доля влаги, %, не
более
|
4,5
|
5,0
|
6,0
|
5,0
|
|
Массовая доля экстракта в
сухом веществе солода тонкого помола, %, не менее
|
79,0
|
78,0
|
76,0
|
74,0
|
|
Разность массовых долей
экстрактов в сухом веществе тонкого и грубого помолов, %, не более
|
1,5
|
2,0
|
4,0
|
3,0
|
Не регламен-тируется
|
4,0
|
|
Массовая доля белка в сухом
веществе солода, %, не более
|
11,5
|
12,0
|
12,2
|
Не регламентируется
|
|
Отношение массовой доли
растворимого белка к массовой доле белковых веществ в сухом веществе солода
(число Кольбаха), %
|
39 - 41
|
Не регламентируется
|
|
Кислотность лабораторного
сусла, см3 раствора гидроксида натрия концентрацией 1 моль/дм3 на 100 см3
сусла
|
0,9 - 0,11
|
0,9-1,2
|
0,9-1,3,
|
|
Продолжительность
осахаривания, мин, не более
|
15
|
20
|
25
|
|
Прозрачность лабораторного
сусла (визуально)
|
Прозрачное
|
Допускается не большая
опалесценция
|
Не регламентируется
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 3 - Физико-химические показатели карамельного и жженого солода
первого класса
|
Наименование показателя
|
Значение показателя для
солода
|
|
Карамельного
|
Жженого
|
|
Первого класса
|
Второго класса
|
|
|
1
|
2
|
3
|
4
|
|
Массовая доля влаги, %, не
более
|
6,0
|
5,0
|
|
Массовая доля сорной
примеси, %
|
0,5
|
|
|
Кольчество карамельных
зерен, %, не менее
|
93,0
|
25,0
|
|
|
Массовая доля экстракта в
сухом веществе солода тонкого помола, %, не менее
|
75,0
|
70,0
|
|
Показатель лабораторного
сусла: цвет, не менее, Лн
|
20,0
|
100,0
|
Помимо приведенных требований готовый солод должен иметь мягкий
эндосперм, что является признаком хорошей степени растворения. Присутствие
солода стекловидной структуры приводит к недостаточному размельчению при
дроблении и низкому выходу экстракта. Стекловидный солод получается из
недостаточно разрыхленного свежепроросшего зерна, особенно если при высокой влажности
он подвергается воздействию высокой температуры. Солод легко становится
стекловидным, если его влажным направляют с верхней решетки сушилки на плохо
охлажденную нижнюю решетку [2].
Основное сырье для производства пива - светлый солод, применяемый для получения
практически всех типов пива: от светлого типа Пилзнер (Pilsner) до темного
почти черного пива типа Стаут (Stout) [5].
1.2.2 Вода
В пивоваренном производстве вода является
технологическим сырьем. В пиве содержится 90-95 % воды. Кроме того, вода используется
для замачивания зерна, мойки оборудования и тары. Общий расход воды на 1 м3
конечного продукта составляет 20-25 м3 в производстве пива. Поэтому к качеству
воды предъявляются повышенные требования [1].
Вода должна быть безопасна в эпидемическом и
радиационном отношении, безвредна по химическому составу и обладать качествами
питьевой воды, быть прозрачной, бесцветной, без запаха и привкуса [1].
В чистой природной воде всегда содержатся растворимые
соли, которые влияют на вкус пива, а также на ферментативные процессы. Для
производства пива очень важен солевой состав применяемой воды. От него в
значительной мере зависит вкус пива. Содержание солей можно изменять различными
способами обработки. Для питьевой воды существую ограничения по микробиологическим,
токсикологическим показателям и по компонентам, отрицательно влияющим ее
органолептические свойства [1].
Содержащиеся в производственной воде соли относительно
сильно разбавлены, вследствие чего они всегда глубоко диссоциированы, поэтому
следует обращать внимание на влияние катионов и анионов на процесс
приготовления пива. К основным ионам, присутствующим в природной воде,
относятся катионы Н+, Na+, K+, NH4+, Ca2+, Mg2+, Mn2+, Fe2+ и
Fe3+, Al3+, а также анионы (ОН-), Сl-, HCO3-,
CO32-, NO3-, NO2-, SO42-, PO43-, SiO32-.
Катионы и анноны находятся в равновесии [10].
В молекулярном и коллоидном состоянии находятся органические вещества, а
также растворенные в воде газы СО2, О2, N2 [3].
Вода для производства пива поступает из коммунальных источников водоснабжения.
В пивоварении к ней предъявляются требования, указанные в технологической
инструкции по водоподготовке для производства пива и безалкогольных напитков
[7]. По органолептическим показателям вода должна представлять собой прозрачную
бесцветную жидкость без вкуса и запаха. Химические показатели качества воды
приведены в таблице 4 а микробиологические в таблице 5.
Таблица 4 - Химические показатели качества воды
|
Показатель
|
Значение (не более)
|
|
1
|
2
|
|
Величина рН
|
6,0 - 6,5
|
|
Сухой остаток минеральных
солей, мг/дм3
|
500
|
|
Окисляемость, мг О2/дм3
|
2,0
|
|
Щелочность, мг-экв./дм3
|
0,5 - 1,5
|
|
Общая жесткость,
мг-экв./дм3
|
2,0 - 4,0
|
|
Алюминий, мг/дм3
|
0,5
|
|
Аммиак, мг/дм3
|
Следы
|
|
Железо (суммарно мг/дм3)
|
0,1
|
|
Нитраты, мг/дм3
|
10,0
|
|
Нитриты, мг/дм3
|
0
|
|
Сульфаты, мг/дм3
|
100 - 150
|
|
Хлориды, мг/дм3
|
100-150
|
|
Кальций, мг-экв./дм3
|
2,0 - 4,0
|
|
Кремний, мг/дм3
|
2,0
|
|
Магний, мг/дм3
|
Следы
|
|
Марганец, мг/дм3
|
0,1
|
|
Медь, мг/дм3
|
0,5
|
Таблица 5 - Микробиологические показатели качества воды
|
Показатель
|
Значение (не более)
|
|
1
|
2
|
|
Общее количество бактерий в
1 см3 воды, не более
|
100
|
|
Количество бактерий группы
кишечной палочки в 1 см3 воды, не более
|
3
|
В 1 см3 питьевой воды обычно содержится до 300 видов
микроорганизмов, поэтому при подготовке технологической воды требуется ее
обеззараживание, особенно в производстве пива. Это вызвано тем, что жидкости,
содержащие углеводы, представляют собой благоприятную питательную среду для
развития микроорганизмов, которые, при попадании в напиток с водой, могут очень
быстро привести его в непригодное к употреблению состояние [1].
Жесткость воды характеризуется присутствием ионов
кальция и магния. Этот показатель рассматривают при оценке воды для
практического использования. Различают следующие виды жесткости воды:
· общую, обусловленную содержанием в воде всех солей кальция и
магния − Са(НСО3)2, Мg(НСО3)2
МgSО4, CaSO4, CaCl2,
MgCl2;
· карбонатную, или временную, причиной, которой является
наличие наличием в воде гидрокарбонатов (солей НСОЗ) кальция и магния,
удаляемых при кипячении вследствие разрушения и перехода в слаборастворимые
карбонаты, выпадающие в осадок;
· некарбонатную, или постоянную, оставшуюся в воде после
удаления из нее гидрокарбонатов.
Общая щелочность зависит от наличия и воде гидроксидов, карбонатов и
гидрокарбонатов кальция, магния и натрия; ее определение проводят с целью
установления пригодности воды для пивоваренного производства [3].
Повышающему pH действию карбонатных ионов противостоит понижающее
действие прочих кальциевых и магниевых ионов, присутствующих в виде хлоридов и
сульфатов кальция и магния. Действие этих солей сводится под определение
«некарбонатная жесткость» (или остаточная, а также сульфатная, гипсовая
жесткость, так как часть жесткости образуется соответствующими солями) [5].
Чем выше показатель остаточной щелочности, тем сильнее проявляется
действие карбонатной жесткости, и следует ожидать большего значения pH [5].
О загрязненности воды органическими веществами судят по показателю
окисляемости. При оценке пригодности воды для технологических целей
рассматривается не только химический состав, но и бактериальный, так как воду
используют для мойки оборудования, емкостей, помещений и т. п [3].
Точные аналитические методы (хроматография, спектрометрия) позволяют
обнаружить в воде даже незначительное присутствие антропогенных органических
веществ. Они дают ясное понимание о сути загрязнений и служат основой для
выбора способа их устранения и применяемого для этого оборудования [16].
Для уменьшения цвета поверхностных вод и количества органических веществ
и повышения гигиенической безопасности. В настоящее время, сооружена совершенно
новая система подготовки воды, содержащая линии подготовки, горизонтальные
емкости для обработки озоном, а также фильтров для нисходящих потоков с
емкостью для фильтрования из легированной стали для биофильтрации и емкости для
очищенной воды [13].
1.3 Влияние состава воды на технологический
процесс
сусло хмель вода пива
В воде всегда растворены соли, причем, они содержатся
в воде не в виде солей, а почти полностью диссоциированы на ионы. Поэтому правильнее
рассматривать не соли, а растворенные ионы [5].
Большая часть этих ионов не реагирует при затирании с
компонентами солода. Другие же реагируют с определенными его компонентами.
Поэтому принято, различать: химически неактивные ионы и химически активные ионы
[5].
Химически неактивные (пассивные) ионы
К химически пассивным ионам относят те, которые не
вступают в химические реакции с составляющими солода и переходят в пиво без
изменений. Если они присутствуют в повышенных концентрациях, то могут оказывать
на вкус пива как положительное, так и отрицательное воздействие [5].
Однако некоторые из этих химически неактивных ионов
при производстве пива влияют на те или иные процессы. Понятие «химическая
неактивность» по отношению к упомянутым ионам относится только к их
нейтральности по отношению к веществам солода, с которыми данные ионы могут
контактировать во время приготовления сусла [5].
Химически активные ионы
Ряд ионов, присутствующих в используемой для
производства пива воде, при затирании реагируют с компонентами солода, что в
ходе технологического процесса оказывает влияние на величину водородного
показателя pH [5].
Реакции, которые протекают между анионами и катионами,
присутствующими, с одной стороны, в солоде, с другой - в воде, применяемой в
производстве пива в условиях затирания, довольно сложны. Так как они влияют на
формирование вкусовых качеств каждого сорта пива, на них давно сосредоточено
внимание теоретиков и практиков [9].
Рассмотрим ионы, изменяющие рН среды. Гидрокарбонат-ионы реагируют с Н-катионами,
поступающими из солода, и образуют угольную кислоту:
НСO- + H+ - H2O + CO2 (1)
Малая степень диссоциации угольной кислоты приводит к сдвигу значения рН
в щелочную сторону, что влечет за собой ухудшение осахаривания заторов,
снижению экстрактивности сусла, увеличению продолжительности фильтрования,
выщелачиванию дубильных и красящих веществ [3].
Положительное действие ионов кальция и магния заключается в их
способности, сдвигать показатель рН в кислую сторону. Ионы кальция
взаимодействуют с вторичным фосфатом солода и в результате чего в осадок
выпадает сильнощелочной третичный фосфат кальция, освобождая при этом ион
водорода:
3Ca2++ 2HPO42- ↔ 2H+ + Ca3(PO4)2↓ (2)
Данная реакция происходит также между ионами магния и фосфатами. При
охлаждении сусла третичный фосфат магния частично растворяется и частично
становится снова вторичным фосфатом, поэтому значение рН горячего сусла более
низкое, чем холодного. Следовательно, подкисляющее действие ионов магния
меньше, чем ионов кальция, примерно в 2 раза [3].
Подкисляющее действие ионов кальция и магния объясняется также их
взаимодействием с белковыми веществами или продуктами распада белка, в
результате чего образуется протеинат и высвобождаются ионы водорода:
Н-протеин + Са2+↔Са-протеинат + 2Н+ (3)
Эта реакция протекает уже при комнатной температуре и характерна для
процесса варки сусла. Протеинат магния более диссоциирован, чем протеинат
кальция, т. е. магний дает меньшую кислотность в реакции с белками, чем кальций
[3].
Негативное влияние на активную кислотность среды небольшого количества
гидрокарбонатов кальция (или магния) объясняется уравнением:
|
2КН2PO4
|
+ Са(НСО3)2
|
→К2НPO4
|
+ СаНРО4
|
+ 2Н2О
|
+ 2СО2;
|
(4)
|
|
|
|
гидрофасфат кальция
|
вода
|
двуокись углерода
|
|
Реакции при большом количестве кальция, магния, натрия:
4KH2РO4 + 3Ca(HCO3)2 = Са3(PO4)3 + 2K2HPO4 + 6H2O + 6СO2; (5)
KH2PO4 + 3Mg(HCO3)3 ↔ Mg3(PO4)2 + 2K2HPO4 + 6H2O +
6CO2; (6)
KH2PO4 + 2NaHCO3 = K2HPO4 (+2CO2) + Na2HPO4 + 2H2O; (7)
Из двух щелочных фосфатов, образующихся по данной реакции, наиболее
нежелателен для технологии пива вторичный фосфат натрия [3].
Благоприятное влияние на активную кислотность среды оказывают сульфаты и
хлориды кальция и магния по уравнению:
К2НРО4 +3CaSО4→
Са3(РО4)2 + 2КН2РО4 +3К2SО4; (8)
Снижение естественной кислотности (повышение рН) заторов, сладкого сусла
и сусла охмеленного с точки зрения технологического процесса всегда
отрицательно. Это отражается в затруднительном осахаривании заторов, медленной
фильтрации сусла, которое при этом недостаточно прозрачно, в более темных
заторах и сусле и менее интенсивном выделении бруха при кипячении сусла с
хмелем, а иногда и в снижении выхода экстракта [9].
Снижение рН под влиянием ионов Са2+ и Мg2+ проявляется в готовом пиве, в
то время как декарбонизацией воды снижается только рН сусла. С точки зрения
щелочности вода для приготовления пива тем лучше, чем ниже щелочность по
метиловому оранжевому и одновременно выше содержание Са2+ [9].
На основании сведений об отрицательном действии на рН среды ионов
гидрокарбоната и положительном - ионов кальция и магния установили показатель -
остаточная щелочность [3].
Остаточная щелочность 3,57 мг-экв/л=10°Н повышает рН готового сусла
приблизительно на 0,3 по сравнению с дистиллированной водой. Для производства
светлых сортов пива хорошо подходят воды, остаточная щелочность которых не
превышает 0,357 мг-экв/л=1°Н. При такой низкой остаточной щелочности, которая
получилась в приведенном примере, можно предположить, что рН сусла из этой воды
приблизительно такой же, как при использовании дистиллированной воды [9].
Минимальный уровень Ca2+ в воде составляет 50 мг/л для многих сортов
пива. Более низкое содержание Ca2+ в воде для пивоварения, но не ниже 20 мг/л,
подходит для производства лагерного пива с низовым брожением с последующим
брожением при низкой температуре, доля которого в производстве пива составляет
80%. Ячмень обычно содержит достаточное количество кальция, и нет необходимости
добавлять его дополнительно. Содержание Mg2+ порядка 10-20 мг/л является
безопасным для большинства сортов пива. Поддержание соотношения Mg2+ : Са2+ на
уровне > 1,8 улучшает рост дрожжей и брожение [21].
Вода для пивоварения должна иметь качество питьевой воды. Очень мягкая
вода с низким содержанием солей и низкой остаточной щелочностью идеально
подходит для изготовления пива типа плзенского. Для него рекомендуется вода с
остаточной щелочностью <5 °dH, предпочтительно 1-2 °dH. Необходим постоянный
контроль качества воды для пивоварения [17].
Данные о влиянии ионов воды на технологические процессы солодовенного и
пивоваренного производств и качество готового продукта позволили нормировать
показатели воды, дополняющие требования стандарта [3].
1.4 Способы обработки воды
Зачастую качество воды нуждается в улучшении. При этом следует
определиться с тем, что именно требует улучшения или изменения - цель
определяет способ водоподготовки [5].
Чтобы иметь возможность использовать для производства светлого
качественного пива и жесткую воду, ее либо декарбонизируют, либо по мере
необходимости проводят обессоливание [10].
Предлагаются следующие методы обработки воды для производственных нужд:
нейтрализация кислотами; внесение сульфата и хлорида кальция; кондиционирование
реагентным или ионообменным способом, методами электродиализа и обратного
осмоса [3].
Нейтрализация гидрокарбонатов серной, соляной, фосфорной или молочной
кислотами - самый простой способ устранения щелочности воды. Применение серной
и соляной кислоты возможно, только если в воде присутствует незначительное
количество сульфатов или хлоридов, а применение молочной кислоты - при
содержании в воде небольшого количества гидрокарбонатов натрия, так как,
образующиеся при этом, лактаты имеют щелочной характер. Фосфорная кислота
непригодна, если в воде накапливаются буферные соли в количестве,
препятствующем изменению рН среды. Главный недостаток способа нейтрализации
воды кислотами - образование свободного диоксида углерода, который вызывает
коррозию оборудования [3].
Внесение в воду сульфата или хлорида кальция - метод, которым можно
понижать рН сусла и пива, но при этом ионы кальция вместе с фосфатами выпадая в
осадок, снижают буферность сусла, что влечет за собой более значительный сдвиг
рН в кислую сторону при брожении [3].
Реагентные способы умягчения применяют редко; они основываются на
переводе растворенных в воде солей кальция и магния с помощью химических
реагентов в нерастворимые соединения с последующим отделением их отстаиванием и
фильтрованием. Из реагентных методов в пивоваренном производстве применяют
декарбонизационный (известковый) и декарбонизационно-карбонатный
(известково-содовый). Цель декарбонизации воды - снизить некарбонатную
жесткость и щелочность воды путем добавления гидроксида кальция (извести).
Основной недостаток реагентных способов умягчения - невозможность удалить из
воды гидрокарбонаты натрия, являющиеся наиболее вредной солью для пивоваренного
производства [3].
Проведены исследования по очистке и умягчению питьевой воды
активированным бентонитом для использования ее в пищевой промышленности и
ликероводочном производстве. Сущность способа заключается в обработке воды
20%-ной водной суспензией активированного бентонита, взятого в количестве 1-2
г/л, с последующим перемешиванием в течение 1,0-1,5 ч и отстаиванием 8-10 ч.
Бентонит активировали 5%-ным раствором поваренной соли [20].
Ионообменный способ обработки воды основан наприменении ионитов. Иониты -
материалы, обладающие свойствами обменивать входящие в их состав ионы на ионы,
присутствующие в растворе [3].
Применяемые в настоящее время иониты изготавливаются из так называемых
гель-смол, матрица которых представляет собой образованный с помощью валентных
связей и сил связи решетки каркас, состоящий из нерегулярных высокомолекулярных
углеводородов, образующих объемную сеть. Свойства ионитов зависят от величины
этих молекул, от числа поперечных связей от количества и вида функциональных
групп, которые могут иметь положительный или отрицательный избыточный заряд,
нейтрализующийся ионами противоположного знака [10].
Катиониты имеют матрицу из полимерных смол на основе акрила или стирола.
В зависимости от диссоциации функциональных групп могут быть «слабокислыми» или
«сильнокислыми». Первые способны обменивать преимущественно ионы кальция и
магния, входящие в состав гидрокарбонатов, на ионы водорода, и поэтому их можно
использовать для простой декарбонизации воды. Сильнокислые иониты, наоборот,
обменивают ионы Са2+, Mg2+ и Na+, входящие в состав гидрокарбонатов, а также
сульфатов, хлоридов и нитратов (то есть входящие в состав солей сильных кислот)
на ионы Н+ [10].
Аниониты имеют матрицу из эпоксидных конденсационных и других смол со
«слабоосновной» или «сильноосновной» реакцией. Первые обменивают анионы сильных
кислот (SO42-, Cl-, NO3-)
на гидроксильные или хлорид-ионы, а сильноосновные аниониты способны связывать
также анионы очень слабых кислот, например, угольной или кремниевой [10].
Процесс обмена обратим. Использованный ионит может регенерироваться
раствором, содержащим соответствующие ионы: катионит - соляной кислотой, а
анионит, в зависимости оттого, кaкoй ион участвовал в обмене (ОН- ,Cl-), - едким натром или поваренной
солью. Эти реагенты применяются для регенерации обычно в виде 3-8 %-ного
раствора [10].
Реакция в ионообменнике проходит следующим образом:
Слабокислый обмен:
A<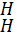
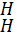 +
Ca(HCO3)2→A<Ca + 2CO2 + 2H2O; (9)
+
Ca(HCO3)2→A<Ca + 2CO2 + 2H2O; (9)
Сходные
реакции имеют место и в случае гидрокарбоната магния. Ионы кальция и магния,
входящие в состав гидрокарбонатов почти полностью обмениваются на ионы
водорода. Катионы, обусловливающие некарбонатную жесткость, сохраняются, и по
этой причине декарбонизация достигает своего предела, если остаточная магниевая
жесткость выше 5 °dН. Выделившийся СО2 агрессивен, него необходимо удалять
[10].
Сильнокислый
обмен:
<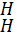
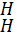 +
CaSO4→A<Ca+H2SO4; (10)
+
CaSO4→A<Ca+H2SO4; (10)
В
данном случае удаляются ионы натрия гидрокарбонатной жесткости. Также реагируют
MgSO4, CaCl2, MgCl2, NaCl, Na2S04, NaNO3 и т. д. В качестве продуктов обмена
образуются свободные неорганические кислоты, которые необходимо нейтрализовать.
Для этого применяют либо смешивание с необработанной водой, которое возможно
только при некарбонатной жесткости менее 5 °dН (для поддержания магниевой
жесткости чистой воды на низком уровне), либо нейтрализацию насыщенной известковой
водой. При этом все некарбонаты переходят в форму кальциевых солей, но
некарбонатная жесткость полностью сохраняется. Таким способом декарбонизируют
воду, некарбонатная жесткость которой составляет 12-15 °dН [10].
Анионный
обмен:
Таким
образом, можно осуществить практически полное обессоливание воды, но для
обработки пивоваренной воды этого не только не требуется, но и нежелательно.
Необходимая жесткость может быть достигнута путем смешивания с необработанной
водой [10].
Ионит
должен быть совершенно нерастворим и не отдавать воде никаких веществ с запахом
и вкусом [10].
Ионообменными
методами не всегда удается получить воду с составом солей, оптимальным для
производства пива. В таких случаях предлагается обрабатывать воду методом
электродиализа, перспективен также метод обратного осмоса [3].
Метод
электродиализа - это обессоливание воды посредством разделения положительных и
отрицательных ионов с помощью ионтовых мембран. Данные мембраны при прохождении
постоянного электрического тока пропускают ионы из обрабатываемого раствора,
находящегося по одну сторону мембран, к концентрированному раствору,
располагающемуся по другую сторону их [3].
Метод
обратного осмоса. При обессоливании воды этим методом жидкость нагнетают через
полупроницаемые мембраны; они пропускают растворитель (воду), но задерживают
растворенные вещества (гидратированные ионы солей и молекулы органических
соединений) [3].
Подготовка
пивоваренной воды требует комбинации эффективных способов, чтобы добиться
соответствующих параметров воды в пределах установленных граничных значений в
правильном соотношении. При большом количестве корректируемых параметров
обратный осмос является подходящим способом для достижения постоянного качества
пивоваренной воды. Благодаря этому чисто механическому способу отпадает
необходимость в использовании химических веществ и трудоемкой работы по
контролю и техническому обслуживанию. Большинство производственных процессов в
пивоварении протекают автоматически, а подготовка пивоваренной воды до сих пор
связано со значительными расходами на контроль и техническое обслуживание.
Современные способы подготовки (обратный осмос) все больше заменяют
классические способы, которые требуют регенерации и ионообменников.
Автоматизация подготовки пивоваренной воды является важнейшей составляющей
постоянного качества, уменьшает долю ручного труда и загрязненность сточных вод
[19].
Изложены
способы предотвращения загрязнения мембран в том числе путем дозирования в
поток исходной воды ингибитора осадкообразования. Показана необходимость
удаления из воды микрофлоры в зависимости от степени микробиального
загрязнения, а также самообработки мембранной установки [18].
Современные
системы водоподготовки строятся по принципу создания основного блока, благодаря
которому осуществляется регулирование состава технологической воды, и блоков
предварительной подготовки воды, обеспечивающих эффективную работу основного
блока, в состав которого могут входить фильтры: многослойные для
обезжелезивания, для удаления органических загрязнений, карбоновые и
фильтры-умягчители [18].
1.5 Основы процесса
затирания
Затирание - смешивание дробленых зернопродуктов в
определенной пропорции с теплой водой и последующее контролируемое нагревание
полученной смеси. В процессе затирания под действием накопленных при
солодоращении ферментов осуществляется осахаривание крахмалистых веществ
солода, сопровождающееся их переводом из нерастворимой формы в растворимую, и экстрагирование
растворимых веществ. Помимо осахаривания при затирании протекают и другие
ферментативные процессы, например распад белков [1].
В процессе затирания осуществляется ферментативный
гидролиз крахмала, белков солода и несоложенных материалов в сбраживаемые и
несбраживаемые сахара и аминокислоты [1].
При этом основной технологической задачей затирания
является получение наибольшего количества экстракта. В связи с этим при
затирании необходимо обеспечить оптимальные гидродинамические и тепловые условия
для интенсификации ферментативных процессов и массообмена [1].
При затирании зернопродуктов осуществляются следующие
процессы и явления:
· перевод образовавшихся растворимых
веществ солода в раствор;
· ферментативный гидролиз некоторых
веществ солода;
· химические взаимодействия между
компонентами сусла;
· инактивация ферментов;
· снижение величины pH преимущественно в результате
взаимодействия ионов Ca2+ c некоторыми компонентами солода,
например с фосфатами.
Солод является не только основным сырьем для получения
экстрактивных веществ, но и источником ферментов, благодаря которым при
затирании осуществляются биохимические процессы, среди которых можно выделить
три основные реакции:
· ферментативный гидролиз крахмала и
полисахаридов;
· ферментативный гидролиз
гумми-веществ, таких как β-глюканы и пентозаны;
· ферментативный гидролиз белков и
полипептидов[1].
В практике при затирании следует выбирать такой
процесс, при котором продукты расщепления крахмала и белка, образующие главную
долю растворимого экстракта, имели бы состав, качественно отвечающий характеру
изготавливаемого пива. Одновременно нужно обеспечивать более высокий выход
экстракта из перерабатываемого сырья [9].
Качественный состав экстракта сусла зависит от состава
применяемой засыпи. Прямое влияние имеет также химический состав используемой
на затирание воды и технологический процесс при затирании [9].
Состав засыпи изменяется в зависимости от
изготавливаемого типа пива и иногда от особых требований к его вкусу, цвету,
пенистости и стойкости. Наряду с чисто солодовым пивом часто изготавливают пиво
из смеси солода с заменителями. Чем больше активных ферментов содержит солод и
чем лучше он растворен, тем легче протекает гидролитическое расцепление при
затирании [9].
Например, установлено, что при одинаковых условиях
затирания сусло, полученное из пшеничного солода, имело более высокую
экстрактивность, но при этом содержало меньшее количество редуцирующих веществ
по сравнению с ячменным. На экстрактивность и на количество редуцирующих
веществ в значительной степени влияла начальная температура затирания. Для
засыпи с использованием пшеничного солода оказалась благоприятна более низкая
начальная температура затирания. При этом слишком длительные паузы во время
затирания приводили к снижению экстрактивности. Но при использовании пшеничного
солода увеличение длительности пауз приводило к увеличению доли редуцирующих
сахаров. Для получения пшеничного сусла с максимальной экстрактивностью и
максимальным количеством редуцирующих веществ оптимальным оказался отварочный
метод, при этом может использоваться режим с короткими паузами [15].
Наиболее важную роль при затирании играют амилазы и
протеазы, причем для каждого из ферментов существуют оптимальные температура и pH, при которых проявляется его
максимальная каталитическая активность [1].
Таблица 6 - Свойства основных гидролитических
ферментов солода
|
Фермент
|
Субстрат
|
Продукт гидролиза или
эффект
|
Оптимальная температура, ºC
|
Оптимальное значение pH
|
|
1
|
2
|
3
|
4
|
5
|
|
Протеазы
|
Белки
|
Аминокислоты, пептиды,
пептоны,
|
50-52
|
5,5
|
|
β-Амилаза
|
Амилоза(a-1,4-связи)
|
Мальтоза
|
60-65
|
5,4-5,6
|
|
a-Амилаза
|
Крахмал(все связи)
|
Высокомолекулярные
декстрины, амилоза
|
72-75
|
5,6-5,8
|
|
β-Глюканаза
|
β-глюкан(гумми вещества)
|
Снижает вязкости сусла
|
56
|
6,0
|
Расщепление крахмала совершается в три этапа,
последовательно переходий один в другой. Очередность их неизменна:
· клейстеризация;
· разжижение;
· осахаривание.
Клейстеризация
Под клейстеризацией понимают набухание и разрыв
оболочки зерен крахмала в теплом водном растворе. Освободившиеся молекулы
крахмала в этом вязком растворе лучше подвергаются действию амилаз, чем
неклейстиризованный крахмал [5].
Крахмал солода и ячменя клейстеризуется в присутствии
амилаз при 60°С [5].
Разжижение
Длинные цепочки крахмала, состоящие из глюкозных
остатков (амилоза и амилопектин), очень быстро разрываются α-амилазой на короткие цепочки [5].
Поэтому очень быстро уменьшается вязкость
клейстеризованного затора, ß-амилаза способна расщеплять длинные
цепочки лишь от нередуцированных концов, так что самостоятельное расщепление
этим ферментом длилось бы сутками [5].
Под разжижением понимают снижение вязкости
клейстеризованного крахмала α-амилазой [5].
Осахаривание
Под осахариванием мы понимаем полное расщепление
разжиженного крахмала амилазами на мальтозу и декстрины [5].
α-амилаза разрывает цепочки амилазы и
амилопектина главным образом на декстрины с 7-12 глюкозными остатками. От
концевых групп образовавшихся цепочек ß-амилаза отщепляет двойные группы
(мальтозу). Данная реакция неприменно длится гораздо дольше, чем разрушение
более длинных цепочек α-амилазой [5].
Из-за различной длины молекул помимо мальтозы
образуются и другие сахара, глюкоза и мальтотриоза [5].
Во всех случаях расщепление веществ останавливается на
2-3 глюкозных остатках перед 1,6-соединениями амилопектина, так как эти
1,6-соединения не могут быть расщеплены ни α-, ни ß-амилазой. Эти предельные декстрины
всегда содержатся в нормальном сусле [5].
Светлый солод по сравнению с темным содержит большее
количество ферментов осаханивания притом более деятельных. В сусле из светлого
- солода образуется больше сахара и меньше декcтринов. В заторах из светлого
солода осахаривание идет быстро, в таких заторах обеспечивается высокое
сбраживание. Осахаривание сусла из темных солодов ведут медленнее и осторожнее
[11].
В зависимости от температуры и времени осахаривания
превращение крахмала в сахар протекает быстрее или медленнее, а также
изменяется отношение мальтозы к декcтрину, т.е. легкосбраживаемой части к
трудно сбраживаемой. Поэтому свойство изготовляемого сусла зависит от
температуры осахаривания [12].
Температуры между 56 и 70ºC
называются температурой
осахаривания; при этой температуре образуется наибольшее количество сахара и
наименьшее количество декстрина. При 64 ºC и выше образуется больше декcтрина
[12].
Продолжительность осахаривания затора из светлого или
сильно пророшенного солода при нормальных условиях составляет приблизительно 15
мин, из темного солода - до 25 мин и более. Затор из плохо разрыхленного и
слабо пророшенного солода осахаривается значительно дольше [11].
Окончание осахаривания обычно определяют по следующим
признакам:
) белый густой затор превращается в жидкость
тёмного цвета;
) изменяется цвет йода в заторе, т.е. проводят
классическую пробу йодом.
В начальный период затирания йод окрашивает
содержащийся в заторе крахмал - а его там достаточно - в темно-синий цвет. В
дальнейшем присутствие крахмала в заторе снижается, и реакция на йод становится
красной. Когда же осахаривание завершилось, йод с крахмалом не реагирует и цвет
не меняет [11].
Образующиеся при затирании продукты расщепления
крахмала существенно отличаются по сбраживаемости пивными дрожжами.
Таблица 7 − Продукты гидролиза крахмала
|
Декстрины
|
не сбраживаются;
|
|
Мальтотриоза
|
сбраживается всеми сильно
сбраживающими штаммами дрожжей, но мальтотриоза расщепляется дрожжами лишь
тогда, когда сброжена мальтоза, а именно при дображивании (сахар
дображивания);
|
|
Мальтоза
|
и другие дисахариды
сбраживаются дрожжами хорошо и быстро (сахар главного брожения);
|
|
Глюкоза
|
подвергается действию дрожжей
в первую очередь (сахар забраживания).
|
Расщепление ß-глюкана
Известно, что стенки клеток ячменного зерна состоят из
прочного переплетения белковых веществ, целлюлозы и гемицеллюлозы, пронизанного
цепочками ß-глюкана. Высокомолекулярный ß-глюкан при определенных условиях
склонен к гелеобразованию, а значит, к повышению вязкости пива и с ним - к
затрудненному фильтрованию [5].
Вязкость сусла контролируют как параметр, указывающий
на содержание ß-глюкана и на ожидаемые затруднения при фильтровании затора и
пива [5].
Разработаны методы, позволяющие идентифицировать
блокировку фильтров и отложения напрямую в фильтрующей среде. Они являются
вспомогательным средством для предсказания фильтруемости и определения
препятствующих фильтрованию веществ, а также позволяют изучать взаимодействие с
фильтрующими материалами за тем, чтобы сделать прямой вывод о связи между
веществами, содержащимися в пиве, и ожидаемой фильтруемостью. Для полной
идентификации веществ, блокирующих фильтрование, целесообразно расширять методы
оценки каркасных веществ, прежде всего β-глюкана и изучать специфические
механизмы отложения на и внутри исследуемых фильтрующих сред. Это позволило
сделать точный прогноз о проблемах фильтрации, организовывать процесс и
своевременно реагировать на фильтруемость пива [14].
Расщепление белковых веществ
Все (высокомолекулярные) протеины за некоторым
исключением выпадают в осадок самое позднее на этапе кипячения сусла. Поэтому в
пиве оказываются только продукты расщепления, которые необходимы для роста
дрожжей и сбраживания сахаров[5].
Ферментативное расщепление белковых веществ должно
разделить на следующие стадии:
· при 45-50°С в большей степени
образуются низкомолекулярные продукты расщепления, особенно пептиды и
аминокислоты;
· при 60-70°С в большей степени
образуются высокомолекулярные продукты расщепления, которые считаются
обеспечивающими пеностойкость.
Аминокислоты играют огромную роль в питании дрожжей
[5].
Из хорошо растворенного солода всегда получается
сусло, с большим количеством α-аминокислот. Естественно, при
добавлении несоложенного сырья, сахара или сиропа, содержание в сусле
аминокислот не прибавляется, и поэтому следует проводить аминокислотную паузу
при 45-50°С. Но, с применением хорошо растворенного солода, потребность
выдержки паузы при 45-50°С для образования низкомолекулярных продуктов
пропадает [5].
Продолжительная пауза при 45-50°С всегда дает в
последующем плохую пену [5].
Ферментативное расщепление при затирании должно
происходить глубоко, однако излишнее расщепление приносит больше вреда, чем
пользы. Это относится в первую очередь к белкам, избыток которых снижает
стойкость пива. Стойкость коллоидных веществ (продуктов расщепления белков,
декcтринов и т. д.) в практике определяется по прозрачности сусла при
фильтрации. По существующим данным отрицательное влияние имеет также слишком
большая аэрация сусла (охмеленного), которая повышает цвет и ухудшает вкус пива
[9].
Температура не только влияет на скорость
ферментативных реакций, но и на образующееся при этом соотношение продуктов
гидролиза крахмала, что объясняется изменением каталитических способностей
ферментов в различных тепловых условиях, поскольку они отличаются как
температурным оптимумом, так и тепловой стойкостью. Таким образом,
установленный тепловой режим затирания позволяет регулировать состав углеводов
в пивном сусле [1].
Роль рН при затирании также определяется его влияние
на скорость ферментативного гидролиза крахмала и зависит, прежде всего, от
состава технологической воды. Оптимальное значение рН в заторе (обычно 5,1-5,2)
обеспечивают добавлением в него молочной кислоты или гипса. Кроме того,
внесением в затор гипса можно регулировать содержание в нем ионов кальция,
недостаток которых в заторе или сусле приводит к образованию в пиве кристаллов
оксалата[1].
Гидродинамические условия в заторном аппарате
способствуют интенсификации тепло- и массообмена в процессе затирания.
Оптимальные гидродинамические условия обеспечивают перемешиванием заторной
массы. Специфической особенностью организации перемешивания затора является то,
что его интенсивность должна быть достаточной для обеспечения однородности
заторной массы и равномерности ее параметров (концентраций, рН и температур) во
всем объеме, но в то же время не слишком высокой, чтобы:
· во-первых, обеспечить невысокие
значения напряжений сдвига в заторной массе, которые способствуют переходу в
раствор высокомолекулярного β-глюкана, оказывающего негативное
влияние на последующую обработку технологических сред;
· во-вторых, уменьшить количество
захватываемого затором кислорода для минимизации окислительных процессов в
технологических средах, оказывающих негативное влияние на качественные
показатели сусла и пива.
Современные заторные аппараты оснащают перемешивающими
устройствами с приводами, имеющими частотные регуляторы, что позволяет разные
этапы затирания осуществлять в различных, наиболее благоприятных
гидродинамических режимах[1].
2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Изучение влияния качества воды и условий технологического процесса на
экстрактивность пивного сусла.
Объекты исследования: пивное сусло неохмеленное, неосветленное, сваренное
на солоде пилзенского типа.
Методы исследования:
Определение значений активной кислотности (pH) проводилось в соответствии с требованиями ГОСТ Р 53070-2008
«Пиво. Метод определения рН».
Определение содержания экстракта в сусле проводилось в соответствии с
требованиями ГОСТ 12787-81 «Пиво. Методы определения спирта, действительного
экстракта и расчет сухих веществ в начальном сусле».
Определение содержания редуцирующих сахаров в сусле методом, основанным
на окислении альдоз йодом.
2.1 Методика постановки эксперимента
Для установления зависимости экстрактивности начального сусла от качества
воды и условий технологического процесса было проведено три эксперимента. Во
всех трех экспериментах сусла варились с применением солода сорта Пилзнер
(Pilsner). В первом опыте изучалось влияние химического состава воды и способа
ее обработки на экстрактивность начального сусла и количество редуцирующих
сахаров. Во втором эксперименте изучалось влияние гидродинамических условии
проведения процесса на качество начального сусла и количество в нем
редуцирующих сахаров. В третьем эксперименте изучалось влияние
продолжительности затирания на качественные показатели сусла.
В процессе проведения 1-го эксперимента была сварена серия лабораторных
сусел на воде различного качества. Для этого использовалась водопроводная,
талая, дистиллированная, питьевая вода торговой марки «Аэро», а так же вода,
подвергнутая ионообменному способу очистки, профильтрованная через катионит или
анионит. Для каждой воды была определена карбонатная (временная) жесткость.
Для установления влияния качества воды сусла варились в одинаковых
технологических условиях, затем у каждого из них измерялись показатель активной
кислотности (pH), экстрактивность, количество редуцирующих сахаров. На
основании полученных данных, была выбрана вода, чьи показатели были наилучшими.
Дальнейшие эксперименты проводились с этой водой.
В ходе 2-го эксперимента было изучено влияние гидродинамических условии
проведения процесса, а именно, зависимость качества начального сусла от
интенсивности перемешивания затора. Проводились варки сусла с перемешиванием на
различных этапах. Так же были сварены сусла без перемешивания в ходе всего
процесса, так и с постоянным перемешиванием.
В процессе проведения 3-го эксперимента исследовалось влияние
продолжительности затирания на качественные показатели сусла. Варились сусла с
различным временем мальтозной паузы: в первом сусле она составляла 5 минут, в
последнем - 25 минут, затем у каждого из них измерялись показатель активной
кислотности (pH), экстрактивность, количество редуцирующих сахаров.
Таким образом, в ходе всех трех экспериментов было выявлено влияние
различных факторов на качество начального сусла.
.
Результаты и их обсуждение
.1 Результаты эксперимента №1
В таблице 8 приведены результаты определения временной жесткости воды, а
так же показатели сусла, сваренного на воде различного качества.
Таблица 8 - Показатели жесткости воды и показатели качества сусла
|
Наименование воды
|
Показатель временной
жесткости, моль/экв Ca2+ и Mg2+
|
Показатели сусла
|
|
|
pH
|
Экстрактивность, %
|
Количество редуцирующих
сахаров (по мальтозе), мг/100 мл
|
|
1
|
2
|
3
|
4
|
5
|
|
Водопроводная
|
3,5
|
6,820
|
7,164
|
17,6
|
|
Талая
|
0,5
|
6,551
|
7,189
|
17,6
|
|
Дистиллированная
|
0,1
|
6,378
|
7,214
|
20,52
|
|
«Аэро»
|
1,0
|
6,405
|
7,140
|
17,1
|
|
Профильтрованная через
катионит
|
0,1
|
5,438
|
8,146
|
27,36
|
|
Профильтрованная через
анионит
|
1,0
|
4,898
|
6,770
|
8,55
|
Необходимо отметить, что все из вод удовлетворяют требованиям, указанным
в технологической инструкции по водоподготовке для производства пива и
безалкогольных напитков.
3.2 Результаты эксперимента №2
В таблице 9 приведены показатели сусла, сваренного в различных
технологических условиях.
Таблица 9 − Влияние перемешивания на показатели качества сусла
|
Технологические условия
процесса затирания
|
Показатели сусла
|
|
pH
|
Экстрактивность, %
|
Количество редуцирующих
сахаров (по мальтозе), мг/100 мл
|
|
1
|
2
|
3
|
4
|
|
Перемешивание на всех
стадиях
|
5,725
|
7,509
|
27,36
|
|
Без перемешивания
|
5,960
|
3,421
|
17,1
|
|
Перемешивание на мальтозной
паузе
|
5,852
|
6,473
|
20,52
|
|
Перемешивание на белковой и
мальтозной паузах
|
5,352
|
9,751
|
34,2
|
|
Перемешивание на мальтозной
паузе и осахаривании
|
5,438
|
8,146
|
27,36
|
По данным таблицы 9 видно, что прямой зависимости между интенсивностью
перемешивания и содержанием экстракта в сусле нет. Можно лишь сказать, что
перемешивание оказывает положительное влияние во время действия β−амилазы и отрицательное при действии α−амилазы.
3.3 Результаты эксперимента №3
В ходе эксперимента сусло варилось в одинаковых условиях, но с различной
продолжительностью затирания. В таблице 10 приведены показатели сусла,
сваренного с различной продолжительностью мальтозной паузы.
Таблица 10 − Влияние продолжительности затирания на показатели
качества сусла
|
Продолжительность
мальтозной паузы, мин
|
Показатели сусла
|
|
pH
|
Экстрактивность, %
|
Количество редуцирующих
сахаров (по мальтозе), мг/100 мл
|
|
1
|
2
|
3
|
4
|
|
5
|
5,803
|
6,745
|
17,1
|
|
10
|
5,709
|
7,140
|
20,52
|
|
15
|
5,438
|
8,146
|
34,20
|
|
20
|
5,424
|
8,195
|
34,20
|
|
25
|
5,409
|
8,293
|
27,56
|
По данным таблицы 10 видно, что с увеличением времени мальтозной паузы
увеличивается экстрактивность пивного сусла. Однако, количество
восстанавливающих сахаров не изменяется. Оптимальная продолжительность
мальтозной паузы для данного вида солода - 15 минут, далее экстрактивность
пивного сусла и содержание редуцирующих сахаров возрастает незначительно.
3.4 Обсуждение результатов исследований
Качество воды является одним из основных факторов, определяющих качество
пива, в том числе и такой важный параметр как экстрактивность пивного сусла. Важную
роль в процессе затирания играют минеральные вещества, содержащиеся в воде. Они
оказывают влияние, как на вкус готового напитка, так и на действие различных
ферментов в ходе приготовления пива.
Положительное влияние на экстрактивность пивного сусла оказывают ионы Ca2+ и Mg 2+. Они обладают способностью снижать pH, сдвигая его в
кислую сторону. Это благоприятно сказывается на активности ферментов, так как
их оптимум pH лежит в слабокислой области. Кроме способности положительно
влиять на pH сусла, ионы Ca2+ и
Mg2+ являются кофакторами амилаз и
протеаз солода, тем самым регулируя их активность. Однако карбонаты и
гидрокарбонаты этих и других ионов повышают pH и оказывают отрицательное
влияние на качество сусла. Для оценки влияния карбонатов и гидрокарбонатов было
введено понятие «временной жесткости». Все эти факторы следует учитывать при
подборе метода обработки воды для пивоваренного производства.
Крупные пивоваренные заводы, имеющие длительную историю, обладают
собственными источниками качественной воды, например, артезианские скважины. В
последние годы в пивоваренной отрасли наметилась тенденция расширения числа
малых предприятии и создание пивоварен малой производительности, типичным
примером является ОАО "Ивановская пивоварня". Для таких предприятий одной
из актуальных проблем является водоподготовка, так как использование
водопроводной воды для производства пива является нежелательным из-за высокого
содержания железа и, использования хлорсодержащих соединении для её
дезинфекции. Исходя из вышеизложенного, целью настоящей работы является
исследование влияния предварительной обработки воды на качество пивного сусла.
Существует несколько методов водоподготовки, используемых в пищевой
промышленности. Несомненно, самым затратным является дистилляция, особенно на
фоне растущих цен на энергоносители. Наиболее перспективными, с технологической
точки зрения, является применение для обработки воды с применением
специфических сорбентов, таких как катиониты и аниониты. Данные сорбенты могут
не только удалять минеральные примеси из воды, но и менять рН воды, что крайне
важно, так как процесс получения пивного сусла относится к ферментативным и
крайне чувствителен к малейшим изменение рН воды. При обработке воды
фильтрацией через катионит происходит «замена» ионов Ca2+ и Mg2+,
входящих в состав гидрокарбонатов и карбонатов, и как следствие, снижение
временной жесткости, выделяющаяся при этом углекислота обуславливает смещение pH воды в кислую область. Основным
показателем качества воды является временная жёсткость и рН.
В ходе экспериментов было исследовано 6 типов воды: дистиллированная,
питьевая «Аэро», водопроводная, талая, обработанная катионитом и обработанная
анионитом. Анализируя результаты, полученные в ходе эксперимента №1 можно
сделать вывод, что чем выше показатель временной жесткости, тем выше pH сусла,
что отрицательно сказывается на его экстрактивности и содержании редуцирующих
сахаров. Это объясняется отрицательным влиянием карбонатов и гидрокарбонатов.
Как оказалось, что по показателю временной жёсткости вода дистиллированная и
профильтрованная через катионит являются одинаковыми, в то время как с
экономической точки зрения обработка воды катионитом является более
целесообразной. Кроме того показатель кислотности воды обработанной катионитом
составляет 5,438, что является оптимумом как для протеолитических (белковая
пауза), так и амилолитических (гидролиз полисахаридов) ферментов. Данный факт
непосредственным образом сказался на экстрактивности пивного сусла, которое в
случае водоподготовки с использованием катионита, была наибольшей. При
длительной обработке воды фильтрацией через анионит можно достичь практически
полного обессоливания, что крайне нежелательно для процессов пивоварения.
Именно низким содержанием солей можно объяснить получение наихудших показателей
сусла, полученного с применением воды, прошедшей фильтрацию через анионит. К
этому следует добавить, что в данном сусле процесс осахаривания не прошел до
конца. Даже при длительной выдержке затора йодная проба давала синее
окрашивание. Несмотря, на то, что вода, профильтрованная через анионит,
обладает жёсткостью в 4 раза меньше по сравнению с водопроводной, и оптимальным
рН (≈5,000), экстрактивность пивного сусла в этом случае получилась
минимальной и даже существенно ниже по сравнению с водопроводной.
Воды талая, дистиллированная, питьевая оказались близкими по показателю
экстрактивности, что позволяет сделать вывод, что их применение не даёт ни
каких преимуществ по сравнению с самой дешёвой водопроводной водой.
Вторым важным показателем, определяющим качество сусла, является
количество редуцирующих сахаров, которое оказалось максимальным при применении
воды обработанной с применением анионита. Неожиданным оказался тот факт, что
вода прошедшая обработку катионитом, является более хорошим сырьём по сравнению
с дистиллированной водой.
На рисунках 1 и 2 приведены графики зависимости значений экстрактивности
и количества восстанавливающих сахаров от временной жесткости. На рисунке 3
показана зависимость pH сусла от временной жесткости.
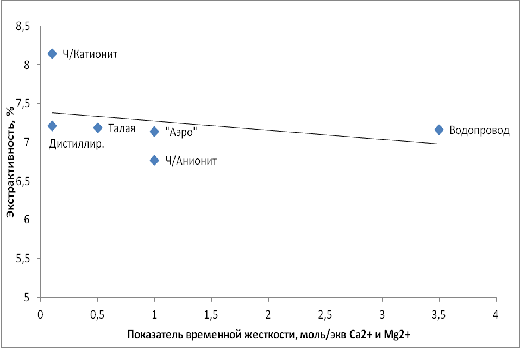
Рис.1− Зависимость значений экстрактивности сусла от временной
жесткости
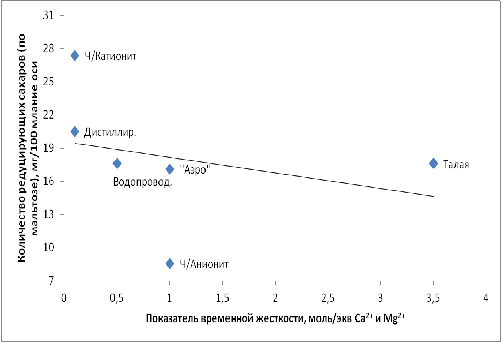
Рис.2 − Зависимость количество восстанавливающих сахаров от
временной жесткости
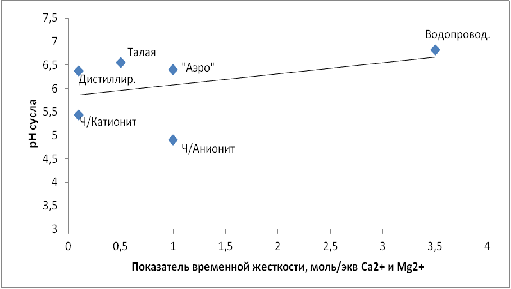
Рис.3 − График зависимости pH сусла от временной жесткости
Временная жёсткость является одним из определяющих факторов, который
обуславливает качество пивного сусла. Это следует из графиков 1, 2, 3. Так,
экстрактивность сусла в случае водопроводной воды, которая является наиболее
жёсткой, существенно ниже, по сравнению с водой с низкой жёсткостью, за
исключением воды обработанной катионитом. Такая же зависимость наблюдается по
количеству редуцирующих сахаров. Обращает на себя внимание тот факт, что
зависимости являются практически линейными, за исключением того, что вода
обработанная катионитом в них не укладывается. Из рисунка 3 следует, что рН
воды, обработанной катионитом, является оптимальным для работы амилолитических
ферментов солода.
Качество пивного сусла во многом зависит от технологии его получения. На
него оказывает влияние, как степень измельчения солода, так и технологические
режимы пауз. Оптимальные гидродинамические условия обеспечивают равномерным
перемешиванием заторной массы. Главной особенностью организации перемешивания
затора является то, что его интенсивность должна быть достаточной, что бы
обеспечить однородность заторной массы и равномерности ее параметров
(концентраций, рН и температур) во всем объеме, но в то же время не слишком
высокой.
Силы сдвига, возникающие при перемешивании, способствуют разрушению
комков. Для минимизации захвата кислорода и предотвращения неблагоприятного
изменения структуры частичек мешалка должна обеспечивать равномерное перемешивание
заторной массы. Нами было изучено влияние режима перемешивания на
экстрактивность пивного сусла.
По результатам эксперимента №2 можно сделать вывод, что интенсивное
перемешивание заторной массы отрицательно сказывается на качестве сусла. Это можно
объяснить тем, что ферментам сложнее взаимодействовать с субстратом. Так же как
видно из результатов эксперимента отсутствие перемешивания так же негативно
сказывается на выходе экстракта. Это объясняется неравномерностью нагревания и
малой интенсивностью процессов массообмена. Отсутствие перемешивания приводит к
слеживанию материала и затруднению доступа ферментов к субстрату. Максимальный
выход экстракта наблюдается при работе мешалки в начальные периоды затирания,
при протекании белковой и мальтозной пауз. Из полученных данных можно сделать
вывод, что используемая на заводе технология является правильной.
Подбор оптимальных условий перемешивания имеет не только технологическую,
но и экономическую целесообразность. Это заключается в сокращении расхода энергии
на работу мешалки. Современные заторные аппараты модернизированы мешалками
различной формы с частотным регулированием.
Так же в ходе работы было исследовано влияние времени мальтозной паузы на
экстрактивность пивного сусла, с использованием воды, обработанной катионитом.
При выборе оптимальных условий для проведения процесса затирания следует
уделять особое внимание продолжительности пауз. От того сколько по времени
длится та или иная пауза зависит, какие продукты будут преобладать в сусле и
какими свойствами будет обладать конечный продукт. Регулируя продолжительность
затирания можно добиться оптимального соотношения сбраживамых сахаров и
несбраживаемых декстринов.
Наиболее важным составляющим затора является мальтоза. Данный дисахарид
образуется под действием β−амилазы в интервале температур от 60
до 65°. Именно поэтому данный температурный интервал при затирании носит
название «мальтозной паузы». На практике для получения сусла с высокой степенью
сбраживания следует увеличивать выдержку затора при температуре мальтозной
паузы. Однако следует помнить, что с течением времени скорость ферментной
реакции снижается и падает практически до нуля.
При проведении эксперимента №3 главной задачей было добиться получение
сусла с наибольшим выходом экстракта и с наибольшим содержанием в этом сусле
редуцирующих веществ.
На рисунке 4 приведен график зависимости значений экстрактивности пивного
сусла от продолжительности мальтозной паузы.
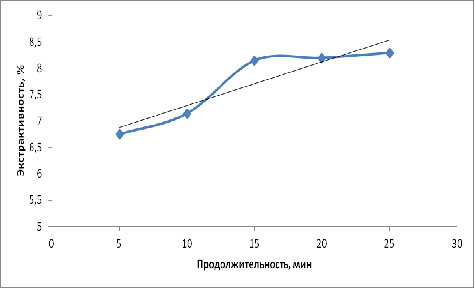
Рис.4 − График зависимости экстрактивности сусла от
продолжительности мальтозной паузы
Из результатов данного эксперимента следует, что с увеличением
продолжительности мальтозной увеличивается экстрактивность сусла и содержание в
нем редуцирующих веществ. Данная тенденция наблюдается до продолжительности
паузы 15 минут, затем экстрактивность сусла с увеличением длительности паузы
повышается незначительно, а содержание редуцирующих сахаров снижается. Это
можно объяснить тем, что с течением времени действие β−амилазы ослабляется и в реакцию
вступает α−амилаза, чей оптимум лежит в более высоком интервале
температур. Продуктом реакции с участием α−амилазы являются высокомолекулярные
декстрины и амилоза, которые не относятся к редуцирующим.
Как показано на рисунке 4, оптимальным временем продолжительности
мальтозной паузы является 15 минут. Именно такое время применяется на
действующем производстве.
Из всего вышеперечисленного следует, что при выборе способа подготовки
воды для пивоваренного производства следует отдать предпочтение катионному
способу умягчения воды. Кроме высоких технологических параметров данный способ
является наиболее экономически выгодным.
С точки зрения технологических условий процесс затирания следует вести с
перемешиванием лишь на начальных стадиях, в ходе белковой и мальтозной стадиях,
при этом мальтозную паузу следует вести не более 15 минут.
При указанном режиме затирания и водоподготовки, наблюдается наибольший
выход экстракта и наибольшее содержание редуцирующих сахаров.
ВЫВОДЫ
1. Исследовано влияние способа обработки воды на качество сусла.
Показано, что оптимальным способом водоподготовки является обработка воды
недорогим и доступным катионитом КУ-1.
. Установлено, что одним из ключевых факторов, влияющих на
качество пивного сусла, является жесткость воды.
. Показано, что продолжительность мальтозной паузы во многом
определяет качество пивного сусла, и ее оптимальная длительность составляет 15
минут.
. При исследовании влияния перемешивания на качество сусла
наилучшие результаты получены при использовании применяемой на предприятии
технологии, т.е. при перемешивании на белковой и мальтозной паузе.
СПИСОК
ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Федоренко Б.Н. Пивоваренная инженерия: технологическое
оборудование отрасли. СПб.: Профессия, 2009. - 1000 с.
. Ермолаева Г. А., Колчева Р.А. Технология и оборудование
производства пива и безалкогольных напитков: учебник для начального
профессионального образования. М.: Академия, 2000. 416 с.
3. Тихомиров
В. Г. Технология пивоваренного и безалкогольного производства. М.: Колос, 1999.
448 с.
4. Осина Г. И. Состояние рынка пива и безалкогольной продукции / Г.
И. Осина // Экономика и экологический менеджмент. 2011. № 1. С. 198-201.
. Кунце В. Технология солода и пива / В. Кунце, Г. Мит. - СПб.:
Профессия, 2001. - 257 c.
. Меледина Т. В. Сырье и вспомогательные материалы в пивоварении /
Т. В. Меледина. - СПб. : Профессия, 2003 - 304 с.
. ГОСТ 29294-92. Солод Пивоваренный ячменный. Технические условия.
Введ. 1993-06-01. М.: Изд-во стандартов, 1993. 19 с.
. СанПиН 2.1.4.1074-01. Питьевая вода. Гигиенические требования к
качеству воды централизованных систем питьевого водоснабжения. Контроль
качества (взамен СанПиН 2.1.4.559-96).
. Главачек Ф. Пивоварение/ Ф. Главачек, А. Лхотский; перевод с
чешского. - М.: Пищевая промышленность, 1977. - 623 с.
. Нарцисс Людвиг. Краткий курс пивоварения / Л. Нарцисс; при
участии В. Бака; пер. с нем. А.А. Куреленкова. - СПб.: Профессия, 2007. - 640
с.
. Смирнова Л. Домашнее пиво и квас/ авт-сост. Любовь Смирнова. −
Минск: Харвест, 2007. − 288 с.
. Дворский Ярослав, Лензе Карл. Катехизис пивоваренной практики -
М: Пивоваренная секция ВАИ, 1928 - 278 с.
13. Brugger M.,
Liane S. F., Paskert P. Neue Perspektiven für Wasserwerke durch
Großfilter aus Edelstahl // bbr : Leitungsbau, Brunnenbau, Geothermie. - 2014. -
65, № 6. - С. 52-57. - Нем.
. Kupetz M., Weber M., Zarnikow M., Becker T. Den
Blockern auf der Spur // Brauindustrie. - 2014. - 99, № 10. - С. 18-21. - Нем.
15. Алябьев Б. А. Зависимость экстрактивности и содержания
редуцирующих веществ сусла от параметров затирания и состава засыпи / Б. А.
Алябьев, М. Ф. Ростовская, Ю. В. Приходько // Пиво и напитки. - 2016. - № 1. -
С. 40-43 . - ISSN 2072-9650
16. Von der Analytik
zur verfahrenstechnischen Lösung / Schmidt Th., Eggers G., Sabo D.,
Lichtblau D. // Getränkeindustrie. - 2013. - 67, № 1. - С. 29-31. - Нем.
17. Jentsch M.
Konstante Beschaffenheit : Brauwasser - das unterschätzte Element //
Brauindustrie. - 2012. - 97, № 12. - С. 34-37.
- Нем.
18. Федоренко В. И. Исправление воды методом обратного осмоса //
Ликероводоч. пр-во и виноделие. - 2010. - № 11. - С. 8-10. - Рус.
19. Eisenhofer A.
Konstante Qualität // Brauindustrie. - 2013. - 98, № 12. - С. 26-29. - Нем.
20. Даудова Т. Н., Ахмедов М. Э., Демирова А. Ф., Даудова Л. А. Новый
способ водоподготовки для производства алкогольных напитков // Пиво и напитки.
- 2014. - № 4. - С. 12-13. - Рус.; рез. англ.
21. Brungard Martin Calcium and magnesium in brewing water
// Zymurgy. - 2015. - 38, № 2. - С. 31-37. - Англ.
22. Просин М. В. Разработка и исследование роторно-пульсационного
экстрактора для интенсификации процесса затирания при производстве пива :
Автореф. дис. на соиск. уч. степ. канд. техн. наук. Кемер. технол. ин-т пищ.
пром-сти, Кемерово, 2014. - 16 с. : ил. - Рус.