Ионика твёрдого тела
Реферат
ионика
твёрдого тела
Содержание
1. Введение
. Ионный обмен
.1 Общие замечания
.2 Ионный обмен в стеклах
.3 Ионный обмен в керамике
.4 Ионный обмен в порошках
.4.1 Изучение ионообменной селективности сурьмяной кислоты
.4.2 Изучение кинетики обмена
.4.3 Особенности ионного обмена в слоистых структурах
.4.4 Получение слоистых кислот
.4.5 Получение электродного материала литий-ионного
аккумулятора
. Ионная проводимость и числа переноса
.1 Общие сведения
.2 Подготовка образцов
.3 Иммиттансная спектроскопия
.4 Четырёхэлектродный (четырёхзондовый) метод
.5 Зависимость импеданса от межэлектродного расстояния
.6 Оценка электронной проводимости поляризационным методом
.7 Метод Тубандта
. Электродные явления в твердоэлектролитных ячейках
.1 Вольтамперные характеристики асимметричных ячеек
.2 Влияние атмосферы на электродный импеданс
. Гальванические элементы
.1 Общие замечания
.2 Гальванические элементы с твёрдыми электролитами
.3 Литиевый аккумулятор
Список рекомендуемой литературы
1. Введение
Ионика твёрдого тела - междисциплинарное направление науки и техники на
стыке электрохимии, материаловедения, неорганической химии, кристаллохимии,
приборостроения и энергетики. Она занимается явлениями переноса ионов в твёрдых
веществах, соответствующими материалами и устройствами на основе этих явлений:
химическими источниками тока, датчиками концентраций, высокоёмкими
конденсаторами, электрохромными индикаторами, ионообменниками и т.д.
2. Ионный обмен
.1 Общие замечания
Метод низкотемпературного ионного обмена в готовой кристаллической
структуре позволяет получать термически неустойчивые соединения (например,
кислоты и соединения аммония со слоистыми или каркасными структурами) и
метастабильные фазы, не образующиеся при прямом высокотемпературном синтезе
(например, литиевый b-глинозём).
Получающиеся вещества могут представлять ценность как твёрдоэлектролитные,
электродные, каталитические, магнитные и др. материалы. Поверхностный ионный
обмен в монокристаллах и стёклах применяется для модификации их свойств. Кроме
того, ионный обмен важен как простейший индикатор подвижности ионов в твёрдой
фазе и как метод разделения ионов. Кристаллические неорганические иониты
интереснее аморфных органических полимеров тем, что имеют большую селективность
(более жёстко сортируют ионы по размеру), более устойчивы к нагреванию и
ионизирующим излучениям.
Контролировать протекание ионного обмена в данной работе будем методом
рентгенофазового анализа (РФА), химическим анализом, по изменению массы при
обмене, по свойствам продукта, по потере массы при прокаливании и по РФА
продукта прокаливания.
2.2 Ионный обмен в стеклах
ионный обмен электродный проводимость
Обычные силикатные, боратные, фосфатные стёкла имеют анионные каркасы, в
пустотах которых находятся крупные низкозарядные катионы (чаще всего натрия и
кальция). Здесь возможен обмен только катионов, но не анионов кислорода, прочно
связанных с кремнием. Коэффициенты диффузии катионов в стёклах обычно выше, чем
в "обычных" ионных кристаллах близкого состава, но значительно ниже,
чем в лучших кристаллических ионных проводниках. Поэтому ионный обмен в стёклах
идёт медленно, обычно проводится в солевых расплавах при повышенных
температурах (но, конечно, ниже температуры размягчения стекла) и редко
распространяется по всему объёму - обычно затрагивает лишь тонкий наружный
слой. Такое изменение состава наружного слоя при сохранении неизменной
сердцевины широко применяется в технике для упрочнения стекла и для создания
градиента показателя преломления. В первом случае основную роль играет
соотношение радиусов замещаемого и замещающего ионов, во втором - соотношение
их поляризуемостей при близких радиусах. Так, замещение малополяризуемых ионов
с оболочкой инертного газа на ионы с 18- или 18+2-электронной оболочкой,
имеющие большую поляризуемость (Na+ на
Ag+ или K+ на Tl+)
повышает показатель преломления наружного слоя, что используется в градиентных
линзах и волноводах (в том числе, в оптическом волокне).
В данной работе предлагается контролировать ионный обмен по изменению
механических свойств на примере наиболее легко измеряемого параметра -
микротвёрдости. Получите у лаборанта плоский образец натриевого стекла (удобны
предметные стёкла и старые фотопластинки с удалённым желатиновым слоем) и
разделите его на 4-5 частей (чтобы иметь уверенность, что будут сравниваться
образцы одинакового исходного состава и одинакового способа получения). Для
этого процарапайте стеклорезом или напильником прямую линию и разломите стекло
по ней. Осторожно! Нужны защитные очки, т.к. возможны осколки! Форма кусков
роли не играет, важно лишь, чтобы они помещались в тигель, но не были слишком
маленькими (не менее 10 мм). Взвесьте каждый кусок на аналитических весах и
поставьте в отдельный пронумерованный фарфоровый тигель с твёрдой солью (если
кусок будет лежать прижатым к дну, доступ соли с одной стороны будет
затруднён), а один или два оставьте для сравнения. Соли выбираем так, чтобы там
были катионы как крупнее натрия, так и мельче. Чтобы убедиться, что изменения
вызваны именно ионным обменом, а не термообработкой, один из опытов нужно
провести с солью натрия, где никакого изменения состава не ожидается. Наиболее
удобны нитраты или эвтектические смеси с их участием [8]. Тигли поместите в
заранее разогретую печь (температура и время выдержки - по указанию преподавателя),
заметьте время, когда соли расплавились. По истечении заданного времени слейте
расплавы на чистую сухую керамическую плиту или в фарфоровую чашку (их можно
будет использовать повторно), медленно остудите стёкла, промойте их водой,
высушите, взвесьте. Осторожно! Если расплав попадёт на мокрую поверхность,
возможно разбрызгивание и ожог!
А пока образцы находятся в печи, займитесь измерением твёрдости исходного
стекла. Для этого используется микротвёрдомер ПМТ-3 с алмазной пирамидкой.
Поскольку стёкла - очень твёрдые материалы, используйте максимальную нагрузку -
200 г. При измерении непрозрачных материалов обычно рекомендуется сначала
поместить образец под микроскоп, настроить резкость и, перемещая столик
винтами, выбрать гладкий участок для измерений. Но если стекло гладкое и
прозрачное, то его просто не видно, и резкость настроить не удаётся. Поэтому
рекомендуются два варианта: либо сделайте на стекле метку фломастером и
наводите на неё, либо сразу помещайте стекло под пирамидку и регулируйте высоту
так, чтобы между ними обязательно оставался зазор, но очень маленький, порядка
0,1-0,3 мм. Отпечаток должен отстоять от края куска не менее, чем на 3 мм.
Плавным поворотом ручки опустите пирамидку на образец и через 5-10 с поднимите
(длительность выдержки имеет значение лишь для пластичных материалов). Сместите
образец на 10 делений микрометрического винта и повторите отпечаток. Сделайте
ещё два-три отпечатка для повышения надёжности. Разверните столик на 180°, чтобы образец оказался под
микроскопом и настройте резкость. При наличии отпечатка это уже гораздо легче.
Перемещая столик микрометрическими винтами, добейтесь, чтобы отпечаток был
вписан своим правым углом в перекрестие и запишите показание объект-микрометра.
Затем, уже не трогая микрометрические винты столика, переместите перекрестие
объект-микрометра так, чтобы в него вписался левый угол отпечатка. По разности
двух отсчётов определите длину диагонали. Можно аналогично измерить вторую
диагональ, повернув объект-микрометр на 90°. Конечно, у квадрата они должны совпадать. Но, во-первых,
неизбежны случайные ошибки, а во-вторых, отпечатки бывают неправильной формы.
Заметьте, что на хрупких материалах, таких, как стёкла, алмазная пирамидка
оставляет не только квадратный отпечаток, но и радиальные трещины, идущие от
вершин квадрата наружу. Длина этих трещин даёт полуколичественное представление
о вязкости разрушения материала, и её тоже следует измерять. Затем найдите
остальные отпечатки, перемещая столик в обратном направлении тем же винтом, что
и раньше, и аналогично измерьте их. Усредните все значения длин диагоналей и
трещин, вычислите средние отклонения от усреднённых значений. Это позволяет
оценить случайную погрешность измерений.
Аналогично измерьте свойства образцов, обработанных солевыми расплавами.
Можно ли, с учётом оценённых погрешностей, утверждать, что стекло упрочнилось
или, наоборот, разупрочнилось? Совпадает ли это с вашим прогнозом? Вычислите
значения твёрдости каждого образца. Твёрдость определяется как отношение силы
давления к площади отпечатка: H = F/S. Зная массу гири, вычислите её вес в ньютонах. Для
вычисления площади надо знать, что цена деления окулярного микрометра 0,3 мкм,
а площадь отпечатка при длине диагонали L и угле между боковыми гранями пирамиды 136° выражается как S = 0,539 L2. Полученный результат удобно выражать в гигапаскалях.
Объясните влияние размеров обмениваемых ионов на твёрдость и прочность
стекла.
2.3 Ионный обмен в керамике
Ионный обмен в керамике важен для получения компактных образцов тех
твёрдых электролитов, которые нельзя получить обычным высокотемпературным
спеканием из-за термической неустойчивости. Это особенно относится к
водородсодержащим материалам - твёрдым кислотам и соединениям аммония. Для
обеспечения ионного обмена по всему объёму нужны довольно высокие коэффициенты
диффузии, и метод применим далеко не ко всем материалам. Кроме того, если при
замещении сильно меняются параметры кристаллической решётки, керамика лопается.
Поэтому размеры замещаемого и замещающего ионов должны быть очень близки. В
частности, на кафедре общей и неорганической химии РГУ разработан способ
получения керамических протонных проводников на основе танталатов аммония,
предлагаемый ниже.
Синтез и спекание предшественника - танталовольфрамата рубидия.
Рассчитайте массы нитрата рубидия и оксидов тантала и вольфрама для получения 3
г Rb4Ta10WO30. Отвесьте их,
тщательно перемешайте в ступке, спрессуйте таблетку, в корундовом или
платиновом тигле поместите в печь, заранее разогретую до 750°С и выдержите 1-2 часа. Такая
обработка связывает рубидий в танталаты и вольфраматы, удаляет оксиды азота, но
ещё не даёт чистого целевого продукта. Смесь тщательно разотрите с добавкой 2-3
капель резинового (или другого органического) клея в качестве пластификатора и
связки и быстро, пока клей не высох, отпрессуйте заготовки для спекания. Для
получения плотной керамики нужно использовать горячее прессование при 1150-1200°С и 20-30 МПа, но для учебных целей
можно ограничиться и пористой керамикой, полученной без давления при 1000-1100°С. В первом случае сделайте одну
толстую заготовку диаметром 10-11 мм, во втором - две-три тонких того же
диаметра. Нагревание должно быть медленным (вместе с печью), чтобы органическая
связка успела выгореть, выдержка при максимальной температуре - небольшой (30-40
мин), чтобы уменьшить потери от улетучивания оксида рубидия. Очистите
поверхность горячепрессованного образца от засыпки и придайте ему правильную
цилиндрическую форму с помощью корундового бруска или алмазной пилы, отшлифуйте
мелкой наждачной бумагой. Толстый образец можно распилить на более тонкие
диски.
Контроль качества керамики танталовольфрамата рубидия. Проведите РФА
керамики. В данном случае важна не широта углового интервала, а хорошее
разрешение, поэтому при съёмке на ДРОН-2.0 рекомендуется интервал 10-35° при скорости сканирования 1°/мин. В базе PDF-2 нет такого точно материала, но есть очень близкие
(№ 32-950 и 34-731). Рассчитайте рентгеновскую плотность (Z=3). Измерьте микрометром в
нескольких местах толщину и диаметр каждого диска, усредните, вычислите объём.
Взвесьте диски, вычислите их плотность и выразите в процентах от рентгеновской
плотности. Для нахождения плотности достаточно взвешивания с точностью до 3
значащих цифр, но для контроля полноты обмена нужна более высокая точность.
Проведение ионного обмена. Наиболее подходящая соль аммония - нитрат,
который плавится при 169°С и
интенсивно разлагается выше 220°С, поэтому оптимальные температуры - 200-210°. Процесс удобно вести в маленькой
печи в длинной стеклянной пробирке, конец которой высовывается из печи и служит
обратным холодильником. Осторожно! Перегрев нитрата аммония иногда приводит к
взрыву! Ионный обмен здесь обратим, и для смещения равновесия в нужную сторону
нужен большой избыток соли - не менее 20-кратного по сравнению с расчётным (а
если учесть улетучивание нитрата - то ещё больше). Скорость обмена сильно
зависит от плотности дисков, их толщины и температуры, поэтому однозначные
рекомендации дать трудно. Но в пористых дисках толщиной 1-1,5 мм высокая
степень обмена достигается за 2-3 часа, а далее процесс замедляется и наступает
равновесие. В течение выдержки нужно несколько раз взболтать расплав. Затем
слейте с дисков расплав, остудите их, промойте несколько раз дистиллированной
водой (полноту удаления иона аммония можно контролировать реактивом Несслера),
промокните фильтровальной бумагой, подержите несколько минут в спирте для
удаления воды из пор, опять промокните и высушите при 40-60°С.
Контроль качества керамики танталовольфрамата аммония. В рентгенофазовом
анализе продукта нет особого смысла, т.к. при низкой температуре каркасная
структура не могла перестроиться, а параметры решётки тоже практически не
меняются из-за близости радиусов рубидия и аммония. Взвесьте каждый диск,
вычислите относительное изменение массы по сравнению с исходным и сравните с
изменением, вычисленным по уравнению реакции. Это даёт степень замещения
(разумеется, если от диска не откололись куски). Независимо проверить степень
замещения можно, измерив потерю массы при прокаливании (800°С) и сделав РФА продукта
прокаливания, но для этого придётся пожертвовать одним из образцов. Если есть
образцы разной толщины или разной плотности - обсудите, повлияло ли это на
полноту обмена. Если степень замещения менее 70%, то обработку следует
повторить, а при большей степени замещения образцы пригодны как протонные
проводники, т.к. величина проводимости далее меняется мало, а температура
разложения даже повышается от примеси рубидия. Эти образцы используются в
следующих работах.
2.4 Ионный обмен в порошках
.4.1 Изучение ионообменной селективности
сурьмяной кислоты
Реактив, неправильно называемый "оксид сурьмы (V) водный" - это на самом деле
кристаллическая сурьмяная кислота с каркасной структурой типа пирохлора HSbO3*xH2O (x£1). Она практически нерастворима в
воде и в этом смысле является слабой. Но она имеет высокую протонную
проводимость и способна давать ионы водорода в раствор в обмен на катионы
металлов, т.е. вытеснять сильные кислоты из их солей, и в этом смысле она -
сильная кислота.
Возьмём растворы одинаковой нормальности нитратов (или других солей
сильных кислот) лития, натрия, калия, цезия, кальция, серебра, свинца. Возможен
и другой набор, но желательно иметь в нем щелочные катионы, сильно отличающиеся
по размеру (Li+, Na+, Cs+),
щелочной и щелочноземельный катион близкого размера (Na+ и Ca2+
или K+ и Ba2+), чтобы увидеть влияние заряда, а также ионы одного заряда
и близкие по размеру, но сильно отличающиеся электронной структурой (Na+ и Ag+ или Sr2+ и
Pb2+). Соблюдайте осторожность, т.к.
соли бария и свинца ядовиты! Отмерьте пипетками в пронумерованные колбы или
стаканы одинаковые объёмы этих растворов и всыпьте туда одинаковые навески
сурьмяной кислоты. Соотношение реагентов пусть будет близкое к стехиометрии,
например 1 миллимоль HSbO3*xH2O и 10 мл 0,1 н раствора соли. Если готовых растворов нет, их
можно приготовить из точных навесок солей и приблизительных объёмов воды,
отмеренных цилиндром (важнее точное количество вещества, а не точная
концентрация) Выдержите взвеси при периодическом (а лучше непрерывном)
встряхивании достаточно долго, чтобы приблизиться к равновесию (лучше всего -
несколько дней), отметьте температуру, отфильтруйте и промойте, собирая
промывные воды. Осадки высушите на фильтре без нагревания и проведите РФА
вместе с исходной кислотой. Признаками протекания обмена являются изменение
параметра решётки (уточните по отражениям из области 2Q > 60°) и изменение интенсивностей,
особенно существенное в случае тяжелых атомов. Фильтрат с промывными водами
оттитруйте щелочью по метилоранжу и рассчитайте степень обмена. Расположите
ионы в порядке их предпочтения к обмену с сурьмяной кислотой и сделайте вывод о
кристаллохимических факторах, определяющих это предпочтение.
2.4.2 Изучение кинетики обмена
Постановка опытов аналогична п. 2.4.1, но вместо одинаковых выдержек с
разными реагентами проводятся разные выдержки с одним реагентом. Можно
использовать ту же сурьмяную кислоту (выбрав ион, с которым обмен проходит
достаточно полно) или другой ионит, например, из описанных в пп. 2.4.3 и 2.4.4.
Чтобы упростить последующую обработку результатов, можно вести процесс при
практически постоянной концентрации соли, а для этого взять её в большом
избытке. Делать анализ без отбора проб сложно, а при отборе проб меняется
соотношение реагентов и накапливается ошибка. Поэтому рекомендуется для каждого
времени выдержки использовать отдельную смесь, при условии, что их составы и
температуры будут одинаковы. Для получения вразумительной кинетической кривой
нужно не менее 7-10 существенно отличающихся точек. Чтобы узнать, какие
выдержки оптимальны, сделайте пробный опыт, например, с выдержкой в один час.
Если за это время будет достигнута высокая степень превращения (50-70%) -
очевидно, что основное внимание нужно уделить коротким выдержкам (3, 5, 10, 20
мин. и т.п., а после 1 часа интервалы увеличить). В этом случае, чтобы
уменьшить ошибки, особенно важно интенсивное перемешивание и быстрое разделение
реагентов вакуумным фильтрованием. Если же изменения за час небольшие, то могут
потребоваться выдержки в несколько суток. По данным анализа постройте кривую в
координатах время - степень обмена. Если на ней есть сомнительные места
(большие разрывы или выпадающие точки) - сделайте дополнительные опыты.
Подберите кинетическое уравнение, которое лучше всего описывает экспериментальные
данные [9, c. 164-194] и попытайтесь сделать
вывод о механизме процесса.
2.4.3 Особенности ионного обмена в слоистых
структурах
Слоистые иониты, казалось бы, менее требовательны к размерам ионов, чем
каркасные, т.к. слои могут раздвигаться на разные расстояния в зависимости от
радиуса иона. Кроме того, в межслоевое пространство могут входить молекулы
воды, аминов и т.п. Тем не менее, и здесь размер ионов и молекул очень важен.
Это можно увидеть на примере изоструктурных NaSbO3 и KSbO3
типа ильменита.
Их удобно получать по реакции
O3 + 0.8 MNO3 + 0.6 M2CO3 = 2 MSbO3 + 0.6 CO2 + 0.4 N2.
Расчётные массы реагентов (для получения примерно 0,01 моль каждого
продукта) тщательно перетрите в ступке, спрессуйте, поставьте в фарфоровом или
корундовом тигле в печь, заранее разогретую до 600°С, выдержите один час, охладите и
разотрите в ступке. Проверьте продукты методом РФА. В случае антимоната калия,
наряду с ромбоэдрической фазой типа ильменита, часто получается примесь
кубической модификации, но это не препятствует дальнейшей работе.
Большую часть каждого вещества оставьте в запасе, а примерно 0,2-0,3 г
поместите в колбу, залейте избытком раствора хлорида аммония и взбалтывайте.
Существенные изменения, хотя и не полный обмен, можно получить уже за 1-2 часа.
Отфильтруйте осадки на воронке Бюхнера, промойте раствором аммиака (чтобы
подавить возможный гидролиз), затем небольшим количеством спирта и дайте
высохнуть при комнатной температуре. Когда порошок станет легко отставать от
фильтра, можно проверить результат методом РФА. В слоистых структурах ионный
обмен влияет прежде всего на межслоевое расстояние и мало изменяет параметры
жёсткого слоя. В данном случае ожидается изменение гексагонального параметра с,
которое легко обнаруживается по смещению рефлексов с большим индексом l: 003, 006 и т.п.
Сравните поведение антимонатов натрия и калия, попытайтесь дать
кинетическое и (или) термодинамическое объяснение наблюдаемому различию и на
его основе предскажите, как будут вести себя те же вещества по отношению к
солям лития, предложите способы интенсификации процесса и проверьте свои
предположения на оставшихся в запасе порошках.
2.4.4 Получение слоистых кислот
Безводные слоистые кислоты H2Ti3O7, HTiNbO5,
H4Nb6O17 предложены в
качестве чувствительных элементов кондуктометрических датчиков аммиака и как
материалы для фотоэлектрохимического преобразования солнечной энергии. Их можно
получить действием водных кислот на Na2Ti3O7, KTiNbO5,
K4Nb6O17, которые
получаются твердофазным синтезом из соответствующих оксидов и карбонатов при
800-1000°С. Синтезируйте, например, трититанат
натрия, тщательно разотрите, проверьте методом РФА, взболтайте порошок с
избытком раствора кислоты и периодически отбирайте пробы порошка для РФА. В
данном случае не образуется твёрдого раствора, а возникают и постепенно
усиливаются отражения H2Ti3O7 с одновременным ослаблением линий исходной фазы.
Контролировать протекание обмена удобно по самому яркому базальному отражению.
Кроме исчезновения линий трититаната натрия, полнота обмена может быть проверена
по потере массы при прокаливании кислоты и по данным РФА продукта прокаливания
при 800°С: образуется оксид титана (рутил или
анатаз), а небольшая примесь натрия легко обнаруживается в виде Na2Ti6O13. Полученную
слоистую кислоту можно далее отпрессовать, снабдить электродами и испытать
изменение её проводимости в атмосфере аммиака, проверить обратимость этого
изменения. Она может также использоваться для опытов по п.п. 2.4.2 и 2.4.3.
2.4.5 Получение электродного материала
литий-ионного аккумулятора [10]
В настоящее время в положительных электродах литий-ионных аккумуляторов
используется в основном слоистый ромбоэдрический LiCoO2 и материалы на его основе. При длительном
циклировании часть катионов переходного металла мигрирует в литиевые слои,
образуется кубическая структура типа шпинели и диффузия лития затрудняется.
Поэтому предложены материалы с другим способом упаковки слоёв, которые не могут
перестраиваться в шпинель, например, Li2Ni2MnO6. При прямом высокотемпературном синтезе такая
структура получается только с натрием, но не с литием, и необходим ионный обмен
натрия на литий.
Рассчитайте массы карбоната натрия, оксидов или основных карбонатов
никеля и марганца для получения, например, 4 г Na2Ni2MnO6. Для интенсификации реакции и
окисления марганца (2+, 3+) можно заменить 20-30 % карбоната натрия
эквивалентным количеством нитрата. Отвесьте реагенты, тщательно перемешайте в
ступке, спрессуйте, прокалите 1-2 часа при 700-750°С, тщательно разотрите, вновь
спрессуйте, прокалите 3-4 часа при 900°С и резко охладите. Проверьте полученный продукт методом РФА
(в PDF-2 его рентгенограммы, вероятно, нет,
но она есть в цитируемой статье [10]), при необходимости проведите
дополнительный обжиг, а затем обработайте порошок избытком расплавленного
нитрата лития в течение часа при 280-300°С, промойте водой и высушите при 100°С. Проверьте, согласуется ли
рентгенограмма продукта с литературными данными [10]. Обратите внимание, что,
кроме уменьшения межслоевого расстояния, происходит также изменение симметрии с
гексагональной до ромбической в результате скольжения слоёв. В исходном
соединении натрий находился в треугольно-призматическом окружении, но для лития
это неприемлемо, и слои сдвигаются, обеспечивая ему тетраэдрическое окружение.
Полученный материал может далее использоваться в подразделе 5.3.
3. Ионная проводимость и числа переноса [1-4]
.1 Общие сведения
В отличие от металлов и полупроводников, у ионных проводников
электропроводность нельзя определить просто как отношение силы тока к
напряжению на образце. Дело в том, что на границе ионного проводника с
электронным возникают электродные явления - зарядка ёмкости двойного
электрического слоя, электролиз, и мы фактически изучаем не электролит, а
электрохимическую ячейку, состоящую из электролита и электродов. В данном
разделе не ставится задача изучения электродных явлений, но они существуют, и
нужно уметь отделять их вклад от свойств электролита. Этому посвящены
подразделы 3.3-3.5. В общем случае в полную проводимость вносят вклад катионы,
анионы, электроны и дырки (хотя обычно что-то сильно преобладает), и нужно
уметь определять их вклады - числа переноса. Этому посвящены подразделы 3.6,
3.7 и 5.1.
И ионная, и дырочная, и электронная проводимость имеют термически
активированный характер (металлы здесь не рассматриваются), поэтому нужно из
температурной зависимости проводимости найти энергию активации. Её выражают
либо в электронвольтах в расчёте на один элементарный акт переноса, либо в
килоджоулях на моль элементарных актов. Соответственно, в уравнении Аррениуса появляется
либо постоянная Больцмана k,
либо газовая постоянная R.
Далее используется только первый вариант. В литературе встречаются два варианта
уравнения Аррениуса для описания температурной зависимости проводимости:
Измерьте проводимость при нескольких температурах (желательно не менее
шести-восьми точек) в достаточно широком интервале. Обязательно нужно проверить
обратимость, т.е. после достижения максимальной температуры сделать несколько
измерений при охлаждении. Если предполагается влияние адсорбированной влаги (у
плохо проводящих материалов оно почти всегда заметно), то измерения вблизи
комнатной температуры нужно делать в сухой атмосфере или в вакууме. Если же
измерения проводятся ниже комнатной температуры, то удаление влаги становится
обязательным для всех материалов, иначе результаты будут искажены выпадением
росы или инея. Постройте график в координатах Аррениуса 1/T - lnsT. Это можно сделать на миллиметровой бумаге, но гораздо быстрее провести
все вычисления и построение программой MS Excel. Если все точки удовлетворительно ложатся на прямую -
уравнение выполняется, можно находить энергию активации и s0 ("добавить линию тренда"
- "линейная" - "формат линии тренда" -
"параметры" - "показывать уравнение на диаграмме"). Если на
графике чётко виден излом - определите энергию активации и s0 отдельно для каждого участка. Если
же излом сомнителен, зависит от положения всего одной или двух точек - нужно
провести дополнительные измерения, чтобы либо доказать, либо опровергнуть
наличие излома. Если результаты при нагреве и охлаждении систематически
отличаются - нужно искать причину (удаление адсорбированной влаги, термическое
разложение, окисление или восстановление образца, порча контактов и т.п.).
Таким образом, для характеристики материала нужно будет указать:
- повторяемость результатов при нагревании и охлаждении;
- удельную электропроводность при некоторых характерных
температурах (обычно при 25 и 300°С);
энергию активации с указанием интервала температур, где она
определена (или разные энергии активации в разных интервалах);
наличие скачков проводимости, которые указывали бы на фазовые
переходы, температуры и величины этих скачков;
числа переносов ионов и электронов.
Изучение неосновных носителей - сложная задача, и в данной работе не
ставится задача разделения дырочного и электронного вкладов, будем их вместе
называть электронным, в смысле "не ионным". Числа переноса, конечно,
тоже зависят от температуры, и при значительной электронной составляющей нужно
находить энергию активации ионной и электронной проводимости отдельно, но при
малом вкладе электронной проводимости его трудно точно измерить, и приходится ограничиться
оценками типа "не более...".
Наибольший вклад в ошибку определения удельной электропроводности вносят
не погрешности электрических измерений, а неточности определения температуры и
размеров образца. Например, изменение температуры на один градус может изменить
проводимость на 1-5 %; если размер образца около 1 мм измерен штангенциркулем с
точностью 0,1 мм - это даёт погрешность в 10 %, а при измерении микрометром
ошибка в 10 раз меньше, но всё равно существенна. Поэтому размеры и температуру
нужно измерять особенно тщательно. Спай термопары должен находиться как можно
ближе к образцу, измерения следует проводить после выдержки при постоянной
температуре, а не при непрерывном нагревании или охлаждении. При пользовании
термометром нужно вводить поправку на выступающий из печи столбик ртути. Ток,
пропускаемый через образец при измерениях, должен быть очень малым, чтобы не
вызывать его нагревания джоулевым теплом.
Раньше удельную электропроводность выражали в Ом-1см-1. Но для обратного
ома давно введено специальное название сименс (См, S), а использование десятичной приставки санти- вряд ли
уместно, если рядом еще стоит степень десяти: запись типа 10-2 Ом-1см-1 очень
громоздка, удобнее записать то же самое в виде 1 См/м.
3.2 Подготовка образцов
Идеальными образцами являются монокристаллы, т.к. они лишены посторонних
фаз, границ зёрен и позволяют исследовать анизотропию проводимости, т.е.
наиболее полно и точно охарактеризовать фазу. Но получение крупных
монокристаллов - сложная задача, и они малодоступны. Прессование порошков даёт
хороший контакт частиц только в случае пластичных материалов, таких, как иодиды
серебра, меди и материалы на их основе. Многие соли получают в виде компактных
образцов литьём расплава. Но оксидные материалы (алюминаты, силикаты,
танталаты, титанаты и т.п.) обычно очень твёрдые, хрупкие, тугоплавкие (причём
плавятся зачастую инконгруэнтно), и для них эти методы непригодны, необходимо
спекание или горячее прессование, т.е. получение керамики.
Для расчёта удельного сопротивления материала r через сопротивление образца R нужно знать площадь поперечного
сечения S и длину L: r = RS/L. Подразумевается, что площадь сечения по всей длине образца
одинакова. Поэтому нужны образцы в форме цилиндра или прямой призмы (например,
прямоугольного параллелепипеда). Такую форму керамике нужно придать шлифовкой.
Поскольку материалы с подвижными щелочными катионами почти всегда склонны к
гидролизу, их механическую обработку нужно вести всухую. Размеры образца
измерьте микрометром в нескольких местах и усредните. По ним вычислите и объём
для нахождения плотности, и коэффициент S/L (его изменением
от теплового расширения можно пренебречь).
Если у материала ожидается высокая проводимость, т.е. малое
сопротивление, то сопротивление контактов и подводящих проводов может внести
существенную ошибку. Чтобы её уменьшить, желательна малая величина S/L, т.е. длинный образец небольшого сечения - стержень. Если же
проводимость очень низкая, то сопротивление такого стержня может выйти за
пределы возможностей аппаратуры, и нужно, наоборот, большое значение S/L - тонкий диск.
Очень важный вопрос - электроды. Они должны иметь очень высокую
электропроводность (поэтому предпочтительны металлы), полностью покрывать грани
образца площадью S, иметь хороший
контакт с образцом. Это особенно важно при большом соотношении S/L: если в каких-то местах контакт нарушен, то в
электропроводности участвует не всё сечение образца, и проводимость получается
заниженной. На первый взгляд, кажутся лучше обратимые электроды, которые могут
свободно участвовать в электродной реакции, например, для натрий-ионного
проводника - металлический натрий. Но и такие электроды оказывают некоторое
сопротивление переносу заряда ("фарадеевское сопротивление"), и
отделить его непросто, не говоря уже о том, что натрий легко плавится и
окисляется. Поэтому гораздо чаще используются блокирующие электроды из
благородных металлов, вклад которых гораздо легче выявить и отделить.
Механическое прижимание металлического электрода приемлемо только для
пластичных материалов, и всё равно свойства контакта зависят от давления.
Электроды из серебра, золота, платины можно нанести напылением в вакууме:
сначала на одну сторону, потом, после переворачивания и повторной откачки, на
другую. Обычно при этом запыляется и боковая поверхность, и её надо чистить.
Применяется также взрывное нанесение металла, например, меди, большим импульсом
тока. Метод не требует вакуума, но наносит тепловой удар по образцу, что
неприемлемо для термически нестойких веществ. Оба эти метода требуют специальной
аппаратуры, которая не везде доступна, и эффективны лишь при большом количестве
образцов.
Для диэлектрической и пьезоэлектрической керамики широко применяется
вжигание серебряных электродов. На образец кистью наносят пасту из скипидара,
канифоли, карбоната серебра и флюсов. При нагревании сперва образуется расплав,
содержащий резинат серебра, а затем органика сгорает, серебро восстанавливается
и образует сплошной блестящий хорошо сцепленный слой. Но в случае твёрдых
катионных проводников сначала происходит ионный обмен керамики с солью серебра,
ионы серебра проникают в керамику, изменяя её состав и свойства [11]. Кроме
того, вжигание неприменимо для термически неустойчивых материалов.
Вжиганием специальных паст наносят также платиновые электроды, которые
важны не только для измерений, но и для работы устройств, основанных на
кислород-ионных и протонных проводниках.
Хорошо зарекомендовало себя натирание керамики расплавленным индием [11].
У него невысокая температура плавления 156°, и он хорошо удерживается как в твёрдом, так и в жидком
состоянии. Тонкий слой In2O3 - полупроводник и не оказывает
заметного сопротивления.
Если у материала не ожидается высокой проводимости, можно применять
графитовые электроды. Их наносят либо в виде водной или спиртовой суспензии
коллоидного графита ("аквадага", "алкогольдага"), либо
путём натирания сухим графитом. В крайнем случае можно использовать очень
мягкий карандаш (3М).
Если образец получен прессованием (холодным или горячим), то в нём
возможна преимущественная ориентация зёрен и анизотропия проводимости. Чтобы
проверить это, нужно после измерений снять электроды, нанести их на другие
грани и провести измерения в перпендикулярном направлении.
3.3 Иммиттансная спектроскопия [1, с. 124-140;
11, 12]
В настоящее время это наиболее распространённый способ разделения вкладов
электролита и электродов в полное сопротивление электрохимической ячейки. Кроме
того, метод позволяет решать и ряд других задач: разделение вкладов объёма и
границ зёрен, оценку электронной проводимости, исследование электродных
процессов.
Для измерения электрохимического иммиттанса (импеданса или адмиттанса)
применима различная аппаратура: устаревшие мосты Р-5021 с ручной компенсацией с
помощью магазинов сопротивлений и ёмкостей; более современные компьютеризированные
приборы: измеритель-анализатор конструкции Института проблем управления РАН,
импедансметры серии Z, разработанные в
Институте проблем химической физики РАН, импортные приборы фирм Solartron и Hewlet-Packard.
Главные требования, отличающие электрохимическую аппаратуру от
радиоизмерительной: возможность использовать малые напряжения (1-100 мВ), не
возмущающие электрохимическую систему, и широкий диапазон частот - от 0,1-10 Гц
до 105-107 Гц. Особенности использования у каждого прибора свои, и тут они не
рассматриваются; ознакомьтесь с инструкцией к прибору.
Перед работой зафиксируйте липкой лентой соединительные провода, измерьте
их сопротивление и индуктивность (соединив контакты накоротко), а также ёмкость
пустой ячейки (разведя контакты на длину образца). Эти параметры далее должны
учитываться при измерениях. Стабилизируйте температуру образца, измерьте
импеданс (или адмиттанс) на 15-30 сильно отличающихся частотах, сохраните
результаты (рекомендуется для каждого цикла измерений создать отдельный
каталог, а в именах файлов указывать температуру с пометкой "нагр"
или "охл"). Далее либо переходите к измерению на постоянном токе при
той же температуре (см. подраздел 3.6), либо изменяйте температуру, а пока она
стабилизируется, обрабатывайте результаты согласно рекомендациям пособия [12].
При анализе иммиттанса часто забывают, что одна и та же частотная
зависимость его параметров может получаться при совершенно разных эквивалентных
схемах. Поэтому для объективного подтверждения правильности интерпретации нужно
использовать и другие методы, рассматриваемые в подразделах 3.4 и 3.5. Эти
методы более требовательны к геометрии образцов, но зато гораздо нагляднее и
используют более доступную аппаратуру. При аккуратной работе все методы дают
одинаковые результаты [11].
3.4 Четырёхэлектродный (четырёхзондовый) метод
[1, с. 87-89; 11]
Форма образца и взаимное расположение электродов могут быть разными; на
рис. 1 показан наиболее наглядный вариант, обеспечивающий наибольшую точность.
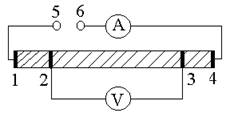
Рисунок 1 - Схема четырёхзондового метода
На образец в виде стержня ("шпалы") нанесены электроды 1, 2, 3,
4, а к клеммам 5 и 6 подключается источник переменного или постоянного тока:
звуковой генератор, позволяющий варьировать частоту, или трансформатор сетевой
частоты, или выпрямитель, или аккумулятор. Через токовые электроды 1 и 4 течёт
ток, они поляризуются, и там даже может происходить электролиз образца, но это
не влияет на измерения, т.к. напряжение снимается высокоомным вольтметром с
потенциальных электродов 2 и 3, которые не поляризуются, поскольку ток через
них не идёт. Сопротивление находим как отношение напряжения к силе тока, а
длиной образца считается расстояние между электродами 2 и 3. Для уменьшения
погрешности их ширина должна быть как можно меньше, а расстояние между ними -
побольше. Следует подчеркнуть, что сопротивление вольтметра должно быть на
много порядков выше сопротивления образца, иначе сопротивление образца
получится заниженным из-за тока, идущего через вольтметр. С плохими
электролитами (имеющими высокое сопротивление) и плохими вольтметрами (имеющими
невысокое сопротивление) этот метод применять не нужно.
Если нужно провести измерения на постоянном токе, то, чтобы не разрушать
образец электролизом и уменьшить поляризационное сопротивление, желательно
использовать обратимые контакты. Но в случае материалов с проводимостью
щелочных катионов неудобно использовать соответствующие металлы, их можно
заменить жидкими электролитами - растворами или расплавами соответствующих
солей. Например, при изучении натрийпроводящих силикатов [11] к концу стержня
поджимали стеклоткань, пропитанную легкоплавким ацетатом натрия, а уже потом -
графитовый или платиновый электрод. При измерениях на постоянном токе
результаты могут искажаться паразитными электродвижущими силами, имеющими
термоэлектрическую природу (если вдоль образца температура не строго постоянна)
или вызванными микропримесями на электродах. Чтобы их выявить и учесть,
рекомендуется повторять измерения с переменой полярности.
В иммиттансной спектроскопии предполагается, что ионная проводимость
кристаллов не зависит от частоты, а здесь это можно непосредственно проверить.
Если в сопротивлении керамики есть существенный вклад межзёренного импеданса,
он заметен на низких частотах, и там измеряется суммарное сопротивление объёма
и границ зёрен. Но ток более высокой частоты свободно проходит через
межзёренные границы благодаря их большой ёмкости, и там измеряется только
сопротивление объёма. Есть, конечно, и переходная область (рис. 2). Граница
между "низкими" и "высокими" частотами зависит от качества
керамики и от температуры. Она может быть в области 104-107 Гц, а сверхвысокие
частоты (109-1012 Гц) здесь не рассматриваются, там совсем другие явления,
методы и аппаратура.
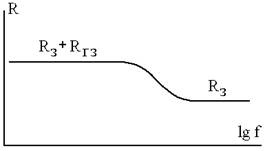
Рисунок 2 - Типичная частотная зависимость сопротивления ионпроводящей
керамики (Rз и Rгз - сопротивления зёрен твёрдого электролита и границ зёрен)
3.5 Зависимость импеданса от межэлектродного
расстояния [1, с. 85-86; 4, с. 69-70; 11]
Идея этого метода ещё проще и нагляднее: объёмное сопротивление
пропорционально межэлектродному расстоянию L, а электродный импеданс от него не зависит: RS = ZS + rL, где R - полное сопротивление ячейки, Z - электродный импеданс. Имея два или
несколько образцов идентичного качества, с одинаковыми электродами, но разной
длины, можно разделить сопротивление на две составляющие. Графически это
нагляднее (рис. 3), аналитически - точнее:
r = (R2S2 - R1S1) / (L2-L1)
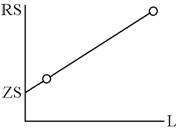
Рисунок 3 - Типичный результат измерений сопротивления двух образцов
одного ионного проводника в одинаковых условиях на низкой частоте
Очевидно, что для повышения точности нужны очень длинные и очень короткие
образцы, а образцы промежуточной длины неинформативны. Главная проблема -
обеспечить одинаковое качество образцов и одинаковые условия измерения. Можно,
например, спечь длинную "шпалу", распилить её на две неравные части,
нанести на них одинаковые электроды и выдерживать при заданной температуре
одновременно, в ячейке, рассчитанной на два образца. Измерения можно проводить
простейшим мостом переменного тока на фиксированной частоте, или даже с помощью
вольтметра и амперметра двухэлектродным методом. Какая из двух схем подключения
(рис. 4) правильнее?
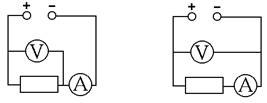
Рисунок 4 - Два варианта измерений двухэлектродным методом
Если вольтметр имеет бесконечно большое сопротивление, а амперметр -
бесконечно малое, то обе схемы верны. Но реально сопротивления конечны и могут
вносить погрешности. Левая схема занижает сопротивление образца, т.к. часть
измеренного тока идёт через вольтметр. Такую схему можно использовать, только
если сопротивление образца на несколько порядков меньше сопротивления
вольтметра. Правая схема завышает сопротивление образца, т.к. к нему
добавляется сопротивление амперметра, и её можно использовать, только если
сопротивление образца на несколько порядков больше сопротивления амперметра.
3.6 Оценка электронной проводимости
поляризационным методом [1, с. 148-154, 3, с. 230]
В упрощённом виде идея метода состоит в следующем. Если электроды
блокирующие, т.е. не могут участвовать в процессах разряда-ионизации в данном
электролите, и к ним приложено малое напряжение, заведомо меньшее, чем
напряжение разложения электролита, то через границу электролит/электрод может
идти только электронно-дырочный ток, но не ионный. Напряжения разложения
известны далеко не для всех материалов, но обычно это величины порядка 0,5-4 В
(для соединений щелочных металлов - побольше, для соединений серебра -
поменьше). Поэтому напряжение в 0,1 В можно считать достаточно малым. А какие
электроды можно считать блокирующими? Очевидно, что серебряный электрод на
серебропроводящем электролите - обратимый, а на литийпроводящем - блокирующий.
Платиновый электрод на кислород-ионном проводнике в воздухе не может считаться
блокирующим, т.к. способен катализировать реакцию разряда-ионизации кислорода,
а в инертной атмосфере или на натрийпроводящем электролите - может.
Прикладываем к твердоэлектролитной ячейке с блокирующими электродами
малое постоянное напряжение и измеряем силу тока. Источником может служить
выпрямитель, включённый через понижающий трансформатор, или аккумулятор с
делителем напряжения (реостатом). В начальный момент в цепи идёт и электронный,
и ионный ток, но ионы (или вакансии) накапливаются у электродов и не могут
разрядиться. Формируется двойной электрический слой, и это выглядит как зарядка
конденсатора: ток экспоненциально уменьшается. После полной зарядки ёмкости
двойного слоя ионный ток равен нулю, и наблюдаемый остаточный ток можно считать
электронно-дырочным, рассчитать по нему электронную проводимость и электронное
число переноса. Но если электронная проводимость очень мала, то её трудно точно
измерить; такие измерения могут давать завышенный результат: во-первых, нет
уверенности, что ионный ток полностью подавлен; во-вторых, могут вносить вклад
какие-то микропримеси в электролите, электроде или атмосфере.
Здесь опять возникает вопрос выбора одной из двух схем, показанных на
рис. 4. Если мы имеем дело с хорошим твёрдым электролитом, у которого
электронная проводимость ничтожна, то правая схема надёжнее.
3.7 Метод Тубандта [1, с. 122-124; 3, с.
228-229]
Это наиболее прямой (хотя и не самый точный) метод определения ионных
чисел переноса, поскольку он основан на измерении массы перенесённого вещества.
Для эксперимента нужны три плоских образца одного и того же материала, хорошо
пришлифованные друг к другу. Это могут быть керамические диски или прессовки из
пластичного ионного проводника. На два крайних наносится по одному электроду
(анод и катод), и все три взвешиваются на аналитических весах. Далее их
прижимают друг к другу, подсоединяют токонесущие контакты, термостатируют и
пропускают постоянный ток, измеряя количество электричества. Для этого нужен
кулонометр или потенциостат. При их отсутствии можно найти количество
электричества как произведение силы тока на время, но тогда нужно
стабилизировать силу тока, т.к. по мере электролиза может сильно меняться
сопротивление системы. Если оно не слишком велико, то можно присоединить
последовательно гораздо большее "балластное" сопротивление, которое и
будет определять силу тока в цепи.
В учебных целях предлагаются системы с переносом ионов серебра - на
основе иодида или сульфата серебра (обратите внимание на наличие у них фазовых
переходов!). Они просты в исполнении и наглядны, так как:
серебряные электроды устойчивы на воздухе, не нужна защитная атмосфера и
разделённые газовые пространства;
высокий электрохимический эквивалент обеспечивает хорошо заметное
изменение массы;
высокая ионная проводимость сокращает время эксперимента;
пластичность электролитов облегчает изготовление образцов и улучшает
контакт между ними.
Чтобы серебряная пластинка хорошо держалась на ионном проводнике, её
поверхность не должна быть гладкой. Процарапайте её грубым напильником или
загните её края на 1-2 мм внутрь. Положите электрод в прессформу, засыпьте
небольшим количеством порошкообразного ионного проводника, спрессуйте
гидравлическим прессом и выдавите прессовку. Солевые ионные проводники бывают
очень пластичны и при излишнем давлении могут вытекать через зазоры прессформы,
поэтому давление нужно подбирать опытным путём. Аналогично сделайте третий
диск, а второй спрессуйте без металла.
Вычислите время, необходимое для того, чтобы получить достаточно ощутимое
изменение массы при наблюдаемой силе тока, и по его истечении (или по
достижении желаемого количества электричества) разберите цепь и взвесьте
образцы. Если их не удаётся разнять, или масса средней таблетки изменилась
из-за спекания, то опыт испорчен, и результаты использовать нельзя. Если же
масса средней таблетки осталась прежней, то изменение масс анодной и катодной
таблеток покажет, куда переносилось вещество, и каково ионное число переноса.
4. Электродные явления в твердоэлектролитных ячейках
.1 Вольтамперные характеристики асимметричных
ячеек
В работе предлагается исследовать ячейки с одним обратимым и одним
блокирующим электродами, например:
| AgI | C или H2,
Pd | (NH4)4Ta10WO30 | Cu, H2
Первая ячейка готовится прессованием (см. выше подраздел 3.7), вторая -
нанесением металлов или соединений, восстанавливающихся до металлов, на керамику,
полученную в подразделе 2.3, и нагреванием её в атмосфере водорода. Строго
говоря, для полной необратимости на правом электроде не должно быть водорода,
но ячейку с разделёнными газовыми пространствами сделать трудно, поэтому
используем электрод с малой каталитической активностью (медный, графитовый или
сурьмяный) и считаем его условно блокирующим. В качестве каталитически
активного электрода можно использовать платину вместо палладия.
Газовые электроды должны иметь хороший контакт с керамикой и одновременно
быть пористыми, обеспечивая доступ газа к контакту. Эти два требования трудно
совместить. Если электрод готовится намазыванием взвеси оксида с последующим
восстановлением, то хорошо выполняется лишь второе условие. Такие электроды
легко осыпаются и требуют осторожного обращения.
Стабилизируйте температуру ячейки, соберите цепь согласно рис. 4 и
проведите измерения силы тока в зависимости от величины и полярности
напряжения, например, от минус 2 В до плюс 2 В с шагом 0,1 В. Постройте
вольтамперную характеристику и объясните её вид. Выполняется ли закон Ома?
Можно ли из полученных данных найти ионную проводимость твёрдого электролита?
Его электронную проводимость? Его напряжение разложения?
4.2 Влияние атмосферы на электродный импеданс
Для опыта предлагается протонпроводящая керамика с двумя одинаковыми
электродами: платиновыми, палладиевыми или графитовыми. Поместите её в ячейку,
допускающую продувку разными газами, нагрейте в воздухе до 250-300°С и после стабилизации температуры
измерьте импеданс в широком интервале частот, обращая особое внимание на
низкочастотную (электродную) область. Затем продуйте ячейку инертным газом
(аргоном или азотом) и повторите измерения при той же температуре. Третий цикл
измерений проведите в водороде (чистом или разбавленном инертным газом).
Нельзя, минуя стадию инертного газа, сразу продувать горячую ячейку водородом,
т.к. образуется гремучая смесь! Дайте качественное объяснение наблюдаемым
различиям. Чтобы проверить, не вызваны ли изменения восстановлением керамики в
водороде, повторите измерения в инертной атмосфере. Предложите теоретически
обоснованные эквивалентные схемы ячейки в воздухе и в водороде, проверьте их
правильность численным моделированием и определите параметры эквивалентных схем
[12]. Какие из них зависят от атмосферы, а какие - нет?
5. Гальванические элементы
.1 Общие замечания
Кроме общеизвестного применения в качестве химических источников тока,
гальванические элементы могут также использоваться как источники информации о
веществах и процессах. Объединив три известных уравнения:
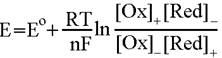
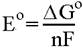

получим
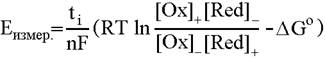
Здесь индексами + и - помечены концентрации (точнее, активности или
парциальные давления) окисленных и восстановленных форм на положительном и
отрицательном электроде соответственно, взятые в степенях, соответствующих
коэффициентам в уравнении потенциалопределяющей реакции.
Не следует забывать, что эдс определяется в условиях термодинамического
равновесия, т.е. в отсутствие тока. Поэтому для её измерения применяется либо
компенсационный (мостовой) метод, либо вольтметр с очень большим входным
сопротивлением, порядка 109 Ом и более. Если сопротивление вольтметра не очень
велико, то в цепи течёт заметный ток, и электроды поляризуются, равновесие
нарушается. Кроме того, если велико внутреннее сопротивление гальванического
элемента, на него приходится значительная доля эдс, и вольтметр показывает
заниженное значение даже в отсутствие поляризации электродов. При пользовании
таким вольтметром измеряемое напряжение может при нагревании гальванической
ячейки возрастать (из-за уменьшения внутреннего сопротивления ячейки), даже
если эдс при нагревании убывает.
5.2 Гальванические элементы с твёрдыми
электролитами
Задание: собрать твёрдофазный элемент, изучить его эдс в зависимости от
температуры и определить термодинамические параметры протекающей реакции. Для
учебных целей предлагаются не самые технически важные, а самые простые в исполнении
гальванические ячейки. Предлагаемые варианты: Ag | AgI | C, S и Ag | AgI | C, V2O5, но по указанию преподавателя
возможны и другие варианты.
Эти элементы выбраны потому, что окислители и восстановитель относительно
устойчивы на воздухе, а электролит пластичен, и хороший контакт достигается
простым прессованием. В обоих случаях окислитель - диэлектрик, и к нему для
электронной проводимости примешивается сажа или толчёный графит. Кроме того,
для улучшения контакта рекомендуется подмешать твёрдый электролит. Таким
образом, катодная масса готовится перетиранием в ступке иодида серебра,
углерода и окислителя (серы или оксида ванадия). Оптимальное соотношение нужно
подбирать опытным путём, но удовлетворительный результат получается при
одинаковых массовых долях всех трёх фаз. Поскольку сажа - самый лёгкий
компонент, её объёмная доля будет наибольшей.
Подготовьте серебряный электрод, как описано выше в подразделе 3.7,
положите его на дно прессформы, засыпьте порошком электролита и слегка
придавите пуансоном (не прессом, а вручную). Затем засыпьте катодную массу и
опять придавите. Количества порошков подбираются так, чтобы толщина каждого
слоя в прессованном виде была 1,5-3 мм. В ряде случаев (см. ниже) рекомендуется
сделать прослойку из одного углерода, засыпав его поверх катодной массы. Для
повышения прочности туда можно подмешать в ступке каплю органического клея
(резинового, БФ-6 и т.п.). Окончательно придавите всё это гидравлическим
прессом для получения монолитного гальванического элемента. Если он после
выдавливания из прессформы рассыпается, нужно его переделать. Если боковая
сторона электролита запачкана углеродом - осторожно счистите его наждачной
бумагой, иначе элемент получится короткозамкнутым.
Установите элемент в нагреваемую ячейку и зажмите его между контактами.
Чтобы сера при плавлении не вытекала на серебро, она должна быть снизу.
Впрочем, при небольшом содержании она удерживается капиллярными силами. Особое
внимание следует уделить контакту с катодом. Если он будет точечным, то может
расколоть прессовку. Если он будет из материала, способного реагировать с
окислителем (например, из того же серебра), то появятся продукты их
взаимодействия, осложняющие эксперимент. Поэтому необходима прослойка из
инертного электронного проводника. При использовании серы металлические
прослойки не годятся, нужно использовать графитовую пластинку или
припрессованный углерод, как описано выше. Под него уже можно положить
серебряную или платиновую фольгу для более равномерного распределения нагрузки.
При использовании оксида ванадия можно вместо углерода проложить платиновую
фольгу.
Термостатируйте элемент при нескольких температурах и измеряйте эдс,
отмечая полярность. Постройте зависимость эдс от температуры. Обратите внимание
на фазовые переходы: плавление серы при 119°С и полиморфное превращение AgI при 146°С. Отражаются ли они на графике? Согласуется ли это с
теоретическими ожиданиями?
Обратите внимание, что в системе с оксидом ванадия можно ожидать
образования как ванадатов, например, AgVO3, так и ванадиевой бронзы AgxV2O5. Напишите уравнения электродных
процессов, суммарные уравнения потенциалопределяющих реакций и предложите, как
выбрать правильный вариант без анализа продукта (ведь его образуется ничтожно
мало). Вычислите DG° для каждой температуры, где есть признаки установления равновесия, а
также средние значения DH° и DS°. Если они определены и ниже, и выше точки плавления серы, то
по ним можно найти также DH° и DS° процесса плавления серы. Найдите в справочниках эти
термодинамические параметры, сравните со своими результатами и, если есть
существенные различия, обсудите их возможные причины.
5.3 Литиевый аккумулятор
В коммерческих литий-ионных аккумуляторах стараются обеспечить
минимальное внутреннее сопротивление, поэтому предельно сближают электроды, а для
отрицательного электрода используют специально подготовленный углерод для
внедрения лития, который лучше циклируется, чем чистый литий, и не образует
дендритов. Но в данной работе предлагается не изготовление мощного
малогабаритного аккумулятора (хотя такую задачу надо всегда иметь в виду!), а
изучение свойств оксидного материала положительного электрода, поэтому для
чистоты эксперимента используется чистый литий, а во избежание короткого
замыкания используется большое межэлектродное расстояние. В таких случаях
применяют трёхэлектродную стеклянную ячейку в виде буквы Ш или Ж: в среднее
колено помещают исследуемый электрод, а в боковые - два литиевых электрода.
Через один из них (рабочий или токовый) пропускают ток при заряде и разряде
аккумулятора, а другой (электрод сравнения или потенциальный) не поляризуется,
т.к. ток через него не идёт, и относительно него измеряется потенциал оксидного
электрода.
В качестве активных материалов положительного электрода можно испытать LiCoO2, LiNiO2, LiMn2O4, полученные твердофазными реакциями
из разных исходных веществ, при разных температурах, с разным размером частиц,
с разными легирующими добавками, или Li2Ni2MnO6, полученный ионным обменом (см. п. 2.4.5). Для
придания электронной проводимости к ним подмешивается сажа, а для лучшего
сцепления - связующее, нерастворимое в электролите, например,
политетрафторэтилен в виде раствора в 1-метил-2-пирролидоне.
Отвесьте на аналитических весах оксидный материал и сажу в соотношении
примерно 7:1. Точно соблюдать это соотношение не обязательно, но точные навески
нужно знать, чтобы потом правильно найти количество вещества в электроде.
Тщательно разотрите вместе эти навески в ступке, прикапайте раствор связующего
в таком количестве, чтобы масса сухого вещества в нём составляла 1-2 % готовой
смеси, и продолжайте растирать до получения однородной вязкой пасты.
Подготовьте коллектор тока в виде фольги или сетки из алюминия или никеля
такого размера, чтобы входил в горлышко ячейки, взвесьте на аналитических
весах, намажьте на него кисточкой приготовленную пасту, оставив свободный конец
для крепления, высушите при 60-70°С (лучше всего - в вакууме), охладите и взвесьте опять. По
разности определите массу электродной смеси и, зная её состав, массу активного
вещества в ней. Далее следует рассчитать количество электричества, необходимое
для извлечения всего содержащегося там лития, чтобы затем относить к нему
реально пропущенное количество электричества и знать степень превращения.
Укрепите электрод на контакте пробки, вставляемой в среднее колено
трёхэлектродной ячейки. Эти процедуры можно делать на воздухе, но работу с
металлическим литием и электролитом нужно вести в защитной атмосфере - в
перчаточном боксе.
В качестве электролита используется раствор соли лития - гексафторфосфата
или перхлората - в апротонном растворителе - смеси эфиров. Мешают кислород,
азот и влага, которые взаимодействуют с литием. Кроме того, влага в электролите
вызывает гидролиз LiPF6, а
образующийся HF реагирует с оксидным материалом.
Приготовление и осушка электролита сложны, лучше всего использовать готовый
безводный электролит, который поставляется в герметичной упаковке и довольно
дорог. Загрузите в бокс все необходимые материалы, посуду и инструменты,
продуйте его сухим аргоном или углекислым газом для вытеснения воздуха, затем
вскройте в боксе банку с осушителем - фосфорным ангидридом - пересыпьте его в
широкую чашку и оставьте на сутки. Только после этого можно вскрывать упаковку
лития и электролита, и то лишь на короткое время. Вырежьте два литиевых
электрода, очистите их от вазелина и укрепите на пробках. Залейте в ячейку
электролит, погрузите в него все три электрода, убедитесь, что оксидный
электрод полностью покрыт электролитом, а литиевые погружены частично, и плотно
закройте. Только после этого можно извлекать ячейку из бокса. Описанная
процедура требует большого расхода времени, аргона и осушителя. Поэтому
целесообразно накопить достаточно много материалов и заряжать все ячейки сразу.
Для испытания электрохимических характеристик электродного материала желательно
использовать программируемый потенциостат-гальваностат, а при его отсутствии -
источник регулируемого постоянного напряжения, миллиамперметр и самопишущий
потенциометр. В крайнем случае можно обойтись вольтметром, но тогда показания
придётся записывать вручную. Изучить все свойства материала на одном образце
вряд ли удастся. Обсудите план работы с преподавателем. Возможна, например,
такая схема эксперимента.
Проводим зарядку аккумулятора в гальваностатическом режиме (I=const), регистрируя напряжение относительно литиевого
электрода сравнения и откладывая его в функции x - степени извлечения лития. Силу тока выбираем таким
образом, чтобы зарядка на половину теоретической ёмкости проходила за разумное
время - порядка часа. Если при этом возникает сильная поляризация, т.е.
требуется слишком большое напряжение (больше 4,5 В), которое может вызвать
разложение электролита, ток придётся уменьшить, а время эксперимента увеличить.
Зарядка прекращается, если напряжение достигнет предельно допустимого, или по достижении
заранее оговоренной величины x
(например, 0,5). Далее проводим разряд, опять-таки в гальваностатическом режиме
с регистрацией напряжения в функции x. При отсутствии потенциостата или стабилизатора тока придётся разряжать
аккумулятор на переменное сопротивление, а постоянство силы тока поддерживать
регулировкой вручную. Удаётся ли получить обратно при разряде то же количество
электричества, которое было пропущено при заряде? Сильно ли отличаются зарядные
и разрядные напряжения?
Если в первом цикле материал вёл себя удовлетворительно, далее следует
повторить заряд-разряд несколько раз для проверки циклируемости: сохраняются ли
параметры, наблюдавшиеся в первом цикле? Они могут и ухудшаться, и улучшаться!
Поляризация электрода может быть обусловлена малой скоростью диффузии
лития в твёрдой фазе. Мы рассчитываем величину x, среднюю по объёму зерна, а реально она сильно изменяется на
поверхности и мало изменяется в глубине зерна. Поэтому интересно также провести
заряд и разряд с паузами, в которых ток отключается, и измеряется изменение
напряжения разомкнутой цепи. По мере выравнивания состава по объёму зёрен это
напряжение приближается к равновесному значению эдс. Но быстро ли? Если
электрод плохо ведёт себя при большой силе тока, это может быть обусловлено не
свойствами вещества как такового, а слишком крупным размером частиц или плохим
контактом с сажей, или недостаточным её количеством.
Если материал хорошо циклируется в пределах заданных выше 50%
теоретической ёмкости, интересно проверить максимально возможную глубину его
заряда: заряжать небольшим током, пока напряжение не достигнет допустимого
предела, а затем извлечь электрод, промыть его и исследовать
рентгенографически.
Если необходимо рентгенографическое исследование на промежуточных стадиях
заряда-разряда, без извлечения электрода ("in situ"), то стеклянная трёхэлектродная ячейка не
годится. Предложена ячейка из никеля, титана или нержавеющей стали в виде
кюветы рентгеновского дифрактометра, герметически закрываемая
полуцилиндрической полиэтиленовой крышкой (рис. 6).
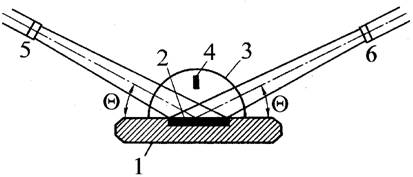
Рисунок 6 - Схема ячейки для рентгенофазового анализа электродного
материала в процессе работы (in situ) [14]
- корпус ячейки, 2 - исследуемый электрод, 3 - крышка, 4 - литиевый
электрод, 5 - рентгеновская трубка, 6 - детектор дифрагированного излучения
При горизонтальном положении ячейки оба электрода омываются электролитом,
и может идти электрохимический процесс. Когда её поворачивают вертикально,
электролит стекает в имеющийся приёмник, и можно проводить РФА. Затем её
поворачивают обратно и продолжают электрохимический процесс. При подготовке
образца к такому комплексному исследованию рекомендуется для введения поправок
в брегговские углы и для количественного РФА ввести в него 15-25 % инертного внутреннего
эталона, например, BaF2.
Список рекомендуемой литературы
1.
Иванов-Шиц, А.К. Ионика твёрдого тела [Текст]: монография / А.К. Иванов-Шиц,
И.В. Мурин. - С.-Петербург: Изд-во С-Петербургского университета, 2010. - Т. 1.
- 616 с.
. Вест, А.
Химия твёрдого тела [Текст]: монография / А. Вест. - М.: Мир. - 1988. Ч. 2. -
С. 5-58, 306-307.
. Чеботин,
В.Н. Электрохимия твёрдых электролитов [Текст]: монография / В.Н. Чеботин, М.В.
Перфильев. - М.: Химия, 1978. - 312 с.
. Укше, Е.А.
Твёрдые электролиты [Текст]: монография / Е.А. Укше, Н.Г. Букун. - М.: Химия,
1977. - 176 с.
. Рао, Ч.Н.Р.
Новые направления в химии твёрдого тела [Текст]: монография / Ч.Н.Р. Рао, Дж.
Гопалакришнан. - Новосибирск: Наука. - 1990.
. Налбандян,
В.Б. Задачник по химии твёрдого тела с примерами решений [Текст]: учеб. пособие
/ В.Б. Налбандян, Е.А. Кандюшева. - Ростов-на-Дону: УПЛ ЮФУ (готовится к
печати).
. Беляев,
И.Н. Солевые расплавы в химии и технологии сложных оксидов. 1. Обменные реакции
солевых расплавов и сложных оксидов [Текст] / И.Н. Беляев, Т.Г. Лупейко, В.Б.
Налбандян // Ионные расплавы и твёрдые электролиты. - Киев: Наукова думка,
1986. - Вып. 1. - С. 1-13.
. Справочник
по плавкости систем из безводных неорганических солей. Т. 1. Двойные системы
[Текст] / Н.К. Воскресенская [и др.]. - М.-Л.: Изд-во АН СССР. - 1961. - 846 с.
. Третьяков,
Ю.Д. Твердофазные реакции [Текст]: монография / Ю.Д. Третьяков. - М.: Химия,
1978. - 360 с.
10.
Paulsen, J.M. Layered T2-, O6-, O2-, and P2-type A2/3[M1/3'2+M2/34+]O2 bronzes,
A = Li, Na; M' = Ni, Mg; M = Mn, Ti [Текст] / J.M. Paulsen, R.A. Donaberger, J.R. Dahn // Chem. Mater.
- 2009. - V. 12. - № 8. - P. 2257-2267.
11.
Налбандян, В.Б. Сравнение различных методик и источники ошибок определения
удельного сопротивления керамических катионных проводников на примере силикатов
натрия-РЗЭ [Текст] / В.Б. Налбандян, Л.И. Медведева, Н.Г. Судоргин, Б.С.
Медведев // Электрохимия. - 1993. - Т. 29. - № 11. - С. 1380-1387.
. Шукаев,
И.Л. Иммиттансная спектроскопия [Текст]: учеб. пособие / И.Л. Шукаев, А.А.
Поспелов. - Ростов-на-Дону: УПЛ ЮФУ (готовится к печати).
. Налбандян,
В.Б. Материалы литий-ионных аккумуляторов [Текст]: учеб. пособие / В.Б.
Налбандян, В.Е. Гутерман, Б.С. Медведев. - Ростов-на-Дону: УПЛ ЮФУ (готовится к
печати).
. Судоргин,
Н.Г. Методика количественного рентгенографического контроля электродных
процессов в герметичных ячейках. Восстановление b-молибдата циркония литием [Текст] / Н.Г. Судоргин,
В.Б. Налбандян // Электрохимия. - 2012. - Т. 28. - № 1. - С.122-123.