Единое уравнение состояния и термодинамические соотношения метана
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
федеральное государственное
автономное образовательное учреждение высшего образования
«Национальный исследовательский
Томский политехнический университет»
Институт ЭНИН
Кафедра ТПТ
Направление, специальность Физика и
техника низких температур
ОТЧЁТ
по научно-исследовательской практике
г. Томск, Томский Национальный
исследовательский политехнический университет
Введение
Метан
является основным компонентом природных газов большинства месторождений и
важным сырьевым источником химической промышленности, где его используют для
производства водорода, спиртов, синтетического каучука, ряда растворителей и
многих других продуктов.
В связи с современными требованиями к рабочим параметрам машин и
аппаратов химических производств, вызванными стремлением к интенсификации
химических реакций и тепло- и массообмена, для расчета этих машин и
совершенствования технологических процессов переработки метана необходимы
данные о его термодинамических свойствах при высоких температурах и давлениях.
Для проектирования аппаратуры, предназначенной для очистки метана, и при
использовании его в качестве рабочего вещества в технике глубокого холода нужны
подробные и точные данные о его термических и калорических свойствах при низких
температурах, в том числе о свойствах жидкой фазы.
Развитие транспортирования природного газа по гигантским трубопроводам и
увеличение межгосударственных перевозок сжиженного метана на морских
судах-газовозах заставляют по-новому подойти к вопросу о точности измерения
массового расхода газа и жидкости при низких температурах и высоких давлениях.
Решение этой народнохозяйственной задачи существенно облегчается при
использовании точных данных о термодинамических свойствах метана.
Еще одним важным моментом является совершенствование методов
проектирования химических производств, широкое внедрение ЭВМ в практику
проектных проработок, что позволяет производить сложные вариантные расчеты. В
этих условиях возрастает влияние точности информации о термодинамических
свойствах рабочего вещества на точность результатов расчета и появляется
насущная потребность в оценке достоверности справочных данных о различных
свойствах при тех или иных параметрах состояния.
Таким образом, для удовлетворения запросов современной техники необходимы
надежные сведения о термодинамических свойствах газообразного и жидкого метана
в широких интервалах давлений как при низких, так и при высоких температурах.
По мере накопления экспериментального материала рядом авторов предложены
таблицы термодинамических свойств метана. Некоторые из этих таблиц,
естественно, устарели, но даже в наиболее новых таблицах погрешности
табулированных величин оценивались недостаточно строго.
При описании опытных данных о термических и калорических свойствах метана
применяют методику составления единого уравнения состояния газа и жидкости,
проверенную ранее по данным для ряда веществ. Методика была усовершенствована,
что позволило более эффективно получить серии уравнений, эквивалентных по
точности описания исходной экспериментальной информации. Эти уравнения
использованы для составления единого уравнения состояния, расчета таблиц
свойств и оценки допусков.
Цель: численное исследование процессов
тепло- и массообмена в теплообменниках-испарителях и/или конденсаторах в
условиях теплопритока с учетом реальных свойств рабочего тела.
Задачи:
. Формулировка математической модели для описания процессов тепло-
и массообмена в теплообменниках-испарителях и/или конденсаторах в условиях
теплопритока с учетом реальных свойств рабочего тела.
. Создание программного комплекса для математического
моделирования процессов тепло- и массообмена в теплообменниках-испарителях
и/или конденсаторах в условиях теплопритока с учетом реальных свойств рабочего
тела.
. Проведение теоретического исследования процессов тепло- и
массообмена в теплообменниках-испарителях и/или конденсаторах в условиях
теплопритока с учетом реальных свойств рабочего тела.
Единое
уравнение состояния и термодинамические соотношения для метана
Дифференциальные связи используются для калорических и термических
параметров и есть определенные связи, которые ставят соответствия между ними. В
уравнение состояния (2.1) можно включить эти связи. Как в работе 6, считаем
молярную энергии Гельмгольца А как сумму идеальных и остаточных членов:
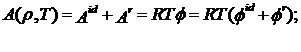 (2.1)
(2.1)
где А
- молярная энергия Гельмгольца, Дж/моль;
R
- газовая постоянная, Дж/(моль·К);
Т - температура, К;
ϕ - приведенная энергия Гельмгольца;
id -
идеальный газ;
r - реальный
газ.
С
определением δ
= ρ/ρс и τ = Тс/Т, остаточные члены становятся
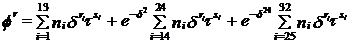 (2.2)
(2.2)
и
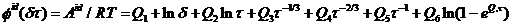 (2.3)
(2.3)
где δ - приведенная плотность;
τ - приведенная температура;
ρс -
критическая плотность, моль/м3;
Тс - критическая температура, К;
ri -
экспонента от δ;
si -
экспонента от τ;
Qi -
коэффициенты приведенной энергии для идеального газа.
Таблица
1. Экспоненты и коэффициенты для остаточной свободной энергии ϕr
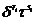 1
1
.5
.5
.5
.5
.5
.38443609966
.7969259880
.32944494737
.022631272844
.075923676880
.069375844726
.024116326395
.010700992085
.038093327516
.00047153756114
.00055660767881
.00000054875934653
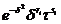 14
14
.5
.5
.5
.5
.5-0.12808797928
.038019887338
.13922665055
.0033489416576
.051757629712
.025283517912
.00051870320595
.0016677059452
.00060740192739
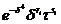 25
25
-0.000029884401046
.013094011124
.019817583380
.020846576233
.035802505263
.20348685174
.21596475509
Таблица 2. Коэффициенты для свободной энергии идеального газа
|
Q0
|
Q1
|
Q2
|
Q3
|
|
-15.479844
|
-10.413865
|
2.5998324
|
-3.3854083
|
|
Q4
|
Q5
|
Q6
|
Q7
|
|
1.6900979
|
-0.3911541
|
4.7206715
|
-10.543907
|
Таблица 3. Коэффициенты, необходимые для расчета производных для
идеального газа
|
ϕd
|
δϕδid (=1)
|
τϕτid
|
δ2ϕδδid
(=-1)
|
τ2ϕττid
|
|
1
|
Q1
|
1
|
Q2
|
-1
|
-Q2
|
|
lnδ
|
1
|
0
|
0
|
0
|
0
|
|
lnτ
|
Q2
|
0
|
0
|
0
|
0
|
|
τ-1/3
|
Q3
|
0
|
-Q3/3
|
0
|
4Q3/9
|
|
τ-2/3
|
Q4
|
0
|
-2Q4/3
|
0
|
10Q4/9
|
|
τ-1
|
0
|
-Q5
|
0
|
2Q5
|
|
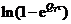 Q60000 Q60000
|
|
|
|
|
|
|
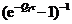 00-Q6Q7τ00 00-Q6Q7τ00
|
|
|
|
|
|
|
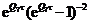 0000-Q6Q72τ2 0000-Q6Q72τ2
|
|
|
|
|
|
Таблица 4. Коэффициенты, необходимые для расчета производных для
реального газа
|
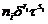 (i=1…13) (i=1…13)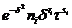 (i=14…24)(i=25…32) (i=14…24)(i=25…32)
|
|
|
|
ϕr
|
1
|
1
|
1
|
|
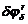 riri
- 2δ2ri - 4δ4 riri
- 2δ2ri - 4δ4
|
|
|
|
|
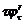 sisi sisi
|
|
|
|
|
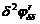 ri(ri - 1)(ri(ri - 1)-2(2ri+1)δ+4δ4)(ri(ri - 1)-4(2r+3)δ4+16δ8) ri(ri - 1)(ri(ri - 1)-2(2ri+1)δ+4δ4)(ri(ri - 1)-4(2r+3)δ4+16δ8)
|
|
|
|
|
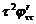 si (si - 1)si (si - 1)si (si - 1) si (si - 1)si (si - 1)si (si - 1)
|
|
|
|
|
 ri sisi (ri - 2δ2)si
(ri - 4δ4) ri sisi (ri - 2δ2)si
(ri - 4δ4)
|
|
|
|
Используя производные от уравнения (2.1) получаем из них соотношения
между термическими параметрами. В данном случае берется энергия Гельмгольца и
определяется через RT и функцию
идеального газа и добавки к реальному.
Мы можем взять критические параметры для метана и в чистом виде получится
зависимость Т, ρ и функции для идеального и реального газов.
Если подобрать некий вид функций (промежуточных) идеальных с учетом
реальных, можно легко аппроксимировать вот эти потенциалы в достаточно широком
диапазоне изменения параметров. Взяв от них производные, например аналитически,
можно найти реальные зависимости между параметрами.
Как получается энергия Гельмгольца? Подставив функции в уравнения и
получаем, например:
давление
 (2.4)
(2.4)
внутренняя
энергия
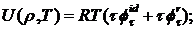 (2.5)
(2.5)
энтальпия
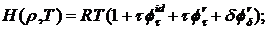 (2.6)
(2.6)
энтропия
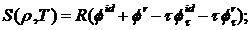 (2.7)
(2.7)
изохорная
теплоемкость
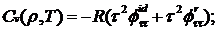 (2.8)
(2.8)
изобарная
теплоемкость
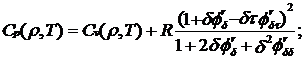 (2.9)
(2.9)
Аппроксимировав
эти функции, практически можно построить всю таблицу, то есть возможность
аппроксимировать в широком диапазоне данные по метану. Расчет можно вести либо
через уравнение энергии, либо изменением внутренней энергии или энтальпии. В
итоге должен быть такой математический аппарат, в котором определяется
суммирование по этим компонентам от δ, τ, а потом от этих функций комбинировать ϕ или с
помощью ϕ или производной от ϕ, и в следствии получатся все
необходимые параметры.
Листинг 1
diss;Tkr=190.551;Rokr=0.010139;Pkr=459920;Mr=16.043;RR=8.314;Q0=-15.479844;Q1=-10.413865;Q2=2.5998324;Q3=-3.3854083;Q4=1.6900979;Q5=-0.3911541;Q6=4.7206715;Q7=-10.543907;e=2.71;T,r,tau,del,Ru,P,u,h,G,A,Entr,Cv,Cp,i,Ro,s,dbr,dbr1,dbr2,dbr3,dbr4,dbr5,dbi,dbi1,dbi2,dbi3,dbi4:real;('vvedite
T');(T);('vvedite
Ro');(Ro);:=Ro/Rokr;:=exp(del);:=exp(tau);:=Tkr/T;:=RR/Mr;:=Q1+Ln(del)+Ln(tau)*Q2+power(tau,-1/3)*Q3+power(tau,-2/3)*Q4+1/tau*Q5+Ln(1-power(e,Q7*tau))*Q6;:=1;:=Q2+power(tau,-1/3)*(-Q3)/3+power(tau,-2/3)*(-2)*Q4/3+1/tau*(-Q5)+1/(power(e,(-Q7)*tau)-1)*(-Q6)*Q7*tau;:=-1;:=(-Q2)+power(tau,-1/3)*4*Q3/9+power(tau,-2/3)*10*Q4/9+1/tau*2*Q5+1/sqr(power(e,Q7*tau)*(power(e,(-Q7)*tau)-1))*(-Q6)*sqr(Q7)*sqr(tau);:=Ro*Ru*T*(1+dbr1);:=Ru*T*(dbi2+dbr2);:=Ru*T*(1+dbi2+dbr2+dbr1);:=Ru*T*(1+dbi+dbr+dbr1);:=Ru*T*(dbi+dbr);:=(-Ru)*(dbi+dbr-dbi2-dbr2);:=(-Ru)*(dbi4+dbr4);:=Cv+Ru*(sqr(1+dbr1-dbr5)/(1+2*dbr1-dbr3));;(T>=0)
and (T<=210) then:=1;:=r;:=s;:=r*(r-1);:=s*(s-1);:=r*s;(T>=220) and
(T<=320) then:=1;:=r-2*sqr(del);:=P;:=r*(r-1)-2*(2*r+1)*sqr(del)+4*sqr(sqr(del));:=s*(s-1);:=s*(r-2*sqr(del));(T>=330)
and (T<=400)
then:=1;:=r-4*sqr(sqr(del));:=s;:=r*(r-1)-4*(2*r+3)*sqr(sqr(del))+16*sqr(sqr(sqr(del)));:=s*(s-1);:=s*(r-4*sqr(sqr(del)));('del=',
del);('r=', r);('s=', s);('tau=', tau);('Dbr=',dbr);('Dbr1=', dbr1);('Dbr2=',
dbr2);('Dbr3=', dbr3);('Dbr4=', dbr4);('Dbr5=', dbr5);('Dbi=',dbi);('Dbi1=',
dbi1);('Dbi2=', dbi2);('Dbi3=', dbi3);('Dbi4=', dbi4);('P=',P);('u=', u);('h=',
h);('G=', G);('A=', A);('Entr=',Entr);('Cv=', Cv);('Cp=', Cp);.
Заключение
Существуют пакеты программ, в которых представлены методы расчета и форма
представления реальных газов, но с помощью этих программ невозможно рассчитать
течение в трубе. В связи с этим ведется работа по созданию математического
аппарата для формулировки задач. Используя формулы и таблицы, вместе с
соответствующим уравнением для свободной энергии идеального газа и, все
термодинамические свойства метана могут быть оценены с помощью стандартных
термодинамических соотношений.
Список
литературы
1. Пасконов В.М., Полежаев В.И, Чудов Л.А. Численное
моделирование процессов тепло- и массообмена. - М.: Наука, 1984 - 310 с.
2. Вассерман А.А. О составлении единого уравнения
состояния для газа и жидкости с помощью ЭВМ. - Теплофизические свойства веществ
и материалов/ГСССД, 1976, вып. 10, с. 7 - 34
. Спиридонов Г.А., Козлов А.Д., Сычев В.В. Определение
термодинамических функций газов по данным pvT - измерений методом математического эксперимента на
ЭЦВМ. - Теплофизические свойства веществ и материалов/ГСССД, 1976, вып. 10, с.
35 - 53
. В.В. Сычев, А.А. Вассерман, В.А. Загорученко, А.Д.
Козлов, Г.А. Спиридонов, В.А. Цымарный. Термодинамические свойства метана:
ГСССД. - М.: Издательство стандартов, 1979, - 348с.
. Санду С.Ф. Математическое моделирование процессов
переноса тепла и массы в испарительно-конденсационных системах теплопередачи
энергетических установок. - Известия Томского политехнического университета,
2003, вып. 4, с. 60 - 63
6. Daniel G. Friend, James F. Ely, and Hepburn
Ingharn. Thermophysical properties of methane. - National Institute of
standards and technology, Boulder, Colorado, 1988
7. Барилович В.А., Смирнов Ю.А. Основы технической
термодинамики и теории тепло- и массообмена: Учебное пособие. - М.: ИНФРА-М,
2014. - 432с.