Метод клонального микроразмножения в декоративном растениеводстве
Учреждение образования
«БЕЛОРУССКИЙ
ГОСУДАРСТВЕННЫЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ»
Факультет
лесохозяйственный
Кафедра
ландшафтного проектирования и садово-паркового строительства
Специальность
1-75 81 01
«Ландшафтное
проектирование и строительство»
РЕФЕРАТ
по
дисциплине «Интенсивное ведение отрасли садоводства и декоративного
растениеводства»
Тема «Метод
клонального микроразмножения в декоративном растениеводстве»
Исполнитель:
магистрант М.В. Козлова
Руководитель
кандидат
с.-х. наук
ст.
преподаватель каф. ЛП и СПС
С.А.
Праходский
Минск
2015
Введение
Одна из особенностей живых организмов -
способность к размножению. Существует два основных способа размножения: половое
и бесполое. Для каждого из них характерно значительное разнообразие форм.
Половое - это размножение, при котором новый организм развивается из зиготы,
образующейся в результате оплодотворения, т. е. слияния ядер мужской и женской
половых клеток.
Вегетативное размножение - образование нового
организма из части материнского. Таким образом могут размножаться
микроорганизмы, почти все растения и некоторые животные (губки, мшанки,
кишечнополостные, простейшие).
Бесполое размножение - характеризуется
отсутствием полового процесса; такое размножение свойственно одноклеточным и
многоклеточным растительным и животным организмам.
Термин «клон» (по гречески klon - черенок) был
предложен в 1903 г А. Веббером для вегетативно размножаемых растений. Он
установил, что отпрыски растения, размножаемого неполовым путем, лишь части
(клоны) материнской особи, идентичные как с ней, так и между собой.
Клонирование подразумевает организмы, полученные из единичных клеток
посредством митотических делений [1].
Достижения в области культуры клеток и тканей
привели к созданию принципиально нового метода вегетативного размножения -
клонального микроразмножения. В основе метода лежит уникальная способность
растительной клетки реализовывать присущую ей тотипотентность, т. е. под
влиянием экзогенных воздействий давать начало целому растительному организму.
Главное предназначение системы производства
посадочного материала создание долголетних, ежегодно плодоносящих, удобных в
эксплуатации, быстро окупающихся и стабильно приносящих прибыль, адаптированных
к местным природно-климатическим и рыночным условиям насаждений плодовых и
ягодных культур. Известно, что потребность растениеводства в посадочном
материале в последние 10-15 лет увеличивается, кроме того, в последнее время
возросла потребность в оздоровленном посадочном материале, что связано с
широким распространением вирусных, фитоплазменных и грибных заболеваний. Однако
в полевых условиях не существует эффективных приемов массового оздоровления
многолетних растений. В настоящее время в ряде стран Европы и Америки уже
невозможно представить систему производства оздоровленного посадочного
материала без широкого использования методов культуры изолированных тканей.
Применение биотехнологических приемов позволяет:
) получить посадочный материал, свободный от
грибных, фитоплазменных и вирусных заболеваний, за короткое время и в
достаточном количестве;
) быстро размножить ценный клон растения (сорт);
) получить в большом количестве вегетативное
потомство трудноразмножаемых в обычных условиях сортов и форм растений;
) работать в лабораторных условиях круглый год и
планировать выпуск растений к определенному сроку;
) длительно сохранять растительный материал в
условиях in vitro, а также обменивать его в международном масштабе без риска
заражения карантинными вредителями и болезнями;
) получать растения с измененной плоидностью и
трансгенные растения.
Сейчас технологии клонального микроразмножения
in vitro на лабораторном уровне разработаны в мире более чем для 2400 видов
растений. Однако коммерческих лабораторий, использующих эти приемы,
относительно немного, не считая тех, которые занимаются орхидеями. Это
объясняется отчасти тем, что не все, разработанные в сугубо лабораторных
условиях методики, применимы непосредственно в производстве. Часто требуется
решение отдельных узловых моментов для конкретных видов растений. Немаловажным является
и вопрос экономической эффективности.
Область применения микроразмножения разнообразна
и имеет тенденцию постоянно расширяться. Это в первую очередь относится к
размножению in vitro картофеля, плодовых, ягодных, декоративных, лесных
растений [2].
1. Сущность, основные преимущества клонального
микроразмножения, области его применения
Микроклональное размножение растений -
один из способов вегетативного размножения в условиях «in vitro».
Для семенных растений
<https://ru.wikipedia.org/wiki/%D0%A1%D0%B5%D0%BC%D0%B5%D0%BD%D0%BD%D1%8B%D0%B5_%D1%80%D0%B0%D1%81%D1%82%D0%B5%D0%BD%D0%B8%D1%8F>
характерно два способа размножения
<https://ru.wikipedia.org/wiki/%D0%A0%D0%B0%D0%B7%D0%BC%D0%BD%D0%BE%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5>:
семенной
<https://ru.wikipedia.org/w/index.php?title=%D0%A1%D0%B5%D0%BC%D0%B5%D0%BD%D0%BD%D0%BE%D0%B5_%D1%80%D0%B0%D0%B7%D0%BC%D0%BD%D0%BE%D0%B6%D0%B5%D0%BD%D0%B8%D0%B5&action=edit&redlink=1>
и вегетативный. Оба эти способа имеют как преимущества, так и недостатки. К
недостаткам семенного размножения следует отнести, в первую очередь,
генетическую пестроту получаемого посадочного материалa
<https://ru.wikipedia.org/w/index.php?title=%D0%9F%D0%BE%D1%81%D0%B0%D0%B4%D0%BE%D1%87%D0%BD%D1%8B%D0%B9_%D0%BC%D0%B0%D1%82%D0%B5%D1%80%D0%B8%D0%B0%D0%BB&action=edit&redlink=1>
и длительность ювенильного периода
<https://ru.wikipedia.org/w/index.php?title=%D0%AE%D0%B2%D0%B5%D0%BD%D0%B8%D0%BB%D1%8C%D0%BD%D1%8B%D0%B9_%D0%BF%D0%B5%D1%80%D0%B8%D0%BE%D0%B4&action=edit&redlink=1>.
При вегетативном размножении сохраняется генотип
<https://ru.wikipedia.org/wiki/%D0%93%D0%B5%D0%BD%D0%BE%D1%82%D0%B8%D0%BF>
материнского растения и сокращается продолжительность ювенильного периода.
Однако для большинства видов <https://ru.wikipedia.org/wiki/%D0%91%D0%B8%D0%BE%D0%BB%D0%BE%D0%B3%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B9_%D0%B2%D0%B8%D0%B4>
(в первую очередь для древесных пород
<https://ru.wikipedia.org/w/index.php?title=%D0%94%D1%80%D0%B5%D0%B2%D0%B5%D1%81%D0%BD%D1%8B%D0%B5_%D0%BF%D0%BE%D1%80%D0%BE%D0%B4%D1%8B&action=edit&redlink=1>)
проблема вегетативного размножения остается до конца не решенной. Это
обусловлено следующими причинами:
не все породы, даже на ювенильной
стадии, могут размножаться вегетативным способом с требуемой эффективностью
(дуб <https://ru.wikipedia.org/wiki/%D0%94%D1%83%D0%B1>, сосна
<https://ru.wikipedia.org/wiki/%D0%A1%D0%BE%D1%81%D0%BD%D0%B0>, ель
<https://ru.wikipedia.org/wiki/%D0%95%D0%BB%D1%8C>, орехоплодные
<https://ru.wikipedia.org/w/index.php?title=%D0%9E%D1%80%D0%B5%D1%85%D0%BE%D0%BF%D0%BB%D0%BE%D0%B4%D0%BD%D1%8B%D0%B5&action=edit&redlink=1>
и др.);
практически невозможно с помощью
черенкования
<https://ru.wikipedia.org/w/index.php?title=%D0%A7%D0%B5%D1%80%D0%B5%D0%BD%D0%BA%D0%BE%D0%B2%D0%B0%D0%BD%D0%B8%D0%B5&action=edit&redlink=1>
размножать многие виды древесных пород в возрасте старше 10-15 лет;
не всегда удается получать
стандартный посадочный материал (возможность накопления и передачи инфекции);
трудоемкостью и сложностью операций
при размножении взрослых (древесных) растений с помощью прививок
<https://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B8%D0%B2%D0%B8%D0%B2%D0%BA%D0%B0_%28%D0%B1%D0%BE%D1%82%D0%B0%D0%BD%D0%B8%D0%BA%D0%B0%29>;
неэффективностью разработанных
технологий для получения достаточного количества генетически однородного
материала в течение года.
Обязательное условие клонального
микроразмножения - использование объектов, полностью сохраняющих генетическую
стабильность на всех этапах процесса, от экспланта до растений в поле. Такому
требованию удовлетворяют стеблевые апексы и пазушные почки органов стеблевого
происхождения, т. е. меристематические ткани. Их устойчивость к генетическим
изменениям, вероятно, связана с высокой активностью систем репарации ДНК, а
также негативной селекцией изменённых клеток.
Для получений клонов можно
использовать любую клетку, ткань или орган растения. Вызывая последовательно
дедифференцировку клеток экспланта и вторичную дифференцировку каллусных
клеток, можно добиться регенерации растения. Однако проще и удобнее
использовать для клонирования меристематические ткани, так как они обладают
генетической стабильностью и позволяют получать оздоровленные растения.
Реализовать тотипотентность in vitro можно индукцией в каллусных тканях или
культивируемых клетках цепи событий. Это образование меристематических очагов,
развитие на их основе стеблевых апексов; появление побегов, которые после
укоренения развиваются в целое растение (индукция побегов).
Метод микроклонального размножения,
несомненно, имеет ряд преимуществ перед существующими традиционными способами
размножения:
получение генетически однородного
посадочного материала;
освобождение растений от вирусов
<https://ru.wikipedia.org/wiki/%D0%92%D0%B8%D1%80%D1%83%D1%81> за счет
использования меристемной культуры <https://ru.wikipedia.org/wiki/%D0%9C%D0%B5%D1%80%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0>;
высокий коэффициент размножения
(105-106 - для травянистых
<https://ru.wikipedia.org/wiki/%D0%A2%D1%80%D0%B0%D0%B2%D1%8F%D0%BD%D0%B8%D1%81%D1%82%D1%8B%D0%B5_%D1%80%D0%B0%D1%81%D1%82%D0%B5%D0%BD%D0%B8%D1%8F>,
цветочных растений
<https://ru.wikipedia.org/w/index.php?title=%D0%A6%D0%B2%D0%B5%D1%82%D0%BE%D1%87%D0%BD%D1%8B%D0%B5_%D1%80%D0%B0%D1%81%D1%82%D0%B5%D0%BD%D0%B8%D1%8F&action=edit&redlink=1>,
104-105 - для кустарниковых <https://ru.wikipedia.org/wiki/%D0%9A%D1%83%D1%81%D1%82%D0%B0%D1%80%D0%BD%D0%B8%D0%BA%D0%B8>
древесных, 104 - для хвойных
<https://ru.wikipedia.org/wiki/%D0%A5%D0%B2%D0%BE%D0%B9%D0%BD%D1%8B%D0%B5_%D1%80%D0%B0%D1%81%D1%82%D0%B5%D0%BD%D0%B8%D1%8F>);
сокращение продолжительности
селекционного процесса
<https://ru.wikipedia.org/wiki/%D0%A1%D0%B5%D0%BB%D0%B5%D0%BA%D1%86%D0%B8%D1%8F>
и возможность размножить уникальные формы за 2 - 3 года вместо 10-12 лет,
необходимых при обычных подходах;
ускорение перехода растений от
ювенильной к репродуктивной
<https://ru.wikipedia.org/wiki/%D0%A0%D0%B5%D0%BF%D1%80%D0%BE%D0%B4%D1%83%D0%BA%D1%82%D0%B8%D0%B2%D0%BD%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0>
фазе развития;
размножение растений, трудно
размножаемых традиционными способами;
возможность проведения работ в
течение года и экономия площадей, необходимых для выращивания посадочного
материала
возможность автоматизации процесса
выращивания
[4].
сохрание редких видов растений
орхидеи <#"864716.files/image001.gif">
Рисунок 1 - Активация развития уже существующих
в растении меристем, основывающаяся на снятии апикального доминирования: 1
-снятие апикального доминирования и последующее микрочеренкование побега in
vitro на безгормоналыюй среде; 2 - индуцированное развитие многочисленных
пазушных побегов под действием веществ цитокининового типа действия
Этого можно достичь двумя путями: а) удалением
верхушечной меристемы стебля и последующим микрочеренкованием побега in vitro
на безгормональной среде; б) добавлением в питательную среду веществ
цитокининового типа действия, индуцирующих развитие многочисленных пазушных
побегов. Как правило, в качестве цитокининов используют 6-бензиламинопурин
(БАП) или 6-фурфуриламинопурин (кинетин) и зеатин.
Полученные таким образом побеги отделяют от
первичного экспланта и вновь самостоятельно культивируют на свежеприготовленной
питательной среде, стимулирующей пролиферацию пазушных меристем и возникновение
побегов более высоких порядков.
Часто в качестве экспланта используют верхушечные
или пазушные почки, которые изолируют из побега и помещают на питательную среду
с цитокининами. Образующиеся пучки побегов делят, при необходимости черенкуют и
переносят на свежую питательную среду. После нескольких пассажей, добавляя в
питательную среду ауксины, побеги укореняют in vitro.
В настоящее время этот метод широко используется
в производстве безвирусного посадочного материала сельскохозяйственных культур,
таких как технические (сахарная свекла, хмель, табак, топинамбур, стахис) и
овощные (томаты, картофель, огурец, перец, тыква, спаржа и др.), а также для
размножения культур промышленного цветоводства (гвоздика, хризантема, роза,
гербера), тропических и субтропических растений (рододендрон, азалия, камелия,
чай и др.), плодовых и ягодных культур (яблоня, слива, вишня, груша, виноград,
малина, смородина, крыжовник и др.) и древесных растений (тополь, ива, ольха,
береза, рябина, секвойя, туя, можжевельник и др.)
Для некоторых культур, таких как картофель,
технология клонального размножения поставлена на промышленную основу.
Применение метода активации развития существующих меристем позволяет получать
из одной меристемы картофеля более 100000 растений в год, причем технология
предусматривает получение в пробирках микроклубней - ценного безвирусного семенного
материала [3-5].
Второй метод - индукция возникновения
адвентивных почек непосредственно тканями экспланта. Он основан на способности
изолированных частей растения при благоприятных условиях питательной среды
восстанавливать недостающие органы и таким образом регенерировать целые
растения. Можно добиться образования адвентивных почек почти из любых органов и
тканей растения (изолированного зародыша, листа, стебля, семядолей, чешуек и
донца луковиц, сегментов корней и зачатков соцветий). Этот процесс происходит
на питательных средах, содержащих цитокинины в соотношении с ауксинами 10:1 или
100:1. В качестве ауксина используют ИУК или НУК.
Это наиболее распространенный метод
микроразмножения высших растений, которым были размножены многие луковичные цветочные
растения (нарциссы, лилии, гиацинты, гладиолусы, тюльпаны) из луковичных чешуи,
сегментов базальной части донца луковиц, эксплантов листьев; представители рода
Бразика (капуста цветная, кочанная, брюссельская, листовая, брокколи) - из
сегментов гипокотиля, котиледона, листьев; лук, чеснок - из верхушечной
меристемы, ткани донца луковиц; томаты - из апикальных или пазушных меристем;
салат цикорный - из сегментов листовых пластинок; петуния - из сегментов
корней; глоксиния, сенполия, стрептокарпус, эшинапсус - из сегментов листовых
пластинок, а также некоторые представители древесных растений - из
изолированных зрелых и незрелых зародышей.
Несомненный интерес
вызывает вопрос, связанный с происхождением адвентивных почек, в частности,
какие клеточные слои участвуют в дифференциации меристем. Единого мнения по
этому вопросу пока нет. Так, Тран Тан Ван в своих работах с тканями табака
установила, что именно эпидермис является наиболее активной тканью, способной
образовывать почки, каллус или корни в зависимости от гормонального баланса
питательной среды.
Цитологические исследования, проведенные на
сегментах базальной части донца луковиц тюльпанов и нарциссов, показали, что
адвентивные побеги формируются из поверхностных слоев меристематических клеток,
прилегающих к донцу, а для растений глоксинии, сенполии и стрептокарпуса
процесс формирования адвентивных почек, как правило, происходит в
субэпидермальных клеточных слоях листовых пластинок.
Единого мнения по этому вопросу также нет и
среди исследователей, работающих с древесными растениями. Так, Арнольд и
Эрихсон, Джонсон и Борнмап считают, что образование почек на изолированной хвое
ели обыкновенной под действием БАП и 2ip происходит в эпидермальном слое
культивируемого экспланта, по мнению Чин и Ченга, для псевдотсуги - в
субэпидермальных слоях; а Вилалобос и другие утверждают, что при
культивировании семядолей сосны замечательной на среде, содержащей один
цитокинин, этот процесс происходит одновременно в эпидермальном и
субэпидермальном слоях. Для сосны обыкновенной также было отмечено образование
адвентивных почек в эпидермальном и субэпидермальном слоях семядолей зародыша.
Этот процесс для сосны не зависит от применяемых цитокининов [3-5].
Третий метод, практикуемый при клональном
микроразмножении, основывается на дифференциации из соматических клеток
зародышеподобных структур, которые по своему виду напоминают зиготические
зародыши. Этот метод получил название соматического эмбриогенеза. В отличие от
развития in vivo, соматические зародыши развиваются асексуально вне
зародышевого мешка и по своему внешнему виду напоминают биполярные структуры, у
которых одновременно наблюдается развитие апикальных меристем стебля и корня.
Согласно Стеварду, соматические зародыши проходят 3 стадии развития:
глобулярную, сердцевидную, торпедовидную и в конечном итоге имеют тенденцию
развития в проросток.
Соматический эмбриогенез заключается в том, что
из соматических клеток растения (из каллусных клеток), на определенной
питательной среде могут формироваться зародышеподобные структуры - эмбриоиды.
Последовательно проходя определённые стадии развития, соматический эмбриоид
может превратиться в проросток, то есть в полностью сформированное растение.
Это позволяет исключить этап ускорения, что облегчает и ускоряет процесс клонирования.
Наиболее впечатляющим применением метода
соматического эмбриогенеза стало размножение гвинейской масличной пальмы
(Elaeis guineensis), масло которой широко используется при производстве
маргарина и пищевого масла. Масличная пальма в природе не образует побегов и
боковых ростков, что затрудняет ее вегетативное размножение. Культивирование
черенков in vitro также невозможно. Было решено получить скопления клеток
недифференцированной ткани (каллусы) путем дедифференцировки специфических
тканей, а затем культивировать их до регенерации целых проростков. В первой
культуральной среде каллусы из фрагментов листьев развивались в течение 90
дней, при переносе во вторую и третью культуральные среды превращались в
"эмбриоиды". Эмбриоиды размножались самопроизвольно, в течение месяца
число эмбриоидов возрастало втрое, а за год из 10 эмбрионов можно было получить
потомство численностью 500000 растений.
Основное отличие образования зародышей in vitro
и in vivo (в естественных условиях) заключается в том, что соматические
зародыши развиваются асексуально вне зародышевого мешка и по своему внешнему
виду напоминают биполярные структуры, у которых одновременно наблюдается
развитие апикальных меристем стебля и корня. Согласно Стеварду, соматические
зародыши проходят три стадии развития: глобулярную, сердцевидную,
торпедо-видную и в конечном счете имеют тенденцию к развитию в проросток. Это
явление впервые было отмечено в культуре клеток моркови еще в середине 50-х
гг., а в настоящее время используется для размножения большинства растений из
семейства Orchidaceae и Rutaceae, а также для некоторых представителей злаковых
(пшеница, ячмень), люцерны, редиса, винограда и некоторых видов древесных пород
(осина, эвкалипт, дуб, ель обыкновенная) [7].
Формирование эмбриоидов в культуре тканей
происходит в два этапа. На первом этапе клетки экспланта дифференцируются за
счет добавления в питательную среду ауксинов, как правило,
2,4-дихлорфеноксиуксусной кислоты (2,4-Д) и превращаются в эмбриональные. Для
формирования эмбриоидов необходимо уменьшать концентрацию ауксина или полностью
его исключать из состава питательной среды.
Соматический эмбриогенез возможно наблюдать
непосредственно в тканях первичного экспланта, а также в каллусной культуре.
Причем последний способ менее пригоден при клональном микроразмножении, так как
посадочный материал, полученный таким методом, будет генетически нестабилен по
отношению к растению-донору. Как правило, соматический эмбриогенез происходит
при культивировании каллусных клеток в жидкой питательной среде (суспензии) и
является наиболее трудоемкой операцией.
Однако этот метод размножения имеет свои
преимущества, связанные с сокращением последнего (третьего) этапа клонального
микроразмножения, не требующего подбора специальных условий укоренения и
адаптации пробирочных растений, потому что соматические зародыши представляют
собой полностью сформированные растеньица. При использовании соответствующей
техники их капсулирования из этих эмбриоидов возможно получать искусственные
семена.
Четвертый метод клонального микроразмножения -
дифференциация адвентивных почек в первичной и пересадочной каллусной ткани Каллус
- неорганизованная, пролиферирующая масса дифференцированных растительных
клеток. Каллусная клетка (из которой получается каллусная ткань или каллус) -
один из типов клеток присущих высшему растению. Такая ткань возникает в
чрезвычайных обстоятельствах (при травмах) и функционирует непродолжительное
время.
По мере размножения каллусных клеток происходит
их дифференциация, которая зависит от ростовых веществ, добавляемых в
питательные среды. Дедифференциация - переход специализированных, неделящихся
клеток к пролиферации.
Практически он мало используется с целью
получения посадочного материала in vitro. Это связано с тем, что при периодическом
пересаживании каллусной ткани на свежую питательную среду часто наблюдаются
явления, нежелательные при микроразмножении: изменение плоидности
культивируемых клеток, структурные перестройки хромосом и накопление генных
мутаций, потеря морфогенетического потенциала культивируемыми клетками. Наряду
с генетическими изменениями отмечаются и морфологические: низкорослость,
неправильное жилкование листьев, образование укороченных междоузлий, пониженная
устойчивость к болезням и вредителям.
Однако, несмотря на некоторые недостатки, данный
метод имеет свои положительные стороны и преимущества.
Во-первых, он является эффективным и
экономически выгодным, так как в процессе размножения из каждой индивидуальной
каллусной клетки при определенных благоприятных условиях культивирования может
сформироваться адвентивная почка, дающая начало новому растению. Во-вторых, в
ряде случаев он является единственно возможным способом размножения растений в
культуре тканей. В-третьих, представляет большой интерес для селекционеров, так
как растения, полученные данным методом, отличаются генетически и
морфологически друг от друга. Это дает возможность селекционерам проводить
отбор растений по хозяйственно важным признакам и оценивать их поведение в
полевых условиях.
Этот метод целесообразно применять лишь к тем
растениям, для которых показана генетическая стабильность каллусной ткани, а
вариабельность между растениями-регенерантами не превышает уровня естественной
изменчивости.
К таким растениям можно отнести амариллис,
эписции, драцены, томаты, спаржу, некоторые древесные породы и другие культуры.
Кроме
того, в некоторых случаях он является единственно возможным способом
размножения растений в культуре тканей. Через каллусную культуру успешно
размножаются сахарная свекла, злаковые, представители рода , кукуруза, рис,
пшеница и другие злаковые, подсолнечник и другие культуры. Разработаны условия,
способствующие регенерации растений из каллуса огурца, картофеля, томатов.
Этапы клонального микроразмножения
Процесс клонального микроразмножения можно
разделить на четыре этапа:
. выбор растения-донора, изолирование эксплантов
и получение хорошо растущей стерильной культуры;
. собственно микроразмножение, когда достигается
получение максимального количества меристематических клонов;
. укоренение размноженных побегов с последующей
адаптацией их к почвенным условиям, а при необходимости депонирование
растений-регенерантов при пониженной температуре (+ 2°, + 10 °C);
. выращивание растений в условиях теплицы и
подготовка их к реализации или посадке в поле.
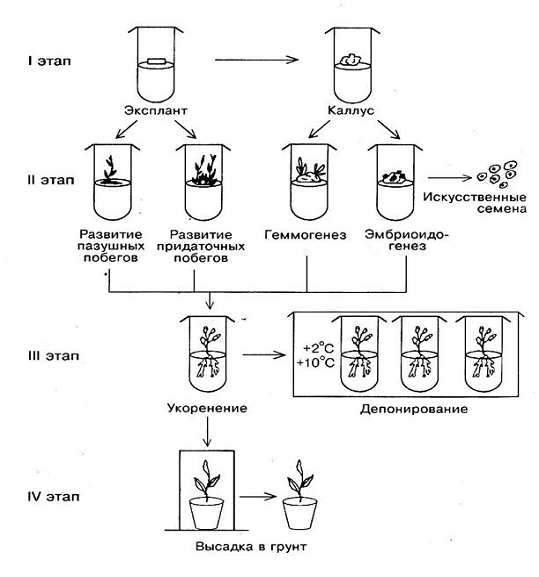
Рисунок 2: Схема клонального микроразмножения
растений: I путь -активация развития существующих меристем; II путь - индукция
возникновения адвентивных почек; 1 - выбор исходного экспланта; 2 - получение
стерильной культуры; 3 - образование адвентивных почек на первичном экспланте;
4 - рост почек и формирование микропобегов; 5 - размножение микропобегов; 6 -
укоренение микропобегов; 7 - депонирование растений-регенерантов; 8 -
акклиматизация растений к грунту; 9 - высадка регенерантов в поле
Для культивирования тканей на каждом из четырех
этапов требуется применение определенного состава питательной среды.
На первом этапе необходимо правильно выбрать
растение-донор, получить свободную от инфекции культуру, добиться её выживания
и быстрого роста на питательной среде. Это достигается путем получения хорошо
растущей стерильной культуры, в которой на эксплантах (кусочках листа)
формируется большое количество почек.
В тех случаях, когда трудно получить исходную
стерильную культуру экспланта, рекомендуется вводить в состав питательной среды
антибиотики (тетрациклин, бензилпенициллин и др.) в концентрации 100-200 мг/л.
Это в первую очередь относится к древесным растениям, у которых наблюдается
тенденция к накоплению внутренней инфекции.
На первом этапе, как правило, используют среду,
содержащую минеральные соли по рецепту Мурасига и Скуга, а также различные
биологически активные вещества и стимуляторы роста (ауксины, цитокинины) в
различных сочетаниях в зависимости от объекта. В тех случаях, когда наблюдается
ингибирование роста первичного экспланта, за счет выделения им в питательную
среду токсичных веществ (фенолов, терпенов и других вторичных соединений),
снять его можно, используя антиоксиданты. Это возможно двумя способами: либо
омывкой экспланта слабым его раствором в течение 4-24 ч, либо непосредственным
добавлением в питательную среду. В качестве антиоксидантов используют:
аскорбиновую кислоту (1 мг/л), глютатион (4-5 мг/л), дитиотриэтол (1-3 мг/л),
диэтилдитиокарбомат (2-5 мг/л), поливинилпирролидон (5000-10000 мг/л). В
некоторых случаях целесообразно добавлять в питательную среду адсорбент -
древесный активированный уголь в концентрации 0,5-1%. Продолжительность первого
этапа может колебаться от 1 до 2 месяцев, в результате которого наблюдается
рост меристематических тканей и формирование первичных побегов.
этап - собственно микроразмножение. На этом
этапе необходимо добиться получения максимального количества мериклонов,
учитывая при этом, что с увеличением субкультивирований увеличивается число
растений-регенерантов с ненормальной морфологией и возможно наблюдать
образование растений-мутантов. При размножении полученной культуры, почки
отделяют от экспланта и рассаживают на новую питательную среду, где побег
укореняется и растет.
Как и на первом этапе, используют питательную
среду по рецепту Мурасига и Скуга, содержащую различные биологически активные
вещества, а также регуляторы роста. Основную роль при подборе оптимальных
условий культивирования эксплантов играют соотношение и концентрация внесенных
в питательную среду цитокининов и ауксинов. Из цитокининов наиболее часто
используют БАП в концентрациях от 1 до 10 мг/л, а из ауксинов-ИУК и НУК в
концентрациях до 0,5 мг/л.
При долгом культивировании растительных тканей
на питательных средах с повышенным содержанием цитокининов (5-10 мг/л)
происходит постепенное накопление их в тканях выше необходимого
физиологического уровня, что приводит к появлению токсического действия и
формированию растений с измененной морфологией. Вместе с тем, возможно
наблюдать такие нежелательные для клонального микроразмножения эффекты, как
подавление пролиферации пазушных меристем, образование витрифицированных
(оводненных) побегов и уменьшение способности растений к укоренению.
Отрицательное действие цитокининов возможно преодолеть, по данным Н.В. Катаевой
и Р.Г. Бутенко, путем использования питательных сред с минимальной
концентрацией цитокининов, обеспечивающих стабильный коэффициент
микроразмножения, или путем чередования циклов культивирования на средах с
низким и высоким уровнем фитогормонов.
и 4 этапы - укоренение микропобегов, их
последующая адаптация к почвенным условиям и высадка в поле являются наиболее
трудоемкими этапами, от которых зависит успех клонального микроразмножения. На
третьем этапе, как правило, меняют основной состав среды: уменьшают в два, а
иногда и в четыре раза концентрацию минеральных солей по рецепту Мурасига и
Скуга или заменяют ее средой Уайта, уменьшают количество сахара до 0,5-1% и
полностью исключают цитокинины, оставляя один лишь ауксин. В качестве стимулятора
корнеобразования используют β-индолил-3-масляную
кислоту (ИМК), ИУК или НУК.
Укоренение микропобегов проводят двумя
способами:
) выдерживание микропобегов в течение нескольких
часов (2-24 ч) в стерильном концентрированном растворе ауксина (20-50 мг/л) и
последующее их культивирование на агаризованной среде без гормонов или
непосредственно в подходящем почвенном субстрате (импульсная обработка);
) непосредственное культивирование микропобегов
в течение 3-4 недель на питательной среде, содержащей ауксин в невысоких
концентрациях (1-5 мг/л в зависимости от исследуемого объекта). В последнее
время предложен метод укоренения пробирочных растений в условиях гидропоники.
Этот метод позволяет значительно упростить этап укоренения и одновременно
получать растения, адаптированные к естественным условиям. Для картофеля
возможно использовать безсубстратную гидропонику для получения мини-клубней.
Затенение нижней части культуральных сосудов плотной черной материей или
добавление в питательную среду активированного угля способствует укоренению
микропобегов.
. Выбор питательной среды и ее основные
компоненты
Успех в культивировании объектов зависит от
правильного выбора питательной среды и тщательности ее приготовления. В состав
питательных сред входят макро- и микроэлементы (N, P, K, Ca, S, Mg, Fe, B, Zn,
Cu, Co, Mn, J, Mo); витамины В1, В6, В12, РР и другие; углеводы (сахароза,
глюкоза, маннит); фитогормоны (чаще всего цитокинины и ауксины в определенном
соотношении). Ауксины вызывают клеточную дедифференцировку, цитокинины
индуцируют деление дедифференцированных клеток и необходимы для получения
каллусных тканей.
На средах без гормонов растут “привыкшие” и
опухолевые ткани. Для получения стеблевого морфогенеза снижают содержание
ауксинов. Из ауксинов чаще всего применяют 2,4-дихлорфеноксиуксусную кислоту
(2,4-Д) - 0.1-10 мг/л, нафтилуксусную кислоту (НУК) - 0.1-2 мг/л, ИУК - 1-30
мг/л. Для индукции каллусогенеза используют более высокие концентрации
ауксинов, в дальнейшем ткань может расти при более низком содержании ауксинов.
В качестве цитокининов используют кинетин, 6-бензиламинопурин (БАП), зеатин
(0.001-10 мг/л); из них кинетин наименее активен. В состав некоторых сред
входит аденин. Иногда используют гибберелловую кислоту (ГК). В качестве
ростактиваторов применяют также кокосовое молоко, дрожжевой экстракт,
гидролизат казеина и др.
Разработано много питательных сред, но
большинство из них представляют модификации основных: Мурасиге-Скуга (МС),
Уайта, Шенка-Хильдебрандта, Гамборга (В5), Линсмайера-Скуга, Хеллера, Чапека и
др. Составы питательных сред, получивших наибольшее распространение приведены в
таблицах 1 и 2 [8].
Таблица 1 - Среда Мурасиге-Скуга
|
Компоненты
|
Концентрация
солей в 1 литре готового маточного раствора, мг
|
Объем
маточного р-ра для приготовления 1 литра среды, мл
|
|
маточный
раствор макроэлементов
|
|
NH4NO3
|
33000
|
50
|
|
KNO3
|
38000
|
|
|
CaCl2
* 2H2O
|
8800
|
|
|
MgSO4
* 7H2O
|
7400
|
|
|
KH2PO4
|
3400
|
|
|
маточный
раствор микроэлементов
|
|
KJ
|
166
|
5
|
|
H3BO3
|
1240
|
|
|
MnSO4
* H2O
|
4460
|
|
|
ZnSO4
* 7H2O
|
1720
|
|
|
Na2MoO4
* 2H2O
|
50
|
|
|
CuSO4
* 5H2О
|
5
|
|
|
CoCl2
* 6H2O
|
5
|
|
|
маточный
раствор хелатного железа
|
|
FeSO4
* 7H2O
|
5560
|
5
|
|
Na2ЭДТА
* 2H2O
|
7460
|
|
|
витамины
и органические вещества
|
|
Мезоинозит
|
20000
|
5
|
100
|
|
|
Пиридоксин-HCl
|
100
|
|
|
Тиамин-HCl
|
100
|
|
|
Глицин
|
400
|
|
|
Добавлять
в виде порошка в среду перед варкой: Сахароза - 30 г/л; Агар-агар - 7 г/л рН
готовой среды - 5.6-5.8 * для получения стерильных проростков на 1 литр среды
берут 1/2 часть маточных растворов, т.е. вместо 50 мл раствора макроэлементов
берут 25 мл и т.д.
|
Таблица 2- Среда Гамборга (B5)
|
Компоненты
|
Концентрация
солей в 1 литре готового маточного раствора, мг
|
Объем
маточного р-ра, для приготовления 1 литра среды, мл
|
|
маточный
раствор макроэлементов
|
|
(NH4)2SO4
|
2680
|
50
|
|
KNO3
|
50000
|
|
|
CaCl2
* 2H2O
|
3000
|
|
|
MgSO4
* 7H2O
|
5000
|
|
|
NaH2PO4*H2O
|
3000
|
|
|
маточный
раствор микроэлементов
|
|
KJ
|
75
|
10
|
|
H3BO3
|
3300
|
|
|
MnSO4
* H2O
|
1000
|
|
|
ZnSO4
* 7H2O
|
200
|
|
|
Na2MoO4
* 2H2O
|
25
|
|
|
CuSO4
* 5H2О
|
25
|
|
|
CoCl2
* 6H2O
|
2.5
|
|
|
маточный
раствор хелатного железа
|
|
FeSO4
* 7H2O
|
5560
|
5
|
|
Na2ЭДТА
* 2H2O
|
7460
|
|
|
витамины
и органические вещества
|
|
Мезоинозит
|
10000
|
10
|
|
Никотиновая
кислота
|
100
|
|
|
Пиридоксин-HCl
|
100
|
|
|
Тиамин-HCl
|
1000
|
|
|
Добавлять
в виде порошка в среду перед варкой: Сахароза - 30 г/л; Агар-агар - 7 г/л рН
г.-ой среды - 5.5
|
Последовательность приготовления питательных
сред для растительных клеток.
Составление питательной среды начинают с
приготовления концентрированных (маточных) растворов. Для удобства готовят
маточные растворы, чтобы не взвешивать все необходимые соли всякий раз, когда
вздумается завести культуру. С другой стороны, концентрированные растворы менее
подвержены опасности быть съеденными микроорганизмами, которая существует даже
при хранении разбавленных растворов в холодильнике. Ведь соленые огурцы у вас
хранятся гораздо дольше, чем свежие.
Вторая причина, по которой готовят маточные
растворы - снижение погрешности при отмеривании необходимого количества солей.
Согласитесь, взвесить 5 граммов проще, чем 50 миллиграмов - во всяком случае
мерную емкость, которой потом можно будет отмерить 5, 10 или 20 миллилитров
найти проще, чем аналитические весы.
Обычно готовят несколько маточных растворов -
макроэлементы, хелатное железо, микроэлементы, хлористый кальций, витамины,
хранят их в отдельных колбах, а при приготовлении среды сливают в той последовательности,
в какой они перечислены выше. Делается это для того, чтобы при взаимодействии
солей не происходило образование осадка.
Макросоли взвешивают на технических весах,
растворяют по отдельности в небольшом количестве бидистиллята и доводят в
цилиндре до объема, в 10 меньшего, чем требуется по прописи среды, т.е. на 1
литр общего объема питательной среды берут 100 мл раствора макросолей. Иногда
эта пропорция изменяется, и концентрация увеличивается не в 10 раз, а более,
соответственно меняется и объем маточного раствора, который берется для
приготовления 1 литра питательной среды.
Например, если мы готовим 1 литр (1000 мл)
маточного раствора, увеличивая концентрацию солей в нем в 20 раз (масса навески
каждой соли * 20), то для приготовления среды берется 50 мл такого
концентрированного раствора (как в случае среды Мурасиге-Скуга). Таким образом,
в этим 1 литре маточного раствора у нас 20 порций по 50 мл для приготовления 20
сред (20*50=1000). Если концентрация увеличивается в 25 раз, то берется 40 мл и
т.д.
Навески микросолей для хелатного железа
растворяют по отдельности, смешивают и доводят до объема с конечной
концентрацией 50 мл/л. Раствор должен получится ярко-желтого цвета, рН 8.0.
Неправильное приготовление хелатного железа может привести к выпадению в осадок
после автоклавирования фосфатов кальция или магния.
Навески микроэлементов взвешивают на
аналитических весах, растворяют так, чтобы конечная концентрация
соответствовала 5 мл раствора на 1 литр готовой среды, то есть для
приготовления питательной среды мы будем брать по 5 миллилитров.
Полученные растворы сливают в склянки с
притертыми крышками, снабжают этикеткой и хранят в холодильнике.
Железо-хелатный комплекс хранят в темной склянке.
Витамины готовить несколько сложнее. Самая
большая проблема - правильно определить, сколько же граммов или миллиграммов
искомого вещества может содержать капсула с витамином. Обычно на коробочке
пишут 1%, 5%, 6% раствор тиамин-хлорида, никотиновой кислоты или другого
необходимого вам витамина. Это означает, что для его приготовления 1% раствора
было взято 1000 миллиграмм вещества, которые растворили в 100 мл воды.
Следовательно, каждый миллилитр этого раствора содержит 10 миллиграмов
витамина. Стандартная аптечная расфасовка - капсулы по 1 миллилитру. Значит, в каждой
капсуле содержится 10 миллиграммов витамина, если это 1% раствор, 50 мг - если
5%. Если вам требуется 10 миллиграммов определенного витамина, а вы имеете в
распоряжении капсулу объемом 1 мл, содержащую 50 мг вещества, то что вы
сделаете? Правильно - добавите содержимое этой капсулы в мерный цилиндр,
доведете объем до 50 мл (лучше всего вытянуть раствор из капсулы шприцем и
потом несколько раз промыть дистиллятом и шприц, и капсулу, сливая воду в
цилиндр, где вы производите разбавление. И уже разведенного раствора вы
возьмете 10 миллилитров. Витамины разливают по 5 мл в пенициллиновые флакончики
или пробирки, ставят в морозилку и хранят в замороженном виде.
Концентрированные растворы готовят с расчетом добавления 5 мл на 1 литр среды.
При составлении среды флакончик с витаминами достают из холодильника,
размораживают, опуская в горячую воду, и выливают в колбу с питательной средой.
Фитогормоны (ауксины и цитокинины) сначала
растворяют в 2 мл 96oC этилового спирта (или 0.1 н NaCl) и добавляют 98 мл
воды, доводя объем до 100 мл, хранят при температуре 2-4оС. Гиббереллин легко
растворим в воде.
Необходимую навеску агар-агара растворяют 300 мл
дистиллированной воды (можно при подогревании), добавляют сухие органические
компоненты, перемешивают.
С помощью мерного цилиндра и пипеток отбирают
маточные растворы макросолей, микроэлементов, хелатного железа, гормонов,
витаминов и переносят их в колбу на 1 литр с уже растворенным агаром, доводят
рН до необходимого значения с помощью 0.1 н NaOH или HCl.
Колбы или пробирки закрывают ватными пробками,
накрывают целлофаном и затягивают резинкой. Можно закрывать плотной фольгой
вместо пробок. Если нет целлофана, то перед автоклавированием пробирки или
колбы закрываются сверху крафтовой бумагой.
Автоклавированную среду, содержащую ауксины,
лучше использовать сразу; если среду необходимо хранить продолжительное время,
её помещают в холодильник при 2-4оС.
Некоторые фитогормоны, например гибберелловую
кислоту и зеатин, а также аминокислоты автоклавировать нельзя по причине их
термолабильности. В таких случаях среду готовят без этих веществ,
автоклавируют, охлаждают до 50оС, в стерильных условиях добавляют
термолабильный компонент, пропущенный через бактерицидный фильтр с размером пор
0.22 мкм, разливают по пробиркам и колбам [8].
Размножение растений клоновым способом может
производиться в отдельных шариках питательной среды.
Заводить и вести культуру растительных клеток
гораздо проще.
Растительные культуры поддерживают при
температурах от 22 до 27оС, в темноте или при освещении. Среды для них -
несложные, и их легко приготовить самому. Культивировать можно на твердых
питательных средах с добавлением агар-агара, крахмала или на жидких питательных
средах, с использованием мостиков из ваты и фильтровальной бумаги.
Когда проводили работы по селекции каллусов на
среде с ПЭГ (очень сильный осмотик, имитирующий засуху в этих экспериментах),
то столкнулись с проблемой - агар в присутствии высоких концентраций
полиэтиленгликоля не застывал после автоклавирования. Выход был найден - на дно
пробирок или баночек клали комочек ваты (рыхлый), сверху - вырезанный по
диаметру сосуда кусочек фильтровальной бумаги, заливали жидкой питательной
средой так, чтобы ее уровень не превышал 1 мм над поверхностью бумаги. Высота
столбика среды в пробирке диаметром 2 см - примерно 1-1,5 см, в баночке из под
детского питания - 0,5 см.
Суспензионные культуры растительных клеток
поддерживать гораздо сложнее - необходима мешалка для постоянного перемешивания
среды. Иначе эксплант погибнет, в первую очередь, от отсутствия доступа
кислорода.
Условия освещения различны в зависимости от
поставленных вами задач. Каллусную ткань обычно получают в темноте. Клональное
микроразмножение проводят при освещении. В качестве источника света лучше
пригодны лампы дневного света. Они не нагревают камеру и имеют более или менее
подходящий для растений спектральный состав света.
. Факторы, влияющие на процесс клонального
микроразмножения
На эффективность микроклонального размножения
влияет масса факторов различной природы. Это физиологические особенности
вводимого в культуру растения, химические и физические условия культивирования.
Наиболее важным моментом является выбор материнского растения и экспланта.
При выборе материнского растения необходимо
учитывать его физиологические, сортовые и видовые особенности. Исходные
растения должны быть здоровы, не поражены грибными, бактериальными и вирусными
болезнями. Кроме того, они должны находится в состоянии интенсивного роста
(выход из фазы покоя и переход к активному росту). Луковицы, корневища и клубни
в состоянии покоя непригодны, перед введением в культуру их предварительно
обрабатывают высокими или низкими температурами. Способность к размножению
также детерминирована генетически. Например, земляника размножается всеми
способами, облепиха - ни одним, хотя в природе черенкуется. Двудольные обладают
большей регенерационной способностью, чем однодольные и древесные.
При выборе экспланта необходимо учитывать его
возраст, строение и происхождение. Для обеспечения максимальной стабильности
клонируемого материала, во избежание появления аномальных растений в качестве
экспланта желательно использовать молодые, слабодифференцированные ткани. Кроме
того, экспланты от ювенильных растений лучше укореняются, чем от зрелых,
особенно это касается древесных пород. Лучше всего использовать кончики
стеблей, пазушные почки, зародыши, молодые листья, черенки, соцветия, чешую
луковиц, то есть экспланты, содержащие меристемы. Опыты с эмбрионами кукурузы,
проведенные Грином и Филипсом в 1975 году, показали, что при извлечении
эмбрионов из зрелых семян они образуют каллус и корни. Если же изолировать их
через 2 - 3 недели после опыления, то образуются и каллус, и растения.
Вероятно, это связано с разворачиванием генетической программы в онтогенезе
растения. Следует отметить, что не всегда молодые ткани являются удачным объектом
для размножения. У эхеверии на эксплантах из молодых листьев возникают только
корни, из старых - только побеги, из средних по возрасту - и побеги, и корни.
Чем меньше размер экспланта, тем меньше его регенерационная способность. С
другой стороны, в крупном экспланте увеличивается возможность появления в его
клетках вирусов и других патогенов, что препятствует оздоровлению тканей.
Длительность культивирования также влияет на
эффективность микроразмножения. Физиологическое состояние экспланта меняется в
течение пассажей, при длительном культивировании частота укореняемости побегов
возрастает. Возможно, что при этом эксплант приобретает признаки ювенильности,
что ведет к повышению его морфогенетического потенциала.
Успех введения в культуру часто определяется
эффективностью стерилизации. Выбор стерилизующего агента определяется
особенностями экспланта. Для нежных тканей концентрация стерилизующего агента
должна бать снижена, чтобы сохранить жизнеспособность экспланта. Часто
внутреннее заражение исходных эксплантов бывает намного сильнее, чем
поверхностное, поэтому экспланты предварительно обрабатывают фунгицидами и
антибиотиками против грибной и бактериальной инфекций. Хорошие результаты дает
обработка растений бензоатом натрия.
В зависимости от вида растений необходимо
испытывать как твердые, так и жидкие питательные среды. Иногда жидкие среды
имеют преимущество, так как обеспечивают большую подвижность трофических
элементов. Например, при размножении роз более успешным было культивирование
побегов на двухслойной питательной среде: нижний слой - агаризованный, верхний
- жидкий. На эффективность размножения могут также влиять расположение
экспланта (горизонтальное или вертикальное), тип пробок (ватные, пластмассовые,
стеклянные, металлические и т.д.), а также соотношение объема эксплантов и
количества питательной среды для оптимального освещения и газообмена
эксплантов.
Состав питательной среды необходимо подбирать
для каждого вида растений. На клональное микроразмножение влияют гормоны,
минеральные соли, витамины и углеводы. При микроразмножении in vitro часто
используют среды Мурасиге и Скуга, Линсмайера и Скуга, Шенка и Хильдебрандта,
Нича, Гамборга, Хеллера и другие. Обычно используют среду Мурасиге-Скуга,
которая содержит много неорганического азота, что стимулирует процессы
органогенеза и соматического эмбриогенеза. В наших экспериментах (Кузьмина
Н.А., Внукова В.В., 1997) выход морфогенных каллусов твердой пшеницы был выше
на среде Мурасиге-Скуга по сравнению со средой Гамборга, которая одержала
окисленные формы азота. Среда Мурасиге-Скуга также способствовала стабилизации
хромосомного набора клеток твердой пшеницы при высоком содержании ауксина в
среде. Вообще вопрос оптимального соотношения NH4 : NO3 остается открытым, так
как литературные данные весьма противоречивы и универсального рецепта для всех
видов растений нет. В качестве источника углеродного питания используют
различные углеводы типа сахарозы, глюкозы, фруктозы, галактозы. Разные культуры
требуют различной концентрации углеводов на разных этапах клонального
микроразмножения.
К физическим факторам выращивания относятся
температура и условия освещения. На первых двух этапах освещенность колеблется
от 1000 до 3000 Лк, фотопериод 14 - 16 часов, но эти параметры зависят от
культуры. Высокая интенсивность света может вызывать хлорозы и задерживать
развитие, но при переносе в почву эти растения чувствуют себя лучше и растут
энергичнее. Спектральный состав также играет немаловажную роль. Некоторые
исследователи (Катаева Н.В., Аветисов В.А, 1981) указывают на синий свет как
основной компонент морфогенеза. Красный свет стимулирует образование почек у
табака, у салата - образование побегов, у березы - укоренение. В работах Т.Н.
Константиновой с соавторами (1987) показано, что синий свет усиливает закладку вегетативных
почек у побегов табака в условиях in vitro , а красный стимулирует развитие
цветочных почек. Однако при добавлении цитокининов и ауксинов в различной
концентрации соотношение процессов дифференциации цветочных и вегетативных
почек меняется, в некоторых случаях наблюдается даже противоположный эффект. В
исследованиях Р. А. Карначук и Е. С. Гвоздевой (1998) наибольший выход
морфогенных каллусов пшеницы, формирующих растения и побеги, отмечен на зеленом
свету. Важное значение играет также сочетание спектрального состава света и
гормональных факторов среды.
Температура культивирования обычно варьирует в
интервале 22 - 26оС днем и 18 - 22оС ночью. В некоторых случаях понижение
температуры ведет к повышению эффективности размножения. Для повышения коэффициента
размножения необходимо каждому виду с учетом его естественного ареала
произрастания подбирать индивидуальные условия культивирования. Относительная
влажность воздуха - 65 - 70% [8]
. Адаптация растений к почвенным условиям
произрастания
Подготовка к высадке в поле (адаптация). Это
очень важный этап, во время которого в теплице ускоренно растущие растения,
полученные in vitro, адаптируют к новым условиям внешней среды: проводят их
закаливание, повышают устойчивость к местным патогенным микроорганизмам и
различным неблагоприятным факторам внешней среды.
Существует много различных способов
адаптирования растений к пересадке in vitro. Сюда входит: подбор почвенного
субстрата, создание определенной влажности, обработка химическими веществами
(глицерин, парафин) для предотвращения обезвоживания листьев. Некоторые
древесные растения лучше приживляются, если их заразить in vitro
микоризообразующими грибами. Чтобы укоренившиеся побеги адаптировались к
почвенным условиям, необходимо поддерживать определенную влажность («создание
тумана»), температуры и т. д.
Упрощенный способ адаптации пробирочных растений
винограда заключается в следующем:
Адаптация прямо в пробирках, снимая с них
пробки, когда растения винограда достают до верха пробирки.
Через 1,5-2 недели, когда верхушки побега с
двумя развитыми листьями появляются над пробиркой, растение готово к пересадке
в почву.
Пересадка растений-регенерантов в субстрат
является ответственным этапом, завершающим процесс клонального
микроразмножения. Наиболее благоприятное время для пересадки пробирочных
растений - весна или начало лета.
Растения с двумя-тремя листьями и хорошо
развитой корневой системой осторожно вынимают из колб или пробирок пинцетом с
длинными концами или специальным крючком. Корни отмывают от остатков агара и
высаживают в почвенный субстрат, предварительно простерилизованный при 85-90° С
в течение 1-2 ч. Для большинства растений в качестве субстратов используют
торф, песок (3:1); торф, дерновую почву, перлит (1:1:1); торф, песок, перлит
(1:1:1). Исключение составляют семейство орхидных, для которых готовят
субстрат, состоящий из сфагнового мха, смеси торфа, листьев бука или дуба,
сосновой коры (1:1:1).
Приготовленным заранее почвенным субстратом
заполняют пикировочные ящики или торфяные горшочки, в которых выращивают
растения-регенеранты. Горшочки с растениями помещают в теплицы с регулируемым
температурным режимом (20-22° С), освещенностью не более 5 тыс. лк и влажностью
65-90%. Для лучшего роста растений создают условия искусственного тумана. В тех
случаях, когда нет возможности создать такие условия, горшочки с растениями
накрывают стеклянными банками или полиэтиленовыми пакетами, которые постепенно
открывают до полной адаптации растений.
Через 20-30 дней после посадки хорошо
укоренившиеся растения подкармливают растворами минеральных солей Кнудсона,
Мурасига и Скуга, Чеснокова, Кнопа (в зависимости от вида растений) или
комплексным минеральным удобрением. По мере роста растений их рассаживают в
большие емкости со свежим субстратом. Дальнейшее выращивание
акклиматизированных растений соответствует принятой агротехнике выращивания для
каждого индивидуального вида растений.
Процесс адаптации пробирочных растений к
почвенным условиям является наиболее дорогостоящей и трудоемкой операцией.
Нередко после пересадки растений в почву наблюдается остановка в росте,
опадение листьев и гибель растений. Эти явления связаны, в первую очередь, с
тем, что у пробирочных растений нарушена деятельность устьичного аппарата,
вследствие чего происходит потеря большого количества воды. Во-вторых, у
некоторых растений в условиях in vitro не происходит образования корневых
волосков, что приводит, в свою очередь, к нарушению поглощения воды и
минеральных солей из почвы. Поэтому целесообразно на третьем или четвертом
этапах клонального микроразмножения применять искусственную микоризацию
растений (для микотрофных), учитывая их положительную роль в снабжении растений
минеральными и органическими питательными веществами, водой, биологически
активными веществами, а также в защите растений от патогенов.
Индийскими учеными предложен простой метод
предотвращения быстрого обезвоживания листьев растений, выращенных in vitro, во
время их пересадки в полевые условия. Метод заключается в том, что листья в
течение всего акклиматизационного периода следует опрыскивать 50%-ным водным
раствором глицерина или смесью парафина, или жира в диэтиловом эфире (1:1).
Применение этого метода помогает избежать длинных и затруднительных процессов
закаливания пробирочных растений и обеспечивает 100%-ную их приживаемость [8].
Для предотвращения механических повреждений
корневой системы растение пересаживают в почву вместе с агаром, заглубляя его
так, чтобы над поверхностью почвы оставались только развитые листы, которые
выросли из пробирки и уже адаптировались к внешним условиям. Такая методика
позволяет значительно упростить, ускорить и удешевить этапы роста, развития и
акклиматизации растений.
Адаптация винограда. Упрощенный дешевый способ
адаптации растений винограда, выращенных в стерильных условиях в пробирках, был
разработан в Институте физиологии растений им. К. А. Тимирязева РАН. Адаптацию
проводят прямо в пробирках. Когда растения дорастают до пробки, его вынимают из
пробирки. Через 1,5-2 недели, когда верхушки побегов появляются над пробирками,
растения пересаживают в почву.
. Применение клонального микроразмножения для
выращивания декоративных растений
Основное преимущество клонального
микроразмножения - получение генетически однородного, безвирусного посадочного
материала. Предположение о возможности отсутствия вирусов в меристематических
тканях больных растений впервые было высказано в 1936 г. Чунгом, а позднее, в
1943 г., и Уайтом. В 1949 г. этот факт был подтвержден экспериментально. В 1952
г. Морелю и Мартену из Национального агрономического института (Франция)
удалось получить безвирусные георгины из зараженных растений.
Структурной основой используемого на практике
явления служит специфика строения точки роста растений: дистальная ее часть,
представленная апикальной меристемой, у разных растений имеет средний диаметр
200 мкм и высоту от 20 до 150 мкм. В нижних слоях дифференцирующиеся клетки
меристемы образуют прокамбий, дающий начало пучкам проводящей системы.
Известно, что успех клонального микроразмножения
зависит от меристематического экспланта. При этом отмечается закономерность:
чем больше листовых зачатков и тканей, тем легче идут процессы морфогенеза,
заканчивающиеся образованием целого растения. Вместе с тем, при таком развитии
конуса нарастания увеличивается риск быстрой транспортировки вируса по
проводящей системе. Кроме того, даже небольшой меристематический эксплант может
содержать вирусы, проникшие в клетки в результате медленного распространения
через плазмодесмы.
В целом, эффективность применения апикальной
меристемы в качестве метода оздоровления зараженных вирусами растений может
оказаться довольно низкой. Снизить риск попадания вирусов в здоровые ткани
можно путем применения предварительной термо- или химиотерапии исходных
растений.
Метод термотерапии применяется как в условиях in
vivo, так и in vitro и предусматривает использование горячего сухого воздуха.
Для объяснения механизма освобождения растений от вирусов в процессе
термотерапии существуют различные гипотезы. Согласно одной их них при высоких
температурах разрушаются белковая оболочка и нуклеиновая кислота вируса. Вторая
гипотеза предполагает действие высоких температур на вирусы через метаболизм
растений. При такой температуре начинает преобладать деградация вирусных
частиц, а синтез их, наоборот, уменьшается. Растения, подвергающиеся
термотерапии, помещают в термокамеры, где температура в течение первой недели
повышается с 25 до 37оС путем ежедневного увеличения температуры на 2 градуса.
Все остальные режимы обязательно поддерживаются в оптимальном состоянии:
освещенность, высокая относительная влажность воздуха, определенный фотопериод.
Продолжительность термостатирования зависит от состава вирусов и их
термостойкости. Если для гвоздики достаточно 10 - 12 недельного воздействия
теплом, то для хризантемы этот период превышает 12 недель.
Помимо положительного действия высоких
температур на освобождение от вирусов, выявлено аналогичное влияние их на точку
роста и процессы морфогенеза некоторых цветочных культур (гвоздики, фрезии) в
условиях in vitro. Высокие температуры увеличивают коэффициент размножения на
50 - 60%, повышаю адаптацию пробирочных растений к почвенным условиям и
позволяют получить больше безвирусных маточных растений.
Другой способ оздоровления - химиотерапия. В
питательную среду, на которой культивируют апикальные меристемы, добавляют
препарат вирозола в концентрации 20 - 50 мг/л. Это противовирусный препарат
широкого спектра действия. Применение его позволяет увеличить число безвирусных
растений с 40% до 80 - 100%.
Культура изолированных органов,
тканей и клеток растений в настоящее время
<http://chem21.info/info/1707373> находит все большее применение
<http://chem21.info/info/1842458> в биологических исследованиях
<http://chem21.info/info/860334>. Такие методы
<http://chem21.info/info/1867145>, как клональное микроразмножение
растений <http://chem21.info/info/1856528>, оздоровление от вирусной
инфекции <http://chem21.info/info/265837> с помощью культуры апикальных
<http://chem21.info/info/1414235> меристем, регенерация растений
<http://chem21.info/info/587021> из каллусных культур
<http://chem21.info/info/1856522>, находят сейчас практическое применение
<http://chem21.info/info/133999>. Существенную помощь методы
<http://chem21.info/info/392475> культивирования in vitro могут оказать
генетикам и селекционерам в получении новых
<http://chem21.info/info/260655> форм растений
<http://chem21.info/info/98384>. Используя гаплоиды, незрелые или
нежизнеспособные зародыши гибридов, сомаклональные варианты
растений-регенерантов <http://chem21.info/info/1381330>, биотехиологи
вместе с селекционерами ускоряют и облегчают селекционный процесс. Более
сложная <http://chem21.info/info/1522460> техника манипулирования с
клетками растений <http://chem21.info/info/98287> необходима для
получения соматических гибридов <http://chem21.info/info/510695> слиянием
протопластов <http://chem21.info/info/586706> или для генетической
трансформации <http://chem21.info/info/1339190> клеток и растений.
Второе направление
<http://chem21.info/info/1897140> - это использование культуры
<http://chem21.info/info/587051> изолированных тканей для размножения и
оздоровления посадочного материала <http://chem21.info/info/1896720>.
Этот метод, названный клональным микроразмножением растений
<http://chem21.info/info/1856528>, позволяет получать от одной меристемы
сотни тысяч растений в год.
После оздоровления с помощью
вышеперечисленных технологий нормальные растения-регенеранты
<http://chem21.info/info/1381330> размножают обычными методами
<http://chem21.info/info/1028404> клонального микроразмножения. Для некоторых
растений <http://chem21.info/info/1685745>, например цитрусовых, получить
морфогенез из меристем малого размера <http://chem21.info/info/332885> не
удается, поэтому требуется разработка оригинальных методов. Лимоны и апельсины
оздоровляют и размножают, используя прививки меристем размером 0,14-0,18 мм на
пробирочные подвои, полученные из семян. Достоинство такого подхода состоит и в
том, что развивающиеся из меристем побеги не имеют ювенильных признаков, при
этом цветение и плодоношение ускоряются.
Помимо фундаментальных исследований
<http://chem21.info/info/671199> метод культуры
<http://chem21.info/info/200429> изолированных тканей широко
<http://chem21.info/info/955278> используется в сельском хозяйстве
<http://chem21.info/info/72275> и промышленном производстве
<http://chem21.info/info/63171>. Примером может служить массовое
клональное микроразмножение плодовоовощных и декоративных растений
<http://chem21.info/info/924422>, а также их оздоровление от вирусных и
других инфекций. С помощью культуры in vitro можно расширить возможности
селекционной работы <http://chem21.info/info/1631380> получать клоны
<http://chem21.info/info/1875726> клеток, а затем и растения с
запрограммированными свойствами. Благодаря способности клеток синтезировать в
культуре вторичные <http://chem21.info/info/1339356> метаболиты возникла
отрасль промышленности <http://chem21.info/info/589680>, осуществляющая
биологический синтез <http://chem21.info/info/1521355> веществ,
необходимых человеку.
Некоторые из указанных технологий стали
<http://chem21.info/info/1510038> традиционными, другие находятся на
начальных этапах <http://chem21.info/info/972707> разработки. Наконец,
есть такие методы <http://chem21.info/info/1867145>, которые явно вышли
из ранга вспомогательных, ускоряющих селекцию технологий. К ним можно отнести
криосохранение генофонда - технологию, в настоящий момент приобретшую
экологическую направленность или клональное микроразмножение растений
<http://chem21.info/info/1856528>, тесно связанное с проблемой их оздоровления
от вирусных и других инфекций. Поэтому обзор этих технологий вынесен за рамки
данного раздела.
Четвертый способ - размножение в
биореакторах микроклубнями. Это один из способов ускоренного
<http://chem21.info/info/1472297> размножения оздоровленного материала.
О. Мелик-Саркисов сконструировал гидропонную установку, позволяющую получать
около 7000 микроклубней с 1 м при массе одного кт ня 5 г. Предусмотрена
последующая механизированная посадка их в грунт. В отделе биологии клетки
<http://chem21.info/info/1277351> и биотехнологии Института физиологии
растений <http://chem21.info/info/653057> им. К. А. Тимирязева РАН
создана эффективная полупромышленная замкнутая система
<http://chem21.info/info/4936> пневмоимпульсного биореактора для получения
микроклубней картофеля, в которой предусмотрена возможность воздействия на
направление и скорость процессов <http://chem21.info/info/9384>
клубнеобразования <http://chem21.info/info/1349174>. Технологии
клонального микроразмножения в биореакторах разработаны не только для
сельскохозяйственных, но и для декоративных растений
<http://chem21.info/info/924422> (лилии, гладиолусы, гиацинты,
филодендроны и т.д.). Однако созданные установки
<http://chem21.info/info/873645> пока носят лабораторный, модельный
характер [7-8].
Технология клонального микроразмножение роз
Материалы и оборудование: 1-летние
побеги роз, скальпель, кисточка, пинцет, стаканчик с этанолом, пробирки со
стерильной водой, 4% раствор хлорамина,чашка Петри, кафельная плитка,
спиртовка, спички, пробирки с модифицированной питательной средой МС, ее
компоненты (макроэлементы по прописи Мурасиге-Скуга (МС)
<http://practice.biotechnolog.ru/recept1.htm>, микроэлементы по прописи
МС, хелат железа, витамины по прописи МС, источник углерода: глюкоза - 40 г/л,
агар-агар 7 г/л, гормоны: гиббереллин - 0.1 мг/л, 6-БАП - 2 мг/л, рН готовой
среды 5.6-5.8).
В качестве экспланта используют
боковые почки из средней части 1-летнего побега. Побеги промывают водопроводной
водой с мылом, ополаскивают дистиллированной водой, вырезают почку. Стерилизуют
сначала 70% этанолом в течение 1 минуты, а затем в растворе хлорамина 10 минут.
Трижды промывают стерильной дистиллированной водой (в каждой порции по 10
минут). Срезы обновляют, снимают почечные чешуи и переносят почки на
агаризованную питательную среду в пробирки. В некоторых случаях экспланты
переносят на свежую питательную среду, так как в среду выделяются полифенолы.
Культивируют при температуре 18-25оС, освещенности 500-1000 люкс, 16-часовом
фотопериоде. Пассируется через 3-4 недели. Для укоренения побеги переносят на
среду Гамборга (В5) <http://practice.biotechnolog.ru/recept1.htm> с
добавлением 1 мг/л ИУК и увеличивают интенсивность освещения до 2000 люкс.
При переносе посадочного материала в
почву используют следующие материалы и оборудование: пробирки с растениями,
горшки с почвой; почву желательно прогреть или проавтоклавировать до посадки
растений
Сделать пробиркой углубление в
увлажненной почве в горшке. Пробирочное растение вынуть из пробирки, поместить
в горшки с почвой, не отмывая агаровой среды. Уплотнить почву вокруг растения.
Первые 3-5 дней желательно прикрывать растения стеклянным колпаком. Через 10
дней растения пересаживают на постоянное место в теплице [7].
Клональное микроразмножение архидей
Первые работы в области клонального
микроразмножения были проведены в конце 50-х годов XX столетия и связаны с
именем Жоржа Мореля, которому удалось получить первые растения-регенеранты
орхидей. Культивируя в стерильных условиях верхушку побега орхидеи, размером
всего 0,5 мм, он наблюдал формирование сферических структур, напоминающих
видоизмененные почки. Эти структуры можно было делить, подращивать на
искусственной питательной среде, опять делить и получать из них целые растения.
Французские фирмы, занимающиеся разведением орхидей, использовали этот метод, и
очень скоро орхидеи из мериклонов появились на цветочном рынке в огромном
количестве, превратив орхидею из дорогого и редкого цветка в широко
распространенное растение.
Для массового получения оздоровленных растений
необходимо, чтобы быстрое клональное микроразмножение новых и уже существующих
сортов стало крупномасштабным процессом. Среди растений этот способ впервые
применили для размножения орхидных. Теперь так размножают многие декоративные
растения. Микроклональное размножение позволяет получить из одной чешуи
луковицы до 105 новых растений за 6 месяцев. Большая часть гербер, которые
продаются в цветочных магазинах, получена путем клонирования. Одно растение
герберы за год при клональном микроразмножении дает до одного миллиона новых
генотипически и фенотипически сходных растений. При обычных способах
размножения можно получить только 50-100 растений.
В настоящее время большое внимание уделяется
культуре орхидей. Коллекция насчитывает, как было изложено выше, 108 таксонов
собственной репродукции, в т.ч. 55 видов, из которых 23 в списке охраняемых, и
53 гибрида. Для орхидных, естественное размножение которых требует особых
условий, введение в культуру и микроклональное размножение является
единственным способом получения достаточного количества посадочного материала
сортов и гибридных форм этой культуры в промышленном цветоводстве.
В рамках ГП «Реконструкция объектов ЦБС НАН
Беларуси» была проведена работа по созданию in vitro коллекции орхидных в ЦБС
НАН Беларуси
В настоящее время in vitro коллекция орхидных
Отдела биохимии и биотехнологии растений ЦБС НАНБ насчитывает 35 образцов. Из
них 28 относятся к представителям тропических и субтропических видов орхидей и
семь к орхидным зоны умеренного климата (в том числе Cypripedium calceolus,
занесенный в Красную Книгу Республики Беларусь). Для создания коллекции
использовался растительный материал из фондовой оранжереи ЦБС НАН Беларуси и
частных коллекций (Ракицкий С.Е., Бурчик Н.А.). 17 образцов стерильных культур
получены из ФИБХ им. М.М. Шимякина и Ю.А. Овчинникова РАН (РФ), ГБС им.
Н.В.Цицина (РФ) и НБС им. Н.Н.Гришко (Украина). К настоящему времени получено и
выращивается в условиях оранжереи около 500 растений тропических орхидных.
Введение в культуру видовых растений, а так же гибридов
первого поколения осуществлялся посевом семян в асептических условиях. Такой
способ является одним из наиболее популярных и широко используемых методов
размножения и введения в культуру орхидных. При этом можно использовать как
сухие семена, полученные из созревших коробочек, так и недозревшие зеленые
коробочки. Были получены стерильные культуры Cymbidium lowianum, Bletilla
striata, Laelia purpurata, Stanhopea tigrina, Cypripedium calceolus,
Dactylorhiza fuchsii, Dactylorhiza maculata. Стимулирующее действие на
всхожесть семян Stanhopea tigrina и Bletilla striata оказало их культивирование
до момента образования протокормов в темноте. При перенесении таких протокормов
в условия освещения у них начинался синтез хлорофилла и активный рост
первичного побега. При подобном способе проращивания семян снижалось количество
некротизированных протокормов по сравнению с протокормами, выращенными на
свету. Подросшие сеянцы пикировали на свежие среды и после формирования
достаточного количества корней переходили к адаптации растений в условиях
оранжереи.
Для введения в культуру сортов и гибридов
использовались вегетативные органы, содержащие меристематические ткани:
апикальные и латеральные почки молодых побегов, покоящиеся почки цветоносов.
Основной средой культивирования полученных in vitro растений была среда MS с
добавлением различных регуляторов роста. При культивировании орхидных
умеренного климата так же использовалась среда BM.
Адаптация размноженных in vitro растений
проводилась в 2 этапа. В качестве субстрата для первого этапа адаптации был
использован измельченный сфагновый мох, предварительно обработанный кипятком.
Растения высаживались в посадочные плошки на расстоянии 1-2 см друг от друга с
небольшим заглублением в субстрат не более 0,5 см. Высаженные в субстрат
растения переносили в изолированную теплицу с высокой влажностью и необходимой
температурой воздуха. Период нахождения в таких условиях составил для всех
сортов Phalaenopsis hybridum, Epidendrum radicans, Macodes petola - 3 месяца,
Dendrobium sp, Dendrobium phalaenopsis “Red Lip” и Oncidium sp - 4 месяца,
Oncidium lanceanum - 6 месяцев.
Появление у растений новых туберидиев и корней
позволило перейти ко второму этапу адаптации - пересадке растений на смешанный
субстрат.
Смешанный субстрат готовили из следующих
компонентов: сосновая кора, мох сфагнум, не полностью разложившаяся часть
верхового торфа, древесный уголь в соотношении 1:1:1:0,1, соответственно.
В течение 10 дней после пересадки растения
находились в изолированной теплице в режиме, аналогичном первому этапу, а затем
были помещены в теплицу с условиями наиболее приближенными к естественным:
Phalaenopsis hybridum, Macodes petola находились в оранжерее с минимальными
колебаниями температуры, которая составляла 18-20 °C, а Dendrobium sp., Dendrobium
phalaenopsis «Red Lip» и Oncidium sp. в оранжерее с дневной температурой 18-20
°C и ночной 10-12 °C.
клональный микроразмножение декоративный почвенный
Заключение
Значение клонального микроразмножения:
. Размножают редкие сорта и гибриды растений, а
также растения, которые не размножаются в искусственных условиях.
. В селекции клональное микроразмножение
применяют для сохранения в культуре новых перспективных сортов, особенно
полученных in
vitro. Создание
нужного для селекционера количества копий уникальных генотипов не требует
больших масштабов. Периодически пересаживая микрочеренки, микроклубни или
другие органы растений на свежую питательную среду, можно достаточно долго
сохранять в культуре in
vitro растения с
необходимым генотипом.
. Клональное микроразмножение используется также
для быстрого получения больших количеств безвирусного материала с дальнейшей
посадкой в грунт.
. Клональное микроразмножение помогает в
сохранении редких и исчезающих видов растений. Однако эта технология
размножения редких растений и их возвращение в природные экосистемы ещё
нуждается в разработке.
. Клональное микроразмножение применяют также
для ускорения размножения в селекции древесных растений. В Италии, в результате
черенкования пазушных побегов in
vitro, за год выращивают
более миллиона подвоев персиковых деревьев. Таким же образом клонируют
гвинейскую масляничную пальму, многие породы хвойных деревьев (ель, сосна,
лиственница, секвойя). С помощью клонального размножения отдельных экземпляров
взрослых растений удается создавать декоративные древесные растения необычной
формы и расцветки, например в виде шара, «плакучие», золотистого цвета и т. д.
[1]
Список литературы
1.
Бутенко Р. Г. Биология культивируемых клеток высших растений in vitro и
биотехнологии на их основе, Монография. - Москва, ФБК-Пресс, 1999 159 с.
.
Катаева Н. В., Бутенко Р. Г. Клональное микроразмножение растений. - М., 1983.
.
Культура клеток растений. / под ред. Р. Г. Бутенко. М., 1986.