Болезни, связанные с нарушением фолдинга белка
Содержание
Введение
)
Структура и функциональная роль шаперонов в фолдинге белков
.1
Класификация шаперонов
.2
Роль шаперонов в фолдинге белков
.3
Роль шаперонов в защите белков клеток от денатурирующих
воздействий
)
Болезни, связанные с нарушением фолдинга белков
.1
Болезнь Альцхаймера
.2
Прионовые болезни
.3
Преэклампсимия
.4
Болезнь Паркинсона
.4.1
«Плохие белки»
.4.2
Виновник-окружающая среда!?
.4.3
Генетические основы
)
Лечение Паркинсона сегодня
.1
Лекарственная терапия
.2
Стимуляция глубинных структур мозга
.3
Новые подходы к лечению болезни
Заключение
Список
используемой литературы
Введение
В
биохимии и молекулярной биологии фо́лдингом белка (укладкой белка, от англ.
<https://ru.wikipedia.org/wiki/%D0%90%D0%BD%D0%B3%D0%BB%D0%B8%D0%B9%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA>
folding) называют процесс спонтанного сворачивания
полипептидной
<https://ru.wikipedia.org/wiki/%D0%9F%D0%B5%D0%BF%D1%82%D0%B8%D0%B4> цепи
в уникальную нативную пространственную структуру (так называемая третичная
структура
<https://ru.wikipedia.org/wiki/%D0%A2%D1%80%D0%B5%D1%82%D0%B8%D1%87%D0%BD%D0%B0%D1%8F_%D1%81%D1%82%D1%80%D1%83%D0%BA%D1%82%D1%83%D1%80%D0%B0>).
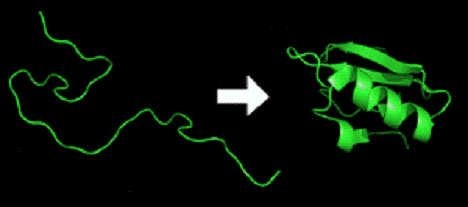 <https://ru.wikipedia.org/wiki/%D0%A4%D0%B0%D0%B9%D0%BB:Protein_folding.png>
<https://ru.wikipedia.org/wiki/%D0%A4%D0%B0%D0%B9%D0%BB:Protein_folding.png>
Рис.1.
Переход первичной структуры полипептида (слева) в третичную структуру (справа)
Каждая
молекула белка <https://ru.wikipedia.org/wiki/%D0%91%D0%B5%D0%BB%D0%BE%D0%BA>
начинает формироваться как полипептид
<https://ru.wikipedia.org/wiki/%D0%9F%D0%B5%D0%BF%D1%82%D0%B8%D0%B4%D1%8B>,
транслируемый
<https://ru.wikipedia.org/wiki/%D0%A2%D1%80%D0%B0%D0%BD%D1%81%D0%BB%D1%8F%D1%86%D0%B8%D1%8F_(%D0%B1%D0%B8%D0%BE%D1%85%D0%B8%D0%BC%D0%B8%D1%8F)>
из последовательности мРНК
<https://ru.wikipedia.org/wiki/%D0%9C%D0%A0%D0%9D%D0%9A> в виде линейной
цепочки аминокислот
<https://ru.wikipedia.org/wiki/%D0%90%D0%BC%D0%B8%D0%BD%D0%BE%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D1%8B>.
У полипептида нет устойчивой трёхмерной структуры (пример в левой части
изображения). Однако все аминокислоты в цепочке имеют определённые химические
свойства: гидрофобность
<https://ru.wikipedia.org/wiki/%D0%93%D0%B8%D0%B4%D1%80%D0%BE%D1%84%D0%BE%D0%B1%D0%BD%D0%BE%D1%81%D1%82%D1%8C>,
гидрофильность
<https://ru.wikipedia.org/wiki/%D0%93%D0%B8%D0%B4%D1%80%D0%BE%D1%84%D0%B8%D0%BB%D1%8C%D0%BD%D0%BE%D1%81%D1%82%D1%8C>,
электрический заряд. При взаимодействии аминокислот друг с другом и клеточным окружением
получается хорошо определённая трёхмерная структура -конформация
<https://ru.wikipedia.org/wiki/%D0%9A%D0%BE%D0%BD%D1%84%D0%BE%D1%80%D0%BC%D0%B0%D1%86%D0%B8%D1%8F>.
В результате на внешней поверхности белковой глобулы формируются полости
активных центров
<https://ru.wikipedia.org/wiki/%D0%90%D0%BA%D1%82%D0%B8%D0%B2%D0%BD%D1%8B%D0%B9_%D1%86%D0%B5%D0%BD%D1%82%D1%80_%D1%84%D0%B5%D1%80%D0%BC%D0%B5%D0%BD%D1%82%D0%BE%D0%B2>,
а также места контактов субъединиц мультимерных белков друг с другом и с биологическими
мембранами
<https://ru.wikipedia.org/wiki/%D0%9A%D0%BB%D0%B5%D1%82%D0%BE%D1%87%D0%BD%D1%8B%D0%B5_%D0%BC%D0%B5%D0%BC%D0%B1%D1%80%D0%B0%D0%BD%D1%8B>.
В
редких случаях нативными могут быть сразу две конформации белка (т. н.
конформеры). Они могут сильно различаться, и даже выполнять различные функции.
Для этого необходимо, чтобы в разных областях фазового пространства
<https://ru.wikipedia.org/wiki/%D0%A4%D0%B0%D0%B7%D0%BE%D0%B2%D0%BE%D0%B5_%D0%BF%D1%80%D0%BE%D1%81%D1%82%D1%80%D0%B0%D0%BD%D1%81%D1%82%D0%B2%D0%BE>
белковой молекулы существовали два примерно равных по энергии состояния, каждое
из которых будет встречаться в нативной форме с соответствующей вероятностью.
Для
стабилизации третичной структуры многие белки в клетке подвергаются
посттрансляционной модификации
<https://ru.wikipedia.org/wiki/%D0%9F%D0%BE%D1%81%D1%82%D1%82%D1%80%D0%B0%D0%BD%D1%81%D0%BB%D1%8F%D1%86%D0%B8%D0%BE%D0%BD%D0%BD%D0%B0%D1%8F_%D0%BC%D0%BE%D0%B4%D0%B8%D1%84%D0%B8%D0%BA%D0%B0%D1%86%D0%B8%D1%8F>.
Весьма часто встречаются дисульфидные мостики
<https://ru.wikipedia.org/wiki/%D0%94%D0%B8%D1%81%D1%83%D0%BB%D1%8C%D1%84%D0%B8%D0%B4%D0%BD%D0%B0%D1%8F_%D1%81%D0%B2%D1%8F%D0%B7%D1%8C>
между пространственно близкими участками полипептидной цепи.
Для
корректной работы белков весьма важна правильная трёхмерная структура. Ошибки
сворачивания обычно приводят к образованию неактивного белка с отличающимися
свойствами. Считается, что некоторые болезни происходят от накопления в клетках
неправильно свёрнутых белков.
В
фолдинге участвуют белки-шапероны
<https://ru.wikipedia.org/wiki/%D0%A8%D0%B0%D0%BF%D0%B5%D1%80%D0%BE%D0%BD%D1%8B>.
И хотя большинство только что синтезированных белков могут сворачиваться и при
отсутствии шаперонов, некоторому меньшинству обязательно требуется их присутствие.
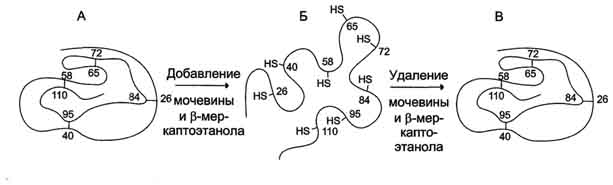
Рис. 2. Денатурация и ренативация рибонуклеазы. А - нативная молекула
рибонуклеазы, в третичной структуре которой имеются 4 дисульфидные связи; Б -
денатурированная молекула рибонуклеазы; В - нативная молекула рибонуклеазы, в
структуре которой вновь образованы 4 дисульфидные связи между теми же остатками
цистеина.
фолдин белок паркинсон
болезнь
Механизм
сворачивания белков до конца не изучен. Экспериментальное определение
трёхмерной структуры белка часто очень сложно и дорого. Однако аминокислотная
последовательность белка обычно известна. Поэтому учёные пытаются использовать
различные биофизические
<https://ru.wikipedia.org/wiki/%D0%91%D0%B8%D0%BE%D1%84%D0%B8%D0%B7%D0%B8%D0%BA%D0%B0>
методы, чтобы предсказать пространственную структуру белка
<https://ru.wikipedia.org/wiki/%D0%9F%D1%80%D0%B5%D0%B4%D1%81%D0%BA%D0%B0%D0%B7%D0%B0%D0%BD%D0%B8%D0%B5_%D1%81%D1%82%D1%80%D1%83%D0%BA%D1%82%D1%83%D1%80%D1%8B_%D0%B1%D0%B5%D0%BB%D0%BA%D0%B0>
из его аминокислотной последовательности.
1) Структура и функциональная роль шаперонов в фолдинге белков
В процессе синтеза полипептидных цепей, транспорта их через мембраны, при
сборке олигомерных белков возникают промежуточные нестабильные конформации,
склонные к агрегации. На вновь синтезированном полипептиде имеется множество
гидрофобных радикалов, которые в трёхмерной структуре спрятаны внутри молекулы.
Поэтому на время формирования нативной конформации реакционно-способные
аминокислотные остатки одних белков должны быть отделены от таких же групп
других белков.
Во всех известных организмах от прокариотов до высших эукариотов
обнаружены белки, способные связываться с белками, находящимися в неустойчивом,
склонном к агрегации состоянии. Они способны стабилизировать их конформацию,
обеспечивая фолдинг белков. Эти белки получили название "шапероны".
. Классификации шаперонов (Ш)
В соответствии с молекулярной массой все шапероны можно разделить на 6
основных групп:
· высокомолекулярные, с молекулярной массой от 100 до 110 кД;
· Ш-90 - с молекулярной массой от 83 до 90 кД;
· Ш-70 - с молекулярной массой от 66 до 78 кД;
· Ш-60;
· Ш-40;
· низкомолекулярные шапероны с молекулярной массой от 15 до 30
кД.
Среди шаперонов различают: конститутивные белки (высокий базальный синтез
которых не зависит от стрессовых воздействий на клетки организма), и
индуцибельные, синтез которых в нормальных условиях идёт слабо, но при
стрессовых воздействиях на клетку резко увеличивается. Индуцибельные шапероны
относят к "белкам теплового шока", быстрый синтез которых отмечают практически
во всех клетках, которые подвергаются любым стрессовым воздействиям. Название
"белки теплового шока" возникло в результате того, что впервые эти
белки были обнаружены в клетках, которые подвергались воздействию высокой
температуры.
. Роль шаперонов в фолдинге белков
При синтезе белков N-концевая область полипептида синтезируется раньше,
чем С-концевая область. Для формирования конформации белка нужна его полная
аминокислотная последовательность. Поэтому в период синтеза белка на рибосоме
защиту реакционно-способных радикалов (особенно гидрофобных) осуществляют Ш-70.
Ш-70 - высококонсервативный класс белков, который присутствует во всех
отделах клетки: цитоплазме, ядре, ЭР, митохондриях. В области карбоксильного
конца единственной полипептидной цепи шаперонов есть участок, образованный
радикалами аминокислот в форме бороздки. Он способен взаимодействовать с
участками белковых молекул и развёрнутых полипептидных цепей длиной в 7-9
аминокислот, обогащённых гидрофобными радикалами. В синтезирующейся полипептидной
цепи такие участки встречают примерно через каждые 16 аминокислот.
Фолдинг многих высокомолекулярных белков, имеющих сложную конформацию
(например, доменное строение), осуществляется в специальном пространстве,
сформированном Ш-60. Ш-60 функционируют в виде олигомернoго комплекса,
состоящего из 14 субъединиц (рис. 1-23).
Ш-60 образуют 2 кольца, каждое из которых состоит из 7 субъединиц,
соединённых друг с другом. Субъединица Ш-60 состоит из 3 доменов: апикального
(верхушечного), промежуточного и экваториального. Верхушечный домен имеет ряд
гидрофобных остатков, обращённых в полость кольца, сформированного
субъединицами. Экваториальный домен имеет участок связывания с АТФ и обладает
АТФ-азной активностью, т.е. способен гидролизовать АТФ до АДФ и Н3РО4.
Шапероновый комплекс имеет высокое сродство к белкам, на поверхности
которых есть элементы, характерные для несвёрнутых молекул (прежде всего
участки, обогащённые гидрофобными радикалами). Попадая в полость шаперонового
комплекса, белок связывается с гидрофобными радикалами апикальных участков
Ш-60. В специфической среде этой полости, в изоляции от других молекул клетки
происходит перебор возможных конформации белка, пока не будет найдена
единственная, энергетически наиболее выгодная конформация.
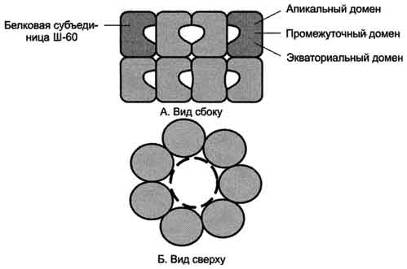
Рис. 3. Структура шаперонового комплекса, состоящего из 14 белковых
молекул Ш-60
Высвобождение белка со сформированной нативной конформацией
сопровождается гидролизом АТФ в экваториальном домене. Если белок не приобрёл
нативной конформации, то он вступает в повторную связь с шапероновым
комплексом. Такой шаперонзависимый фолдинг белков требует затрат большого
количества энергии.
Таким образом, синтез и фолдинг белков протекают при участии разных групп
шаперонов, препятствующих нежелательным взаимодействиям белков с другими
молекулами клетки и сопровождающих их до окончательного формирования нативной
структуры (рис. 1-24).
. Роль шаперонов в защите белков клеток от денатурирующих стрессовых
воздействий
Шапероны, участвующие в защите клеточных белков от денатурирующих
воздействий, как уже говорилось выше, относят к белкам теплового шока (БТШ) и в
литературе часто обозначают как HSP (от англ, heat shock protein).
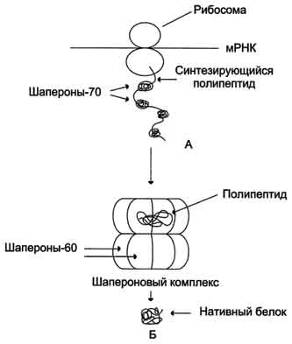
Рис. 4. Участие шаперонов в фолдинге белков. А - участие шаперонов-70 в
предотвращении гидрофобных взаимодействий между участками синтезирующегося
полипептида; Б - формирование нативной конформации белка в шапероновом
комплексе.
При действии различных стрессовых факторов (высокая температура,
гипоксия, инфекция, УФО, изменение рН среды, изменение молярности среды,
действие токсичных химических веществ, тяжёлых металлов и т.д.) в клетках
усиливается синтез БТШ. Имея высокое сродство к гидрофобным участкам частично
денатурированных белков, они могут препятствовать их полной денатурации и
восстанавливать нативную конформацию белков.
Установлено, что кратковременные стрессовые воздействия увеличивают
выработку БТШ и повышают устойчивость организма к длительным стрессовым
воздействиям. Так, кратковременная ишемия сердечной мышцы в период бега при
умеренных тренировках значительно повышает устойчивость миокарда к длительной
ишемии, вызванной стенокардией или закупоркой сосудов сердца тромбом. В
настоящее время перспективными исследованиями в медицине считают поиски
фармакологических и молекулярно-биологических способов активации синтеза БТШ в
клетках.
2) Болезни, связанные с нарушением фолдинга белков
Лишь небольшая часть теоретически возможных вариантов полипептидных цепей
может принимать одну стабильную пространственную структуру. Большинство же
таких белков может принимать множество конформаций с примерно одинаковой
энергией Гиббса, но с различными свойствами. Первичная структура большинства
известных белков, отобранных эволюцией, обеспечивает исключительную
стабильность одной конформации.
Однако некоторые растворимые в воде белки при изменении условий могут
приобретать конформацию плохо растворимых, способных к агрегации молекул,
образующих в клетках фибриллярные отложения, именуемые амилоидом (от лат.
amylum - крахмал). Так же как и крахмал, амилоидные отложения выявляют при
окраске ткани йодом. Это может происходить:
• при гиперпродукции некоторых белков, в результате чего увеличивается их
концентрация в клетке;
• при попадании в клетки или образовании в них белков, способных влиять
на конфор-мацию других молекул белка;
• при активации протеолиза нормальных белков организма, с образованием
нерастворимых, склонных к агрегации фрагментов;
• в результате точечных мутаций в структуре белка.
В результате отложения амилоида в органах и тканях нарушаются структура и
функция клеток, наблюдают их дегенеративные изменения и разрастание
соединительнотканных или глиальных клеток. Развиваются болезни, называемые
амилоидозами. Для каждого вида амилоидоза характерен определённый тип амилоида.
В настоящее время описано более 15 таких болезней.
2.1 Болезнь Альцхаймера
Болезнь Альцхаймера - наиболее часто отмечаемый β-амилоидоз нервной системы, как
правило, поражающий лиц преклонного возраста и характеризующийся
прогрессирующим расстройством памяти и полной деградацией личности. В ткани
мозга откладывается β-амилоид - белок, образующий нерастворимые фибриллы,
нарушающие структуру и функции нервных клеток. β-амилоид - продукт изменения
конформации нормального белка организма человека. Он образуется из более
крупного предшественника частичным протеолизом и синтезируется во многих
тканях. β-Амилоид, в отличие от своего
нормального предшественника, содержащего много а-спиральных участков, имеет
вторичную β-складчатую структуру, агрегирует с образованием нерастворимых
фибрилл, устойчив к действию протеолитических ферментов.
Причины нарушения фолдинга нативных белков в ткани мозга ещё предстоит
выяснить. Возможно, с возрастом уменьшается синтез шаперонов, способных
участвовать в формировании и поддержании нативной конформации белков, или
увеличивается активность протеаз, что приводит к увеличению концентрации
белков, склонных изменять конформацию.
.2 Прионовые болезни
Прионы - особый класс белков, обладающих инфекционными свойствами.
Попадая в организм человека или спонтанно возникая в нём, они способны вызывать
тяжёлые неизлечимые заболевания ЦНС, называемые прионовыми болезнями. Название
«прионы» происходит от аббревиатуры английской фразы proteinaceous infectious
particle - белковая инфекционная частица.
Прионовый белок кодируется тем же геном, что и его нормальный аналог,
т.е. они имеют идентичную первичную структуру. Однако два белка обладают
различной конформацией: прионовый белок характеризуется высоким содержанием β-слоёв, в то время как нормальный
белок имеет много а-спиральных участков. Кроме того, прионовый белок обладает
устойчивостью к действию протеаз (подкласс гидролаз 3.4., расщепляет пептидные
связи в белке и пептидах) и, попадая в ткань мозга или образуясь там спонтанно,
способствует превращению нормального белка в прионовый в результате межбелковых
взаимодействий. Образуется так называемое «ядро полимеризации», состоящее из
агрегированных прионовых белков, к которому способны присоединяться новые молекулы
нормального белка.
В результате в их пространственной структуре происходят конформационные
перестройки, характерные для прионовых белков.
Известны случаи наследственных форм прионовых болезней, вызванных
мутациями в структуре данного белка. Однако возможно и заражение человека
прионовыми белками, в результате чего возникает заболевание, приводящее к
гибели больного. Так, куру - прионовая болезнь аборигенов Новой Гвинеи,
эпидемический характер которой связан с традиционным каннибализмом в этих племенах
и передачей инфекционного белка от одной особи к другой. В связи с изменением
образа их жизни данное заболевание практически исчезло.
В настоящее время интерес к прионовым болезням возрос в связи с
заражением людей прионами при употреблении мясопродуктов, полученных от
животных, являющихся носителями прионов, вызывающих «бешенство коров» (болезнь
Кройтц-фельдта-Якоба). Несмотря на то, что прионовые белки человека и животных
различаются лишь незначительно, долгое время полагали, что существуют межвидовые
барьеры на пути передачи болезни. Однако последние данные показали, что эти
барьеры не абсолютны, и что существует принципиальная возможность передачи
болезни от одного вида другому. Так, в Великобритании к середине1999 г. было
зарегистрировано около 40 случаев данного заболевания. Прогноз не исключает
развития эпидемии прионовой болезни в ближайшие 10-15 лет.
2.3 Преэклампсия
Преэклампсия
- патология беременности, лидирующая среди причин материнской и детской
смертности в мире - имеет характеристики, позволяющие отнести этот синдром к
заболеваниям, связанным с аномальной структурой белков, таким, как болезнь
Альцгеймера или прионные болезни. Сделанное международной группой
исследователей открытие, результаты которого опубликованы
<#"823707.files/image005.gif">
Рис. 5. Предшественник бета-амилоида
В то же время белок IFI6-16, играющий ключевую роль в регуляции апоптоза
(программируемой клеточной гибели), чья аномальная версия также оказалась
вовлечена в развитие преэклампсии, ранее не был ассоциирован с болезнями,
связанными с нарушением фолдинга белков.
Далее группа Бухимши продолжила исследования в этом направлении, собрав
образцы мочи более 600 беременных женщин и проанализировав их с помощью
гистологического красителя конго красный (конгорот), применяемого для
обнаружения скоплений амилоидных белков. Моча здоровых женщин при соединении с
красителем не меняет цвет, а моча, в которой присутствуют белковые клубки,
окрашивается красным с разной, в зависимости от выраженности патологии,
интенсивностью. В итоге было установлено, что такой метод позволяет с более чем
80-процентной точностью, еще до появления клинических симптомов,
диагностировать преэклампсию и даже предсказать тяжесть ее течения и
необходимость срочного родоразрешения.
На
основании сделанного группой Бухимши открытия уже создан пилотный образец
бумажного теста на раннюю диагностику преэклампсии по анализу мочи, проходящий
в настоящее время клинические испытания в различных медицинских центрах мира.
«Это прекрасная возможность действительно помочь женщинам с помощью простого,
дешевого, неинвазивного и очень точного теста», - отметила
<#"823707.files/image006.gif">
Рис.
6. Дофамин
Эти
нейроны служат основным компонентом базальных ганглиев, сложных структур в
глубине головного мозга, отвечающих за координацию и тонкую регуляцию движений.
В самом начале заболевания, когда число утраченных дофаминергических нейронов
невелико, мозг работает нормально, но с выходом из строя более половины
специализированных клеток их нехватку организм уже не может компенсировать.
Структуры мозга, отвечающие за движения (таламус, базальные ганглии и кора
головного мозга), перестают работать как единая система, и тогда наступает
ситуация, аналогичная той, что наблюдается в крупном аэропорту при выходе из
строя системы контроля полетов: опоздания, задержки, нестыковки и, наконец,
полный хаос. Больше всего страдают клетки черной субстанции (составная часть
экстрапирамидной системы
<https://ru.wikipedia.org/wiki/%D0%AD%D0%BA%D1%81%D1%82%D1%80%D0%B0%D0%BF%D0%B8%D1%80%D0%B0%D0%BC%D0%B8%D0%B4%D0%BD%D0%B0%D1%8F_%D1%81%D0%B8%D1%81%D1%82%D0%B5%D0%BC%D0%B0>,
находящаяся в области четверохолмия среднего мозга
<https://ru.wikipedia.org/wiki/%D0%A1%D1%80%D0%B5%D0%B4%D0%BD%D0%B8%D0%B9_%D0%BC%D0%BE%D0%B7%D0%B3>.
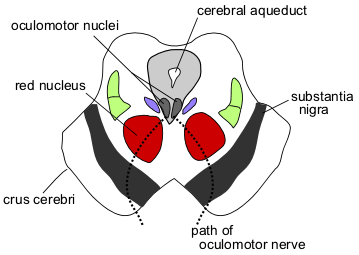
Рис.
7. Мозг. Черная субстанция
Играет
важную роль в регуляции моторной функции, тонуса мышц, осуществлении
статокинетической функции участием во многих вегетативных функциях: дыхании
<https://ru.wikipedia.org/wiki/%D0%94%D1%8B%D1%85%D0%B0%D0%BD%D0%B8%D0%B5>,
сердечной деятельности
<https://ru.wikipedia.org/wiki/%D0%A1%D0%B5%D1%80%D0%B4%D1%86%D0%B5>,
тонусе кровеносных сосудов
<https://ru.wikipedia.org/wiki/%D0%9C%D1%8B%D1%88%D0%B5%D1%87%D0%BD%D0%BE%D0%B5_%D1%81%D0%BE%D0%BA%D1%80%D0%B0%D1%89%D0%B5%D0%BD%D0%B8%D0%B5>.),
которые контролируют произвольные движения и настроение. Вначале последствия
гибели нейронов в этой области компенсируют другие нейроны, но когда доля
утраченных клеток достигает 50-80%, незатронутые области головного мозга не
справляются с перегрузкой. С этого момента части головного мозга, тоже
вовлеченные в регуляцию двигательной активности, в том числе остальная часть
базального ганглия, таламус и кора головного мозга, перестают работать
согласованно, и движения становятся неконтролируемыми.
.4.1
«Плохие белки»
У
многих больных, умерших от паркинсонизма, при вскрытии в черной субстанции обнаруживаются
белковые скопления (они называются тельцами Леви по фамилии немецкого
патологоанатома, открывшего их в 1912 г.). Аналогичные образования характерны
также для болезни Альцгеймера. Являются ли эти кластеры причиной деструктивных
изменений или, напротив, выполняют защитные функции, удерживая аномальные,
токсичные для нейрона белки от распространения по всей клетке, - не совсем
ясно. В любом случае большинство ученых сходятся на том, что выяснение причины
кластеризации белков поможет раскрыть тайну болезни Паркинсона.
Рис.
8. Патология чёрной субстанции с потерей клеток, видны Тельца Леви
<https://ru.wikipedia.org/wiki/%D0%A2%D0%B5%D0%BB%D1%8C%D1%86%D0%B0_%D0%9B%D0%B5%D0%B2%D0%B8>.
Если
по тем или иным причинам шаперонная система (Помогает по завершении синтеза
белковой молекулы, сворачивается ей в компактную трехмерную глобулу. Эти же
молекулы вновь упаковывают белки, утратившие должную конфигурацию.) выходит из
строя, то неправильным образом уложенные белки становятся мишенью для так
называемой убиквитин-протеасомной системы. Сначала к белковой молекуле с
аномальной конформацией присоединяется небольшой белок убиквитин (небольшой
консервативный белок
<https://ru.wikipedia.org/wiki/%D0%91%D0%B5%D0%BB%D0%BA%D0%B8>, который у
эукариот
<https://ru.wikipedia.org/wiki/%D0%AD%D1%83%D0%BA%D0%B0%D1%80%D0%B8%D0%BE%D1%82%D1%8B>
присоединяется к белкам.). Вслед за первой убиквитиновой «бусиной»
присоединяется вторая - и так до тех пор, пока на конце обреченной на гибель
белковой молекулы не образуется цепочка (своеобразная «черная метка»). Она
служит сигналом для протеасомы («мусорщика» нервной клетки) к расщеплению
аномального белка на составляющие его аминокислоты.
Рис.
8. Протеасома. Вид сверху.
Стало
более или менее ясно, что болезнь Паркинсона развивается в результате нарушений
в работе шаперонной и убиквитин-протеасомной систем. По-видимому, дело обстоит
следующим образом. Какое-то повреждение в нейронах черной субстанции запускает
целый каскад реакций, приводящих к появлению большого количества неправильно
упакованных белков. Они образуют кластеры, что вначале даже дает некоторые
преимущества клетке, поскольку аномальные белки держатся вместе, а не
распространяются по ней, вызывая повреждения. Затем в дело вступают шапероны,
приводящие белки в норму, а те из них, которые исправить не удается,
расщепляются убиквитин-протеасомной системой. Когда аномальных белков
становится слишком много, клеточная «очистительная машина» перестает справляться
с работой, шаперонов не хватает, токсичные белки накапливаются, и в конце
концов нейроны погибают. Эта гипотеза хороша тем, что, по мнению ученых,
объясняет природу обеих форм болезни Паркинсона. Предполагается, что 95%
больных страдают вторичным паркинсонизмом, возникающим в результате сложных
взаимодействий между генетическими и средовыми факторами. Если человек с
предрасположенностью к паркинсонизму попадает в неблагоприятные условия
(например, длительное время находится в контакте с пестицидами), то нейроны
черной субстанции страдают у него в большей степени, чем нейроны людей, не
имеющих предрасположенности, и в них накапливается больше белков с аномальной
конформацией. У 5% остальных больных паркинсонизмом в основе патологии лежат
чисто генетические факторы (первичный паркинсонизм). Результаты исследований,
проведенных за последние восемь лет, указывают на наличие связи между мутациями
в геноме больных и образованием белков с аномальной конформацией или сбоем в
работе защитных механизмов клетки. Это наиболее впечатляющее достижение в
изучении природы болезни Паркинсона за многие годы.
.4.2
Виновник - окружающая среда!?
Гипотеза
о роли в возникновении болезни Паркинсона неблагоприятных внешних факторов
циркулировала в научных кругах не одно десятилетие. Однако подтверждение ей
было получено лишь в начале 1980-х гг., когда Уильям Лангстон (J. William
Langston) из Института по изучению болезни Паркинсона в Саннивейле, шт.
Калифорния, обнаружил, что у молодых наркоманов буквально через несколько дней
после приема одного из синтетических вариантов героина (чайна-уайт) появились
симптомы, характерные для паркинсонизма. Оказалось, что партия наркотика была
загрязнена веществом, губительным для нейронов черной субстанции. После курса
терапии у некоторых из наркоманов контроль над отдельными движениями
восстановился, состояние же большинства не изменилось. В течение следующих
нескольких лет ученые пытались найти другие вещества со сходным действием, и в
2003 г. Национальный институт по изучению влияния окружающей среды на состояние
здоровья выделил на эти работы $20 млн. Сегодня выявлено несколько случаев
развития паркинсонизма в результате длительных контактов человека с различными
пестицидами, гербицидами и фунгицидами. Тимоти Гринэмайер (J. Timothy Greenamyre)
из Университета Эимори показал в опытах на животных, что при контакте с
пестицидом ротеноном, который вырабатывается из натуральных продуктов и часто
применяется в органическом сельском хозяйстве, возможно образование белковых
агрегатов, губительных для дофаминпродуцирующих нейронов и клеточных органелл,
вырабатывающих энергию. Кроме того, у подопытных животных наблюдались
двигательные расстройства. Помимо «провокаторов» паркинсонизма существуют и
вещества, оказывающие противоположное действие. Специалисты полагают, что
некоторым защитным эффектом обладают никотин и кофеин. Но стоит ли беспрерывно
пить кофе или выкуривать по пачке сигарет в день ради призрачной надежды
избежать паркинсонизма? Некоторые пестициды, в том числе изготовленные только
из природных веществ, могут вызывать у животных симптомы, характерные для
болезни Паркинсона.
.4.3
Генетические основы
В
1997 г. Михаэль Полимеропулос (Mihael H. Polymeropoulos) из Национальных
институтов здоровья идентифицировал мутацию в гене, кодирующем белок под
названием альфа-синуклеин, у членов итальянских и греческих семей, страдавших
наследственной формой паркинсонизма. Мутация наследовалась по
аутосомно-доминантному типу, т.е. для возникновения болезни было достаточно
одной мутантной копии гена (полученной от отца или матери). Мутация в гене
альфа-синуклеина встречается крайне редко: доля несущих ее больных составляет
лишь 1% от числа всех страдающих паркинсонизмом. Но сам факт обнаружения связи
между наличием мутантного белка и болезнью Паркинсона вызвал большой интерес в
научных кругах. Отчасти это было связано с тем, что в том же году выяснилось,
что альфа-синуклеин (не важно, мутантный или нормальный) относится к категории
белков, способных к образованию кластеров. Отсюда напрашивается вывод: разобравшись,
каким образом мутация приводит к паркинсонизму, можно раскрыть тайну
образования телец Леви в дофаминпродуцирующих клетках черной субстанции при
болезни Паркинсона.
Альфа-синуклеин
- это небольшой белок, состоящий всего из 144 аминокислот. Полагают, что он
участвует в обмене сигналами между нейронами. Мутации в его гене приводят к
минимальным изменениям в аминокислотной последовательности белка. В настоящее
время идентифицированы несколько таких мутаций, две из них приводят к единичным
аминокислотным заменам. Опыты на дрозофилах, нематодах и мышах показали, что
если мутантный альфа-синуклеин образуется в нейронах черной субстанции в
больших количествах, то происходит их дегенерация и возникают двигательные
расстройства. Обнаружено также, что мутантные альфа-синуклеины не упаковываются
надлежащим образом и образуют кластеры - тельца Леви. Кроме того, они подавляют
деятельность убиквитин-протеасомной системы и устойчивы к протеасомной
деградации. Недавно обнаружилось, что при наличии в геноме избыточных копий
нормального гена альфа-синуклеина также развивается болезнь Паркинсона. В 1998
г. японские ученые Есикуни Мицуно (Yoshikuni Mizuno) из Университета Джунтендо
и Нобуёси Шимицу (Nobuyoshi Shimizu) из Университета Кейо идентифицировали еще
один ген - он кодирует белок паркин, мутация в котором приводит к
наследственному паркинсонизму, но другого типа. Такая мутация обычно
встречается у людей, заболевших в возрасте до 40 лет, и чем моложе пациент, тем
выше вероятность, что в основе заболевания лежит мутация в гене паркина. Те,
кто получают мутантные копии гена и от отца, и от матери, обязательно
заболевают, но к группе риска относятся и люди, несущие лишь одну копию
мутантного гена. Мутации в гене паркина встречаются чаще, чем в гене
альфа-синуклеина, однако точные цифры неизвестны. В последнее время появились
сообщения об идентификации целого ряда других генов, имеющих отношение к
паркинсонизму.
3)
Лечение Паркинсона сегодня
Врачи
используют два основных подхода к лечению паркинсонизма. У каждого есть свои
преимущества и недостатки, однако оба лишь смягчают симптомы заболевания, не
устраняя его причины.
.1
Лекарственная терапия
Сегодня
применяются лекарственные средства, имитирующие действие дофамина, вещества -
метаболические предшественники дофамина (например, леводопа) и препараты,
блокирующие разрушение дофамина. Кроме того, используются лекарства,
действующие на некоторые недофаминовые системы головного мозга, страдающие при
паркинсонизме, такие, в частности, где нейромедиаторами служат ацетилхолин и
глутамат. Многие из них помогают на начальных стадиях заболевания, но при
длительном приеме вызывают побочные эффекты. Основной из них - непредсказуемые
переходы от нормального состояния к периодам заторможенности, тремора и
ригидности. Кроме того, возникают дискинезии, особенно сильно выраженные у
молодых пациентов.
.2
Стимуляция глубинных структур мозга
В
начале XX века ученые обнаружили, что разрушение небольшого числа клеток
структур мозга, отвечающих за аномальную двигательную активность, уменьшает
тремор. И хотя подобная операция сопровождается мышечной слабостью, больные
предпочитают лечь под нож, чем жить с постоянно трясущимися руками. В 1938 г.
хирурги провели операцию на базальных ганглиях, которая дала положительный
результат. Обнаружилось, что устранение гиперактивных или неправильно
реагирующих на сигнал клеток приводит к нормализации работы остальных отделов
мозга. К несчастью, хирургическое вмешательство не стало решением всех проблем.
Если при этом затрагивались оба полушария или место разрушения подкорковых
структур было выбрано не совсем точно, могли возникнуть такие серьезные
осложнения, как нарушение речи и когнитивных функций. В 1970-х гг.
обнаружилось, что высокочастотная электростимуляция отдельных частей головного
мозга имитирует их разрушение, не вызывая при этом никаких побочных эффектов.
Сегодня методы стимуляции головного мозга в разных вариантах используются для
лечения многих неврологических расстройств (см. статью «Чудеса магнитотерапии»,
«В мире науки», №12, 2003 г.). Больным паркинсонизмом в одну из структур
базального ганглия (бледный шар или субталамическую область) вводят электрод,
подсоединенный к генератору электрических импульсов, который имплантирован в
область грудной клетки. Длительность импульса составляет 90 микросекунд,
амплитуда - три вольта, частота - 185 импульсов в секунду. Генератор подлежит
замене каждые пять лет. После того как разработчики этого метода, Алим Бенабид
(Alim Benabid) и Пьер Поллак (Pierre Pollak) из Гренобльского университета во
Франции, сообщили, что подобная стимуляция приводит к значительному уменьшению
тремора и ригидности, метод вышел на одно из первых мест в лечении
паркинсонизма. Иногда на фоне стимуляции удавалось существенно снизить дозу
принимаемых препаратов и даже вообще обходиться без них. Впрочем, стимуляция
глубинных структур головного мозга не может остановить патологический процесс и
не решает проблем, связанных с утратой когнитивных функций, расстройств речи и
чувства равновесия. Среди нерешенных проблем остается и такая: является ли
бледный шар и субталамическая область оптимальными для подобных воздействий?
Неясно также, какие именно электрические и химические процессы отвечают за
смягчение симптомов. Считалось, что стимуляция глубинных структур мозга
вызывает тот же эффект, что и хирургическое вмешательство, а именно - разрушает
клетки. Однако недавно выяснилось, что эта процедура приводит к повышению
частоты импульсации.
.3
Новые подходы к лечению болезни
Сегодня
все усилия ученых направлены на поиски лекарственных средств, которые
воздействовали бы на активность молекул (участников патологического процесса)
таким образом, чтобы не только смягчались симптомы болезни, но и
останавливались дегенеративные процессы, ответственные за ее прогрессирование.
Уже получены два крайне интересных результата. Так, опыты на животных показали,
что повышение концентрации шаперонов в клетках черной субстанции приводит к
блокированию нейродегенеративного действия мутантного альфа-синуклеина. А в
ходе экспериментов с использованием дрозофилы как модельной системы
установлено, что вещества, повышающие активность шаперонов, продлевают жизнь
нейронов. Обнаружено также, что при повышении содержания немутантного паркина в
клетках снижается действие неправильно упакованных белков. Возможно, со
временем удастся разработать препараты, сходные с шаперонами, которые
воздействовали бы на аномальные процессы в нейронах и предотвращали их гибель,
или с помощью генной терапии запускать синтез нужных шаперонов. Параллельно
развивается и другое направление, основанное на введении в головной мозг
больных нейротропных факторов, способствующих росту и дифференцировке нейронов.
Они не только облегчают состояние больного, но и защищают нейроны от вредных
воздействий и даже восстанавливают уже поврежденные клетки.
Так,
опыты, проведенные на животных, показали, что семейство белковых факторов под
названием GDNF (от англ. glial cell line-derived neurotrophic factor -
нейротропный фактор, происходящий из линии глиальных клеток), повышает
устойчивость к повреждениям дофаминергических нейронов и существенно смягчает
симптомы болезни. Стив Гилл (Steve Gill) из госпиталя Френхей в Бристоле
отважился на смелый эксперимент: он инъецировал GDNF больным паркинсонизмом.
Для этого был введен катетер в левое и правое полосатое тело, куда в основном
поступает дофамин, секретируемый нейронами черной субстанции. GDNF инфузировали
с помощью насоса, имплантированного в брюшную полость. Количества GDNF в
емкости насоса хватало на месяц, новую порцию препарата вводили с помощью шприца.
Предварительные результаты испытаний, проведенных на небольшом числе пациентов,
указали на смягчение симптомов, а позитронно-эмиссионное сканирование
подтвердило частичное восстановление поглощения дофамина в полосатом теле и
черной субстанции. Однако последующие более масштабные испытания оказались не
столь обнадеживающими. И все же в медицинской практике нередки случаи, когда
первые попытки применения новых методов терпели неудачу. Так, препарат левопода
поначалу не давал никакого положительного эффекта, а сегодня является одним из
основных лекарственных средств, используемых для лечения паркинсонизма. Не
стоят на месте и исследования в области генной терапии. Джеффри Кордоувер
(Jeffrey H. Kordower) из Чикагского медицинского пресвитерианского центра св.
Луки в Раше и Патрик Эбишер (Patrick Aebischer) из Института неврологии в
Федеральном технологическом институте в Швейцарии сконструировали вирус,
несущий ген фактора GDNF, и ввели его в дофаминпродуцирующие клетки полосатого
тела четырех обезьян, больных паркинсонизмом. Результаты превзошли все
ожидания: двигательные расстройства у животных почти исчезли, никак на них не
подействовали инъекции МРТР, вещества, токсичного для дофаминергических
нейронов черной субстанции. Введенный ген функционировал в организме и
«снабжал» его белком в течение шести месяцев, после чего эксперимент был
остановлен. Воодушевленные такими результатами, ученые из компании Ceregene в
Сан-Диего использовали аналогичный подход для доставки в организм другого белка
из семейства GDNF-нейртурина. Испытания находятся пока на доклинической стадии,
однако ученые надеются испытать новый белок и на человеке. Крис Банкиевич
(Krys Bankiewicz) в сотрудничестве с компанией Avigen (Сан-Франциско) показал в
опытах на животных, что введение в область полосатого тела гена, кодирующего
фермент под названием декарбоксилаза ароматических аминокислот, стимулирует
выработку дофамина. У крыс и обезьян при этом смягчаются симптомы заболевания.
Вскоре предполагается проведение соответствующих клинических испытаний на
человеке. Майкл Каплит (Michael Kaplitt) из Корнеллского университета пытается
использовать генную терапию в других целях - для «отключения» тех областей
головного мозга, которые проявляют излишнюю активность при существенном
уменьшении количества дофамина, высвобождаемого черной субстанцией. В число
таких областей входит гипоталамическое ядро базального ганглия. (В отсутствие
дофамина нейроны синтезируют глутамат, один из возбудительных нейромедиаторов,
что приводит к гиперстимуляции его мишеней и к двигательным расстройствам.)
Каплит планирует провести испытания на человеке, используя вирусный вектор для
адресной доставки гена декарбоксилазы глутаминовой кислоты. Этот фермент играет
ключевую роль в синтезе гамма-аминомасляной кислоты (ГАМК), ингибиторного
нейромедиатора. Есть надежда, что ГАМК предотвратит гиперактивацию клеток,
отвечающую за чрезмерную двигательную активность. Для доставки вектора
используется трубка толщиной с человеческий волос, вводимая в мозг через
крошечное отверстие в теменной области черепа. Вирус, оказавшись в мозге,
снабжает копиями гена нейроны гипоталамического ядра. Кодируемый этим геном
белок не только «усмиряет» слишком активные нейроны, расположенные в данной
области, но, возможно, проникает и в другие места, которые тоже ведут себя
неспокойно. Пожалуй, наиболее жаркая дискуссия развернулась вокруг возможности
замены погибших клеток новыми путем трансплантации. При этом предполагалось
использовать эмбриональные стволовые клетки и стволовые клетки взрослого организма,
запрограммированные на превращение в дофаминпродуцирующие нейроны. Источником
эмбриональных стволовых клеток должны служить эмбрионы, полученные в пробирке
путем искусственного оплодотворения, - сегодня такой подход вызывает резкое
неприятие в силу его неэтичности. Использование стволовых клеток взрослого
организма считается более приемлемым, однако с ними трудно работать. Несмотря
на значительные успехи в идентификации молекулярных процессов, побуждающих
недифференцированные клетки синтезировать дофамин, неизвестно, даст ли
трансплантация должный эффект. До сих пор все клинические испытания с
привлечением тщательно разработанных методик проводились с использованием
материала, взятого от плода. При том что сотни тысяч трансплантированных
дофаминпродуцирующих клеток успешно приживались, положительные функциональные
изменения были в лучшем случае умеренными и к тому же нестабильными, а кроме
того, наблюдались серьезные побочные эффекты, в частности дискинезия
(непроизвольные, нерегулярные движения, от кратковременных до медленных
вращательных). О полноценных испытаниях на человеке можно будет говорить только
тогда, когда станут ясны причины недостаточной эффективности трансплантации и
устранены побочные эффекты. Тем временем продолжаются работы по усовершенствованию
методов лечения, отличных от стимуляции глубинных структур мозга, а именно -
подведение импульсов электрического тока. Несколько месяцев назад Стефан Пальфи
(Ste'phan Palfi) из госпиталя Фредерика Жолио при центре CEA в Орси сообщил,
что мягкая стимуляция поверхности головного мозга облегчает состояние павианов
с симптомами болезни Паркинсона. Сейчас во Франции и других странах идет
подготовка к клиническим испытаниям этого метода.
Заключение
Новые
исследования метаболизма белков обещают возможность применения действительно
революционных методов лечения болезней человека, связанных с нарушением
метаболизма белков в результате синтеза аномальных белков с измененными
функциями и накоплением белковых отходов в клетке. Примеры таких аномальных
белков - длинные вязкие амилоидные волокна, найденные в клетках мозга,
страдающих болезнью Альцхеймера.
Несмотря
на то, что многое в этиологии и патогенезе болезни Паркинсона остается неясным,
успехи, достигнутые за последние годы в изучении этой патологии на клеточном,
молекулярном и генетическом уровнях, вселяют большие надежды. В сочетании с
традиционными методами лечения новые подходы, несомненно, облегчат состояние
многих больных и предотвратят прогрессирование мучительного недуга. В
нормальных клетках правильную пространственную укладку белковых молекул
обеспечивают сложные комплексы - «шапероны». Когда белки упаковываются
ненадлежащим образом или в результате каких-то воздействий утрачивают
нормальную пространственную конфигурацию, шапероны исправляют ситуацию. Если
шаперонная система не работает, то белок остается уложенным неправильно и
протеасома («чистильщик» клетки) расщепляет его, прежде чем он успевает
причинить какой-либо вред.
Существует
большое количество веществ, которые могли бы служит для лечения заболевания,
связанные с нарушением фолдинга белка или для правильного фолдинга белка в
биоинженерных системах производства. Попытки разработать метод быстрого
скрининга для выявления большого количества потенциально полезных молекул
получают хорошее финансирование.
Список
используемой литературы
1)Биохимия: Учеб. для вузов,
Под ред. Е.С. Северина., 2003. 779 с.
<http://www.biochemistry.ru/biohimija_severina/B5873Part6-34.html>
2)Википедия. Свободная энциклопедия.
https://ru.wikipedia.org/wiki/ Предшественник_бета - амилоида
3)Википедия. Свободная
энциклопедия. <https://ru.wikipedia.org/wiki/Протеасома>
)Википедия. Свободная
энциклопедия. https://ru.wikipedia.org/wiki/Убиквидин 5)Википедия. Свободная
энциклопедия. <https://ru.wikipedia.org/wiki/ Черная>_субстанция
)Лосано А, Калиа С. Новые
подходы к лечению болезни Паркинсона.// «В МИРЕ НАУКИ
<http://www.sciam.ru/>», октябрь 2005 № 10
) Медпортал.
<http://medportal.ru/mednovosti/news/2014/07/18/647preeclampsia/>
) Rus Docs
<http://www.rusdocs.com/> Новости, интернет сервисы, описания программ,
новинки железа. Биотехнологии. http://www.rusdocs.com/belkovaya-terapiya-i-nepravilnyj-folding-belka