Производные альдегидов. Взаимосвязь химических свойств и биологического действия
Министерство Здравоохранения Украины
Запорожский Государственный
Медицинский Университет
Кафедра Фармацевтической Химии
Курсовая работа
на тему: "Производные
альдегидов. Взаимосвязь химических свойств и биологического действия. "
Работу выполнил:
Студент 3 курса, 9 группы.
Фармацевтического факультета.
Луцик Д.Ю.
Работу проверил:
Кандидат фармацевтических наук, доцент
Портная Е.А.
Запорожье 2013
План
Введение
Альдегиды и его производные
Взаимосвязь химических свойств и биологического действия
Физико-химические свойства альдегидов
Методы анализа альдегидов
Раствор формальдегида. Формалин Solutio Formaldehydi М. м 30,03
Методы анализа Формальдегида
Применение формальдегида
Гексаметилентетрамин. Уротропин Hexamethylentetraminum
Методы анализа Уротропина
Применение
Заключение
Список литературы
Введение
Соединения углерода, которые накапливались в растениях ранних
эпох, большей частью подверглись превращениям под влиянием анаэробных бактерий.
Из остатков отмерших - растений образовались торф и каменный уголь. Этому
процессу способствовало высокое давление минеральных отложений, которые
постепенно осаждались на остатках растений. Движение земной коры, связанное с
образованием гор, также благоприятствовало появлению угля, поскольку при этом
повышались давление и температура.
Нефть и природный газ возникали на дне огромных озер и морей,
где было необычайно много водорослей и водных животных. Погибая, они
погружались на дно и без доступа воздуха, под влиянием бактерий превращались в
гниющий ил. При гниении выделялся ядовитый сероводород, губительно действующий
на остальные живые организмы. Из органических веществ возникали вначале жирные
кислоты, а позднее - нефть и природный газ. Особенно благоприятными условиями
для таких процессов отличался пермский период палеозойской эры. Именно с тех
пор существуют многие из крупных месторождений нефти.
Из остатков погибших растений и животных образовался тот
самый бурый уголь, который в настоящее время используется во многих отраслях
народного хозяйства. Он служит одним из важнейших видов сырья для химической
промышленности.
Бензин и бытовой газ, растворители, пластмассы и красители,
новые лекарства и духи - все продукты органической химии рождаются из этого
сырья. За многие миллионы лет природа накопила богатейшие запасы углерода и его
соединений. И если сейчас мы все еще вынуждены сжигать значительную часть этого
сырья для получения энергии, то это, в сущности, неразумное расточительство.
Будем надеяться, что атомная энергия вскоре позволит нам использовать уголь и
нефть только как сырье для химической промышленности.
Альдегиды и
его производные
Альдегиды
(от лат.
<#"822560.files/image001.gif">
Подобное разделение зарядов подтверждается физическими методами
исследования и во многом определяет реакционную способность альдегидов, как
выраженных электрофилов
<#"822560.files/image002.gif">
Исключение составляет формальдегид, в молекуле которого
карбонильный атом углерода связан с двумя водородами. В кетонах с карбонильным
углеродом связаны две алкиль-ные группы (R и R'), а в сложных эфирах - одна
алкильная, другая - алкоксильная группа (R'O-). Все эти типы соединений,
содержащие одну и ту же функциональную группу (карбонильную), имеют много общих
свойств, общих реакций идентификации, обусловленных именно этой группой. В свою
очередь каждое из этих соединений имеет и частные, специфические реакции
идентификации, отличающие их друг от друга. Физиологическое действие
препаратов, имеющих в молекуле альдегидную группу, различно и зависит главным
образом от характера алкильного остатка, связанного с карбонильным углеродом
(табл. 1).
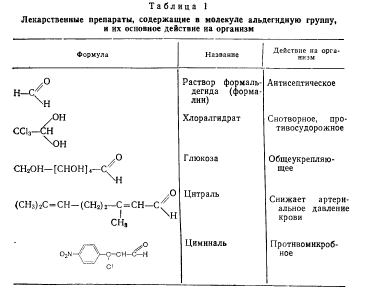
Взаимосвязь
химических свойств и биологического действия
Удлинение алкильного радикала в молекуле
альдегида приводит к усилению физиологической активности, но вместе с этим
возрастает и токсичность.
Введение галогена в молекулу альдегида
повышает его наркотическое (снотворное) действие. Так, наркотические свойства
хлораля более выражены, чем у ацетальдегида.

Альдегидная группа усиливает токсичность
вещества, но она может быть значительно снижена путем образования гидратной
формы альдегида.
Способность к образованию гидратной формы
проявляется лишь у хлорированного альдегида. Так, гидратная форма хлораля мало
токсична, в такой форме хлораль применяется в медицине под названием
хлоралгидрата, проявляющего снотворное действие.
Физико-химические
свойства альдегидов
По физическим свойствам альдегиды могут быть газообразными
(формальдегид), жидкими (низшие альдегиды) и нерастворимыми твердыми (высшие
альдегиды) веществами.
Альдегиды хорошо растворяются в спирте и
эфире. Низшие альдегиды имеют неприятный удушливый запах. Альдегиды с большой
молекулярной массой обладают приятным цветочным запахом.
В химическом отношении альдегиды весьма
реакционноспо-собные соединения, что обусловлено наличием в их молекуле сильно
поляризованной двойной связи, за счет которой протекает большинство реакций,
характеризующих химические свойства альдегидов. Многие из этих реакций,
например образование оксимов, семикарбазонов и ряда других соединений,
используются для качественного и количественного анализа лекарственных
препаратов из группы альдегидов.
Из химических свойств альдегидов, лежащих
в основе реакций их идентификации, необходимо отметить следующие:
. Альдегиды легко окисляются, являясь сами
хорошими восстановителями. Восстановительная способность альдегидов выражается
следующими реакциями:
альдегид формальдегид химическое свойство
а) реакция с аммиачным раствором нитрата
серебра (образование серебряного зеркала); при добавлении к аммиачному раствору
нитрата серебра раствора альдегида при нагревании

Применяя данные реакции в фармацевтическом
анализе, надо учитывать их чувствительность. Так, для идентификации препарата с
альдегидной группой в молекуле следует применить реакцию с нитратом серебра и
реактивом Фелинга, а для обнаружения альдегидов как примесей в лекарственных
препаратах следует применить более чувствительную реакцию (с раствором
Несслера).
. Реакции присоединения представляют
интерес для фармацевтического анализа потому, что продукты присоединения
альдегидов характеризуются определенной для каждого альдегида температурой
плавления.
Так, альдегиды легко присоединяют
бисульфит натрия, образуя бисульфитные производные альдегидов - кристаллические
вещества, имеющие определенную температуру плавления.
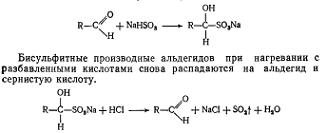
Бисульфитные производные альдегидов при
нагревании с разбавленными кислотами снова распадаются на альдегид и сернистую
кислоту.
Этой реакцией пользуются не только для
идентификации препарата с альдегидной группой в молекуле, но и для очистки
альдегидов и выделения их из смесей с другими веществами, не реагирующими с
гидросульфитом натрия.
К реакциям присоединения относится также
реакция взаимодействия альдегидов с фуксинсернистой кислотой1, при
которой раствор окрашивается в красный или красно-фиолетовый цвет. При
добавлении к реакционной смеси минеральных кислот окрашивание исчезает.
Исключение составляет лишь формальдегид, в присутствии которого окраска не
исчезает. Поэтому реакцию считают специфичной для формальдегида.
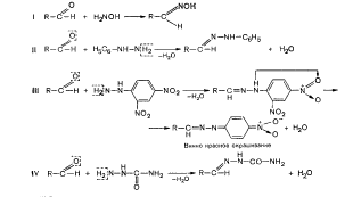
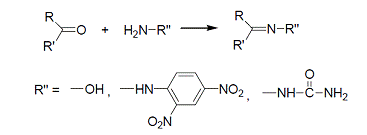
. Реакции замещения - это реакции
взаимодействия альдегидов с аминами и их производными, например с
гидроксиламином (I), фенилгидразином (II), 2,4-динитро-фенилгидрази-ном (III),
семиркарбазидом (IV) и др.
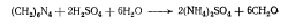
Продукты взаимодействия этих веществ с
альдегидами выпадают в виде осадков и после высушивания имеют определенную
температуру плавления или окраску (2,4-динитрофенилгидразин), поэтому эти
реакции используются для идентификации препаратов, имеющих в молекуле
альдегидную группу.
Фармакопейными препаратами из группы
альдегидов являются: раствор формальдегида (формалин), хлоралгидрат и глюкоза.
В этой группе лекарственных препаратов мы
рассматриваем также гексаметилентетрамин, физиологическое действие которого
обусловлено формальдегидом, выделяющимся в кислой среде при разложении гексаметилентетрамина.
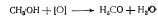
Методы
анализа альдегидов
· Присоединение бисульфита натрия. Альдегиды
и многие кетоны образуют с 40% раствором бисульфита натрия труднорастворимые
соединения, которые при кипячении с разбавленными кислотами или щелочами снова
разлагаются на исходные соединения.
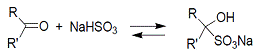
· Реакции с гидроксиламином,
2,4-динитрофенилгидразином и семикарбазидом.
Реакция альдегидов и кетонов с указанными соединениями в
условиях кислотного катализа протекает по типу присоединения-отщепления с
образованием оксимов, 2,4-динитрофенилгидразонов и семикарбазонов
соответственно.
взаимодействием с гидроксиламином оксимы очень неустойчивы и
склонны к
саморазложению, а реакция с 2,4-динитрофенилгидразоном для
многих
альдегидов и кетонов протекает очень медленно, однако
образование желтого осадка 2,4-динитрофенилгидразона делает ее более подходящей
для качественного анализа, чем получение оксимов.
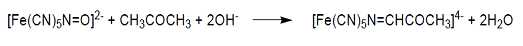
· Реакция с нитропруссидом натрия. Альдегиды
и кетоны, способные к образованию енолов, реагируют с нитропруссидом натрия,
давая красное окрашивание. В случае альдегидов при продолжительном стоянии или
после добавления уксусной кислоты окраска бледнеет и затем полностью исчезает.
· Кетоны дают более интенсивное окрашивание,
которое после подкисления уксусной кислотой изменяет свой цвет.
· Формальдегид, глиоксаль, бензальдегид,
ванилин, бензофенон и некоторые другие соединения, а также кетоны с длинной
углеродной цепью не дают этой реакции.
Описанные ранее тесты позволяют установить наличие
карбонильной группы в соединении, однако не позволяют сказать альдегиду или
кетону она принадлежит.
Соотнесение можно сделать на основании качественных реакций,
характерных только для альдегидов.
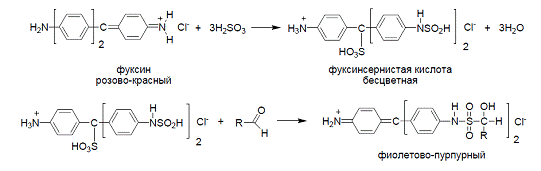
· Проба с фуксинсернистой килотой.
Фуксинсернистая кислота, получаемая из фуксина пропусканием SO2, в присутствии
альдегидов окрашивается в фиолетово-пурпурный цвет.
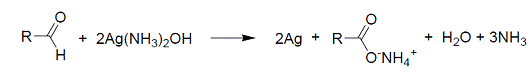
Некоторые соединения способны регенерировать розово-красную
окраску фуксина, поэтому положительной пробой считается лишь та, где появляется
фиолетово-пурпурная окраска.
Реакция не идет с ванилином, хлоральгидратом, пара-аминобензальдегидом.
Вместо фуксина может быть использован обесцвеченный сернистой
кислотой раствор малахитового зеленого. В этом случае в присутствии альдегида
появляется зеленое окрашивание, однако эта реакция менее чувствительна.
· Реакция с реагентом Толленса.
Взаимодействие альдегидов с реактивом Толленса (аммиачным раствором оксида
серебра) сопровождается либо образованием серо - черного осадка
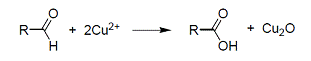
Положительная реакция наблюдается с некоторыми ароматическими
аминами, многоатомными фенолами, аминофенолами и α-дикетонами.
Взаимодействие с реагентом Фелинга. Прибавление альдегида к
раствору реактива Фелинга и последующее нагревание вызывает появление красного
осадка оксида меди (I).

· Обнаружение по каталитическому ускорению
реакции окисления пара-фенилендиамина пероксидом водорода. пара-Фенилендиамин
окисляется в кислом или нейтральном растворе в черные хиноидные соединения.
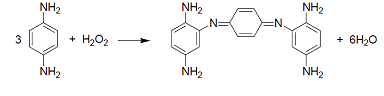
Окисление значительно ускоряется в присутствии альдегидов. В
нейтральных растворах все альдегиды дают черное окрашивание или черный осадок,
образованию которого предшествует появление ряда промежуточных окрасок. В
кислой среде алифатические альдегиды ведут себя так же, тогда как большинство
ароматических альдегидов образуют вначале сохраняющуюся в течение некоторого
времени желтое окрашивание или желтый осадок. Эта особенность позволяет
различать ароматические и алифатические альдегиды.
Токсичны. Способны накапливаться в организме. Кроме
общетоксического, обладают раздражающим и нейротоксическим
<#"822560.files/image019.gif">
Раствор
формальдегида. Формалин Solutio Formaldehydi М. м 30,03
Формальдегид получают в промышленности
путем окисления метилового спирта.
Для этого через нагретый до 50°С метиловый
спирт пропускают ток воздуха, который насыщается парами метилового спирта и
поступает в трубку с раскаленной медной спиралью (медь играет роль
катализатора).
% раствор формальдегида в воде Solutio
Formaldehydi является фармацевтическим препаратом и описан в фармакопее.
Он представляет собой прозрачную
бесцветную жидкость с острым своеобразным запахом.
Для подтверждения идентификации препарата
можно' применить все те общие реакции, которые характерны для альдегидов (см.
выше), однако для формальдегида существуют и частные, специфические реакции,
отличающие его от других альдегидов.
Методы
анализа Формальдегида
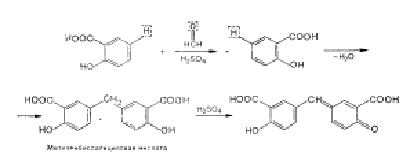
К таким реакциям относится, например,
реакция взаимодействия формальдегида с фенолами в присутствии концентрированной
серной кислоты, при этом образуются окрашенные продукты реакции.
ГФ X рекомендует для этой цели
фенолокислоты - салициловую или хроматроповую.
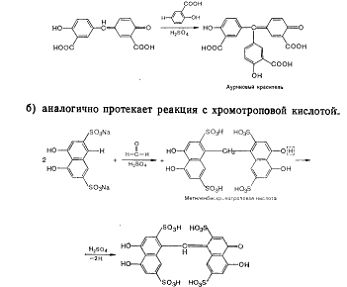
Нa первой стадии реакции концентрированная
серная кислота играет роль водоотнимающего агента, вследствие чего происходит
конденсация фенола с формальдегидом с образованием метиленбис-салициловой
кислоты, которая окисляется серной кислотой до хиноидной структуры. Последняя
вступает во взаимодействие с непрореагировавшей в реакции салициловой кислотой.
В присутствии серной кислоты происходит
окисление с образованием ауринового красителя красного цвета.

При низкой температуре (ниже 9°С)
формальдегид легко полимеризуется, образуя параформ (СН20) п,
который выпадает в виде белого осадка. Параформ уже не обладает теми
свойствами, которые присущи раствору формальдегида как медицинскому препарату.
Поэтому нельзя хранить раствор формальдегида при температуре ниже 9°С.
В растворе формальдегида возможна примесь
муравьиной кислоты, которая может образовываться при получении формальдегида.
Поэтому ГФ X устанавливает допустимый предел кислотности в препарате, а для
предупреждения возможных окислительно-восстановительных процессов и для
стабилизации препарата к нему добавляют метиловый спирт (не более 1%).
Количественное определение препарата
основано на способности альдегида окисляться. В качестве окислителя можно
использовать йод, пероксид водорода, реактив Несслера.
ГФ X рекомендует йодометрический метод
определения формальдегида, при котором формальдегид окисляется йодом.
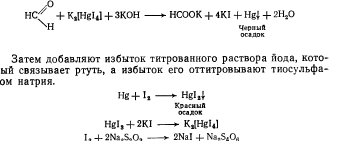
Выделившийся йод оттитровывают
тиосульфатом натрия. Разность между количеством йода и тиосульфата натрия,
пошедшего на оттитровывание йода, равна количеству йода, пошедшему на окисление
формальдегида.
Расчет содержания формальдегида в препарате (%) проводят по
формуле: где:
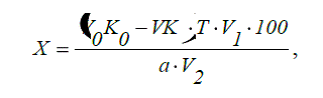
а - навеска препарата, взятая для определения, г (1
г);
V1 - объем раствора препарата первого разведения,
мл (100 мл);
V2 - объем аликвотной части разведения, взятый для
определения, мл (1 мл);
Vo - объем избытка стандартного раствора (I2),
реагирующего с определяе - мым веществом, мл (4 мл);
V - объем стандартного раствора (Na2S2O3),
пошедший на титрование избытка раствора I2, мл;
Ко, К - поправочные коэффициенты к титру стандартных
растворов I2 и Na2S2O3, соответственно;
Т - титр титранта по
определяемому веществу.
Этот метод пригоден в том случае, если
раствор формальдегида не имеет примесей других альдегидов и ацетона, которые
также реагируют с йодом.
Применение
формальдегида
Раствор формальдегида применяется в медицине как
дезинфицирующее средство. Действие его основано на способности свертывать
белок. Белковые вещества бактерий свертываются под влиянием формальдегида, что
приводит их к гибели. Являясь протоплазматическим ядом, раствор формальдегида
не может назначаться внутрь. Он применяется как дезинфицирующее средство для
мытья рук хирургов, обработки хирургических инструментов (0,5% раствор),
обмывания ног при потливости (0,5-1% раствор), спринцеваний в разведении 1:
1000 - 1: 3000.
Так как раствор формальдегида способен
придавать тканям упругость, его часто применяют для консервации анатомических и
биологических препаратов.
Хранение формальдегида Основная трудность связана
с химической неустойчивостью формальдегида, которая проявляется в склонности к
спонтанной полимеризации и к различным реакциям превращения. В закупоренных
флаконах в защищенном от света, прохладном месте. Поскольку формальдегид
тяжелее воздуха, при выделении в атмосферу помещения он опускается к полу, где
его концентрация становится максимальной. Поэтому при проектировании вентиляции
вытяжные отверстия должны быть расположены в 20-30 см от пола, а приточные - на
потолке или под ним. При работе с формальдегидом необходимо использовать
индивидуальные средства защиты. Не принимать пищу и воду во время работы с
формалином. Хранить формалин следует в герметично закрытых емкостях в местах с
ограниченным доступом. Формалин - пожароопасная жидкость! Температура кипения
формальдегида +19, 20С. Поэтому при работе с формалином следует соблюдать
правила противопожарной безопасности.
Гексаметилентетрамин.
Уротропин Hexamethylentetraminum
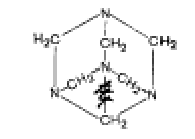
Физико-химические
свойства Гексаметилентетрамин
представляет собой продукт взаимодействия раствора формальдегида с аммиаком.
Впервые его получил А.М. Бутлеров (1860), но только 35 лет спустя после
открытия он стал применяться в медицине.
Гексаметилентетрамин - белый
кристаллический порошок, весьма гигроскопичный. Запаха не имеет. Вкус жгучий,
вначале сладкий, затем горьковатый. Препарат хорошо растворим в воде и спирте,
растворим в хлороформе, почти нерастворим в эфире. Водные растворы
гексаметилентетрамина обладают слабощелочной реакцией. При нагревании
улетучиваются не плавясь. При нагревании водных растворов гексаметилентетрамина
он гидролизуется с образованием формальдегида и аммиака.
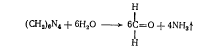
Гексаметилентетрамин является
однокислотным основанием, третичный азот придает ему основные свойства, поэтому
с кислотами он образует двойные соли, например гидрохлорид
гексаметилентетрамина. Наличие третичного азота, как у алкалоидов,
обусловливает также образование пикратов (желтый осадок), тетрайодидов (СН2)
в^-14 и других продуктов реакций. Гексаметилентетрамин обладает способностью
давать комплексные соединения с солями серебра, кальция и фосгеном.
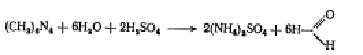
Методы анализа
Уротропина
Идентифицируют Уротропин в кислой среде гексаметилентетрамин
разлагается с выделением формальдегида. При добавлении к реакционной смеси
раствора щелочи ощущается запах аммиака.
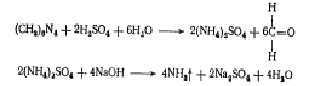
Количественное содержание препарата можно определить методом
нейтрализации. Навеску препарата нагревают с определенным количеством
титрованного раствора серной кислоты, после охлаждения смеси избыток кислоты
оттитровывают щелочью по метиловому красному. Параллельно в тех же условиях
проводят контрольный опыт (фармакопейный метод).
5 мл 10 % раствора помещают в мерную колбу вместимостью 50 мл
и доводят объем раствора водой до метки. К 2 мл разведенного раствора
прибавляют 2 мл воды, 2 капли раствора метилового оранжевого, 1 каплю раствора
метиле - нового синего и титруют 0,1 н. раствором хлороводородной кислоты до
фиолетового окрашивания.
1 мл 0,1 н. раствора хлороводородной кислоты
соответствует 0,0140 г гексаметилентетрамина.
Для анализа 2 % раствора берут 1 мл раствора гексаметилентетрамина,
прибавляют 2 капли раствора метилового оранжевого, 1 каплю раствора
метиленового синего и титруют 0,1 н. раствором хлороводородной кислоты до
фиолетового окрашивания.
Количественное содержание гексаметилентетрамина (х, %) в 10 %
растворе рассчитывают по формуле:
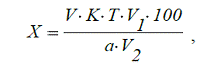
где:
V1 - объем раствора препарата после первого
разведения, мл (50 мл);
V2 - объем аликвотной части разведения, взятый для
титрования, мл (2 мл);
V - объем титранта (HCl), пошедший на титрование;
К - поправочный коэффициент к концентрации раствора
титранта;
Т - титр титранта по определяемому веществу.
Применение
Гексаметилентетрамин применяется как
дезинфицирующее средство. Его действие основано на образовании формальдегида в
кислой среде, который и оказывает дезинфицирующее действие. Применяется при
заболевании мочевых путей. Следует учитывать при этом, что, если моча не имеет
кислой реакции, препарат неэффективен, так как расщепления его на формальдегид
не произойдет. Наряду с антисептическим действием гексаметилентетрамин
проявляет в некоторой степени и противо-"одагрическое действие, поэтому
его применяют также при ревматизме.
Гексаметилентетрамин находит широкое
применение и в качестве противогриппозного средства. Препарат назначают внутрь
в порошках и таблетках и внутривенно в виде 40% раствора.
Лек. Форма, хранение Выпускается в порошке и
таблетках по 0,25 и 0,5 г, а также в ампулах по 5-10 мл 40% раствора. Хранить
следует в хорошо закупоренных банках.
Заключение
Человек не знакомый с органической химией и в частности со
свойствами, особенностями, применением альдегидов и кетонов может быть поражен
насколько наша жизнь зависит от группы этих веществ.
Благодаря тому, что получение альдегидов и кетонов возможно
различными простыми и доступными способами, мы не испытываем недостатка во
многих предметах необходимых для нашего существования. Можно привести огромное
число примеров. Вот только некоторые из них: альдегиды необходимы для получения
пластмасс, лаков, лекарственных веществ, красителей, уксусной кислоты. Так же
они находят применение в медицине и электротехнике, парфюмерии и кулинарии.
Список
литературы
1. <http://ladoni.ru/hyperhydrosis-conservat/formalin.html>
. <http://www.balzamirovanie.ru/formalin-kak-balzamiruyushhaya-zhidkost.html>
. <http://farmchem.ru/organicheskie-lekarstvennyie-veschestva/aldegidyi/aldegidyi.html>
. <http://www.xumuk.ru/encyklopedia/167.html>
. Губен-Вейль. Методы
органической химии. Том II. Методы анализа [Текст]: монография / Губен-Вейль. −
М.: Химия, 1967. − 1032 с.
. Файгль Ф. Капельный
микроанализ органических веществ [Текст]:
. монография / Файгль
Ф. − М.: ГХИ, 1962. − 836 с.
. Идентификация
органических соединений [Текст]: практическое руководство / Шрайнер Р. [и др.].
− М.: Мир, 1983. - 703 с.
. Органикум [Текст]:
руководство к практическим занятиям в 2-х томах / Г. Беккер [и др.]. −
М.: Мир, 1979. - Т.2. - 422 с.