Определение содержания Трилона Б химическим и физико-химическим методами анализа
Введение
Целью данной курсовой работы является
количественное определения содержания Трилона Б (динатриевая соль
этилендиаминтетрауксусной кислоты, комплексон-III, хелатон III, ЭДТА -
C10H14O8N2Na2*2H2O), химическим и физико-химическим методом анализа. В качестве
химического метода используется метод комплексонометрии , а в качестве
физико-химического метода фотометрия.
Трилон Б (динатриевая соль
этилендиаминтетрауксусной кислоты, комплексон-III, хелатон III, ЭДТА -
C10H14O8N2Na2*2H2O)согласно [1], представляет собой белый кристаллический
порошок или кристаллы белого цвета, хорошо растворимые в воде и щелочах
<#"822218.files/image001.gif">
комплексон ІІІ (трилон Б, ЭДТА,
динатрия эдетат)a2H2L ∙ 2Н2О
Комплексоны являются
полидентатными лигандами, которые образуют со многими катионами (Са2+,
Ва2+, Sr2+, Mg2+, Со2+, Сu2+,
Bi3+, Al3+, Zn2+, Fe3+, Ni2+
и др.) очень прочные, хорошо раствори-мые в воде, бесцветные внутрикомплексные
(хелатные) соеди-нения.
Внутрикомплексные соли
образуются всегда в тех случаях, когда катионы металла - комплексообразователя
замещают активные атомы водорода функциональных групп органического соединения,
а также с определенными его группами образуют координационные
(донорно-акцепторные) связи. К группам, в которых атомы водорода способны
замещаться на ионы металла, относятся -СООН, -SО3Н, -ОН, =NOH и др.
Донорно-акцепторную связь с
ионами комплексообразователя способны образовывать группы -NH2, =NH,
-NOH, =S, =СО и др.
Комплексонометрия
(трилонометрия) - титриметрический метод анализа, основанный на реакциях
взаимодействия комплексонов (чаще всего трилона Б), катионами щелочноземельных
и тяжелых металлов, которые приводят к образованию растворимых в воде
бесцветных прочных внутрикомплексных соединений. Трилон Б (комплексон III)
образует внутрикомплексные соединения с катионами металлов за счет валентных
связей с карбоксильными группами, вытесняя из них атомы водорода, а также за
счет координационных связей ионов-комплексообразователей с атомами азота.
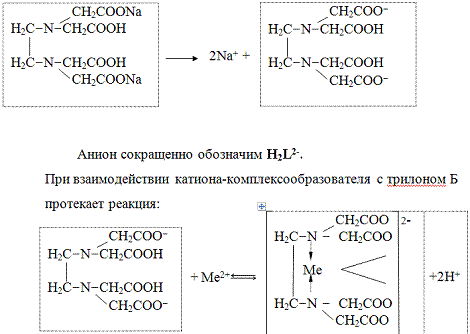
В растворе трилон Б
диссоциирует на ионы:
Во всех случаях независимо от
степени окисления катионов они реагируют с комплексоном в соотношении 1: 1,
поэтому фактор эквивалентности для ЭДТА и катионов металла равен 1.
Схематически реакции
комплексообразования с катионами, имеющими различные степени окисления, можно
представить следующими уравнениями:
H2L2- +
Ме2+ ↔ [MeL]2- + 2Н+2L2-
+ Ме3+ ↔ [MeL]- + 2Н+2L2-
+ Ме4+ ↔ [MeL] + 2Н+
В качестве титранта используют
растворы 0,1; 0,05 или 0,02 моль/дм3трилона Б.
Динатриевая соль
этилендиаминтетрауксусной кислоты (трилон Б, комплексон ІІІ, динатрия эдетат)
гигроскопична, поэтому из нее готовят вторичный стандартный раствор, а затем
определяют его точную концентрацию по стандартным веществам - химически чистыми
Zn, ZnO, СаСО3. Для этого точную навеску стандартного вещества
растворяют в химически чистой серной или хлорово-дородной кислотах, полученный
раствор нейтрализуют раствором NaOH или аммиака, прибавляют аммиачную буферную
смесь и титруют раствором трилона Б. Стандартизуют приготовленный раствор
трилона Б так же - по стандартным растворам ZnSО4 или MgSО4.
Способы фиксирования конечной
точки титрования. При комплексонометрическом титровании используют
металлохромные индикаторы (металлоиндикаторы). Металлоиндикаторы - это
органические красители (мурексид, эриохром черный Т, эриохром сине-черный Б,
цинкон и др.), которые образуют с определяемыми ионами растворимые в воде
окрашенные комплексные соединения, менее прочные, чем комплекс катиона металла
с трилоном Б.
При этом комплекс катиона с
индикатором и свободный индикатор имеют различную окраску:
H2Ind- +
Ме 2+ ↔ [Ме Ind]-
(окраска 1) (окраска 2)
При комплексонометрическом
титровании к анализируемому раствору прибавляют металлоиндикатор, который
образует с определяемыми катионами комплекс, имеющий определенную окраску. В
процессе титрования трилоном Б комплекс катионов металла с индикатором
разрушается и образуется бесцветный, очень прочный комплекс катионов с трилоном
Б, а в раствор переходят ионы свободного индикатора:
[Ме
Ind] - + H2L2 - ↔ [MeL]2 - +
H2Ind -
(окраска 2) (окраска 1)
Конечную точку титрования
определяют по собственной окраске индикатора (окраска 1).
Металлоиндикаторы в водном
растворе неустойчивы. Поэтому их применяют в виде сухих смесей, тщательно
растирая в фарфоровой ступке индикатор с сухими, химически чистыми NaCl или КСl
в соотношении 1 : 100 . или 1 : 200. Для титрования берут сухой стеклянной
ложечкой 20-30 мг этой смеси на 100 мл титруемого раствора.
Условия комплексонометрическоro
титрования:
. Реакции комплексообразования
должны протекать быстро, количественно и стехиометрично, чтобы вблизи точки
эквивалент-ности определяемые катионы были практически полностью связа-ны в
комплекс. Константа нестойкости образующихся комплексов должна быть малой
величиной.
. Определяемые ионы должны
образовывать с металлоиндиктором менее прочные комплексы, чем их комплексы с
трилоном Б.
. Комплексонометрическое
титрование следует проводить при определенном значении рН (рН < 10), так как
в щелочной среде могут образовываться осадки гидроксидов определяемых катионов
или их основные соли.
В процессе титрования при взаимодействии
катионов с трилоном Б в раствор переходят ионы Н+, в результате чего
рН раствора понижается, что приводит к смешению реакции комплексообразования
влево и делает реакцию обратимой. Для поддержания определенного значения рН
титрование следует проводить в присутствии буферных растворов, имеющих
определенное значение рН. Большинство катионов титруют трилоном Б в присутствии
аммиачного буферного раствора NH4ОH + NH4Cl при рН = 9,2.
Очень прочные комплексы с
комплексоном III образуют катионы Fe3+ Sn2+ и другие, их
можно определить в кислой среде. Катионы, образующие менее прочные комплексы с
трилоном Б, не мешают определению, так как не титруются в кислой среде.
Способы комплексонометрического
титрования.
Прямое титрование. К
анализируемому раствору прибавляют аммиачный буферный раствор, металлоиндикатор
и титруют стандартным раствором трилона Б. Способом прямого титрования
определяют катионы Cu2+, Со2+, Pb2+, Ni2+,
Zn2+, Fе3+, Ва2+, Сг3+,Ca2+,
Mg2+ и т. д.
Обратное титрование. К
анализируемому раствору прибавляют аммиачный буферный раствор, затем точно
отмеренный удвоенный минимальный объем (35,00-40,00 см3)
стандартного раствора трилона Б, который вступает в реакцию с определяемыми
ионами, а его избыток оттитровывают стандартным раствором магния сульфата или
цинка сульфата в присутствии металлоиндикатора. При этом протекают реакции:
Ме2+ + H2L2-
↔ [Ме]2- + 2Н+
изб. H2L2-
+ Zn2+ ↔ [ZnL] 2- + 2Н+
Способ обратного титрования
применяют:
· когда реакция
комплексообразования протекает медленно;
· нет подходящего индикатора
для фиксирования конечной точки титрования при прямом способе титрования;
· индикатор образует с
определяемым ионом очень прочный комплекс, который не разрушается комплексоном;
· для определения катионов в
нерастворимых в воде осадках например Са2+ в СаС2О4,
Mg2+ в MgNH4PО4, Рb2+ в PbSО4Заместительное
титрование. Метод основан на том, что большинство ионов образуют с трилоном Б
более устойчивые комплексные соединения, чем комплекс катионов Mg2+
с трилоном Б [MgL] 2- (β = 9,72). После
прибавления к анализируемому раствору комплекса [MgL] 2- протекает
реакция обмена:
[MgL] 2- + Ме2+
→ [MeL] 2- + Mg2+
Эта реакция возможна потому,
что ионы металла образуют с H2L2- более прочное
комплексное соединение [MeL] 2- (β > 9,2), и
равновесие вышеприведенной реакции смещается вправо. Выделившиеся ионы Mg2+
оттитровывают стандартным раствором трилона Б в присутствии металлохромного
индикатора:
Mg2+ + H2L2-
→ [MgL] 2- + 2Н+
Трилонометрическим методом
определяют:
а) общую жесткость воды;
б) практически все катионы
щелочноземельных и тяжелых металлов;
в) в фармацевтическом анализе -
лекарственные формы, содержа-щие катионы щелочноземельных металлов.
Фотометрия
Согласно[4],фотометрический метод
количественного анализа основан на способности определяемого вещества или его
окрашенной аналитической формы избирательно поглощать электромагнитное
излучение в УФ-, видимой или ИК- областях спектра. Наибольшее распространение
получили фотометрические методы анализа с использованием поглощения в видимой
области спектра, т.е. в интервале длин волн 400 - 700 нм. Цветная реакция,
используемая для количественного определения, должна протекать избирательно,
быстро, полностью и воспроизводимо. Окраска образующийся аналитической формы
должна быть устойчивой во времени и к действию света. Основой для
фотометрических методов анализа является закон Бугера - Ламберта - Бера,
который устанавливает зависимость интенсивности монохроматического светового
потока, прошедшего через слой окрашенного раствора J,
от интенсивности падающего потока света J0,
концентрации и толщины слоя окрашенного раствора:
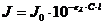
где: ελ - молярный
коэффициент светопоглощения при данной длине волны; l - толщина
поглощающего слоя в см; С - концентрация поглощающего вещества, моль-экв/л.
В логарифмической форме:
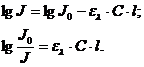
Величина  характеризует
поглощение излучения. Её называют оптической плотностью и обозначают А:
характеризует
поглощение излучения. Её называют оптической плотностью и обозначают А:
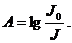
Основной закон светопоглощения
принимает следующий вид:
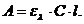
Оптическая плотность раствора прямо
пропорциональна молярному коэффициенту светопоглощения, концентрации
поглощающего вещества и толщине слоя раствора.
При С=1моль-экв/л и l=1см; А=ελ, то есть
молярный коэффициент светопоглощения представляет собой оптическую плотность
раствора с концентрацией 1 моль-экв/л, помещенного в кювету с толщенной слоя 1
см. Величина ελ зависит от
длины волны проходящего света λ, температуры раствора и природы
растворенного вещества.
Закон Бугера - Ламберта - Бера
строго справедлив лишь для разбавленных растворов при следующих условиях:
постоянство состава и неизменность поглощающих частиц в растворе и монохроматичность
проходящего через пробу светового потока. Первое условие выполняется при
соответствующем выборе аналитической реакции и соблюдении одинаковых условий во
всей серии производимых измерений. С целью монохроматизации светового потока,
т.е. чтобы из всей видимой области спектра λ=400 - 700 нм выделить
лучи определенных длин волн на пути световых потоков перед поглощающими
растворами устанавливают избирательные поглотители света, называемыми
светофильтрами,
Светофильтр для фотометрирования
выбирают таким образом, чтобы максимум поглощения окрашенного раствора
соответствовал максимуму пропускания (минимуму поглощения светофильтра).
Пропусканием Т называют отношение 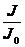 :
:
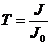
Его значение может изменяться от 0
до 1 или от 0 до 100 %.
Зависимость между пропусканием Т и
светопоглощением или оптической плотностью А выражается уравнением:
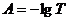 .
.
Наиболее распространенным и точным
методом фотометрических измерений является метод градуировочного графика. По
этому методу готовят 5 - 8 стандартных (или эталонных) растворов анализируемого
вещества с различными, но точными заданными заранее концентрациями. После выполнения
с этими растворами выбранной аналитической реакции измеряют оптическую
плотность полученных окрашенных растворов при определенной длине волны и
толщине слоя относительно растворителя или раствора сравнения, который содержит
все те же реагенты, что и рабочие растворы, кроме определяемого вещества.
Строят график зависимости А = f(С), который называют градуировочным
графиком или градуировочной кривой (рис1).
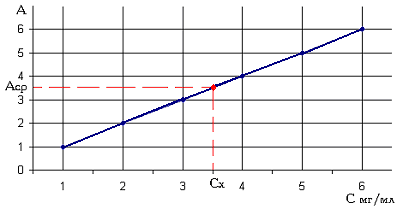
Рис. 1. Зависимость оптической плотности от
концентрации вещества в растворе (градуировочный график).
При строгом выполнении закона светопоглощения
Бугера - Ламберта - Бера градуировочный график представляет из себя прямую
линию, проходящую через начала координат. Используя метод построения
градуировочного графика, количественные фотометрические измерения можно
проводить с высокой степенью точности и при отклонении его от линейности. Но в
этом случае следует увеличить количество эталонных растворов и каждая точка для
построения графика должна быть средним значением не менее трех параллельных
измерений.
Общая схема выполнения фотометрического анализа
включает следующие стадии.
1. Подготовка
пробы и переведение определяемого вещества в раствор в реакционноспособную по
отношению к аналитической реакции форму. Например, при анализе органических
фосфорсодержащих соединений связанный фосфор предварительно переводят в
фосфат-ионы РО43-. Если необходимо определить содержание
хлора в хлорорганических соединениях, его первоначально гидролизуют до
хлорид-ионов Cl-
и т.п.
2. Получение
окрашенной аналитической формы определяемого вещества в результате проведения
цветной реакции.
3. Измерение
светопоглощения полученного раствора аналитической формы.
4. По
величине светопоглощения (оптической плотности) с помощью градуировочного
графика находят концентрацию анализируемого вещества.
Практическая часть
Определение массовой доли Трилона Б методом
обратного комплексонометрического титрования
В данной курсовой работе массовою долю2-водной
динатриевой соли этилендиамин -N,N,N’,N’-тетрауксусной
кислоты, в качестве химического метода анализа, согласно ГОСТ 10652-73,
определяют комплексонометрическим титрованием сернокислого цинка.
Допускаемые расхождения между результатами двух
параллельных определений составляют 0,3%.
Реактивы
. Аммиак водный , с массовой долей 25%
. Вода дистиллированная
. Буферный раствор I
c pH
9,5-10
. Сульфарсазен, раствор с массовой долей
0,05%
. Эриохром черный Т - индикаторная смесь
. Цинк сернокислый, раствор с
концентрацией c (ZnSO4*7H2O)=
0,05 моль/дм3
. Натрий тетраборнокислый 10-водный,
раствор с концентрацией (Na2B4O7*10H2O)=
0,05 моль/дм3.
Оборудование
. Бюретка вместимостью 50 см3 с
ценой деления 0,1 см3.
. Колба коническая вместимостью 100
см3
. Пипетки вместимостью 10 см3
Проведение анализа
Приготовление и стандартизация раствора ZnSO4
.
Схема стандартизации
мл 0,0500 М раствора трилона Б (пипетка) +H2O
дист. (60-80) мл + 10 мл ацетатного буферного раствора (рН= 5,5-6) + (4-5)
капель индикатора ксиленового оранжевого ( 0,5 %-ный раствор). Затем проводят
титрование раствором ZnCl2
до
перехода окраски индикатора из желтой в устойчивую красную.
Проведение анализа
Около 0,5000 г. препарата помещают в коническую
колбу и растворяют в 100 см3. К раствору прибавляют 5 см3
буферного раствора (рН 9,5-10), приблизительно 0,1 г индикаторной смеси -
эриохрома черного Т, перемешиваем и титруем из бюретки раствором 7-водного
сернокислого цинка, до первого изменения окраски из синей окраски в
фиолетово-красную.
Обработка результатов.
Массовую долю 2-водной динатриевой соли
этилендиамина- N,N,N’,N’-
тетрауксусной кислоты (Х) в процентах вычисляют по формуле
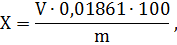
где V- объем раствора
7-водного сернокислого цинка концентрации точно 0,05 моль/дм3, из растворенных на
титрование см3;
m - масса навески
препарата, г;
0,01861- масса 2- водной динатриевой соли
элитендиамин- N,N,N’,N’-
тетрауксусной кислоты, соответствующая 1 см3 раствора 7-водного
сернокислого цинка концентрации точно 0,05 моль/дм3, г.
За результат анализа принимают среднее
арифметическое результатов двух параллельных титрований.
В результате проведения двух параллельных
титрований был получен обьем 7-водного сернокислого цинка концентрации 0,05
моль/дм3, полученный объем соответствует 27,5 мл, что соответствует
массовой доле
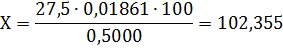
Погрешность измерения составляет 2%.
По результатам измерений согласно ГОСТ 10652-73,
анализируемое вещество (Трилон Б) можно отнести к химически чистым. Так как
полученную погрешность можно отнести к человеческому фактору.
Определение массовой доли железа роданидным
методом (с предварительным окислением железа надсернокислым аммонием).
Данный метод основан на образовании в кислой
среде окрашенного в красный цвет нестойкого комплекса роданида железа Fe
(III). Предварительное
окисление железа Fe
(III) проводят азотной
кислотой или надсернокислым аммонием или пероксидом водорода.
Определению мешают ионы, кобальта, молибдена,
висмута, титана, хрома, нитратов, фторидов, фосфатов, оксалатов, ацетатов.
Оборудование.
1. Колба коническая вместимостью 100 см3
. Пипетки вместимостью 10 см3
. Пипетка мерная
. Кюветы с толщиной поглощающего свет
слоя 50мм.
. Спектрофотометр или
фотоэлектроколориметр
Реактивы
. Аммоний надсернокислый ,
свежеприготовленный раствор с массовой долей 5%;
. Аммоний роданистый , раствор с массовой
долей 30%
. Вода дистиллированная
. Кислота азотная, раствор с массовой
долей 25%
. Кислота соляная, раствор с массовой
долей 25%
Проведение анализа
При применении кюветы с толщиной поглощающего
свет слоя 50мм растворы сравнения готовят следующим образом: в пять мерных колб
помещают растворы, содержащие 0,002; 0,005; 0,010; 0,020; 0,040 мг железа и
добавляют около 20 см3 воды.
Одновременно готовят раствор, не содержащий
железо.
К каждому раствору прибавляют по 3 см3
раствора соляной кислоты, 1 см3 раствора надсернокислого аммония, 4
см3 раствора роданистого аммония, доводим объемы растворов водой до
метки и перемешиваем.
Через 5 минут измеряют оптические плотности
растворов сравнения и контрольного раствора по отношению к воде на
спектрофотометре при длине волны 450 нм или на фотоэлектроколориметре при длине
волны 450-480 нм. В данном опыте использовался спектрофотометр при длине волны
490 нм (в связи с высокой прозрачностью полученных растворов).
Из значения оптической плотности раствора
сравнения вычитают значение оптической плотности контрольного раствора. По
полученным данным строят градуировочный график.
Обработка результатов
В результате проведенного анализа с
использованием спектрофотометра с длиной волны равной ƛ=490нм, были
получены следующие данные:
|
С
мг/мл
|
А
|
|
0,002
|
0,001
|
|
0,005
|
0,054
|
|
0,010
|
0,1
|
|
0,020
|
|
0,040
|
0,21
|
Согласно полученным данным строим градуировочный
график зависимости концентрации содержащегося вещества в растворе от его
полученной оптической плотности.
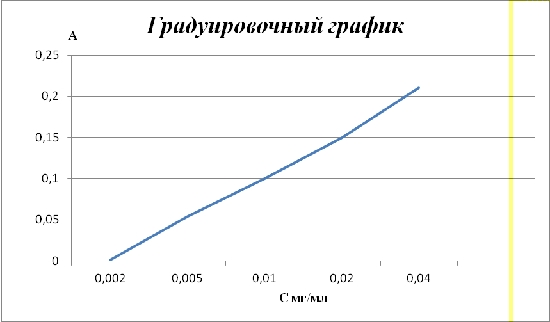
Согласно измерению оптической
плотности раствора сравнения с раствором содержащий Трилон Б, получили
оптическую плотность практически равную нулю А≈0, следовательно ионы
железа в анализируемом растворе Трилона Б практически отсутствуют.
Выводы
В курсовой работе были исследованы свойства и
характеристики Трилона Б. В результате проведенных химических и
физико-химических опытов было установлено, что Трилон Б используемый студентами
при лабораторных работах является практически чистым и близок к стандартам
предъявляемым ГОСТ 10652-73. Вещество соответствует предъявляемым нормам
массовой доли, и практически не содержит в своем составе ионов железа.
Библиографический список
1. ГОСТ
10652-73 Реактивы, соль динатриевая этилендиамин- N,N,N’,N’-
тетрауксусной кислоты 2-водная (Трилон Б)
. ГОСТ
10555-75 Реактивы и особо чистые вещества
. http://www.himmir.ru/chem_rea/trilon_b.htm
- [электронный ресурс].
. http://milomarket.com/ingridient/akrivi/222-trilon-b.html
- [электронный ресурс]
5.