Квантово-химическое исследование распада гидропероксида тимина
МИНИСТЕРСТВО
ОБРАЗОВАНИЯ И НАУКИ УКРАИНЫ
МАКЕЕВСКОЕ
ТЕРРИТОРИАЛЬНОЕ ОТДЕЛЕНИЕ
МАЛОЙ
АКАДЕМИИ НАУК УКРАИНЫ
Секция:
химия
Квантово-химическое
исследование распада гидропероксида тимина
Работу выполнила:
Плешингер
Татьяна Сергеевна
ученица
10-В класса
Руководитель:
Учитель
химии высшей категории, учитель- методист
Петрова
Татьяна Анатольевна
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
.
ЛИТЕРАТУРНЫЙ ОБЗОР
.1
АКТИВНЫЕ ФОРМЫ КИСЛОРОДА
.2
ОКИСЛЕНИЕ ДНК ГИДРОКСИЛЬНЫМИ РАДИКАЛАМИ
.3
ОКИСЛЕНИЕ ОСТАТКА ТИМИНА
.
МЕТОДИЧЕСКАЯ ЧАСТЬ
.1
ОБЪЕКТ ИССЛЕДОВАНИЯ
.2
МЕТОДЫ РАСЧЕТА
.3
ПОСТРОЕНИЕ ЭСКИЗА ОБЪЕКТА
.4
ОПТИМИЗАЦИЯ МОЛЕКУЛЯРНОЙ ГЕОМЕТРИИ ОБЪЕКТОВ
.5
МЕТОДИКА РАСЧЕТА ПАРАМЕТРОВ ГЕОМЕТРИИ И ЭЛЕКТРОННОГО СТРОЕНИЯ ОБЪЕКТОВ
.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
.1
ОСОБЕННОСТИ МОЛЕКУЛЯРНОЙ ГЕОМЕТРИИ И ЭЛЕКТРОННОГО СТРОЕНИЯ ГИДРОПЕРОКСИДОВ
ТИМИНА
.2
ПРОЧНОСТЬ ПЕРОКСИДНОЙ СВЯЗИ В МОЛЕКУЛАХ ГИДРОПЕРОКСИДОВ ТИМИНА
ВЫВОДЫ
СПИСОК
ЛИТЕРАТУРЫ
ВВЕДЕНИЕ
Гидропероксидные соединения являются ключевыми
реагентами многочисленных свободнорадикальных процессов окисления органических
веществ, которые используются в промышленных масштабах [ - , ] для получения ценных кислородсодержащих
соединений. Процессы старения пищевых продуктов [], полимерных материалов [],
топлив [, ], метаболизм живых организмов в норме и патологии [ - ] включает стадии образования и радикального
распада гидропероксидов. Поэтому контроль над протеканием реакций накопления и
распада гидропероксидов является ключевым фактором для решения широкого спектра
практических задач химии, биологии и медицины.
В ряде биохимических процессов, протекающих в
клетках живых организмов, а также при воздействии ряда внешних факторов
образуются активные формы кислорода (супероксидный радикал, гидроксильный
радикал, пероксиды и гидропероксиды), которые повреждают различные компоненты
клетки, в том числе и ДНК [_]. Повреждение ДНК ведет, в свою очередь, к
развитию дегенеративных процессов, старению, гибели клетки. Продуктами
окислительной деструкции ДНК при воздействии активных форм кислорода являются
соответствующие гидропероксиды. Они также могут генерировать гидроксильные
радикалы в реакциях радикального распада и наряду с указанными активными
формами кислорода вызывать дальнейшее более глубокое повреждение ДНК. Поэтому,
установление структуры и прогнозирование реакционной способности
гидропероксидов, образующихся при окислительной деструкции ДНК, является
необходимым этапом при решении актуальной задачи - установления механизма
повреждения ДНК, выявления роли окислительной деструкции в возникновении
мутаций и развитии заболеваний.
Целью данной работы стало изучение реакционной
способности гидропероксидов, образующихся в процессах деструкции ДНК при
окислении гетероциклических оснований, на основе модельной реакции
гомолитического распада гидропероксида тимина.
Объектом исследования является реакция
радикального распада гидропероксида тимина.
Для достижения поставленной цели необходимо было
выполнить следующие задачи:
· В приближении квантово-химических
методов получить равновесную конфигурацию молекулы гидропероксида тимина,
радикальных продуктов реакции его гомолиза. Рассчитать параметры молекулярной
геометрии и электронного строения гидропероксидов тимина.
· Рассчитать прочность пероксидной
связи О-О в молекуле гидропероксида тимина.
· Исследовать влияние положения
гидропероксидной группы в молекуле гидропероксида тимина на прочность
пероксидной связи.
1. ОКИСЛИТЕЛЬНАЯ ДЕСТРУКЦИЯ ДНК. ОБЗОР
ЛИТЕРАТУРЫ
.1 Активные формы кислорода, вызывающие
окислительную деструкцию ДНК
Человек в покое вдыхает около 280 мл кислорода в
минуту или не менее 400 л в сутки. Основное количество О2 (95-98%)
расходуется на выработку энергии и окислительный метаболизм субстратов. И
только относительно небольшая часть (2-5%) переходит в активные формы кислорода
и участвует в окислительной модификации макромолекул []. Активные формы
кислорода включают супероксидный радикал ·О2-,
гидроксильный радикал ·ОН, синглетный
кислород 1О2, пероксиды (пероксид водорода H2O2,
органические пероксиды и гидропероксиды различного строения, пероксинитрит-анион
ONOO−), оксо- и пероксокомплексы металлов переменной
валентности []. Все они способны приводить к окислительной деструкции ДНК.
Причины и следствия повреждения ДНК, белков и липидов активными формами
кислорода иллюстрирует схема, представленная на рисунке 1.1.
Рис. 1.1. Причины и следствия повреждения ДНК,
белков и липидов активными формами кислорода.
Окислительные свойства АФК могут быть
использованы для направленной деградации нуклеиновых кислот. Так для
установления последовательностей ДНК, связывающих определенные белки, методом
футпринтинга широко применяют системы, генерирующие гидроксильные радикалы [].
Повреждение НК может использоваться также для лечения онкологических, вирусных
и других заболеваний.
.2 Окисление ДНК гидроксильными радикалами
Гидроксильный радикал - сильный окислитель. Он в
состоянии отрывать атом водорода от связи С-Н или присоединяться по связям С=С.
Скорости реакций по двойным связям выше, чем скорости отрыва атома водорода от
связи С-Н [].
Радикалы НО·
взаимодействуют с НК и модельными соединениями с константами скорости, близкими
к диффузионным. При этом преобладают процессы присоединения по двойным связям
гетероциклов и отрыва атомов водорода от связей С-Н остатка рибозы. Но
взаимодействуют они преимущественно с азотистыми основаниями: отношение
образующихся радикалов гетероциклов к радикалам рибозы достигает 5-10. Обычно
возникновение радикалов гетероциклов приводит к необратимым модификациям
последних. Некоторые из этих модификаций ослабляют гликозидную связь и вызывают
образование апиридиновых/апуриновых сайтов, что сопровождается расщеплением
рибозофосфатного остова в щелочных средах [].
Структура и свойства радикалов гетероциклов
изучены на примере свободных гетероциклов, нуклеозидов и нуклеотидов. Продукты
окисления гетероциклических оснований гидроксильными радикалами определены при
окислении модельных нуклеозидов, нуклеотидов, коротких олиго-нуклеотидов.
Большинство модифицированных оснований образуются в случае окисления ДНК [].
.3 Окисление остатка тимина
гидропероксид тимин молекулярный
окисление
При взаимодействии остатка тимина с
гидроксильными радикалами зарегистрировано образование трех радикалов с
различными свойствами [8]. Установлено, что гидроксильные радикалы
присоединяются к атомам углерода С(5) или С(6) азотистого основания (Рис. 2),
при этом образуются радикалы (Т5-ОН)· и (Т6-ОН)·
соответственно. Кроме того, наблюдается отрыв атома водорода от метильной
группы у атома С(5) с образованием экзоциклического радикала (U-CH2).
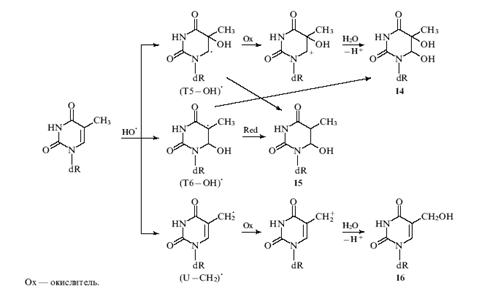
Рис. 1.2. Окисление остатка тимина
гидроксильными радикалами.
Методом импульсивного радиолиза в присутствии
окислителей и восстановителей показано, что ·ОН-радикал
преимущественно присоединяется к атому С(5) гетероцикла (~56%), что обусловлено
наиболее высокой электронной плотностью на этом атоме. По атому С(6)
присоединяется ~35% гидроксильных радикалов, а в отрыве атома водорода от
метильной группы участвуют <9% таких радикалов [].
Образующиеся три типа радикалов различаются по
своим окислительно-восстановительным свойствам. Радикал (Т5-ОН)·
относится к альфа-аминоалкильному типу и обладает восстановительными
свойствами. Радикал (U-CH2)· также является
восстановителем, но более слабым, чем (Т5-ОН)·.
Радикал (Т6-ОН)·, наоборот, проявляет
окислительные свойства.
При окислении (Т5-ОН)·
образуется карбокатион, к которому быстро присоединяется гидроксил-анион, что
приводит к количественному формированию dR-производных
цис- или транс-5,6-дигидротимина (14). Восстановление радикала (Т6-ОН)·
приводит к dR-производному 6-гидрокси-5,6-дигидротимина (15), а окисление
радикала (U-CH2) - к dR-производному
5-гидроксиметилурацила (16).
Поскольку окислительно-восстановительные
свойства радикалов тимина различаются, в отсутствие экзогенных окислителей или
восстановителей радикал (Т5 - ОН) может окисляться радикалом (Т6-ОН) до
карбокатиона с последующим образованием 14 и 15.
В аэробных условиях (Рис. 1.3.) происходит
присоединение молекулярного кислорода к радикалам (Т5 - ОН), (Т6-ОН) и (U-CH2)
с диффузионной константой скорости. В результате появляются пероксидные
радикалы, продуктами при восстановлении которых являются соответствующие
dR-производные гидропероксидов: транс- и цис-формы 6-гидропероксида
5-гидрокси-5,6-дигидротимина (17) 5- гидропероксида 6-гидрокси-5,6-
дигидротимин (18), а также алкилгидропероксида 5-метил-2'-дезоксиурацила (19).
Время жизни гидропероксидов при 37 градусах составляет
от нескольких дней до одной недели [].
В результате гидролитического
распада гидропероксидов 17-19 образуются устойчивые продукты. Основной продукт
разложения 6-гидропероксида тимина 17 - dR-производное
5-гидрокси-5-метилбарбитуровой кислоты (20), а продуктами превращения цис- и
транс-изомеров 5-гидропероксида тимина 18 является преимущественно dR-производное
5-гидрокси-5-метилгтдантоина (21).
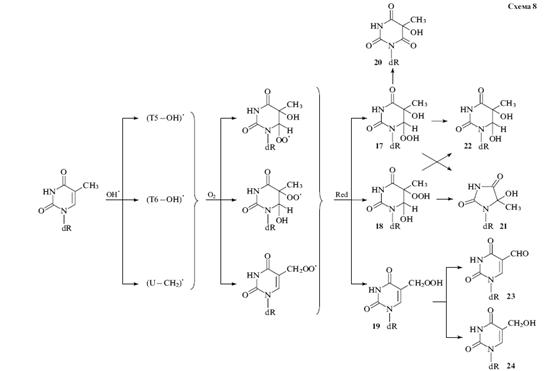
Рис. 1.3. Схема взаимодействия
остатка тимина с гидроксильными радикалами в аэробных условиях
Образование цис- и транс-изомеров
5,6дигидрокси-5,6-дигидротимина 22 объясняют протеканием конкурентной реакции
диспропорционирования 5- и 6-пероксидных радикалов. В результате образуются
высокореакционноспособные алкоксирадикалы, способные отрывать атом водорода от
различных соединений, что и приводит к накоплению производного 22. Кроме того,
в алкоксирадикалах может протекать реакция раскрытия пиримидинового кольца
посредством расщепления связи С(5) - С(6). Дальнейшие превращения приводят либо
к фрагментации с образование производных мочевины, либо к замыканию цикла с
образованием dR-производного 5-гидрокси-5-метилгидантоина 21.
Вследствие разложения алкилгидропероксида 5-
метил-2'-дезоксиурацила 19 накапливаются два продукта:
5-формил-2'-дезоксиурацил (23) и 5-гидроксиметил-2'-дезоксиурацил (24).
Таким образом, главными продуктами окисления
остатка тимина под действием гидроксильных радикалов являются dR-производные
5,6-дигидрокси-5.6-дигидротимина, 5-гидроксиметилурацила,
6-гидрокси-5,6-дигидротимина, 5-гидрокси-5-метилгидантоина
5-гидрокси-5-метилбарбитуровой кислоты [, ].
2. МЕТОДИЧЕСКАЯ ЧАСТЬ
.1 Объект исследования
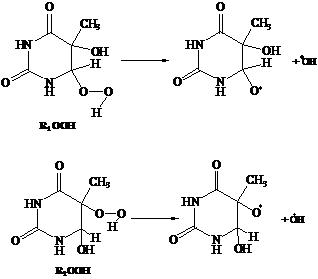
Объектом исследования является реакция
гомолитического распада гидропероксидов тимина с образованием двух свободных
радикалов. В работе рассмотрены два изомера гидропероксида тимина, которые
отличаются положением гидропероксидной группы: 6-гидропероксида
5-гидрокси-5,6-дигидротимина (R1OOH)
5- гидропероксида 6-гидрокси-5,6- дигидротимина (R2OOH).
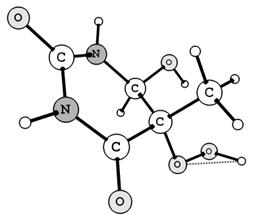
2.2 Методы расчёта
Исследования структуры, а именно молекулярной
геометрии и электронного строения объектов исследования, выполнены
квантово-химическими методами. Все расчёты проведены полуэмпирическим методом
АМ1 в приближении ограниченного метода Хартри-Фока, который реализован в
программе HyperChem
5.02 (комплекс программ структурной химии, потенциальные возможности которого
позволяют проводить квантово-химический расчёт энергии и электронной структуры
химических частиц). При оптимизации структурных элементов молекул
гидропероксидов и радикальных продуктов их распада использовали процедуру Eigenvector
Following. Параметры
молекулярной геометрии рассчитаны с граничной нормой градиента 0.01.
.3 Построения эскиза объекта
.4 Оптимизация молекулярной геометрии объектов
Для оптимизации молекулярной геометрии объекта
необходимо после создания его 3D модели в меню Setup
выбрать команду Semi-emperial (полуэмпирические методы), в открывающемся окошке
выбрать метод расчёта (АМ1). Затем в меню необходимо открыть пункт Compute,
выбрать команду Geometry
Optimization.
После этих действий мы получим равновесную
конфигурацию молекулы, которая отвечает определённому минимуму её полной
энергии. Информация о структуре объекта хранится в файле с расширением ZMT.
.5 Методика расчёта параметров геометрии и
электронного строения объектов
Для получения более подробной информации о
свойствах объекта, проводят расчёт в режиме одиночного расчёта. При этом
используется равновесная конфигурация молекулы. Для этого необходимо в меню
команд File, выбрать команду Start loq, создать файл с расширением.Loq. затем в
меню Compute выбрать команду Sinqle Point, а потом вернуться снова в File и
выбрать Stop loq. Тогда в сохранённом файле с расширением Loq будет вся
информация о молекулярной геометрии и электронном строении объекта
исследования.
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
.1 Особенности молекулярной геометрии и
электронного строения гидропероксидов тимина
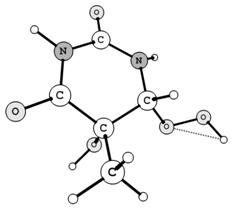
На первом этапе выполнена
оптимизация молекулярной геометрии гидропероксидов полуэмпирическим методом
АМ1, который достаточно широко используется для оценки строения, электронных
характеристик и энергетических параметров органических пероксидов различных
классов (гидропероксидов, диалкилпероксидов, диацильных пероксидов). Отдельно выполнен
расчет частот гармонических колебаний. Полученные таким образом равновесные
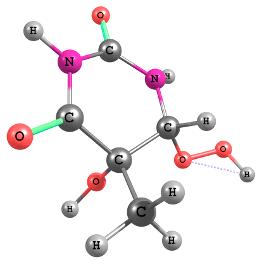
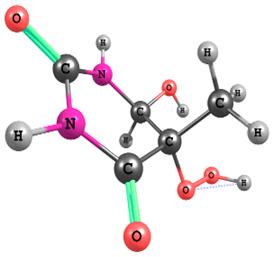
конфигурации гидропероксидов R1OOH и R2OOH (Рис. 1)
были определены как минимумы на поверхности потенциальной энергии (отсутствуют
мнимые частоты). Основные характеристики строения гидропероксидного фрагмента
(Табл. 1) соответствуют известным экспериментальным параметрам для
гидропероксидов [2].
|
|
|
|
R1OOH
|
R2OOH
|
Рис. 1. Равновесная конфигурация гидропероксидов
тимина, полученная методом АМ1.
Таблица 3.1. Параметры молекулярной геометрии и
электронного строения гидропероксидов тимина
|
параметры
|
R1OOH
|
R2OOH
|
|
O1-O2,
Å
|
1.289
|
1.287
|
|
C-O1,
Å
|
1.462
|
1.459
|
|
O2-H,
Å
|
0.984
|
0.985
|
|
O1-O2-H,
º
|
107.4
|
107.8
|
|
C-O1-O2,
º
|
111.1
|
111.9
|
|
C-O1-O2-H,
º
|
104.6
|
97.99
|
|
μ, D
|
4.59
|
3.61
|
|
q(O1), e
|
-0.138
|
-0,117
|
|
q(O2), e
|
-0.235
|
-0,245
|
Результаты, представленные в таблице 1,
свидетельствуют о том, что оба изомера гидропероксида тимина имеют близкие
параметры геометрии гидропероксидного фрагмента, который содержит реакционный
центр системы - пероксидную связь. Однако величина рассчитанного дипольного
момента для них существенно различается. Это свидетельствует о различии в
электронном строении. Положение гидропероксидного фрагмента в цикле влияет на
параметры его электронного строения. Наблюдается различная величина частичных
зарядов на атомах кислорода фрагмента СООН.
.2 Прочность пероксидной связи в молекулах
гидропероксидов тимина
Основной характеристикой прочности пероксидной
связи является энергия ее гомолитической диссоциации (DO-O)
с образованием двух радикальных частиц:
R-O-O-H
→
RO•
+ •OH (3.1)
Величину DO-O
для реакции (3.1.) можно рассчитать, используя величины стандартных энтальпий
образования гидропероксида и двух радикалов либо соответствующие величины общих
энергиий (Etot)
этих частиц по закону Гесса:
DO-O
= [ΔfHº(RO•)
+ ΔfHº(•OH)]
- ΔfHº(ROOH)
(3.2)O-O = [Etot(RO•) + Etot(•OH)]
- Etot(ROOH) (3.3)
Для расчета прочности О-О связи гидропероксидов
R1OOH и R2OOH использовали величины ΔfHº(RO•),
ΔfHº(•OH)]
и ΔfHº(ROOH),
полученные при расчете полуэмпирическим методом АМ1 (Табл. 2) в рамках
ограниченного метода Хартри-Фока (RHF).
Для расчета радикальных частиц использовали соответственно неограниченный метод
Хартри-Фока (UHF).
Таблица 3.2. ΔfHº
(ккал/моль)
гидропероксидов тимина и радикальных продуктов их распада и прочность
пероксидной связи DO-O
(ккал/моль)
|
Объект
|
R1OOH
|
R2OOH
|
|
ROOH
|
-133.4
|
-131.2
|
|
RO•
|
-111.7
|
-107.0
|
|
•OH
|
0.9
|
0.9
|
|
DO-O
|
22.6
|
25.0
|
По результатам таблицы 3.2. видно,
что прочность пероксидной связи для исследуемых гидропероксидов тимина
несколько ниже соответствующей величины для аралкильных гидропероксидов [] и
пероксида водорода [2]. Следовательно, можно предположить более высокую
реакционную способность исследуемых гидропероксидов в реакции генерирования
радикальных частиц по сравнению с пероксидом водорода. Таким образом,
гидропероксиды, образующиеся при окислении тимина могут служить дополнительными
источником гидроксильных радикалов наряду с традиционными формами активного
кислорода, присутствующими в клетке.
Для исследуемых гидропероксидов
наблюдается зависимость прочности пероксидной связи от расположения СООН
фрагмента в молекуле. 6-гидропероксид 5-гидрокси-5,6-дигидротимина будет более
реакционноспособным по сравнению с 5-гидропероксидом
6-гидрокси-5,6-дигидротимина.
ВЫВОДЫ
1. Получена равновесная молекулярная
геометрия гидропероксидов тимина. Показано, что положение гидропероксидной
группы в кольце не влияет на параметры геометрии реакционного центра, но
существенно влияет на его электронное строение.
. Рассчитана прочность пероксидной связи
в молекулах гидропероксидных объектов. Данные гидропероксиды наряду с
пероксидом водорода и другими активными формами кислорода могут служить
источником гидроксильных радикалов при окислительной деструкции тиминового
остатка ДНК.
. Показано, что расположение
гидропероксидной группы в тиминовом остатке влияет на прочность пероксидной
связи. Гидропероксид с СООН-группой в положении 6 тиминового кольца более
реакционноспособный по сравнению с 5-
гидроперокси-6-гидрокси-5,6-дигидротимином.
СПИСОК ЛИТЕРАТУРЫ