Каталитическое действие хиральных n5-комплексов Zr в реакциях алюминийорганических соединений с терминальными алкенами
Каталитическое
действие хиральных n5-комплексов Zr в реакциях алюминийорганических
соединений с терминальными алкенами
Введение
Актуальность темы. Открытие металлоценовых
соединений в середине прошлого столетия стимулировало развитие нескольких
важных направлений в металлорганической химии. Одним из таких направлений стал
катализ реакции полимеризации алкенов Циглера- Натта з5-комплексами
металлов IV подгруппы в
сочетании с алюминий- и борорганическими соединениями [1-4]. В результате были созданы
высокоактивные и стереоселективные «одноцентровые» катализаторы полимеризации
непредельных соединений, а также появилась возможность более подробного
изучения механизма данного процесса. В дальнейшем в работах член-корр. РАН
Джемилева У.М. и др. было показано, что металлоценовые комплексы подгруппы Ti
могут быть с успехом применены в качестве катализаторов реакций гидро-, карбо-
и циклометаллирования непредельных соединений, позволяющие получать в одну
стадию в мягких условиях с высокой регио- и стереоселективностью как
ациклические, так и циклические металлорганические соединения, которые без
предварительного выделения могут быть вовлечены в реакции с электрофильными и
нуклеофильными реагентами для получения широкого ассортимента важнейших мономеров
и различных классов карбо-, гетероциклов и гетероатомных соединений [5-12].
Высокая активность, хемо- и стереоселективность
металлоценовых комплексов в указанных выше реакциях является следствием их
структурных особенностей. В з5-комплексах наиболее эффективно
удается обеспечивать стабильность электронного и стерического окружения атома
переходного металла за счет высокой энергии связи металл-лиганд, а также
варьировать электрофильность и геометрию каталитически активных центров
благодаря большим возможностям структурной модификации р-лиганда.
Одним из направлений изменения пространственной
структуры лиганда является связывание лигандов с помощью мостика или введение
заместителей, содержащих в своем составе стереогенные центры [13-18]. На основе
модифицированных таким образом лигандов синтезировано ограниченное число
хиральных з5- комплексов металлов подгруппы Ti, нашедших применение
в качестве энантиоселективных катализаторов реакций функционализации алкенов с
помощью магний- и алюминийорганических соединений (АОС) [3,6,9]. Таким образом,
важным и актуальным является расширение круга хиральных металлоценовых
катализаторов, вовлекаемых в реакции АОС с алкенами, что позволило бы получить
важную информацию о вкладе структуры р- лиганда в активность, хемо- и стереоселективность
каталитических систем на основе комплексов переходных металлов, предоставило
дополнительные сведения о механизмах изучаемых реакций, что, в конечном итоге,
создало бы научную основу для разработки новых эффективных каталитических
систем для реакций гидро-, карбо- и циклоалюминирования алкенов.
Работа выполнена в соответствии с планами НИР
Института нефтехимии и катализа РАН по темам «Механизмы реакций олефинов с
участием алюминийорганических соединений и цирконийсодержащих металлокомплексных
катализаторов» (№ гос. регистрации 01201168011), «Механизм действия
биметаллических каталитических систем на основе металлоценовых комплексов и АОС
в реакциях хемо- и стереоконтролируемого построения С-Н, С-С и металл-С связей»
(№ гос. регистрации 01201460331); при финансовой поддержке Министерства
образования и науки РФ (госконтракт №8426), Российского фонда фундаментальных
исследований (гранты №11-03-00210-а, 12-03-33089мол_а_вед).
Целью работы являлось исследование
каталитического действия хиральных конформационно жестких и конформационно
лабильных з5- комплексов Zr
в реакциях алюминийорганических соединений с алкенами.
В ходе работы решались следующие задачи:
исследование каталитической активности и
хемоселективности конформационно жестких комплексов Zr
со связанными з5- лигандами в реакциях AlR3
(R= Me,
Et) c
алкенами;
изучение реакций гидроалюминирования алкенов
изобутилаланами XAlBui2
(X= H,
Cl, Bui),
катализируемых бис-инденильными и бис-циклопентадиенильными анса-комплексами Zr;
ЯМР исследование структуры и динамики активных
центров реакций гидро-, карбо- и циклоалюминирования алкенов, катализируемых
анса-комплексами Zr;
синтез энантиомерно чистых конформационно
жестких з5- комплексов Zr
и исследование их каталитических свойств в реакциях AlR3
(R= Me,
Et) c
алкенами в сравнении с конформационно лабильным комплексом
бис--(1-неоментилинденил)цирконоцендихлорида;
разработка методов определения энантиомерного
избытка и абсолютной конфигурации стереогенных центров продуктов реакций карбо-
и циклоалюминирования алкенов.
Научная новизна. Впервые изучена активность и
хемоселективность анса-з5-комплексов L2ZrCl2
(L2=
Me2Si(С5H5)2,
rac-Mе2С(2-Me-4-But-C5H2)2,
meso-Mе2С(2-Me-4-But-C5H2)2,
rac-Mе2С(3-But-C5H3)2,
rac-Me2C(Ind)2,
rac-Me2Si(Ind)2,
rac-C2H4(Ind)2,
meso-C2H4(Ind)2)
в реакциях алюминийорганических соединений (AlMe3,
AlEt3,
HAlBui2,
AlBui3)
с терминальными алкенами.
С использованием метода ЯМР спектроскопии
впервые в реакции анса-комплексов Zr
с АОС (AlMe3,
AlEt3,
HAlBui2)
установлена структура Zr,Al-биметаллических
комплексов, определены константы и активационные параметры динамических
процессов, проходящих с участием биметаллических интермедиатов. Показано
влияние динамических процессов на реакционную способность изучаемых
каталитических систем.
Получены новые энантиомерно чистые
анса-комплексы Zr:
p-S,
p-S-
диметилсилил-бис-(4,5,6,7-тетрагидроинденил)цирконийдихлорид (p-S,
p-S-
Me2Si(THI)2ZrCl2)
и S, p-S,
p-S-
диметилсилил-бис-(4,5,6,7-тетрагидроинденил)цирконий бинафтолат (S,
p-S,
p-S-
Me2Si(THI)2ZrBIN).
Энантиомерно чистые комплексы p-S,
p-S-
Me2Si(THI)2ZrCl2,
S,p-S,p-S-
Me2Si(THI)2ZrBIN
и S,p-S,p-S-С2H4(THI)2ZrBIN
впервые испытаны в качестве катализаторов реакций AlR3
(R= Me,
Et) с алкенами.
Наибольшую активность, хемо- и энантиоселективность (~50%ее) показал комплекс p-S,
p-S-
Me2Si(THI)2ZrCl2
в
реакции карбоалюминирования гексена-1 с помощью AlEt3.
Впервые установлено, что реакция AlEt3
с алкенами в присутствии оптически активных анса- комплексов Zr
проходит с образованием энантиомерно обогащенных функционально замещенных
олигомерных продуктов с числом звеньев до 6.
Впервые показано влияние структуры алкена на
хемо- и энантиоселективность реакции терминальных алкенов с AlEt3
в присутствии конформационно лабильного комплекса бис-(1-неоментилинденил)цирконийдихлорида.
Установлено, что в хлорсодержащем растворителе (CH2Cl2)
реакция с линейными алкенами проходит преимущественно с образованием продуктов
карбометаллирования с выходом ~50-90%, в которых преобладают S-
энантиомеры с 47-69%ee.
В случае использования винилциклоалканов или стирола в продуктах реакции
увеличивалось содержание циклических АОС - замещенных алюмаланов, энантиомерная
чистота которых составила 40-57%.
Впервые показана возможность применения (R)-
2-фенилселенпропионовой кислоты (R-
PSPA) для установления
энантиомерной чистоты и абсолютной конфигурации в- стереогенных центров
2-этил-1-алканолов и в-алкил-1,4-бутандиолов, образующихся в результате
окисления и гидролиза продуктов карбо- и циклоалюминирования алкенов.
Практическая значимость. Разработаны новые
каталитические системы на основе HAlBui2
и
рац-изомеров стерически затрудненных бис-циклопентадиенильных анса-комплексов Zr
(rac-Mе2С(2-Me-4-But-C5H2)2ZrCl2,
rac-Mе2С(3-But-C5H3)2ZrCl2),
позволяющие проводить реакцию гидроалюминирования терминальных алкенов с
высоким выходом целевых алкил-диизобутилаланов (~99%).
Осуществлен синтез новых энантиомерно чистых
анса-комплексов Zr
на основе Si-связанных
бис-тетрагидроинденильных лигандов, перспективных катализаторов
стереоселективной олигомеризации и функционализации алкенов с помощью магний- и
алюминийорганических реагентов.
Разработаны каталитические методы получения
энантиомерно обогащенных ациклических и циклических АОС - в- замещенных
алкилаланов и алюмоланов, которые могут быть использованы в качестве синтонов
для получения большого ряда практически важных соединений.
Предложены методы определения абсолютной
конфигурации в- стереогенных центров и энантиомерной чистоты продуктов карбо- и
циклоалюминирования алкенов путем анализа R-MTPA
и R-PSPA
эфиров в-этил-1-алканолов и в-алкил-1,4-бутандиолов, образующихся в результате
окисления и гидролиза соответствующих ациклических и циклических АОС.
Положения, выносимые на защиту: результаты
изучения каталитического действия анса-комплексов Zr
в реакциях АОС с алкенами; данные ЯМР исследования структуры и динамики
интермедиатов, образующихся в системах анса-L2ZrCl2
- АОС; синтез энантиомерно чистых анса-комплексов Zr
и результаты их испытания в качестве катализаторов реакций AlR3
(R= Me,
Et) c
терминальными алкенами; результаты исследования хемо- и энантиоселективности
реакций алкенов с AlEt3,
катализируемых конформационно лабильным комплексом
бис-(1-неоментилинденил)цирконийдихлоридом; конформационный анализ
диастереомеров МТРА- и PSPA-
эфиров 2-этил-1-алканолов и эффекты влияния в-заместителей в этих соединениях
на параметры спектров ЯМР.
Личный вклад автора. Постановка цели и задач
работы, обсуждение результатов и подготовка материалов для публикаций выполнены
совместно с руководителем. Автором работы осуществлено испытание
анса-комплексов Zr
в качестве катализаторов реакций АОС с алкенами, обработка данных исследования
структуры и динамики интермедиатов реакций методом ДЯМР, синтез энантиомерно
чистых комплексов Zr
и изучение их активности, хемо- и стереоселективности в реакциях карбо- и
циклоалюминирования терминальных алкенов различной структуры. Автором проведена
работа по планированию эксперимента и отработке методик получения исходных
комплексов Zr.
металл каталитический хемоселективность
алкен
1. Строение и синтез анса- з5-комплексов
металлов подгруппы Ti
.1 Особенности структуры анса- комплексов
Особенности электронного и пространственного
строения анса-металлоценов предопределили их уникальные каталитические свойства
в реакциях построения С-С, С-H,
металл-C связей. Основными
геометрическими параметрами анса- комплексов (Схема 1), как и в случае
несвязанных металлоценов, являются [15, 16]:
б - угол между плоскостями колец;
в - угол между нормалями от металла к плоскостям
колец;
г - угол между отрезками центроид кольца -
металл - центроид кольца;
д - угол между плоскостью кольца и отрезком
металл-центроид кольца;
е - угол между векторами от связывающего
мостикового атома Y к ipso
-углеродным атомам кольца;
ц - угол между вектором от связывающего
мостикового атома Y к ipso
- углеродному атому и плоскостью кольца;
d - кольцевое
смещение, равное расстоянию от центроида к пересечению нормали с плоскостью
кольца.
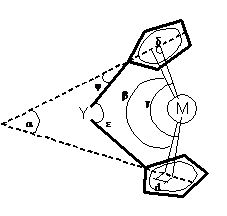
Схема 1
Углы г и в позволяют количественно оценить
степень отклонения з5- лигандов от «идеального» случая Cp2Fe
(г = в = 180°). Угол ц показывает отклонение мостикового атома Y
от плоскости циклопентадиенильного кольца и косвенно позволяет оценить
кольцевое смещение. Например, в случае sp2-
гибридизованного мостикового атома бора угол ц больше, чем в комплексах,
связанных атомами углерода и серы, имеющих sp3-
гибридизацию [19]. О кольцевом смещении также можно судить и по величине d
[20], показывающей, насколько атом металла в составе комплекса открыт.
Предполагается, что чем больше d,
тем большей реакционной способностью обладает комплекс.
В качестве важного структурного параметра анса-
комплексов Хальтерманом отмечается угол поворота лигандов относительно друг
друга [21, 22], поскольку этот фактор контролирует степень открытости атома
металла для субстрата. Большинство анса- комплексов обладают открытой
конформацией: двугранные углы между лигандами обычно находятся в пределах
60-1200 (Схема 2). Закрытые конформации отличаются достаточно более
острым диэдральным углом ~ 0-300.
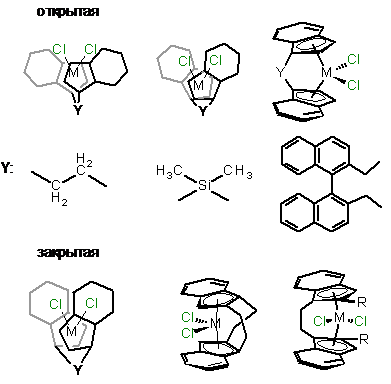
Схема 2
Из примеров, приведенных выше видно, что угол
поворота лигандов относительно друг друга определяется типом мостика и
заместителей в р-лиганде.
Часто для одного и того же комплекса характерно
наличие разных конформаций в растворе, количество и строение которых
определяется, в основном, типом мостика и природой заместителей в з5-лиганде.
Так, например, этандиил-бис-инденильные комплексы подвержены конформационной
изомерии благодаря подвижности мостика -СH2-CH2-.
C помощью ЯМР -
исследования [23] раствора рац-изомера комплекса этилиденбис(инденил)цирконий
дихлорида (1a) в CD2Cl2
в интервале температур -80 ч 250С установлено, что данное соединение
существует в виде двух конформеров: рац-1a'
и рац-1a'' (Схема 3).
Выявлено, что в жидкой среде конформеры мало отличаются по энергии (ДG≈ДH=0.945
ккал/мол) и находятся в быстром обмене, тогда как в кристаллическом виде,
согласно РСА, молекулы имеют конформацию рац-1a'.
Конформационное равновесие рац-1a'
↔ рац-1a'' было также
исследовано квантово-химическмими неэмпирическими методами Хартри-Фока [25].
Оказалось, что ориентация этандиильного моста в переходном состоянии рац-1a'
и рац-1a'' соответствуют
гош- конформации бутана, а энергетический барьер вращения составляет 20
кДж/моль.
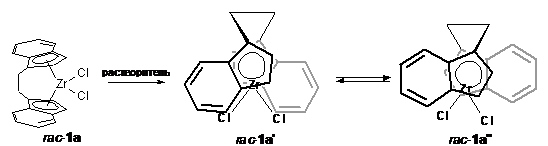
Схема 3
Стабилизации состояния рац-1a'
в растворе способствует наличие заместителей в 4,7- положении бензольного
кольца инденильных фрагментов молекул комплекса, как показано в работе [24].
Отмечается также, что мезо-1a
существует в растворе в виде двух эквивалентных заторможенных и одной
заслоненной конформациях [23] (Cхема
4):

Схема 4
При рассмотрении стереохимии анса-комплексов
автором обзоров [17,18] предложено исходить из пространственной структуры
лигандов, которую можно описать в рамках теории симметрии [26]. Согласно данным
работам, лиганды, как связанные мостиком, так и несвязанные, можно разделить на
три группы: лиганды с эквивалентными или гомотопными сторонами, лиганды с
энантиотопными сторонами и лиганды с диастереотопными сторонами.
Схема 5
Лиганды, координация которых атомом переходного
металла не сопровождается образованием нового стереохимического элемента, - это
лиганды с эквивалентными или гомотопными сторонам. Как правило, они обладают
либо центром симметрии, либо осью симметрии Сn
(Схема
5).
Лиганды с энантиотопными сторонами - это лиганды
с двумя различными ахиральными заместителями или лиганды, для которых
характерны элементы второго рода симметрии, в частности зеркально-поворотная
симметрия. При координации аниона атомом переходного металла, не обладающего
хиральностью, возможно образование двух энантиомеров комплекса (Схема 6). Так,
первоначальный энантиотопный процесс координации одной из части дианиона связан
с образованием з1,з5-переходного состояния трихлоридного
комплекса, который находится в виде смеси S-
и R- энантиомеров.
Последующая координация второй половины бисинденильного лиганда сопровождается
формированием дополнительных стереогенных центров в составе комплекса. В
результате образуются пространственные изомеры анса-комплекса, содержащие
лиганды с разными стереогеннными центрами: оптически неактивный мезо- изомер (p-R,p-S)
и рацемическая смесь рац-комплексов (dl:
p-R,p-R
и p-S,p-S).
На схеме 7 приведен случай, когда несимметричный
лиганд содержит стереогенные центры в мостиковой группе. В результате комплекс
3a образуется в виде
двух энантиомерных рац- и одного оптически неактивного мезо-изомеров в
соотношении 1:2,5:4,2. Как следует из примера, наличие стереогенных центров в
лиганде изменяет диастереоселективность образования конечных комплексов. Этот
прием часто используют при получении энантиомерно чистых комплексов переходных
металлов.
Таким образом, как отмечается в работе [15],
связывание лиганда в составе металлоцена приводит к следующему:
) фиксирование симметрии комплекса благодаря
ограничению вращения лигандов;
) возможность контроля стереохимии образования металлоцена
путем определенной ориентации лигандов за счет варьирования заместителей в их
составе;
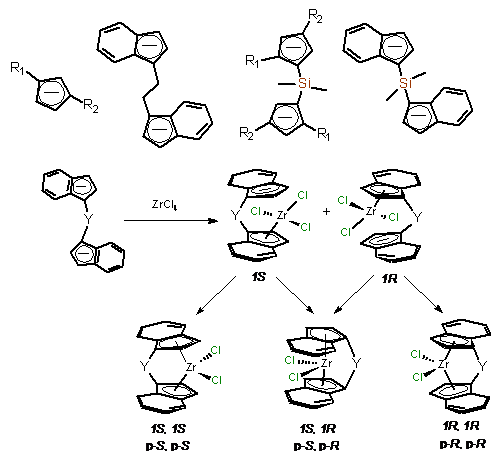
Схема 6
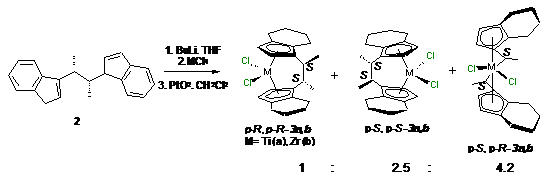
Схема 7
) влияние лигандов на реакционную способность
атома металла путем придания сэндвичевой структуры молекуле комплекса;
) увеличение электрофильности и доступности
каталитически активного центра в результате изменения наклона р- лигандов на
металле;
) формирование каталитических центров, в которых
возможно образование активных сторон, необходимых для процессов замещения
лигандов, координации субстратов, обратимого образования мостиковых связей и
т.д.
Таким образом, строение и свойства анса-
комплексов напрямую зависят от электронной и пространственной структуры
лигандов.
.2 Способы получения оптически активных
анса-комплексов металлов IV подгруппы
Основными способами получения энантиомерно
обогащенных анса-металлоценов являются разделение рац- изомеров комплексов с
помощью дериватизирующих реагентов или синтез, где в качестве исходного
соединения используется хиральный субстрат.
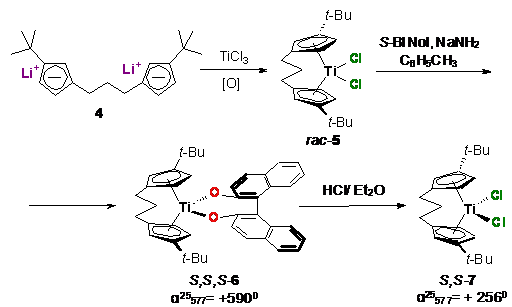
Схема 8
C момента первого
сообщения о синтезе рац-анса-металлоценов разрабатывались методы их разделения
с помощью различных дериватизирующих реагентов. В качестве дериватизирующего
реагента в основном применялся оптически активный бинафтол. Так, в 1979 году
Бринтзингером с сотр. был осуществлен синтез S,S-
пропандиил-бис-(трет-бутилциклопентадиенил)цирконий дихлорида (S,S-7)
реакцией энантиомерно чистого бинафтолатного комплекса 6 с HCl
в эфире согласно схеме 64 [125]. Энантиомерно чистый комплекс 6 предварительно
выделяли с помощью колоночной хроматографии.
В работе [89] Бринтзингер с сотр. проводит
дериватизацию rac-63 с
помощью S,S-
бинафтола в присутствии Et3N.
Разделение реакционной смеси на хроматографической колонке позволило получить
комплексы S,S,S-9
и R,R-8
выходами 77% и 70%, соответственно. Энантиомерная чистота R,R-63
составила 75%. Бинафтолатный комплекс S,S,S-9
после выделения переводили в диметильное производное, которое продували
хлороводородом до образования красного осадка титаноцен дихлорида S,S-8.
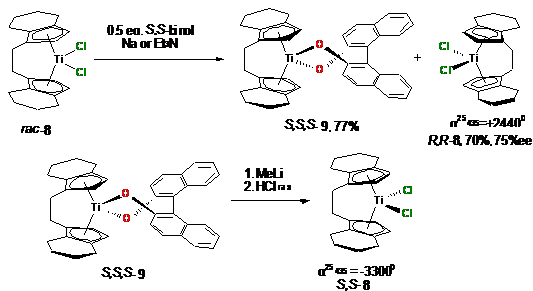
Схема 9
Для минимизации потерь хирального комплекса S,S,S-9
Коллинз в работе [126] предлагает реакционную смесь подвергать кипячению с
натрием и S,S-бинафтолом.
В этом случае выход энантиомерно чистого комплекса S,S,S-9
составил 78%. Дихлорид R,R-
8 был выделен в количестве 40%. После обработки S,S,S-9
раствором MeLi в гексане и
HCl в эфире был
получен S,S-8
с выходом 68% и энантиомерной чистотой 93%ее, которая определялась по спектрам 1H
ЯМР карбоксилатного комплекса S,S,R,R-10.

Схема 10
В дальнейшем Бринтзингер для разделения
хиральных анса- металлоценов использовал различные оптически активные кислоты
[127]. Авторы выделяют три способа получения карбоксилатов: 1) перевод
дихлоридных металлоценовых комплексов в диметильные производные и последующая
их реакция с кислотой в толуоле; 2) реакция хлоридов металлоценов с Li
или Na солями
кислот; 3) взаимодействие металлоцендихлоридов с кислотами в присутствии
триэтиламина в толуоле или этаноле. Наиболее эффективным способом оказалась
реакция дихлоридов металлов с R-ацетил-миндальной
кислотой в присутствии Et3N
(Схема 10). Полученные комплексы 10, 12 были выделены из реакционной смеси
дробной кристаллизацией с выходами 77-88%. Перевод карбоксилатов в дихлоридные
комплексы S,S-8
и S,S-11
осуществляли через диметильные производные с последующей обработкой соляной
кислотой в эфире (выход >50%).
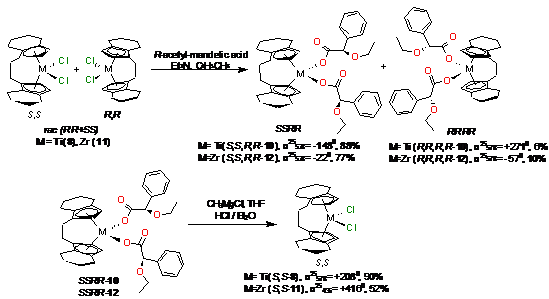
Схема 11
В работе [128] был выделен энантиомерно чистый
комплекс S,S-14.
Для этого исходный рацемат 11 вовлекали в реакцию с литийбинафтолатом и затем
реакционную смесь обрабатывали алюминиевой пудрой в дихлорметане (Схема 11). В
результате получали комплекс S,S,S-13,
который при взаимодействии с MeLi
давал диметилпроизводное S,S-14
с выходом 63% и энантиомерной чистотой 98% ee.

Схема 12
При разделении рацематов анса- металлоценов с
бифенильными мостиками 15 (Ti)
и 16 (Zr) с помощью R-бинафтола
получены энантиомерно чистые комплексы R,R,R-17
и R,R,R-18
(Схема 12) [129]. Реакция титаноцена 15 с R-ацетил-миндальной
кислотой приводила к образованию смеси диастереомеров 19 (выход определяли по
спектру ЯМР 1Н реакционной смеси), которые не удалось разделить при
помощи колоночной хроматографии.
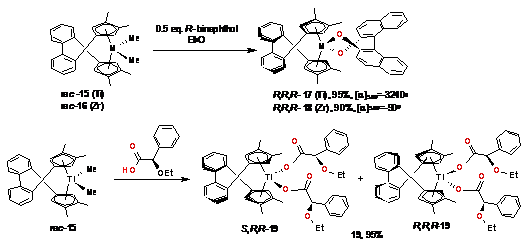
Схема 13
В работе [130] титановый комплекс рац-8
дериватизировали смесью R-
бинафтола и пара-аминобензойной кислоты в толуоле при кипячении с избытком
триэтиламина (Схема 13). В итоге получен бинафтолатный комплекс R,R,R-9
с выходом 34% и производное аминобензойной кислоты S,S-20,
которое при продувании хлороводородом в дихлорметане дает энантиомерно чистый
комплекс S,S-8
с выходом до 33%.
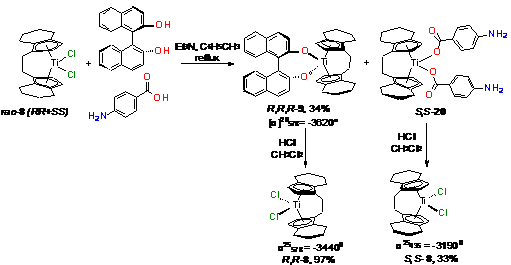
Схема 14
Такой же прием использовался для разделения
анса- цирконоцена 11 (Схема 14) [131]. В результате получали бинафтолатный
комплекс R,R,R-13
с выходом 37% и энантиомерной чистотой 97%ee.
Производное аминобензойной кислоты S,S-21
обрабатывали (S)-1,1’-бифен-2-олом
с получением комплекса S,S,S-22
(27%, 97%ee).
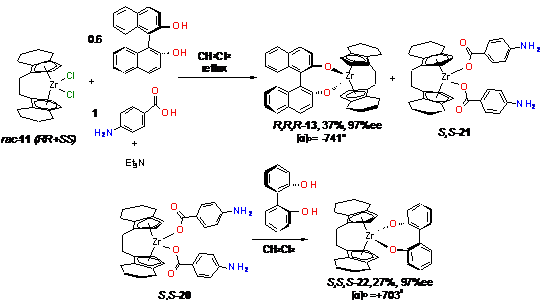
Схема 15
В работах [132, 133] описывается разделение
рацемической смеси комплекса rac-22
с помощью ВЭЖХ на оптически активных колонках, в которых в качестве носителя
используется нанесенный на силикагель трис(3,5-триметилфенилкарбамат) целлюлозы
[134, 135]. В ходе разделения получены два энантиомера: R,R,R-22
(б25435= -11000) и S,S,S-22
(б25435= +11000).
В литературе имеются также сведения о синтезе
хиральных комплексов переходных металлов за счет стереонаправленного действия
энантиомерно чистых лигандов. Так, в работе [136] описывается получение
оптически активных соединений титана S,S-26
и циркония S,S-27
c бифенильным
мостиком (Схема 15). Лиганд 25 был получен из дикарбоновой кислоты R,S-23,
которую предварительно разделяли на энантиомеры с помощью (+)-бруцина.
Взаимодействие S-24 с
димагниевым реагентом Гриньяра и последующий протонолиз приводили к
энантиомерно чистому лиганду 25 с выходом 60%. Переметаллирование на атом
переходного металла позволило выделить 46% комплекса S,S-26
и 20% S,S-27.

Схема 16
Хальтерман в своих работах [54-56] предложил
методы синтеза энантиомерно обогащенных комплексов S,S-Ti
(28a,b)
(Схема 16) на основе оптически активного лиганда S-28a,b,
в котором инденильные фрагменты связаны бинафтильным мостиком.
Схема 17
В работе [51] из оптически активного анса-
лиганда 30 с хорошим выходом (83%) был получен транс-бис(инденильный) комплекс
31. Возможно, пространственная структура транс-бис(инденил)циклогексана 30
определила в данном случае образование только одного диастереомера 31:
Схема 18
Для разделения смеси полученных в работе [52]
оптически активных комплексов 32a
(Схема 17) применяли фотолиз, затем, реакционную массу смешивали с R-(+)-бинафтолом
и разделяли на силанизированном силикагеле (Схема 18). Таким образом, были
получены оптически чистые комплексы p-R,p-R-32a
(выход 45%) и p-R,p-S-32a
(выход 14%). Взаимодействие энантиомерно чистого депротонированного лиганда 33
с ZrCl4
позволяет получать смесь диастереомеров 32b
с выходом до 18% с соотношением p-R,p-S-32b:p-R,p-R-32b:p-Sp-,S-32b=18.8:1:1.
Перекристаллизацией удалось выделить 9% изомеров p-R,p-R-32b
и p-S,p-S-32b
с соотношением 5,9:1 (схема 19).
Благодаря жесткой структуре и стерической
нагруженности диизопропилзамещенного циклогександиильного мостика оптически
активного лиганда 34 [53] был получен оптически чистый титаноцен 1R,2R,4R,5R-35
с выходом 76% (Схема 20):
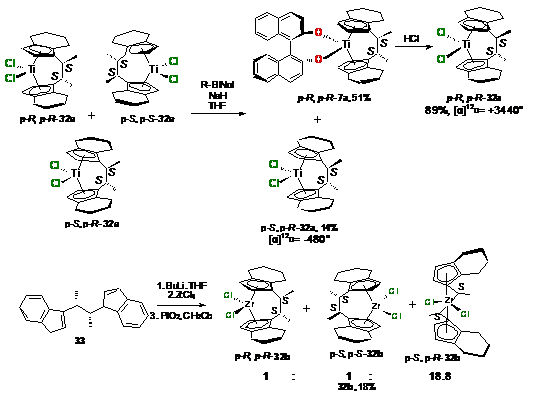
Схема 19

Схема 20
В работе [138] энантиомерно чистый анса-лиганд S,S-39
был получен на основе бинафтола и третбутилзамещенного
бисциклопентадиенилкремнийдиметила (37) (Схема 21). Синтезированный лиганд
использовали для получения комплекса иттрия S,S,R-40,
выход и энантиомерная чистоту которого определяли с помощью много- и одномерных
1H и 13C ЯМР-спектров в d8-ТГФ. Авторы отмечают, что использование (R)-(+)-1,1’-би-2-нафтола
приводило к образованию (R,R,S)-40
и (R,S)-40, соответственно, (S)-(−)-1,1'-би-2-нафтол
- к (S,S,R)-40
и (S,R)-40.

Схема 21
Энантиомерно чистые С1- симметричные
анса-комплексы S-44a-c
получены в работе [137], где в качестве синтона использовали оптически активный
циклопентадиен, содержащий углеводородный заместитель со стереогенным центром
(45) (Схема 22). Для придания большей жесткости молекуле комплекса лиганды
связывались двумя кремниевыми мостиками.

Схема 22
Использование более объемных оптически активных
заместителей в циклопентадиенильном лиганде 49a
привело к образованию двух изомеров комплекса S-50a'
и S-50a''
в соотношении 1:1 в случае переметаллирования ZrCl4
и 1:10 в случае Zr(NMe2)4 (схема 23).
Схема 23
В качестве прекурсоров синтеза хиральных анса-комплексов
могут выступать энантиомерно чистые амиды металлов. Так, Джордан в работе
[139], основываясь на идее стереоконтроля в ходе образования анса- комплексов
через хелатные пропандиамидные комплексы циркония (Схема 59), предложил синтез
оптически чистого R,R-энантиомера
амидного прекурсора 54 (выход 84%) исходя из R,R-
диметилпропандиамина (51) (Схема 24).
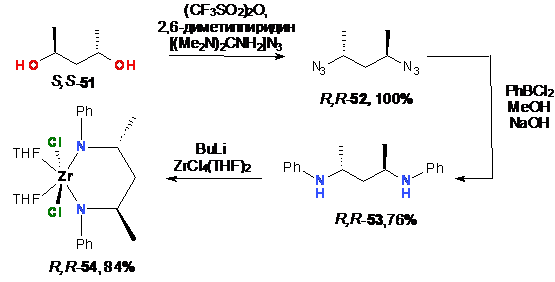
Схема 24
Дальнейшее взаимодействие прекурсора 54 с
литиевой солью лиганда с этилиденовым (61a)
и силильным (77a) мостиками
приводило к образованию энантиомерно чистых амидных комплексов 55 и 56 с
выходами 97% и 95%, соответственно. Так, впервые был получен энантиомерно
чистый этилиден-бис(инденил)цирконий дихлорид S,S-1a
с выходом 91% (Схема 25).
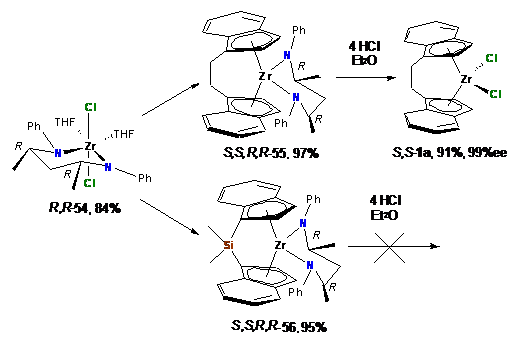
Схема 25
Таким образом, в литературе описано достаточно
большое количество методов получения энантиомерно чистых анса- комплексов
металлов IV подгруппы.
Интерес к подобного рода комплексам обусловлен возможностью их применения в
качестве катализаторов реакций энантиоселективной функционализации непредельных
соединений [1], примеры которых приведены на схеме 26.
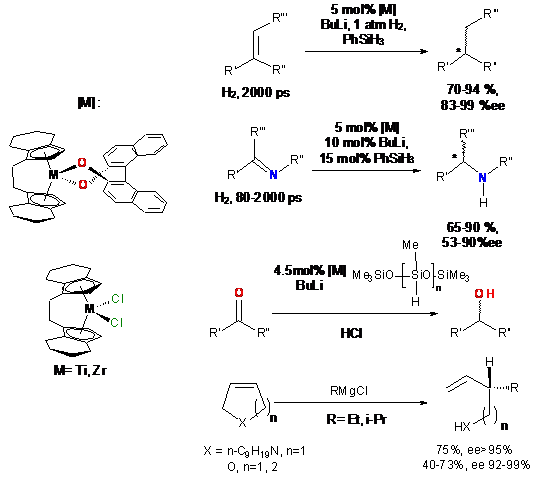
Схема 26
2. Каталитическое действие энантиомерно чистых
з5- комплексов переходных металлов подгруппы Ti в реакциях АОС с олефинами
Одним из важнейших направлений химии
металлоценов стал катализ реакции полимеризации алкенов Циглера- Натта з5-комплексами
металлов IV подгруппы в
сочетании с алюминий- и борорганическими соединениями (Схема 27). Реализация
этого метода в лабораторном и промышленном масштабе позволила перевести
традиционный циглеровский катализ из гетерогенной в гомогенную среду. В
результате были созданы высокоактивные и стереоселективные «одноцентровые»
катализаторы полимеризации непредельных соединений, а также появилась
возможность более подробного изучения механизма данного процесса [1, 2]. В
дальнейшем было показано, что металлоценовые комплексы подгруппы титана могут
быть с успехом применены в качестве катализаторов реакций функционализации
алкенов и ацетиленов алюминий- и магнийорганическими соединениями (Схема 28). В
результате развития этих работ разработаны методы гидро-, карбо- и
циклометаллирования непредельных соединений [8-7], позволяющие получать в одну
стадию в мягких условиях с высокой регио- и стереоселективностью как
ациклические, так и циклические металлорганические соединения, которые без
предварительного выделения могут быть вовлечены в реакции с электрофильными и
нуклеофильными реагентами для получения широкого ассортимента важнейших
мономеров и различных классов карбо-, гетероциклов и гетероатомных соединений.
Использование в данных реакциях катализаторов на
основе хиральных производных металлов подгруппы Ti
позволило создать новые энантиоселективные методы функционализации олефинов.
Так, в реакции алкенов с алюминийорганическими соединениями в качестве
катализаторов были использованы как конформационно лабильные 57-59, так и
конформационно жесткие R,R-11a,
R,R,R-13,
p-S,p-S-1a,
p-S,p-S-61a,
60-64 С2- и С1- симметричные энантиомерно чистые
комплексы (Схема 29). Результаты исследования энантиоселективного действия
данных комплексов объединены в таблице 1 и 2.

Схема 27
Схема 28
Возможность применения оптически активных
циркониевых катализаторов для энантиоселективной функционализации алкенов с
помощью АОС впервые показал Негиши в 1995 году [141]. Так, было изучено
каталитическое действие хиральных комплексов p-S,p-S-57a,
p-R,p-R-57a,
p-R,p-R-58,
впервые синтезированных в работе [142], R,R-11a
[89,128,131] и R,R,R-13
[89,128,131] в реакции олефинов с AlMe3 в хлорсодержащих
растворителях (таблица 1).
Таблица 1 - Каталитическое действие энантиомерно
чистых комплексов p-S,p-S-1a,
R,R-11a,
R,R,R-13,
p-S,p-S-61a,
57-64 в реакциях алкенов с AlR3

|
Каталитическая
система, ссылка
|
Строка
|
AlR3 R=
|
Выделенный
продукт
|
|
p-S,p-S-57a +MAO, CH2Cl2, CH3CHCl2, (CH2)2Cl2,
-200…250C [141-145, 150]
|
1
|
Me
|
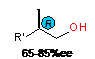 R'=
i-C4H9 (74%ee), n-C6H13(72%ee), Cy(65%ee), Ph(85%ee), Bn(70%ee),
(CH2)4NEt2(71%ee), (CH2)4OH(75%ee), PhOCH2(75%ee) R'=
i-C4H9 (74%ee), n-C6H13(72%ee), Cy(65%ee), Ph(85%ee), Bn(70%ee),
(CH2)4NEt2(71%ee), (CH2)4OH(75%ee), PhOCH2(75%ee)
|
|
2
|
Et
|
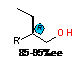 R'=
n-C4H9 (94%ee), i-C4H9 (90%ee), n-C8H17(92%ee), Bn(93%ee), (CH2)4NEt2(95%ee),
(CH2)4OH(90%ee), PhOCH2(85%ee) R'=
n-C4H9 (94%ee), i-C4H9 (90%ee), n-C8H17(92%ee), Bn(93%ee), (CH2)4NEt2(95%ee),
(CH2)4OH(90%ee), PhOCH2(85%ee)
|
|
p-R,p-R-57a+ MAO [141]
|
3
|
Me
|
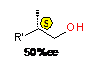 R'=
C6H13 R'=
C6H13
|
|
p-S,p-S-57a 2 eq.R3Al, 1.2 eq. i-BAO, CH2Cl2,
0 0C [147]
|
4
|
Me
|
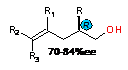 R1=Ph,
R2=R3=H (80%ee), R1=n-C6H13, R2=R3=H(78%ee), R1= R3=H, R2=n-C6H13(76%ee),
R1=H, R2=n-C6H13, R3=Cl (80%ee), R1= R3=H, R2=TBS (70%ee), R1=Me, R2=
TBSO(CH2)2, R3=H (84%ee), R1=H, R2=H, R3=n-C4H9 (72%ee), R1=Me3Si, R2=
n-C4H9, R3=H (74%ee), R1= n-C4H9, R2=H, R3=n-C4H9 (76%ee), R1=H, R2=n-C6H13,
R3=Me (78%ee) R1=Ph,
R2=R3=H (80%ee), R1=n-C6H13, R2=R3=H(78%ee), R1= R3=H, R2=n-C6H13(76%ee),
R1=H, R2=n-C6H13, R3=Cl (80%ee), R1= R3=H, R2=TBS (70%ee), R1=Me, R2=
TBSO(CH2)2, R3=H (84%ee), R1=H, R2=H, R3=n-C4H9 (72%ee), R1=Me3Si, R2=
n-C4H9, R3=H (74%ee), R1= n-C4H9, R2=H, R3=n-C4H9 (76%ee), R1=H, R2=n-C6H13,
R3=Me (78%ee)
|
|
5
|
Et
|
 R1=Ph,
R2=R3=H (94%ee), R1=n-C6H13, R2=R3=H(90%ee), R1=H, R2=n-C6H13, R3=Cl (92%ee),
R1=H, R2=TBS, R3=H(90%ee) R1=Ph,
R2=R3=H (94%ee), R1=n-C6H13, R2=R3=H(90%ee), R1=H, R2=n-C6H13, R3=Cl (92%ee),
R1=H, R2=TBS, R3=H(90%ee)
|
|
p-R,p-R-57a 2 eq.R3Al, 1.2 eq. i-BAO, CH2Cl2,
0 0C [147]
|
6
|
Me
|
 R1=Me,
R2=R3=H (74%ee), R1=H, R2=Me2C=CHCH2CH2-, R3=Me(78%ee), R1=H, R2=Me,
R3=Me2C=CHCH2CH2-(80%ee) R1=Me,
R2=R3=H (74%ee), R1=H, R2=Me2C=CHCH2CH2-, R3=Me(78%ee), R1=H, R2=Me,
R3=Me2C=CHCH2CH2-(80%ee)
|
|
p-R,p-R-58 [141]
|
7
|
Me
|
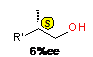 R'=
C6H13 R'=
C6H13
|
|
p-S,p-S-57b + B(C6F5)3 (CH2)2Cl2, -00…230C
[146]
|
8
|
Me
|
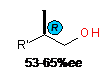 R'=
n-C4H9 (55%ee), i-C4H9 (63%ee), Bn(66%ee), TBS(CH2)7 (53%ee) R'=
n-C4H9 (55%ee), i-C4H9 (63%ee), Bn(66%ee), TBS(CH2)7 (53%ee)
|
|
p-S,p-S-1a [149]
|
9
|
Me
|
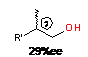 R'=
Bn R'=
Bn
|
|
p-S,p-S-61a [149]
|
10
|
Me
|
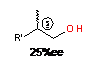 R'=
Bn R'=
Bn
|
|
p-S,p-S-62 [149]
|
11
|
Me
|
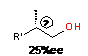 R'=
Bn R'=
Bn
|
|
p-S,p-S-63 [149]
|
12
|
Me
|
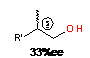 R'=
Bn R'=
Bn
|
|
p-S,p-S-64 [149]
|
13
|
Me
|
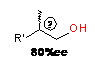 R'=
Ph R'=
Ph
|
|
R,R,R-13 [141]
|
14
|
Me
|
 R'=
C6H13 R'=
C6H13
|
|
R,R-11a [141]
|
15
|
Me
|
 R'=
C8H17 R'=
C8H17
|
В результате окисления и гидролиза реакционной
массы получен 2-метил-1-октанол с выходом более 40%. Оказалось, что во всем
ряду испытанных комплексов наибольшей энантиоселективностью обладает комплекс p-S,p-S-57a,
применение которого в реакции позволяет получать продукты метилалюминирования с
энантиомерной чистотой 85%ее (R).
Другие комплексы показали меньший стереодифференцирующий эффект (таблица 1,
строки 3, 7, 14, 15).
Для объяснения полученных результатов Негиши с
сотр. отмечает [151], что большая энантиомерная чистота продуктов
карбометаллирования может быть объяснена с позиций прямого присоединения Zr-R
связи к алкену, активированного с помощью АОС, по механизму, аналогичному
процессам Циглера-Натта (Схема 29).

Схема 29
Ориентация олефина при подходе и внедрении
молекулы олефина в каталитический центр в таком случае определяется взаимным
пространственным расположением p-лигандов комплекса и
расположением ментильных заместителей. И в случае больших алкильных групп,
например, при использовании AlEt3,
б- агостическое взаимодействие за счет стерически нагруженных ментильных групп
должно оказывать дополнительное стереоиндуцирующее действие.
В ходе дальнейших исследований установлено, что
добавление небольшого количества воды или МАО к каталитической системе на
основе p-S,p-S-57a
(таблица 1, строка 1) увеличивает выход продуктов метилалюминирования олефинов
(>60%) [143-145]. Однако энантиоселективность реакции практически не
изменяется и составляет 55-90%ее.
Применение каталитической системы p-S,p-S-57b‒B(C6F5)3
в реакции алкенов с AlMe3
в толуоле позволяет получать продукты метилалюминирования стирола и аллилбензола
с R-конфигурацией в-стереогенных центров с энантиомерным избытком 55-66%ee
(таблица 1, строка 8) [146].
С целью расширения области приложения данной
реакции в работе [147] асимметрическому карбоалюминированию в присутствии
неоментилинденильных з5- комплексов p-S,p-S-57a
или p-R,p-R-57a
подвергались 4,5-замещенные 1,4-диены с получением оптически активных продуктов
с энантиомерной чистотой 55-85%ее с выходом до 80% (таблица 1, строки 4-6).
Исследование энантиоселективности реакции
карбоалюминирования стирола и аллилбензола с помощью AlMe3
в
присутствии
S,S-анса-цирконоценов
p-S,p-S-1a, p-S,p-S-61a, p-S,p-S-62, p-S,p-S-63, p-S,p-S-64 проведено
Нортоном
с
сотр.
[148,
149] (таблица 1, строки 9-13). В присутствии 10-13 мол.% анса-комплексов
конверсия исходных алкенов в реакции метилалюминирования составила 72-89% в
течение 3-6 ч. Наибольшей энантиоселективности удалось добиться при
использовании в качестве субстрата стирола в присутствии 26 мол.% комплекса p-S,p-S-64,
активированного [Ph3C][B(C6F5)4].
Энантиомерный избыток 2-фенил-1-пропанола, полученного после окисления
продуктов реакции, составил 80%ее. Применение в качестве субстрата аллилбензола
в реакции метилалюминирования после окисления реакционной массы приводило к
2-метил-3-фенил-1-пропанолу с энантиомерным избытком 25-33%ee
практически во всем ряду испытанных катализаторов p-S,p-S-1a,
p-S,p-S-61a,
p-S,p-S-62,
p-S,p-S-63,
p-S,p-S-64.
Интересно, что переход от этандиильного мостика к диметилсилиленовому в
комплексах p-S,p-S-1a
и p-S,p-S-61a,
а также введение метильных групп в 4,7- или 3- положение инденильных лигандов в
комплексах p-S,p-S-62
и p-S,p-S-63
не привело к значительным изменениям энантиоселективности реакции.
Для объяснения этого факта авторами [148]
рассмотрен механизм метилалюминирования алкенов в присутствии энантиомерно
чистых анса-цирконоценов (Схема 30). Так, согласно схеме исходный анса-комплекс
S,S-1a
в присутствии МАО переходит в активированное состояние - катионный комплекс S,S-1a.1.
Последующая координация и внедрение олефина дает новый алкилциркониевый катион S,S-1a.3.
Ассоциация молекулы AlMe3
с катионом S,S-1a.3
приводит к образованию гетеробиметаллического комплекса S,S-1a.4.
Целевой АОС образуется в результате алкильного обмена в комплексе S,S-1a.4
и его диссоциации. Выдвинуто предположение, что большая энантиоселективность
реакции обуславливается стадией координации олефина к активированному комплексу
по типу «side
on», а меньшая по
типу «head
on». Отмечается, что,
по-видимому, в комплексах p-S,p-S-62
и p-S,p-S-63
метильные заместители не обладают объемом, достаточным для блокировки
направления «head
on». Увеличение
энантиоселективности метилалюминирования в случае применения стирола авторы
связывают с усиливающимся взаимодействием лигандного остова комплекса с
фенильным фрагментом стирола.

Схема 30
Карбометаллирование терминальных алкенов с
помощью AlEt3 в хлорсодержащих растворителях в присутствии 8 мол.%
комплекса p-S,p-S-57a,
как показано в работах [145, 150, 151], позволяет получать продукты
этилалюминирования с энантиоселективностью 68-96%ее и общим выходом 5 8-88%
(таблица 2, строка 2).
Таблица 2 - Каталитическое действие энантиомерно
чистых комплексов p-S,p-S-1a,
R,R-11a,
R,R,R-13,
p-S,p-S-61a,
57-64 в реакции циклоалюминирования алкенов с помощью AlEt3

|
Строка
|
Каталитическая
система, ссылка
|
Выделенный
продукт
|
|
1
|
p-S,p-S-57a, C6H14
[150]
|
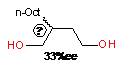 R'=
n- C8H17 R'=
n- C8H17
|
|
2
|
p-S-59
[156]
|
 R'=
SPh R'=
SPh
|
|
3
|
p-S-59
[156]
|
 R'=
(CH2)3Ph R'=
(CH2)3Ph
|
|
4
|
p-R-59
[156]a
|
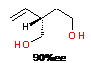
|
|
5
|
R,R,R-13 [156]a
|
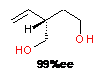
|
|
6
|
p-R,S-60 [154, 155]
|
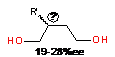 R'=
Ph (19%ee), Bn (28%ee) R'=
Ph (19%ee), Bn (28%ee)
|
aв
качестве исходного соединения использовался 2,5-дигидрофуран
В работах Негиши [152, 153] энантиомерная
чистота образующихся после окисления продуктов этилалюминирования
в-алкил-алканолов была повышена до 99%ee
с помощью катализируемой липазой реакции ацетилирования образующихся
энантиомерно обогащенных алканолов (Схема 31).
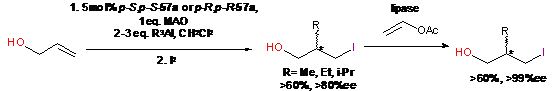
Схема 31
В работе [150] впервые сообщается об
асимметрическом циклоалюминировании децена-1, катализируемым p-S,p-S-57a,
в гексане (таблица 1, строка 1). Энантиомерный избыток 2-октилзамещенного
бутан-1,4-диола, выделенного после окисления и гидролиза соответствующего
циклического АОС, составил 33%ее, что намного меньше энантиомерной чистоты
ациклических продуктов карбоалюминирования, образующейся в этой же
каталитической системе при проведении реакции в хлорсодержащих растворителях
(92%ее).
Последующие попытки использовать оптически
активные комплексы металлов подгруппы титана в качестве катализаторов реакции
циклоалюминирования алкенов триэтилалюминием предпринимались всего в двух
работах. Так, Вэймауф [154, 155] осуществил циклоалюминирование аллилбензола и
стирола с помощью AlEt3
в присутствии 10 мол.% (+)-[з5:з1-инденилдиметилсилил(б-метилбензил)амидо]титан
дихлорида (p-R,S-60)
с выходом продуктов реакции 40-60% и энантиомерным избытком на уровне 19-28%ее
(таблица 1, строка 6).
Этилалюминирование проп-2-енилсульфобензола и
пент-4-енилбензола с помощью AlEt3
в присутствии 2 мол.% комплекса p-S-59,
осуществленное в работе [156], приводило к образованию оптически активного
2-метилбутилсульфобензолу и 2-(3-фенилпропил)бутан-1,4-диолу с
энантиоселективностью 64%ее и 30%ее, соответственно (таблица 1, строки 2-3).
Высокая энантиоселективность на уровне 90-99%ее
наблюдалась в реакции 2,5-дигидрофурана с AlEt3,
катализируемой комплексами p-R-59
или R,R,R-13
(таблица 1, строки 4,5).
Таким образом, хемо- и энантиоселективность
каталитических реакций АОС с алкенами зависит от многих параметров, среди
которых структура катализатора является важнейшим фактором. Как следует из
рассмотренных выше примеров, поиск активных и селективных каталитических систем
для реакций функционализации алкенов с помощью АОС происходит путем широкого
скрининга исходных реагентов, комплексов переходных металлов и условий реакции,
поскольку зачастую трудно установить четкую корреляцию между эффективностью
каталитической системы и электронным и пространственным строением каталитически
активных центров, на которых происходит координация субстрата и его последующая
трансформация. Среди исследований, посвященных поиску новых катализаторов для
хемо- и энантиоселективных трансформаций алкенов под действием АОС, недостаточно
внимания уделено анса-комплексам металлов подгруппы Ti.
Известно, что эти соединения проявляют высокую активность и стереоселективность
в реакциях полимеризации алкенов, однако, их каталитическое действие
практически не изучено в реакциях гидро, карбо- и циклометаллирования алкенов,
которые, в свою очередь, можно рассматривать в качестве промежуточных стадий
полимеризационных процессов. Поэтому исследование каталитического действия
анса-комплексов циркония в реакциях алкенов с АОС важно не только с точки
зрения создания новых эффективных методов построения С-H,
C-C
и металл-С связей, но и в связи с возможностью получения важной информации о
влиянии структуры катализатора на направление и стереоселективность реакций, а
также строении каталитически активных центров, что может являться важным
моментом для понимания механизмов циглеровского катализа.
3. Синтез энантиомерно чистых анса- з5-комплеков
Zr
С целью разработки новых катализаторов для
энантиоселективной функционализации алкенов нами синтезированы энантиомерно
чистые анса-комплексы Zr p-S,p-S-65a,
S,p-S,p-S-13,
S,p-S,p-S-66
и изучено их действие в реакции алкенов с триалкилаланами.
Синтез исходных рац- анса- цирконоцендихлоридов rac-65a,
rac-11a
осуществляли согласно методам, описанным в работах [89, 92]. Связанные Me2Si
или Н4С2 - мостиками бисиндены подвергали
депротонированию с помощью бутиллития в ТГФ, затем раствор литиевой соли аниона
лиганда смешивался с суспензией ZrCl4
в ТГФ, в результате чего получали рац- и мезо-изомеры комплексов 1a
с выходом до 50% и 61а с выходом до 30% (Схема 32). Каталитическое гидрирование
комплексов rac-1a
и rac-61а приводило к rac-11а
(23%) и rac-65а (15%),
соответственно.
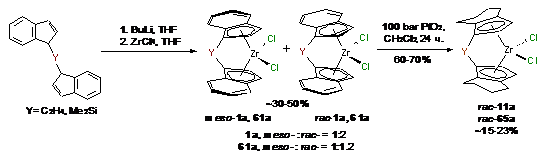
Схема 32
Впервые для комплекса с диметилсилиленовым
мостиком рац-65а проведен рентгеноструктурный анализ и получены параметры длин
связей и углов в комплексе (Рис. 1, Таблица 3).
Кристаллографические данные для рац-65a:
брутто-формула C20H30SiZrCl0.2
(M =365.31),
моноклинная сингония, пространственная группа P21/c,
a = 10.4029(2) Е, b
= 16.3369(7) Е, c = 11.31606
(19) Е, в = 92.4796(17)°, V
= 1921.38(9) Е3, Z
= 5, T = 200.2 K,
м= 0.913 мм-1, dвыч
= 1.5785 мг/мм3, F(000)= 925.7, число независимых отражений 3469 (Rint
= 0.0138), собрано отражений 5685 (4.64 ≤ 2И ≤ 62.26), R1=
0.026925 (I>=2у(I)),
wR2=
0.096142.
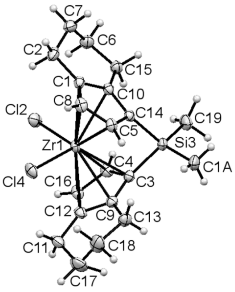
Рисунок 1. Структура комплекса rac-65a
согласно данным РСА.
В результате гидрирования структура Si-содержащего
комплекса рац-65a
незначительно отклоняется от структуры бис-инденильного аналога рац-71a
по таким параметрам как длины связей, диэдральный угол между плоскостями
циклопентадиенильных колец, угол Cl-Zr-Cl
и углами при атоме Si.
Наибольшие изменения претерпевает угол центроид-Zr-центроид
от 119,04° до 126,36°(г согласно схеме 1). Структура полученных комплексов была
также подтверждена с помощью методов одно- и двумерной ЯМР спектроскопии.
Таблица 3 - Длины связей и углы между ними в
соединении рац- 65a
|
Связь
|
Длина,
Е
|
Связь/
угол
|
Длина,
Е/ Угол, 0
|
|
Zr1-Cl2
|
2.4430(6)
|
CE-Zr
|
2,2194(9)
|
|
Zr1-Si3
|
3.3308(8)
|
C11-C17
|
1.527(5)
|
|
Zr1-Cl4
|
2.4326(8)
|
C6-C7
|
1.528(4)
|
|
Zr1-C1
|
2.622(2)
|
C17-C18
|
1.503(5)
|
|
Zr1-C3
|
2.476(3)
|
C15-C6
|
1.535(4)
|
|
Zr1-C4
|
2.449(3)
|
C2-C7
|
1.523(5)
|
|
Zr1-C5
|
2.4372(19)
|
Cl4-Zr1-Cl2
|
97.41(3)
|
|
Zr1-C8
|
2.554(2)
|
C14-Si3-C3
|
94.01(11)
|
|
C1-C2
|
1.499(4)
|
C19-Si3-C14
|
112.98(14)
|
|
C3-C4
|
1.432(3)
|
C1A-Si3-C19
|
110.61(19)
|
|
C5-C8
|
1.409(4)
|
C15-C10-C14
|
128.7(3)
|
|
Si3-C3
|
1.873(2)
|
C7-C2-C1
|
109.1(3)
|
|
Si3-C19
|
1.839(4)
|
C6-C7-C2
|
111.9(2)
|
|
C1-C8
|
1.407(4)
|
CE-Zr-CE
|
126.36(5)
|
|
C1-C10
|
1.421(4)
|
PL-PL
|
61.45(9)
|
Из известных испытанных нами способов разделения
рацемических смесей анса-комплексов на индивидуальные энантиомеры [89, 126-131,
139] наиболее эффективным оказалось взаимодействие литиевой соли
(S)-2,2'-бинафтола с рац-анса-L2ZrCl2
(rac-11a,
rac-65a)
(Схема 33).
В этом случае происходило кинетическое
разделение стереоизомеров с образованием смеси S,p-S,p-S-13
(S,p-S,p-S-66)
и p-R,p-R-11a
(p-R,p-R-65a),
аналогично титаноценовым комплексам [89] (Рис. 2). Энантиомерная чистота комплексов
оценивалась с помощью спектроскопии ЯМР 1Н.
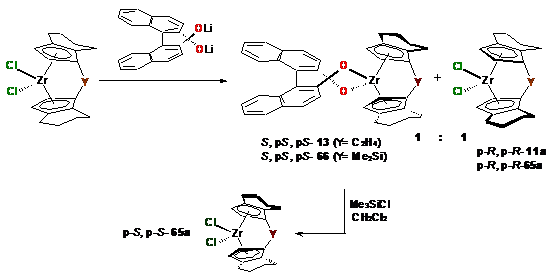
Схема 33
В спектрах ЯМР 1Н реакционной массы
наблюдались пары дублетных сигналов вицинальных протонов На и Hb
циклопентадиенильных колец дихлоридного комплекса при дН 5.46
и 6.69 м.д. и бинафтолатного производного при дН 5.53 и 5.92 м.д.
(Рис. 9), которые давали соответствующие кросс-пики в спектрах COSY
HH.
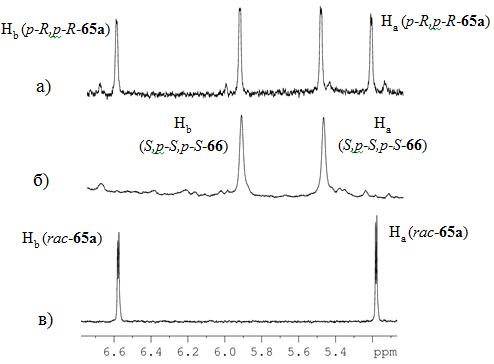
Рисунок 2. а) Сигналы протонов Ha
и Hb в спектре ЯМР 1Н
смеси p-R,p-R-
65а и S,p-S,p-S-66;
б) спектр ЯМР 1Н выделенного S,p-S,p-S-66;
в) спектр ЯМР 1Н рац-65a.
В NOESY спектре бинафтолатных комплексов S,p-S,p-S-66,
S,p-S,p-S-13
обнаружено пространственное взаимодействие протонов циклопентадиенильных
фрагментов р-лиганда Hb и бинафтолатной части комплексов (Рис. 3).
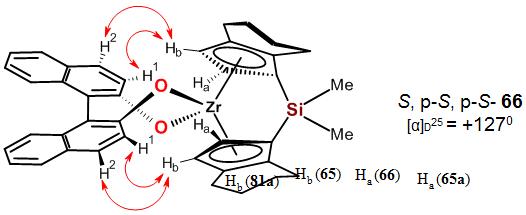
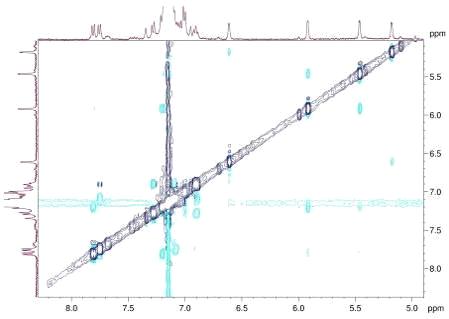
Рисунок 3. Слабопольная часть спектра NOESY
смеси S,p-S,p-S-66
и p-R,p-R-65a
4. Каталитическое действие энантиомерно чистых
з5-комплексов Zr в реакциях терминальных алкенов с AlR3
С целью разработки новых катализаторов для
энантиоселективной функционализации алкенов нами синтезированы энантиомерно
чистые анса-комплексы Zr p-S,p-S-65a,
S,p-S,p-S-13,
S,p-S,p-S-66,
и изучено их действие в реакции AlR3
(R= Me,
Et) c
алкенами [177].
Применение как бинафтолатного (S,p-S,p-S-66),
так и дихлоридного (p-S,p-S-65a)
комплексов с Si-связанными
лигандами в реакции октена-1 с AlMe3
не привело к образованию продуктов реакции. Активирование каталитической
системы с помощью МАО позволило получить ациклическое АОС (68с) с выходом ~66%
при использовании в качестве катализатора p-S,p-S-65a
(Схема 34). Энантиомерный избыток продуктов метилалюминирования составил ~ 58%,S.
В этом случае также наблюдалось образование функционально замещенных олигомеров
69с с выходом до 34%.
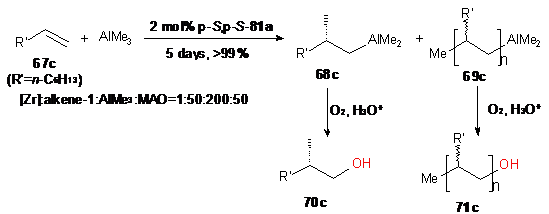
Схема 34
В реакции AlEt3
с гексеном-1 наибольшую энантиоселективность в направлении карбоалюминирования
(72) на уровне 50%ее,S проявляет комплекс p-S,p-S-65a
(Схема 35). Энантиомерная чистота циклических АОС (73) в результате применения
катализаторов p-S,p-S-65a,
S,p-S,p-S-13,
S,p-S,p-S-66
составила 12-26%ee,S.
В реакции гексена-1 с AlEt3,
катализируемой этими комплексами, также происходит региоселективное образование
энантиомерно обогащенных функционально замещенных олигомеров 74a
с числом звеньев до 6 (Таблица 1).
Таким образом, наибольшую энантиоселективность в
реакциях AlEt3 с терминальными алкенами показал конформационно
лабильный комплекс бис(1-неоментилинденил)цирконий дихлорид. Комплексы с жесткой
структурой проявили меньшую активность и энантиоселективность.
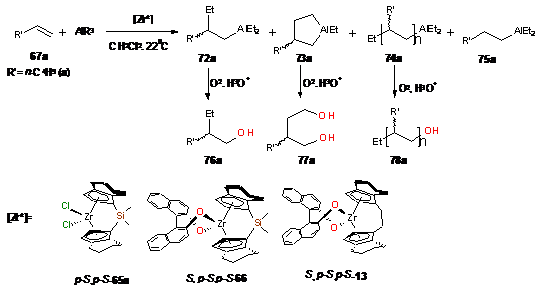
Схема 35
Таблица 3 - Реакция гексена-1 с AlEt3,
катализируемая комплексами p-S,p-S-65a,
S,p-S,p-S-13,
S,p-S,p-S-66,
(мольное соотношение [Zr]
: алкен: AlEt3
= 1 : 50 : 60, CH2Cl2,
время реакции 72 ч, 20єC).
|
Катализатор
|
Конверсия
алкена, %
|
Выход
продукта,a % (ee%,
R/S)
|
|
|
72a
|
73a
|
74a
|
|
p-S,
p-S-65a
|
99
|
65 (50, S)
|
20 (12, S)
|
|
S,p-S,p-S-13
|
98
|
60 (30, S)
|
23
(26, S)
|
20, n=2, [б]D25(78а)
= -1,50
|
|
S,p-S,p-S-66
|
99
|
15 (15,
S)
|
30 (20, S)
|
54, n=2
|
5. Экспериментальная часть
Синтез R-МТРА
эфиров одно- и двухатомных спиртов 239a-j
и 240a-j
Полученные спирты 76a-j
и 77a-j
вовлекали в реакцию с реагентом Мошера (S-МТРАCl)
согласно методике, описанной в литературе [178, 179]. В стеклянный реактор
объемом 5 мл, установленный на магнитной мешалке, заполненный аргоном,
загружали 2 мкл одно- (76a-j)
или двухатомного спирта (77a-j),
10 мкл пиридина-d5,
0,2 мл CDCl3
и 4 мкл реагента Мошера (S-МТРАCl)
(для двухатомных спиртов значения объемов пиридина и реагента Мошера
увеличиваются вдвое). Реакцию проводили при температуре 22оC
при непрерывном перемешивании в течение 24 ч. К реакционной массе добавили 0,5
мл d6-бензола
или d8-толуола
и полученные (R)-МТРА эфиры
анализировали с помощью ЯМР спектроскопии 13С и 2D
гомо- (HH
COSY) и гетероядерной
спектроскопии (HSQC,
HMBС).
Синтез R-PSPA
эфиров одно- и двухатомных спиртов 240a-j
и 242a-j
Полученные спирты 76a-j
и 77a-j
вовлекали в реакцию с реагентом R-PSPA
согласно методике, описанной в литературе [180]. Полученные R-PSPA
эфиры анализировали с помощью ЯМР спектроскопии 77Se.
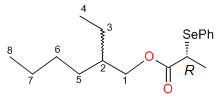
Рисунок 4
(R)-PSPA эфир
(2R,S)-этил-1-гексанола
(240a). 1H ЯМР
(CDCl3) д 0.86 (т,
3H, 3J= 7.5 Гц,
CH3CH2CH), 0.91 (т,
3H, 3J= 6.5 Гц,
CH3), 1.21-1.41 (м,
8H, CH2), 1.45-1.54 (м,
1H, CH2CH), 1.56 (д,
3H, 3J= 7.0 Гц,
CH3CH), 3.80 (кварт,
1H, 3J= 7.0 Гц,
CHSe), 3.95 (дд, 1H, 2J=
10.8 Гц,
3J= 5.8 Гц,
CHHO), 4.00 (дд, 1H, 2J=
10.8 Гц,
3J= 5.8 Гц,
CHHO), 7.24-7.36 (м,
3H, Ph), 7.60 (д,
2H, 3J= 7.0 Гц,
o-H(Ph)). 13C ЯМР
(CDCl3) д 11.0
(C4), 14.1 (C8), 17.8 (CH3CHSe), 22.9 (C7),
23.7 (C3), 28.9 (C5), 30.3 (C6), 38.7 (C2),
37.5 (CHSe), 67.4 (C1), 128.1, 128.4, 129.0, 135.4 (Ph), 173.7
(C=O). 77Se ЯМР
(CDCl3) д
452.13 (SR), 452.22 (RR).
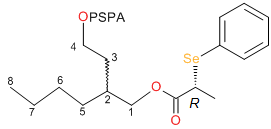
Рисунок 5
(R)-PSPA эфир
(2R,S)-бутил-1,4-бутандиола
(242a). 1H ЯМР
(CDCl3) д 0.89 (т,
3H, CH3CH2, 3J=6.8 Гц),
1.20-1.29 (м, 4H, (CH2)2),
1.22-1.31 (м, 2H, CH3CH2),
1.54 (д,
3H, CH3CH, 3J=7.2 Гц),
1.55 (д,
3H, CH3CH, 3J= 7.2 Гц),
1.51 (пент,
2H, CHCH2CH2O, 3J=6.8 Гц),
1.58-1.67 (м, 1H, CH2CHCH2O),
3.73-3.83 (м, 2H, CH3CH),
3.91 (дд,
1H, CHCHHO, 2J= 11.2 Гц,
3J= 5.6 Гц),
3.97 (дд,
1H, CHCHHO, 2J= 11.2 Гц,
3J= 5.6 Hz), 3.98-4.09 (м,
2H, CH2CH2O), 7.25-7.35 (м,
6H, Ph), 7.55-7.62 (м,
4H, Ph). 13C ЯМР
(CDCl3) дC
14.0 (C8), 17.65, 17.70,
17.73 (CH3CH), 22.8 (C7), 28.8 (C6), 30.7 (C5),
30.10 (RRR), 30.17 (SRR) (C3), 34.39 (RRR), 34.42 (SRR) (C2),
37.6 (SeCH), 63.0 (C4), 67.13 (RRR), 67.16 (SRR) (C1),
173.4, 173.5 (C=O), 127.90, 127.94, 127.99, 128.42, 128.45, 129.00, 129.02,
135.4, 135.6, 135.97 (Ph). 77Se ЯМР
(CDCl3) дSe 453.50 (RRR), 453.89 (RRR), 454.08 (SRR),
454.25 (SRR).
Синтез анса-комплекса
рац-81.
Синтез rac-Me2Si(Ind)2ZrCl2
осуществляли на основе методик, описанных в работе [36]. В 250 мл трехгорлую
колбу, снабженную магнитной мешалкой, заполненную аргоном, помещали 12.1 ммоль
(3.5 г) диметилбис(инденил)силана и 100 мл сухого ТГФ. Смесь охлаждали до -78°С
и добавляли 24.2 ммоль (2.5 М в гексане, 10 мл) BunLi.
Температуру реакционной смеси доводили до комнатной (20°С)
и перемешивали в течение 4 часов. Затем полученный раствор охлаждали до -78°С и
добавляли 12.1 ммоль (2.83 г) возогнанного ZrCl4
при
перемешивании. В течение 2 часов температуру смеси выдерживали -30°С. Затем
полученный раствор перемешивали 24 часа при комнатной температуре (20°С).
Образование комплекса и выход и соотношение рац: мезо определяли по ЯМР 1Н.
Реакционную смесь упаривали и сухой остаток переносили в автоклав, добавляли 65
мл дихлорметана, 100 мг PtO2.
Гидрирование осуществляли при 100 атм Н2 в течение 24 часов при
постоянном перемешивании. Затем реакционная смесь фильтровали. Фильтрат
упаривали и сухой осадок экстрагировали горячим толуолом. Комплекс рац-81
выделяли в виде светло-зеленых кристаллов в результате перекристаллизации из
горячего толуола при температуре - 18°С с выходом 1.0 г (15%).
рац-
Диметилсилилбис(4,5,6,7-тетрагидро-1-инденил)цирконий дихлорид (рац-81).
1H ЯМР (C6D5CD3)
д 0.386 (с, 6Н,
(C10H3)2Si), 1.30-1.48 (м,
4Н,
C7HaxHeq C6HaxHeq),
1.76-1.89 (м, 2Н,
C7HaxHeq), 1.90-2.02 (м,
2Н,
C6HaxHeq), 2.07-2.19 (м,
2Н,
C8HaxHeq), 2.22-2.33 (м,
2Н,
C8HaxHeq), 2.53 (dt, 2J=16.4 Гц,
3J=3J=5.6 Гц,
2Н,
C5HaxHeq), 3.02-3.14 (м,
2Н,
C5HaxHeq), 5.18 (д,
J=3 Гц,
2Н,
C2H), 6.57 (д,
J=3 Гц,
2Н,
C3H). 13C ЯМР
(C6D5CD3) д
-2.82 (C10), 21.79 (C7),
22.1 (C6), 24.4 (C5), 25.8 (C8), 102.1 (C1),
111.9 (C2), 125.04 (C3), 128.32 (C9), 137.59
(C4).
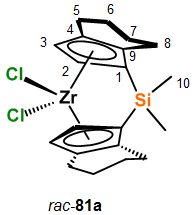
Рис. 6
Синтез энантиомерно
чистых
анса-комплексов
S,p-S,p-S-231, p-S,p-S-81
В стеклянный реактор объемом 50 мл,
установленный на магнитной мешалке, в атмосфере аргона помещали 1,1 ммоль (0.32
г) S-бинафтола и 20 мл
толуола. Смесь охлаждали до -78°С и добавляли постепенно 0.88
мл бутиллития (2.5 М в гексане). Температуру реакционной массы довели до
комнатной (20°С) и перемешивали до образования белого осадка S-бинафтолата
лития. В стеклянный реактор объемом 50 мл, установленный на магнитной мешалке,
в атмосфере аргона помещали 2,2 ммоль (1.0 г) ((диметилсилил{з5 -
4,5,6,7-тетрагидро-1-инденил}) цирконий] дихлорида (рац-81a)
и 20 мл толуола. Затем полученный раствор комплекса был добавлен к смеси S-бинафтолата
лития при охлаждении (до -78 °С) небольшими порциями.
Температуру реакционной массы довели до комнатной (22°С)
и перемешивали в течение 12 ч. до образования белого осадка. После упаривания
растворителя к оставшейся массе добавили 20 мл дихлорметана, отфильтровывали
через стеклянный фильтр. Фильтрат упаривали и получали (p-S,p-S-
(диметилсиланедиил {з5 - 4,5,6,7-тетрагидроинденил}) цирконий]-S-бинафтолат
в виде микрокристаллического осадка с выходом 30 % (0,44 г).
0.05 г бинафтолатного комплекса S,p-S,p-S-231
(0.075 ммоль) растворяли в 20 мл хлористого метилена и добавляли 0.15 ммоль Me3SiCl
при охлаждении. Реакционную массу перемешивали 1 час. В спектрах ЯМР 1H
наблюдались сигналы дихлоридного комплекса p-S,p-S-81
(конверсия >99%).
p-S,p-S-диметилсилилбис(4,5,6,7-тетрагидро-1-инденил)цирконий
S-бинафтолат.
1H ЯМР (C6D6)
д 0.557 (с, 6Н,
(C10H3)2Si), 0.97-1.12 (м,
2Н,
С6HaxHeq),
1.20-1.34 (м, 2Н,
С7HaxHeq),
1.41-1.55 (м, 2Н,
С6HaxHeq),
1.55-1.70 (м, 2Н,
С7HaxHeq),
1.69-1.84 (м, 2Н,
С5HaxHeq),
1.87-2.03 (м, 2Н,
С5HaxHeq),
2.29-2.40 (м, 4Н,
C8H2), 5.46 (д,
J=2.4 Гц,
2Н,
C2H), 5.92 (д,
J=3 Гц,
2Н,
C3H); 6.90 (м,
2H, C17H), 7.08 (м,
2H, C16H), 7.20 (д,
J=8.7 Гц,
2Н,
C12H), 7.28 (д,
J=8.4 Гц,
2Н,
C18H), 7.75 (д,
J=7.9 Гц,
2Н,
C15H), 7.81 (д,
J=8.7 Гц,
2Н,
C13H). 13C ЯМР
(C6D6) д
-2.3 (C10), 21.99 (C6),
22.79 (C7), 23.01 (C5), 26.12 (C8), 105.29 (C1),
111.76 (C2), 118.74 (C3), 127.20 (C9), 137.59
(C4); 118.73 (C20), 121.89 (C12), 122.53 (C16),
125.89 (C17), 127.02 (C18), 127.77 (C15),
128.96 (C13), 135.30 (C19), 135.55 (C14),
160.06 (C11).
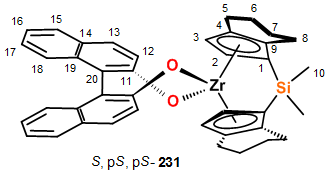
Рис. 7
Комплекс с этандиильными мостиком S,p-S,p-S-231
был синтезирован по описанной выше методике. ЯМР данные S,p-S,p-S-231
совпадают с литературными [131].
Реакция алкенов
с
AlR3 (R= Me, Et) в присутствии
комплексов
p-S,p-S-81a, S,p-S,p-S-155, S,p-S,p-S-231
В стеклянный реактор объемом 10 мл,
установленный на магнитной мешалке, заполненный аргоном, загружали 2 ммоль
катализатора (S,p-S,p-S-231,
p-S,p-S-81a,
S,p-S,p-S-155),
2 мл CH2Cl2,
100 ммоль олефина (209a),
120 ммоль AlR3.
Реакцию проводили при температуре 0-30оС при непрерывном
перемешивании в течение 72-120 часов. По окончании реакции часть реакционной
массы разлагали 10% DCl
при 0оС. Продукты экстрагировали бензолом, фильтровали, органический
слой сушили над Na2SO4.
Выход продуктов (210a, 211a,
213a, 237a)
определяли методом ГЖХ и хроматомасс- спектрометрии.
Оставшуюся реакционную массу охлаждали до 0оС
и окисляли барботированием О2 в течение 2 ч., затем выдерживали в
атмосфере кислорода еще в течение 24 часов. Продукты разлагали HCl и
экстрагировали диэтиловым эфиром, органический слой сушили над Na2SO4,
фильтровали и упаривали. Одноатомные спирты (232a)
выделяли колоночной хроматографией на силикагеле в системе гексан: диэтиловый
эфир 6:1 [141, 150]. Функционально замещенные олигомеры (238a)
были выделены колоночной хроматографией на силикагеле с помощью системы
гексана: диэтиловый эфир 4:1. Двухатомные спирты (233a)
в виде маслянистой жидкости выделяли методом колоночной хроматографиии на
силикагеле с помощью ацетона. Органические фракции сушили над Na2SO4.
-этил-2-н.бутил-октанол-1 (238a).
1H
ЯМР
(CDCl3) д 0.86 (т, 3Н, J=7.2
Гц, C14H3),
0.88-0.97 (м, 6Н, C8H3,
C12H3),
1.11-1.17 (м, 1Н, С3НН), 1.20-1.26 (м, 1Н, С3НН),
1.22-.129 (м, 2Н, С5Н2), 1.22-1.37 (м, 4Н, С7Н2С6Н2,
С11Н2С12Н2), 1.25-1.34 (м, 2Н, С13Н2),
1.25-1.34 (м, 1Н, С4Н), 1.27-1.40 (м, 2Н, С9Н2),
1.49-1.59 (м, 1Н, С2Н), 3.49-3.61 (м, 2Н, С1Н2)
13C ЯМР
(CDCl3) д 10.67
(С14), 14.10 (С12), 14.16 (С8), 26.09 (С13),
23.17 (С7, С11), 28.74 (С10), 28.99 (С6),
31.03 (С9), 33.09 (С5), 35.35 (С3), 36.23 (С4),
37.99 (С2), 66.07 (С1). Масс-спектр, m/z
(%): 196 [M-H2O]+
(0.31), 185 (0.28), 167 (2.11), 154 (1.23), 139 (6.95), 125 (5.68), 112
(14.31), 97 (20.23), 83 (36.71), 70 (51.2), 57.05 (100).
Рис. 8
(2R,S)-Метил-1-гексанол
(8а) nD20=1,421.
Спект ЯМР 1H
(CDCl3)
д
0.88 (т, 3J=6.8
Гц, 3H, CH2CH3),
0.89 (д, 3J=6.8
Гц, 3H, CHCH3),
1.04-1.13 (м, 1H, CHCHHCH2),
1.31 - 1.42 (м, 1H, CHCHHCH2),
1.19-1.41 (м, 4H, CH2),
1.58 (окт, 3J=6.4
Гц, 1Н, СН), 3.38 (дд, 2J=10.4
Гц, 3J=6.4 Гц, 1Н,
СННОН), 3.48 (дд, 2J=10.4
Гц, 3J=5.6 Гц, 1Н,
СННОН). Спектр ЯМР 13С (CDCl3)
д
14.2 (C7),
16.7 (C3)
23.1 (C6),
29.2 (C5),
33.0 (C4),
35.9 (C2),
68.5 (C1).
Найдено (%): С- 72.28, Н - 13.81, О - 13.91; Вычислено (%): С - 72.36, Н -
13.88, О - 13.76.
Рис. 9
(2R,S)-Этил-1-гексанол
(14а) nD20
=
1,431. Спектр ЯМР ЯМР 1H
(CDCl3)
д
0.89 (т, 3J=6.4
Гц, 6H, CH3),
1.20-1.45 (м, 4H, CH2CH3),
1.20 - 1.34 (м, 4H, CH2),
1.34-1.45 (м, 1H, CH),
3.54 (д, 3J=4.8
Гц, 2Н, СН2ОН). Спектр ЯМР 13С (CDCl3)
д
11.3 (C4),
14.3 (C8)
23.3 (C7),
23.6 (C3),
29.3 (C6),
30.3 (C5),
42.2 (C2),
65.5 (С1). Найдено (%): С- 73.69, Н - 13.77, О - 12.54; Вычислено
(%): С - 73.78, Н - 13.93, О - 12.28.
(2R,S)-Бутил-1,4-бутандиол
(15а) nD20=1,451.
Спект ЯМР 1H
(CDCl3)
д
0.87 (т, 3J=6.4
Гц, 3H, CH3),
1.16-1.37 (м, 6H, CH2),
1.50 - 1.69 (м, 3H, CHCH2CH2ОН),
3.40 (дд, 2J=10.8
Гц, 3J=6.8 Гц, 1Н,
СНСННОН), 3.59-3.65 (м, 1Н, СНСННОН), 3.56-3.59 (м, 1Н, СН2СННОН),
3.69-3.75 (м, 1Н, СН2СННОН). Спектр ЯМР 13С (CDCl3)
д
14.1 (C8),
23.1 (C7)
29.4 (C6),
31.6 (C5),
35.8 (C3),
39.3 (C2),
60.9 (C4),
67.4 (С1). Найдено (%): С - 65.79, Н - 12.45, О - 21.76; Вычислено
(%): С - 65.72, Н - 12.41, О - 21.87.
(2R,S)-Метилгексил
(R)-б-метокси-б-трифторметилфенилацетат
(9а) Спектр ЯМР 1H
(C6D6)
д
0.81 (д, 3J=6.4
Гц, 3H, СНCH3),
0.91 (т, 3J=7.2
Гц, 3H, СН2CH3);
0.96 - 1.03 (м, 1H, СНСННCH2),
1.18-1.24 (м, 1H, CHСННСН2),
1.17 - 1.27 (м, 4H, CH2СН3);
1.64 (окт, 3J=6.0
Гц, 1Н, СН). 3.53 (с, 3H,
ОCH3),
3.93 (дд, 2J=10.6
Гц, 3J=6.7 Гц, 1Н,
СННОН), 4.13 (дд, 2J=10.6
Гц, 3J=5.6 Гц, 1Н,
СННОН) (RR); 4.00 (дд,
2J=10.6 Гц, 3J=5.8
Гц, 1Н, СННОН), 4.06 (дд, 2J=10.6
Гц, 3J=6.7 Гц, 1Н,
СННОН) (SR); 6.98-7.21
(м, 2Н, Ph), 7.61-7.67
(м, 1Н, Ph), 7.91-7.95
(м, 2Н, Ph), Спектр
ЯМР 13С (C6D6)
д
13.9 (C7),
16.5 (C3)
22.8 (C6),
28.8 (C5),
32.321 (R), 32.36 (S)
(C2);
32.71 (RR), 32.67 (SR)
(C4);
55.1 (OCH3);
70.82 (RR), 70.76 (SR)
(C1);
124.4 (к, JC-F
= 287 Гц, CF3),
127.4, 128.0, 129.2, 133.3 (Ph),
168.8 (C=O).
Синтез R-MTPA
эфиров двухатомных спиртов 16а,б
В стеклянный реактор объемом 5 мл, установленный
на магнитной мешалке, заполненный аргоном, загружали 2 мкл двухатомного спирта
(16a,б), 20 мкл
пиридина-d5,
0,2 мл CDCl3
и 8 мкл реагента Мошера (S-МТРАCl).
Реакцию проводили при температуре 22оC
при непрерывном перемешивании в течение 24 ч. К реакционной массе добавили 0,5
мл d6-бензола
или d8-толуола
и полученные (R,R)-МТРА
эфиры анализировали с помощью ЯМР спектроскопии 13С и 2D
гомо- (HH
COSY) и гетероядерной
спектроскопии (HSQC,
HMBС).
R)-MTPA эфир
(2R,S)- изобутил-1,4-бутандиола
(17а).
Спектр ЯМР 1H (C6D6)
д 0.86
(т,
3H, 3J=6.8 Гц,
CH3), 0.97-1.12
(м,
4H,
CH2CH2CH2СН3,
СН2СН2СН3); 1.12-1.21
(м,
2H,
CH2СН3);
1.41-1.50
(м,
2H, CH2CH2OH);
1.50-1.59
(м,
1H, CH);
3.85
(дд,
2J=11.2
Гц, 3J=6.4 Гц, 1Н,
СНСННОН), 3.94-4.18 (м,
3H,
CHCHHOH,
СН2СН2ОН);
3.48 (с, 6Н, ОСН3); 7.05-7.14 (м, 4Н, Ph),
7.51-7.89 (м, 6Н, Ph).
Спектр
ЯМР
13C (C7D8)
д
13.7
(C8), 22.6
(С7),
28.5
(C6), 29.95
(SR), 29.78 (RR) (C3);
30.19
(SR), 30.27
(RR)
(С5); 34.11
(SR), 34.01
(RR) (C2);
54.9
(OCH3), 67.6 (C1),
63.6 (C4);
123.7 (к,
JC-F=287
Гц,
CF3),
124.4 (к,
JC-F=287 Гц, CF3);
127.3-130.2 (Ph), 168.9
(С=О), 166.2 (C=O).
Рис. 10
Выводы
1. Синтезированы новые энантиомерно чистые
анса-комплексы Zr:
p-S,
p-S-
диметилсилил-бис-(4,5,6,7-тетрагидроинденил)цирконийдихлорид (p-S,
p-S-
Me2Si(THI)2ZrCl2)
и S, p-S,
p-S-
диметилсилил-бис-(4,5,6,7-тетрагидроинденил)цирконий бинафтолат (S,
p-S,
p-S-
Me2Si(THI)2ZrBIN).
2. Впервые изучено каталитическое действие
энантиомерно чистых комплексов p-S,
p-S-
Me2Si(THI)2ZrCl2,
S,p-S,p-S-
Me2Si(THI)2ZrBIN
и S,p-S,p-S-С2H4(THI)2ZrBIN
в реакциях AlR3
(R= Me,
Et) с алкенами.
Установлено, что наибольшую активность и энантиоселективность на уровне 50%ее (S)
проявляет p-S,
p-S-
Me2Si(THI)2ZrCl2
в реакции карбоалюминирования гексена-1 с помощью AlEt3.
Энантиомерная чистота продуктов реакции циклоалюминирования гексена-1
триэтилалюминием, катализируемой комплексом S,p-S,p-S-С2H4(THI)2ZrBIN,
составила 26%ее (S). Показано,
что реакция AlEt3
с алкенами в присутствии оптически активных анса- комплексов Zr
проходит с образованием энантиомерно обогащенных функционально замещенных
олигомерных продуктов с числом звеньев до 6.
. Установлено, что реакция терминальных
алкенов с AlEt3
в присутствии конформационно нежесткого комплекса (‒)-бис-(1-неоментилинденил) цирконийдихлорида в хлористом
метилене проходит с образованием продуктов карбометаллирования с выходом
~50-90% и энантиоселективностью 47-69%ее (S),
которая слабо зависит от структуры олефина. В реакции циклоалюминирования
терминальных алкенов образуются 3-замещенные алюминациклопентаны с выходом до
85% и энантиомерной чистотой 24-57%ее. Наибольший энантиомерный избыток
продуктов циклоалюминирования (57%ee)
достигнут при использовании винилциклогексана в качестве субстрата и проведении
реакции в дихлорметане. Показано, что в углеводородных растворителях выход и
стереоселективность реакции циклоалюминирования уменьшается при увеличении
объема заместителя в алкене.
4. Разработаны методы определения
энантиомерной чистоты и абсолютной конфигурации в-стереогенных центров
продуктов карбо- и циклоалюминирования алкенов, основанные на сопоставлении
параметров спектров ЯМР с теоретическим конформационным составом R-MTPA
и R-PSPA
эфиров в-алкил-1-алканолов и в-алкил-1,4-бутандиолов, образующихся в результате
окисления и гидролиза соответствующих ациклических и циклических АОС.
Литература
1. Kaminsky W. The Discovery
of Metallocene Catalysts and Their Present State of the Art. // J. Polymer
Science, Part A: Polymer Chem. - 2004. - V.42. - P.3911-3921.
2. Brintzinger H.-H.
Stereospecific Olefin Polymerization with Chiral Metallocene Catalysts / H.-H.
Brintzinger, D. Fischer, R. Mьlhaupt, B. Rieger, R.M. Waymouth // Angew. Chem.
Int. Ed. Engl. - 1995. - V.34. - No.11. - P.1143-1170.
. Janiak Ch. Metallocene
and related catalysts for olefin, alkyne and silane dimerization and
oligomerization // Coordination Chem. Rev. - 2006. - V.250. - Is.1-2. -
P.66-94.
. Resconi L. Selectivity
in Propene Polymerization with Metallocene Catalysts / L. Resconi, L. Cavallo,
A. Fait, F. Piemontesi // Chem. Rew. - 2000. - V.100. - No.4. - P. 1253-1346.
. Dzhemilev U.M.
Homogeneous Zirconium Based Catalysts in Organic Synthesis/ U.M. Dzhemilev,
O.S. Vostrikova, G.A. Tolstikov // J. Organomet. Chem. - 1986. - V.304. - P.
17-39.
. Morken J.P.
Enantioselective C-C and C-H Bond Formation Mediated or Catalyzed by Chiral
ebthi Complexes of Titanium and Zirconium / J.P. Morken, A. H. Hoveyda //
Angew. Chem. Int. Ed. Engl. - 1996. - V.35. - No.12. - P. 1263-1284.
7. Джемилев У.М.
Металлокомплексный катализ в синтезе алюминийорганических соединений / У.М.
Джемилев, А.Г. Ибрагимов // Успехи химии. - 2000. - Т.69. - №.2. - С.134-148.
8. Толстиков Г.А.
Алюминийорганические соединения в органическом синтезе /
Г.А.
Толстиков, У.М. Джемилев, А.Г. Толстиков // Новосибирск:
Акад. изд. «Гео». - 2009. - 645с.
9. Negishi
E.-i.
Discovery of ZACA reaction: Zr-catalyzed
asymmetric carboalumination of alkenes // ARKIVOC. - 2011. - V.VIII. - P.34-53.
10. Dzhemilev U.M. Catalytic
cyclometalation reaction of unsaturated compound synthesis of magnesia and
aluminacarbocycles / U.M. Dzhemilev, A.G. Ibragimov // J. Organomet. Chem. -
2010. - V.8. - P.1085-1110.
. D’yakonov V.A.
Dzhemilev Reaction in Organic and Organometallic Synthesis (Chemistry Research
and Applications). - NY Nova Science Pub., 2010. - 96 p.
. Marek I. Titanium and
Zirconium in Organic Synthesis. - VCH Verlag GmbH&CoKGaA, 2002. -
501 p.
13. Green J.C. Bent
metallocenes revisited // Chem. Soc. Rev. - 1998. - V.27. - P.263-271.
14. Paley R.S. Enantiomerically
pure planar chiral organometallic complexes via facially selective р -
complexation // Chem. Rev. - 2002. - V.102. - No.5. - P. 1439-1524.
15. Shapiro P.J. The
evolution of the ansa-bridge and its effect on the scope of metallocene
chemistry // Coord. Chem. Rew. - 2002. - V.231. - Is.1-2. - P.67-81.
. Wang B. Ansa-metallocene
polymerization catalysts: Effects of the bridges on the catalytic activities //
Coord. Chem. Rev. - 2006. - V.250. - Is.1-2. - P.242-258.
. Halterman R.L.
Synthesis and applications of chiral cyclopentadienylmetal complexes // Chem.
Rev. - 1992. - V.92. - No.5. - P. 965-994.
18. Halterman R.L. 8. Synthesis
of Chiral Titanocene and Zirconocene Dichlorides/ Togni. Metallocenes:
Synthesis, Reactivity, Applications. Eds./ A. Togni, R.L. Halterman. -
Wiley-VCH. - 1998. - P. 457-544.
19. Berenbaum A. Synthesis,
Electronic Structure, and Novel Reactivity of Strained, Boron-Bridged
[1]Ferrocenophanes / A. Berenbaum, H. Braunschweig, R. Dirk, U. Englert, J. C.
Green , F. Jдkle, A.J. Lough, I. Manners // J. Am. Chem. Soc. - 2000. - V.122.
- No.24. - P.5765-5774.
20. Shaltout R.M. The X-ray
crystal structures of the ansa-metallocenes, Me2C(C5H4)2MCl2
(M = Ti, Zr and Hf) / R.M. Shaltout, J.Y. Corey, N.P. Rath, // J. Organomet.
Chem. - 1995. - V.503. - P.205 - 212.
21. Halterman R.L. Application
of the double Pauson-Khand cyclization to the synthesis of
bis(cyclopentadienes): preparation of phenyl-bridged
bis(tetrahydroindenyl)titanium and zirconium dichlorides / R.L. Halterman, T.M.
Ramsey, N.A. Pailes, M.A. Khan // J. Organomet. Chem. - 1995. - V.497. -
P.43-53.
22. Halterman R.L. Synthesis
of C7,C7′-Ethylene- and C7,C7′-Methylene-Bridged C2-Symmetric
Bis(indenyl)zirconium and -titanium Dichlorides / R.L. Halterman, D. Combs,
M.A. Khan // Organometallics. - 1998. - V.17. - No.18. - P.3900-3907.
. Piemontesi F. Crystal
Structures and Solution Conformations of the Meso and Racemic Isomers of
(Ethylenebis(1-indenyl))zirconium Dichloride/ F. Piemontesi, I. Camurati, L.
Resconi , D. Balboni , A. Sironi, M. Moret, R. Zeigler, N. Piccolrovazzi //
Organometallics. - 1995. - V.14. - No.3. - P.1256-1266.
24. Resconi L.
Diastereoselective Synthesis, Molecular Structure, and Solution Dynamics of
meso- and rac-[Ethylenebis(4,7-dimethyl-и5-1-indenyl)]zirconium Dichloride
Isomers and Chain Transfer Reactions in Propene Polymerization with the rac
Isomer / L. Resconi, F. Piemontesi, I. Camurati, D. Balboni, A. Sironi, M.
Moret, H. Rychlicki, R. Zeigler // Organometallics. - 1996. - V.15. - No.23. -
P.5046-5059.
25. Linnolahti M.
Conformational Preferences of Racemic Ethylene-Bridged Bis(indenyl)-Type
Zirconocenes: An ab initio Hartree-Fock Study / M. Linnolahti, T.A. Pakkanen,
R. Leino, H.J.G. Luttikhedde, Carl-Eric Wileґn, J.H. Nдsman // Eur. J. Inorg.
Chem. - 2001. - V.2001. - No.8. - P.2033-2040.
26. Илиел Э. Основы органической стереохимии
/ Э. Илиел, С. Вайлен, М. Дойл; Пер. с англ. - М.: БИНОМ. Лаборатория знаний,
2011. - 703 С.
27. Sommer L.H. Silylindenes
and Silylindans / L.H. Sommer, N.S. Marans // J. Am. Chem. Soc. - 1951. - V.73.
- No.11. - P.5135-5140.
. Chen Y-.X. Indenyl-
and Fluorenylsilanes: Synthesis and Thermal Diastereomerization / Y-.X. Chen,
M.D. Rausch, J.C.W. Chien // Organometallics. - 1993. - V.12. - No.11. -
P.4607-4612.
. Roll W. Synthesis and
Crystal Structure of a Chiral ansa - Titanocene Derivative with Trimethylene -
Bridged Tetrahydroindenyl Ligands / W. Roll, L. Zsolnai, G. Huttner, H.-H.
Brintzinger // J. Organomet. Chem. - 1987. - V.322. - P.65-70.
. Rigby S.S. Molecular
Dynamics of dl- and meso-Bis(indenyl)dimethylsilane: Reexamination of the
Mechanism of Interconversion by using Single Selective Inversion NMR / S.S.
Rigby, L. Girard, A.D. Bain, M.J. McGlinchey // Organometallics. - 1995. -
V.14. - No.8. - P.3798-3801.
. Wiesenfeldt H.
Ansa-Metallocene derivatives. XVII. Racemic and meso diastereomers of Group IV
metallocene derivatives with symmetrically substituted,
dimethylsilanediyl-bridged ligand frameworks. Crystal structure of R,S-Me2Si(3-tert-Bu-5-MeC5H2)2ZrCl2
/ H. Wiesenfeldt, A. Reinmuth, E. Barsties, K. Evertz, H.-H. Brintzinger // J.
Organomet. Chem. - 1989. - V.369. - Is.3-4. - P.359-370.
. Mise T. Excellent
Stereoregular Isotactic Polymerizations of Propylene with C2-Symmetric
Silylene-Bridged Metallocene Catalysts / T. Mise, S. Miya, H. Yamazaki // Chem.
Lett. - 1989. - V.18. - No.10. - P.1853-1856.
. Lee Ik-Mo. Electronic
Effects in Ziegler-Natta Polymerization of Propylene and Ethylene Using Soluble
Metallocene Catalysts / Ik-Mo Lee, W.J. Gauthler, J.M. Ball, Bh. Iyengar, S.
Collins // Organometallics. - 1992. - Vol.11. - No.6. - P.2115-2122.
. Kim S.-J. Syntheses,
Structural Characterizations, and Catalytic Behavior of ansa-Metallocene
Complexes Derived from 1,1-Dicyclopentadienyl-1-silacycloalkanes / S.-J. Kim,
Y.-J. Lee, E. Kang, S.H. Kim, J. Ko, B. Lee, M. Cheong, Il-Hw. Suh, S.O. Kang
// Organometallics. - 2003. - V.22. - No.19. - P.3958-3966.
. Mitchell J.P.
Preparation and Structural Characterization of an Enantiomerically Pure, C2-Symmetric,
Single-Component Ziegler−Natta б-Olefin Polymerization Catalyst / J.P.
Mitchell, Sh. Hajela, S.K. Brookhart, K.I. Hardcastle, L.M. Henling, J.E.
Bercaw // J. Am. Chem. Soc. - 1996. - V.118. - No.5. - P.1045-1053.
. Herrmann W.A. The
First Example of an Ethylene-Selective Soluble Ziegler Catalyst of the
Zirconocene Class / W.A. Herrmann, J. Rohrmann, E. Herdtweck, W. Spaleck, A.
Winter // Angew. Chem. Jnt. Ed. Engl. - 1989. - V.28. - No.11. - P.1511-1512.
. Kaminsky W. Crystal
structure and propene polymerization characteristics of bridged zirconocene
catalysts / W. Kaminsky, O. Rabe, A.-M. Schauwienold, G.U. Schupfner, J. Hans,
J. Kopf // J. Organomet. Chem. - 1995. - V.497. - Is.1-2. - P.181-193.
. Halterman R.L.
Synthesis and structure of ansa-metallocene complexes (M ZrCl2, TiCl2,
YCl, and LuCl) containing the bis(2-methyl-4,5,6,7-tetrahydroinden-yl)dimethylsilane
ligand / R.L. Halterman, H. Schumann, F. Dubner // J. Organomet. Chem. - 2000.
- V.604. - Is.1. - P.12-19.
. Thomas E.J. Synthesis
of Novel Tetrahydrofluorenyl-Containing Group IV Metallocenes for the Ziegler−Natta
Type Polymerization of б-Olefins / E.J. Thomas, M.D. Rausch, J.C.W. Chien //
Organometallics. - 2000. - V.19. - No.26. - P.5744-5749.
40. Spaleck W. High Molecular
Weight Polypropylene through Specifically DesigneZirconocene Catalysts / W.
Spaleck, M. Antberg, J. Rohrmann, A. Winter, B. Bachmann, P. Kiprof, J. Behm,
W.A. Herrmann // Angew. Chem. Int. Ed. Engl. - 1992. - V.31. - No.10. -
P.1347-1350.
41. Spaleck W. The Influence of
Aromatic Substituents on the Polymerization Behavior of Bridged Zirconocene
Catalysts / W. Spaleck, F. Kuber, A. Winter, J. Rohrmann, B. Bachmann, M.
Antberg, V. Dolle, E.F. Paulus // Organometallics. - 1994. - V.13. - No.3. -
P.954-963.
42. Stehling U.
ansa-Zirconocene Polymerization Catalysts with Annelated Ring Ligands-Effects
on Catalytic Activity and Polymer Chain Length / U. Stehling, J. Diebold, R.
Kirsten, W. Roll, H.-H. Brintzinger // Organometallics. - 1994. - V.13. - No.3.
- P.964-970.
. Izmer V.V. Synthesis
and molecular structures of zirconium and hafnium complexes bearing
dimethylsilandiyl-bis-2,4,6-trimethylindenyl and
dimethylsilandiyl-bis-2-methyl-4,6-diisopropylindenyl ligands / V.V. Izmer,
D.A. Sorokin, L.G. Kuz’mina, A.V. Churakov, J.A.K. Howard, A.Z. Voskoboynikov
// J. Organomet. Chem. - 2005. - V.690. - P.1067-1079.
. Asachenko A.F.
Zirconium complexes bearing з5-5′,6′,7′-trihydrospiro[cycloalkane-1,4′-indenyl]
ligands / A.F. Asachenko, D.S. Kononovich, A.N. Zharov, A. Razavi, A.Z.
Voskoboynikov // J. Organomet. Chem. - 2010. - V.695. - Is.15-16. - P.1940-1948.
45. Threlkeil R.S. A Convenient
Synthesis of Alkyltetramethylcyclopentadienes and
Phenyltetramethylcyclopentadiene / R.S. Threlkeil, J.E. Bercaw // J. Organomet.
Chem. - 1977. - V.136. - P.1-5.
46. Ивченко П.В. Синтез анса-
цирконоценов на основе 2-(фенилэтинил)-1Н-индена. Кристаллическая и
молекулярная структура комплекса [м-CH2CH2(з5-2-PhCCInd)2]ZrCl2
/ П.В. Ивченко, И.Э. Нифантьев, Ш.Г. Мкоян // Изв. АН, Сер. Хим. - 2007. - №.1.
- С.68-73.
47. Nifant'ev I.E. Asymmetric
ansa- Zirconocenes Containing a 2-Methyl-4-aryltetrahydroindacene Fragment:
Synthesis, Structure, and Catalytic Activity in Propylene Polymerization and
Copolymerization / I.E. Nifant'ev, P.V. Ivchenko, V.V. Bagrov, Y. Okumura, M.
Elder, A.V. Churakov // Organometallics. - 2011. - V.30. - No.20. -
P.5744-5752.
48. Nifant'ev I.E. Novel
Effective Racemoselective Method for the Synthesis of ansa-Zirconocenes and Its
Use for the Preparation of C2-Symmetric Complexes Based on
2-Methyl-4-aryltetrahydro(s)indacene as Catalysts for Isotactic Propylene
Polymerization and Ethylene−Propylene Copolymerization / I.E. Nifant’ev,
P.V. Ivchenko, V.V. Bagrov, A.V. Churakov, R. Chevalier // Organometallics. -
2012. - V.31. - No.11. - P.4340-4348.
. Nifant'ev I.E.
5-Methoxy-Substituted Zirconium Bis-indenyl ansa-Complexes: Synthesis,
Structure, and Catalytic Activity in the Polymerization and Copolymerization of
Alkenes / I.E. Nifant’ev, P.V. Ivchenko, V.V. Bagrov, A.V. Churakov, P.
Mercandelli // Organometallics. - 2012. - V.31. - No.14. - P.4962-4970.
50. Burk M.J. С2-symmetric
2,2/-Dimethyl-1,1/-binaphthyl-Bridged ansa-
Bis(1-indenyl)metal complexes / M.J. Burk, S.L. Colletti, R.L. Halterman //
Organometallics. - 1991. - V.10. - P.2998-3000.
51. Rieger B.
Cyclohexyl[trans-1,2-bis(1-indenyl)]zirconium(IV)dichloride: Ein chiraler
Polymerisationskatalysator mit stereocheisch starrer Brucke // J. Organomet.
Chem. - 1992. - V.428. - P.C33-C36.
. Rheingold A.L.
Preparation and Properties of Chiral Titanocene and Zirconocene Dichloride
Complexes of a Chiral Ligand / A.L. Rheingold, N.P. Roblnson, J. Whelan, B.
Bosnich // Organometallics. - 1992. - V.11. - No.5. - P.1869-1876.
. Halterman R.L.
Preparation of [2,5-Diisopropylcyclohexane-1,4-bis(indenyl)titanium Dichloride
and [2,5-Diisopropylcyclohexane-1,4-bis(tetrahydroindenyl)]-titanium Dichloride
and Their Comparison as Catalysts for the Enantioselective Pinacol Coupling
Benzaldehyde / R.L. Halterman, Ch. Zhu, Zh. Chen, M.S. Dunlap, M.A. Khan, K.M.
Nicholas // Organometallics. - 2000. - V.19. - No.19. - P.3824-3829.
54. Burk M.J. C2-symmetric
2,2'-dimethyl-1,1'-binaphthyl-bridged ansa-bis(1-indenyl)metal complexe / M.J.
Burk, St.L. Colletti , R.L. Halterman // Organometallics. - 1991. - V.10. -
No.9. - P.2998-3000.
55. Halterman R.L. Asymmetric
Synthesis of a Sterically Rigid Binaphthyl-Bridged Chiral Metallocene:
Asymmetric Catalytic Epoxidation of Unfunctionalized Alkenes / Ronald L.
Halterman, T.M. Ramsey // Organometallics. - 1993. - V.12. - No.8. - P.2879-2880.
56. Halterman R.L. Synthesis
of ansa-2,2/-bis[(4,7-dimethyl-inden-1-yl)methyl]-1,1/-binaphthyl
and ansa-2,2/-bis[(4,5,6,7-tetrahydroinden-1-yl)methyl]-1,1/-binaphthyltitanium
and -zirconium diclorides / R.L. Halterman, D. Gombs, J.G. Kiheaga, M.A. Khan
// J. Organomet. Chem. - 1996. - V.520. - Is.1-2. - P.163-170.
57. Alt H.G. C1-Bridged
fluorenylidene cyclopentadienylidene complexes of the type (C13H8-CR1R2-C5H3R)ZrCl2
(R1, R2=alkyl, phenyl, alkenyl; R=H, alkyl, alkenyl,
substituted silyl) as catalyst precursors for the polymerization of ethylene
and propylene / H.G. Alt, M. Jung // J. Organomet. Chem. - 1998. - V.568. -
Is.1-2. - P.87-112.
58. Kaminsky W. A Tailor-Made
Metallocene for the Copolymerization of Ethene with Bulky Cycloalkenes / W.
Kaminsky, R. Engehausen, J. Kopf // Angew. Chem. Inter. Ed. in Engl. - 1995. -
V.34. - No.20. - P.2273-2275.
. Won Y.Ch. Fulvene having
substituents only on 1-, 4-, and 6-positions: a key intermediate for novel
ansa-metallocene complexes / Y.Ch. Won, H. Y. Kwon, B.Y. Lee, Y.-Wh. Park // J.
Organomet. Chem. - 2003. - V.677. - Is.1-2. - P.133-139.
60. Eisch J.J. Novel
Synthesis of ansa-Metallocenes via the Reductive Dimerization of Fulvenes with
Group 4 Metal Divalent Halides / J. J. Eisch, X.Shi, Fr.A. Owuor //
Organometallics. - 1998. - V.17. - No.24. - P.5219-5221.
61. Koch Th. Unexpected P−Si
or P−C Bond Cleavage in the Reaction of Li2[(C5Me4)SiMe2PR]
(R= Cyclohexyl, 2,4,6-Me3C6H2) and Li[(C5H4)CMe2PHR]
(R = Ph, tBu) with ZrCl4 or [TiCl3(thf)3]:
Formation and Molecular Structure of the ansa-Metallocenes [{(з-C5Me4)2SiMe2}ZrCl2]
and [{(з-C5H4)2CMe2}MCl2]
(M = Ti, Zr) / Th. Koch, St. Blaurock , F.B. Somoza , Jr.A.Voigt , R. Kirmse,
E. Hey-Hawkins // Organometallics. - 2000. - V.19. - No.13. - P.2556-2563.
62. Schwemlen H.V. Synthesis
of tetramethylethylene - Bridged Titanocene and Zirconocene derivatives via
Reductive Fulvene Coupling / H. Schwemlen, H.-H. Brintzinger // J. Organomet.
Chem. - 1983. - V.254. - P.69-73.
. Gutmann S. XVI. Chiral
titanocene and zirconocene derivates with symmetrically substituted,
tetramethylethanediyl - bridged ligand frameworks. Crystal structures of
representative examples / S. Gutmann, P. Burger, H.-U. Hund, J. Hofmann, H.-H.
Brintzinger // J. Organomet. Chem. - 1989. - V.369. - P.343-357.
. Burger P.
ansa-Metallocene derivatives XVIII. Chiral titanocene derivatives accessible
from substituted dihydropentalene and azulene precursors / P. Burger, H.-U.
Hund, K. Evertz, H.-H. Brintzinger // J. Organomet. Chem. - 1989. - V.378. -
Is.2. - P.153-161.
. Burger P. XXIII Aryl -
substituted titanocene and zirconocene complexes with interannular
tetramethylethano- or dimethylsilano - bridges / P. Burger, K. Hortmann, J.
Diebold, H.-H. Brintzinger // J. Organomet. Chem. - 1991. - V.417. - P.9-27.
66. Ивченко П.В. Бис-
циклопентадиенильные мостиковые соединения / П.В. Ивченко, И.Э. Нифантьев // Ж.
Орг. Хим. - 1998. - Т.34. - №.1. - С.9-34.
. Ивченко Н.Б. Методы синтеза
замещенных циклопентадиенов и инденов / Н.Б. Ивченко, П.В. Ивченко, И.Э.
Нифантьев // Ж. Орг. Хим. - 2000. - Т.36. - №.5. - С.641-662.
68. Nifant'ev I.E.
ansa-Metallocene derivatives of TiIV and ZrIV with the
shortest -C(CH3)2- bridge / I.E. Nifant'ev, A.V.
Churakov, I.F. Urazowski, Sh.G. Mkoyan, L.O. Atovmyan // J. Organomet. Chem. -
1992. - V.435. - Is.1-2. - P.37-42.
69. Мкоян, Ш.Г. Молекулярная
структура анса- соединения (ɳ5-С5Н4)СМе2(з5-С9Н6)TiCl2
// Изв. АН, Сер. хим. - 1995. - №.5. - С.305-308.
. Дьяченко А.И.
Взаимодействие циклопентадиена с дихлорметаном в условиях межфазного катализа с
образованием дициклопентадиенилметана / А.И. Дьяченко, Л.Г. Меньчиков, О.М.
Нефедов // Изв. АН СССР, Сер. Хим., 1984. - №.11. - С. 2655.
. Воскобойников А.З. Синтез и
молекулярные структуры рацемической и мезо-форм 2,2'-пропилиден-бис(з5-инденил)цирконий
дихлорида [текст] / А.З. Воскобойников, А.Ю. Агарков, А.В. Чураков, Л.Г.
Кузьмина // Изв. АН, Сер. хим. - 1996. - №.3. - С.765-766.
72. Ивченко Н.Б. Синтез
[м-метилен-бис(з5-3-трет-бутил-2-метилинден-1-ил)]дихлорциркония (IV)
/ Н.Б. Ивченко, П.В. Ивченко, И.Э. Нифантьев // Изв. АН, Сер. хим. - 2000. -
№.5. - С.943-946.
73. Voskoboynikov
A.Z.
Synthesis
and X-ray
crystal structures
of rас-
and meso-2,2/-propilindene-bis(1-indenyl)zirconium
dichlorides / A.Z.
Voskoboynikov, A.Y.
Agarkov, E.A.
Chernyschev, I.P.
Beletskaya, A.V.
Churakov, L.G
Kuz’mina
// J. Organomet.
Chem. - 1997. - V.530.
- P.75-82.
74. Resconi L. Highly
Regiospecific Zirconocene Catalysts for the Isospecific Polymerization of
Propene / L. Resconi, F. Piemontesi, I.Camurati, O. Sudmeijer, I.E. Nifant’ev,
P.V. Ivchenko, L.G. Kuz’mina // J. Am. Chem. Soc. - 1998. - V.120. - No.10. -
P.2308-2321.
. Dang V.A. Simple Route
to Bis(3-indenyl)methanes and Synthesis, Characterization, and Polymerization
Performance of Selected racemic - Dichloro[methylenebis(Rn-1-indenyl)]-zirconium
Complexes / V.A. Dang, L.-C. Yu, D. Balboni, T. Dall’Occo, L. Resconi, P.
Mercandelli, M. Moret, A. Sironi // Organometallics. - 1999. - V.18. - No.19. -
P.3781-3791.
76. Agarkov A.Y. Synthesis and
X-ray crystal structures of ansa-complexes of titanium, zirconium, and hafnium
involving methylene-bis(indenyl) ligand / A.Y. Agarkov, V.V. Izmer, A.N.
Riabov, L.G. Kuz’mina, J.A.K. Howard, I.P. Beletskaya, A.Z. Voskoboynikov // J.
Organomet. Chem. - 2001. - V.619. - Is.1-2. - P.280-286.
77. Halterman R.L. Synthesis
and Structure of C2-Symmetric, Doubly Bridged Bis(indenyl)titanium
and -zirconium Dichlorides / R.L. Halterman, A. Tretyakov, D. Combs, J. Chang,
M. Khan // Organometallics. - 1997. - V.16. - P.3333-3339.
. Burger P. XXI.
Syntheses of etheno - bridged ansa- titanocene derivatives by the McMurry
reaction / P. Burger, H.-H. Brintzinger // J. Organomet. Chem. - 1991. - V.407.
- Is.2. - P.207-213.
. Titanium-Induced
Dicarbony1 - Coupling Reactions, McMurry J.E. // Acc. Chem. Res. - 1983. -
V.16. - P.405-411.
. Rogers R.D. The
Formation and Molecular Structure of Acetylcyclopentadienylsodium -
tetrahyrofuranate / R.D. Rogers, J.L. Atwood, M.D. Rausch, D.W. Macomber, W.P.
Hart // J. Organomet. Chem. - 1982. - V.238. - P.79-85.
. Collins S. Synthesis
of Pure Racemic Isomers of ansa-Titanocene Dichlorides: Conformational Preferences
Are Determined by Substitution Patterns on the Cyciopentadienyl Rings / S.
Collins, Y. Hong, N. Taylor // Organometallics. - 1990. - V.9. - No.10. - P.
2695-2703.
. Luttrinhaus A.
Oligomethylenferrocene Monomere («Ansa-Ferrocene»), Dimere und hohere Polymere
/ A. Luttrinhaus, W. Kullic // Die Makromolekulare Chemie. - 1961. - V.44. -
Is.1. - P.669-681.
. Katz, Th.J. 1,1′-Methylenetitanocene
dichloride / Th.J. Katz, N. Acton // Tetrahedron Letters. - 1970. - V.11. -
No.28. - P.2497-2499.
. Davis B.R. The crystal
and molecular structure of (1,1′-trimethylenedicyclopentadienyl)titanium
dichloride / B.R. Davis, I. Bernal // J. Organomet. Chem. - 1971. - V.30. -
Is.1. - P.75-87.
. Epstein E.F. The
neutron diffraction structure of [C5H4-(CH2)3-C5H4]TiCl2
/ E.F. Epstein, I. Bernal // Inorganica Chimica Acta. - 1973. - V.7. -
P.211-218.
. Saldarriaga-Molina,
C.H. Structural studies of (р-C5H5)2MX2
complexes and their derivatives: The structure of 1,1′-trimethylenedicyclopentadienyl-dichlorozirconium
/ C.H. Saldarriaga-Molina, A. Clearfield, I. Bernal // J. Organomet. Chem. -
1974. - V.80. - Is.1. - P.79-90.
. Smith J.A.
ansa-Metallocene derivatives: Molecular structure and proton magnetic resonance
spectra or methylene- and ethylene - bridged dicyclopentadienyltitanium
compounds / J.A. Smith, J. Seyerl, G. Huttner, H-H. Brintzinger // J.
Organomet. Chem. - 1979. - V.173. - Is.2. - P.175-185.
88. Smith, J.A.
Ansa-metallocene derivatives: III. Influence of an interannular ethylene bridge
on the reactivity of titanocene derivatives / J.A. Smith, H-H. Brintzinger //
J. Organomet. Chem. - 1981. - V.218. - Is.2. - P. 159-167.
89. Wild F.R.W.P. IV.* Synthesis
and molecular structures of chiral ansa-titanocene derivatives with
tetrahydroindenyl ligands / F.R.W.P. Wild, L. Zsolnai, G. Huttner, H-H.
Brintzinger // J. Organomet. Chem. - 1982. - V.232. - P.233-247.
. Kaminsky W.
Polymerization of Propene and Butene with a Chid Zirconocene and
Methylalumoxane as Cocatalyst / W. Kaminsky, K. Kulper, H.-H. Brintzinger,
F.R.W.P. Wild // Angew. Chem. Int. Ed. Engl. - 1985. - V.24. No.6. - P.507-508.
. Melillo G. Branching
Formation in the Ethylene Polymerization with Meso Ansa Metallocene-Based
Catalysts / G. Melillo, L. Izzo, M. Zinna, C. Tedesco, L. Oliva //
Macromolecules. - 2002. - V.35. - No.25. - P.9256-9261.
92. Wild, F.R.W.P. VII*.
Synthesis and Crystal Structure of a Chiral ansa-Zirconocene Derivate with Ethylene
- Bridged Tetrahydroindenyl Ligands / F.R.W.P. Wild, M. Wasiucionek, G.
Huttner, H.-H. Brintzinger // J. Organomet. Chem. - 1985. - V.288. - Is.1. -
P.63-67.
93. Collins Sc. X-Ray
structures of ethylenebis(tetrahydroindenyl)-titanium and -zirconium
dichlorides: a revision / Sc. Collins, Br.A. Kuntz, N.J. Taylor, D.G. Ward //J.
Organomet.Chem. - 1988. - V.342. - Is.1. - P.21-29.
94. Grossman, R.B. Syntheses of
[ethylene-1,2-bis(.eta.5-4,5,6,7-tetrahydro-1-indenyl)]zirconium and -hafnium
hydride complexes. Improved syntheses of the corresponding dichlorides / R.B.
Grossman, R. Ann. Doyle, St.L. Buchwald // Organometallics. - 1991. - V.10. -
No.5. - P.1501-1505.
95. Bajgur Ch.S. Synthesis,
Structural Characterization, and Electrochemistry of [l]Metallocenophane
Complexes, [Si(alkyl)2(CSH4)2]MC12,
M = Ti, Zr / Ch.S. Bajgur, W.R. Tikkanen, J.L. Petersen // Inorg. Chem. - 1985.
- V.24. - P.2539-2546.
. Wochner Fr.
ansa-Metallocene derivatives: VIII. Syntheses and crystal structures of
ethylene-bridged titanocene and zirconocene derivatives with permethylated ring
ligands / Fr. Wochner, L. Zsolnai, G. Huttner, H.-H. Brintzinger // J.
Organomet. Chem. - 1985. - V.288. - Is.1. - P.69-77.
. Wiesenfeldt H. XVII*.
Racemic and meso diastereomers of group IV metallocene derivatives with
symmetrically substituted, dimethylsilanediyl-bridged ligand frameworks.
Crystal structure of R,S-Me,Si(3-t-Bu-5-MeCpH2)2ZrCl2
/ H. Wiesenfeldt, A. Reinmuth, E. Barsties, K. Evertz, H.-H Brintzinger // J.
Organomet. Chem. - 1989. - V.369. - P.359-370.
. Roll W. Stereo- and
Regioselectivity of Chiral, Alkyl-substituted ansa-Zirconocene Catalysts in
Methylalumoxane-activated Propene Polymerization / W. Roll, H.-H. Brintzinger,
B. Rieger, R. Zolk // Angew. Chem. Ind. Ed. Engl. - 1990. - V.29. - No.3. -
P.279-280.
. Chacon St.T. C2-symmetric
ansa metallocenes of titanium and zirconium with a ligand system that yields
pure rac isomer: preparation and crystal structures of rac-{з5-C5H2-2-SiMe3-4-CMe3)SiMe2}MC12
(M = Ti or Zr) / St.T. Chacon, E.B. Coughlin, L.M. Henling, J.E. Bercaw // J.
Organomet. Chem. - 1995. - V.497. - Is.1-2. - P.171-180.
. Damrau H.-R.H. XLI.
Chiral ansa-Magnesocene complexes-syntheses, crystal structures and structural
dynamics in solution / H.-R.H. Damrau, A. Geyer, M.-H. Prosenc, A. Weeber, Fr.
Schaper, H.-H. Brintzinger // J. Organomet. Chem. - 1998. - V.553. - Is.1-2. -
P.331-343.
. Gritzo H. Bis(з3-indenyl)bis(tetrahydrofuran)magnesium(II)
/ H. Gritzo, Fr. Schaper, H.-H. Brintzinger // Acta Cryst. - 2004. - E60. -
P.m1108-m1110.
. Halterman R.L.
Synthesis and structure of ansa-metallocene complexes (M-ZrCl2, TiCl2,
YCl, and LuCl) containing the bis(2-methyl-4,5,6,7-tetrahydroinden-yl)dimethylsilane
ligand / R.L. Halterman, H. Schumann, Fr. Dubner // J. Organomet. Chem. - 2000.
- V.604. - Is.1. - P.12-19.
. Izmer V.V. Synthesis
and molecular structures of zirconium and hafnium complexes bearing dimethylsilandiyl-bis-2,4,6-trimethylindenyl
and dimethylsilandiyl-bis-2-methyl-4,6-diisopropylindenyl ligands / V.V. Izmer,
D.A. Sorokin, L.G. Kuz’mina, A.V. Churakov, J.A.K. Howard, A. Z. Voskoboynikov
// J. Organomet. Chem. - 2005. - V.690. - Is.4. - P.1067-1079.
104. Huttenhofer, M.
Substituted Silastannatetrahydro-s-indacenes as Cyclopentadienyl Transfer
Agents in the Synthesis of Silanediyl-Bridged Zirconocene Complexes / M.
Huttenhofer, M.-H. Prosens, U. Rief, F. Schaper, H.-H. Brintzinger //
Organometallics. - 1996. - V.15. - No.22. - P.4816-4822.
105. Huttenhofer, M. Synthese
eines Ansa-Zirconocens uber eine neue S4-symmetrische
Spirobis(silastannaindacen) - Verbindung / M. Huttenhofer, F. Schaper, H.-H.
Brintzinger // Angew. Chem. - 1998. - V.110. - No.6. - P.2378-2380.
106. Hьttenhofer M. Synthesis
of an ansa-Zirconocene via a Novel S4-Symmetric
Spirobis(silastannaindacene) Compound / M. Hьttenhofer, F. Schaper, H-H.
Brintzinger // Angew. Chem. Int. Ed. - 1998. - V.37. - No.16. - P.2268-2270.
107. Hьttenhofer M.
8-Sila-4-stanna-s-tetrahydroindacenes as synthons for Me2Si-bridged
zirconocenes: formation from biscyclopentadienyl silanes by reaction with
aminostannanes / M. Hьttenhofer, F. Schaper, H-H. Brintzinger // J. Organomet.
Chem. - 2002. - V.660. - P. 85-90.
108. Hьttenhofer M. Mechanisms
of Sn-to-Zr cyclopentadienyl transfer in the formation of Me2Si-bridged
zirconocenes from sila-stanna-tetrahydro-s-indacenes / M. Hьttenhofer, A.
Weeber, H-H. Brintzinger // J. Organomet. Chem. - 2002. - V.663. - P.58-62.
109. Nifant'ev I.E. Synthesis,
Structure, and Fluxional Behavior of 4-Sila-, 4-Germa-, and
4-Stanna-3a,4,4a,8-tetrahydro-4,4,8,8-tetramethyl-s-indacenes / I.E. Nifant'ev,
V.L. Yarnykh, M.V. Borzov, B.A. Mazurchik, V.I. Mstyslavsky, V.A. Roznyatovsky,
Y.A. Ustynyuk // Organometallics. -1991. - V.10. - No.10. - P.3739-3745.
110. Nifant'ev I.E. Synthesis
of Bimetallic Complexes via 4-Stannatetrahydro-s -indacenes / I.E. Nifant'ev,
M.V. Borzov, A.V. Churakov, Sh.G. Mkoyan, L.O. Atovmyan // Organometallics. -
1992. - V.11. - P.3942-3947.
111. Nifant’ev I.E. Synthesis
of Zirconium and Hafnium ansa- Metallocenes via Transmetalation of Dielement -
Substituted Bis(cyclopentadienyl) and Bis(indenyl) Ligands / I.E. Nifant’ev,
P.V. Ivchenko // Organometallics. - 1997. - V.16. - No.4. - P.713-715.
. Park J.T. An efficient
synthetic method of ansa-zirconocene dimethyl complexes via Me2ZrCl2
/ J.T. Park, B.W. Woo, S.Ch. Yoon, S.Ch. Shim // J. Organomet. Chem. - 1997. -
V.535. - P.29-32.
113. Damrau H.-R.H. Racemo-Selective
Synthesis of ansa-Zirconocene
Derivates from Zirconium
Biphenolate Complexes / H.-R.H. Damrau, E. Royo, St. Obert, Fr. Schaper, Ar.
Weeber, H.-H. Brintzinger // Organometallics. - 2001. - V.20. - No.25. -
P.5258-5265.
114. Bryliakov K.P. ansa-Titanocene
Catalysts for r-Olefin Polymerization. Syntheses, Structures, and Reactions
with Methylaluminoxane and Boron-Based Activators / K.P. Bryliakov, D.E.
Babushkin, E.P. Talsi, A.Z. Voskoboynikov, H. Gritzo, L. Schroder, H.-R.H.
Damrau, Ul. Wieser, Fr. Schaper, H.-H. Brintzinger // Organometallics. - 2005.
- V.24. - No.5. - P.894-904.
115. Diamond G.M. Efficient
Synthesis of rac-(Ethylenebis(indenyl))ZrX2 Complexes via Amine
Elimination / G.M. Diamond, S. Rodewald, R.F. Jordan // Organometallics. - 1995.
- V.14. - No.1. - P.5-7.
116. Diamond G.M. Synthesis of
Me2Si-Bridged ansa-Zirconocenes by Amine Elimination / G.M. Diamond,
R.F. Jordan, J.L. Petersen // Organometallics. - 1996. - V.15. - No.19. -
P.4045-4053.
117. Diamond G.M. Synthesis of
Group 4 Metal rac- (EBI)M(NR2)2 Complexes by Amine
Elimination. Scope and Limitations / G.M. Diamond, R.F. Jordan //
Organometallics. - 1996. - V.15. - P.4030-4037.
. Diamond G.M. Efficient
Synthesis of Chiral ansa-Metallocenes by Amine Elimination. Synthesis, Structure,
and Reactivity of rac-(EBI)Zr(NMe2)2, / G.M. Diamond,
R.F. Jordan, J.L. Petersen // J. Am. Chem. Soc. - 1996. - V.118. - P.8024-8033.
. Christopher J.N.
Synthesis, Structure, and Reactivity of rac- Me2Si(indenyl)2Zr(NMe2)2
/ J.N. Christopher, G.M. Diamond, R.F. Jordan // Organometallics. - 1996. -
V.15. - P.4038-4044.
. Zhang X. General
Synthesis of Racemic Me2Si-Bridged Bis(indenyl) Zirconocene
Complexes / X. Zhang, Q. Zhu, I.A. Guzei, R.F. Jordan // J. Am. Chem. Soc. -
2000. - V.122. - No.33. - P.8093-8094.
. LoCoco M.D.
Chelate-Controlled Synthesis of Racemic ansa- Zirconocenes / M.D. LoCoco, X.
Zhang, R.F. Jordan // J. Am. Chem. Soc. - V.126. - P.15231-15244.
. LoCoco M.D.
Chelate-Controlled Synthesis of rac- and meso- Me2Si(3-tBu-С5H3)2
/ M.D. LoCoco, R.F. Jordan // Organometallics. - 2003. - V.22. - No.26. -
P.5498-5503.
. Dunn A.R.
Computational Modeling of ansa-Zirconocene Amide Complexes / A.R. Dunn, L.E.
Sweet, D.C. Wiser, M.D. LoCoco, R.F. Jordan // Organometallics. - 2004. - V.23.
- P.5671-5680.
. Buck R.M.,
Vinayavekhin N., and Jordan R.F. Control of ansa-Zirconocene Stereochemistry by
Reversible Exchange of Cyclopentadienyl and Chloride Ligands // J. Am. Chem.
Soc. - 2007. - V.129. - No.12. - P.3468-3469.
. Schnutenhaus H.
1,1’-Trimethylenebis(з5-3-tert-butylcyclopentadienyl)- titanium (IV)
Dichloride, a Chiral ansa- Titanocene / H. Schnutenhaus, H.-H. Brintzinger //
Angew. Chem. Int. Ed. Engl. - 1979. - V.18. - No.10. - P.777-778.
. Collins S. Additions
of chiral allyltitanocenes to aldehydes: diastereoselective synthesis of
homoallylic alcohols with a recyclable chiral transition metal reagent / S.
Collins, B.A. Kuntz, Y. Hong // J. Org. Chem. - 1989. - V.54. - No.17. -
P.4154-4158.
. Schafer A. XII*.
Diastereomeric derivatisation and enantiomer separation of
ethylenebis(tetrahydroindenyl)-titanium and -zirconium dichlorides / A.
Schafer, E. Karl, L. Zsolnai, G. Huttner, H.-H. Brintzinger // J. Organomet.
Chem. - 1987. - V.328. - P.87-99.
. Grossman R.B.
Enantioselective, zirconium-mediated synthesis of allylic amines / R.B.
Grossman, W.M. Davis, St.L. Buchwald // J. Am. Chem. Soc. - 1991. - V.113. -
No.6. - P.2321-2322.
. Huttenloch M.E.
ansa-metallocene derivatives XXXIX biphenyl-bridged metallocene complexes of
titanium, zirconium, and vanadium: Syntheses, crystal structures and
enantioseparation / M.E. Huttenloch, B. Dorer, Ur. Rief, M.-H. Prosenc, K.
Schmidt, H.-H. Brintzinger // J. Organomet. Chem. - 1997. - V.541. - Is.1-2. -
P.219-232.
. Chin B. An Improved
Procedure for the Resolution of (rac)-Ethylenebis(tetrahydroindenyl)-Titanium
Derivatives / B. Chin, St.L. Buchwald // J. Org. Chem. - 1996. - V.61. - No.16.
- P.5650-5651.
. Chin B. Improved
Procedure for the Preparation of Enantiomerically Pure
Ethylenebis(tetrahydroindenyl)zirconium Derivatives / B. Chin, St.L. Buchwald
// J. Org. Chem. - 1997. - V.62. - No.7. - P.2267-2268.
. Habaue Sh. Chiral
ethylenebis(4,5,6,7-tetrahydro-1-indenyl) complexes of zirconium and hafnium:
separation and application to asymmetric polymerization / Sh. Habaue, H.
Sakamoto, H. Baraki, Y. Okamoto // Macromolecular Rapid Communications. - 1997.
- V.18. - Is.8. - P.707-713.
. Habaue Sh. Optical
Resolution of Chiral Ethylenebis(4,5,6,7-tetrahydro-1-indenyl)zirconium
Derivatives by High-Performance Liquid Chromatography / Sh. Habaue, H.
Sakamoto, Y. Okamoto // Chemistry Letters. - 1996. - V.25. - No.5. - P.383-384.
. Okamoto Y. Resolution
by high-performance liquid chromatography using polysaccharide carbamates and
benzoates as chiral stationary phases / Y. Okamoto, Y. Kaida // J.
Chromatography A. - 1994. - V.666. - Is.1-2. - P.403-419.
. Okamoto Y.
Chromatographic resolution: XI. Controlled chiral recognition of cellulose
triphenylcarbamate derivatives supported on silica gel / Y. Okamoto, M.
Kawashima, K. Hatada // J. Chromatography A. - 1986. - V.363. - Is.2. -
P.173-186.
. Ellis W.W. Synthesis,
structure, and properties of chiral titanium and zirconium complexes bearing
biaryl strapped substituted cyclopentadienyl ligands / W.W. Ellis, T.K. Hollis,
W. Odenkirk, J. Whelan, R. Ostrander, A.L. Rheingold, B. Bosnich //
Organometallics. - 1993. - V.12. - No.11. - P.4391-4401.
. Baar C.R. Kinetic
Resolution of Chiral б-Olefins Using Optically Active ansa-Zirconocene
Polymerization Catalysts / C.R. Baar, Chr.J. Levy, E.Y.-J. Min, L.M. Henling,
M.W. Day, J.E. Bercaw // J. Am. Chem. Soc. - 2004. - V.126. - No.26. -
P.8216-8230.
. Mitchell J.P.
Preparation and Structural Characterization of an Enantiomerically Pure, C2-Symmetric,
Single-Component Ziegler−Natta б-Olefin Polymerization Catalyst / J.P.
Mitchell, Sh. Hajela, S.K. Brookhart, K.I. Hardcastle, L.M. Henling, J.E.
Bercaw // J. Am. Chem. Soc. - 1996. - V.118. - No.5. - P.1045-1050.
. LoCoco M.D.
Enantioselective Synthesis of ansa-Zirconocenes / M.D. LoCoco, R.F. Jordan //
J. Am. Chem. Soc. - 2004. - V.126. - No.43. - P.13918-13919.
140. Kaminsky W. Metallocene
catalysis / W. Kaminsky, A. Laban // Applied Catalysis A. - 2001. -V.222. -
Is.1-2. - P.47-61.
141. Kondakov D.Y.
Zirconium-catalyzed enantioselective methylalumination of monosubstituted
alkenes / D.Y. Kondakov, E.-i. Negishi // J. Am. Chem. Soc. -1995. - V.117. -
No.43. - P.10771-10772.
142. Erker G. The role of
torsional isomers of planarly chiral nonbridged bis(indenyl)metal type
complexes in stereoselective propene polymerization / G. Erker, M. Aulbach, M.
Knickmeier, D. Wingbermuhle, C. Krueger, M. Nolte, S. Werner // J. Am. Chem.
Soc. - 1993. - V.115. - No.11. - P.4590-4601.
. Wipf P. Water/MAO
acceleration of the zirconocene-catalyzed asymmetric methylalumination of б-olefins/
P. Wipf, S. Ribe // Org. Lett. - 2000. - V.2. -No.12. - P.1713-1716.
. Wipf P.
Water-accelerated tandem Claisen rearrangement-catalytic asymmetric
carboalumination / P. Wipf, S. Ribe // Org. Let. - 2001. - V.3. - No.10. -
P.1503-1505.
. Wipf P.
Transition-metal-mediated cascade reactions: the water-accelerated
carboalumination-Claisen rearrangement-carbonyl addition reaction / P. Wipf,
D.L. Waller, J.T. Reeves // J. Org. Chem. - 2005. - V.70. - No.20. -
P.8096-102.
. Shaughnessy H.
Enantio- and Diastereoselective Catalytic Carboalumination of 1-Alkenes and б,щ-Dienes
with Cationic Zirconocenes: Scope and Mechanism / H. Shaughnessy, R.M. Waymouth
// Organometallics. - 1998. - V.17. - P.5728-5745.
. Negishi E.-i.
Zirconium-catalyzed asymmetric carboalumination (ZACA reaction) of 1,4-dienes /
E.-i. Negishi, Z. Tan, B. Liang, Sh. Huo, J.-ch. Shi // Tetrahedron Asymmetry.
- 2006. - V.17. - P.512-515.
. Petros R.A.
Effectiveness in Catalyzing Carboalumination Can Be Inferred from the Rate of
Dissociation of M/al Dimers / R.A. Petros, J.R. Norton // Organometallics. -
2004. - V.23. - No.22. - P.5105-5107.
. Petros R.A.
Enantioselective methylalumination of б-olefins/
R.A. Petros, J.R. Norton, J.M. Camara // J. Organomet. Chem. 2007. - V.692. -
P.4768-4773.
. Kondakov D.Y. Zirconium-catalyzed
enantioselective alkylalumination of monosubstituted alkenes proceeding via
noncyclic mechanism / D.Y. Kondakov, E.-i. Negishi // J. Am. Chem. Soc. - 1996.
- V.118. - No.6. - P.1577-1578.
. Negishi E.-i. An
odyssey from stoichiometric carbotitanation of alkynes to zirconium-catalysed
enantioselective carboalumination of alkenes/ E.-i. Negishi, D.Y. Kondakov //
Chem. Soc. Rev. - 1996. - V.25. - P.417-426.
. Shiqing Xu. Widely
Applicable Synthesis of Enantiomerically Pure Tertiary Alkyl-Containing
1-Alkanols by Zirconium-Catalyzed Asymmetric Carboalumination of Alkenes and
Palladium- or Copper-Catalyzed Cross-Coupling / Xu Shiqing, Ch.-T. Lee, G.
Wang, E.-i. Negishi // Chem. Asian J. - 2013. - V.8. - P. 1829-1835.
153. Shiqing Xu. Highly
enantioselective synthesis of г-, д-, and e-chiral 1-alkanols via Zr-catalyzed
asymmetric carboalumination of alkenes (ZACA)-Cu- or Pd-catalyzed
cross-coupling / Shiqing Xu, A. Oda, H. Kamada, E.-i. Negishi // PNAS. - 2014.
- V.11. - No.23. - P. 8368-8373.
154. McKnight A.L. Selectivity
in Propylene Polymerization with Group 4Cp-Amido Catalysts/ A.L. McKnight, Md.
Ath. Masood, R.M. Waymouth, D.A. Straus // Organometallics. - 1997. - V.16. -
No.13. - P.2879-2885.
155. Millward D.B. Catalytic
Carboalumination of Olefins with Cyclopentadienylamidotitanium Dichloride
Complexes / D.B. Millward, A. P. Cole, R.M. Waymouth // Organometallics. -
2000. - V.19. - P.1870-1878.
156. Dawson G.
Zirconium-catalysed enantioselective 2-aluminoethylalumination of alkenes / G.
Dawson, C.A. Durrant, G.G. Kirk, R.J. Whitby // Tetrahedron Lett. - 1997. -
V.38. - No.13. - P.2335-2338.
157. Parfenova L.V. On study
of chemoselectivity of reaction of trialkylalanes with alkenes, catalyzed with
Zr р-complexes / L.V. Parfenova, V.Z. Gabdrakhmanov, L.M. Khalilov, U.M.
Dzhemilev // J. Organomet. Chem. - 2009. - V.694. - Is.23. - P. 3725-3731.
158. Парфенова Л.В. Механизмы
реакций гидро-, карбо- и циклометаллирования алкенов с помощью
алюминийорганических соединений, катализируемых з5-комплексами Zr:
диссертация на соискание уч. ст. доктора химических наук: 02.00.15 [Место
защиты: Ин-т нефтехимии и катализа]. - Уфа. - 2012. - 302с.: ил. РГБ ОД, 71
12-2/78.
159. Parfenova L.V. Mechanism
of Cp2ZrCl2-catalyzed olefin hydroalumination by
alkylalanes / L.V. Parfenova, S.V. Pechatkina, L.M. Khalilov, U.M. Dzhemilev //
Rus. Chem. Bulletin. - 2005. - V.54. - Is.2. - P.316-327.
. Eisch J.J.
Temperature-dependent stoichiometry of complexation between diisobutyl-aluminum
hydride andd trisobutylaluminum / J.J. Eisch, S.G. Rhee // J. Organomet. Chem.
- 1972. - V.42. - Is.2. - P.C73-C76.
. Chirik P.J. Alkyl
Rearrangement Processes in Organozirconium Complexes. Observation of Internal
Alkyl Complexes during Hydrozirconation / P.J. Chirik, M.W. Day, J.A. Labinger,
J.E. Bercaw // J. Am. Chem. Soc. - 1999. - V.121. - No.44. - P.10308-10317.
. Chirik P.J.
Cyclopentadienyl and Olefin Substituent Effects on Insertion and в-Hydrogen
Elimination with Group 4 Metallocenes. Kinetics, Mechanism, and Thermodynamics
for Zirconocene and Hafnocene Alkyl Hydride Derivatives / P.J. Chirik, J.E.
Bercaw // Organometallics. - 2005. -V.24. - No.22. - P.5407-5423.
. Parfenova L.V.
Enantioselectivity of chiral zirconocenes as catalysts in alkene hydro-, carbo-
and cycloalumination reactions / L.V. Parfenova, T.V. Berestova, T.V. Tyumkina,
P.V. Kovyazin, L.M. Khalilov, R.J. Whitby, U.M. Dzhemilev // Tetrahedron
Asymmetry. - 2010. - V. 21. - No3. - P. 299-310.
. Parfenova L.V.
Asymmetric alkene cycloalumination by AlEt3, catalyzed with
neomenthylindenyl zirconium з5-complexes
/ L.V.Parfenova, P.V. Kovyazin, T.V. Tyumkina, T.V. Berestova, L.M. Khalilov,
U.M. Dzhemilev // J. Organomet. Chem. - 2013. - V.723. - P.19-25.
. Parfenova L.V. Catalytic
Enantioselective Ethylalumination of Terminal Alkenes: Substrate Effect and
Absolute Configuration Assignment / L.V. Parfenova, P.V. Kovyazin, T.V.
Tyumkina, A.V. Makrushina, L.M. Khalilov, U.M. Dzhemilev // Tetrahedron
Asymmetry. - 2015. - V.26. - P.124-136.
166. Заявка на изобретение №
2012154189 (решение о выдаче патента от 22.08.2014). Способ получения
энантиомерно обогащенного 1-этил-(3R)- фенилалюминациклопентана / Парфёнова
Л.В., Ковязин П.В., Халилов Л.М., Джемилев У.М.
. Заявка на изобретение №
2012151798 (решение о выдаче патента от 22.08.2014). Способ получения
энантиомерно обогащенного 1-этил-(3S)- циклогексилалюминациклопентана /
Парфёнова Л.В., Ковязин П.В., Халилов Л.М., Джемилев У.М.
168. Kovyazin P.V., Berestova
T.V., Parfenova L.V., Khalilov L.M., Dzhemilev U.M. Enantioselective alkene
carbo- and cyclometallation by AlEt3, catalyzed with neomenthylindenyl Zr
complexes// International Conference “Catalysis in Organic Synthesis”, Moscow,
September 15-20, 2012. P. 226.
169. Barth S. Lipase-catalyzed
resolution of racemic 2-alkyl substituted 1-alkanols / S. Barth, F. Effenberger
// Tetrahedron Asymmetry. - 1993. - V. 4. - P. 823-833.
170. Levene P.A.
Configurational relationship of members of disubstituted acetic and propionic
acids containing an ethyl group / P.A. Levene, A. Rothen, G.M. Meyer // J.
Biol. Chem. - 1936. - V.115. - P. 401-413.
. Baczko K.
Lipase-catalyzed transesterification of primary alcohols: resolution of
2-ethylhexan-1-ol and 2-ethylhex-5-en-1-ol / K. Baczko, C. Larpent // J. Chem.
Soc. Perkin Trans 2. - 2000. - P. 521-526.
. Garcia-Ruiz V. On the
absolute stereochemistry of (−)-4-alkylnonan-2-ones / V. Garcia-Ruiz, S.
Woodward // Tetrahedron: Asymmetry. - 2002. - V.13. - No.19. - P.2177-2180.
173. Norsikian S. Regio- and enantioselective
carbolithiation of non-activated C-C bonds / S. Norsikian, M. Baudry, J.F.
Normant // Tetrahedron Lett. - 2000. - V.41. - No.34. - P.6575-6578.
174. Reid G.P.
Diastereoselective conjugate addition of Grignard reagents to a homochiral
fumaramide derived from Oppolzer’s sultam / G.P. Reid, K.W. Brear, D.J. Robins
// Tetrahedron Asymmetry. - 2004. - V.15. - No5. - P. 793-801.
175. Krause H. Influence of
в-arranged substituents in chiral seven-membered rhodium diphosphine rings on
asymmetric hydrogenation of amino acid precursors / H. Krause, C. Sailer // J.
Organomet. Chem. - 1992. - V.423. - Is.2. - P.271-279.
176. Brunner H.
Enantioselektive Katalyse, 63 [1] Optisch Aktive Phosphine Aus Dicarbonsдuren
Und Ihr Einsatz in Der Enantioselektiven Hydrierung (pages 259-265) / H.
Brunner, W. Zettlmeier // Bull. Soc. Chim. Bel. - 1991. - V.100. - No.3. -
P.259-265.
177. Ковязин П.В. Асимметрическое
карбо- и циклоалюминирование алкенов, катализируемое энантимерно чистыми
комплексами Zr / П.В.
Ковязин, Л.В. Парфенова, Л.М. Халилов, У.М. Джемилев // Сборник тезисов
докладов II Российского
конгресса по катализу «РОСКАТАЛИЗ», г. Самара , 2-5 октября 2014.