Использование полуэмпирических методов в химической термодинамике
Введение
термодинамический химический реакция
Энтропии, теплоты и свободные энергии
образования являются фундаментальными физико-химическими характеристиками
молекул и веществ. Одной из величин, определяющих стабильность молекулы и самую
возможность её существования как устойчивой, единой частицы, является энергия
её образования из атомов. Следовательно, с полным правом можно говорить об
энергиях отдельных химических связей между атомами как об энергетических
характеристиках отдельных отношений непосредственной химической связи атомов.
В настоящее время экспериментально установлены
энтальпии образования, теплоты сгорания, энергии Гиббса, энтропии и другие
термодинамические характеристики очень многих, но далеко не всех химических
соединений. Число экспериментальных термохимических работ из года в год
значительно возрастает, однако в ещё большей степени растёт потребность в
термохимических данных для новых технологических производственных процессов и
для решения других вопросов. Поэтому бессмысленно ожидать, что в будущем
развитие экспериментальных работ сумеет полностью удовлетворить потребность в
термохимических данных. Кроме того, экспериментальные методы определения
величин различных термодинамических характеристик в ряде случаев встречают
трудности, обусловленными невысокой точностью измерения данного свойства,
трудностью очистки объектов исследования, их нестойкостью, токсичностью,
агрессивностью и т.д., вплоть до невозможности осуществить эксперимент. Не
приходится говорить о свойствах веществ при таких температурах и давлениях,
когда экспериментирование особенно затруднено или, например, о свойствах
неустойчивых частиц (в частности, радикалов).
Разрыв между требуемой и имеющейся информацией
такого рода сдерживает не только освоение синтезированных соединений, но и
развитие многих теоретических разделов химии, прежде всего теории взаимосвязи
строения и свойств веществ. Это приводит к возрастанию роли расчётных методов,
которые, основываясь на небольшом числе полученных экспериментальных достаточно
надёжных данных, позволяют рассчитать термодинамические характеристики для
других соединений того же класса. В настоящее время большое распространение
нашли квантово-химические расчеты модельных объектов. Чтобы прогностические
количественные соотношения могли быть получены достаточно просто, для их вывода
целесообразно использовать полуэмпирические методы квантовой химии.
Целью настоящей работы являлось проведение
небольшого литературного обзора по современным полуэмпирическим методам и
указание области их применения для оценки основных термодинамических
параметров.
1. Теоретический материал
.1 Полуэмпирические методы расчета
.1.1 Общие положения
Непосредственное решение уравнения (1) лежит в
основе неэмпирических методов (ab
initio)
расчета, которые очень трудоемки.
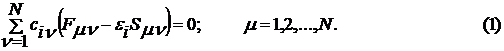
При этом основные затраты времени
ЭВМ направлены на вычисление интегралов межэлектронного взаимодействия (2).
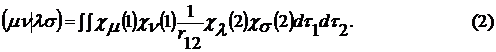
В результате использование
неэмпирических подходов ограничивается размерами молекул.
Полуэмпирические методы расчета
основаны на использовании экспериментальных параметров для оценки некоторых
интегралов или матричных элементов оператора Фока. Это заметно упрощает общие
уравнения и позволяет решать задачи для многоатомных молекул. Однако
полуэмпирические подходы не могут претендовать на одинаково хорошие результаты
в исследовании различных свойств. Например, с помощью вводимых в теорию
подгоночных параметров относительно легко получить удовлетворительные значения
для длин связей, но при этом не обязательно столь же хорошее воспроизведение
значений силовых постоянных или потенциалов ионизации. Поэтому возникают разные
параметризации методов, призванные удовлетворительно описывать определенное
свойство или группу свойств [1].
Из большого числа различных
направлений параметризации можно выделить два, которые легли в основу двух
современных методов ZINDO и PM3: частичное
пренебрежение дифференциальным перекрыванием и пренебрежение двухатомным
дифференциальным перекрыванием. В первом случае дифференциальным перекрыванием
пренебрегают только в тех случаях, когда оно появляется в двухцентровых
интегралах, во втором, между орбиталями, локализованными на различных центрах
[2].
Поскольку, в отличие от
неэмпирических методов, в полуэмпирических нет необходимости рассчитывать
двухэлектронные интегралы в качестве базисных функций используются Слэтеровские
орбитали (3),
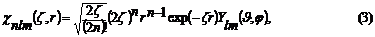
способные лучше гауссовых
воспроизводить форму волновой функции [3].
Упрощенные теоретические модели
должны удовлетворять следующим основным требованиям:
. Полуэмпирические методы должны
быть достаточно просты, чтобы их можно было применять для расчета больших
молекул.
. Они должны с помощью
параметризации компенсировать недостатки метода Хартри-Фока (электронную
корреляцию, энергию нулевых колебаний).
. Результаты расчетов должны быть
инвариантны по отношению к ортогональным преобразованиям АО. Это означает, что
такие величины как энтальпия образования, дипольный момент, электронное
распределение и т.д. не должны зависеть от поворота молекулы как целого в
пространстве.
1.1.2 Приближения нулевого
дифференциального перекрывания
В методе МО ЛКАО орбиталь Ψi
аппроксимируется линейной комбинацией атомных орбиталей χµ
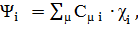
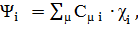 (4)
(4)
где Сµi -
коэффициенты разложения. В полуэмпирических методах для описания АО используют
орбитали слэтеровского типа
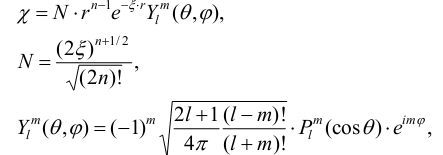
(5)
(6)
(7)
где n, l, m - главное, орбитальное и
магнитное квантовые числа, N - константа нормировки, ξ - слэтеровская
экспонента, 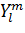
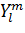 (θ,ϕ) - сферическая
гармоника и
(θ,ϕ) - сферическая
гармоника и 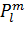
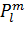 (cosθ) - присоединенный
полином Лежандра. Величина ξ обычно подбирается согласно правилам
Слэтера. Валентное приближение означает, что для водорода используется только1s АО, для
элементов второго периода Периодической таблицы - 2s, 2px, 2py,2pz АО.
(cosθ) - присоединенный
полином Лежандра. Величина ξ обычно подбирается согласно правилам
Слэтера. Валентное приближение означает, что для водорода используется только1s АО, для
элементов второго периода Периодической таблицы - 2s, 2px, 2py,2pz АО.
Для нахождения собственных функций
(МО) и собственных значений (энергий МО) гамильтониана молекулы необходимо
решить уравнения Хартри-Фока-Рутаана:
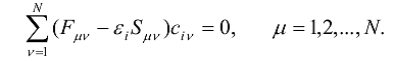
(8)
Здесь εi -
одноэлектронная энергия молекулярной орбитали Ψi, Sµν - элемент
матрицы перекрывания; Fµν - элемент
матрицы Фока.
Неэмпирические методы решают эти
уравнения явным образом, без упрощений. В полуэмпирических методах вводится
приближение, что дифференциальное перекрывание между атомными орбиталями µ и ν равно:
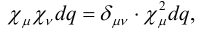 (9)
(9)
где δµν - символ
Кронекера. Тогда двухэлектронные интегралы можно записать как:
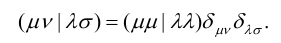 (10)
(10)
Данное приближение превращает
четырехмерный массив интегралов (µν|λσ) в двумерный,
что сильно сокращает число интегралов и, соответственно, время расчета. Кроме
того, в интеграле (µν|λσ)
появляются
три или четыре АО, принадлежащие трем или четырем различным атомам (центрам).
Такие интегралы называются трех- или четырехцентровыми и вычисляются они
намного сложнее, чем одно- и двухцентровые интегралы. В полуэмпирических
методах многоцентровые интегралы взаимодействия полагаются равными нулю, что
также существенно сокращает время расчета.
Рассмотренное выше упрощение
расчетной схемы Хартри-Фока-Рутаана называется приближением нулевого
дифференциального перекрывания (НДП). В английской транскрипции
- NDO (Neglect of Differential Overlap)или ZDO (Zero
Differential Overlap).
Приближение НДП в различных методах
реализуются по-разному. Уровень аппроксимации отражается в названии
полуэмпирических методов. Это: полное пренебрежение дифференциальным
перекрыванием - ППДП CNDO, Complete Neglect of Differential Overlap); частичное
пренебрежение дифференциальным перекрыванием - ЧПДП (INDO, Intermediate Neglect
of Differential Overlap); пренебрежение двухатомным дифференциальным
перекрыванием ПДДП (NDDO, Neglect of Diatomic Differential Overlap).
.1.3 Методы INDO
Большую группу составляют методы,
основанные на частичном пренебрежении дифференциальным перекрыванием,
предложенном в 1967 году Дж. Поплом, Д. Бевериджем и П. Добошем для элементов
первых двух периодов. В его основе лежат следующие допущения:
1. Используется валентное приближение, т.е.
в расчете учитываются только валентные электроны. Влияние внутренних (остовных)
электронов неявно учитывается в виде параметров.
2. Пренебрежение всеми трех- и
четырехцентровыми интегралами.
. Матричные элементы оператора Фока имеют
следующий вид
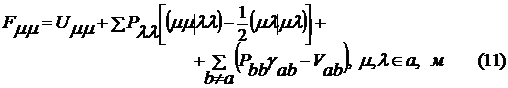
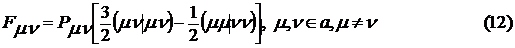
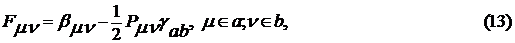
где интегралы определяются следующим
образом:
Таблица 1 - Параметры метода INDO
|
Типы матричных элементов
|
Типы интегралов
|
Параметризация
|
|
Одноэлектронные
|
|
Диагональные
Hμμ
|
Одноцентровые
Uμμ
|
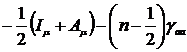
|
|
Двухцентровые
Vab
|
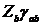
|
|
Недиагональные
Hμν
|
Резонансные
βμν
|
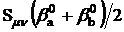
|
|
Двухэлектронные
|
|
Одноцентровые
|
Кулоновские (μμ|νν) (ss|ss),
(ss|pp) 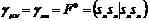
Вариант оценки
|
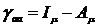
|
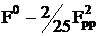
|
|
(pxpx|pxpx)
|
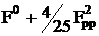
|
|
Обменные
(μν|μν)
|
(spx|spx)
|
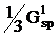
|
|
(pxpy|pxpy)
|
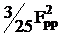
|
|
Двухцентровые
|
Кулоновские (μμ|νν) γab 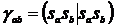
Варианты оценки:
формула Матага-Нишимото
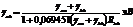
формула Оно
|
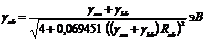
|
|
|
Кулоновские
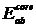 Остовного
отталкивания Остовного
отталкивания 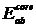 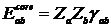
|
|
|
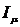 - потенциал ионизации μ-ой атомной
орбитали, определяемый из спектроскопических данных;
- потенциал ионизации μ-ой атомной
орбитали, определяемый из спектроскопических данных;
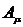 - сродство к электрону μ-ой атомной
орбитали;
- сродство к электрону μ-ой атомной
орбитали;
n - число
валентных электронов атома a;
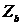 - заряд остова атома b (величина
- заряд остова атома b (величина 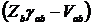 называется
интегралом проникновения);
называется
интегралом проникновения);
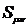 - интеграл перекрывания орбиталей μ и ν;
- интеграл перекрывания орбиталей μ и ν;
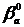 и
и 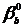 - подгоночные параметры, подобранные
при сравнении с результатами расчетов неэмпирическими методами;
- подгоночные параметры, подобранные
при сравнении с результатами расчетов неэмпирическими методами;
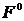 ,
, 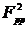 ,
, 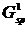 - параметры Слэтера-Кондона,
двухэлектронные интегралы, включающие только радиальные части атомных
орбиталей;
- параметры Слэтера-Кондона,
двухэлектронные интегралы, включающие только радиальные части атомных
орбиталей;
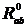 - расстояние между атомами a и b.
- расстояние между атомами a и b.
В 1972 году Кауфман и Пренди
расширили метод INDO на элементы третьего периода [4].
Для вычисления одноцентровых интегралов используется следующая процедура:
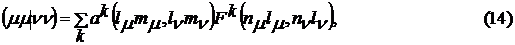
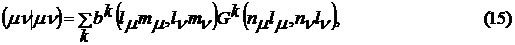
где ak и bk -
коэффициенты, зависящие от угловых частей орбиталей (табулированы в 1949 году
Кондоном и Шортли), Fk и Gk -
интегралы, включающие только радиальные функции. Тогда кулоновские и обменные
интегралы можно записать в следующем виде
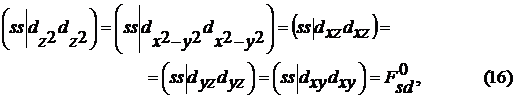
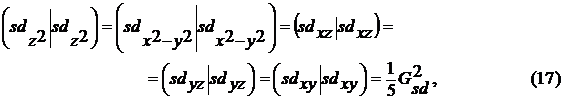
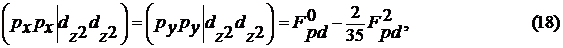
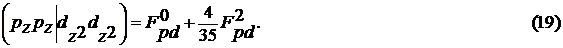
Параметры метода еще не однократно менялись,
поэтому существует несколько модификаций INDO
[62]. Широкое распространение для расчета соединений переходных металлов
получили версии, разработанные группой Майкла Зернера [70], - ZINDO/1,
ориентированная на расчеты структурных и энергетических характеристик
комплексов, и ZINDO/S,
специально откалиброванная для расчета электронных спектров. Эти версии INDO
встроены в целый ряд программных комплексов (например, HyperChem)
и очень популярны.
.1.4 Методы NDDO
Такие популярные современные методы, как MNDO,
AM1, PM3,
MNDO-d
основаны на пренебрежении двухатомным дифференциальным перекрыванием,
разработанным в 1965 году Дж. Поплом и впервые примененным на практике в 1969
году Шустманом и его сотрудниками [60,69]. В его основе лежат следующие
положения:
. Используется валентное приближение, т.е. в
расчете учитываются только валентные электроны. Влияние внутренних (остовных)
электронов неявно учитывается в виде параметров.
. Пренебрежение всеми трех- и четырехцентровыми
интегралами.
3. Произведения двух разных атомных орбиталей
отбрасываются лишь в тех случаях, когда данные АО принадлежат разным атомам.
. Матричные элементы оператора Фока имеют
следующий вид
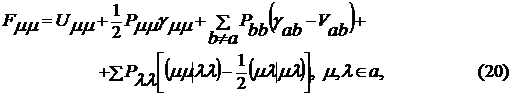
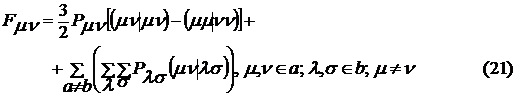
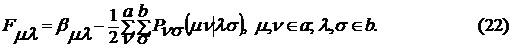
. Для оценки одно- и двухцентровых
интегралов межэлектронного отталкивания (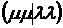 ,
, 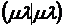 и др.) выполнялось аналитическое
интегрирование при помощи слэтеровских s-орбиталей.
и др.) выполнялось аналитическое
интегрирование при помощи слэтеровских s-орбиталей.
. Двухцентровые остовные интегралы
притяжения 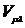 полагались
равными произведению заряда остова на интеграл межэлектронного отталкивания с
противоположным знаком.
полагались
равными произведению заряда остова на интеграл межэлектронного отталкивания с
противоположным знаком.
. Одноэлектронные резонансные
интегралы 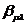 , которые
вносят основной вклад в энергию связи молекулы, вычислялись при помощи
выражения
, которые
вносят основной вклад в энергию связи молекулы, вычислялись при помощи
выражения

где 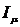 - потенциал ионизации μ-ой атомной
орбитали, определяемый из спектроскопических данных (
- потенциал ионизации μ-ой атомной
орбитали, определяемый из спектроскопических данных (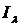 -
аналогично для λ-ой
орбитали),
-
аналогично для λ-ой
орбитали), 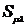 - интеграл
перекрывания орбиталей μ и λ,
- интеграл
перекрывания орбиталей μ и λ, 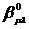 - параметр,
характеризующий пару взаимодействующих между собой атомов.
- параметр,
характеризующий пару взаимодействующих между собой атомов.
Метод ПДДП был разработан для
молекул с замкнутой оболочкой. Результаты, полученные при его использовании,
были признаны удовлетворительными, но обычно они были не более точными, чем
результаты более простых методов.
Метод МПДП (модифицированное
пренебрежение двухатомным перекрыванием, в английской аббревиатуре MNDO - Modified Neglect of Diatomic Overlap) был
предложен Дьюаром и Тилем в 1977 году для расчета органических молекул,
включающих атомы I и II периодов
таблицы Менделеева. Как указывалось выше, данный метод основан на приближении
НДДП. Основные отличия заключаются в следующем:
. Одно- и двухцентровые
интегралы межэлектронного отталкивания (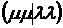 ,
, 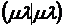 и др.) оцениваются с учетом функций
и др.) оцениваются с учетом функций
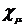 и
и 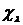 , а не
аппроксимируются соответствующими интегралами слэтеровских s-орбиталей.
При этом оценка двухцентровых интегралов (например,
, а не
аппроксимируются соответствующими интегралами слэтеровских s-орбиталей.
При этом оценка двухцентровых интегралов (например, 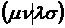 )
полуэмпирическая, основанная на представлении данных интегралов в виде суммы
мультиполь-мультипольных взаимодействий между зарядовыми распределениями
)
полуэмпирическая, основанная на представлении данных интегралов в виде суммы
мультиполь-мультипольных взаимодействий между зарядовыми распределениями 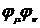 на атоме A и
на атоме A и 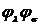 на атоме B.
на атоме B.
. Двухцентровые остовные
интегралы притяжения 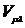 представлены
в виде
представлены
в виде

где 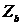 - заряд атома B.
- заряд атома B.
. Одноэлектронные резонансные
интегралы 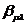 вычислялись
при помощи выражения
вычислялись
при помощи выражения

с подгоночными параметрами 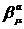 и
и 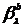 .
.
. Интегралы остовного
отталкивания, 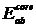 ,
оценивались по эмпирическим формулам с подгоночными параметрами
,
оценивались по эмпирическим формулам с подгоночными параметрами 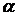 :
:
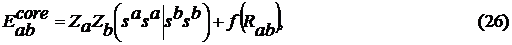
где
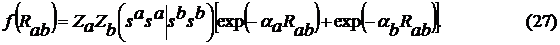
Для пар атомов N-H и О-H последняя
формула была несколько модифицирована:
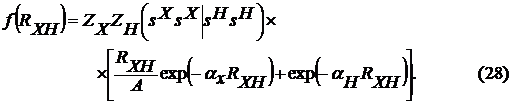
Такой способ описания двухцентрового
межэлектронного взаимодействия позволяет учитывать пространственную ориентацию
орбиталей, и, как следствие, более корректно описывать отталкивание электронных
пар и валентные углы. Такая полуэмпирическая оценка к тому же позволяет
частично учитывать эффекты электронной корреляции.
Параметризация метода MNDO
была ориентирована на расчет свойств молекул в основном электронном состоянии,
прежде всего - теплот образования и геометрических характеристик, и
дополнительно - потенциалов ионизации и дипольных моментов.
Слабой стороной метода является описание систем
с водородными и гипервалентными связями, неудовлетворительное описание
взаимодействий H-H,
неучет ван-дер-ваальсовая притяжения и др. Это препятствовало применению метода
к биологически важным системам.
Для преодоления этих трудностей Дьюаром и его
коллегами в 1984 году метод MNDO был модифицирован [5]. Новый метод был назван
AM1 (Austin Model 1). Его отличие от MNDO заключалось в том, что функция,
описывающая отталкивание остовов (26), была модифицирована добавлением
гауссовых функций. В результате слагаемое (27) было преобразовано к следующему
виду
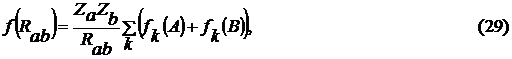
где
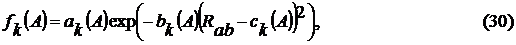
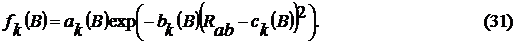
Таблица 3 - Некоторые параметры
метода AM1
|
Параметры
|
Элементы
|
|
H
|
C
|
N
|
O
|
|
a1 a2 a3
a4 b1 b2 b3 b4 c1
c2 c3 c4
|
0.122796 0.005090 -0.018336
5.000000 5.000000 2.000000 1.200000 1.800000 2.100000
|
0.011355 0.045924 -0.020061
-0.001260 5.000000 5.000000 5.000000 5.000000 1.600000 1.850000 2.050000
2.650000
|
0.025251 0.028953 -0.005806
5.000000 5.000000 2.000000 1.500000 2.100000 2.400000
|
0.280962 0.081430 5.000000
7.000000 0.847918 1.445071
|
Основными успехами метода AM1
по отношению к методу MNDO
стали способность описывать водородные связи и давать значительно лучшие
значения энергий активации реакций [6].
Метод PM3
(Parametric
Model
3),
разработанный в 1989 году Дж. Стюартом [7,8], практически представляет собой
метод AM1,
реоптимизированный для большого числа молекул. Его отличительной чертой является
то, что все параметры подбирались для наиболее точного описания свойств
непосредственно молекул, а не атомов, как было ранее. Для каждого элемента был
выбран начальный пробный (базисный) набор молекул, представляющих химию этого
элемента. После того, как параметры были оптимизированы, круг соединений был
расширен. Соединения, для которых получались наибольшие ошибки в рассчитанных
характеристиках, включались в базисный набор и параметры реоптимизировались.
Такая техника позволила приобрести PM3
репутацию самого надежного из полуэмпирических методов.
2. Расчет молекулярных характеристик
.1.1 Энергия молекулы
Любой полуэмпирический метод позволяет
рассчитать несколько энергетических характеристик молекулы:
. Электронная энергия (Eel),
соответствующая энергии всех электронов в молекуле.
. Энергия отталкивания атомных остовов (Erep).
. Полная энергия молекулы Etot=Eel
+ Erep.
4. Энтальпия образования при
нормальных условиях 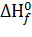
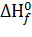 , рассчитывается по формуле:
, рассчитывается по формуле:
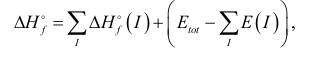 (32)
(32)
где 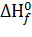
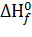 , и E(I) - соответственно
стандартная теплота образования и полная энергия I - го атома (табличные
данные). Выражение , стоящее в скобках, называется энергией связывания .
Формула (32) не учитывает колебательной составляющей энтальпии ( в том числе
энергии нулевых колебаний Ezv). Этот недостаток частично
компенсируется надлежащей параметризацией метода.
, и E(I) - соответственно
стандартная теплота образования и полная энергия I - го атома (табличные
данные). Выражение , стоящее в скобках, называется энергией связывания .
Формула (32) не учитывает колебательной составляющей энтальпии ( в том числе
энергии нулевых колебаний Ezv). Этот недостаток частично
компенсируется надлежащей параметризацией метода.
.1.2 Расчет геометрии молекулы
Геометрические параметры молекулы
включают длины связей , валентные и двугранные ( торсионные) углы. Так, в
методе АМ1 ошибка при расчете длин связей составляет в среднем 0.01Å, валентные
углы рассчитываются с точностью до нескольких градусов. Эти значения имеют тот
же порядок, что и типичные ошибки в данных, полученных экспериментальным путем.
Очень часто на практике требуется
найти зависимость между геометрическими параметрами и энергией молекулы.
Например, при расчете барьеров внутреннего вращения в алканах и поиске их
оптимальных конформаций требуется найти зависимость Etot=f ( ϕXCCX),
где ϕXCCX торсионный угол, включающий связь C-C, вокруг которой
происходит вращение.
В более сложных случаях
функциональная зависимость может включать много независимых переменных (до 3N-6
для молекулы, состоящей из N атомов). В этом случае говорят о расчете
поверхностей потенциальной энергии (ППЭ). Задача расчета ППЭ является одной из
основных задач компьютерной химии, так как позволяет сделать важные выводы относительно
химических и динамических свойств молекулы, изучить механизмы химических
реакций. В частности, расчет профиля ППЭ вдоль координаты реакции позволяет
найти основные термодинамические характеристики переходного состояния (Δ H≠, Δ G≠ Δ S≠).
.1.3 Энергия и форма МО
Энергии МО в полуэмпирических
методах, как и в методах ab initio, непосредственно получают как собственные
значения одноэлектронных операторов Фока. Наибольший интерес представляют
высшая занятая и низшая свободная МО (ВЗМО и НСМО ), так как многие свойства
молекул зависят от вида этих орбиталей. В частности, используя теорему Куманса,
по значениям энергии ВЗМО и НСМО можно оценить первый потенциал ионизации ( IM
= -EВЗМО), сродство к электрону ( AM = EНСМО)
и энергетическую щель EНСМО - EВЗМО для молекулы,
отражающие ее донорно- акцепторные и окислительно-восстановительные свойства.
Форма указанных граничных МО позволяет делать выводы о механизмах органических
реакций, так как электрофильная атака часто идет в области наибольших значений ВЗМО
, а нуклеофильная - по месту наибольших значений НСМО . Кроме того , две
молекулы предпочитают реагировать по месту наибольшего перекрывания их ВЗМО и
НСМО .
.1.4 Заряды на атомах
Рассчитанные значения эффективных
зарядов на атомах в молекуле являются важнейшей информацией, используемой в
теоретической органической химии для предсказания химических свойств молекул и
механизмов реакций.
Вместе с тем необходимо помнить, что
абсолютные значения эффективных зарядов сильно зависят от выбранного метода расчета
и могут быть использованы только в сравнительном анализе нескольких молекул
(или нескольких атомов в одной и той же молекуле).
.1.5 Распределение
электростатического потенциала
По определению электростатический
потенциал в данной точке r равен работе, которую необходимо совершить, чтобы
переместить единичный положительный заряд из бесконечности в r.
Таким образом, отрицательные и
положительные области его распределения в молекуле указывают на возможные пути
соответственно электрофильной и нуклеофильной атаки. Максимальные значения
потенциала не всегда совпадают с положениями центров положительных и
отрицательных зарядов в молекуле. Поэтому распределение электростатического
потенциала может быть более информативным при анализе химических свойств молекулы
и механизмов реакций, чем заряды на атомах.
.1.6 Дипольный момент
Дипольный момент ‒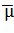
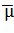 определен только для
электронейтральной системы как вектор, проведенный из центра тяжести
отрицательного заряда в центр тяжести положительного заряда. Для молекулы
дипольный момент в полуэмпирических методах рассчитывают по формуле:
определен только для
электронейтральной системы как вектор, проведенный из центра тяжести
отрицательного заряда в центр тяжести положительного заряда. Для молекулы
дипольный момент в полуэмпирических методах рассчитывают по формуле:
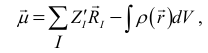 (33)
(33)
где 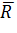
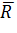 l - радиус
вектор центра тяжести I - го атомного остова , ρ -
электронная плотность, а интегрирование ведется по всему пространству. Для
молекулярных ионов понятие дипольного момента не применимо и попытки его
расчета могут привести к физически бессмысленным результатам.
l - радиус
вектор центра тяжести I - го атомного остова , ρ -
электронная плотность, а интегрирование ведется по всему пространству. Для
молекулярных ионов понятие дипольного момента не применимо и попытки его
расчета могут привести к физически бессмысленным результатам.
Заключение
Создание и совершенствование
полуэмпирических методов позволило квантовой химии стать рабочим инструментом
химика и внедриться в лабораторную практику. Вместе с тем, несмотря на
достигнутый прогресс, полуэмпирические методы не являются панацеей при решении
реальных химических задач, обладая рядом недостатков и ограничений. Корректное
использование методов этой группы предусматривает четкое понимание химиком -
практиком их возможностей и круга задач, для решения которых они предназначены.
В данной работе были рассмотрены
такие группы полуэмпирических методов как INDO и NDDO, а так же
приведены способы оценки основных термодинамических параметров таких как: Δ H, Δ G, Δ
S, дипольный
момент, распределение электростатического потенциала, заряды на атомах и т.д.
Список литературы
1. В.И. Минкин, Б.Я. Симкин, Р.М.
Миняев. Теория строения молекул. - Ростов-на-Дону: Феникс, 1997. - 560 с.
2. Полуэмпирические методы
расчета электронной структуры. Т.1 / Перевод Е.Л. Розенберга, А.М. Бродского. -
Изд-во «Мир» Москва, 1980. - 327 с.
. О.В. Сизова, В.И.
Барановский. Компьютерное моделирование молекулярной структуры. - СПб.: НИИХ
СпбГУ, 2000. - 127 с.
. Д.А. Жоголев, В.Б. Волков.
Методы, алгоритмы и программы для квантовохимических расчетов молекул. - Киев:
Наукова думка, 1976. - 212 с.
5. An intermediate neglect
of differential overlap technique for spectroscopy of transition-metal
complexes. Ferrocene / Michel C. Zerner [et al.] // J. Am. Chem. Soc. - 1980. -
Vol.102, №.2. - P.589-599.
. Murphy R.B. Frozen
orbital QM/MM methods for density functional theory / R.B. Murphy, D.M.
Philipp, R.A. Friesner // Chem. Phys. Lett. - 2000. - Vol.321, №2. - P.113-120.
. Oxygen binding to iron
Pphyrins. An ab initio calculation / A. Dedieu [et al.] // J. Am. Chem. Soc. -
1976. - V.98, №12. - P.3717-3718.
. Rovira C. The
Iron-Sulfur Bond in Cytochrome c / C. Rovira, P. Carloni, M. Parrinello
// J. Phys. Chem. B. - 1999. - V.103, №33. - P.7031-7035.