Изобарно-изотермический потенциал в стандартных и нестандартных условиях
Федеральное
государственное бюджетное образовательное учреждение высшего профессионального
образования
«Ульяновский
государственный технический университет»
Кафедра
«Химии»
Реферат
по
дисциплине «Физическая химия»
ИЗОБАРНО-ИЗОТЕРМИЧЕСКИЙ
ПОТЕНЦИАЛ В СТАНДАРТНЫХ И НЕСТАНДАРТНЫХ УСЛОВИЯХ
Выполнила:
Янова С.М.
Ульяновск
2015г.
Содержание
Введение
. Изобарно-изотермический потенциал
. Стандартный
изобарно-изотермический потенциал и его изменение
. Изменение изобарно-изотермического
потенциала при нестандартных условиях
Заключение
Список литературы
Введение
Гиббса энергия (изобарно-изотермический
потенциал, свободная энтальпия), один из потенциалов термодинамических системы.
Обозначается G, определяется разностью между энтальпией H и произведением
энтропии S на термодинамическую температуру Т: G = H - T·S. Изотермический
равновесный процесс без затраты внешних сил может протекать самопроизвольно
только в направлении убывания энергии Гиббса до достижения ее минимума,
которому отвечает термодинамическое равновесное состояние системы. Названа по
имени Дж.У. Гиббса.
Целью данного реферата является изучение
изобарно-изотермического потенциала.
Задачи:
рассмотреть изменение изобарно-изотермического
потенциала при нестандартных условиях
1. Изобарно-изотермический потенциал
Энергия Гиббса - это величина, показывающая
изменение энергии в ходе химической реакции и дающая таким образом ответ на
вопрос о принципиальной возможности протекания химической реакции; это
термодинамический потенциал следующего вида:
G = U+PV-TS
Энергию Гиббса можно понимать как полную
химическую энергию системы (кристалла, жидкости и т.д.)
Понятие энергии Гиббса широко используется в
термодинамике и химии [1].
Самопроизвольное протекание
изобарно-изотермического процесса определяется двумя факторами: энтальпийным,
связанным с уменьшением энтальпиисистемы (ΔH), и
энтропийным T ΔS, обусловленным
увеличением беспорядка в системе вследствие роста её энтропии. Разность этих
термодинамических факторов является функцией состояния системы, называемой
изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж)
Классическим определением энергии
Гиббса является выражение
G = U+PV-TS,
Где U - внутренняя
энергия,
P
- давление,-
объём,
T - абсолютная температура,
S
- энтропия.
Дифференциал энергии
Гиббса для системы с постоянным числом частиц, выраженный в собственных
переменных - через давление p и температуру
T:
dG= -SdT+VdP.
Для системы с переменным числом
частиц этот дифференциал записывается так:
dG= -SdT+VdP + µdN.
Здесь µ - химический
потенциал, который можно определить как энергию,
которую необходимо затратить, чтобы добавить в систему ещё одну частицу [2].
. Стандартный изобарно-изотермический потенциал
и его изменение
Изобарно-изотермический потенциал G является
функцией состояния, зависит только от начального и конечного состояния системы,
вещества. Поэтому эта функция также проявляет аддитивные свойства, т.е. общий
изобарно-изотермический потенциал системы равен сумме потенциалов отдельных ее
частей (отдельных веществ):
и, как следствие, его изменение ∆G
определяется также законом Гесса:
∆Gреакции = Σ ∆Gпродуктов
- Σ
∆Gисход.
в-ва.
Чтобы можно было сравнивать
изобарно-изотермические потенциалы, производить с ними алгебраические действия,
необходимо их относить к одним и тем же условиям. По аналогии со стандартными
значениями изменения энтальпии (∆Н0 298 и ∆Н0 Т) и энтропии (S0 298
и S0 T) пользуются системой стандартных энергий Гиббса ∆G0 298 и ∆G0
Т образования данного вещества. Для простых веществ (О2 газ, F2 газ, N2 газ,
Feкр., Cuкр. и т.п.), устойчивых в стандартном состоянии, принимается значение
изобарно-изотермического потенциала ∆G0 298 = 0. Обычно в
термодинамических справочниках значения функций состояний приведены для Т = 298
К. Значение ∆G зависят от концентрации.
Принято для характеристики химических процессов
пользоваться значениями ∆G0 298, отвечающими условиям, когда парциальное
давление (концентрации) всех реагентов в течение всего процесса остаются
неизменными и равными единице. Это условие предполагает состав реакционной
смеси неизменным, и молчаливо допускается, что количество всех веществ в
реакционной зоне несоизмеримо больше, чем количество прореагировавших и
образовавшихся веществ по уравнению реакции. Так, например, для реакции: Н2газ
+ 0,5 О2 газ = Н2О газ, для которой изменение изобарного
потенциала ∆G0 298 = -228,8 кДж/моль, предполагается следующее. В
достаточно большом количестве смеси (водорода, кислорода, водяных паров),
взятой при 25 °C, в которой
парциальные давления всех компонентов равны РН2 = РО2 =
РН2О = 101 325 Па (общее давление составляет 3·101325 Па, все газы идеальны),
если бы прореагировало по одному молю Н2 и 0,5 моль О2,
то в результате энергия Гиббса уменьшилась бы на 228,8 кДж/ моль. Применим
закон Гесса к указанной реакции и рассчитаем изменение свободной энергии ∆G0,
без отдельных расчетов изменения энтальпии и энтропии процесса, используя
табличные данные энергии Гиббса образования исходных веществ и продуктов
реакции: ∆G0 реак. = Σ∆G0
продук. - Σ∆G 0 исход.
в-ва. Или, используя стандартные табличные значения, получим: ∆G0 реак. =
(∆G0 Н2О газ) - (∆G0 Н2 газ + 0,5 ∆G0 О2
газ) = -226,8 кДж/ моль. Рассчитанные ∆G0 298 для стандартных условий и
соответствующие выводы о характере процессов, нужно осторожно переносить на
другие условия протекания процессов. Значения ∆S и ∆G сильно
зависят и от концентрации реагирующих веществ и температуры.
Конечно, если для стандартных условий ∆G0
298 значительно меньше нуля, то можно считать, что и при любых реальных
условиях прямой процесс возможен (и наоборот, если ∆G0 298 > 0, то
осуществима обратная реакция). Другими словами, нельзя подменять величину ∆G0
Т при любой другой температуре величиной ∆G0 298. Для получения сугубо
ориентировочных данных можно считать, что: ∆G0 T ≈ ∆Н0 298 -
Т ∆S0 298, но здесь не учтена зависимость ∆Н и ∆S от
температуры. Воспользоваться приведенным выражением можно, но с одним условием,
что при переходе системы от стандартных условий (температуры) к изучаемым при
температуре Т, не происходят фазовые превращения, т. к. это связано с резкими
изменениями энтропии системы [3].
. Изменение изобарно-изотермического потенциала
при нестандартных условиях
В практической деятельности стандартные условия
почти никогда не осуществляются. Процессы протекают с произвольными
количествами реагирующих веществ и продуктов реакции. И решение вопроса о
возможности протекания реакции в данных условиях (концентрациях, парциальных
давлениях, температуре), выходе реакции (константе равновесия) остается
открытым. Чтобы ответить на этот вопрос, вернемся к выражениям: G = G0 + nRT ln
р, или другой формулой, если учитывать активные концентрации: G = G0 + nRT ln
а.
Предположим, что протекает процесс при
нестандартных условиях (с неравновесными парциальными давлениями участников или
неравновесными активными концентрациями) в соответствии с уравнением aА + bB ↔
dD + fF, для которого изменение изобарного потенциала составит ∆Gреак. = ΣGпродук.
- ΣGисход.в-ва.
или ∆Gреак. = (GD + GF) - (GA + GB). Тогда, принимая во внимание
изобарные потенциалы каждого участника реакции, число молей участвующих
компонентов, и подставляя их в последнее выражение, получим изменение
изобарно-изотермического потенциала для этой реакции:
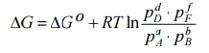
или для растворов через активные концентрации:
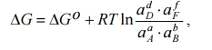
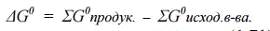
Преобразуем несколько последние выражения.
Константа равновесия (Кр или Кс) реакции при стандартных условиях связана с
изменением изобарно-изотермического потенциала ∆G0 при стандартных
условиях соотношением ∆G0 = - RT ln Kp, или ∆G0 = - RT ln Kс.
Заменим в уравнениях изменение стандартного
потенциала через логарифмическую форму константы равновесия. При этом уравнения
преобразуются в выражения:
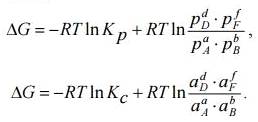
Если эти выражения разности логарифмов
представить в виде логарифма дроби, то получим:
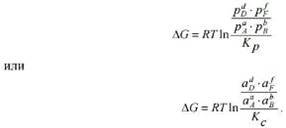
Полученные уравнения носят название уравнений
изотермы химических реакций или уравнений изотермы Вант-Гоффа. С их помощью,
зная константу равновесия при каких-либо условиях (например, стандартных) и
неравновесные парциальные давления (активные концентрации), можно определить
знак изобарного потенциала и, следовательно, возможность прохождения реакции.
Если соотношение неравновесных парциальных давлений, например, и константы
равновесия меньше единицы, т.е.
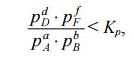
изотерма энтальпия энергия химия
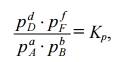
Их соотношение равно единице, а изменение
изобарно-изотермического потенциала ∆G =0, т.е. система находится в
равновесии. И преимущественного протекания прямой или обратной реакции не
происходит. При обратном соотношении, т.е. когда изменение
изобарно-изотермического потенциала ∆G >0. А это означает, что в
системе имеется избыток продуктов по отношению к равновесному состоянию, и
самопроизвольное протекание прямой реакции невозможно. Идет обратная реакция до
тех пор, пока не будет достигнуто равновесное состояние [3].
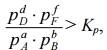
Заключение
Таким образом, можно сделать вывод, что Энергию
Гиббса можно понимать как полную химическую энергию системы (кристалла,
жидкости и т.д.)
Понятие энергии Гиббса широко используется в
термодинамике и химии.
Самопроизвольное протекание
изобарно-изотермического процесса определяется двумя факторами: энтальпийным,
связанным с уменьшением энтальпии системы (ΔH), и
энтропийным T ΔS, обусловленным
увеличением беспорядка в системе вследствие роста её энтропии. Разность этих
термодинамических факторов является функцией состояния системы, называемой
изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж).
Список литературы
1. Я Класс [Электронный ресурс] /
Химическая термодинамика. Энергия Гиббса.
. Физическая химия Практикум для
студентов, обучающихся по специальности 330200 «Инженерная защита окружающей
среды»: учебное пособие / В.Т. Письменко, Е.Н. Калюкова. - Ульяновск: УлГТУ,
2009. - 230с.