Біологічна хімія з біохімічними методами дослідження
Херсонський базовий медичний
коледж Херсонської обласної ради
П(Ц)К санітарно-гігієнічних і
лабораторно-діагностичних дисциплін
Курс лекцій
з дисципліни біологічна хімія
з біохімічними методами дослідження
Спеціальності: 5.12010201
"Лабораторна діагностика"
6.120101 "Сестринська
справа"
Автор: викладач вищої категорії Терентьєва О.А.
Рецензент: викладач методів КЛД Бобощенко Л.І.
м. Херсон
р.
Лекція № 1. ПРЕДМЕТ І
ЗАВДАННЯ БІОХІМІЇ
. Предмет і завдання
біохімії
Біохімія - наука про хімічний
склад, властивості, обмін речовин і енергії в живих організмах, а коротше
кажучи наука про хімію життя.
Основними завданнями
біохімії є вивчення хімічного складу організму і структури речовин, з яких він
складається, послідовності і взаємозв’язку реакцій хімічних перетворень, які
характерні для живого організму і відрізняються від неживого.
Біохімія тісно пов’язана
з другими науками. Наприклад, анатомія вивчає загальну будову організму,
гістологія і цитологія дають уявлення про структуру клітин тканин. Сучасні
методи досліджень такі, як електронна мікроскопія поглиблюють наші
знання про структуру субклітинних фракцій, а іноді і окремих молекул, наприклад
з використанням ізотопних методів стало можливим вивчення механізмів синтезу
холестерину електрофоретичні методи дозволили вивчити склад білків та їх
фракцій в різних тканинах, за допомогою спектрального налізу були відкриті
фракції гемоглобіну.
Найбільш тісно біохімія
пов’язана з фізіологією, що вивчає функціональний стан окремих клітин органів
та організму в цілому. Але завдання і методи фізіології і біохімії
відрізняються. Тісно пов'язана, біохімія з хімією, являючись її розділом, Всі
живі об’єкти складаються з неживих молекул, підлягаючи всім фізичним законам,
то біохімія нерозривно пов’язана з фізикою.
. Коротка історія
розвитку біохімії як науки
Вивчення проблем, що
складають сучасну біохімію почалось кінці ХVIII століття, а як самостійна наука
біохімія виділилась в кінці XIX століття. Але біохімічними процесами людство
користувалось з глибокої давнини. Історію формування біохімії як науки можна
розділити на чотири періоди.
І період - з давніх часів
до епохи Відродження людство використовувало окремі біохімічні процеси
(технологів виготовлення вина, пива, сиру, хліба, тютюну).
ІІ період характеризувався
бурхливим накопиченням знань по хімії взагалі і хімії живої матерії. Цей період
був періодом боротьби ох поглядів, ідеалістичного і матеріалістичного.
Основи матеріалістичних
поглядів на існування живої матерії були закладені М.В. Ломоносовим, що відкрив
закон зберігання маси речовин. Цим законом був написаний удар по ідеалізму. В
цей час Шеєле, вивчаючи хімічний склад рослинних та тваринних організмів
виділив винну, молочну, щавлеву, лимонну, яблучну кислоти, гліцерин, казеїн.
Революційними стали ідеї
і праці великого російського вченого-хіміка Ф.М.Бутлерова, що створив теорію
будови органічних сполук, відповідно якій атоми та молекули реально існують і
хімічні властивості залежать від будов цих сполук. В 50-і роки ХІХ століття
відомий французький фізіолог О.Бернар виділив з тканини печінки глікоген і
показав, що він є єдиним джерелом накопичення глюкози в організмі.
ІІІ період в історії
біохімії почався з другої половини XIX століття. В цей період біохімія
виділилась як окрема наука, поглибились біохімічні дослідження на основі
революційних відкриттів у фізиці та органічній хімії. До кінця XIX століття
було зареєстровано і вивчено більше ніж 1000 природних і синтезованих
органічних сполук.
Берцеліус
створив основи вчення про каталіз, а наш співвітчизник і основоположник
вітчизняної біохімії О.Я.Данилевський, досліджуючи будову білків, сформулював
ряд положень про первинну структуру білка, йому належить ідея про зворотність
ферментативного каталізу. Він вперше здійснив ферментативний синтез білковоподібних
речовин, розробив ряд методів очистки ферментів.
Російські
вчені внесли великий вклад в формування біохімії, як окремої наукової
дисципліни. Величезний вплив зробили роботи І.М. Сеченова, що вивчав фізіологію
та біохімію дихання, вплив на ці процеси складу їжі, фізіологічного стану
організму, температури і інших факторів.
М.В.
Ненцкий створив першу в країні біохімічну лабораторію при Петербурзькому
університеті. М.І. Лунін відкрив вітаміни, О.М. Бах створив теорію впливу
атмосферного тиску на окисні процеси в організмі і утворення перекісних сполук.
К.А. Тимірязєв і його співробітники вивчали реакції фотосинтезу і мінерального
обміну у рослин.
Ряд
важливих робіт були виконані зарубіжними вченими. Еміль Фішер сформулював
основні положення поліпептидної структури білків, закладеної дослідами О.Я.
Данилевського. І. Бериліус і Є.Старлінг відкрили гормони. Функ виділив вітамін
В1, Саммер одержав перший фермент з бобів сої - уреазу.
Таким
чином третій період є періодом становлення і розвитку біохімії як науки.
ІV
період в історії розвитку біохімії бере свій початок з 40-50 років і
характеризується активним використанням фізико-хімічних методів в біохімічних
дослідженнях. Насамперед, це вивчення процесів молекулярних основ зберігання і
передачі спадкової інформації, механізмів біосинтезу білку, розшифровки
структури окремих білків та нуклеїнових кислот. До числа найважливіших
досягнень цього періоду слід віднести встановлення моделі подвійної спіралі ДНК
і спіралі РНК, розшифровку послідовності амінокислот в молекулі інсуліну А.
Сенгером.
Знання
біохімічних процесів, що протікають у здоровому організмі, дозволяє зрозуміти
причину захворювань (їх етіологію), чітко зрозуміти порушення, що відбуваються
при цьому в організмі (патогенез) і намітили шляхи одужання шляхом використання
різноманітних речовин (лікування).
Клінічна
біохімія - це прикладний розділ біохімії, який вивчає біохімічні процеси в
організмі людини для оцінки стану здоров’я і з’ясування механізму розвитку
хвороби і є окремим розділом клінічної лабораторної діагностики.
Клінічний
потенціал лабораторної діагностики має три джерела. Патобіохімія і
патофізіологія надають відомості про зміни хімічного та клінічного складу,
головним чином, біологічних рідин при патологічних станах організму; фізика,
хімія, біологія є джерелом методичних прийомів для виявлення і кількісного
визначення компонентів біологічних рідин; тісна взаємодія з клінічною медициною
дає можливість перевірити на практиці реальну діагностичну і прогностичну
цінність теоретичних уявлень та аналітичну якість лабораторних методів
дослідження. Раціональний вибір певних методів дозволяє будувати стратегію і
тактику одержання лабораторної інформації про стан організму і використовувати
її з метою діагностики, контролю за ефективністю лікування хворих, а в ряді
випадків - і прогнозу.
.
Принципи уніфікації клініко-біохімічних методів дослідження
Серед
великої кількості сучасних методів клінічної лабораторної діагностики
розрізняють наступні групи методик: хіміко-мікроскопічні методи дослідження
біологічних матеріалів (сечі, калу, мокроти та ін.); методи гематологічних
досліджень; методи дослідження системи гемостазу, методи клінічної
мікробіології; методи клінічної імунології та методи клінічної біохімії.
Завдання
клінічної біохімії полягає не лише у виявленні патобіохімічних порушень, але й
у визначенні функціонального стану організму в цілому, його
компенсаторно-пристосувальних можливостей, деякі питання діагностики можуть
вирішуватись лише завдяки клінічній біохімії, оскільки ряд захворювань, наприклад,
уроджені хвороби, а також деякі інфекційні, наприклад, епідемічний гепатит, не
мають експериментальної моделі. Призначення клініко-біохімічних досліджень:
1) рання
діагностика захворювань;
2) постановка
диференціального діагнозу;
3) визначення
тяжкості перебігу і прогнозу захворювання;
4) контроль
ефективності лікування і профілактики;
5) вивчення
молекулярних механізмів розвитку хвороби.
Основними
об’єктами клініко-біохімічних досліджень здебільшого є біологічні рідини: кров,
плазма, сироватка, лімфа, рідше - інші рідини внутрішніх середовищ організму
(спинномозкова рідина, внутрішньосуглобна рідина та ін.); використовуються
також екскрети, такі як сеча, жовч, слина, шлунковий та кишковий сік, кал, піт,
жіноче молоко, сім’яна рідина; шматочки тканин (біоптати), взяті під час
хірургічних операцій або за допомогою спеціальних пристосувань.
Найпоширенішими
об'єктами біохімічних досліджень є кров і сеча, зрідка аналізуються інші рідини
і екскрети, а також тканини. Основні групи біохімічних показників, які визначаються
в клініці, такі:
1) вміст
макромолекул, мономерів і деяких продуктів їхнього обміну;
2) активність
ферментів та ізоферментів;
3) вміст
вітамінів, коферментів та продуктів їхнього обміну;
4) вміст
води і мінеральних речовин;
5) вміст
позаклітинних регуляторів метаболізму - гормонів, гістогормонів, медіаторів та
продуктів їхнього обміну.
Прагнення
до освоєння нових біохімічних методів дослідження зумовило практичне
використання численних методів визначення одних і тих же біохімічних показників
за допомогою різних методичних прийомів або безлічі варіантів однотипних
методик з різними способами.
4. Особливості біохімічних
досліджень у клінічних та клініко-біохімічних лабораторіях
У наш
час у роботі біохімічних лабораторій мають місце наступні три особливості:
1. Прагнення
до багатоплановості комплексного обстеження хворого з використанням декількох
найбільш інформативних для первинного виду патології біохімічних показників,
так званих констеляцій. Як показує досвід багатьох лабораторій, використання
констеляцій упорядковує працю лікарів - біохіміків і лаборантів, є зручним для
клініцистів, скорочує діагностичний період обстеження хворого.
2. Динамічне
спостереження й обстеження, тобто багаторазове визначення показників.
. Широке
використання функціональних навантажувальних проб.
Останнє
зумовлено тим, що завдання клінічної біохімії полягає не тільки у виявленні
патобіохімічних порушень, але й у визначенні функціонального стану окремих
органів і регуляторних систем, а також оцінці їхніх компесаторно-пристосувальних
можливостей.
5. Принципи біохімічної
діагностики захворювань для визначення функціонального стану організму
Сучасна
клінічна біохімія спрямована до комплексної, багатосторонньої і динамічної
оцінки патологічного процесу на системному рівні. Це досягається завдяки
визначенню багатьох показників, які характеризують обмін білків, вуглеводів,
ліпідів, активність ферментів, гормонів, медіаторів та інших біологічно
активних речовин.
Особливості
обміну речовин у органах і тканинах дозволяють виявити вибірково їх
пошкодження, використовуючи для цього комплекс найбільш специфічних і
найінформативніших тестів. Серед показників, які характеризують стан білкового
обміну найчастіше досліджують вміст загального білка в сироватці крові, білкові
фракції, різні осадові проби. Досліджуються також низькомолекулярні азотисті
речовини: сечовина, сечова кислота, креатин, амінокислоти і пептиди, індикан
сечі. Як показники вуглеводного обміну досліджуються глюкоза в крові й сечі,
вуглеводні компоненти глюкопротеїдів, молочна кислота, сіалові кислоти,
зв’язані з білками гексози тощо.
Показниками
ліпідного обміну є рівень холестерину та його ефірів, триацилгліцеринів,
ліпопротеїнів, неестерифікованих жирних кислот та ін. До неорганічних
компонентів, рівень яких у біорідинах досліджують клініко-біохімічні
лабораторії, належать: натрій, калій, кальцій, магній, залізо, фосфор та
фосфоровмісні речовини, хлор та ін. На відміну від показників, перелічених
вище, для визначення яких використовується колориметрія, при визначенні рівня
неорганічних елементів широкого використовуються інші фізико-хімічні методи.
Як
клініко-біохімічні показники пігментного обміну досліджуються білірубін та його
фракції в сироватці крові, порфірини, порфобіліноген, копропорфірин і
уропорфірин у сечі.
Серед
ферментів, які мають діагностичне значення, найчастіше визначаються в сироватці
крові: амінотрансферази (АСТ і АЛТ), α-амілаза, глюкозо-6-фосфатдегідрогеназа,
креатинкіназа, сорбітолдегідрогеназа, лужна фосфатаза. Визначення концентрації
гормонів у методичному відношенні є найбільш складним розділом клінічної
біохімії. Цим займаються лише спеціальні лабораторії або відділення великих
клінічних лабораторій, оскільки для їх виявлення необхідні певні умови, у тому
числі, використання радіонуклідів.
Використовуються
також колориметричні, хроматографічні і флюориметричні методи. Відносно
доступним та досить інформативним є визначення таких показників:
17-кетостероїдів і 17-оксикортикостероїдів у сечі, адреналіну, норадреналіну,
ванілінмигдальної кислоти в сечі, гістаміну та серотоніну в крові.
У
керівництвах, присвячених використанню біохімічних методів дослідження в
клініці, поряд з описом методик, характерних тому чи іншому виду обміну,
містяться данні про обмінні зміни при різних формах патології. Наприклад,
біохімічні показники при захворюваннях печінки, хворобі Боткіна, гіпертонічній
хворобі, атеросклерозі, інфаркті міокарду, ревматизмі, недостатності
кровообігу, інфекційних захворюваннях різної етіології.
Кожне
захворювання або патологічний стан організму характеризуються сукупністю
біохімічних порушень які відображають різні функції органів і систем організму.
Наприклад, при діагностиці цукрового діабету спочатку визначається вміст
глюкози, кетонових тіл у крові та сечі, а кінцевий діагноз встановлюється за
концентрацією інсуліну в крові.
Одним з
раціональних шляхів діагностики, зокрема при захворюваннях печінки, може бути
використання принципу синдромів, тобто сукупності біохімічних порушень, які
характеризують ту чи іншу функцію печінки. Так, виділяють наступні біохімічні
показники дегенерації, реактивних змін і холестазу. При дегенерації найбільш
показовим є методи визначення активності трансаміназ АЛТ, АСТ. Для реактивних
змін найбільш інформативними є тимолова проба, а для холестазу - білірубін,
активність лужної фосфатази. Надзвичайно велике діагностичне значення має
визначення в динаміці активності ферментів у крові ц при інфаркті міокарду:
лактатдегідрогенази (ЛДГ), креатинфосфокензи (КФК), аспартатамінотрансферази
(АСТ). Ступінь підвищення активності залежить від розмірів інфарктного
осередку. Вже в перші години після інфаркту активність КФК підвищується і
досягає максимум через 24 години. Дещо пізніше підвищується активність АСТ і
ЛДГ.
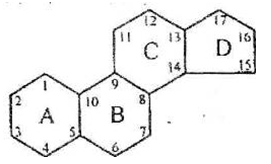
Лекція № 2. ХІМІЯ БІЛКІВ
. Загальна характеристика білків та їх значення в організмі
Білки є найбільш важливими органічними сполуками, що входять
до складу живих організмів. Ще в минулому столітті, вивчаючи склад різних
тваринних і рослинних організмів, вчені виділили речовини, які за своїми
властивостями нагадують білок яйця. Так, при нагріванні вони звертаються. Це і
дало ім назву білки. Підкреслючи головне значення їх в організмі, Н.Мудлер у
1838 році назвав їх протеїнами (від грецького слова перший - protos). Білки
присутьні в кожній молекулі, в будь-якій її частині. В кількісному
співвідношенні, вони займають І місце серед всіх макромолекул, що знаходяться в
жівій клітині. В організмі їх 40-50% по масі. Значення білків для життя було
відмічено Ф. Енгельсом. Він дав визначення життю, як форми існування білкових
молекул.
Тому білкам можна дати таке визначення. Білки - це великий
клас органічних азотовмісних сполук, що присутні в кожній клітині організму і
забезпечують процеси їх життєдіяльності.
Біологічне значення білків
Білки в організмі виконують важливі функції життєдіяльності.
Каталітична функція - одна з основних функцій білків. Вісі
хімічні реакції, шо відбуваються в організмі людини, каталізуються ферментами.
По своїй хімічній природі ферменти є білками.
Структурна функція - білки складають приблизно 1/5 частину
або 20% маси тіла. В м’язах і печінці знаходиться 22% білків, в мозку - 11%, а
в жировій тканині - 6%. Білки відрізняються не тільки по кількості, а й по
структурі та функціях. В крові, наприклад, присутні альбуміни та глобуліни, що
представляють по формі шарики, молекули білку м’язів міозину витягнуті в довги
нитки (фібрили). Основу волосся і нігтів складає керотин - білок жорсткої
структури. Гемоглобін має складну структуру і транспортує кисень до органів,
таканин і СО2 в легені.
Енергетична функція - при повному розпаді одного грама булку
виділяється 17,5 кдж енергії, шо вказує на здатність приймати участь в
забезпеченні організму енергією. Але білки використовуються тільки тоді, коли
недостатньо жирів та вуглеводів, або вони вже використані.
Транспотрна функція - група білків крові має здатність
взаємодіяти з різними сполуками і транспортувати їх. Білками транспотрується
нерозчинні в воді речовини, іони металів, гази або токсичні речовини
(білірубін, жирні кислоти, продукти гниття білків в товстому кишечнику).
Наприклад, гемоглобін транспортує кисень, трансферин - переносить залізо,
ретинол - доставляє клітинам вітамін “А”.
Захисна функція - в ході еволюції організми виробили
різноманітні захисні речовини. Шкіра захищає організм від різких коливань
температури навколишнього середовища, сонячної радіації. Для захисту організм
виробляє антитіла, які сповільнюють патогенну дію мікроорганізмів. По своїй
природі антитіла є білками.
Регуляторна функція - гормони, являючись білками, приймають
участь в регуляції різноманітних процесів в організмі. До них відносяться
гормони гіпофізу, підшлункової залози, паращитовидної залози. Також білки
приймають участь в процесах передачі спадковості. Білки підтримують онкотичний
тиск, входять до складу буферних систем, впливають на кислотно-лужний баланс
організму.
2. Елементарний склад білків
Білки є складними сполуками - полімерами, які складаються з
простих мономерів. Клінічний аналіз показав, що наявність у всіх білках вуглецю
50-55%, водню - 6-7%, кисню - 21-23%, азоту - 15-17%, сірки - 0,2-0,3%.
В складі окремих білків були виявлені фосфор, йод, залізо,
мідь і багато інших макро- та мікроелементів.
Тільки вміст азоту постійний - 16%, а вміст інших елементів
може змінюватися.
Для визначення хімічної природи мономерів білку необхідно
білок розбити на мономери і з’ясувати їх хімічну природу. Білок розділяють за
допомогою гідролізу - кип’ятіння білка з сильними мінеральними кислотами
протягом довгого часу. Природу виділених мономерів з’ясували за допомогою різноманітних
хімічних реакцій. В результаті було встановлено, що мономерами білквів є
амінокислоти.
. Амінокислоти - класифікація, властивості, біологічна роль у
складі білків
В різноманітних об’єктах природи було знайденодо 200
різноманітних амінокислот. В організмі людини їх приблизно 60, а в склад білків
входить тільки 20. Амінокислоти - це органічні кислоти, у яких атом водню α-вуглецю заміщений на
аміногрупу NН2.
Загальна формула:
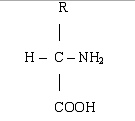
В складі всіх амінокислот є функціональні групи - СН2,
NН2, - СООН, а білкові ланцюги амінокислот різноманітні, хімічна
природа радикалів різномианітна: від атома водню до циклічних сполук. Радикали
визначають стуктурні і функціональні особливості амінокислот.
Якщо біля α-вуглецю всі валентності
заміщені різними групами, то такий атом називають асиметричним, а амінокислота
буде оптично активною, тобто здатною повертати площину поляризованого світла і
мати стериоізомери. Наприклад, в природі існує L-аланін
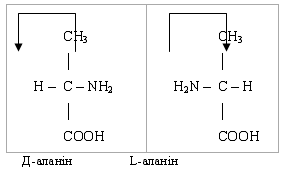
Всі природні амінокислоти L-ряду.
Амінокислоти в водному розчині знаходяться в іонізованому
вигляді за рахунок дисоціації груп СООН і NН2, а також
функціональніх груп, що входять до складу радікалів. Вони мають амфотерні
властивості і можуть виступати як донори, так і акцептори протонів.
Амінокислоти в залежності від стурктури поділяють на декілька
груп: ациклічні, що не мають в своєму складі циклічних групіровок.Їх розділяють
на моноамінокарбонові, моноамінодикарбонові, диаміномонокарбонові.
Моноамінокарбонові мають в своєму складі 1аміно і 1
карбоксильну групу. В водному розчині вони нейтральні. До них належить гліцин,
аланін, серин, треонін, метионін.
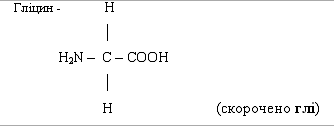
Гліцин не є оптично активним, тому що відсутній асиметричний
атом вуглецю. Гліцин приймає участь в синтезі нуклеїнових кислот, жовчних
кислот, гема, необхідний для знезараження в
печінці токсичних речовин.
Аланін (ала)
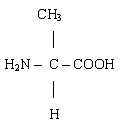
Аланін приймає участь в різноманітних процесах обміну вуглеводів
і енергії.
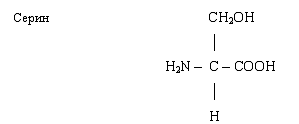
аміно-β-гідроксопропіонова кислота
відноситься до складу гідрок-сокислот, т.ч. має гідроксильну групу. Входе до
складу ферментів, в склад білка молока - казеїну.
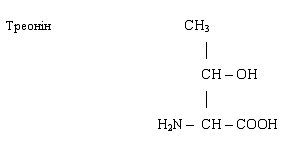
α-аміно-β-гідроксомасляна кислота.
Треонін приймає участь в синтезі білку, є незамінною
амінокислотою.
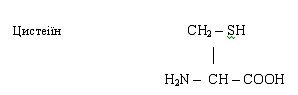
α-аміно-β-тіопропіонова кислота.
Має в своєму складі атом сірки. Значення цистеїну полягає в
тому, що група - SH може легко окислюватись і захищати організм від речовин з
високою окислювальною здатністю (вільних радікалів, радіацї, токсинів).
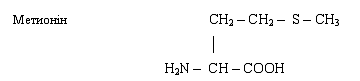
α-аміно-γ-тіометилмасляна кислота.
Метионін характеризується рухливою групою - СН3,
яка використовується для синтезу холину, креатиніну, тиміну, адреналіну.
Моноамінодикарбонові амінокислоти мають в своєму складі одну
аміно- і дві карбоксильні групи, в водному розчині мають кисле середовище.
До них відносяться аспарагінова і глутамінова амінокислоти.
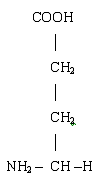
Глутамінова кислота
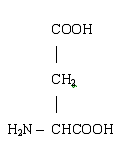
Аспарагінова кислота
Вони приймають участь в біосинтезі білку, є тормозними
медіаторами нервової системи, виконують антитоксичну функцію.
Диаміномонокарбонові кислоти.
Валін, лейцин, ізолейцин представляють собою
розгалуджені диаміномо-нокарбонові амінокислоти, які приймають активну участь в
обміні речовин і
не синтезуються в організмі, тобто є незамінними амінокислотами.
В водному розчині вони мають лужне середовище за рахунок 2
аміногруп. До них відноситься лізин, який необхідний для біосинтезу білку, в
тому числі гістонів, що входять до складу
нуклеопротеїдів. Аргін приймає участь в синтезі сечовини.
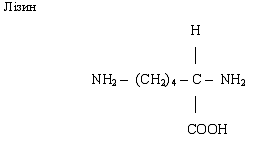
Циклічні амінокислоти
Ці амінокислоти мають в своєму складі ароматичне ядро і, як
правило, не синтезуються в організмі і являються незамінними амінокислотами.
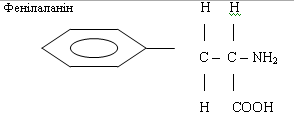
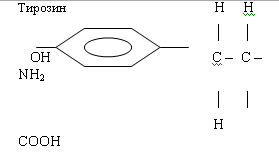
Вони активно приймають участь в різноманітних обмінних процесах. Фенілаланін
служить джерелом синтезу тирозиту, що є попередником гормонів.
. Структури білків
При вивченні складу білків було встановлено, що всі вони
побудовані по одному принципу і мають 4 рівні організації: первинну, вторинну,
третинну, а окремі і четвертинну структуру.
Первинна структура - представляє собою лінійний ланцюг
амінокислот, розташованих в певній послідовності і з’єднаних між собою
пептидними зв’язками. Пептидний зв’язок утворюється за рахунок α-карбоксильної групи однієї
амінокислоти і α-аміногруп другої.
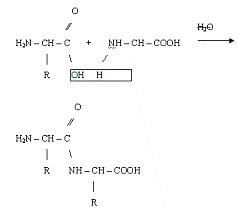
Сполуки, що складаються з двох амінокислот називаються
дипиптидами, з трьох - трипептидами. Ланцюги, що складаються з багатьох
амінокислот називаються поліпептидами.
Значний вклад в розвиток вчення про структуру білків вніс
А.Я. Данилевський, який вперше доказав наявність у білка пептидного зв’язку, а
Е.Фішер був перший, хто синтезував поліпептид, що складався з 19 амінокислот.
Зараз встановлена первинна структура деяких білків.
Наприклад, виявлена послідовність 51 амінокислоти білку інсуліну, що дозволило
одержати його штучним шляхом.
Таким чином, слід зазначити, що різноманітність білків
організму залежить не тільки від кількості амінокислот, що входять до складу
білків, а й від послідовності з’єднання амінокислот між собою.
В останні роки увагу клініцистів привернули пептиди, що
складаються з невеликої кількості амінокислот і мають велику біологічну
активність. Наприклад, у задній долі гіпофізу знаходяться 2 пептиди, що
складаються з 9 амінокислот і є гормонами. Це вазопресин і окситоцин.
Вазопресин стимулює кров’яний тиск і збільшує реасорбцію води в нирках.
Недостатність його приводить до нецукрового діабету, при якому виділяється
велика кількість сильно розведеної сечі.
Окситоцин стимулює скорочення гладкої мускулатури матки і
використовується в акушерстві для стимуляції родової діяльності.
Вторинна структура - представляє собою упорядковану і
компактну упаковку поліпептидного ланцюга. По конфігурації вона буває у вигляді
α-спіралі і β-складчатої структури. Основу α-спіралі складає пептидний
ланцюг, а радикали амінокислот спрямовані зовні, розташовуючись по спіралі.
Зовні α-спіраль схожа на злегка розтягнуту спіраль електроплитки.
Така форма фарактерна для білків, що мають один поліпептидний ланцюг.
Складчата β-структура представляє собою
плоску форму. Вона характерна для білків, що мають декілька поліпептидних
ланцюгів, розташованих паралельно. β-структура зустрічається в
таких білках, як трипсин, рибонуклеаза, керотин волосся, колаген, сухожилля,
які гірше розчинні у воді.
Утворення вторинної структури забезпечується водневим
зв’язком. Вона утворюється при участі атому водню.
Третинна структура - представляє собою більш компактне
просторове розташування поліпептидного ланцюга, точніше його вторинної
структури. Форма третинної структури може бути різноманітна і визначається тим,
які функції виконує білок в організмі. Третинна стурктура забезпечує виконання
білком його основних функцій і може бути представлена у вигляді кульки у
глобулярних білків і вигляді ниток (фібрил) у фібрилярних білків, наприклад,
м’язів.
В організмі є більш складні по структурі білки, що
складаються з декількох субодиниць, кожна з яких представляє собою молекулу
білку зі своєю специфічною стуктурою. Таке об’єднання субодиниць називають
четвертинною сткуктурою. Особливість білків з четвертинною стуктурою полягає в
тому, що вони здатні проявляти свої функції і властивості при наявності всіх
субодиниць.
Видалення хоча б однієї субодиниці приводить до втати
властивостей білку. Четвертинна структура найчастіше зустрічається у ферментів.
5. Фізико-хімічні властивості білків
Білки мають високу молекулярну масу, розчинні у воді, здатні
до набухання, характеризуються оптичною активністю, рухливістю в електричному
полі.
Білки активно вступають у хімічні реакції. Ця властивість
зв’язана з тим, що амінокислоти, що входять до складу білків мають в своєму
складі різні функціональні групи, які здатні вступати в реакції з другими
речовинами. Важливо, що такі взаємодії проходять і в середені білкової
молекули, в результаті чого утворюється пептидний, водневий, дисульфідний
зв’язок. До радикалів амінокислот можуть приєднуватись різноманітні сполуки і
іони, що забезпечує транспорт їх по крові.
Білки мають високу молекулярну масу, вони - полімери, що
складаються з багатьох сотень і тисяч мономерів - амінокислот.
Молекулярна маса знаходиться в межах від 10 тисяч до 1 млн.
Так, в складі рибонуклеази міститься 124 амінокислотні залишки і його
молекулярна маса складає 14 тис., гемоглобін має молекуляну масу 64 тис., γ-глобуліни складаються з 1250
амінокислот і мають молекуляну масу 150 тис., а молеку-ляну маса
глутаматдегідрогенази перевищує 1 млн.
Важливою властивістю білків є їх здатність проявляти як
кислі, так і основні властивості, тобто виступати в ролі амфотерних сполук.
Це забезпечується за рахунок різноманітних дисоціюючих
групіровок, що входять в радикали амінокислот. Наприклад, кислотні властивості
білку придають карбоксильні групи аспарагінової та глутамінової амінокислот, а
лужні - радикали аргініну, лізину, гістидіну. Чим більше дикарбонових
амінокислот входить до складу білку, тим сильніше проявляються його кислотні
властивості і навпаки. Ці функціональні групи мають і електричні заряди, що
формують загальний заряд білкової молекули. В білках, де переважають
аспарагінова та глутамінова амінокислоти білки будуть заряджені негативно,
надлишок основних амінокислот надає білкам позитивний заряд.
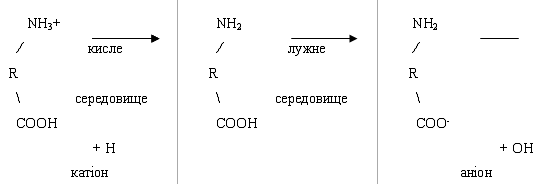
Таким чином, фактором, що визначає поведінку білка, як
катіона чи аніона, є реакція середовища,котра визначається концентрацією іонів
водню і величиною рН. Але при деяких рН число позитивних і негативних зарядів
зрівнюється і молекула стає електронейтральною, тобто вона не буде рухатись в
електричному полі. Таке значення рН середовища називається ізоелектричною
точкою білків. В цій рН білок знаходиться в найбільш не стійкому стані і при
коливаннях рН в кислу або лужну сторону легко випадає в осад. Для більшості
природних білків ізоелектрична точка знаходиться в слабо-кислому середовищі (рН
4,8-5,4), що свідчить про переважання в їх складі дикарбонових амінокислот.
Властивіть амфотерності полягає в основі буферних
властивостей білків і їх участі в регуляції рН крові.
Амфотерність білків використовується для розділення їх на
фракції, наприклад, методом електрофорезу з метою діагностики ряду захворювань
і контролю стану хворого. При різних патологічних станах функціональний склад
білків суттєво змінюється.
Важливою властивістю білків є їх здатність адсорбувати на
своїй поверхні деякі речовини та іони (гормони, вітаміни, залізо, мідь і таке
інше), котрі або погано розчинені у воді, або є токсичними (білірубін, вільні
жирні кислоти). Білки транспортують їх по крові до місця подальших перетворень
або знезараження. Водні розчини білків мають свої особливості. Білки добре
розчинні у воді, тобто є гідрофільними. Це означає, що молекули білку як
заряджені частинки, притягують до себе диполі води, котрі розташовуються
навколо булкової молекули і утворюють водну або гідратну оболонку. Ця оболонка
захищає молекули білку від склеювання і випадання в осад.
Величина гідратної оболонки залежить від структури білку,
наприклад, альбуміни більш легко зв’язуються з молекулами води і мають відносну
велику гідратну оболонку, тоді як глобулін, фібриноген приєднують воду значно
гірше і гідратна оболонка їх менша. Таким чином, стійкість водного розчину
білку визначається двома факторами: наявністю електричного заряду, білкової
молекули і гідратною оболонкою. При видаленні цих факторів білок випадає в
осад. Даний процес може бути зворотнім і незворотнім.
Зворотній осад білків (висолювання) - це випадвання білку в
осад під дією речовин, після видалення яких він знову повертається в свій
попередній (нативний) стан. Для висолювання білків використовується солі лужних
і ліужно-земельних металів. Найбільш часто використовують сульфат натрію чи
амонію.
Ці солі видаляють гідратну оболонку і знімають заряд. Між
величиною водної оболонки білкових молекул і концентрацією солей існує пряма
залежність: цим менша гідратна оболонка, тим мене потрібно солей. Так глобуліни
мають великі і важкі молекули і невилику водну оболонку і випадають в осад при
неповному насиченні солями, а альбуміни, як більш мілкі молекули з більшою
водною оболонкою при повному насиченні.
Незворотний осад білків зв’язаний з глибокими
внутришньомолеку-лярними змінами структури білку, що приводить до втрати
природних властивостей (розчинності, біологічної активності). Такий білок
називається денатурованим, а процес денатурацією. Денатурація білків полягає в
основі лікуванні отруєнь важкими металами, коли хворому вводять молоко, або
сирі яйця для того, щоб метали, депатуруючі білки молока та яєць, адсорбувалися
на їх поверхні.
Розмір білкових молекул знаходиться в межах від 1 мкм до 1
нм, тому вони утворюють колоїдні розчини. Ці розчини характеризуються великою
вязкістю, здатністю розсіювати промені світла, не проходять через напівпрониклі
мембрани і мають деякі інші властивості.
6. Класифікація білків
Прості білки та їх представники, склад, біологічна роль в
організмі
Відома велика кількість білків рослинного і тваринного
походження, що відрізняються за своїм складом та біологічною роллю в організмі.
Для систематизації та вивчення їх запропоновано декілька класифікацій:
1. По формі молекул, тобто просторова будова.
2. Фізико-хімічні властивості.
. Хімічний склад білків.
По формі молекул білки класифікують на глобулярні і
фібрілярні.
Глобілярні білки. Більшість з них розчинні у воді. Це
альбуміни та глобуліни сироватки крові, білки молока, яєць, які мають форму
кулі. Правильної форми глобули не бувають, найчастіше вони мають еліпсоїдну або
овальну форму.
Фібрілярні білки - велика група білків, такі як білок волосся
- керотин, білок шовку - фіброгін, білок м’язів - міозин, білок крові - фібрин,
мають витягнуту або фібрилярну структуру. Довжина молекул в декілька разів
перевищує діаметр.
Між двома крайними формами білків є велика кількість
перехідних форм - від шароподібної до веретеноподібної і волокнистої. За
фізико-хімічними властивостями білки класифікують на прості і складні. Прості
білки складаються тільки з залишків амінокислот. Складні - мають білкову
частину, що складається із залишків амінокислот, і небілкову, що може бути
представлена іонами металів, ліпідами, вуглеводами,
залишком фосфорної кислоти.
Прості білки - альбуміни широко поширені в тваринних та
рослинних організмах. Є основною частиною цитоплазми більшості клітин,
складовою частиною крові, м’язів, молока. В залежності від походження їх
називають лактоальбумінами і сіроальбумінами.
В крові вищіх тварин і людей альбуміни складають більшу
частину білків плазми. Добре розчинні у воді і розчинах солей, характеризуються
великою гідрофільністю та дисперсністю. Мають відносно малу молекулярну масу 60
т.в.о. Приймають участь у підтримці онкотичного тиску крові, транспортують у
крові різні речовини (вітаміни, іони металів, гормони), виконують антитоксичну
функцію.
Глобуліни - дуже поширені в природі білки. На відміну від
альбумінів, майже не розчинні в воді, вони більш грубо дисперсні, мають більшу
молекулярну масу 160-180 т. в.о. В організмі людини та тварин вони виконують
роль антитіл. Білок глобулінового типу фібриноген формує згусток крові. При
допомозі електрофорезу глобуліни можна розділити на А, α1,
α2, β,
γ фракції.
Гістони і протаніни - представляють собою основні білки ядра
клітини і складають основну масу білкової частини нуклеопротеїдів.
Гістони стабілізують молекулу ДНК, підтримують унікальну
структуру ДНК в ядрі, що є умовою для біосинтезу білку.
Керотини складають основну масу рогової тканини епідермісу. В
їх структуру входить багато сірковмісних сполук.
Колаген - є основною складовою частиною з’єднувальної
тканини. Більшість його знаходиться в сухожиллях, зв’язках, шкірі, кістках,
хрящах.
Еластин - білок з’єднувальної тканини, який є хімічно більш
активний.
. Складні білки, їх представники,склад, біологічна роль в
організмі
Складні білки складаються з простого білку та небілкової
частини. Класифікують за небілковою частиною.
Нуклеопротеїди. Небілкова частина представлена нуклеїновими
кислотами РНК та ДНК. Нуклеїнові кислоти приймають участь у передачі спадкової
інформації. Білкова частина представлена протамінами та гістонами. Гістони
забезпечують компактну упаковку ДНК та зберігання спадкової інформації . ДНК не
може в складі нуклеопротеїда виконувати своєї основної біологічної функції -
передавати закодовану спадкову інформацію без стабілізації протамінами та
гістонами.
Хромопротеїди - небілкова частина, зафарбована: гемоглобін,
міоглобін (білок м’язів), деякі ферменти каталази, пероксидази, цитохроми, а
також хлорофіл.
Фосфопротеїди - це білки, що в небілковій частині мають
залишок фосфорної кислоти. Представниками є казеїн молока, вінелін (білок
жовтка яєць), іхтулін (білок ікри риб). Мають надзвичайно велике значення для
розвитку організмів. У дорослих форм присутні в кістках та нервовій системі.
Ліпопротеїди - небілкова (простетична) група представлена
ліпідами. Вони умовно поділяються на розчинні у воді ліпопротеїди і
протеоліпіди - жиророзчинні компоненти кліткових мембран.
Глікопротеїди. Ця назва об’єднує велику кількість сполук, що
є комплексами білків з вуглеводами та їх похідними (гексуронова кислота, глікогенні амінокислоти). Група сполук, в яких
білкова частина відносно слаба слабо зв’язана з вуглеводною називається
мукопротеїдами (хондроітинсуль-фати, гіалуронові кислоти).
Глікопротеїди входять до складу клітинних мембран, приймають
участь у транспорті різних речовин, в процесах звертання крові, імунітету,
являються складовими слизу і секретів шлунково-кишкового тракту. У арктичніих
риб вони виконують роль антифрізів.
Металопротеїди - комплекси білків з важкими металами.
Типічний металопротеїд феритин - кристалічний білок, розчинний у воді, містить
до 20% Fе. Феритин є основною формою запасу заліза в організмі і синтезується в
печінці, там він відкладається про запас. Плазма людини містить розчинний білок
трансферин, що входить у фракцію глобулінів вміст Fе - 0,13%. Цей білок
філіологічний переносчик Fе в організмі.
Церулоплазмін містить 0,34% міді. При проведенні
електрофорезу білок виявляється в α-фракції. Це білок гострої
фази, зафарбований в голубий колір.
8. Гемоглобін, його види і значення в організмі
Гемоглобін (Нb) - основна складова частина еритроцитів.
Складається Нb з білку глобіну (96%) й простетичної частини - гема (4%
молекули). Гем предстваляє собою координаційну сполуку атому заліза з циклічною
сполукою протопорфирином. В склад гему входить Fе2+. В склад
молекули гемоглобіну входить 4 гема, атом заліза координаційно зв’язаний з 4
атомами азоту пірольних кілець. Мr Нb=64458. Молекула
має форму стероїда 6,4х5нм, на поверхні якого розташовані 4 гідрофобні
заглиблення, що містять гем, який має форму диску. Гем для всіх гемоглобінів
однаковий і структурні зміни цього хромопротеїду зумовлені структурою білкової
частини - глобіну.
Глобіни можуть мати різний склад, розрізнятися складом
аміноксилот та їх послідовністю в поліпептидному ланцюзі, а також
співвідношенням поліпеп-тидних лінцюгів (α і β).
З загальної кількості заліза організму (4 гр) приблизно 50%
припадає на гем.
Механіз переносу кисню гемоглобіном
Засновником вчення про дихальну функцію крові є російський
фізіолог І.Н. Сеченов. Вивчаючи залежність між складом повітря в легенях і
вмісту СО2 і О2 в крові, Сеченов вперше доказав, що СО2
переноситься не плазмою, а Нb.
Повітря, яке вдихає людина, містить 20,9% О2 і
0,03% СО2, тиск О2 перевищує тиск СО2.
Така різниця сприяє дифузії кисню і зворотньому сполу-ченню його з
гемоглобіном. Кожна одиниця гемоглобіну може зв’язувати одну молекулу О2,
утворюючи НbО2 - оксигемоглобін.
Оскільки приєднання молекулярного кисню не пов’язано зі
зміною валентності гему і не є окисленням, процес називається оксигенацією.
В Нb декілька місць зв’язування молекулярного кисню і
насищення його киснем відбувається не одночасно. Зі збільшенням місць, занятих
киснем, спорідненість до нього вільних електронів зростає, що прискорює процес
оксигенації, такий процес має кооперативний характер.
При дисоціації НbО2 його спорідненість до кожної
слідуючої молекули О2 зменщується, що сприяє вивільненню О2
в тканинах.
Серед факторів, що впливають на спорідненість Нb до О2
має значення концентрація протонів водню, концентрації СО2,
органічних фосфатів. Оксигенація супроводжується вівільненням протонів Н з
оксигемоглобіну в середовище, а деоксигенація приєднання протонів до гемоглобіну,
що дуже важливо в капілярах тканин, куди поступає велика кількість продуктів
метаболізму.
В артеріальній крові, де О2 міститься 19-20%, тиск
досягає 75-100мм.рт.ст., а в тканинній рідині 20-40 мм.рт.ст., що сприяє
дисоціації оксигемоглобіну і засвоєння О2 тканинами. Кисень реагує в
тканинах з дихальим залізовмістним пігментом цитохромоксидазою і через систему
ферментів окислює водень субстратів з утворенням НbО2.
Утворення НbО2 залежить від парціального тиску
кисню у повітрі. Коли тиск знижується, кількість НbО2 зменшується.
Це явище називається гіпокксемією. При недостатку О2 в в крові може
виникнути недостаток його в тканинах - гіпоксія. Розрахунками встановлено, що
при наявності в повітрі 20,9% кисню приблизно 99% Нb зв’язується в оксигемоглобін,
при наявності 10% О2 - 90% Нb зв’язується в оксигемоглобін, при 2,5%
О2 -тільки 50% Нb зв’язується в оксигемоглобін. Це свідчить про те,
що в організмі людини є величезні адаптаційні можливості. І.М. Сеченов доказав,
що зменшення парціального тиску у альвеолах від 80 до 20 мм.рт.ст. може
викликати таке зниження кількості гемоглобіну. що призводить до смерті.
Границею тиску, при якому може існувати людина є 30% від
норми атмосферного тиску. Це приблизно 8 км над рівнем моря. Основна причина
гірської хвороби - недостаток кисню, але свою роль відіграє СО2 і -
гіпоксемія. В тяжких умовах гіпоксемія може перейти в аноксію, зупинитися
дихання в тканинах і наступить смерть.
Метгемоглобін
Містить в своєму складі Fе3+. В молекулі О2 замінюється
гідроксильною групою ОН-, і він не може транспортувати кисень. В
крові дорослої людини невелика кількість його 0,3-3 г/л. Фізіологічно він грає
захисну роль, зв’язує і знезаражує ціаніди, перетворюючи їх в нешкідливий
комплекс, в крові може зв’язувати до 1/3 ціанідних ядів. Крім того знезаражує сірководень, масляну кислоту, тобто
має виражену антиоксидантну дію, руйнує токсичні для організму перекисні
сполуки. При цьому НbН відновлюється в нормальний гемоглобін. Здатність
відновлювати НbН має аскорбінова кислота (вітамін С).
Карбоксигемоглобін
Утворюється при отруєнні СО. Оскільки спорідненість СО до Нb
в 300 разів вижче ніж у О2 , то навіть в невеликих кількостях він
швидко з’єднується з Нb. Так, при концентрації СО у повітрі 0,07%, 50% Нb
перетворюється в карбоксигемоглобін, а при наявності у повітрі 1% СО фактично
весь Нb перетворюється у карбоксигемоглобін. У боротьбі з гіпоксемією
використовується оксигенотерапія. Вона часто поєднується з добавкою до О2 СО2
(95% О2 + 5%СО2 ). Підвищення тиску О2 у
крові сприяє відновленню гемоглобіну з метогемоглобіну і карбоксигемоглобіну, а
СО2 подразнює дихальний центр, підсилює вентиляцію легень і
надходження О2 в тканини.
Міоглобін - це хромопротеїд м’язів, він складається тільки з
одного ланцюга анологічного субодиниці гемоглобіну. Це дихальний пігмент
м’язів, він значно краще з’єднується з киснем, але трудніше його віддає.
Міоглобін створює запаси кисню в м’язах, де його кількість може досягти 14%
всього кисню організму. Це має велике значення для роботи серцевого м’яза.
Високий вміст міоглобіну в організмах морських ссавців.
Лекція № 3. ХІМІЯ
ВУГЛЕВОДІВ
1. Загальна характеристика вуглеводів та їх біологічна
роль в організмі людини
Структура властивості та функції вуглеводів в організмі
Вуглеводи - найбільш поширені органічні речовини в природі.
Вони становлять основну масу рослин (біля 75-85%) у перерахунку на суху масу
речовини та більшу частину раціону людини, є основним джерелом енергії
(3000-3500 ккал). Приблизно 2/3 енергії забезпечують вуглеводи. Протягом дня
людина в сердньому споживає 110-130г. білків, близько 80-100г. жирів, 450-500г.
вуглеводів. Можуть бути відхилення від середніх величин в залежності від умов
праці та побуту, віку, клімату.
Вуглеводи здатні відкладатися у вигляді крохмалю в рослинах і
глікогену в організмі людини і тварин. Ці запаси розходуються по мірі
необхідності. В організмі людини вуглеводи відкладаються в печінці та м’язах,
які є його депо.
Основні функції вуглеводів
Енергетична. Вуглеводи є одним з основних джерел енергії для
організму, забезпечуючи не менше 60% його енергозатрат. Для діяльності мозку,
клітин крові, мозкової речовини нирок практично вся енергія постачається за
рахунок окислення глюкози. При повному розпаді 1г. глюкози виділяється 17,5
КДж/моль (4,1 ккал/моль) енергії.
Пластична. У всіх клітинах організму знаходяться вуглеводи та
їх похідні. Вони входять до складу біологічних мембран і органоїдів клітин,
приймають участь в утворенні ферментів, нуклеопротеїдів. Від особливостей
структури вуглеводів залежать фізико-хімічні властивості і біологічні
особливості ДНК та РНК. Необхідно відмітити, що пентози містяться в таких
нуклеотидах як АТФ, АМФ, ГТФ, в яких резервується енергія обміну речовин.
Захисна. В’язкі секрети (слиз), що виділяються залозами
внутрішньої секреції, багаті вуглеводами та їх похідними (мукополісахариди).
Вони захищують внутрішні стінки органів шлунково-кишкового тракту, носа,
статевих органів від механічних та хімічних подразнень, проникнення патогенних
мікроорганізмів.
Регуляторна. Їжа людини містить значну кількість клітковини,
груба структура якої викликає механічні подразення слизової оболонки шлунка і
кишечника, приймають участь у регуляції акту перистальтики.
Специфічна. Окремі вуглеводи виконують в організмі особливі
функції: приймають участь у проведенні нервових імпульсів, являються
кофакторами ферментів, гіалуронова кислота зв’язує міжклітинну воду і катіони,
регулюючи міжклітинний осмотичний тиск.
Елементарний склад вуглеводів
Вуглеводи складаються з слідуючих хімічних елементів:
вуглецю, водню, кисню. Загальна формула СnН2nОn
може бути записана Сn(Н2О)n. Вуглеводи
представляють собою сполуки, що складаються з вуглецю та води. Однак серед
вуглеводів зустрічаються сполуки, що не відповідають цій формулі, наприклад,
рамноза С6Н12О5. В той же час відомі речовини хімічний
склад яких підпорядковується цій формулі, але по своїх властивостях вони не
відносяться до вуглеводів, наприклад, оцтова кислота СН3СООН - С2(Н2О)2.
Тому назва вуглеводи, досить умовна і не відповідає формулі. Запропоновано
сучасну назву “глюциди”.
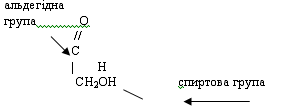
Таким чином, вуглеводи - це органічні речовини, що
представляють собою альдегіди або кетони багатоатомних спиртів.
2. Класифікація вуглеводів
Вуглеводи діляться на 3 групи - моносахариди, дисахариди,
полісахариди.
Моносахариди. Складаються з однієї молекули і представляють
собою тверді, кристалічні речовини, розчинні у воді і солодкі на смак. В певних
умовах вони легко окислюються, перетворюючись у відповідні кислоти, а при відновленні
- у відповідні спирти.
Класифікують в залежності від кількості у їх складі атомів
вуглецю: тріози, тетрози, пентози, гексози.
З тріоз в організмі має значення гліцериновий альдегід і
діоксиацетон, які є проміжними продуктами розпаду глюкози і приймають участь у
синтезі жирів. З тетроз в процесі обміну речовин активно приймає участь
еритроза. Пентози широко представлені в організмі. Рибоза і дезоксирибоза -
складові частини нуклеїнових кислот РНК і ДНК.
Гексози найбільш широко представлені в тваринному та
рослинному світі і грають важливу роль в процесах обміну речовин та енергії.
До них відносяться глюкоза, фруктоза, галактоза.
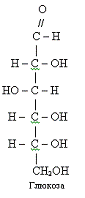

Глюкоза (виноградний цукор) являється основним вуглеводом
рослин і тварин. Вона є основним джерелом енергії, складає основу багатьох
олігосахаридів, приймає участь у підтримці осмотичного тиску. Утворені під час
розпаду глюкози проміжні продукти використовуються для синтезу жирів та
амінокислот. По рівню глюкози в крові судять про стан енергетичного обміну в
організмі. Глюкуронова кислота, що утворюється під час окислення глюкози,
виконує в організмі антитоксичну функцію.
Галактоза. Просторовий ізомер глюкози, відрізняється
розташуванням групи - ОН біля четвертого вуглецевого атому. Входить у склад
лактози, полісахаридів та гліколіпідів. Галактоза в печінці ізомеризується у
глюкозу.
За хімічною будовою глюкоза і галактоза являються
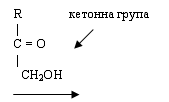
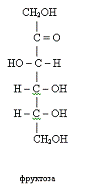
альдегідоспиртами, фруктоза - кетоноспиртом. Глюкоза відновлює метали з їх
оксидів, фруктоза - таких властивостей не має. Фруктоза приблизно в 2 рази
повільніше всмоктується у кишечнику ніж глюкоза.
Моносахариди, що складаються з п’яти і більше атомів вуглецю,
в розчинах існують у вигляді замкнутих циклічних структур, що утворюються за
рахунок внутрішньомолекулярних переміщень атомів. При цьому перший вуглеводний
атом стає асиметричним, що передбачає наявність двох ізомерів моносахаридів - α
і β,
які в організмі
можуть взаємно перетворюватись. Таке явище носить назву мутиротації.
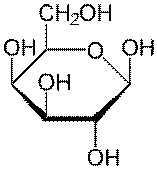
При окисленні шостого вуглеводного атома в молекулі утворюється
гексуронові кислоти: з глюкози - глюкуронова, з галактози - галактуронова.
Глюкуронова кислота приймає акутивну участь в обмінних процесах в
організмі, наприклад, у знезараженні токсичних продуктів, входить у склад
мукополісахаридів.
При заміні в молекулі гексоз ОН- групи другого вуглецевого атому на
аміногрупу утворюються аміносахариди - гексозоаміни: з глюкози синтезується
глюкозоамін, з галактози - галактозоамін, що входять у склад клітинних оболонок
і мукополісахаридів, як у вільному вигляді, так і в сполуці з оцтовою кислотою.
В процесах обміну речовин вуглеводи приймають участь не в вільному
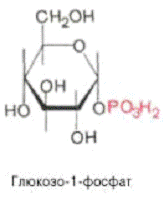
вигляді, а в активованій формі - у вигляді фосфорних ефірів. Активація
забезпечується за рахунок АТФ (макроергічної сполуки), що передає свою кінцеву
фосфатну групу молекулі гексози.
. Олігосахариди (дисахариди)
Олігосахариди мають у своєму складі дві і більше молекул моносахаридів.
Вони зустрічаються в клітинах і біологічних рідинах як у вільному вигляді так і
в сполуках з білками. Для організму найбільше значення мають дисахариди:
сахароза, мальтоза, лактоза. Ці вуглеводи виконують енергетичну функцію. Вони
входять в склад клітин, приймають участь у впізнаванні клітин.
Сахароза - складається з молекул глюкози і фруктози. Вона є рослинним
продуктом і важливим компонентом їжі, має солодкий смак порівняно з іншими
дисахаридами та глюкозою.
Лактоза (молочний цукор). Побудована з глюкози та галактози,
синтезуються в молочних залозах у період лактації.
Мальтоза складаються з двох молекул глюкози і являється основним
структурним компонентом крохмалю і глікогена.
. Полісахариди
Полісахариди - високомолекулярні вуглеводи, що складаються з великої
кількості моносахаридів. Вони є гідрофільними сполуками і при розчинені у воді
утворюють колоїдні розчини.
Полісахариди розділяють на гомо- і гетерополісахариди.
Гомополісахариди. Мають у своєму складі моносахариди одного виду. Так,
крохмаль і глікоген побудовані тільки з молекул глюкози, інулін - фруктози.
Гомополісахариди мають досить розгалуджену структуру і представляють суміш двох
полімерів - амілози та амілопектину.
Амілоза - складається з 60-300 залишків глюкози, з’єднаних між собою за
допомогою кисневих містків у ланцюг. Амілоза розчинна у гарячій воді і дає з
йодом синє забарвлення.
Амінопектин - розгалуджений полімер, що складається як з
неразголуджених так і з розгалуджених лінійних структур. Здатний тільки до
набухання.
Крохмаль (полісахарид рослин) - складається з декількох тисяч залишків
глюкози, 10-20% яких представлені амілозою, 80-90% амілопектином. Крохмаль
нерозчинний у холодній воді, а в гарячій утворює колоїдні розчини, що
називаються крохмальним клейстером.
Клітковина або глюкоза - самий розповсюджений на землі вуглевод рослин,
кількість його приблизно 50 кг на кожного жителя планети. Клітковина
представляє собою лінійний полісахарид, що складається з 1000 і більше залишків
глюкози. В організмі клітковина приймає участь в активації моторики кишечника,
стимулює виділення травних соків.
Глікоген тваринний крохмаль є основним запасним вуглеводом організму
людини. Він складається приблизно з 30 000 залишків глюкози, які утворюють
розгалуджену структуру.
В найбільшій кількості глікоген накопичується в печінці та м’язовій
тканині, в тому числі у м’язах сердця. При нестачі глюкози він швидко
розщеплюється і відновлює її нормальний рівень у крові.
В клітинах глікоген зв’язаний з білками цитоплазми і частково - з
внутрішньоклітинними мембранами.
. Гетерополісахариди (глюкозоамінглікани або мукополісахариди)
Приставка муко- вказує на те, що вони вперше були виділені з муцину.
Складаються з різного виду моносахаридів (глюкози, галактози) та їх похідних
(аміносахаридів, гексуронових кислот). В їх складі виявлені і інші речовини:
азотисті основи, органічні кислоти.
Мукополісахариди представлють собою желеподібні, липкі речовини. Вони
виконують різні функції, в тому числі структурну, захисну, регуляторну.
Мукополісахариди складають основну масу міжклітинної речовини тканин, входять
до складу шкіри, хрящів, скловидного тіла ока. В організмі зустрічаються у
комплексі з білками (протеоглікани та глікопротеїди) і жирами (гліколіпіди), в
яких на долю полісахаридів приходиться основна частина молекули (до 90% і більше).
Для організму мають значення слідуючі з них: гіалуронова кислота - основна
частина міжклітинної речовини, біологічний цемент, який з’єднує клітини,
заповнюючи увесь міжклітинний простір. Вона також виконує роль біологічного
фільтру, який затримує мікроби і запобігає їх проникненню у клітини, приймає
участь у обміні води в організмі.
Слід відмітити, що гіалуронова кислота розщеплюється під дією
специфічного фермента гіалурононідази. При цьому порушується структура
міжклітинної речовини, в її складі утворюються тріщіни, що приводить до
проникливості води і інших речовин. Це має важливе значення в процесі
запліднення яйцеклітини сперматозоїдами, які багаті цим ферментом.
Гіалурононідазу містять і деякі бактерії, що полегшує їх проникнення у клітину.
Хондроітинсульфати - хондроітинсірчані кислоти служать структурним
компонентом хрящів, зв’язок, клапанів серця, пупочного канатика. Вони сприяють
відкладенню Са в кістках.
Гепарин - утворюється в клітинах паренхіматозних органів (печінка,
легені, нирки) і виділяється ними в кров та міжклітинну рідину. В крові він
зв’язується з білками і запобігає процесу зсідання крові, виконуючи функцію
антикоагулянта. Крім того, гепарин має протизапальну дію, впливає на обмін
калію та натрію, виконує антигіпоксичну функцію.
Сиалові кислоти - представляють групу глюкозоамінгліканів, що мають у
своєму складі нейрамілові кислоти і похідні вуглеводів. Сполуки нейромілової
кислоти з оцтовою кислотою представляють собою сиалові кислоти. Вони
знаходяться в клітинних оболонках, слині і інших біологічних рідинах. Для
діагностики ряду запальних захворювань (ревматизм, туберкульоз), при яких їх
рівень у крові підвищений, проводять їх визначення.
Лекція № 4. ХІМІЯ ЛІПІДІВ
. Загальна біологічна характеристика
ліпідів. Основні біологічні функції
Ліпіди (lipos - жир, грецьк.) - це
велика група різноманітних за хімічною будовою органічних речовин нерозчинних у
воді і розчинних у неполярних органічних розчинниках - ефірі, хлороформі,
ацетоні, бензолі і т. ін.
Біологічні функції ліпідів визначаються
їхньою будовою і фізико-хімічними властивостями. Специфічною властивістю
ліпідів є їхня здатність утворювати у водному середовищі емульсії різного
ступеня дисперсності та стійкості. Ця властивість має суттєве біологічне
значення. Так, від емульгування ліпідів у шлунково-кишковому тракті залежить їх
розщеплення та всмоктування. У вигляді емульсії жир знаходиться в крові, лімфі
і транспортується до різних органів і тканин, включаючись в обмінні процеси.
Ліпіди відіграють подвійну біологічну
роль - енергетичну та структурну. При їхньому розщепленні звільнюється велика
кількість енергії. Так, окислення 1 г жиру в організмі людини супроводжується
утворенням 35-39 кДж енергії.
Ліпіди як пластичний матеріал,
утворюючи комплекси з білками (ліпопротеїни) вуглеводами (глїколіпіди),
складають основу структури клітин і тканин.
Особливо важливою є роль ліпідів у
структурі мембран клітин та клітинних органел - мітохондрій, рибосом, ядра
тощо.
Мембрани, як відомо, відіграють
надзвичайно важливу роль у структурі, обміні та функціях клітини.
У кожному типі мембран внутрішня
частина являє собою бімолекулярний шар ліпідів, на якому з внутрішньої і
зовнішньої сторін розташовані білки, немовби вбудовані з двох боків у ліпідний
прошарок. Тому мембрани і вважають багатошаровими або ламелярними структурами.
Окрім того, відкладаючись у значних кількостях у підшкірній жировій клітковині,
жир відіграє роль термоізолятора, запобігаючи втраті організмом тепла, а також
виконує механічну функцію, уберігаючи організм від травмування.
Високий вміст ліпідів у клітинах
нервової тканини й особливо головного мозку свідчить про їхню важливу роль у
формуванні структури і функцій нервової системи.
Як складні ефіри спиртів та вищих
жирних кислот, ліпіди є найважливішим джерелом ендогенної води, яка утворюється
під час їхнього окислення, тому що з усіх органічних сполук ліпіди містять
найбільшу кількість атомів водню.
Ліпіди і продукти їхнього обміну
утворюють велику групу біологічно активних сполук, які впливають на метаболізм
і структуру клітин і організму в цілому. Це чоловічі й жіночі статеві гормони,
гормони кори надниркових залоз (кортикостероїди), простагландини, жовчні
кислоти й жиророзчинні вітаміни -А, D, K, I E.
Основні біологічні функції ліпідів у
вільному стані відображає табл.
Таблиця 1.
|
Функція
|
Характеристика
функції
|
Ліпіди, котрі
здійснюють, функцію
|
|
Емульгуюча
|
Амфіфільні ліпіди є
мульгаторами. Розміщуючись на поверхні фаз масло-вода, стабілізують емульсії
і перешкоджають їх розшаруванню
|
Фосфогліцериди,
жовчні кислоти є емульгаторами для ацилгліцеринів у кишечнику. У крові
фосфогліцериди стабілізують розчинність холестерину
|
|
Енергетик-на
|
При розщепленні 1 г
ліпідів виділяється 39,1 кДж енергії. Це більше ніж під час окислення 1 г
вуглеводів і білків разом узятих
|
Ацилгліцерини, вільні
жирні кислити
|
|
Структурна
|
Ліпіди входять до
складу білково-лІпідного бішару клітинних мембран і суб-целюлярних утворень
|
Фосфоліпіди
(фосфогліцерин-дисфінгомієліни), холестерин та його ефіри
|
|
Механічна
|
Ліпіди сполучної
тканини, яка утворює капсули внутрішніх органів, і підшкірної жирової
тканини, захищають органи від зовнішніх пошкоджень
|
Триацилгліцерини
|
|
Теплоізолююча
|
Ліпіди підшкірної
жирової клітковини зберігають тепло завдяки їх низькій теплопровідності
|
Триацилгліцерини
|
|
Транспор-тна
|
Беруть участь у
транспорті речовин (на-приклад, катіонів) через ліпідний шар біомембран,
переносять ліпіди з кишеч-ника в кров, утворюючи холеїнові комплекси
|
Фосфоліпіди. жовчні
кислоти
|
|
Електроі-золююча
|
Є своєрідним
електроізолюючим матеріа-лом у мієлінових оболонках клітин
|
Сфінгомієліни,
глікосфінголіпіди
|
|
Розчинююча
|
Деякі ліпіди є
розчинниками для інших ліпідних речовин
|
Жовчні кислоти
розчинники вітамінів у кишечнику
|
|
Гормональ-на
|
Усі стероїдні
гормони, які виконують різноманітні специфічні функції
|
Стероїди,
ізопреноїди, похідні есенціальних жирних кислот (олеїнова, лінолева,
ліноленова арахідонова)
|
|
Вітамінна
|
Усі жиророзчинні
вітаміни (А, Д, Е, К) і вітаміноподібні речовини (Р,убіхінон або кофермент 0)
|
Стероїди,
ізопреноїди, похідні есенціальних жирних кислот (олеїнова, лінолева,
ліноленова арахідонова)
|
. Класифікація ліпідів
Існують три основні класифікації
ліпідів; біологічна, або фізіологічна, фізико хімічна і структурна.
Біологічна класифікація. Відповідно
до цієї класифікації ліпіди поділяють на резервні і структурні. Резервні ліпіди
у великих кількостях депонуються в підшкірній жировій тканині, сальниках
внутрішніх органів і в інших жирових депо. Загальна кількість резервних ліпідів
у більшості людей становить 10-15% маси тіл Однак кількість резервних ліпідів може
значно змінюватися залежно під режиму харчування, інтенсивності фізичного
навантаження, стану організму та інших причин. При ожирінні кількість жиру може
досягати 25-35%, а іноді навіть 50% маси тіла.
Резервні ліпіди за своєю хімічною
структурою належать, головним чином, до ацилгліцеринів і в значних кількостях
використовуються для енергетичних потреб організму.
Структурні ліпіди не мають такої
енергетичної цінності, як резервні ліпіди. Це переважно складні ліпіди, і у
вигляді ліпопротеїнів вони складають основу клітинних структур і субклітинних
утворень.
Фізико-хімічна класифікація враховує
ступінь полярності ліпідів. За цією ознакою ліпіди поділяються на нейтральні,
або неполярні, і полярні До першого типу належать ліпіди, які не мають заряду,
а до другого - ліпіди, які несуть заряд і мають виразні полярні властивості,
наприклад фосфоліпіди, жирні кислоти.
Деякі ліпіди мають певні структурні
особливості, які зумовлюють їх важливі біологічні властивості. У більшості
випадків вони представлені іонними або полярними похідними вуглеводнів і
належать до класу речовин, які називаються амфіфтами.
Амфіфіли (спорідненість) містять
полярні або іонні гідрофільні групи, а також гідрофобні неполярні вуглеводневі
групи. Властивості амфіфілів значною мірою визначаються природою цих груп. Так,
наприклад нейтральні жири відзначаються низькою полярністю і я мають дуже малу
спорідненість з водою. Інші ліпіди," такі як фосфогліцериди і
сфінголіпіди, більш полярні; внаслідок виразних амфіфільних властивостей вони
входять до складу основних структурних компонентів різних біологічних мембран.
Ці фізико-хімічні особливості різних ліпідів зумовлюють їх різноманітні
біологічні функції.
Структурна класифікація - це
найскладніша класифікація, яка ґрунтується на хімічній будові ліпідів.
Відповідно до цієї класифікації ліпіди поділяються на три великі групи: прості,
складні та похідні ліпідів.
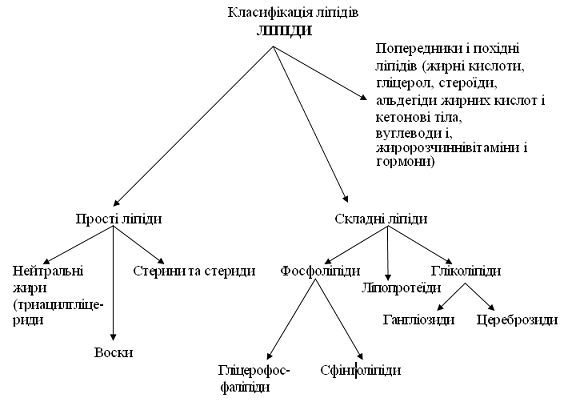
Прості ліпіди - у хімічному
відношенні є складними ефірами різних спиртів та жирних кислот. Залежно від
спиртового компонента вони діляться на такі підгрупи:
1. Нейтральні жири або гліцериди
(ацилгліцерини) - складні ефіри трьохатомного спирту гліцерину та вищих жирних
кислот.
2. Стерини і стериди. Стерини -
одноатомні циклічні спирти. Стериди - складні ефіри одноатомних циклічних
спиртів і вищих жирних кислот.
3. Воски - складні ефіри вищих
одноатомних спиртні і вищих жирних кислот.
Складні ліпіди - це також ефіри вищих
жирних кислот і спиртів, але на відміну від простих ліпідів, вони мають у своїй
структурі ряд інших компонентів (азотисті сполуки, залишки фосфорної або
сірчаної кислот, вуглеводи тощо). До складних ліпідів відносяться:
1.
Фосфоліпіди
(фосфатиди) - складні ефіри спиртів (гліцерину або сфінгозину) і жирних кислот.
Окрім того, до їх складу входять залишки фосфорної кислоти і азотисті сполуки
(холін, серин).
2.
Гліколіпіди
- складні ефіри аміноспирту сфінгозину та жирних кислот, зв'язані з вуглеводами
(глюкоза, галактоза). Деякі з гліколіпідів містять нейрамінову кислоту і
галактозамін.
Сульфоліпіди - подібні, до
гліколіпідів, але мають у своєму складі залишок сірчаної кислоти.
Похідні ліпідів. Ця група речовин
включає різноманітні сполуки, котрі близькі до ліпідів за будовою і
фізико-хімічними властивостями.
До них належать такі речовини, як
насичені і ненасичені жирні кислоти, моно- і диацилгліцерини, вищі спирти, а
також каротини, жиророзчинні вітаміни (А, Д, Е, К) та ін.
3.
Прості
ліпіди. Жирні кислоти. Гліцерин
Нейтральні жири - тригліцериди
(триацилгліцерини). Вони складають основу резервних ліпідів і служать джерелом
енергії. Оскільки жири є складними ефірами гліцерину і жирних кислот, то їх
різноманітність залежить переважно від природи і властивостей жирних кислот,
які входять до складу їх молекули.
Вищі жирні кислоти с основними
гідрофобними компонентами простих і складних ліпідів. Із різних ліпідів
виділено понад 200 жирних кислот. Вони відрізняються між собою довжиною
зв'язків, а також замісниками (окси-, кето-, циклічні структури). Більшість
жирних кислот, які входять до складу жирів, мають нерозгалужений вуглеводневий
ланцюг і парну кількість атомів вуглецю.
У природі жирні кислоти у вільному
стані зустрічаються рідко. Проте, утворюючи ефірні чи амідні зв'язки, вони
входять до складу різних класів ліпідів, зазначених вище, а також багатьох
проміжних продуктів метаболізму ліпіді.
Серед них можуть бути насичені
кислоти (масляна, капронова, пальмітинова, стеаринова) і ненасичені, які мають
різну кількість подвійних зв'язків: один (олеїнова), два (лінолева), три
(ліноленова), чотири (арахідонова).
Суміш жирних кислот, яку одержують
під час гідролізу ліпідів із різних природних джерел, звичайно, містить як
насичені, так і ненасичені жирні кислоти. У ліпідах тваринного походження
переважаючою насиченою жирною кислотою є пальмітинова (С16,), друге
місце займає стеаринова кислота (С18).
Більш короткі жирні кислоти (С14
і С12), як і довголанцюгові (до С28), зустрічаються лише
в невеликих кількостях. Жирні кислоти, які містять 10 або менше вуглецевих
атомів, у тваринних ліпідах зустрічаються рідко, причому у вільному стані ці
жирні кислоти в організмі містяться в невеликій кількості, переважно як
продукти обміну.
У деяких рідинах організму, таких як
молоко і молозиво, присутні жири, які містять разом із вищими жирними кислотами
(пальмітиновою, олеїновою) і коротко ланцюгові жирні кислоти (масляна,
капронова). У жіночому молоці виявлено близько 40 різних жирних кислот.
У жирових депо відкладаються,
головним чином, ліпіди, які містять вищі жирні кислоти з довжиною ланцюга 16-18
вуглецевих атомів.
Що стосується ненанасичених жирних
кислот які зустрічаються в природі то всі вони при кімнатній температурі -
рідини.
Одинарний подвійний зв'язок у жирних
кислотах тваринного походження звичайно знаходиться в 9,10-положенні жирної
кислоти. Двома найбільш розповсюдженими мононенасиченими жирними кислотами
тваринного походження є олеїнова і пальмітоолеїнова
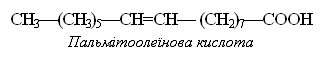
Проте олеїнова кислота в природі
превалює в кількісному відношенні.
Наявність подвійного зв'язку створює
можливість утворення цис- та транс-ізомерів. Як правило, природні жирні кислоти
з одним подвійним зв'язком є цис-ізомерами.
Жирні кислоти, які мають більше
одного подвійного зв'язку, відносяться до поліненасичених кислот.
Встановлено, що чим активніший обмін
і функція клітин, тим більше подвійних зв'язків у жирних кислотах, які беруть
участь в утворенні їх мембран. Так, із мембран паличкоподібних зорових клітин
сітківки ока виділено поліненасичену жирну кислоту, яка має 22 атоми вуглецю в
ланцюзі і 6 подвійних зв'язків,
Поліненасичені жирні кислоти входять
до складу харчових жирів, особливо рослинних олій, таких як кукурудзяна, соняшникова,
горіхова, оливкова, бавовняна та інших, а також деяких лікарських препаратів
(риб'ячий жир, лінетол, есенціале, олія обліпихова, олія шипшини, арахіден та
ін.),
Найважливішими для організму людини і
вищих тварин є такі полінена-сичені кислоти, як лінолева, ліноленова й
арахідонова. Ці кислоти в організмі або зовсім не синтезуються (лінолева і
ліноленова), або утворюються в недостатніх кількостях (арахідонова), тому їх
називають незамінними, або есенціальними кислотами (виключний) ї відносять до
вітамінів (вітамін F). Ці кислоти відзначаються високою біологічною активністю.
Експериментально доведено, що у разі недостатності лінолевої і ліноленової
кислот у тварин, наприклад у щурів, починається випадіння шерсті, посилюється
злущування епітелію, а в молодих тварин припиняється ріст.
Таблиця 2. Жирні кислоти
|
Насичені
|
Ненасичені
|
|
Масляна С3Н7СООН
|
Олеїнова С17Н33СООН
|
|
Капронова С5Н11СООН
|
Лінолева С17Н31СООН
|
Ліноленова
С17Н29СООН
|
|
Стеаринова
С17Н35СООН
|
Арахідонова
С19Н31СООН
|
Характерними біохімічними ознаками
дефіциту ненасичених жирних кислот є порушення обміну холіну, холестерину і
фосфору. Встановлено, що поліненасичені жирні кислоти знижують вміст
холестерину в крові, стимулюють його обмін у печінці і виведення із жовчю. Ефіри
холестерину з поліненасиченими жирними кислотами - це важлива транспортна форма
стероїдів і необхідна ланка їх метаболізму, Похідними ноліненасичених жирних
кислот є гормони простагландини.
Гліцерин
Спиртовим компонентом більшості
нейтральних жирів виступає гліцерин.
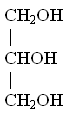
Це триатомний спирт. У структурі
гліцерину відсутній асиметричний атом вуглецю. Він розчинний у воді та етанолі
і нерозчинний або слабо розчинний в органічних розчинниках. Гліцерин утворює
ефіри з жирними кислотами типу гліцеридів (ацилглїцеринів), які називають також
нейтральними ліпідами. Ацилгліцерини поділяються на моно-, ди- та
три-ацилгліцерини, які містять відповідно один, два і три ефірозв'язані ацили
(RСО-):
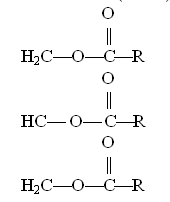
Триацилгліцерин
Номенклатура триацилгліцеринів
Якщо до складу молекули жирів входять
гліцерин та три залишки будь-якої однієї кислоти, то такі жири називають
моноацидними, або простими триацилгліцеринами. У ньому випадку назва молекули
жиру утворюється з назви жирної кислоти із зазначенням кількості її залишків у
молекулі Наприклад, моноацидний жир, утворений із трьох молекул стеаринової
кислоти, називається тристеарином, утворений із пальмітинової кислоти
-трипальмітином, а із олеїнової - триолеїном.
Якщо до складу молекули жиру входять
різні жирні кислоти, то такий жир називається гетероацидним, Гетероацидний жир
може містити або три різні, або дві однакові жирні кислоти. Відповідно до цього
утворюється і назва. Наприклад, стеаропальмі-тоолеїн або дистеаропальмітин. Фізико-хімічні
властивості ацил-гліцеринів значною мірою залежать від переважання в їхньому
складі тієї чи іншої жирної кислоти. Так, стеаринова кислота плавиться при
температурі 70°С, тому при звичайній температурі жир, у якому вона переважає,
буде твердим, наприклад, жир вівці. Моно- і диацилгліцерини, які мають вільні
полярні гідроксили, розчинні у воді. Вони утворюють у воді міцели.
Триацилгліцерини не мають здатності до утворення міцел і не розчинні у воді.
При лужному гідролізі або омиленні ацилгліцеринів здійснюють ферменти ліпази.
До складу жирів підшкірної клітковини
входить 50-60% олеїнової кислоти, тому вони плавляться при 17-23 °С,
перебуваючи в організмі фактично в рідкому стані. Це сприяє обміну жиру між
жировою тканиною і кров'ю, а також прискорює його внутрішньоклітинне
використання.
Прості моноацидні жири отримують
переважно штучним шляхом. В організмі людини і вищих тварин більшість жирів
гетероацидні. Вміст жиру в деяких органах, тканинах і рідинах людини (у %) у
перерахуванні на сиру масу такий:
печінка 1,5-3,0
м'язи 1,0-1,1
кров 0,2-0,3
молоко 3,2-3,8
. Стерини та стериди. Холестерин.
воски
Стерини та стерини
Циклопентанпергідрофенантрен
(стеран)
Сполуки цієї групи можна розглядати
як похідні відновленої конденсованої циклічної системи -
циклопентанпергідрофенаетрену, який складається 5 трьох конденсованих
циклогексанових кілець (А, В і С) у нелінійному або фенантреновому сполученні і
циклопентанового кільця В.
Стерини, або стероли, - одноатомні
вторинні спирти, похідні циклопентан-пергідрофенантрену. Вони широко
розповсюджені в живій природі і залежно від походження розподіляються на дві
групи - тваринні (зоостерини) і рослинні (фітостерини). У складі тканин стерини
перебувають або у вільному стані або (частіше) у вигляді складних ефірів з
жирними кислотами - стеридів.
До зоостеринів відносяться:
холестерин (С27Н45ОН), десмостерин (С27Н43ОН),
ланостерин (С30Н40ОН) і ряд інших. Найбільше значення в
організмі людини і тварин має холестерин Холестерин (холестерол) уперше був
виділений ще у XVIII сторіччі із жовчних каменів, звідки і походить його назва
(сhоlе - жовч, лат.).
Холестерин - це циклічний ненасичений
одноатомний спирт. З'єднуючись із жирними кислотами, переважно ненасиченими,
холестерин утворює складні ефіри - холестериди. Холестерин і його ефіри є
складовою частиною мембран клітин і субклітинних структур. Особливо великий їх
вміст (більше 2%) у тканині головного мозку. У крові ефіри холестерину
складають основну частину загального холестерину і транспортуються в складі
ліпопротеїдів.
В організмі людини та вищих
тварин із холестерину утворюються такі біологічно активні сполуки, як гормони
кори надниркових залоз -кортикостероїди, статеві гормони, а також жовчні
кислоти.
Холестерин може з'єднуватися своєю
гідроксильною групою не тільки з жирними кислотами, але й з іншими сполуками в
тому числі токсичними речовинами (наприклад, з токсинами патогенних
мікроорганізмів, гемолітич-ними отрутами змій тощо) і знешкоджувати їх.
Окрім холестерину, у деяких тканинах
(кістковий мозок, кров, нервова тканина шкіра) у невеликих кількостях містяться
7-оксихолестсрин, 7-дегідрохолестерин, який має ще один подвійний зв'язок у
положенні С7-С8. Під дією ультрафіолетового опромінення
7-дегідрохолестерин, який є у людини в шкірі, перетворюється у вітамін Д3.
Воски
Загальна назва воски відноситься до
природних ефірів вищих жирних кислот і витих монооксиспиртів. Воски утворюють
захисне покриття на шкірі, шерсті, пірї, а також є головними ліпідними
компонентами багатьох видів морського планктону - одного з основних джерел їжі
океанської фауни.
Ланолін - жир шерсті вівці є сумішшю
жирнокислотних ефірів ланостерину й агностерину і застосовується у фармації як
мазева основа.
Спермацет. Входить до складу
спермацетового масла, яке добувають із черепних порожнин кашалота.
Основна складова частина спермацету -
цетилпальмітин - складний ефір цетилового спирту і пальмітинової кислоти.
Бджолиний віск - це суміш різних
речовин ліпідної природи, серед яких основною складовою частиною є складний
ефір мірицилового спирту і
пальмітинової кислоти -
мірицилпальмітин. Ланолін, спермацет та бджолиний віск широко використовуються
в парфумерії і фармації як основа для приготування кремів і мазей.
. Складні ліпіди. Фосфогліцериди.
фосфатиди-негліцериди. Гліколіпіди і сульфоліпіди
Складні ліпіди
Складні та змішані ліпіди на відміну
під простих ліпідів містять неліпідний компонент, наприклад фосфат
(фосфоліпіди), вуглевод (гліколіпіди), білки (ліпопротеїди) та ін.
Фосфоліпіди (фосфатиди), як уже
зазначалося, є складовою частиною мембран клітин і субклітинних структур -
ядер, мітохондрій, рибосом. Це складні ефіри жирних кислот та спиртів, але,
крім того, до їх складу входять фосфорна кислота і такі азотовмісні речовини,
як амінокислоти й аміноспирти.
Залежно від характеру спирту, що
входить до складу їх молекули, фосфатиди поділяються на дві групи:
фосфатид-гліцериди, або фосфогліцериди і фосфатиди-негліцериди.
Фосфогліцериди
Ліпіди цього класу, що називаються
також гліцерофосфатами, містяться практично тільки в клітинних мембранах, і
лише дуже невелика кількість фосфогліцеридів знаходиться в складі жирових депо.
Молекули всіх фосфогліцеридів мають
полярну голову і два неполярних вуглеводневих хвости; тому їх називають
амфіпатичними, або полярними ліпідами.
Кожний тип фосфогліцеридів може бути
представлений великою кількістю різних сполук, що відрізняються залишками
жирних кислот. Як правило, вони містять один залишок насиченої й один залишок
ненасиченої жирної кислоти, причому остання знаходиться в положенні С2
гліцерину. До структури природних фосфогліцеридів входить α-гліцеринфосфорна кислота.
Лецитин. Одним з найперших фосфогліцеридів,
отриманим ще у 1845 р. з яєчного жовтка, був лецитин (жовток). У молекулі
лецитину два гідроксили гліцерину з'єднані з двома молекулами вищих жирних
кислот, з котрих одна, як правило, ненасичена. Третій гідроксил з'єднується з
фосфорною кислотою, до якої приєднується аміноспирт - холін. Таким чином,
лецитин відноситься до фосфатидилхолінів.
Кефалін. Ця група фосфоліпідів на
відміну від лецитину містить замість холіну аміноспирт коламін (етаноламін).
Тому ця група фосфоліпідів одержала назву коламінфосфатидів.
Хоча кефалін і лецитин - це старі
назви, проте й до теперішнього часу вони використовуються досить часто. Цї два
фосфогліцериди метаболічне зв'язані один з одним і є основними ліпідними
компонентами більшості мембран у клітинах тварин.
Серинфосфатиди вперше були виділені
із головного мозку бика, а потім знайдені і в більшості інших тканин тварин,
рослин і бактерій. Вони побудовані з тих же складових частин, але азотовмісна
частина в них містить амінокислоту серин
Інозитфосфатиди вперше виділені з
туберкульозних паличок, а потім знайдені в рослинах і тканинах тварин. Ця група
фосфатидів характеризується тим, що до їхнього складу входить шестиатомний
циклічний спирт інозит.
Існує порівняно багато форм
інозитфосфатидів, які відрізняються наявністю або відсутністю (наприклад,
ліпозитол) у їх структурі молекули гліцерину, кількістю залишків жирних і
фосфорної кислоти. Залежно від цього інозитфосфатиди діляться на три основні
групи; монофосфоінозитфосфатиди (де один залишок фосфату сполучається з інозитом),
поліфосфоінозитфосфатиди (в яких декілька фосфатів приєднуються до
гідроксильних груп інозиту) і складні інозитфосфатиди (у яких до інозиту
приєднуються інші речовини - амінокислоти, моносахариди, фітосфінгозин).
Поліфосфорні інозитфосфатиди виявлені переважно в головному мозку людини і
вищих тварин, де, як вважають, вони відіграють важливу роль у нервовій
діяльності. У рослинному світі на них багаті соя, арахіс, соняшник.
Плазмалогени містяться в усіх
тканинах організму людини і становлять близько 20% від загальної кількості
фосфоліпідів. Особливо багато їх у головному і спинному мозку, де 50-90% під
вмісту всіх ліпідів припадає на плазмалогени.
Кардіоліпін - подібний до
фосфатидилгліцеринів, але має більш складну структуру. Хребет молекули кардіоліпіну
включає три залишки гліцерину.
Кардіоліпін уперше був виділений із
серця бика і звідси отримай свою назву. Надалі він був виявлений у багатьох
тканинах тварин і людини, в зеленому листі вищих рослин, дріжджах. Вміст його в
клітинах складає 7-5% від маси ліпідів. Проте в мембранах мітохондрій він є
головним компонентом фосфоліпідів.
Фосфатиди-негліцериди
Діольні фосфатиди (фосфоліпіди) -
нова, нещодавно відкрита група сполук. Вони є похідними двохатомних спиртів, у
яких одна зі спиртових груп етерифікована залишком жирної кислоти, а інша
зв'язана з фосфатом і будь-яким /спиртом, наприклад і холіном. У організмі
діольні фосфоліпіди можуть зв'язувати з клітинними мембранами, змінюючи їх
функцію. Вони виявляють виразні поверхнево-активні властивості. Великі їх
концентрації призводять до гемолізу еритроцитів. Діольні фосфоліпіди впливають
на імунні реакції і усувають вплив медіатору ацетилхоліну на клітини, тобто
виявляють холінолітичну дію.
Сфінгомієліни. Вони у великих
кількостях містяться в нервовій тканині, входячи до складу мієліну, який
утворює оболонку нервових волокон {звідси пішла їх назва). Сфінгомієліни
виявлені і в інших органах (легені, печінка, нирки, селезінка, а також у
крові).
Сфінгомієліни побудовані з
двохатомного ненасиченого аміноспирту сфінгозину, холіну, фосфорної та жирної
кислот, причому жирна кислота своїм карбоксилом реагує з аміногрупою
сфінгозину, в результаті чого утворюється ациламідний зв'язок.
Сфінгомієліни відрізняються між собою
характером жирної кислоти, котра входить до їхнього складу (стеаринова,
пальмітинова, лігноцеринова).
Гліколіпіди і сульфоліпіди.
Гліколіпіди - це велика група складних ліпідів, що містять у своєму складі
вуглеводи.
У гліколіпідів голову молекули
утворюють полярні, гідрофільні групи вуглеводів, найчастіше D-галактоза, але
може бути й глюкоза, а в деяких випадках -галактозамін і нейрамінова кислота.
Найпростішими гліколїпідами є
глікозилдиацилгліцерини, виявлені в рослинах і мікроорганізмах.
Інша група - цереброзиди, їх можна
розглядати і як гліколіпіди, і як сфінголіпіди, оскільки ці сполуки містять і
цукор, і аміноспирт сфінгозин. Особливо багато цереброзидів міститься в
мембранах нервових клітин і, зокрема, в мієліновій оболонці. Жирні кислоти, які
входять до складу цереброзидів незвичайні, бо містять понад 20 атомів вуглецю;
найчастіше зустрічаються нервонова, церебронова і лігноцеринова кислоти.
Нижче наведено формулу цереброзиду
нервову, до складу якого входять нервонова кислота (С23Н45СООН)
і галактоза. Остання своїм напівацетальним гідроксилом утворює глікозидний
зв'язок зі спиртовою групою сфінгозину.
Інший великий клас гліколіпідів
складають гангліозиди. Це надзвичайно складні, багаті вуглеводами ліпіди з дуже
великими молекулами. Як правило вони виявляються на зовнішній поверхні
клітинних мембран, особливо в нервовій тканині. Наприклад, у складі
гангліозидів із мозку бика виявлені: жирна кислота, спирт сфінгозин, цукри
D-глюкоза і D-галактоза і похідні аміноцукрів - N-ацетил-глюкозамін і
N-ацетилнейрамінова кислота. Таким чином, у структурному відношенні гангліозиди
подібні до цереброзидів з тією різницею, що замість одного залишку галактози
вони мають складний олігосахарид.
Сульфоліпіди - це сульфатні похідні
цереброзидів. Сульфат приєднується до третього гідроксилу галактози. Вони мають
дуже виразні кислотні властивості і легко зв'язують катіони. Вважають, що вони
беруть участь у транспорті катіонів через мембрани нервових клітин і волокон.
Тому сульфоліпіди потрібні для нормальної електричної активності нервової
системи.
Ліпопротеїди - комплекси ліпідів з
білками. По будові це невеликого розміру (150-200 нм) сферичні частини,
зовнішня оболонка яких утворена білками (що дозволяє їм пересуватися по крові),
а внутрішня частина - ліпідами та їхніми похідними.
Основна функція ліпопротеїдів -
транспорт по крові ліпідів. Залежно від кількості білка й ліпідів ліпопротеїди
розділяються на хіломікрони, ліпопротеїди низкою щільності (ЛПНЩ) і високої
щільності (ЛПВЩ), які раніше позначалися як α-
і β-ліпопротеїди.
Хіломікрони - найбільш великий клас
ліпопротеїдів і містять до 98-99% ліпідів і тільки 1-2% білка. Вони утворяться
в клітинах слизової оболонки кишечника і забезпечують транспорт ліпідів з
кишечника в лімфу, а потім у кров.
У ЛПНЩ кількість білка становить
9-20%, а серед ліпідів переважають холестерин і триацилгліцерини (до 40%).
Білкова частина ЛПВЩ коливається в межах 35-50%, а ліпідна представлена
фосфоліпідами і холестерином. Таким чином, холестерин транспортується по крові
в складі ліпопротеїдів, особливо ЛПНЩ. Внаслідок цього між рівнем холестерину й
ЛПНЩ відзначається пряма залежність: підвищення холестерину супроводжується
збільшенням у крові його транспортної форми ЛПНЩ і навпаки. От чому визначенню
рівня ліпопротеїдів у крові надається важливе значення в клінічній лабораторній
діагностиці.
Лекція № 5. ХІМІЯ
ФЕРМЕНТІВ
1. Загальна характеристика
ферментів
Матеріальною основою життя являється
взаємодія хімічних речовин і елементів живого організму.
В нормальних фізіологічних умовах
біологічні реакції протікають з досить великими швидкостями. Велику швидкість
забезпечують біологічні каталізатори-ферменти.
Діючи в строго визначеній
послідовності, вони каталізують розщеплення молекул поживних речовин,
забезпечують запас і перетворення хімічної енергії, з простих молекул будують
макромолекули, що входять в склад клітин і тканин організму.
Наука про ферменти є окремою галуззю
біохімії і називається ферментологія.
Вчення про ферменти лежить в основі
найважливіших проблем фізіології і патології людини на молекулярному рівні.
Практично всі фізіологічні процеси в
організмі забезпечуються каталітичною дією ферментів. І.П. Павлов назвав
ферменти "збудниками життя".
Велике значення мають ферменти і в
медицині. Деякі хвороби людини, особливо спадкові, можуть бути зв'язані з
недостатністю або взагалі відсутністю якогось ферменту.
Наприклад, відсутність у дітей
ферменту, що перетворює галактозу в глюкозу є причиною галактомезії, при якому
діти отруюються надлишком галактози. З іншої сторони, підвищена активність
ферменту може привести до захворювання, наприклад, подагри.
Порушення біохімічних процесів
спостерігається при самих різноманітних хворобах людини, при цьому змінюється і
діяльність відповідних ферментів. Ось чому визначення активності ферментів
крові має важливе значення в діагностиці, а використання ферментів в якості
ліків відкриває новий розділ в медицині.
Крім того, ферменти широко
використовуються і в промисловості. З допомогою ферментів розшифрована
структура білків і нуклеїнових кислот, одержаний ряд ферментативних препаратів,
вітамінів.
Ферментологія має довгу і багату
відкриттями історію. В її розвитку приймали участь вчені світу, серед них гідне
місце займають вітчизняні вчені І.П. Павлов, С.Є. Северин, В.Н. Орехович, Ю.А.
Овчинников.
2. Номенклатура ферментів
Назва у ферментів досить складна і
складається з декількох частин.
I. Назва субстрату (тобто
речовини, на яку діє фермент).
II. Назва типу ферментативної
реакції, що каталізує фермент.. Назва продукту реакції (Р) та її
учасників.. До назви фермента додають закінчення -аза. Наприклад, у печінці
є фермент, що каталізує розщеплення глюкозо-6-фосфату на вільну глюкозу та
фосфатну кислоту.
Глюкоза-6-фосфат-фосфогідролаза
В цій назві:
I.
Назва
субстрату - глюкоза - 6 - фосфат.
II.
Назва
продукту реакції - фосфорна кислота.
III.
Тип
реакції - гідроліз.
IV.
Додається
закінчення - аза.
В практиці збереглись і другі назви
ферментів, що називаються тривіальними: пепсин, амілаза, трипсин. До них
відносяться гідролітичні ферменти ШКТ.
3.
Особливості ферментативного каталізу
Каталіз - процес прискорення хімічної
реакції під впливом каталізатора, який приймає участь у даному процесі, але до
кінця реакції залишається хімічно незмінним. Каталізатори бувають органічні та
неорганічні. Органічні каталізатори - це ферменти.
Між молекулами, які вступають в реакцію,
існують сили притягування і відштовхування.
При недостатньому запасі енергії
молекули необхідно активізувати, тобто додати їм необхідну кількість енергії,
що називається енергією активізації. Активація молекул відбувається різними
шляхами: нагріванням, опроміненням, підвищенням тиску і за допомогою
каталізаторів.
Суть дії каталізаторів заключається в
тому, що вони в нормальних фізіологічних умовах викликають перебудову субстрату
за рахунок внутрішньо молекулярної перебудови. Це призводить до зниження
енергії активізації і молекули можуть взаємодіяти без залучення додаткової
енергії. Крім того, активовані молекули взаємодіють набагато швидше.
Характеристика ферментативного
каталізу.
Ферменти є природними біологічними
каталізаторами, і тому мають подібні властивості з неорганічними
каталізаторами.
Суть ферментативної реакції
характеризується слідуючими рівняннями.
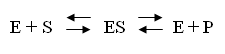
Е - фермент, S - субстрат, Р -
продукти реакції. ЕS - фермент субстратний комплекс.
Але ферменти відрізняються від
неорганічних каталізаторів рядом параметрів. Ферменти на відміну від
неорганічних каталізаторів є високомолекулярними полімерами, мають високу
специфічність, низький оптимум температури (35-45ºС) фізіологічний діапазон рН,
діють при атмосферному тиску і мають зворотність дії і велику швидкість
ферментативної реакції.
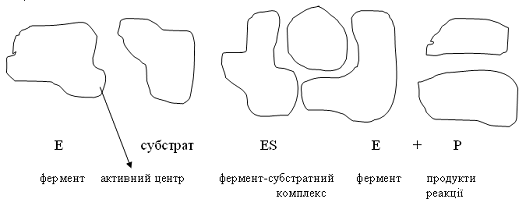
Ферментативна реакція може йти як у
прямому так і в зворотньому напрямку.
Активність ферментів може змінюватися
в залежності від статі, віку, фізіологічного стану організму. Це не властиво
неорганічним каталізаторам.
Розмір молекули ферменту не
відповідає розміру молекули субстстрату. Фермент є по своїй природі білком і
має велику молекулярну масу в порівнянні з низькомолекулярним субстратом. Крім
того, було відмічено, що навіть після відщеплення від молекули ферменту деякої
кількості амінокислот, він зберігає свої властивості. Все це дає підстави
стверджувати, що фермент діє не всією молекулою, а деякою ділянкою,
розташованою на поверхні ферменту. Ця ділянка відповідає структурі субстрату і
називається активним центром. Він складається з різноманітних функціональних
груп, що представляють радикали амінокислот, утворюючих первинну структуру
ферменту.
4. Хімічна природа ферментів
Це білки, що мають велику молекулярну
масу рибонуклеаза - 12. 700 в.о., пепсин - 35.000 т. в.о. Ферменти, як і всі
білки мають первинну, вторинну, третинну, четвертинну структури.
Первинна структура представляє собою
послідовне з’єднання амінокислот і зумовлена спадковими особливостями
організму. Саме первинна структура в значній мірі характеризує індивідуальність
ферменту.
Вторинна структура представляє α
- спіраль.
Третинна - має вид глобули і приймає
участь у формуванні активного центру та інших властивостей ферментативної
молекули.
Багато ферментів мають четвертинну
структуру, що представляє собою об'єднання декількох субодиниць, що мають три
рівні організації молекул. Ці субодиниці можуть розрізнятися між собою, як в
кількісному, так і в якісному співвідношенні. Це привело до появи груп
споріднених ферментів - ізоферментів, що представляють собою ряд форм одного і
того ж ферменту. Вони каталізують одну і ту ж реакцію, але розрізняються по
місцю локалізації, складу, і тому мають різні фізико-хімічні властивості: швидкості
руху в електричному полі, оптиму температури.
Ізоферменти існують більш ніж у 100 ферментів.
Наприклад, ЛДГ - каталізує утворення і окислення молочної кислоти. Цей фермент
має четвертинну структуру і складається з чотирьох субодиниць, дві з яких
представлені типом Н (heat - серце), дві М (muscul - м'язи). За назвою органів
де знайдена їх найбільша активність. Різне співвідношення цих субодиниць
призвело до появи 5-и ізоферментів ЛДГ.
ЛДГ - 1 (4Н) серце, печінка, мозок.
ЛДГ - 2 (ЗНІМ) нирки, легені.
ЛДГ - З (2Н2М) нирки, легені, мозок.
ЛДГ - 4 (ІНЗМ) - печінка, м'язи.
ЛДГ - 5 (4М) - печінка, м'язи.
Ці ізоферменти позначаються цифрами і
в залежності від швидкості руху в електричному полі розділяються методом
електрофорезу на 5 фракцій.
Відмінність у хімічному складі
ферментів послужила основою для поділу їх на ферменти-протеїни та
ферменти-протеїди.
Протеїни складаються тільки з
амінокислот. Це в основному гідролітичні ферменти (пепсин, амілаза, ліпаза)
ШКТ.
Складні ферменти протеїди мають
небілкову частину кофермент і білкову - апофермент.
Коферменти можуть бути представленні
мінеральними речовинами, їх називають металоферментами, активними формами
вітамінів і нуклеозидтрифосфатами. Присутність вітамінів у складі ферментів
визначає їх біологічне значення.
Таблиця 3
|
Присутність
вітамінів у складі ферментів і визначає їх біологічне значення. Вітамін
|
Кофермент
|
Фермент
|
Тип реакції
|
|
Тіамін В1
|
Тіамінпірофосфат
|
Декарбоксилаза
|
Декарбоксилювання
(від щеплення СО2)
|
|
Піродоксін В6
|
Фосфопіродоксаль
|
Амінотрансферази
|
Перенесення
аміногрупи
|
|
Вітамін В12
|
Кобамідні ферменти
|
Трансметилази
|
Перенесення
метальної гр.
|
. Властивості ферментів
Ферменти являються по своїй хімічній
природі білками і характеризуються їх властивостями. Це високомолекулярні
сполуки здатні утворювати колоїдні розчини мають властивості амфоретних
електролітів, термолабільні. Окрім властивостей білків вони мають свої
специфічні властивості - зворотність дії та специфічність.
Зворотність дії:
При вивченні дії ферментів біло
встановлено, що деякі з них можуть каталізувати як пряму так і зворотну
реакцію. Наприклад, ЛДГ забезпечує не тільки розпад молочної кислоти, але і її
утворення. Вперше на таку властивість ферментів вказав А.Я. Данилевський (1888
рік), що далі було підтверджено роботами І.П. Павлова, А.І. Опаріна. Слід
зазначити, що зворотність дії мають не всі ферменти.
Специфічність
Специфічність це одне з найбільш
видатних властивостей ферментів. Ця властивість була відкрита ще в минулому
столітті, коли було зроблено спостереження, що близькі по структурі речовини -
просторові ізомери, розщеплюються зовсім різними ферментами. В основі
специфічності лежить строга відповідність структури субстрату активному центру
ферменту. Утворення фермент-субстратного комплексу відбувається слідуючим
чином. Як було встановлено у первинному стані структура субстрату і активного
центру не точно відповідають один одному. Але при їх взаємодії вони впливають
один на одного таким чином, що їх просторові структури змінюються. В
результаті, по образному вислову Е.Фішера субстрат підходить до ферменту, як
ключ до замка. І стає можливим утворення комплексу субстрата з активним центром
ферменту. Цю модель взаємодії називають іще моделлю ключа і замка.
Ступінь специфічності у ферментів
різна і поділяється на абсолютну і відносну специфічність.
Відносну специфічність мають
ферменти, кожен з яких діє на декілька речовин, що мають один тип зв'язку.
Наприклад, протеїнази розщеплюють пептидний зв'язок - NH - СО.
Ферменти, що каналізують перетворення
тільки одного субстрату мають абсолютну специфічність. Прикладом цього може
бути амілаза, що гідролізує крохмаль до глюкози, сахараза, що розщеплює
сахарозу на глюкозу і фруктозу.
6. Кінетика ферментативних реакцій
На швидкість ферментативної реакції
впивають концентрація ферменту та субстрату, температура, рН середовища,
активатори та інгібітори.
Концентрація ферменту. Величина цього
показника прямо пропорційна швидкості реакції.
Підвищення концентрації приводить до
одночасного підвищення швидкості реакції при оптимальних умовах (надлишок
субстрату, температура рН середовища). Швидкість реакції буде максимальною,
коли весь фермент буде зв'язаний у фермент - субстратний комплекс.
Концентрація субстрату. Між швидкістю
реакції і кількістю субстрату при оптимальних умовах існує пряма залежність. З
підвищенням кількості субстрату швидкість реакції буде підвищуватись.
Температура. Ферменти являється
термолабільними сполуками. З підвищенням температури на кожні 10°С швидкість
реакції підвищується в два рази. Це проходить до температурного оптимуму. Так
називають інтервал температур в якому ферменти проявляють найбільшу активність.
Для більшості ферментів це 35-45°С. В організмі людини оптимальна температура
для дії ферментів 37°С. Підвищення температури приводить до зниження активності
ферменту і швидкості реакції, а при 70-80°С фермент перестає діяти. Це зв'язано
з тим, що ферменти мають білкову природу і при підвищенні температури
змінюється структура активного центру настільки, що він перестає взаємодіяти з
субстратом, тобто відбувається денатурація. При високій температурі структура
білка руйнується і руйнується активний центр ферменту.
Зниження температури викликає і
зниження швидкості ферментативної реакції, але при цьому фермент зберігає свою
структуру і властивості. Якщо температуру підняти до оптимуму, активність
ферменту і швидкість реакції відновлюється. Цю властивість застосовують у
медицині при хірургічних операціях, наприклад, при проведенні операції на
грудній порожнині, організм хворого охолоджують приблизно до 22-25°С, з метою
знизити активність ферментів і відповідну швидкість реакцій, тобто обмін
речовин в організмі.
рН середовища. Кожний фермент
проявляє свою активність тільки при оптимальному рН викликає зниження
активності ферменту і зниження швидкості реакції, а при значній зміні реакції
середовища фермент інактивується. Це зв'язано з тим, що в утворенні ферменту -
субстратного комплексу приймають участь електростатичні зв’язки, які
утворюються між протилежно зарядженими функціональними групами субстрата і
активного центра ферменту. Такий заряд створюється тільки специфічною рН.
Активатори - являються факторами, що
підвищують швидкість ферментативної реакції. Прикладами можуть бути іони хлору,
що є активаторами амілази слини Н+, які підвищують активність
пепсину, жовчні кислоти, що підвищують активність ліпази підшлункової залози.
Існує і процес самоактивації. Багато ферментів виробляється в неактивній формі
в клітинах в виді проферментів або зимогенів, у яких активний центр
заблокований ділянкою пептидного ланцюга.
В результаті цього субстрат не може
з'єднатися з активним центром ферменту. Видалення такого додаткового
поліпептиду приводить до звільнення активного центру і можливості утворення
фермент-субстратого комплексу. Наприклад, проферментом пепсину являється
пепсиноген. Відщеплення від його молекули невеликого поліпептидного ланцюга
приводить до утворення активного пепсину.
Інгібітори знижують швидкість
ферментативної реакції шляхом пригнічення дії ферменту. Даний процес носить
назву інгібірування. Інгібірування буває зворотне і незворотне. При
незворотному інгібіруванні повністю втрачається активність ферментів, що
зв'язано з руйнуванням їх структури. До таких інгібіторів відносяться різні
денатуруючі агенти (сильні кислоти, луги, спирти), отрути, фосфорорганічні
сполуки.
Зворотне інгібірування проходить
тільки в період взаємодії ферменту з інгібітором, видалення якого знову
повертає активність ферменту. Воно буває конкурентним і неконкурентним.
Конкурентне має в своїй основі
конкуренцію між субстратом і інгібітором за взаємодію з активним центром
ферменту. Це можливо тільки тоді, коли структура інгібітора подібна структурі
субстрату, інгібітор є структурним аналогом субстрату. Тільки при цій умові
інгібітор може взаємодіяти з активним центром ферменту.
Друга особливість конкурентного
інгібірування - це строге кількісне співвідношення між субстратом і
інгібітором.
Інгібірування може пройти тільки
тоді, коли інгібітору буде більше, ніж ферменту.
Неконкурентне - інгібітор не є
структурним аналогом субстрату і з'єднується з не активним центром, а з другим
центром молекулами, що носить назву алостеричного центру. В результаті цього
змінюється структура всього ферменту, в тому числі і активного центру, який уже
не може приєднувати субстрат.
Коферменти теж є факторами, що
впливають на швидкість реакції, при цьому відмічається пряма залежність між
концентрацією коферменту і швидкістю реакції.
. Класифікація
В основу класифікації покладений тип
ферментативної реакції. Ділять на 6 класів.
I.
Оксидоредуктази.
Каталізують окисновідповідні реакції (ЛДГ, ксинтино-оксидаза, що каталізує
синтез сечової кислоти).
II.
Трансферази.
Ферменти здійснюють міжмолекулярний перенос різних функціональних груп (метилтрансферази
транспортують метильні групи, амінотрансферази приймають участь у переносі аміногруп,
гексокінази переносять фосфорну кислоту з АТФ на глюкозу).
III.
Гідролази.
Гідролізують різні сполуки шляхом розриву внутрішньо молекулярних зв'язків
(пепсин, трипсин, амілаза, сахараза). При цьому відбувається розпад ефірних
зв’язків.
IV.
Ліази. Розщеплюють
негідролічним шляхом сполуки з подвійними зв'язками. До них відносяться
декарбоксилази, ферменти що каталізують відщеплення СО2 (лізиндекорбоксилаза)
знаходиться в товстому відділі кишечнику і каталізує перетворення лізину з
утворення кадаверіну. Декарбоксилази, також катілізують утворення з амінокислот
біогенних амінів типу тир аміну, гістаміну.
V.
Ізомерази.
Каталізують взаємне перетворення субстратів. Глюкозо-6- фосфатізомераза
забеспечує пряму і зворотну реакції між фруктозо-6- фосфатом і глюкозо-6-фосфатом.
VI.
Лігази.
Каталізують синтез органічних речовин з двох молекул з використанням енергії
АТФ.
В прийнятій класифікації передбачають
чотирьох значний код. Перша цифра - номер одного з головних класів, друга -
підклас, що характеризує основні субстрати, третя - номер підкласу, який
деталізує хімічні групіровки субстрату, четверта цифра являється порядковим
номером ферменту, що відноситься до відповідного під-підкласу.
. Локалізація ферментів
Ферменти локалізуються в органоїдах
клітини, де проявляється їх діяльність. Виключення складають ферменти ШКТ, які
виділяються у просвіт ШКТ в момент травлення і ферменти системи зсідання крові,
що функціонують в кровоносних судинах.
В ядрі клітини знаходяться головним
чином ті ферменти, які каналізують обмін нуклеїнових кислот: ДНК-полімерази,
ДНК-лігази, РНК-полімерази.
Закономірний розподіл ферментів у
різних органоїдах цитоплазми. Наприклад, ферменти тканинного дихання
розташовані переважно в мембранах мітохондрій. Каталізатори біосинтезу білку
знаходяться переважно в мембранах рибосом, а також в мітохондріях. Ферменти, що
каналізують гідролітичне розщеплення органічних речовин (протеїнази, нуклеази,
естерази) розташовані головним чином в лізосомах.
Фіксація ферментів в органоїдах
клітини сприяє інтенсифікації і впорядкованості біохімічних процесів завдяки
направленому контакту між собою, а не випад кованому зштовхуванню.
Клітинна організація ферментів також
сприяє надходженню різних речовин в клітини і виведенню продуктів обміну, що є
важливою умовою взаємодії біохімічних процесів і їх великої швидкості.
При зміні умов існування організму в
процесі адаптації і особливо при патологічних процесах може порушуватися
унікальна будова клітини і субклітинних структур, що пояснює відхилення в
розподілі і функціях окремих ферментів, а також цілих ферментних систем.
Наприклад, при дії іонізуючого випромінювання порушується унікальна структура
мембран мітохондрій і в зв’язку з цим послаблюється фіксація на них таких
ферментів, як піруватдегідрогеназа і α-кетоглуторатдегідрогеназа, що
каналізують процеси декарбоксилування. В таких умовах порушується синтез АТФ,
що приводить до стану енергетичного голоду в організмі. Також при променевих
враженнях клітини підвищується проникливість лізосом і відбувається їх руйнування,
що приводить до переходу в цитозоль гідролітичних ферментів, що підсилюють
розщеплення білків нуклеїнових кислот і інших сполук.
Під впливом мікроорганізмів,
продуктів їх обміну та обломків клітин також може відбуватися руйнування
мембран лізосом. Ці фактори не тільки вивільнюють ферменти з лізосом, а й
грають роль індукторів їх біосинтезу. Отже ферменти лізосом не тільки виконують
захисну функцію, а і являються важливим механізмом очищення клітин від різних
продуктів обміну і деструктивних частинок, а також сприяють самовідновленню
клітин.
9. Значення ферментів для медицини
Життєдіяльність любого організму
забезпечується постійним і строго послідовним протіканням багатьох тисяч
хімічних реакцій, що каталізують ферментами. Ось чому в основі любих порушень
функцій організму лежать розлади діяльності ферментів. Механізми виникнення
подібних відхилень, роль ферментів у розвитку захворювань, діагностиці і
лікуванні - всі ці питання входять в самостійний розділ фітохімії - медичну
ферментологію.
Ферментопатії - захворювання,
пов'язані з порушенням діяльності ферментів. В залежності від причин, що
викликають ці порушення, виділяють декілька видів ферментопатій. По перше, це
спадкові ферментопатії, причина яких - порушення синтезу ферментів. Причини
цього знаходяться в порушенні генетичного апарату клітин. Виявлено 1500
спадкових ензимопатій, для 100 з них виявлена причина. До них відносяться,
наприклад, фенілвиноградна олігофренія, в основі якої лежить порушення синтезу
ферменту, що перетворює фенілалинін в тирозин. При цьому в організмі йде
накопичення фенілаланіну, який розпадається з утворенням токсичних продуктів,
що порушують обмін речовин в організмі, особливо у мозку. У дитини розвивається
психічна неповноцінність. Причинами інших ензимопатїй може бути недостатність
забезпечення організму незамінними факторами харчування, наприклад, вітамінами,
що являються основними частинами ферментів (аліментарні ензимопатії). При дії
токсинів, що гальмують діяльність ферментів виникають токсичні ензимопатії.
Велика роль ферментів у діагностиці
захворювань. Використання їх з цією метою пов'язана з тим, що ферменти
виробляються в клітинах різних органів і тканин і при їх руйнуванні, як в
звичайних умовах, так і при патології, поступають у кров, сечу, які використовуються
для визначення активності ферментів.
Можливість використання ферментів з
діагностичною метою основана на слідуючій характеристиці. Кожний орган має
характерний набір ферментів і поява їх у крові дозволяє локалізувати патологію.
Так, для серцевого м'яза серед великої групи ферментів найбільш специфічними
являються КК (креатинкіназа), АСТ (аспартатамінотрансфераза), ЛДГ
(лактатдегідрагеназа). В печінці локалізується АЛТ (аланінамінотрансфераза),
ЛДГ, ЩФ (лужна фосфатаза), АСТ. В скелетних м’язах ЛДГ, КК і в меншій мірі АСТ,
в нирках, ЛДГ, ЩФ і в значно менше АСТ. В підшлунковій залозі висока активність
α-амілази. Крім того різна
локалізація ізоферментів в органах і тканинах. Наприклад, ЛДГ-1 переважно
локалізується в серці, а ЛДГ-4,5 в печінці. Деякі ферменти виробляється в
різних тканинах, тому треба враховувати їх активність і кількісне
співвідношення. Так, в серці відмічено більше висока активність АСТ порівняно з
АЛТ, в печінці відмічено зворотне співвідношення. У зв’язку з цим для даних
ферментів введений, так названий, коефіцієнт де Рітіса - відношення АСТ/АЛТ,
яке в серці здорової людини дорівнює 1,33.
Другою причиною, що дозволяє
використовувати ферменти в діагностиці являється те, що в організмі здорової
людини підтримується стан динамічної рівноваги між процесами катаболізму та
анаболізму. Тому вміст в крові ферментів є величиною відносно постійною, а
підвищення або зниження активності ферментів свідчить про патологічний процес.
Так при інфаркті відмічено суттєве підвищення активності КК, АСТ, АЛТ, ЛДГ, для
панкреатиту характерно підвищення α-амілази, для захворювань
печінки, перш за все підвищення АЛТ, при злоякісних пухлинах кісток відмічено
підвищення активності лужної фосфатази.
Вихід ферментів в кров відбувається
не тільки при руйнуванні клітин, а й при підвищені проникливості клітинних
мембран. Останнє, як правило, відмічається на самому початку розвитку
патологічного процесу, часто до розвитку клінічної картини захворювання.
Цей факт ще більше підвищує
значимість ферментативної діагностики. Так КК і АСТ підвищується через 4-6
годин після інфаркту міокарду, активність α-амілаза через 3 години після
початку гострого панкреатиту.
Відмічена пряма залежність між
активністю ферментів і кількістю зруйнованих клітин. Чим вища активність
ферменту, тим більша зона зруйнованої тканини, а зниження активності свідчить
про локалізацію некротичного процесу.
Так, при гострому гепатиті, що
характеризується дифузним характером запального процесу, активність АЛТ зростає
в 50-100 разів порівняно з нормою і підтримується на цьому рівні на протязі 2-3
тижнів.
При інфаркті міокарду, що представляє
собою враження невеликої ділянки серцевого м'яза, активність КК і АСТ в крові
досягає максимуму на 3-5 добу, після чого знижується.
Визначення активності ферментів
використовується для диферентціальної діагностики. Визначення активності АЛТ і
АSТ і їх співвідношення дозволяє провести диференціальну діагностику інфаркту
міокарду і захворювань печінки. В нормі співвідношення АЛТ/АСТ = 1,33 -
коефіцієнт де Рітіса. При інфаркті міокарда цей коефіцієнти більше норми, тоді
як гепатити характеризуються його зниженням. При паренхіматозних жовтяницях
різко зростає активність АЛТ, АСТ, ЩФ, чого не спостерігається при
паренхіматозній жовтяниці.
Таким чином, ферменти надають суттєву
допомогу в питаннях діагностики, допомагають контролювати лікування хвороби і
процес реабілітації. При деяких захворюваннях (спадкові хвороби) ферменти
являються основним діагностичним тестом. Так, недостатність
фенілаланінгідроксилази завжди свідчить про розвиток фенілпіровиноградної
олігофренії.
10. Особливості використання ферментів як лікарських
препаратів
Пепсин, ліпази, амілази, панкреатин - знайшли широке
використання при недостатній секреторній функції шлунково-кишкового тракту
(замісна терапія). Трипсин використовується для очищення гнійних ран і
внутрішньом’язово як протизапальний засіб при остеомієлітах і гайморитах.
Фібринолізин використовується як фібринолітичний засіб. Для активації
діяльності відповідних ферментів використовуються в клініці коферменти. Знання
основ ферментології дозволяє створювати ферментативні препарати ціленаправленої
дії. Так, сульфаніламідні препарати дають позитивний ефект при коковій
інфекції. В основі їх дії лежить конкурентне гальмування ферментативної
реакції, так як вони є структурними аналогами субстратів, необхідних для
життєдіяльності кокових мікроорганізмів. Нікотинова кислота необхідна для
життєдіяльності туберкульозних бацил, а її структурний аналог гідразид
ізонікотинової кислоти (фтивазид) являється ефективним засобом для лікування
туберкульозу.
Все вищесказане підтверджує важливість і необхідність
вивчення ферментів з метою використання їх в медичній практиці.
Специфіка методів дослідження ферментів
Зумовлена перш за все низькою концентрацією ферментів в
тканинах. Звичайними методами кількісного аналізу, доступними в лабораторній
діагностиці, цю концентрацію визначити неможливо. Тому про концентрацію
ферменту судять пропорційно кількості перетвореного субстрату, або по кількості
продукту реакції. Тому в біоматеріалі визначається їх активність. Як приклад
визначення можна розглянути визначення активності α-амілази. Про активність α-амілази судять по кількості
розщепленого крохмалю, що є субстратом для даного ферменту. Ступінь розщеплення
крохмалю визначається йодометрично по зниженню зафарбованості розчину.
Одиниці активності ферменту
Активність ферменту визначають за кількістю розщепленого ним
субстрату в перерахунку на 1л сироватки крові за одиницю часу. За міжнародну
одиницю прийнята така кількість ферменту, яка в оптимальних умовах каталізує
перетворення 1 мкмоль субстрату за 1 хвилину (Е= мкмоль/хв). В перерахунку на
1л біологічного матеріалу цю величину можна передавати наступним чином:
Е/л = мкмоль/л • хв.
В міжнародній системі одиниць СИ за одиницю активності
ферменту прийнято КАТАЛ, що відповідає кількості ферменту, який перетворює 1
моль субстрату за 1 секунду ( кат=моль/сек). В перерахунку на 1л біоматеріалу:
катал=моль/сек • л.
білок вуглевод ліпід фермент
Лекція № 6. ЗАГАЛЬНІ УЯВЛЕННЯ ПРО
ОБМІН РЕЧОВИН ТА ЕНЕРГІЇ В ОРГАНІЗМІ
1. Обмін речовин як основна ознака
життєдіяльності організму
Живий організм тісно пов’язаний з
зовнішнім середовищем, яке поставляє необхідні йому харчові продукти та кисень.
В харчових продуктах багато мінеральних речовин і поживних речовин: білків,
жирів, вуглеводів, води і мінеральних солей.
В шлунково-кишковому тракті вони
перетравлюються і всмоктуються, а потім при участі кисню, окислюються з
виділенням енергії.
Далі з продуктів розпаду синтезуються
нові поживні речовини. Цей процес називається катаболізм, або диссиміляція.
Одночасно продукти розпаду і енергія використовується для синтезу специфічних
речовин і запасання енергії - це процес анаболізму або асиміляції. У здорової
людини ці процеси збалансовані.
Сукупність реакцій асиміляції та
дисиміляції визначається як обмін речовин або метаболізм.
Відповідно метаболізм включає в себе
процеси надходження поживних речовин в організм, їх перетворення до кінцевих
продуктів і виведення продуктів обміну у зовнішнє середовище. Все це тісно
пов'язане з обміном енергії, яка вивільняється при розпаді речовин і
використовується в біосинтезі.
. Види процесів обміну речовин в
організмі - пластичний та енергетичний, їх характеристика
Обмін речовин і енергії в організмі
протікають одночасно.
Обмін речовин ділять на зовнішній
(надходження харчових продуктів в організм і виділення продуктів розпаду) і
проміжний. Проміжний включає процеси переварювання та всмоктування поживних
речовин, надходження їх у клітини, розпад до проміжних або кінцевих продуктів і
синтез з них специфічних сполук для кожної тканини, а також контроль і регуляцію цих процесів.
3. Продукти харчування - основне
джерело пластичного матеріалу та енергії для забезпечення життєдіяльності
організму
Серед поживних речовин, необхідно
виділити такі, що не можуть синтезуватися в організмі. Вони називаються
незамінними факторами харчування. До них відносяться незамінні амінокислоти:
лізин, метионін, триптофан, фенілаланін, валін, лейцин, ізолейцин. Вони
необхідні для синтезу повноцінних білків.
До незамінних факторів харчування
відносяться ненасичені жирні кислоти: лінолева, лініленова, арахідонова, що
знаходяться в рослинних оліях, вони необхідні для синтезу вітамінів,
фосфоліпідів, простогландинів.
Їх добова норма складає біля 1г, що знаходиться
в 25-30г рослинної олії.
Значна частина вітамінів також не
синтезується в організмі і повинна поступати з їжею.
Поряд з перерахованими речовинами
організму постійно потрібні мікро та макроелементи. Вони приймають участь у
побудові всіх клітин організму і входять в склад активного центра ферменту.
Кальцій і фосфор складають основу кісткової тканини, натрій та калій входять в
склад буферних систем організму, приймають участь в передачі нервових
імпульсів.
До незамінних факторів відноситься і
вода. Незважаючи на те, що вона частково утворюється в організмі, цього
недостатньо тому вона повинна входити в склад добового раціону.
Таким чином у склад добового раціону
повинні входити незамінні фактори харчування.
Особливістю проміжного обміну є
постійна пристосованість до потреб клітини і організму в цілому. При змінах
умов зовнішнього і внутрішнього середовища організму, проміжний обмін може
перебудовуватися і підтримувати життєдіяльність клітини в нових умовах.
Наприклад, при недостатності в клітині кисню глюкоза розпадається до молочної
кислоти, а при достатній кількості кисню кінцевими продуктами розпаду глюкози є
вуглекислий газ і вода.
Друга особливість полягає в тому що
існує тісний взаємозв'язок між різними речовинами в ході їх перетворень.
Наприклад, при розпаді деяких
амінокислот утворюються без азотисті залишки з яких може синтезуватися глюкоза.
4. Основні етапи вивільнення
енергії харчових речовин. Біологічне окислення
Обмін енергії включає в себе процеси
вивільнення, накопичення і використання енергії, що утворюється при розпаді
поживних речовин в організмі.
Особливість цих процесів полягає в
тому, що кінцеві етапи вивільнення енергії та її запасання при розпаді різних
речовин однакові.
Основним носієм енергії в природі є
електрон. Одержавши кількість енергії він переходить на більш високий
енергетичний рівень, тобто збуджується. Переходячи на більш низьку енергетичну
орбіту, електрон віддає енергію. Якщо ця енергія витрачається на виконання
роботи, то вона називається вільною. Не використана на роботу енергія,
переходить в тепло і вважається розтраченою.
Сказане має місце і в живій природі.
Основним джерелом енергії для всіх організмів на землі є сонячна радіація, що
виникає в результаті ядерного синтезу. Фотосинтезуючі клітини синтезують в рослинах
крохмаль. Тварини нездатні до фотосинтезу і одержують необхідну енергію в виді
готових органічних речовин, в ході розпаду /окислення/ яких енергія
вивільняється, а електрони переходять на більш низьку енергетичну орбіту.
Вивільнена енергія витрачається на тепло та підтримку температури тіла. Друга
частина йде на синтез макроергічних сполук, в яких енергія переходить в енергію
фосфатного зв’язку. В першу чергу до них відноситься АТФ.
Величина цього макроергічного зв’язку
складає 33,5 - 41,9 кДж/ моль. З других макроєргічних сполук слід відмінити
креатинфосфат, фосфоєнол - піровиноградну кислоту, ГТФ, УТФ, ТТФ.
Особливістю перерахованих сполук
являється те, що при розпаді енергії макроергічних сполук не розсіюється, а
переноситься на другі сполуки. Це можна спостерігати на прикладі АТФ.
Для її утворення потрібні АДФ, Н3Р04
і деяка кількість енергії. Відповідно при розпаді утворюються вихідні речовини
і виділяється енергія.
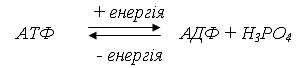
Таким чином АТФ є переносником
енергії і зв'язує між собою процеси, що йдуть з виділенням енергії.
Процес вивільнення енергії можна
розбити на три етапи.
І. На першому етапі, який протікає в
шлунково-кишковому тракті проходить розщеплення високомолекулярних сполук і
всмоктування утворених мономерів. Так білки розпадаються до амінокислот, жири
до гліцерину та вищих жирних
кислот, вуглеводи до моносахаридів. На першому етапі вивільняється 0,1%
енергії.
ІІ. На другому етапі мономери
розпадаються в клітинах до більш простих сполук, котрі можуть бути однаковими у
різних мономерів. Так при окисленні вуглеводів, жирів, амінокислот хоч і
різними шляхами, утворюється одна і таж речовина - ацетил КоА.
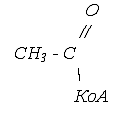
На другому етапі вивільняється
приблизно третя частина всієї енергії, розщеплених речовин.
Ш. Третій етап представляє собою
повне окислення ацетил-КоА в циклі Кребса з утворенням вуглекислого газу і
вивільненням водню. Цей етап протікає однаково у всіх клітинах, точніше в
матриксі мітохондрій. Цикл Кребса представляє собою замкнуту систему реакцій,
що починається зі взаємодії ацетил-КоА і щавлево-оцтової кислоти з утворенням
лимонної кислоти, котра проходячи через ряд стадій, знову перетворюється в
щавлево-оцтову кислоту. Серед других сполук циклу Кребса особливе значення має ізолимонна,
а-кетоглутарова, янтарна та яблучна кислоти. Ці кислоти і окислюються в циклі Кребсу. Окислення каталізується
ферментами дегідрогеназами, коферментами яких є похідні вітамінів, нікотинової
кислоти і рибофлавіну (НАД, НАДФ, ФАД).
Незначна частина вивільненого водню
використовується для синтезу нових сполук, а більша частина окислюється киснем
з утворенням води. При цьому в ході цього процесу і проходить вивільнення
енергії, що знаходиться в електронах.
В експерименті взаємодія водню з
киснем хоча і приводить до утворення води, то супроводжується вибухом, що
свідчить про великий запас енергії в електронах водню.
В організмі утворення води відбувається через ряд реакцій і тому
енергія виділяється не одномоментно, а поступово. Подібна система реакцій називається
ланцюгом біологічного окислення і включає ряд окисно-відновних реакцій, в ході
яких проходить перенос водню на кисень. В цих реакціях приймають участь НАД,
НАДФ, цитохроми. Особливістю вказаних сполук є їх здатність як окислюватись,
так і відновлюватись. Так НАД може легко приєднувати водень (НАДН) і віддавати
на слідуючи сполуки, наприклад ФАД. При цьому НАД окислюється, а ФАД
відновлюється.
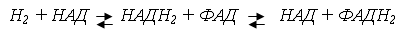
Механізм дії цитохромів полягає в
тому, що в їх складі є атом заліза з перемінною валентністю, котрий може
знаходитись як в окисному так і відновленому стані.
В ланцюзі біологічного окислення є
декілька цитохромів а, в, с, d. Один з цих цитохромів а3 або
цитохромоксидаза передає електрони на кисень.
Значення ланцюга біологічного
окислення полягає в тому, що електрони переходять з одного переносника на
другий, постійно опускаючись з більш високого рівня на низький, при цьому йде
втрата енергії. Віддається накопичена енергія.
Вивільнена енергія частково
витрачається на утворення тепла, а більша частина на утворення АТФ. При цьому
одні речовини при своєму окисленні
вивільняють енергію достатню для синтезу трьох молекул АТФ тоді як інші тільки для двох молекул АТФ.
Синтез АТФ проходить двома шляхами -
окислювального фосфорування, тобто АТФ утворюється шляхом приєднання до АДФ
неорганічного фосфату з використанням енергії, що вивільнилася під час
окислення різних речовин. Всі компоненти ланцюга біологічного окислення
знаходяться на внутрішній мембрані мітохондрій.
В організмі існує і другий шлях
синтезу АТФ. Деякі речовини в ході перетворень накопичують в своїх зв’язках
достатню кількість енергії, яку можуть передати для синтезу АТФ. Цей шлях
синтезу носить назву субстратного фосфорування. Наприклад, при розпаді
вуглеводів утворюється фосфоепол-піровиноградна кислота, що має запас енергії в
фосфатному зв’язку. При взаємодії с АДФ вказана кислота передає енергію цього
зв’язку на синтез АТФ.
. Регуляція обміну речовин та енергії
Основні етапи обміну речовин:
1. Надходження в організм поживних
речовин.
2. Переварювання та всмоктування
їх в шлунково-кишковому тракті. Надходження їх в клітини, де проходить їх
перетворення.
Регуляція обміну речовин та енергії
може відбуватися:
І. На рівні всього організму і систем
органів. Наприклад, фактори зовнішнього середовища через центральну нервову
систему діють на обмінні процеси в організмі.
Надходження поживних речовин контролюється різними транспортними системами. До
них відноситься ретинолзв’язуючий білок, що переносить вітамін А, транскортин,
що транспортує стероїдні гормони, церулоплазмін, позв’язує мідь трансферин, що
транспортує залізо, ліпопротеіди, що транспортують жири.
ІІ. Клітинний рівень регуляції. Тут
важлива роль належить клітинній мембрані.
Продукти обміну та поживні речовини
поступають в організм до клітин,
діяльність яких регулюється. Наприклад, якщо не достає енергії в клітині, то
ацетил КоА поступає з цитоплазми в мітохондрії,
де окислюючись, забезпечує її накопичення. І, навпаки, при надлишку енергії
ацетил КоА цитоплазми йде на синтез жирних кислот, ацетонових тіл, холестерину.
ІІІ. Регуляція може проходити на
молекулярному рівні. Так регулюються процеси розпаду і синтезу молекул глюкози,
жирних кислот, гліцерину, амінокислот. Цей рівень контролюється діяльністю
ферментів, субстратів, інгібіторами і активаторами, оптимальними умовами
діяльності ферментів.
Контроль над всіма процесами здійснює
нервова система. Вона впливає на фізіологічні, психічні, метаболічні та інші
процеси. Нервова система тісно пов’язана з ендокринною системою. Про це
говорить той факт, що зниження діяльності однієї зразу ж підсилює діяльність
другої. Регуляторний вплив нервової
системи в значній мірі проявляється через гуморальні фактори, до яких
відносяться гормони, що виробляються залозами внутрішньої секреції, тканинні
гормони та простогландини.
Лекція № 7. ГОРМОНИ
. Загальні відомості про гормони
Гормони (від грецького hormaino -
спонукаю) - біологічно активні сполуки, що виділяються залозами внутрішньої
секреції в кров або лімфу й регулюють метаболізм клітини. Для них характерні
наступні загальні властивості:
1. Дія на відстані від місця
продукції (дистантність дії).
2. Специфічність, яка полягає в
тому, що ефект кожного з них не адекватний ефекту інших гормонів.
3. Висока швидкість утворення і
інактивації, обумовлена короткочасністю дії.
4. Висока біологічна активність
(ефект проявляється в присутності мінімальних концентрацій гормону).
5. Роль посередника в передачі
інформації від нервової системи до клітини.
Подібні речовини виділяють також
клітини деяких органів, що не відносяться до залоз внутрішньої секреції
(клітини шлунково-кишкового тракту, гладкі клітини сполучної тканини, клітини
нирок, клітини эндотелію. На відміну від гормонів ці біологічно активні
речовини діють у місцях утворення і називаються гормоноподібними речовинами
(гормоноїдами).
Номенклатура гормонів побудована
таким чином, що назви відображають джерело (орган-продуцент) або функцію
гормону (наприклад, гормон росту, ліпотропний гормон).
. Класифікація гормонів
Класифікація гормонів заснована на
хімічній будові.
1. Білково-пептидної природи:
- складні білки
(фолікулостимулюючі, лютеінизуючий, тіреотропний);
- прості білки (пролактин,
гормон росту, інсулін і ін.);
- пептиди (АКТГ, глюкагон,
кальцитонін, вазопресин, окситоцин).
2. Похідні амінокислот
(тироксин, мелатонін, катехоламіни
3. Стероїдної природи
(кортикостероїди і статеві гормони).
Анатомічна класифікація невдала, тому
що деякі гормони утворяться у двох-трьох залозах або депонуються поза місцем
продукції. Однак ця класифікація зручна під час обговорення регуляторних зв'язків,
а хімічна - під час обговорення механізмів дії.
3. Механізм дії гормонів
У керуванні метаболізмом гормони
беруть участь у такий спосіб. Потік інформації про стан внутрішнього середовища
організму і про зміни, пов'язані з зовнішніми впливами, надходить у нервову
систему, там переробляється і формується відповідний сигнал. Він надходить до
органів-эфекторів у вигляді нервових імпульсів і опосередковано через
ендокринну систему.
Пунктом, де зливаються потоки
нервової й ендокринної інформації, є гіпоталамус: сюди надходять нервові
імпульси з різних відділів головного мозку. Вони визначають продукцію й
секрецію гипоталамічних гормонів, що впливають у свою чергу через гіпофіз на
продукцію гормонів периферичними ендокринними залозами. Гормони периферичних залоз,
зокрема мозкової речовини наднирочників (біогенні аміни), контролюють секрецію
гипоталамічних. Вміст гормону в кровотоці підтримується за принципом
саморегуляції. Високий рівень гормону виключає або послаблює по механізму
зворотного зв'язку його утворення, низький рівень підсилює продукцію.
Ці взаємозв'язки представлені на
малюнку.
Механізм дії гормонів. Гормони діють
на тканини вибірково, що обумовлено неоднаковою чутливістю тканин до них.
Органи і клітини, найбільш чутливі до впливу певного гормону, прийнято називати
мішенню гормону (орган-мішень або клітина-мішень). Специфічність гормонів
стосовно клітин-мішенів обумовлена наявністю в клітин специфічних рецепторів,
які входять до складу плазматичних мембран. Рецептори є глікопротеїнами, їхня
специфічність обумовлена вуглеводним компонентом білка, а також вуглеводними
компонентами гангліозидів ліпідного бішару мембран.
Для деяких гормонів описані
специфічні ділянки зв'язування в ядрі клітини.
Залежно від того, де в клітині
відбувається передача інформації, можна виділити такі варіанти дії гормонів:
Мембранний (локальний).
Мембранно-внутрішньоклітинний або
опосередкований.
Цитозольний (прямий).
Мембранний тип дії реалізується в
місці зв'язування гормону з плазматичною мембраною, полягає у вибірковій зміні
її проникливості. По механізму дії гормон у цьому випадку виступає як
аллостеричний эфектор транспортних систем мембрани. Так, наприклад,
забезпечується трансмембранний перенос глюкози під дією інсуліну, амінокислот і
деяких іонів. Звичайно мембранний тип дії зв’язаний з
мембранно-внутрішньоклітинним.
Мембранно-внутрішньоклітинна дія
гормонів характеризується тим, що гормон, не проникаючи в клітину, впливає на
обмін у ній через посередник, що є як би представником гормону в клітині -
вторинним посередником (первинний посередник - сам гормон). Описано три групи
вторинних посередників: циклічні нуклеотиди, іони кальцію і 2,5-олігоаденіловий
нуклеотид. При цьому механізмі гормон зв’язується з специфічним рецептором,
комплекс гормон-рецептор взаємодіє з білком, який підвищує проникливість
клітинної мембрани.
Іони кальцію як посередник ефекту
гормонів у клітині. Внутрішньоклітинний вміст кальцію досить незначний (на
чотири порядку нижчий, ніж поза клітиною). Іони кальцію надходять із
зовнішнього середовища по двох кальцієвих каналах у мембрані. Відкачування
кальцію із клітини здійснює Са2+-АТФаза (за рахунок енергії АТФ) в
обмін на іони натрію, що надходять ззовні. У клітину кальцій надходить під дією
різних зовнішніх стимулів і взаємодіє із Са2+-зв’язуючими білками
цитоплазми. Ці білки виконують роль регуляторів. Один з них - кальмодулін.
Зв'язуючись із ним, кальцій утворює комплекс Са2+-кальмодулін, що
регулює активність різних ферментів, змінюючи біохімічні функції клітини.
Цитозольний механізм дії. Гормони з ліпофільними
властивостями (стероїди) здатні проникати через мембрану в клітину й вступати в
контакт із рецепторами, що перебувають у цитозолі. У вигляді комплексу
гормон-рецептор вони переміщаються в ядро клітини, де вибірково впливають на
активність геномів, змінюючи доступність для транскрипції певних матриць ДНК.
Отже, гормони впливають на синтез мРНК і швидкість синтезу специфічних
білків-ферментів. Це, природно, спричиняє зміну швидкості й спрямованості
метаболічних процесів у клітині.
Змішаний тип передачі інформації
властивий йодтиронінам (гормонам щитовидної залози), які по ліпофильним
властивостям займають проміжне положення між водорозчинними й ліпофильними
(стероїдними) гормонами. Ця група гормонів реалізує свій ефект по
мембрановнутрішньоклітинному, і цитозольному механізмам.
Модуляція дії гормонів може
забезпечуватися як ендогенними, так і екзогенними факторами. До ендогенних
модуляторів гормонального ефекту відносять простогландини, які регулюють обмін
речовин на клітинному рівні.
З екзогенних модуляторів
гормонального ефекту в експериментальній і практичній медицині використовують
сполуки, що змінюють активність фосфодієстераз, швидкість руйнування циклічних
нуклеотидів.
4. Регуляція синтезу і секреції
гормонів
Гормони гіпоталамо-гіпофізарної
системи
В гіпоталамусі у відповідь на нервові
або хімічні імпульси секретуются і транспортуються в аденогіпофіз (по
гіпоталамо-аденогіпофізарній портальній системі) біологічно активні пептиди,
які називають регуляторними гормонами. Назва визначена їхньою функцією: ці
пептиди регулюють продукцію гіпофізарних гормонів. Нові робочі назви
регуляторних гормонів відображають біологічне значення кожного з них:

Всі гіпоталамічні гормони -
олігопептиди, структура деяких з них вивчена детально. Функція ліберинів -
активація, статинів - гальмування продукції відповідних гормонів в
аденогіпофізі - основний їхній орган-мішень. Виключення становить соматостатін:
його мішень також і панкреас, де цей гормон синтезується і гальмує секрецію
інсуліну і глюкагону.
Гіпофізарні гормони. В аденогіпофізі
утворяться тропні гормони, що контролюють функцію периферичних залоз
внутрішньої секреції.
1. Тіреотропний гормон (тіреотропін)
- глікопротеїд, що складається із двох субодиниць. Продукцію гормону активує
тіроліберін, гальмують гормони щитоподібної залози за принципом зворотного
зв'язка.
Тіреотропін контролює функцію
щитоподібної залози:
- прискорює поглинання йоду із
крові;
- прискорює включення йоду в
тіреоглобулін;
прискорює протеоліз тіреоглобуліна,
тобто вивільнення тіреоідних гормонів і їхню секрецію.
Ефект гормону опосередковується по
мембранно-внутрішньоклітинному типу. Поряд із клітинами тіреоідного епітелію
мішенню гормону є клітини жирової тканини, в якій він прискорює ліполіз.
2. Адренокортикотропний гормон (АКТГ)
- поліпептид з 39 амінокислотних залишків. Продукція активується
кортиколіберином, обмежується кортикостероїдними гормонами (негативний
зворотний зв'язок).
Орган-Мішень АКТГ - наднирочники, у
корковому шарі яких гормон прискорює синтез і секрецію кортикостероїдів із
холестерола. Це перетворює його в попередник кортикостероїдів. Крім того, АКТГ
гальмує зв'язування кортизола в кров отоці з білком, що забезпечує його
виведення. Таким чином, АКТГ не тільки стимулює продукцію, але й «подовжує
життя» одного з важливих кортикостероїдів.
Мішень АКТГ - також клітини жирової
тканини (активація ліполізу) і клітини нейрогіпофізу (активація утворення
меланоцитстимулюючого гормону).
3. Гонадотропні гормони. Із чотирьох
таких гормонів три синтезуються в аденогипофизе.
Фолікулостимулюючий гормон (ФСГ) -
гликопротеид, що складається із двох субъединиц. Продукція активується
фоліберином. Інгібітор утворення фоліберину - естрогени (зворотний негативний
зв'язок).
Орган-Мішень у самок - яєчники, де
ФСГ ініціює розвиток фолікулів, клітини внутрішнього шару яких починають
синтезувати естрогени. Останні, як уже сказано, за принципом зворотного зв'язку
гальмують продукцію фоліберину, а отже, і ФСГ.
У самців орган-мішень - насінники, де
ФСГ стимулює розвиток епітелію сім’явивідних протоків і появу великого числа
сперматоцитів на всіх стадіях розвитку, включаючи стадію зрілих.
Лютеінізуюючий гормон (ЛГ) - також
глікопротеїд, складається із двох субодиниць. Його продукція контролюється
люліберином (активація) і прогестероном (гальмування за принципом зворотного
зв'язка).
Мішень ЛГ у самок - зрілий фолікул
(граафов пухирець). Гормон забезпечує його остаточне дозрівання, овуляцію й
утворення жовтого тіла.
Мішень ЛГ у самців - клітини Лейдига,
де гормон стимулює утворення тестостерону, і насінники, де гормон стимулює ріст
інтерстиційних клітин.
Пролактин - простий білок, синтез
якого прискорюється пролактолібери-ном, обмежується пролактостатином і
прогестероном (зворотний негативний зв'язок).
Мішень пролактину - молочна залоза.
Тут гормон у синергізмі з естрогенами стимулює проліферацію функціональної
тканини й секрецію молока. Крім того, пролактин гальмує ефект лютеінізуючого
гормону - овуляцію і лютеінізацію. У жировій тканині пролактин активує
ліпогенез.
Хоріонічний гонадотропін не є
гормоном гіпофізу. Розглядається тут у зв'язку з подібністю по ефеку з
гонадотропними гормонами.
Утворюється у плаценті в ранній
термін вагітності (перший тиждень після строку настання чергової менструацій,
що не відбулася). Діє подібно ЛГ, стимулюючи ріст жовтого тіла під час
вагітності.
4. Гормон росту (соматотропін) -
простий білок, продукція якого контролюється соматоліберіном (активація) і
соматостатіном (гальмування секреції). Ростстимулююча дія гормону проявляється
з неоднаковою інтенсивністю в різних тканинах і реалізується за рахунок:
- стимулювання синтезу РНК і
білків (анаболічна дія);
- підвищення рівня глюкози в
крові (діабетогенний ефект);
збільшення вмісту глікогену
в м'язах і міокарді (глюкостатичний ефект);
підвищення рівня вищих
жирних кислот (ліпідмодилюючий ефект);
росту ниркового кліренсу і
канальцьової екскреції (ренотропний ефект);
стимуляції ретикулоцитозу
(еритропоетичний ефект):
стимуляції хондро- і
остеогенезу.
Стосовно одних тканин ефект
соматотропного гормону прямий (острівці Лангерганса, кісткова тканина).
Стосовно інших тканин (хрящ, жирова, м'язова) ефект гормону опосередкується
поліпептидами, які, очевидно, специфічні для даної тканини. Ці посередники
ефекту соматотропного гормону (виділено шість типів) називають соматомедини.
5. Ліпотропіни представлені двома
близькими по амінокислотному набору і послідовності білками α-
і β-ліпотропіни. Єдина відома
мішень - жирова тканина, у клітинах якої гормони активують ліполіз. β-ліпотропін - попередник ендорфінів
(при інкубації гормону у водному екстракті мозку вивільняються продукти з
опіато-подібною активністю).
Нейрогіпофіз секретує вазопресин і
окситоцин, меланоцитстимулюючі гормони й когерін.
. Вазопресин -нанопептид утворюється
в супраоптичних і паравентрикулярних ядрах гіпоталамусу з
поліпептидів-попередників (нейрофізинів), мігрує по аксонах
гіпоталамо-гіпофізарного тракту в нейрогіпофіз, накопичуючись у ньому. Секреція
контролюється меланоцитрегуляторными гормонами (меланолиберин і меланостатин).
Мішені вазопресину - артеріоли і
капіляри легеневих і коронарних судин. Гормон викликає їхнє звуження, що
супроводжується підвищенням артеріального тиску і пов'язаним із цим розширенням
мозкових і ниркових судин (вторинне розширення). Ще одна мішень - дистальні
звиті канальці і збірні трубочки нефрону. Ефект реалізується через
аденілатциклазну систему. Це проявляється активацією гіалуронідази, посиленим
розщепленням гіалуронової кислоти і пов'язаним із цим ростом проникності
канальцевого епітелію. У результаті збільшення проникності прискорюється
реабсорбція води, що веде до зменшення об’єму кінцевої сечі. При введенні
вазопресину ззовні його ефект чітко проявляється зниженням діурезу. Це
визначило другу назву гормону - антидіуретичний. Дефіцит гормону проявляється
збільшенням діурезу (поліурія), що супроводжується підвищеною спрагою
(полідипсія).
2. Окситоцин, як і вазопресин,
нонапептид. По місцю утворення не відрізняється від вазопресину, тим же шляхом
надходить у нейрогіпофіз, де і депонується. Секреція контролюється
меланоліберином і меланостатином.
Органи мішені - гладка мускулатура
кишечника, жовчного міхура і сечоводів, а також міометрій. Викликає виділення
молока.
Діє через аденілатциклазну систему,
як і вазопресин.
3.
Меланоцитстимулюючі
гормони (МСГ) існують у двох варіантах - α- і β-МСГ (коротколанцюгові
поліпептиди), продукція контролюється меланоліберином і меланостатином. Мішень
- меланофорні клітини, ефект - розосередження чорного пігменту (меланіна). У
людей при введенні може підсилюватися пігментація вже пигментованої шкіри,
депігментовані ділянки на введення не реагують.
4.
Когерін -
маловивчений гормон нейрогіпофізу, введення якого викликає ритмічні гармонічні
скорочення худої кишки, що тривають до 5 г.
Лекція № 8. ОБМІН ПРОСТИХ БІЛКІВ
. Добову потребу в білках треба в
основному визначити як таку кількість, яка повністю забезпечує всі потреби
організму. Величина ця не однакова для всіх і залежить від статі, віку,
трудової діяльності та інших факторів. Але при складанні харчового раціону слід
враховувати не тільки кількість білків, але і кількісний і якісний склад.
Це пов'язано з тим, що всі
амінокислоти, що входять до складу білків, можна розділити на незамінні та
замінні.
Незамінні амінокислоти, які не
синтезуються в організмі і повинні регулярно поступати з їжею у складі
повноцінних білків: триптофан, лізин, метіонін, фенілаланін, треонін, валін,
лейцин. Вони в основному знаходяться в продуктах тваринного походження (м'ясо,
риба, сир), в рослинних продуктах їх значно менше.
Замінні амінокислоти синтезуються в
організмі. До них відноситься більша частина амінокислот. Білки, що мають в
своєму складі всі незамінні амінокислоти, є біологічно повноцінними. Крім того,
в таких білках співвідношення замінних і незамінних амінокислот оптимальне.
Важливим питанням є білкові резерви
організму. Білки на відміну від вуглеводів про запас не відкладаються.
Відмічено, що чим більше білків поступає з їжею, тим більше виводиться у
вигляді кінцевих продуктів обміну. При білковому голодуванні або білковій
недостатності якийсь час може підтримуватись білкова рівновага, але при цьому
зменшується вміст білків організму. В першу чергу це відноситься до білків
плазми крові (втрата 1 г білку супроводжується втратою 30 г білку тканин), а в
подальшому розходжуються білки печінки, серця, м'язів.
2. Перетравлення та всмоктування
білків
В порожнині рота білки не
розщеплюються, так як тут відсутні протеолітичні ферменти (протеази). В шлунку
починається активне перетравлення білків під дією протеаз - пепсина і
гастриксина, які в сильно кислому середовищі шлунку (рН 1,5-2,5) проявляють
максимальну активність. Кисле середовище створюється за рахунок соляної
кислоти, яка виробляється слизистою оболонкою шлунку і виконує різні функції в
шлунково-кишковому тракті, сприяє денатурації білків їжі, що полегшує їх
гідроліз ферментами, активує пепсиноген.
З протеолітичних ферментів основним є
пепсин, який синтезується з свого проферменту пепсиногена шляхом відщеплення
від нього поліпептиду і при участі у цьому процесі соляної кислоти або
активного пепсину. За добу у шлунку виробляється 2г пепсину. Пепсин розщеплює
пептидні зв'язки, викликає розпад білків до окремих амінокислот або
поліпептидів. Він гідролізує зв'язки, утворені головним чином ароматичними та
дикарбоновими кислотами. Другою протеазою шлунку є гастриксин, оптимум рН якого
лежить в межах 3,5- 4,5.
Наявність у шлунку цих двох ферментів
з різним оптимумом рН фізіологічно оправдана. На початку процесу перетравлення
білків оптимум рН шлункового соку складає 1,0-1,5, а потім змінюється до рН
4,0-4,5. Це пов'язано з частковою нейтралізацією кислого вмісту шлунку
речовинами лужної природи, які утворюються при перетравлені їжі. Тому на
початку перетравлення основний вплив на білки має пепсин, а по мірі здвигу рН і
зниження активності пепсину зростає каталітична дія гастриксину. В шлунку йде
активний процес гідролізу альбумінів та глобулінів і значно повільніше колагену
та еластину.
У шлунковому соку у дітей знайдений
хімозин (ренін), що денатурує молоко і розщеплює казеїн. У процесі росту дитини
активність його спадає.
У кишечнику поліпептиди і
нерозщеплені білки гідролізуються ферментами підшлункової залози і клітин
слизової оболонки тонкої кишки (трипсину, химотрипсину, аміно- і кокарбоксилази),
які в слаболужному середовищі кишечника проявляють максимальну активність (рН
7,8-8,2). Трипсин виробляється у вигляді свого проферменту трипсиногену і
активується ентеропипдазою або раніше утвореним трипсином. Трипсин гідролізує
пептидні зв'язки, створені аргіном та лізином. Химотрипсин синтезується з
химотрипсиногена під дією трипсина і розщеплює пептидні зв'язки в білках або
поліпептидах. Механізм дії аміно- і кокарбоксипептидаз полягає в гідролізі
кінцевих амінокислот, що мають вільну карбоксильну групу. Нерозщеплені невеликі
білки піддаються дії специфічних тетрапептидаз, але вже в слизистій оболонці
тонкого кишечника.
Таким чином, в результаті
перетравлення білків у ШКТ утворюються вільні амінокислоти, що поступають у
кров і по ворітній вені - в печінку. Приблизно 5% від них попадає в лімфу. В
печінці значна частина амінокислот йде на синтез специфічних білків
(альбумінів, глобулінів, фібриногену, ферментів), а інша частина з током крові
розноситься до органів і тканин, де використовується клітинами. У людини в
нормі концентрація амінокислот у крові підтримується на постійному рівні.
Загнивання білків в кишечнику -
процес розпаду амінокислот і білків під дією ферментів мікроорганізмів товстої
кишки. При цьому утворюються токсичні речовини (кадаверін, фенол, індол,
скатол), які всмоктуються і поступають по ворітній вені в печінку, де
знезаражуються при участі активованої сірчаної або глюкуронової кислот. В
результаті вони перетворюються в нешкідливі для організму продукти типу
фенол-сірчаної, крезолглюкуронової та інших кислот і виводяться з сечею.
3. Проміжний обмін амінокислот
а) дезамінування. Цей процес полягає
в відщепленні від амінокислоти аміногрупи при участі ферментів дезаміназ або
оксидаз. В результаті утворюється безазотистий залишок, а аміногрупа
виділяється у вигляді аміаку. Дезамінування може проходити різними шляхами:
відновним, гідролітичним, внутрішньомолекулярним і окисним.
Найбільш активно окисному
дезамінуванню підлягає глутамінова кислота, що пов'язано з високою активністю глутаміндегідрогенази,
що є у всіх тканинах.
В якості безазотистого залишку
утворюється α- кетоглутарова кислота.
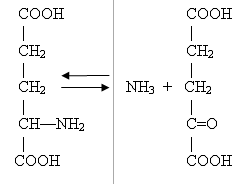
Глутаміндегідрогеназа каталізує як
пряму, так і зворотну реакцію, тобто має зворотність дії. Зворотна реакція
синтезу глутамінової кислоти з аміаку і α-кетоглутарової кислоти носить
назву відновлювального амінування.
б) переамінування. В 1937 р. Крицман
вперше знайшов можливість переносу аміногрупи від амінокислоти на кетокислоту
без звільнення при цьому аміаку. Цей процес каналізується амінотрансферазами,
коферментами яких є фосфопіродоксаль (вітамін В6)
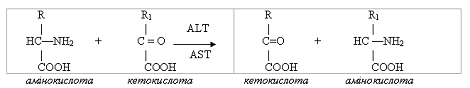
Процес переамінування проходить в два
етапи: на першому -амінотрансфераза відщеплює аміногрупу від амінокислоти, яка
при цьому перетворюється в α-кетокислоту, а аміногрупа
приєднується до коферменту. На другому етапі - кофермент переносить цю групу на
другу α-кетокислоту, яка перетворюється на нову амінокислоту. А
кофермент відновлюється в свою первинну форму. Прикладом може служити
переамінування між аланіном і α-кетоглутаровою кислотою
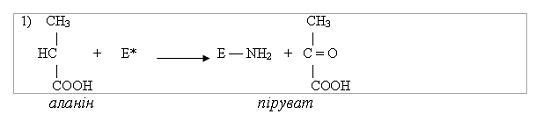
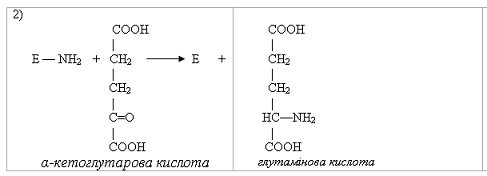
Переамінуванню підлягають практично
всі амінокислоти, крім лізина, аргініна, треоніну.
Для організму процес переамінування
має особливе значення, так як це є основним шляхом синтезу замінних амінокислот
з відповідних α-кето-кислот. Значна частина останніх
являється проміжними продуктами обміну вуглеводів, як, наприклад,
піровиноградна кислота, що використовується для синтезу аланіну. Це ще раз
свідчить про взаємозв’язок різних видів обміну речовин в організмі, зокрема
вуглеводного і білкового.
Переамінування достатньо активно
протікає в різних тканинах організму, але при деяких захворюваннях цей процес
порушується внаслідок зниження активності амінотрансфераз. Тому визначення
активності амінотрансфераз використовується в діагностичних цілях при
захворюваннях печінки та серця.
в) декарбоксилування. Це процес
відщеплення вуглекислого газу від карбоксильної групи амінокислот з утворенням
відповідних амінів.
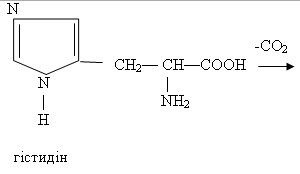
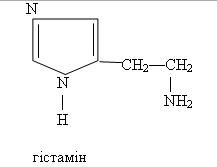
Таким шляхом утворюється триптамін з
триптофану, γ-аміномасляна кислота з глутамінової,
тирамін з тирозину. Ці сполуки мають сильну біологічну дію на організм і тому
називаються біогенними амінами. Так, гістамін викликає розширення капілярів і
підвищення їх проникливості, звуження крупних судин, скорочення гладкої
мускулатури внутрішніх органів, підсилює секрецію соляної кислоти у шлунку. Серотонін
(похідний триптофану) сприяє підвищенню кров'яного тиску і звуженню бронхів, є
медіатором ЦНС. Його дія на ЦНС неоднозначна: малі дози подавляють, а високі
стимулюють її діяльність, γ-аміномасляна кислота є
тормозним медіатором в ЦНС.
В організмі значна кількість
біогенних амінів знаходиться в неактивній формі, з якої звільнюється в разі
необхідності. Свою біологічну дію вони проявляють у вільній формі, а потім
руйнуються в печінці моноамінооксидазами.
. Аміак як кінцевий продукт розпаду
амінокислот
В результаті різноманітних процесів в
організмі амінокислоти повністю розпадаються до аміаку, вуглекислого газу та
води. Вода є необхідним продуктом для всіх обмінних процесів у організмі.
Вуглекислий газ приймає участь в побудові карбонатної буферної системи, в
активованій формі приймає участь у побудові жирних кислот, пуринових та
піримідинових основ, вуглеводів. Виводиться він з організму через легені.
Аміак є одним з джерел азоту в
організмі. Азот використовується для підтримування азотистої рівноваги, в тому
числі для синтезу білку, побудови небілкових азотовмісних сполук (пуринових та
піримідинових основ, холіну, креатинину, глюкозоамінів). Але частина азоту
зв'язується в формі аміаку, який для організму є токсичним. Отруєння ним не
відбувається, так як в організмі він активно знезаражується. Важливе місце у
процесі знешкодження належить глугаміновій кислоті і її похідним. Так, α-кетоглутарова кислота може
зв'язувати одну молекулу аміаку з утворенням глутамінової кислоти. В свою чергу
глутамінова кислота може зв’язувати ще одну молекулу аміаку з утворенням
аміду-глутаміну.
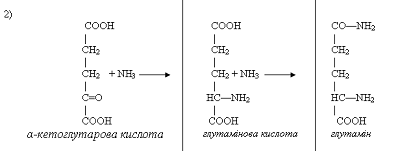
При цьому аміак приєднується по місцю
карбоксильної групи. Такий же процес протікає з участю аспарагінової кислоти.
Таким шляхом проходить зв'язування
аміаку в місцях його безпосереднього утворення (клітини печінки, мозку) і
можливе повторне використання азоту. Утворена глутамінова кислота і глутамін
включається в різноманітні процеси обміну, в тому числі в реакції синтезу
пуринових та піримідинових основ, що входять до складу нуклеїнових кислот.
Однак основним шляхом зв’язування
аміаку є синтез сечовини, яка виводиться з організму з сечею. З азотовмісних
сполук сечі на долю сечовини приходиться 80-85%. В розшифровці біосинтезу
сечовини пріоритет належить вітчизняному вченому М.О.Ненцькому. Він вперше
довів гіпотезу, що сечовина утворюється з двох молекул аміаку і молекули
вуглекислого газу і цей процес відбувається в клітинах печінки.
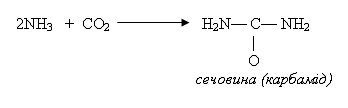
. Діагностичне значення визначення
сечовини в крові
Концентрація сечовини в крові
залежить від інтенсивності її синтезу і виведення. Визначення сечовини є
важливим діагностичним тестом, що характеризує не тільки стан білкового обміну,
а й функціональний стан печінки і нирок. Оскільки азот сечовини складає більшу
частину фракції залишкового азоту, то підвищення вмісту небілкового азоту
залежить від вмісту сечовини в крові. Вміст сечовини в крові підвищується при
захворюваннях нирок (гломерулонефрит, пієлонефрит). При захворюваннях нирок
ступінь підвищення вмісту сечовини визначається характером враження нефрону,
рівнем інтоксикації, підсиленим розпадом білку в тканинах.
При гострому нефриті концентрація
сечовини підвищується рідко і складає величини, близькі до рівня залишкового азоту,
азот сечовини при цьому знаходиться в нормі.
При хронічних захворюваннях нирок
ступінь порушення їх функції відзначається на вмісті сечовини в крові, яке не
перевищує 13-15 ммоль/л. В пізні строки хронічної ниркової недостатності, коли
різко підвищується залишковий азот крові рівень сечовини зростає до 33,2
ммоль/л. Особливо високий вміст сечовини (49,1-81 ммоль/л) спостерігається при
гострій нирковій недостатності. При цьому різко знижується виведення сечовини з
сечею.
Печінка має великі антитоксичні
резерви, здатність її до дезамінування і синтезу сечовини зберігається при
відключенні від обміну 85% її тканин. Синтез сечовини порушується при дуже
важких враженнях печінки, пов’язаних з незворотними деструктивними процесами:
гострий некроз печінки, печінкова кома, цироз, отруєння фосфором, миш'яком,
алкоголем).
. Діагностичне значення визначення
креатину та креатиніну
Креатин і його похідний креатинін по
діагностичній цінності не поступається сечовині. В організмі існує два джерела
креатину: з харчових продуктів і ендогенний, що утворюється в результаті
синтезу. Креатин синтезується з аргинину, гліцину і метионіна. Починається
синтез в нирках, а закінчується в печінці, звідки з током крові поступає в
м'язові тканини, де приєднуючи активовану фосфорну кислоту, креатин
перетворюється в креатин-фосфат - макроергічну сполуку. В процесі м'язової
роботи креатин-фосфат вивільнює енергію і перетворюється в креатинін, при цьому
втрачаючи молекулу води.
Концентрація креатиніну в сироватці
крові у здорових людей практично постійна 65-106 мкмоль/л. Його синтез залежить
від потреб організму в креатині і на відміну від сечовини мало залежить від
кількості білків у їжі. Креатинін має седативну дію. У хворих з депресивним
станом в крові вміст креатиніну підвищений.
Креатинін відноситься до безпорогових
речовин, що фільтрується тільки клубочком нирок і не реабсорбується. Секреція
креатинніу канальцями можлива тільки при високій концентрації в крові.
Критичним кордоном встановлена концентрація креатиніну 115 мкмоль/л.
При захворюваннях нирок кількість
креатиніну в крові збільшується, так як креатинін виводиться з організму з
сечею. Різке зростання рівня креатиніну є одним з показників ниркової
недостатності в ранній стадії. Для діагностики захворювань нирок велике значення
має розрахунок кліренсу креатиніну або сечовини. Розраховують його, виходячи з
знання концентрації цих компонентів залишкового азоту в крові та сечі.
Підвищений рівень креатиніну в крові
відмічається при закупорці сечових шляхів, тяжкому діабеті, декомпенсації
серця, механічній жовтянці. Паралельне визначення у одного і того ж хворого
концентрації креатиніну або сечовини в крові і сечі розширює можливості
дослідження функціонального стану нирок, оскільки дає можливість одержати
інформацію про функції нефрону - фільтрацію, реабсорбцію, секрецію, а також
стан кровообігу у нирках.
. Участь печінки в білковому обміні
Печінка в організмі людини виконує
ряд дуже важливих функцій. Участь печінки в білковому обміні характеризується
тим, що в ній активно протікають процеси синтезу і розпаду білків, що мають
важливе значення для організму. В печінці синтезується за добу приблизно 13-18г
білку. З них альбуміни, глобуліни, фібриноген, протромбін синтезуються тільки в
печінці. З глобулінів тут синтезується до 90% β-глобулінів і близько 50% γ-глобулінів. В зв'язку з цим
при хворобах печінки в ній знижується синтез білків і це приводить до зменшення
кількості білків або зміні їх фізико-хімічних властивостей, в результаті чого
знижується колоїдостійкість білків і вони легше ніж у нормі випадають в осад
при дії осаджувачів (солей лужних та лужноземельних металів, а також тимолу,
сулеми). Знайти зміну кількості білків або їх властивостей можна за допомогою
проб на колоїдостійкість білків або осадових проб, серед яких використовується
проба Вельтмана, тимолова проба, сулемова проба.
Печінка являється основним місцем
синтезу білків, що забезпечують процес зсідання крові (фібриноген, протромбін).
Порушення їх синтезу приводить до геморагічних діатезів. Причиною цього може
бути порушення синтезу вітаміну К.
Активно в печінці протікає синтез і
перетворення амінокислот (переамінування, дезамінування, декарбоксилювання).
При тяжких її враженнях ці процеси суттєво змінюються, що характеризується
збільшенням концентрації вільних амінокислот в крові, виділенням їх з сечею. В
сечі можуть з’явитися кристали лейцину та тирозину.
Синтез сечовини відбувається тільки в
печінці і порушення функцій гепатоцитів приводить до збільшення її кількості в
крові, що має негативний вплив на весь організм і може проявитися печінковою
комою, яка може привести до загибелі хворого.
Обмінні процеси в печінці
каталізуються різними ферментами, які при її захворюваннях виходять в кров і
поступають у сечу. Важливо, що вихід ферментів з клітин відбувається не тільки при
їх враженні, а й при порушенні проникливості клітинних мембран, що мають місце
в самому початку захворювання. Тому визначення активності ферментів є одним з
важливих діагностичних показників оцінки стану хворого ще в до клінічний
період, наприклад, при хворобі Боткіна ще в дожовтушний період відмічено
збільшення в крові активності АЛТ, ЛДГ, АСТ.
Печінка виконує важливу антитоксичну
функцію. В ній знезаражуються такі продукти кінцевого обміну білків, як індол,
скатол, фенол, білірубін, аміак, продукти обміну стероїдних гормонів. Шляхи
знезараження токсичних речовин різноманітні: аміак перетворюється в сечовину;
індол, фенол, білірубін утворюють знешкоджені для організму сполуки з сірчаною
та глюкуроновою кислотами, що виводяться з сечею.
. Білки сироватки крові
Білки в організмі виконують різні
функції життєзабезпечення і входять в склад кожної клітини організму, тому стан
білкового обміну характеризує і стан всього організму. Для оцінки білкового
обміну існують різні показники, в тому числі кількість білку і його фракцій в
крові, рівень азотистого обміну (тільки білки та продукти обміну є
азотовмісними сполуками).
Білки плазми крові є їх важливою
складовою частиною, серед яких особливе місце належить фібриногену.
Основні фізіологічні функції білків
сироватки крові
1.
Приймають
участь у регуляції колоїдно-осмотичного тиску крові.
2.
Забезпечують
постійність в'язкості крові.
3.
Приймають
участь поряд з другими системами в регуляції рН крові.
4.
Підтримують
фізіологічний рівень катіонів у крові. Білки утворюють з катіонами
недіалізовані сполуки, що попереджує їх втрату через нирки з організму, 50% Са
зв'язано з білками.
5.
Білки
плазми крові зв'язують надлишок гормонів, нейтралізуючи їх токсичну дію.
6.
Виконують
транспортну функцію. Сполучаючись з метаболітами, лікарськими препаратами,
токсичними речовинами, сприяють їх переносу у відповідні органи та тканини або
виведенню з організму.
7.
Грають
важливу роль у процесах імунітету.
8.
Приймають
участь у процесах зсідання крові (фібриноген, білкові фактори гемостазу).
9.
У
випадках крайнього виснаження білки можуть бути джерелом амінокислот. До білків
плазми крові в нормі відносяться альбуміни, глобуліни та фібриноген. Це прості
білки - протеїни, які розрізняються між собою по молекулярній масі,
фізико-хімічними властивостями і біологічній ролі.
Сумарна кількість білків плазми крові
складають поняття "загальний білок крові". У дорослої людини ця
величина складає 65-85 г/л, на долю альбумінів припадає 45-55 г/л, глобулінів
20-30 г/л, фібриногену 2-4 г/л. В лабораторній практиці частіше користуються
таким поняттям як „загальний білок” сироватки крові. Так як сироватка крові -
це плазма крові без фібриногену, то загальний білок сироватки крові буде на 2-4
г нижче, ніж загальний білок плазми.
В залежності від методу дослідження
білків можна одержати від 5 до 100 білкових фракцій. Традиційним уніфікованим
методом розподілу білків на фракції є метод електрофорезу на папері та
ацетатцелюлозі. Таким методом одержують 5 білкових фракцій: альбуміни та α1,
α2,
β, γ-глобуліни.
Норми білкових фракцій у крові
складає слідуючи величини
Таблиця 4
|
в г/л
|
в%
|
|
Альбуміни
|
35-45 г/л
|
56,5-66,8%
|
|
Глобуліни
|
23-35 г/л
|
33,2-43,5%
|
|
α1-глобуліни
|
3-6 г/л
|
3,0 - 5,6 %
|
|
α2-глобуліни
|
4-9 г/л
|
6,9-10,5%
|
|
β-глобуліни
|
6-11 г/л
|
7,3 -12,5 %
|
|
γ-глобуліни
|
7-15,0 г/л
|
12,9-19,0%
|
Альбуміни. На долю альбумінів
приходиться 55-66 від загального білку. Синтезуються альбуміни у печінці. Тому
цілий ряд проб на колоїдостійкість білків крові, пов'язаних з кількісними
змінами у співвідношенні альбумінів і глобулінів, характеризує стан паренхіми
печінки.
Альбуміни в організмі несуть велике
фізіологічне навантаження:
. Приймають участь у регуляції
колоїдно-осмотичного тиску крові. Вони є гідрофільними колоїдами, одна молекула
альбуміну втримує біля себе 17 молекул води, з білків плазми на долю альбумінів
приходиться найбільша кількість. Тому альбуміни утримують воду у кров'яному
руслі, підтримують онкотичний тиск. Відомо, що повноцінна капілярна стінка
судин прониклива для води і солей, але не прониклива для білків і клітин крові.
Через капілярну стінку вода рухається в сторону з більшим осмотичним тиском.
Так як альбуміни є гідрофільними, то вода рухається з тканин у кров. В нормі
між кров'ю і тканинними рідинами існує динамічна рівновага, але при різкому
зменшенні альбумінів вода не утримується у кров'яному руслі і проникає у
тканини, викликаючи набряк. Це спостерігається при нефротичному синдромі,
масивних крововиливах.
. Альбуміни виконують транспортну
функцію. Зв'язуючи токсичні продукти обміну, вони, не знижуючи токсичних
властивостей метаболітів, сприяють їх виведенню з організму. Альбуміни
зв'язують білірубін, утворюючи нетоксичну фракцію вільного білірубіну,
доставляють його у печінку, яка забезпечує виведення його у кишечник. Альбуміни
зв'язують у крові високотоксичні вільні жирні кислоти, доставляючи їх у жирове
депо, а також надлишок гормонів, нейтралізуючи їх токсичну дію. Це найбільш
важлива властивість альбумінів. Альбуміни, завдяки своїй високій дисперсності
транспортують лікарські препарати, іони металів.
В патології альбумінів частіше
зустрічається зниження його концентрації -гіпоальбумінемія. Такий стан
спостерігається при захворюваннях печінки, а також при запальних процесах у
інших органах.
Глобуліни - велика група білків
різної структури з важливими біологічними властивостями (80% глобулінів
синтезується в печінці).
α1-глобуліни. Фракція α1-глобулінів представлена білками,
частина яких відома (гаптоглобін, глюкокортикоїди, церуплазмін). Більшість цих
білків відноситься до білків гострої фази. їх концентрація зростає в гострому
періоді багатьох захворювань ,при загостренні хронічних процесів.
Зменшення кількості α1-глобулінів буває рідко, частіше при
гострих дистрофічних процесах в клітинах печінки, цирозах, спостерігається
зниження α1-фракції при лімфолейкозі, мієломі.
Збільшення вмісту α2-глобулінів спостерігається
при всіх гострих запальних процесах (крупозній пневмонії, брюшному тифі,
скарлатині, дифтерії). Рівень α2-глобулінів може служити мірою
активності інфекційного процесу, сигналом загострення хронічної хвороби
(наприклад, туберкульозу). Кількість загального білку при цьому не міняється,
але через дві неділі після початку інфекційного процесу збільшується вміст γ-глобулінів, що є ознакою
хорошої реактивності організму.
З групи α-глобулінів виділений
С-реактивний білок (0,1 г/л), який одержав свою назву по властивості вступати в
реакцію преципітації з С-полісахаридом пневмококів. С-реактивний білок у крові
здорової людини відсутній, але він може бути з’являтися при багатьох
патологічних процесах, які супроводжуються запаленням і некрозом. Його
визначають реакцією преципітації з специфічною імунною сироваткою до
С-реактивного білку.
Визначення С-реактивного білку має
важливе діагностичне значення в гострій фазі ревматизму, при пневмо- і
стрептококових інфекціях, інфаркті міокарду. Визначення С-реактивного білку при
інфаркті міокарду має більш важливе діагностичне значення, ніж визначення ШОЄ,
лейкоцитозу, оскільки він з’являється в сироватці крові в кінці першої доби.
β-глобуліни. У склад фракції
входить α- і β-ліпопротиїди, фібриноген,
плазміноген, трансферин, ліпопротеїдліпази. Ці білки синтезуються частково в
тканинах системи мононуклеарних фагоцитів (СМФ). В нормі β-глобуліни складають 7-12%
від вмісту загального білку крові. При патології їх концентрація збільшується,
в основному при хронічних захворюваннях.
γ-глобуліни. До складу фракції
входять антитіла (імуноглобуліни), що забезпечують гуморальний імунітет
організму, білкові фактори системи зсідання крові-аглютиніни, що приймають
участь у формуванні груп крові, а також кріоглобуліни. Синтезуються в тканинах
СМФ, печінки і інших органів. В нормі γ-глобуліни складають 13-19%
від загального білку крові. В патології γ-глобулінів зустрічається
гіпогамаглобулінемія - зниження концентрації γ-глобулінів, пов'язане перш за
все з зниженням синтезу антитіл при враженні імунної системи любої етіології.
Гіпергамаглобулінемія - підвищення вмісту γ-глобулінів є результатом
активізації імунних реакцій з підсиленим синтезом імуноглобулінів.
Спостерігається це при бактеріальних, вірусних інфекціях, паразитарних
захворювання, хронічних інфекціях і цирозі печінки.
. Патологія обміну простих білків
Біохімічними симптомами порушення
білкового обміну є гіпопротеїнемії, гіперпротинемії, диспротеїнемії,
парапротеїнемії.
Захворювання з порушенням білкового
обміну зустрічається досить часто. Причому в одному з випадків вони складають
причину захворювань, а в інших випадках є другорядними. В любому випадку
порушення білкового обміну проявляється зміною рівня білку або залишкового
азоту в крові (гіпо- і гіперпротеїнемії, азотемії). Вони можуть бути
абсолютними (що пов'язані з зміною процесів синтезу і розпаду білку) і
відносними (викликані іншими причинами).
Гіпопротеїнемії - зниження рівня
загального білку в крові може бути викликане різними причинами і носити
абсолютний і відносний характер.
Абсолютні (зниження синтезу білку) -
пов’язані з недостатністю речовин для синтезу білків. Причиною цього є
недостатнє і неповноцінне харчування (білкове голодування), порушення
переварювання та всмоктування білків, враження синтезуючих білкових клітин при
паранхематозних гепатитах, цирозі печінки, хронічних отруєннях.
Причиною відносних гіпопротеїнемій є
втрата білку з сечею, враження ниркового фільтру при нефрозах, хронічних
нефритах, а також при кровотечах.
Гіперпротеїнемії - підвищення рівня
білка в крові, зустрічаються досить рідко і мають в основному відносний
характер. Вони спостерігаються при згущенні крові, при високих втратах рідини
організмом, що спостерігається при блюванні, діабеті, проносі.
Значно рідше зустрічається абсолютна
гіперпротеїнемія, в основі якої лежить підвищення рівня білку за рахунок
підвищення синтезу. При цьому не тільки підсилений синтез білку, а й змінена
його структура. Такі патологічні білки називаються парапротеїнами і у здорової
людини їх немає. Структура їх подібна до імуноглобулінів, але вони не мають
властивостей антитіл і при розподілі білків на білкові фракції визначаються у
вигляді М-градієнту між фракціями β- і γ-глобулінів. При мієломній
хворобі загальний білок крові може бути підвищений порівняно з нормою більше
ніж у 2 рази. При цьому в сечі з'являється білок Бен-Джонса, що випадає в осад
при 40-60º С і розчиняється при 85-100º
С.
Слід відмітити, що зниження рівня
білку у крові проходить, як правило, за рахунок зменшення синтезу альбумінів,
тоді як рівень глобулінів залишається майже незмінним або міняється дуже
незначно. Другими словами, в основі гіпопротеїнемії лежить гіпоальбумінемія.
Збільшення білку у крові пов'язано з підвищенням його кількості в глобуліновій
фракції.
Крім зменшення рівня загального білку
в крові при ряді захворювань відмічається і кількісне змінення його фракцій -
диспротеїнемія.
Найбільш часто порушення білкового
обміну проявляється диспротеїнемією. При цьому загальний білок крові
залишається в межах норми, а спостерігається порушення кількісного
співвідношення між білковими фракціями, що пов’язано з зниженням вмісту
альбумінів і підвищенням фракцій глобулінів. Виявлення її особливо важливе для
ранньої діагностики і спостереження за ходом патологічного процесу.
До найбільш розповсюджених відносять
диспротеїнемії при:
- гострих інфекційних
захворюваннях (сепсис, поліартрит), що супроводжуються збільшенням α2-глобулінів, незначним підвищенням γ-глобулінів і зниженням
альбумінів при нормі загального білку в крові;
- хронічних запальних
процесах, що супроводжуються підвищенням γ-глобулінів і зниженням
альбумінів при нормальному вмісті загального білку в крові;
для гепатитів, токсичних
вражень печінки, гемолітичних процесів, характерне помірне зменшення
альбумінів, підвищення γ-глобулінів, різке збільшення β-глобулінів;
при нефрозах, нефритах
відмічається значне зменшення альбумінів, підвищення α2- і β-глобулінів при зниженні γ-глобулінів;
для механічних жовтяниць
специфічне помірне збільшення α2-,
β і γ-глобулінів.
. Залишковий азот крові
Азотемія - підвищення рівня
залишкового азоту у крові. Вона частіше всього пов'язана з порушенням процесу
утворення і виведення продуктів азотистого обміну.
Абсолютна азотемія розвивається за рахунок
накопичення в крові залишкового азоту за рахунок затримки його виведення
нирками (ниркова) або посилення його утворення (позаниркова). Ретенційна
азотемія наступає в наслідок недостатнього виділення залишкового азоту з сечею
при нормальному надходженні в кров. Якщо ця затримка пов'язана з порушенням
видільної функції нирок, то вона визначається як ниркова форма і зустрічається
при гломерулонефриті, туберкульозі нирок, пієлонефриті. Позаниркова азотемія
виникає в результаті порушення кровообігу в нирках або наявності перешкод
відтоку сечі. Вона спостерігається при вроджених вадах серця, профузних
кровотечах, пухлинах сечового міхура.
Продукційні азотемії розвивається при
збільшенні білкового синтезу в організмі і збагаченні крові білками (цукровий
діабет, їжа багата білками, лікування стероїдами), при підсиленому розпаді
білків (пухлини, лейкози, геморагії, інфекційні захворювання).
Відносні азотемії зустрічаються рідко
і пов'язані зі зменшенням об'єму крові (блювання, пронос, отруєння газами).
Зниження рівня залишкового азоту відмічається при недостатньому харчуванні,
іноді при вагітності.
Для початкових стадій характерно не
стільки підвищення залишкового азоту крові, скільки змінення компонентів
залишкового азоту, співвідношення між ними і загальним азотом. Так, при гострій
нирковій недостатності, коли залишковий азот може бути в нормі, різко
підвищується концентрація сечовини.
Для оцінки тяжкості стану визначають
співвідношення азоту сечовини до залишкового азоту і виражають цю величину в
процентах. В норму даний показник складає 48%, а при нирковій недостатності
90%.
Відносна уремія спостерігається при
зневодненні організму. Зниження рівня сечовини характерне для захворювань
печінки (паренхіматозна жовтяниця, гостра дистрофія печінки, цироз). Креатин,
котрий в основному знаходиться в м’язах, збільшується в крові при м'язовій
дистрофії, ревматичному артриті, захворювання нирок.
Для характеристики фільтрувальної
здатності нирок користуються умовним показником, який називається коефіцієнтом
очищення або кліренсом. Його розраховують на здатності нирок виділяти креатинин
з крові (проба Реберга).
Серед патологічних станів пов'язаних
в білковим обміном найбільш характерне білкове голодування. Воно може бути
викликане недостатністю загальної кількості білку в добовому раціоні так і
порушенням кількісного і якісного складу білку.
Лекція № 9. ОБМІН СКЛАДНИХ БІЛКІВ
В організмі людини найбільш інтенсивному обміну з складних
білків підлягають нуклеопротеїди і хромопротеїди. Нуклеопротеїди - це білки у
яких небілкова частина представлена нуклеїновими кислотами РНК і ДНК. Ці білки
зберігають і передають спадкову інформацію. Серед хромопротеїдів в організмі
людини найбільше значення має гемоглобін, який виконує функцію газообміну.
1. Обмін нуклеопротеїдів: перетравлення і всмоктування в ШКТ
В шлунково-кишковому тракті під дією соляної кислоти,
пепсину, трипсину і других ферментів від нуклеопротеїдів відщеплюється білкова
частина і гідролізується до амінокислот. Небілкова група - нуклеїнові кислоти -
нуклеазами гідролізується до мононуклеотидів. Останні частково всмоктуються, а
більшою частиною під дією особливих ферментів (нуклеофосфотаз) розщеплюються на
складові компоненти: азотисті основи, пентози, фосфорну кислоту які, як
водорозчинні, активно всмоктуються в ШКТ в кров.
Таким же шляхом проходить і розпад нуклеопротеїдів в
тканинах організму. Фосфорна кислота поповнює запаси фосфору в організмі,
пентози приймають участь в процесах окислення і синтезу нових нуклеїнових
кислот, а азотисті основи піддаються різним перетворенням. Так, похідні -
аденін і гуанін після дезамінування утворюють сечову кислоту, яка виводиться з
організму нирками.
2. Проміжний обмін складних білків - розпад пуринових та
піримідинових основ
Кінцевими продуктами розпаду пуринових та піримідинових основ
є аміак, вуглекислий газ і безазотисті основи. Так, урацил розпадається на
аміак, вуглекислий газ та β-аланін. Шляхи перетворення
аміаку і вуглекислого газу загально відомі. β-аланін приймає участь в
утворенні ацетил-КОА.
Одночасно з розпадом в клітинах проходить постійний синтез
нуклеїнових кислот. Це дуже складний процес, в якому приймають участь велике
число сполук. Так, для утворення пуринових мононуклеотидів використовуються
пентози в своїй активній формі, АТФ і відповідні ферменти. В ході синтезу
утворюються проміжні продукти інозинмонофосфату, з якого будується АТФ і АМФ.
Похідними речовинами для синтезу піримідинових мононуклеотидів є глутамін,
вуглекислий газ і аспарагінова кислота, в результаті чого утворюється оротова
кислота, котра взаємодіє з активованими пентозами.
3. Утворення сечової кислоти. Діагностичне значення її
визначення
Одним з порушень обміну нуклеопротеїдів є подагра, в основі
якої лежить підвищена активність ферменту ксантинооксидази, що каталізує
утворення сечової кислоти. При подагрі сечова кислота та її солі відкладаються
в хрящах, зв’язках, особливо в суглобах пальців рук і ніг. Це призводить до
деформації суглобів і сильних больових відчуттів. Сечова кислота може
відкладтися також у нирках, порушуючи їх діяльність. При цьому відповідно
знижується виведення сечової кислоти з сечею, що підвищує її рівень в крові.
Ось чому гіперурекемія може служити одним із показників враження нирок.
Таким чином гіперурекемія - підвищення вмісту сечової кислоти
в крові - може бути ниркового походження, що зустрічається при враженні
клубочкового апарату нирок (нефрити, зморщена нирка), а також може виникати при
підвищеному розпаді нуклеопротеїдів (лейкози, гемолітичні жовтяниці, серцева
недостатність, цукровий діабет).
Гіпоурекемія - зниження вмісту сечової кислоти в крові -
зустрічається при анемії, після прийому деяких ліків (піперазіну, атофану).
4. Обмін хромопротеїдів і гемоглобіну. Білірубін та його
фракції
Серед багатьох представників хромопротеїдів для людини
найбільше значення має гемоглобін.
Гемоглобін, що поступає з їжею, в шлунково-кишковому тракті
розпадається на свої складові частини гем і глобін. Глобін гідролізується до
амінокислот, які всмоктуються і поступають в кров, гем окислюється в гематин і
виводиться з калом, тобто не використовується організмом. Слід зазначити, що
найкраще засвоюється організмом залізо, що поступає у складі гемоглобіну. Це
особливо слід пам’ятати при лікуванні залізодефіцитної анемії.
Обмін ендогенного гемоглобіну протікає досить активно. Це пов’язано
з тим, що період існування еритроцитів, в яких знаходиться гемоглобін, 110-120
днів, після чого вони розпадаються в незначній мірі в кровоносному руслі, а
основний розпад відбувається в клітинах ретикулоендотеліальної системи.
Процес активно протікає в селезінці, кістковому мозку,
печінці і інших органах РЕС. Частина еритроцитів розпадається в кровоносному
руслі. Вивільнений при цьому Нb адсорбується в крові гантоглобіном і
транспортується в печінку, де підлягає процесам обміну.
Розпад в клітинах РЕС відбувається за слідуючою схемою:
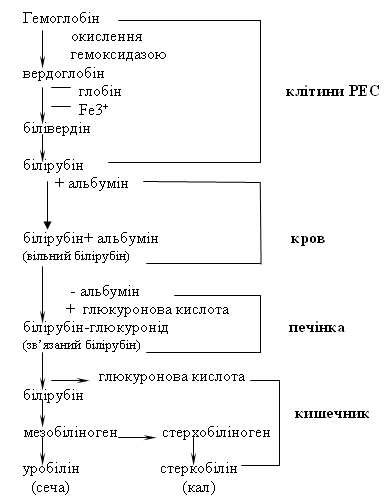
В клітинах РЕС спочатку Нb окислюється гемоксидазою з
утворенням вердогемоглобіну (речовина зеленого кольору). Останній спонтанно
розпадається на глобін, залізо і залишену частину гему - білівердін (пігмент
зеленого кольору). Глобін гідролізується до амінокислот. Залізо з’єднується з
трансференином і кров’ю, доставляється в печінку, де звільнюється від
білку-переносчика і відкладається про запас у вигляді феритину (сполуки заліза
з особливим білком).
Цей комплекс по мірі необхідності розпадається, а звільнене
залізо знову адсорбується на трансферині і поступає в клітини, де приймає
участь в різних процесах обміну речовин.
Білівердін відновлюється в білірубін - пігмент жовто-коричньового
кольору, який є водонерозчинною і досить токсичною речовиною. Тому він швидко
виводиться з клітин і поступає в кров, де адсорбується альбуміном і утворює
водорозчинний і нетоксичний комплекс, що називається вільний білірубін. Він
транспортується в печінку, де розпадається в гепатоцитах. Тут він зв’язується з
глюкуроновою кислотою (точніше з її активованою формою) з утворенням
білірубін-глюкороніду. До молекули білірубіну може приєднуватися одна або
декілька молекул глюкуронової кистоти. В такому вигляді білірубін є
нетоксичним, водорозчинним і називається зв’язаним білірубіном. Цей процес
називають, також, кон’югацією, а зв’язаний білірубін - кон’югованим.
В клінічній практиці використовуються трохи інші терміни.
Виходячи з методів визначення білірубіну, вільний білірубін називають непрямим,
а зв’язаний прямим, тому що вільний визначають в два етапи (не прямо), а
зв’язаний - в один етап - прямо. Ця термінологія є не зовсім доречною, тому що
називати речовину за методом її визначення, а не по структурі є неправильним. В
лабораторній практиці визначають у крові загальний білірубін, що є сумою
вільного і зв’язаного білірубіну і зв’язаний білірубін (кон’югований, прямий).
За різницею загального білірубіну і зв’язаного, розраховують вміст вільного
білірубіну (некон’югованого), непрямого. Норма білірубіну 1-20 мкмоль/л, з
якого 75% вільного, 25% - зв’язаного.
5. Роль печінки в утворенні білірубін-глюкуронідів.
Перетравлення білірубіну у кишечнику. Пігменти калу та сечі
В клітинах печінки накопичується зв’язаний білірубін, який
поступає в жовчний міхур і входить до складу жовчних пігментів, що зафарбовують
жовч. З жовчю зв’язаний білірубін поступає в кишечник де розпадається до
білірубіну і глюкуронової кислоти.
Білірубін піддається дії ферментів мікроорганізмів з
утворенням мезобіліногену (уробіліноідів), а потім стеркобіліногену. Невелика
частина мезобіліногену всмоктується в кров і по воротній вені доставляється в
печінку, де розщеплюється до дипіролів. Більша ж частина мезобіліногену,
перетворюючись в стеркобіліноген в нижніх відділах товстої кишки всмоктується в
кров і через систему гемороїдальних вен попадає в велике коло кровообігу і
потім виводиться з сечею (в клінічній практиці це називається уробіліногеном).
Уробіліноген сечі на повітрі окислюється в уробілін. Частина стеркобіліногену
виводиться з організму з калом і окислюється на повітрі в стеркобілін. Таким
чином, колір сечі і калу залежить від вмісту в них уробіліну і стеркобіліну, і
їх називають пігментами калу і сечі.
Для нормальної життєдіяльності організм постійно потребує
велику кількість гемоглобіну. В наш час механізм синтезу гемоглобіну
встановлений. В ньому приймає участь гліцин, сукциніл-КоА, які утворюють
дипірольні кільця. Чотири дипірольних кільця, з’єднуючись, утворюють
корфобріноген, котрий перетворю-ється в протопорферін і, приєднуючи залізо,
утворює гем. Останній, взаємодіючи з глобіном, утворює молекулу гемоглобіну.
6. Патологія обміну гемоглобіну. Види жовтяниць. Причини.
Лабораторна діагностика
Порушення обміну жовчних пігментів проявляється жовтяницями.
Жовтушна пігментація шкіряних покривів, слизових оболонок і склер, як симптом
клінічного прояву жовтяниці, проявляється при збільшенні вмісту білірубіну в
сироватці крові вище 34,2 мкмоль/л.
До основних факторів, що викликають порушення обміну жовчних
пігментів відносять слідуючи:
1.
Порушений
гемоліз еритроцитів.
2.
Порушення
синтезу білірубіну.
3.
Порушення
виділення зв’язаного білірубіну з гепатоцитів в жовчні капіляри.
4.
Порушення
жовчовиділення внаслідок обтурації позапечінковаих жовчовивідних шляхів.
В залежності від механізму розвитку жовтяниць, їх поділяють
на гемолітичну, механічну та паренхіматозну.
Гемолітична жовтяниця
Гемолітична жовтяниця пов’язана з підвищеним розпадом
еритроцитів і підвищеним надходженням вільного білірубіну з клітин РЕС в кров і
далі в клітини печінки.
При підвищені рівня вільного білірубіну в крові здатність
гепатоцитів переводити вільний білірубін в зв’язаний може зрости в 3 рази. В
той же час надмірне утворення вільного білірубіну може призвести до накопичення
його в крові. Отже, кількість загального білірубіну при гемолітичній анемії
збільшена за рахунок вільного білірубіну.
Вміст зв’язаного білірубіну також може зрости при
гемолітичній анемії, чому сприяють такі причини, як збиткове утворення його з
вільного білірубіну за рахунок посилено функції гепатоцитів до процесів
кон’югації.
Велика кількість похідних зв’язаного білірубіну забезпечує
інтенсивне забарвлення калу та сечі за рахунок уробіліну та стеркобіліну.
Уробіліногенурію підтримують і виділення з сечею істинного
уробіліну, який при токсичному враженні білірубіном печінкових клітин не
окислюється до дипіронів.
При відсутності враження паренхіми збільшення зв’язаного
білірубіну не відбувається і в сечі жовчні пігменти відсутні. Подібний патогенез
спостерігається і при інших гіпербілірубінеміях, пов’язаних з гемолізом
еритроцитів і гемоглобіну, наприклад, при перциніозній анемії.
Гемолітичні жовтяниці супроводжуються зниженням вмісту
гемоглобіну і еритроцитів, підвищенням показнику осмотичної резистентності
еритроцитів, підвищеним вмістом вільного заліза. Показники біохімічних
досліджень, що відтворюють порушення функції печінки, залишається в нормі або
змінюється досить мало. У новонароджених можуть спостерігатися анемії,
гемоглобінопатії, еритроцитарні ензимопатії, (механічна) дискенезія
жовчовивідних шляхів, паренхіматозна жовтяниця, сепсис. Можливий розвиток
жовтяниці внаслідок порушення утворення зв’язаного білірубіну (синдром
Жильбера, фізіологічна жовтяниця новонароджених тощо). При підвищеному вмісті в
крові новонароджених вільного білірубіну він може з’явитися в сечі з-за
недорозвитку ниркового фільтру. Фізіологічна жовтяниця новонароджених
проявляється низькою активністю глюкуронілтрансферази і малим вмістом протеїну
в гепатоцитах. Показники білірубіну у новонароджених, що складають 250-290
мкмоль/л, можуть бути причиною замінного переливання крові, а вище 273-342
мкмоль/л веде до появи ядерної жовтяниці або білірубінової енцефалопатії. Так,
при високій гіпербілірубінемії, що пов’язана з вільним білірубіном, проводять
замінне переливання.
Механічна жовтяниця
Симптоматика, продовжуваність і вираженість захворювання може
варіювати в залежності від закупорки (каменем чи пухлиною) та від місця
обтурації жовчовивідних шляхів. В своїй основі порушення обміну жовчних
пігментів полягає в тому, що клітини печінки гепатоцити невражені. Вони
продовжують перетворювати вільний білірубін у зв’язаний. Але внаслідок
обтюрації жовчовивідних шляхів розвивається холестаз і зв’язаний білірубін
накопичується з жовчю у жовчних капілярах, протоках і жовчному міхурі.
У тонкий кишечник білірубін та його похідні не поступають.
Уробілін і стеркобілін не утворюються. Реакція на уробілін, а вірніше, на
стеркобілін буде негативною. З розвитком механічної жовтяниці кал стає
темно-сірим (ахолічним), а в сечі з’являються жовчні пігменти (білірубін) і
вона набуває темного кольору.
По мірі розвитку жовтяниці і накопичення жовчі печінкової
клітини починають здавлюватись, жовчовивідні капіляри розтягуватися. Виникає
можливість попадання зв’язаного білірубіну в кров і звідти в сечу. Кількість
загального білірубіну підвищується за рахунок зв’язаного. Зв’язаний білірубін,
як водорозчинна речовина попадає в сечу і її реакція на жовчні пігменти стає
позитивною.
При відновленні току жовчі в кишечник починають поступати
жовчні пігменти. Кал забарвлюється, іноді дуже інтенсивно. В крові зникає
зв’язаний білірубін, припиняється білірубінурія, в сечі з'являється уробілін,
що є сприятливим симптомом.
Крім порушень в обміні жовчних пігментів виявляється
підвищення активності таких ферментів, як лужна фосфатаза,
лактамедогідрогеназа, підвищується вміст холестерину, церулоплазміну.
Диференційний діагноз різних хвороб печінки оснований не тільки на визначенні
жовчних пігментів, а й інших показниках печінкових проб.
Паренхіматозна жовтяниця
Паренхіматозна жовтяниця пов’язана з враженням клітин печінки
гепатоцитів факторами токсичного, інфекційного характеру. Найчастіше
паренхіматозна жовтяниця зустрічається при хворобі Боткіна. Враження печінкових
клітин, що призводить до деструкції та некрозу утворює умови, при яких
порушується перетворення уробіліногену в пентдіопент, по-друге, процес переводу
вільного білірубіну в зв’язаній (при цьому перш за все порушується утворення
білірубінглюкуроноідів), по-третє, розвивається печінковий холестаз. При
печінковому холестазі порушується виведення зв’язаного білірубіну в жовчні ходи
і виникає можливість попадання зв’язаного білірубіну з жовчних капілярів в
кровоносні. Все це пояснює, чому ще в дожовтушний період підвищується вміст
уробіліногену в сечі, а пізніше збільшується кількість загального білірубіну в
основному за рахунок зв’язаного. Збільшення кількості непрямого білірубіну
пояснюється враженням клітин печінки, котрі нездатні переводити вільний білірубіну
в зв’язаний. В сечі з’являються жовчні пігменти і їх вміст збільшується.
На висоті захворювання в сечі спостерігається низький вміст
уробіліноїдів, або їх зовсім немає, так як пігменти не потрапляють з жовчу в
кишечник внаслідок холестазу.
В процесі одужання жовч починає потрапляти в кишечник і в
крові зменшується зв’язаний білірубін, а кількість вільного білірубіну
знижується. Пізніше відновлюється здатність окислення уробіліногену в
пентдіопент і сеча зафарбовується за рахунок уробіліну. Через зникнення
зв’язаного білірубіну в крові реакція сечі на жовчні пігменти стає негативною.
При паренхіматозній жовтяниці підвищуються всі показники
печінкових проб: активність ферментів АЛТ, лужної фосфотази, γ-глутаматтрансферази.
Порушується білково-септична функція печінки, знижується вміст альбумінів і
зростає активність холінестерази, знижується вміст β-ліпопротеідів. З’являється
диспротеінемія з підвищенням α2-,
β-, γ- глобулінів.
Підвищуються проби на колоідостійкість білків (тимолова проба), яка
підвищуються у дожовтушний період. Знижується рівень сечовини, але рівень
залишкового азоту може зрости за рахунок азоту амінокислот. Порушуються процеси
етерифікації і співвідношення вільного холестерину і ефірозв’язаного. Рівень
заліза сироватки крові підвищується, так як воно поступає в кров із зруйнованих
клітин і не засвоюється враженими клітинами печінки. Падає активність факторів
протромбінового комплексу (фібриноген, протромбін), але зростає фібринолітична
активність крові.
При хронічних гепатитах, особливо в період загострення також
може спостерігатися порушення обміну жовчних пігментів.
Лекція № 10. ОБМІН
ВУГЛЕВОДІВ
. Біохімічні процеси при травленні та
всмоктуванні вуглеводів
Вуглеводи складають 2% маси тіла
людини, в організмі виконують важливі функції життєзабезпечення: енергетичну,
пластичну, захисну, регуляторну і специфічну.
Основна роль вуглеводів в організмі
людини зводиться до забезпечення енергією (до 50-52%), крім того вони необхідні
для нормального окислення жирів і білків. Рівень глюкози в крові є основним
показником стану енергетичного обміну в організмі, обміну речовин. Цукровий
діабет є основним порушенням обміну вуглеводів, дуже поширеним захворюванням.
У склад їжі людини входять різні
представники вуглеводів від мономерів до полімерів. В кров поступають мономери.
Розщеплення полімерів відбувається в шлунково-кишковому тракті під дією
ферментів. Процес починається в ротовій порожнині під дією амілази слини.
Крохмаль гідролізується частково до декстринів. У шлунку ферменти, що
розщеплюють крохмаль, відсутні, крім того у шлунку кисле середовище. Процес
травлення вуглеводів не відбувається. Основне перетравлення вуглеводів
відбувається в тонкому кишечнику, куди секретується сок підшлунковоі залози і
кишечника, багатий ферментами, що гідролізують крохмаль і інші вуглеводи.
Слаболужне середовище (рН 7,8-8,2) забезпечує їх оптимальну активність. В
процесі перетравлення крохмаль гідролізується до декстринів, потім до мальтози
і до глюкози. Мальтозу розщеплює мальтаза, сахарозу - сахараза. Процес всмоктування
досить складний. Слизовою оболонкою всмоктуються тільки гексози, причому у
вигляді фосфорних ефірів. На всмоктування активно впливає натрій, калій навпаки
пригнічує процес.
З вуглеводів не гідролізується
клітковина. В товстому кишечнику вона розщеплюється під дією ферментів целюлаз
мікроорганізмів. Продукти розщеплення використовуються для життєдіяльності
самих мікроорганізмів. Неперетравлена клітковина приймає участь у формуванні
калових мас.
2. Шляхи перетворення вуглеводів
в тканинах організму
Шляхи перетворення вуглеводів в
тканинах організму. Можливі 4 шляхи розщеплення глюкози:
1. Гліколіз - анаеробний шлях в
тканинах, бідних киснем.
2. Гліколітичний ланцюг і цикл
трикарбонових кислот - аеробний, в тканинах, багатих киснем.
. Пентофосфатний шлях -
аеробний.
. Глюкуронат - ксилюлозний -
аеробний.
Переважають в організмі перші два
шляхи.
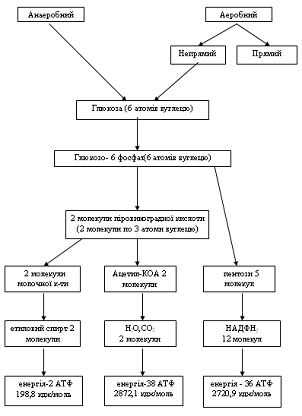
Схема: Основні шляхи розпаду
вуглеводів
Анаеробний розпад.
Характерний в основному для м'язової
тканини. Проходить в III етапи відповідно схеми. Закінчується утворенням
молочноі кислоти. Якщо розпаду піддається глікоген, то процес називається
глікогеноліз. Слід відмітити, що при активній роботі м'язів накопичується
багато молочної кислоти, що викликає втому м'язів. Щоб відновити роботу м'язів,
треба звільнити їх від молочної кислоти. Молочна кислота поступає в кров, далі
в печінку, де перетворюється в глюкозу шляхом глюконеогенезу.
Аеробний розпад.
Це основний шлях для утворення
енергії в клітинах організму. Він може протікати непрямим (дихотомічним) або
прямим (апотомічним) шляхами.
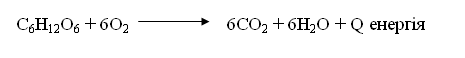
Процес окислення ділять на III етапи.
Основним етапом є третій - дві молекули ацетил - КОА окислюється в циклі
Кребсу, з утворенням 24 молекул АТФ.
. Шляхи синтезу вуглеводів. Поняття
про глюконеогенез. Глікогенні хвороби
Приблизно 65% глюкози поступає до
органів і тканин в першу чергу до клітин ЦНС, кишок, м'язів, нирок. 35% цієї
кількості затримується в печінці, з неї 30% перетворюється в жир, а 5%
відкладається у вигляді глікогену.
Глікоген - депонована форма глюкози,
вивільнює цю гексозу при участі глікогенфосфорілази.
Можливі шляхи перетворення:
- в м'язах, де немає
глюкозо-6-фосфатази, по основному шляху (анаеробний або аеробний);
- в жировій тканині, де йдуть
інтенсивні відновлювальні процеси .В печінці,
де багато
глюкозо-6-фосфатази, розщеплюється на глюкозу і фосфат;
Синтез і розпад глікогену
контролюється гормонами, які через аденілциклазну систему забезпечують
фосфорування глікогенсинтетази і фосфорилази. При потребі в глюкозі α-клітини островків Лангенгарсу
підшлункової залози секретують глюкагон, котрий активує фосфорилазу.
Фосфорилаза розщеплює глікоген до глюкози.
При порушенні синтезу і розщеплення
глікогену виникають глікогенози. Як правило, вони носять спадковий характер.
Хвороба Тірке характеризується гіпотрофією,
гіпоглікемією, гіперлакто-земіею, гіперліпеміею, гіперурикеміею. В основі
захворювання - дефект печінкової глюкозо-6-фосфатази, що гальмує розщеплення
глікогену в печінці.
Хвороба Помпе - проявляється в перший
рік життя: млявість, мала прибавка маси тіла, цианоз, збільшений язик. Причина
захворювання - дефект кислої мальтази, що є лізосомним ферментом.
. Гормональна регуляція вуглеводного
обміну
Найбільше впливають на вуглеводний
обмін гормони підшлункової залози та наднирочників. Підшлункова залоза секретуе
інсулін та глюкагон. Інсулін синтезується β-клітинами островків
Лангергансу-Соболева підшлункової залози, має білкову природу, складається з
двох поліпептидних ланцюгів, єдиний знижує рівень глюкози в крові.
Гіпоглікемічний ефект дії інсуліну реалізується за рахунок активізації процесів
утилізації глюкози:
- забезпечує фосфорування глюкози;
- забезпечує транспорт глюкози
через клітинну мембрану в клітину;
активує процеси
внутрішньоклітинного розщеплення глюкози;
активує фермент глікоген-синтетазу,
сприяючи синтезу глікогену в печінці;
гальмує активність ліпази,
що розщеплює жири, стимулює синтез жирів з глюкози;
гальмує глюконеогенез.
Надлишок інсуліну в крові
нейтралізується інсуліназою.
Підвищують рівень глюкози
контрінсулярні гормони.
Глюкогон виробляється α-клітинами островків
Лангергансу-Соболева підшлункової залози. Гормон білкової природи, активує
фосфорилазу печінки, що гідролізує глікоген.
Гормони наднирочників синтезуються
корковим і мозговим шарами наднирочників.
Гормони коркового шару -
глюкокортикоїди (кортизол, кортикостерон) підвищують концентрацію глюкози
шляхом активації глюконеогенезу.
Гормони мозкового шару - катехоламіни
( адреналін, норадреналін, дофа,мін) підвищують рівень глюкози за рахунок
розщеплення глікогену печінки та м'язів.
З м'язового глікогену утворюється
молочна кислота, яка знову перетворюється в печінці в глюкозу.
5. Порушення вуглеводного обміну
при цукровому діабеті
Серед захворювань, що в своїй
етіології має порушення вуглеводного обміну, особливе місце посідає цукровий
діабет. Це зв'язано з розповсюдженням його і відносно слабо вивченою
біохімічною характеристикою патогенезу. Основними біохімічними симптомами є
гіперглікемія, глюкозурія, кетонемія і кетонурія.
Головною причиною даного захворювання
являється зниження синтезу інсуліну в підшлунковій залозі, в результаті чого
гальмується надходження глюкози в клітини. Це приводить, з однієї сторони, до
підвищення рівня глюкози в крові (розвивається гіперглікемія і глюкозурія), а з
другої - до енергетичного голоду клітин. Недостатність енергії клітина
компенсує активацією розпаду жирів та амінокислот.
При окисленні жирів вивільнюється
невелика кількість енергії та накопичується ацетил - КОА (продукт окислення
жирних кислот). При окисленні амінокислот виділяються великі дози аміаку, а
безазотисті залишки амінокислот можуть стати джерелом утворення глюкози.
В нормі ацетил-КОА окислюється в
циклі Кребсу з утворенням енергії. Але для його окислення необхідна
щавлево-оцтова кислота, яка в основному утворюється в циклі Кребсу з
піровиноградної кислоти - проміжного продукту розпаду глюкози. При цукровому
діабеті недостача глюкози в клітині приводить відповідно до недостачі пірувату
і щавлево-оцтової кислоти. В результаті, окислення ацетил-КОА гальмується і він
в великій кількості поступає в печінку, де з нього утворюються ацетонові та
кетонові тіла.
Поява в крові надлишку їх (більше
30%) сприяє розвитку ацидозу. Одночасно кетонові тіла з'являються в великій
кількості в сечі (до 50 мг/добу) і розвивається кетонурія.
Клінічно ці здвиги проявляються
сильною спрагою і виділенням великої кількості сечі, розладом дихання, серцевої
діяльності, втратою свідомості (діабетична кома).
Лікування цукрового діабету повинно
бути направлено на забезпечення організму потрібною кількістю інсуліну. Перше
досягається призначенням лікувальних доз інсуліну. При цьому інсулін вводять з
глюкозою, яка попереджує передозування інсуліну і розвиток гіпоглікемічної
коми. Другим напрямком лікування є включення в дієту фруктози, ксиліту, сорбітолу,
обмін яких не залежить від інсуліну.
Серед інших причин порушення
вуглеводного обміну слід назвати спадкові хвороби, що приводять до порушення
діяльності і синтезу ферментів. До них відносяться глікогенози, галактоземія і
деякі інші хвороби.
6. Ензимопатіі вуглеводного
обміну, ферменти вуглеводного обміну в ензим-діагностиці
Вони об’єднують групу спадкових
хвороб, в основі яких лежать порушення діяльності ферментів, що каталізують
розпад глікогену. Відомо, що глікогенози і глікоген в значній кількості накопичуються
в печінці і м'язах і шляхи розпаду їх різні. Так в печінці глікоген
розпадається, в основному, до вільної глюкози, що поступає в кров . Проходить
це під дією ферменту глюкозо-6-фосфатази, що знаходиться в печінці. В м'язах
розпад глікогену йде до утворення лактату і супроводжується накопиченням
енергії у виді АТФ, що необхідний для м’язового скорочення.
Другим типом глікогенозу є вроджена
недостатність фосфорилази в печінці. В результаті цієї патології, по-перше,
гальмується розпад глікогену до глюкози, яка не поступає в кров і розвивається
гіпоглікемія з її симптомами. По-друге, має місце гіперліпемія - високий вміст
в крові ліпідів, що проявляється ожирінням печінки.
Недостатність фосфорилази в скелетних
м'язах приводить до того, що глікоген в них розщеплюється і при постійному
синтезі накопичується.
В результаті зниження продукції АТФ
відмічається м'язова слабкість, болі, судоми при фізичній роботі.
Вроджена відсутність фосфорилази і
глюкозо-6-фосфотази в печінці приводить до недостатності вільної глюкози
(гіпоглікемія), підвищеного розпаду жирів, накопиченню жирних кислот,
холестерину і ліпопротеідів в крові. В печінці накопичується глюкозо-6-фосфат,
який розпадається з утворенням лактату та пірувату. Викид їх в кров приводить
до здвигу рН в кислу сторону і розвивається ацидоз.
7. Методи дослідження
вуглеводного обміну
Для оцінки стану вуглеводного обміну
в нормі і при патології визначають концентрацію різних речовин, що приймають
участь в обміні. До них відносяться моносахариди, піруват, лактат, кетонові та
ацетонові тіла і різні ферменти, що каталізують метаболізм вуглеводів.
Серед названих сполук найбільше місце
має глюкоза.
Для визначення вмісту глюкози в крові
рекомендовані ортотолуідиновий, глюкозооксидазний методи і метод Хагердона-Йенсена.
Для оцінки стану обміну вуглеводів,
особливо секреторної здатності ост-ровків Лангергансу, що виробляють інсулін,
широко використовують функціональну пробу толерантості до глюкози -
глюкозотолерантний тест (ГТТ). Цей тест часто називають цукровим навантаженням,
або побудовою цукрових кривих. Суть цього методу полягає в тому, що у відповідь
на цукрове навантаження (прийом глюкози) і надлишкове надходження глюкози в
кров, посилюється синтез інсуліну, який знижує рівень глюкози в крові до норми
на протязі 2-3 годин. В тому випадку, якщо гіперглікемія знижується повільно,
вважають, що інсулін виробляється недостатньо і говорять про зниження
толерантності до глюкози. Існують два види цукрового навантаження: однократний
і двохкратний прийом глюкози. Частіше використовують однократний з дачею
глюкози у кількості 50 г на 200-250 мл води. Проба проводиться наступним чином:
у обстежуваного натще беруть кров з пальця і визначають вміст глюкози, після
чого дається цукрове навантаження. Потім через 30 хв. на протязі 2-3 годин
визначають глюкозу в крові. У хворих панкреатитом застосовують внутрішньовенне
введення.
У здорової людини на протязі першої
години рівень глюкози досягає максимуму, але не перевищує нирковий поріг. Потім
наступає зниження кількості глюкози в крові, яке до кінця другої години досягає
відповідного рівня і навіть стає декілька нижчим. До третьої години вміст
глюкози в крові відновлюється до норми.
У хворих цукровим діабетом
відмічається підвищення початкового рівня глюкози і висока гіперглікемія (вище
8 ммоль/л) уже через годину після цукрового навантаження. Рівень глюкози
залишається високим (вище 6 ммоль/л) на протязі всієї другої години і до кінця
дослідження (через 3 години) не повертається до початкового рівня. Відмічається
і глюкозурія. При повторному цукровому навантаженні, яке дається через годину і
в тій же дозі, у здорової людини пік гіперглікемії повинен бути менший або
взагалі відсутній.
Серед інших показників вуглеводного
обміну в клінічних умовах визначають лактат і ЛДГ для оцінки забезпеченості
киснем, їх рівень зростає при фізичних навантаженнях, пневмоніях, токсикозах,
хворобах серця.
білок вуглевод ліпід
фермент
Лекція № 11. ОБМІН
ЛІПІДІВ
1. Перетравлення і всмоктування ліпідів. Роль жовчі, кіло
мікронів і НЕЖК та їх біологічне та клінічне значення
Вміст ліпідів в організмі людини складає в середньому 10-20%
маси тіла. Ліпіди умовно діляться на протоплазматичні і резервні.
Протоплазматичні входять до складу органів і тканин (25% від вмісту всіх
ліпідів). Резервні запасаються в організмі.
Ліпіди мають в організмі велике значення, так як входять до
складу всіх органів і тканин. 90% входять в жирову тканину, в мозку складають
половину маси, в комплексі з білками складають основу клітинних мембран,
завдяки чому приймають участь в діяльності гормонів, ферментів, процесах
біологічного окислення.
Ліпіди на 25-35 % забезпечують організм енергією, приймають
участь у терморегуляції, виконують захисну функцію, захищають від висихання,
являються попередніми для синтезу гормонів, вітамінів.
При перетравленні ліпідів в ШКТ необхідні ліполітичниі
ферменти і оптимальні умови для їх діяльності, а також наявність емульгаторів
(детергентів).
Ліполітичні ферменти - це велика група гідролаз, що каталізує
розпад ліпідів. В шлунково-кишковому тракті і знаходяться ліпази, що
розщеплюють ефіри холестерину. Максимальну активність ферменти проявляють при
рН 7,8-8,2, тобто в слабо лужному середовищі. Емульгатори - це речовини, що
знижують поверхневий натяг і запобігають склеюванню частинок жиру.
Гідролітичному розщепленню піддаються тільки емульговані жири.
В ротовій порожнині перетравлення жирів не відбувається, так
як тут відсутні ліполітичні ферменти. В шлунку іде незначний розпад жирів
молока та яєчного білку. Це пов’язано з тим, що хоча в шлунковому соці і присутня
ліпаза, але вона інактивована в кислому середовищі і в шлунку немає
емульгаторів.
Основне місце перетравлення жирів - це тонка кишка, де є всі
необхідні умови. Підшлункова залоза та клітини слизової оболонки кишечника
секретують велику кількість ліполітичних ферментів, а слабо лужне середовище
забезпечує їх велику активність.
Крім того, жири під дією перистальтики кишечнику
роздроблюються на дуже малі краплини, які емульсуються при участі парних
жовчних кислот і моацилгліцеринів. в такий умовах триацилгліцерини
гідролізуються ліпазою на 90-97%,з яких 40% розщеплються повністю на гліцерин і
жирні кислоти , а 50-57% на моногліцерини.
Інша кількість жирів або всмоктується в тонкому кишечнику,
або поступає в товсту кишку і виводиться з калом.
Перетравлення фосфоліпідів забезпечується групою фосфоліпаз,
котрі послідовно гідролізують молекулу на складові частини. Спочатку
фосфоліпаза “А” відщеплює ненасичену жирну кислоту від другого вуглеводного
атома гліцерину.
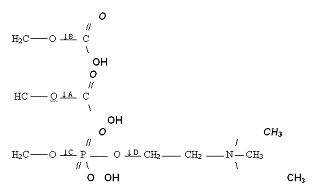
Залишена частина молекули називається лізофосфатидом і має
властивості емульгатора. Потім послідовно діють фосфоліпіди В, С, Д, котрі
розщеплюють молекули на гліцерин, жирну кислоту, фосфорну кислоту, азотисті
основи. Холестерин їжі, що знаходиться у вигляді ефіро зв’язаної сполуки,
розщеплюється під дією холестераз.
Процес всмоктування характеризується тим , що водорозчинні
продукти розпаду (гліцерин, моноацилгліцерини, фосфорна кислота, азотисті
основи) легко проникають в клітини слизової оболонки кишечнику. Жиророзчинні
компоненти (жирні кислоти, холестерин) всмоктуються при участі парних жовчних
кислот, котрі утворюють водорозчинні комплекси.
До жовчних кислот відносяться холева, хенодезоксихолева,
літихолева і дезоксихолева, які розрізняються числом і місцем розташування
гідроксильних груп.
В організмі найбільше значення мають холева,
хенодезоксихолева кислоти. Парні жовчні кислоти являють собою сполуки кислот з
глікоколом (гліцином) і таурином, і утворюються в жовчному міхурі. В просвіті
кишечнику вони з’єднуються в міцели - дуже малі частинки, зовнішня частина яких
представлена гідрофільними частинами цих кислот, а внутрішня - гідрофобними.
Жирні кислоти, холестерин і другі жиророзчинні речовини проникають у внутрішню
частину міцели і в її складі всмоктуються в клітини слизової оболонки
кишечнику. Тут міцели розпадаються. При цьому парні жовчні кислоти всмоктуються
в кров і поступають в печінку, де знову включаються до складу жовчі.
Виділяючись з жовчю, вони знову попадають в кишечник, знову утворюють міцели для
всмоктування нової порції жирів. В результаті чого невелика кількість жовчних
кислот забезпечує всмоктування достатньо великої кількості жирів. Нерозщеплені
або розщеплені лише частково жири можуть всмоктуватись в тонкій кишці
самостійно, якщо їх розмір не перевищує 0,5 НМ, а інші жири поступають в товсту
кишку і виводяться з калом.
Таким чином, в результаті процесів всмоктування в клітинах
слизової оболонки накопичуються продукти розпаду ліпідів. В стінці тонкої кишки
відбувається і первинний синтез ліпідів, але вже специфічних для даного
організму (триацилгліцеринів, фосфоліпідів, ефірів холестерину).
Подальший шлях ліпідів пов’язаний з утворенням хіломікронів,
що утворюються в стінці тонкого кишечнику. Захопивши певну кількість ліпідів,
хіломікрони поступають спочатку в лімфу, а потім в кров.
Після прийому їжі утворення хіломікронів збільшується і вони
в великій кількості поступають через лімфу в кров, що супроводжується
помутнінням крові. Така кров вважається хілюзною. Найбільше помутніння
спостерігається через 3 години після їжі, а потім кров просвітляється під дією
ферментів ліпопротеідліпаз ендотелію судин (цей фермент вважають фактором
просвітлення), котрий не тільки розщепляє хіломікрони, але й гідролізує
триацилгліцерини на гліцерин та жирні кислоти. Останні можуть надходити до
клітин крові і піддаватись процесам розпаду. Частка ж жирних кислот попадає в
кров, де адсорбується альбуміном. Такі комплекси називаються неестерифікованими
жирними кислотами. У вигляді НЕЖК жирні кислоти переносяться до органів і
тканин і включаються в процеси обміну.
2. Проміжний обмін ліпідів
В клітинах ТАГ накопичується в цитоплазмі, де гідролізується
тканинами на гліцерин і жирні кислоти. Як вже було відмічено, перетворенням
піддаються тільки активовані молекули. Це відноситься і до гліцерину, котрий
при участі АТФ та гліцерокінази перетворюється в свою активовану форму -
гліцерофосфат. Але він може перетворюватися в 3-фосфогліцериновий альдегід і
знову включатися в синтез ТАГ:
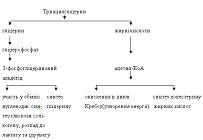
Обмін жирних кислот
Перед процесом розпаду жирні кислоти також активуються при
участі КоА, АТФ і ферментів з утворенням ацетил-КоА.

Цей процес проходить в цитоплазмі, в той час, як подальше
окислення спостерігається в мітохондріях, куди жирні кислоти самостійно
проникнути не можуть. Для цієї мети в мембрані мітохондрій є спеціальний
переносник - карнитин, котрий транспортує активовану жирну кислоту з
цитоплазмами в мітохондрію.
Розпад жирних кислот відбувається по типу β-окислення. Суть цього процесу
заключається в тому, що в ході реакцій одного циклу жирна кислота скорочується
на два вуглецевих атоми, котрі виділяються у вигляді ацетил-КоА. Частина жирної
кислоти, що залишається, знову окислюється таким самим шляхом і цей процес йде
до повного її розпаду.
Наприклад, пальмітинова кислота, що складається з 16 атомів
вуглецю повністю розпадається в ході семи циклів з утворенням 8 молекул
ацетил-КоА.
Вперше такий шлях розпаду жирних кислот в клітинах
запропонував Ф.Кнооп на початку нашого століття і назвав теорією β-окислення (окисленню
піддається вуглецевий атом в β-положенні від вільної
карбоксильної групи). В наші дні теорія була уточнена і зараз її представляють
у слідуючому вигляді:
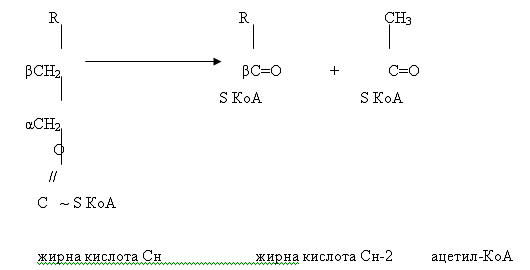
Окислення жирних кислот має важливе енергетичне значення.
Встановлено, що в ході одного циклу окислення проміжні речовини двічі піддаються
дегідруванню, а вивільнені атоми водню акомулюються в одному випадку ФАД з
утворенням ФАДН2, а в другому НАД з утворенням НАДН2.
Вони вступають в ланцюг біологічного окислення і забезпечують
утворення двох і трьох молекул АТФ. Крім того, утворений ацетил-КоА може
окислюватися в циклі Кребсу і дати 12 молекул АТФ.
Таким чином енергетичний бланс тільки одного циклу окислення
дає 17 молекул АТФ. Крім того, утворений ацетил-КоА може окислюватися в циклі
Кребсу і дати 12 молекул АТФ.
Таким чином, енергетичний баланс тільки одного циклу
окислення дає 17 молекул АТФ, а повністю окислення одної молекули трипальмітину
дає 412 молекул АТФ. Це в 10 разів більше, ніж при окисленні однієї молекули
глюкози. Таким чином, при ліполізі ТАГ утворюється гліцерин і жирні кислоти,
котрі розпадаються з утворенням великої кількості енергії і речовин, що
використовується в інших процесах.
Поряд з процесами розпаду ліпідів протікає і синтез
триацилгліцеринів і інших ліпідів (літогенез).
В синтезі АТФ можна виділити три етапи:
І. Утворення гліцерину.
ІІ. Синтез жирних кислот.
ІІІ. Взаємодія гліцерину і жирних кислот з утворенням ТАГ.
Біосинтез жирних кислот нагадує їх окислення і заключається в
поступовому подовженні ланцюга жирної кислоти на два вуглецевих атоми для
одержання потрібної кислоти для даної клітини. Цей процес дуже складний. В
ньому приймають участь ацетил-КоА, малоніл-КоА, АТФ, НАДН2, і
система ферментів, що об’єднується разом з ацетилпереносячим білком (АПБ) в
мультиферментний комплекс, що є стартовою речовиною при синтезі. Він
утворюється з ацетил-КоА шляхом приєднання до нього активованої вуглекислоти
Синтетаза жирних кислот складається з 7 ферментів. Схематично
цей комплекс нагадує сферичну частину, по периферії якої розташовані ферменти,
а центральну частину займає АПБ. Значення цього білку полягає в тому, що до
нього приєднуються вихідні речовини для синтезу - ацетил-КоА і малопил-КоА і
він переміщає їх від одного ферменту до іншого, забезпечуючи їх перетворення.
АПБ можна представити у вигляді часової стрілки, переміщуючись за циферблатом
годинника в визначених місцях (де знаходяться ферменти) вона викликає звуковий
сигнал (речовини піддаються перетворенням). Наприклад, синтез пальмітинової
кислоти проходить в ході 7 циклів.
Утворена кислота відщеплюється від синтетази і включається в
інші процеси, а до синтетази знову приєднуються вихідні речовини і починається
синтез слідуючої молекули жирної кислоти. Ненасичені жирні кислоти в організмі
практично не синтезуються і повинні регулярно поступати з їжею.
. Обмін фосфоліпідів
В клітинах організму під дією специфічних фосфоліпаз А, В, С,
Д гліцерофосфатиди гідролізуються на свої складові компоненти. Послідовність
дії фосфоліпаз також, як і при розпаді фосфоліпідів їжі в кишечнику. Але
утворений в клітинах лізофосфатид спричиняє при попаданні в кров сильну
гемолітичну дію. Такий механізм лежить в основі токсичної дії яду змій, що
мають у своєму складі фосфоліпазу А. Потрапляючи в кров, цей фермент проводить
до збиткового накопичення в крові лізофосфатидів і розвитку гемолізу
еритроцитів.
Перетворення вивільнених при гідролізі фосфоліпідів гліцерину
і жирних кислот загально відомі. Фосфорна кислота використовується організмом в
незмінному вигляді. Азотиста основа - холін може бути використана для синтезу
фосфоліпідів і стати джерелом утворення ацетилхоліну - медіатора нервової
системи, серин приймає участь у біосинтезі білку і других перетвореннях.
Поряд йде синтез специфічних фосфоліпідів.
. Обмін холестерину
Холестерин в організмі можна розділити на холестерин харчових
продуктів - екзогенний, він всмоктується клітинами кишечника у складі міцел,
утворених парними жовчними кислотами, а потім поступає в лімфу у складі
хіломікронів. Ендогенний холестерин синтезується в печінці і транспортується в
складі ЛПНГ до органів і тканин.
Значення холестерину для організму дуже велике. Він входить
до складу мембран клітин, субклітинних фракцій, в клітинах печінки він
перетворюється в жовчні кислоти, в клітинах наднирочників з нього синтезуються
стероїдні та статеві гормони, в клітинах шкіри з нього утворюється витамін D.
Надлишок холестерину з клітин периферичних тканин в складі ЛПВГ переноситься в
печінку, де метаболізується.
Ще недавно основною причиною збиткового накопичення
холестерину в крові пов’язували з вживанням продуктів, що багаті холестерином.
В наш час встановлено, що гіперхолістеринемія, що супроводжує атеросклероз,
пов’язана з підвищеним синтезом ендогенного холестерину .
Тому зараз основна увага направлена на вивчення цього
процесу. В організмі холестерин утворюється з ацетил-КоА. 18 молекул ацетил-КоА
через ряд проміжних продуктів утворює первинну структуру, котра перетворюється
в холестерин. Тому основні дослідження направлені на пошук речовин, що
сповільнюють цей процес.
. Ацетонові та кетонові тіла, біологічна роль в організмі
В ході обмінних процесів в організмі постійно утворюються
ацетонові і кетонові тіла, до яких відносяться ацетоуксусна і β-оксимасляна кислоти, ацетон.
Вони утворюються в печінці з ацетил-КоА, а потім поступають до периферичних
тканин, де використовуються для обмінних процесів. Так, в м’язах (серцевому
м’язі), мозку при голодуванні ацетонові тіла окислюються з утворенням АТФ і
приймають участь у мієлонізації нервових волокон, є регулятором вуглеводного і
ліпідного обмінів. Вони запобігають гідролізу ТАГ в жировій тканині і
попереджують гіперліпемію. Таким чином, вони знижують і використання
вуглеводів.
. Регуляція обміну ліпідів
На регуляцію впливають фактори зовнішнього і внутрішнього
середовища.
Зовнішні фактори (харчування, стать, вік, характер роботи,
режим дня) впливають на процеси синтезу, запасу, витрачання жирів.
Великий вплив на жировий обмін нервової системи. При
збудженні нервової системи підсилюється мобілізація з депо в кров, з якою він
попадає в печінку, де окислюється, крім того нервова система контролює
діяльність залоз внутрішньої секреції, забезпечуючи злагоджену діяльність
гормонів. Інсулін підсилює процеси літогенезу, перетворюючи вуглеводи в жири,
подавляє окислення жирних кислот. Контрінсулирні гормони (адреналін, глюкагон,
глюкокортикоїди, СТГ) стимулюють розпад жирів. Ось чому зниження синтезу
гормонів гіпофізу і статевих гормонів стимулює синтез жирів і гальмує їх
розщеплення. В регуляції обміну жирів значення має співвідношення синтезу ТАГ і
фосфоліпідів.
Для синтезу ТАГ треба три молекули жирних кислот, а для
синтезу фосфоліпідів - дві. ТАГ відкладаються в клітинах, а фосфоліпіди є
водорозчинними і виводяться з клітин. Постійне виведення фосфоліпідів з клітин
стимулює їх синтез і знижує утворення ТАГ. Але в склад фосфоліпідів, крім
гліцерину і жирних кислот входять ще й фосфорна кислота і азотисті основи.
Організм не відчуває недостачі фосфорної кислоти, але може не доставати
азотистих основ (холіну, серину, етиламіну), необхідних для синтезу
фосфоліпідів. Вони називаються ліпотропними факторами. При їх недостатку синтез
фосфоліпідів затримується і зростає синтез ТАГ. Це може бути причиною жирової
інфільтрації печінки.
Таким чином ліпотропні речовини приймають участь у регуляції
ліпідного обміну.
. Патологія обміну ліпідів
Ліпіди приймають важливу участь в обміні речовин в організмі
і активну участь в діяльності органів і тканин організму.
Обмін ліпідів тісно поч.’язаний з перетворенням інших
речовин. Ось чому порушення ліпідного обміну можуть проявитися при
захворюваннях, причиною яких можуть бути порушення других видів обміну.
Біохімічними симптомами порушення ліпідного обміну є
гіперліпемія (підвищення вмісту загальних ліпідів проти норми), гіполіпемія
(зниження вмісту загальних ліпідів проти норми), ліпурія (підвищення вмісту
ліпідів в сечі). В клініці визначають вміст загальних ліпідів в крові, їх норма
складає 4-8 г/л. В поняття загальні ліпіди об’єднується вміст ТАГ,
фосфоліпідів, холестерину, жирних кислот, тому великі коливання норми
утрудняють широке використання цього показника в клініці. Важко сказати за
рахунок якого показника підвищується вміст загальних ліпідів. Гіперліпімія може
бути фізіологічною і виникати після їжі, особливо багатої ліпідами. Часто
гіперліпімії виникають при захворюваннях, пов’язаних з порушенням енергетичного
обміну. Це цукровий діабет, гострі панкреатити, нефрози, гепатити. При цих
захворюваннях недостатньо використовуються вуглеводи в процесах обміну і тому в
організмі йде посилений процес окислення жирів. Йдуть активні процеси мобілізації
жирів з депо організму. Вони поступають в кров, викликаючи гіперліпемію і
доставляються до тих органів, які відчувають недостаток енергії. Збільшення
вмісту загальних ліпідів відбувається за рахунок збільшення вмісту ТАГ.
Гіперліпемії спостерігаються також при отруєннях, недостатній функції
ендокринних залоз (щитовидної, статевих залоз, наднирочників).
В сечі в нормі визначаються тільки сліди ліпідів (2 мг/л) за
рахунок жиру клітин епітелію сечовивідних шляхів. Підвищення вмісту жиру в сечі
- ліпурія, відмічається після їжі. Особливо після прийому риб’ячого жиру і
швидко проходить. Патологічне накопичення жиру в сечі пов’язано з цілим рядом
причин. Спостерігається при тяжких формах цукрового діабету, туберкульозу,
сечокаменевій хворобі, нефрозах, отруєнях. В сечі з’являється велика кількість
зруйнованих лейкоцитів і епітеліальних клітин і жирових компонентів. Вони
придають сечі молочний вигляд. Ліпурія має місце також при пухлинах
підшлункової залози, інфекційних і гнойних процесах.
Гіполіпемія - зниження вмісту жиру в крові - відмічена при
цирозі печінки, гіпотеріозі.
В клініці, як правило, визначають ліпідні фракції.
Рівень триацилгліцеринів ТАГ в крові 0,59 -1,77 ммоль/л
підвищується при ожирінні, нефрозах, атеросклерозі, гіпофункції щитовидної
залози паралельно з вмістом загальних ліпідів.
Рівень фосфоліпідів 1,52-3,62 г/л підвищується в крові при
діабеті, нефрозах, глікогенозах, гіпотеріозі. При тяжких враженнях паренхіми
печінки (гострий гепатит, жирова інфільтрація) рівень фосфоліпідів знужеється,
так як вражаються ті структури, де йде синтез ліпідів.
Вміст холестерину в крові 2,7-7 ммоль/л залежить від віку,
статі. Гіперхолестеринемія може бути фізіологічною при емоціональному
збудженні, при вагітності і клімаксі.
Патологічна гіперхолестеринемія може бути спадковою і також
може розвиватись при захворюваннях ЦНС (менінгіті, пухлинах мозку, епілепсії),
захворюваннях нирок (нефрити, нефрози), печінки (механічна жовтяниця, гострий
паренхіматозний гепатит).
Гіпорхолестеринемія - зниження вмісту холестерину в крові -
має в основі загальні порушення обміну речовин, що розвиваються при різних
захворюваннях (бронхопневмонії, подагрі, туберкульозі) і порушеннях функції
ендокринних залоз (Базедова хвороба, хвороба Адисона, гіпофункція підшлункової
залози).
В лабораторіях досліджують загальний холестерин і його форми
(вільну і ефірозв’язану). Холестерин транспортується по крові в складі
ліпопротеїдів. В складі ліпопротеїдів низької густини (ЛПНГ) він
транспортується до органів і тканин, і вступає в процеси обміну речовин.
Надлишок холестерину транспортується в складі ЛПВГ в печінку де
метоболізується. Вміст холестерину в крові прямо пропорціональний вмісту
ліпопротеїдів. Все це дає основу для використання ліпопротеїдів в діагностиці.
Гіперліпопротеінемія (ГЛП) ділиться на декілька типів, позначених римськими
цифрами. Для атеросклерозу характерна ГЛП типу ІІ (підвищення ЛПНГ і ЛПВНГ) для
діабету і ожиріння тип ІV (збільшення ЛПВНГ).
Зниження активності ферментів в ШКТ або недостатнє
надходження в кишечник жовчі викликає порушення перетравлення і всмоктування
ліпідів.
До захворювань, основою яких є порушення променевого обміну
ліпідів, відноситься ожиріння. При ожиріння підсилюються процеси синтезу жирних
кислот і ТАГ, що приводить до накопичення їх в клітинах організму.
Вивчення цієї проблеми має важливе значення в зв’язку з
вивченням проблеми довголіття.
Встановлено, що люди з надмірною вагою живуть на 7 років
менше і смертність від серцево-судинних хвороб, цукрового діабету, раку в 3-4
рази вище порівняно з людьми, що мають нормальну вагу. Причиною ожиріння можуть
бути спадкові хвороби, ендокринні порушення пов’язані з гіпофункцією статевих
залоз (ожиріння у кастратів), гіпофізу (гіпофізарне ожиріння). Але найчастіше
ожиріння може бути пов’язане з порушенням енергетичного обміну, коли кількість
енергії, що поступила в організм, набагато перевищує її витрати. Це може бути
при неправильному харчуванні або при гіподинамії.
Порушення обміну холестерину
Порушення обміну холестерину найчастіше спостерігається при
атеросклерозі. Причиною атеросклерозу може бути порушення обміну речовин і
нервового апарату, що регулює кровообіг і фізіологію судин. При атеросклерозі
рівень холестерину збільшується у 2-3 рази (іноді досягає 13 ммоль/л) і
підвищується рівень ЛПНГ.
Причиною гіперхолестеринемії є порушення між обміном
розщепленого і синтезованого холестерину. З їжею холестерину поступає 0,2-0,5
г/добу. Ця кількість майже не впливає на рівень холестерину в організмі. Тому
основна роль належить ендогенному холестерину, якого синтезується за добу
0,8-1,5 г.
Жирова дистрофія печінки пов’язана з накопиченням в клітинах
печінки ТАГ, що приводить до дистрофії клітин печінки і порушення їх функцій.
Це перш за все пов’язано з порушенням співвідношення між синтезом ТАГ і
фосфоліпідів. Посилення синтезу ТАГ гальмує синтез фосфоліпідів і навпаки.
Зниження синтезу фосфоліпідів спостерігається при недостатку ліпотропних
факторів (азотистих основ холину, метионіну, атиламіну).
Лекція № 12. ВОДНО-СОЛЬОВИЙ, МІНЕРАЛЬНИЙ
ОБМІН
1. Розподіл і обмін води в організмі,
регуляція її загального об'єму
Водно-мінеральний обмін включає
процеси надходження, всмоктування, розподіл і виділення води і солей з
організму. Водно-мінеральний обмін забезпечує постійність іонного складу,
кислотно-лужної рівноваги, об’єму рідин внутрішнього середовища організму,
осмотичний тиск, тобто основні параметри гомеостазу.
Розподіл води в організмі. 72% Н2О
знаходиться в клітинах і називається клітинною, 28-30% знаходиться у
міжклітинному просторі, 8-10% знаходиться у вільному стані в біологічних
рідинах: плазмі крові, лікворі, в рідинах суглобів. Вона лабільна і має
властивості розчинника.
Стан води в організмі. Невелика
кількість води (4%) зв'язана з тканинними колоїдами, переважно білками і
субклітинними структурами, мембранами. Це іммобілізована вода, або гідратна.
Між різними формами води існує зв'язок, вона може переходити із однієї форми в
іншу.
Збільшення об'єму міжклітинної води
при короткочасній роботі зумовлено переважно приливом крові, а збільшення
внутрішньоклітинної рідини при довготривалій роботі м'язів, що зв'язано з
підвищення гідратації білків працюючих м'язів.
Біологічна роль води.
1. Універсальний розчинник, в
ній розчиняється більшість органічних і неорганічних речовин. Властивості
розчинника зумовлені тим, що вода - диполь з високою діелектричною здатністю.
2. Вода грає важливу роль в
підтримці унікальної структури і функції клітинних органел.
4. Вода підтримує постійність
складу внутрішнього середовища організму - гомеостаз.
. Являється важливим фактором
в терморегуляції. Вміст води в організмі як теплоємної речовини сприяє
постійності теплового режиму тіла людини.
Потреба у воді організму людини 2,5-3
л в залежності від віку .статі, температури навколишнього середовища. Дитячий
організм витрачає більше води, тому що в ньому інтенсивніше протікає обмін
речовин і вище гідрофільність білків. Дорослій людині треба 30-50 г води на 1
кг маси тіла, дитині 100-150 г.
Організм людини може прожити без їжі
до двох місяців, без води 12-15 днів, Втрата 20-25 % води приводить до загибелі
організму.
При зміні обміну води спочатку в
фізіологічних умовах змінюється кількість вільної води в біологічних рідинах
(плазма, ліквор, лімфа) і міжклітинному просторі, в меншій мірі порушується
обмін внутрішньоклітинної води.
При патологіях, пов'язаних з
дегідратацією організму (гострі кишкові інфекції, тяжкі опіки) зменшується
кількість води в клітинах, що приводить до дегідратації тканинних білків,
глибоких порушень їх обміну, функцій і структури.
Основна маса води всмоктується в
кишечнику, переважно в товстій кишці, і транспортується в тканини і органи
(печінка, м'язи, шкіра), в результаті чого вміст води в них постійний.
Встановлено, що 100 калорій їжі
утворює приблизно 12 г води. За добу необхідно 3000-3500 калорій, при цьому
виділяється 350-400 г води.
Постійна динамічна рівновага між
кількістю води, що поступає в організм і виділилась з нього, являється
необхідною умовою життя. Це водний баланс організму. Якщо води виділяється
менше, чим поступило в організм, то це - позитивний баланс: спостерігається при
набряках, при значному послабленні серцевої діяльності, голодуванні Якщо води
виділилось більше, то це негативний баланс. Це спостерігається при порушеннях
функції нирок, при захворюваннях гіпофізу.
Найбільша кількість води виділяється
з сечею 1200-1500 мл за добу. Значна кількість виділяється з потом, причому тут
спостерігають коливання 200-500 мл, через легені виділяється 300-500 мл, з
випорожненнями 250-300 мл.
. Основні функції нирок. Біохімічна
характеристика ниркового кліренсу та порогу, їх діагностичне значення
Нирки - основний орган виділення
продуктів обміну, регуляції осмотичного тиску, кислотно-лужної рівноваги і
водно-електролітного балансу. Основна функція нирок - екскреторна.
Нирки відіграють важливу роль у всіх
процесах метаболізму і підтриманні енергетичного балансу. В нирках інтенсивно
протікають процеси глюконеогенезу та глюкогенезу. При голодуванні половина
всієї глюкози крові забезпечується нирковим глюконеогенезом.
Нирки приймають участь в регуляції
ліпідного обміну, при хронічній нирковій недостатності розвивається
гіперліпопротеїнурія. В нирках синтезується компоненти біомембран, що мають
ліпідну природу (фосфоліпіди), утворюються ТАГ, формується активна форма
вітаміну Д.
У нирках здійснюються важливі
метаболічні процеси перетворення амінокислот, початковий етап біосинтезу
креатину з аргіну та гліцину.
У нирках протікають процеси
утилізації проміжних кислих метаболітів (окси- і кетокислот) в глюкозу,
синтезується вазоактивний гормон ренін, руйнується інсулін, СТГ, глюкогон,
пролактін, 45% екзогенного інсуліну руйнується в нирках.
Нирки виконують важливу роль в
підтриманні гомеостазу організму людини, характеризуються великою інтенсивністю
обміну речовин, вміст води в нирках біля 83%.
Важлива особливість метаболічних
процесів в нирках - висока активність окислювальних процесів і зв'язаного з ним
фосфорування. Нирки складають 0,5% маси тіла, а поглинають 10% кисню, що
використовується організмом. Інтенсивність обміну зумовлена і підсиленим
кровообігом.
У нирках протікають
фільтраційно-реабсорбційні процеси, так як кров'ю доставляється необхідний
енергетичний матеріал (вуглеводи, ліпіди і кисень), що забезпечує можливість
ефективного функціонування нирок. Затрати кисню і інтенсивність тканинного
дихання максимальні у корковому шарі.
Енергія для роботи нирок
забезпечується в основному за рахунок окислення вуглеводів і ліпідів. В нирках
активно протікають процеси окислення ацетооцтової кислоти - важливого
проміжного продукту обміну ліпідів.
Завдяки утворенню і виділенню сечі
відбувається очищення організму від продуктів обміну і шкідливих речовин. Весь
цей процес пов'язаний з функціональними особливостями клубочків нирок, а також
проксимальних і дистальних канальців, що характеризує клубочкову фільтрацію -
коефіцієнт очищення, або кліренс. Кліренс - це об'єм плазми крові в мілілітрах,
яка проходить через нирки за 1 хв. і повністю очищується від тої чи іншої
речовини. За добу в нирках утворюється 170 - 180 л. первинної сечі, що
відповідає утворенню за 1 хв, 125 мл ультрафільтрату. З 170 л. приблизно 168,5
зворотно всмоктуються в кров. Якщо речовина зворотно всмоктуються, то її
кліренс дорівнює 0. Якщо речовина зворотно не всмоктується (креатинін), то
кліренс, виражений в мілілітрах дорівнює величині ультрафільтрату, в даному
випадку 125мл. Практично кліренс є величиною трохи меншою ніж 125 мл. так як
частина речовин зворотно всмоктується в кров у канальцях нирок.
Значне зниження клубочкової
фільтрації спостерігається при запальних процесах в нирках (нефрити), що
супроводжується зменшенням виділення кінцевих продуктів обміну.
3. Електролітний склад організму.
Біологічна роль основних катіонів та аніонів Nа, К
Роль солей і окремих хімічних
елементів досить важлива. Як пластичний матеріал вони входить до складу різних
тканин тіла (кістки, м’язи, шкіра), є компонентами багатьох білків і
нуклеїнових кислот, знаходяться у вільному стані. Вони необхідні для процесу
обміну речовин, як активатори і коферменти багатьох ферментів, В організмі
людини знайдено 70 хімічних елементів, з них 47 хімічних елементів присутні
постійно і називаються біогенними. Загальна кількість мінеральних речовин
0,8-1% від маси тіла. У залежності від кількості вмісту біогенних хімічних
елементів їх розділяють на макро-, мікро і ультрамікроелементи. До
макроелементів відносяться елементи вміст яких 10-2% (Nа, К, Са. Р,
СL, S).
До мікроелементів відносяться
елементи, вміст яких складає 10-3-10-5% (Вг, F, Fе, Сu,
АІ, Мn, Со, Sr, Li). Елементи вміст яких складає 10-5-10-9%
називаються ультрамікроелементами (Нg, Аu, Сг, Sі, Nі, Ті).
Білки, нуклеїнові кислоти, що мають
властивості іонів, можуть вступати в реакції з різними катіонами. Це відіграє
важливу роль у формуванні структури цих біополімерів і органел клітин, особливо
клітинних мембран. Са2+, Мg2+ необхідні для підтримки
нормальної структури рибосом.
Натрій (Nа) - основний катіон
міжклітинної рідини. Норма Nа в плазмі крові 135-155 ммоль/л. Солі натрію в
організмі знаходяться в іонізованому стані в плазмі лімфі, жовчі, травних
соках, Nа - головний катіон міжклітинної рідини, в ній знаходиться 50% від
всієї кількості Nа. Накопичується в кістках, в кістковій тканині знаходиться
44% від всієї кількості Nа; 6% локалізується внутрішньоклітинно.
Біологічні функції Nа - підтримка
осмотичного тиску, участь у підтримці кислотно-лужної рівноваги, входить в
склад буферних систем крові, приймає участь у передачі збудження по нервовому
волокну.
Баланс Nа регулюється ЦНС,
ендокринною системою та нирками, реабсорбує Nа гормон альдостерон.
Гіпонатріємія розвивається при
недостатньому синтезу альдостерону, введенні в організм великої кількості
рідини.
Гіпернатріємія спостерігається при
гіперпродукції альдостерону, значних втратах рідини без втрати солей, при
хронічних нефритах, гепатитах, цирозі печінки, менінгітах, енцефалітах.
Калій (К) - головний
внутрішньоклітинний елемент, загальна кількість в організмі 160 г,
внутрішньоклітинно К знаходиться до 90%, у міжклітинній рідині 2,5%, в тканинах
м'язів до 8%. М'язова тканина - депо калію. Норма К 3,5-5,3 ммоль/л, в
еритроцитах 79,9-99,3 ммоль/л.
Біологічна роль калію: приймає участь
у підтримці осмотичного тиску і кислотно-лужної рівноваги в клітинах, разом з
Nа створює різницю потенціалів по обидві сторони клітинної мембрани, що
забезпечує енергією фізіологічні процеси, що протікають у мембранах, приймає
участь у процесах біосинтезу білку, глікогену, АТФ, креатин-фосфату,
ацетилхоліну, приймає участь у передачі збудження по нервовому волокну. Добова
потреба - 75 ммоль/л, поступає у складі їжі.
Виводиться з організму нирками, калій
сприяє діурезу і краще виводиться з організму ніж Nа.
У регуляції рівня К грає роль ЦНС:
калій-чутливі рецептори розташовані в судинах печінки, нирок, тонкого
кишечнику. Впливають на рівень К+ альдостерон та інсулін.
Альдостерон підсилює секрецію К в ниркових канальцях, сприяє зниженню
концентрації в організмі. Інсулін, навпаки, зменшує втрату калію нирками і
полегшує його транспорт у клітини.
Гіпокаліємія. Спостерігається при
підвищеній продукції альдостерону і нестачі інсуліну, при нестачі калію в їжі,
поліуріях, пов'язаних з нирковою недостатністю, прийомі діуретиків.
Гіпокаліємія проявляється затримкою проведення нервового збудження в м'язовій
тканині і в міокарді. Виникає недостатність серцевого м'яза, аж до паралічу і
зупинки серця.
Гіперкаліємія виникає при надлишку
надходження калію з лікарськими препаратами, при підсиленому виході калію з
клітин в результаті травм, опіків, гемолізу еритроцитів, при порушенні виділення
калію. Основні зміни спостерігаються при цьому в серцевому м'язі.
4. Біологічна роль та обмін кальцію,
магнію, кобальту, молібдену, цинку, йоду
Кальцій (Са) - міститься в організмі
в основному в кістках, дентині, емалі зубів - 99% загальної кількості кальцію
знаходяться у міжклітинній рідині. У плазмі знаходиться у слідуючих формах:
іонізований, неіонізований, білковозв'язаний. Біологічно активний тільки
іонізований, його 50% від загального вмісту.
Біологічна роль Са: приймає участь у
регуляції процесів нервово-м'язової збудженості, як антагоніст калію, в процесі
зсідання крові, забезпечує цілісність клітинних мембран, так як сприяє
стабілізації структури білків. Необхідний для секреторної активності практично
всіх залоз внутрішньої секреції і є вторинним посередником при передачі
мембранного сигналу, активатор 40 ферментів. Являється основним компонентом у
побудові кісткового скелету.
Добова потреба складає 30 ммоль/л.
Виводиться з організму в складі сечі, слинними залозами, в складі шлункового та
кишкового секретів.
Регулюється обмін гормонами
паращитовидної залози - паратиріном, щитовидної залози - кольцитоніном, у
регуляції приймає участь вітамін Д. Паратирін реабсорбує Са у ниркових
канальцях, кальцитонін знижує його реабсорбцію в ниркових канальцях і підсалює
фіксацію у кістках.
Гіпокальціємія зустрічається при
гіпотеріозі, що супроводжується судомами, спостерігається також при механічній
жовтяниці.
Цинк (Zn) є одним з незамінних
мікроелементів, входить в склад тканинних білків, ДНК, ферментів, інсуліну.
Іони цинку необхідні для функціонування дипепсидаз, лужної фосфатази, РНК- і
ДНК-полімераз, багатьох дегідрогеназ, зокрема алкогольдегідрогенази.
Мікроелемент активує велику групу
ферментів. У ферментах іони цинку можуть бути замінені іонами марганцю, або
кобальту без зниження активності ферменту, з цинком конкурує мідь і дуже
токсичний кадмій.
Цинк активує деякі гормони: статеві,
тіреотропний, гонадотропний, вазопресин, подовжує гіпоглікемічний ефект
інсуліну.
Марганець (Мn) являється необхідним
компонентом організму. Зустрічається в двох і трьох валентній формах.
Біологічна роль марганцю полягає в
тому, що він приймає участь в ферментативних процесах, входить в склад
металзалежних ферментів і регулює їх активність. У марганці мають потребу
велика кількість ферментів: піруваткарбоксилаза, глутамінсинтетаза, фосфатази,
транскетолаза. Марганець підвищує діяльність гормонів гіпофізу, статевих
гормонів, інсуліну, сприяє процесу кровотворення, підвищує катаболізм білків,
попереджує відкладення холестерину в стінках судин. Знайдена залежність між
обміном марганцю і вітамінами А, В, С, Д, Е.
Кобальт (Со) в організмі входить в
склад вітаміну В12 цианкобаламіну, метилкобаламіну, приймає участь в
обміні білків, синтезі РНК, ДНК, еритропоезі, сприяє використанню депонованого
заліза для синтезу гему, підвищує синтез гормонів щитовидної залози, вітамінів
- пірідоксину, тіаміну, стимулює накопичення в організмі вітамінів А, В, С, К,
нікотинової кислоти.
Молібден (Мо) широко розповсюджений у
природі, його можна знайти в любому організмі. Молібден приймає участь в
азотистому, пуриновому обмінах, активує ряд окисно-відновних ферментів, входить
в склад молібдензалежних ферментів. Ці ферменти містять по два атоми молібдену.
Ксантинооксидаза приймає участь в окисленні ксантину і гіпоксантину до сечової
кислоти - кінцевого продукту пуринового, обміну.
Активність ферменту знаходиться в
прямій залежності від вмісту мікроелементу. Є твердження про активацію іонами
молібдену лужної фосфатази. В організм людини молібден поступає з водою,
рослинною і тваринною їжею. Найбільш багаті цим елементом зернові, бобові
культури, печінка, нирки.
Надлишок молібдену в організмі
викликає токсикози, порушення обміну речовин, затримку росту кісток, порушення
обміну міді та фосфору, молібденову падагру в результаті підвищення активності
ксантинооксидази і збільшення в 3 рази і більше вмісту сечової кислоти.
Йод (І) - життєвоважливий елемент, що
входить в структуру гормону щитовидної залози - тироксину. Щитовидна залоза
найбільш багата іонами йоду, який активно поступає з плазми крові і
накопичується в щитовидній залозі. Йод впливає на синтез білків та жирів.
У організм йод поступає з продуктами
харчування (багато його в морських продуктах), водою. Всмоктується він а
тонкому кишечнику досить швидко, поступає з печінку, де на деякий час
затримається.
Недостатнє надходження елементу з
водою і продуктами харчування приводить до порушення гормональної функції
щитовидної залози і розвитку ендемічного зобу. Захворювання проявляється
збільшенням щитовидної залози і зниженням її гормональної функції.
Зменшення концентрації йоду
спостерігається при гіпопротеінеміях, нефротичному синдромі, дистрофії,
ендемічному зобі, кретинізмі, мікседемі.
Підвищення концентрації йоду в крові
спостерігається при гіперфункції щитовидної залози, лейкеміях.
5. Характеристика гомеостазу:
осмотичний тиск, реакція середовища
Осмотичний тиск любої біологічної
рідини (крові, лімфи) визначається молярною концентрацією розчинних в ній
речовин, що називаються осмотичноактивними. До них відносяться неелектроліти
(білки, сечовина, глюкоза), а також різні солі - електроліти (хлорид натрію,
хлорид магнію, дигідрофосфат натрію). Останні в більшій мірі, ніж електроліти
впливають на величину осмотичного тиску, що визначається дисоціацією солей на
осмотичноактивні іони. Сумарний осмотичний тиск, що створюється в біологічних
рідинах неелектролітами і електоолітами при 37ºС складає 7,7-8,1 атм.
Осмотичний тиск має важливе
фізіологічне значення, так як нормальна його величина в крові і лімфі, що омивають
всі клітини людського організму, визначає їх форму і функції (проникливість
мембран). Постійність осмотичного тиску підтримується діяльністю ендокринних
залоз, нирок і іншими регуляторними механізмами.
Вивчення складу речовин, що
визначають осмотичний тиск, має важливе значення в клініці при розробці складу
фізіологічних розчинів, що вводяться в організм при втратах рідини, викликаних
крововиливами, сильними опіками, втратами шлункового та кишкового вмісту, при
інфекційних захворюваннях.
Ці розчини мають осмотичний тиск, що
відповідає осмотичному тиску плазми крові і містить в необхідній кількості
глюкозу, хлористий натрій, хлористий калій, вуглекислий натрій. Такі розчини
називаються ізотонічними. При різних захворюваннях використовуються розчини з
підвищеним або зниженим осмотичним тиском (гіпотонічні і гіпертонічні).
Складовою частиною осмотичного тиску
є онкотичний або колоїдно-осмотичний тиск, що створюється білками, який має
важливе фізіологічне значення для утримування води у циркулярному руслі крові.
Тому при гіпопротеїнемії виникає різниця між онкотичним тиском крові і
тканинних рідин, і вода направляється в сторону більш високого осмотичного
тиску, тобто в тканини, частіше всього у підшкірну клітковину, де накопичується
і викликає набряки.
Реакція середовища визначається
показником рН крові - водневим показником, що представляє собою десятинний
логарифм концентратів іонів водню.
Величина рН крові відрізняється
постійністю і знаходиться в межах 7,3-7,4, незважаючи на різні речовини кислого
або основного характеру, що регулярно поступають з їжею або утворюються в
результаті процесів обміну.
Зсув рН в кислу сторону називається
ацидозом, в лужну сторону - алкалозом. В організмі підтримка рівноваги кислот,
основ, а відповідно і рН крові забезпечується буферними системами, до яких
відноситься білкова, фосфатна, гідрокарбонатна і гемоглобінова. Загальні
уявлення про механізм дії буферних систем можна розглянути на прикладі
бікарбонатного буферу.
Буферна система складається з двох
компонентів: слабкої кислоти і її солі, що утворена сильною основою. В даному
випадку слабка кислота Н2СО3, а її сіль NаНСО3.
При накопиченні в організмі кислих продуктів, наприклад, соляної кислоти, вони
вступають в реакцію нейтралізації з NаНСО3 з утворенням хлориду
натрію і вугільної кислоти.
аНСО3 + НС1 = NаСІ + Н2О
+ СО2
Утворюється вода і вуглекислий газ.
Вуглекислий газ за допомогою гемоглобінової буферної системи переноситься в
легені і видихається. Вода приймає участь у процесах обміну речовин і
виводиться з сечею. NаС1 виводиться теж через нирки з сечею і рН крові
залишається незмінною. При накопиченні в крові основних компонентів (наприклад
NаОН) вони зв'язуються з вугільною кислотою
Н2СО3 + NаОН =
NаНСО3 + Н2О
і NаНСО3 поповнює
бікарбонатну буферну систему, а вода виводиться з сечею.
Діяльність фосфатного буферу
пов'язана з діяльністю нирок.
. Регуляція водно-мінерального обміну
Регуляція водно-мінерального обміну
направлена на підтримку нормальної величини осмотичного тиску, в забезпеченні
якого важливе значення належить натрію (позаклітинний елемент), калію
(внутрішньоклітинний елемент), а також аніонам. Ці мінеральні речовини тісно
пов'язані з обміном води. При збільшенні в плазмі натрію і хлору зростає приток
води в кров з тканин, що забезпечує підтримку нормального рівня осмотичного
тиску. Зменшення в плазмі крові натрію приводить до зневоднення організму.
Натрій і калій тісно пов'язані в
своєму обміні. Підвищення концентрації натрію в крові приводить до зниження в
ній калію. Крім того, в нирках надлишок калію та іонів водню секретується і
виводиться з організму з сечею, тоді як іони натрію реабсорбуються.
Регуляція водно-мінерального обміну
контролюється нервовою та гормональною системами.
Вазопресин (гормон задньої долі
гіпофізу) має антидіуретичігу дію, тобто сприяє реабсорбції води в ниркових
канальцях. В клініці його називають антидіуретичним гормоном. Секреція
вазопресину контролюється величиною осмотичного тиску, підвищення якого
підсилює синтез гормону. В результаті чого підсилюється реабсорбція води в ниркових
канальцях, концентрація осмотично активних речовин знижується і тиск
нормалізується. При цьому виділяється невелика кількість сильно концентрованої
сечі.
При зниженні осмотичного тиску
активується вироблення альдостерону (гормону коркової речовини наднирочників),
який підсилює реабсорбцію натрію в нирках. Рівень натрію в крові підвищується і
осмотичний тиск приходить в норму.
Таким чином вазопресин і альдостерон
регулюють осмотичний тиск: при його зниженні активується вироблення
альдостерону, а вазопресину - гальмується. Підвищення осмотичного тиску
характеризується активацією синтезу вазопресину і пригніченням синтезу
альдостерону.
Паратгормон синтезується
паращитовидною залозою, підвищує реабсорбцію кальцію у ниркових канальцях і
гальмує реабсорбцію фосфатів.
Кальцитонін - гормон С-клітин
щитовидної залози забезпечує депонування кальцію у кістковій тканині і
прискорює виділення кальцію з сечею.
. Роль нирок у регуляції гомеостазу
Виділення води та солей з організму
здійснюється не тільки нирками, але їм належить у цьому процесі основна роль.
Сеча утворюється у функціональних одиницях нирки - нефронах. Об’єм
профільтрованої первинної сечі складає 180 л на добу. Відповідно вся рідина
організму фільтрується чотири рази. Об'єм вторинної сечі складає від одного до
двох літрів за добу. Таким шляхом забезпечується зберігання об'єму міжклітинної
рідини, виведення кінцевих продуктів та солей для підтримки нормального
осмотичного тиску.
Осмотичний тиск і об'єм міжклітинної
рідини контролюється гормонами, для яких орган-мішень - нирки: вазопресин,
альдостерон, ренін.
Кислотно-лужна рівновага
підтримується завдяки буферним системам організму, що в значній мірі
контролюються нирками. Це відбувається завдяки здатності нирок змінювати вміст
іонів водню у сечі (рН сечі може змінюватися від 4,6 до 8,0). Іони водню
виділяються у вигляді недисоційованих кислот або солей амонію. Нирки служать
джерелом надходження невеликої кількості бікарбонатів, що утворюються за
рахунок окислення метаболітів киснем.
Нормальний рН артеріальної крові
складає 7,35-7,43, венозної - 7,26-7,35, тобто кров має слаболужне середовище.
Якщо зсув концентрації настільки
значний, що він супроводжується зміною рН, це свідчить про декомпенсаційний
ацидоз та алкалоз.
У відповідності до патогенезу виникнення
цих порушень розрізняють респіраторні (порушення дихання) та метаболічні
ацидози та алкалози.
Респіраторний ацидоз виникає при
затримці виділення вуглекислого газу в зв'язку з порушенням функції легень
(альвеолярна гіповентиляція):
- обструктивних змінах у легенях;
- важких формах пневмонії,
набряку легень;
- пригніченні дихального
центру (барбітурати, морфін, алкоголь).
Метаболічний ацидоз
пов'язаний з надмірною продукцією і надходженням у кров або порушенням
виведення Н-іонів, а також з витратою основ. Може протікати в залежності від
походження у таких випадках:
- підвищення за рахунок синтезу
ацетонових і кетонових тіл при цукровому діабеті;
- підвищений синтез молочної
кислоти, що відбувається при шоку, гіпоксії, цукровому діабеті, при
захворюваннях печінки;
кишковий ацидоз, що
супроводжується втратою солей (бікарбонатів) при діареї, гострих кишкових
інфекціях, фістулах шлунково-кишкового тракту;
порушення фільтрації Н-іонів
при глумерулонефритах.
Респіраторний алкалоз викликається
підвищеним виділенням вуглекислого газу при видиху (гіпервентиляція легень, що
приводить до зниження концентрації СО2 у крові). Спостерігається при
психічному перезбудженні, лихоманці, наркозі.
Метаболічний алкалоз може виникнути в
зв'язку з великими витратами шлункового соку, що супроводжується блюванням
(гастрити, стенози), підвищенням виділення Н-іонів при гіпокаліємії.
Лекція № 13. ВЗАЄМОЗВ'ЯЗОК ПРОЦЕСІВ ОБМІНУ БІЛКІВ,
ЖИРІВ ТА ВУГЛЕВОДІВ. БІОХІМІЯ ПЕЧІНКИ
1. Взаємозв'язок обміну білків,
жирів, вуглеводів
В організмі процеси обміну різних
речовин дуже тісно пов'язані між собою, що просліджується на різних станах їх
перетворень. Так, при розпаді різних поживних речовин утворюється невелика
кількість проміжних продуктів однакової структури, які складають єдиний резерв
і потім використовуються для синтезу специфічних для даного організму білків,
жирів і вуглеводів.
Взаємозв'язок процесу обміну речовин
можна досліджувати на прикладі використання організмом кінцевих продуктів всіх
обмінних процесів - води, вуглекислого газу, аміаку. Кожна з цих речовин,
незалежно від джерела утворення, активно включається в подальший метаболізм.
Вода необхідна для життєдіяльності кожної клітини і більшості біохімічних
реакцій: цикл Кребсу, окислення жирних кислот, синтез нуклеїнових кислот та
глюкози. Вуглекислий газ утворюється при декарбоксилюванні амінокислот, жирів і
вуглеводів, широко використовується для синтезу холестерину, нуклеїнових,
жирних кислот, жовчних кислот, входить в склад карбонатної буферної системи і
виводиться з організму легенями та з сечовиною в складі сечі.
Аміак, що накопичується в організмі
при дезамінування амінокислот, також активно метаболізується і використовується
як джерело азоту в організмі для синтезу азотовмісних сполук (замінних
амінокислот, нуклеїнових кислот, креатину, холіну.) Невикористаний аміак
виводиться з організму в складі сечовини або амонійних солей.
2.
Ацетил - КОА, глюкоза-6-фосфат і піруват як загальні метаболіти процесів обміну
речовин
Слідуючим фактором, що зв'язують
воєдино обмін різних речовин, є енергія. Незалежно від структури речовини, що
розпалась, вона накопичується однаково - в формі молекули АТФ. Відмінність між
обмінами пов'язана тільки з її кількістю, так жири дають в 2 рази більше
енергії ніж вуглеводи і білки.
Взаємозв'язок обмінів різних речовин
в організмі найбільше виражений на рівні проміжних продуктів, серед яких
центральне значення займає ацетил - КОА, глюкозо-6-фосфат, піруват.
Ацетил - КОА утворюється при обміні
білків (розпад глікогенних амінокислот), ліпідів (окислення жирних кислот) і
вуглеводів (декарбоксилування піровиноградної кислоти). Потім він
використовується в циклі Кребсу, а також служить похідним субстратом для
синтезу жирних кислот, ацетонових і кетонових тіл, холестерину, стероїдних
гормонів, жовчних кислот.
Активований глюкозо-6-фосфат може
бути утворений з різних поживних речовин: глікогену і глюкози, білків,
гліцерину.
Таким чином глюкозо-6-фосфат,
утворений з різних джерел, складає загальний резерв в клітині і по мірі
необхідності витрачається.
Глюкозо-6-фосфат має енергетичне
значення, в ході його розпаду утворюється 2 молекули піровинограної кислоти, а
потім ацетил-КОА, який окислюється до вуглекислого газу і води з виділенням
36-38 молекул АТФ.
Не менше значення має
глюкозо-6-фосфат для синтезу глікогену, для якого він є основним субстратом.
Глюкозо-6-фосфат, розпадаючись в
клітинах печінки під дією глюкозо-6-фосфатази, поставляє в кров вільну глюкозу.
Тим самим забезпечує глюкозою органи і тканини,. в тому числі мозок, для якого
вона в нормі є єдиним джерелом енергії.
Глюкозо-6-фосфат в ході своїх
перетворень утворює речовини, які є стартовими для синтезу багатьох замінних
амінокислот (аланіна, серину, цистеїну). Крім того він поставляє ацетил-КОА, з
якого утворюються жирні кислоти. Він також є похідним для синтезу гліцерину.
Таким чином глюкозо-6-фосфат є
основною для утворення ліпідів, триацетилгліцеридів, гліцерофосфатів. Таким
шляхом при синтезі жирів використовується надлишок глюкозо-6-фосфату.
Піровіноградна кислота є проміжним
продуктом розпаду вуглеводів, жирів, деяких амінокислот (аланіну, цистеїну,
гліцину). В свою чергу, піруват використовується для синтезу вуглеводів
(глюкози), ліпідів і замінних амінокислот, має значення в процесі утворення
ацетил-КОА.
Таким чином, розглянуті три сполуки
ацетил-КОА, глюкозо-6-фосфат і піруват об'єднують обміни різних речовин в
організмі і тому названі ключовими субстратами.
. Функції печінки
Печінка - найкрупніший з внутрішніх органів (1,2 кг у
дорослої людини).
. Печінка приймає і розподіляє майже всі речовини, що
потрапляють в організм людини з шлунково-кишкового тракту по ворітній вені, що
розгалужується на вузькі канальці, по яким кров повільно тече, омиваючи клітини
печінки.
. Служить місцем утворення жовчі, що забезпечує участь
печінки в перетравленні їжі.
. Здійснює біосинтез речовин, які вступають в процеси
обміну в вигляді субстратів в других органах і клітинах.
. Забезпечує знезараження токсичних продуктів
метаболізму, а також продуктів гниття білку в кишечнику.
. Печінка - місце інактивації багатьох гормонів.
. Приймає участь у метаболізмі лікарських препаратів.
. Приймає участь у виділенні деяких продуктів
метаболізму в кишечнику.
а) Роль печінки в обміні вуглеводів.
Печінка відіграє основну роль у підтриманні фізіологічної
концентрації глюкози в крові. З загальної кількості глюкози клітини печінки при
нормальній течії використовують більшу її кількість: 1) на синтез глікогену не
більше 10-15%; 2) на окислення більше 60%; 3) на синтез жирних кислот 30%.
В печінці протікають процеси глюконеогенезу. Основні
попередники глюкози - лактат і аланін - поступають з м’язів, гліцерол - з
жирової тканини, глікоген амінокислот з їжею.
Надлишкове надходження глюкози з їжею збільшує її розпад з
утворенням пірувату. Цей процес гальмує окислення жирів у циклі Кребсу.
Таким чином, між жирами і глюкозою в процесі окислення може
виникнути конкуренція.
б) Участь печінки в обміні ліпідів.
Печінка як орган, відповідальний за синтез компонентів жовчі,
перш за все приймає участь в перетравленні та всмоктуванні ліпідів. Тут
синтезуються жовчні кислоти - емульгатори жовчі і активатори панкриатичної
ліпази в тонкому кишечнику, холестерин, утворюються фосфоліпіди плазми,
кетонові тіла та ліпопротеіди. Печінка контролює обмін ліпідів всього
організму. ТАГ складають 1% маси печінки, але вона контролює процеси синтезу і
транспорту жирних кислот. Це пов’язано з тим, що жирні кислоти необхідні для
синтезу ТАГ і фосфоліпідів. ТАГ здатні відкладатися в клітках печінки прозапас,
а ФЛ є гідрофільними сполуками і виводяться з печінки, доставляються до органів
і тканин. Цей процес стимулює синтез ФЛ і гальмує синтез ТАГ. В організмі
достатньо фосфорної кислоти і гліцерину, але може бути недостатньо азотистих
основ холіну, серину, етаноланіну, метіоніну. Їх називають ліпотропними
факторами. При їх недостатку синтез ФЛ знижується і зростає синтез ТАГ, що
проводить до ожиріння печінки.
в) Участь печінки в обміні білків.
У печінці активно протікає синтез і
розпад білків, що мають важливе значення для організму. В печінці синтезується
13-18 г білків за добу. Альбуміни, фібриноген, протромбін синтезується тільки в
печінці. Тут синтезується до 90% глобулінів і 50% β-глобулінів. В зв'язку з цим,
при захворюванні печінки знижується синтез білків і це приводить до зменшення
їх кількості в крові, або утворення білків з зміненими фізико-хімічними
властивостями, в результаті чого знижується колоїдна стійкість білків крові і
вони швидше випадають в осад, ніж звичайні білки під дією солей лужних і
лужноземельних металів, а також тимолу, сулеми. Знайти зменшення кількості
білків або зміну їх властивостей можливо за допомогою проб на колоїдостійкість
білків, серед яких використовують пробу Вельтмана, Тимолову пробу.
Печінка - основне місце синтезу
білків системи згортання крові (фібриноген, протромбін). Порушення їх синтезу,
як і недостатність вітаміну К, що розвивається внаслідок порушення
жовчовиділення, приводить до гемарогічних діатезів.
Активно протікають в печінці процеси
перетворення амінокислот (пере амінування, дезамінування, декарбоксилювання) і
при таких враженнях печінці процеси суттєво змінюються. В крові зростає
концентрація вільних амінокислот і виділеннях їх з сечею. В сечі навіть можуть
бути кристали лейцину тирозину.
В печінці проходить синтез сечовини і
порушення функцій гепатоцитів приводить до зростання кількості вільного аміаку
в крові, що негативно впливає на весь організм і може проявитися печінковою
комою, що може привести до загибелі хворого.
Обмінні процеси, що протікають в
печінці, каталізуюються різними ферментами, які при захворюваннях виходять в
кров і поступають в сечу. Причиною є порушення проникливості клітинних мембран,
що має місце на початку захворювання. Тому підвищення активності ферментів є
одним з найважливіших показників в доклінічний період. Наприклад, при хворобі
Боткіна зростає активність АLТ і АSТ при холестазі зростає активність лужної
фосфатази.
Печінка виконує дуже важливу
антитоксичну функцію. В ній знезаражуються індол, скатол, фенол, кадаверін, що
є продуктами загнивання білків в кишечнику, білірубін, продукти обміну
стероїдних гормонів. При цьому утворюються кон’юговані з глюкуроновою кислотою
сполуки, що виводяться з сечею.
. Детоксикація токсичних речовин
Детоксикаційні процеси здійснюється шляхом їх хімічної
модифікації, яка включає дві групи перетворень:
- окислення, відновлення або гідроліз з утворенням груп -
ОН, - СООН, - SН, - NН;
- приєднання до цих груп глюкуронової або сірчаної
кислоти, гліцину, глютаміну або ацетильного залишку (кон’югація). Знезараження
може відбуватись за допомогою одного або двох перетворень.
Реакції першої групи забезпечуються гідроксилазами мікросом
(мікросомальна фракція - це обривки мембран єндоплазматичної мережі).
З реакції кон’югації переважає приєднання глюкуронової
кислоти. Цей процес каталізує глюкуронілтрансфераза - інтегральний білок (ГТ)
ендоплаз-матичного ретикулуму.
В реакціях кон’югації з сірчаною кислотою донором є
ацетил-КоА. Ці утворення приводять до підвищення гідрофільності знезаражуючих
продуктів, що полегшуює процес виведення їх з організму.
Знезараження нормальних метаболітів - білірубіну і аміаку.
Знезараження білірубіну відбувається шляхом кон’югації з
одною або двома молекулами глюкуронової кислоти і в меншій мірі з сірчаною
кислотою, що виводяться з жовчю в кишечник. Аміак знезаражується в орнитиновому
циклі і входить в склад молекули сечовини, яка поступаючи в кров, виводиться з
сечею.
Інактивація гормонів в печінці, в залежності від їх природи,
протікає різними шляхами.
Пептидні гормони гідролізуються протеазами. Молекула інсуліну
інактивується в два етапи: відновлення дисульфідних зв’язків з вивільненням
поліпептидних ланцюгів і їх гідроліз інсуліназою. Процес протікає швидко, при
однократному проходженні крові через печінку руйнується 80% гормону.
Катехоламіни (адреналін, норадреналін) в гепатоцитах піддаються
окислювальному дезамінуванню і коньюгуються з сірчаною та глюнуроновою
кислотою. Продукти катаболізму виводяться сечою.
Стероїдні гормони в мікросомальній фракції гідролізуються при
участі гідроксилаз, коньюгуються з глюнуроновою або сірчаною кислотою і також
виводяться з сечею.
Знезараження продуктів гниття амінокислот, що утворюються під
дією мікрофлори кишечнику, відбувається слідуючим чином. Трупні яди (кадаверин
та путресин) - виводяться з сечею в незмінному вигляді, крезол та фенол, що
утворюються при розпаді тирозину, скатол і індол при розпаді триптофану,
всмоктуються в кровообіг і затримується в печінці, утворюючи кон’югати з
глюнуроновою і сірчаною кислотою, а скатол деметилюється, перетворюючись в
індол, який коньюгується і виділяється у вигляді калієвої солі (тваринний
індикан). Інтенсивність цього процесу пропорційна інтенсивності процесів гниття
в кишечнику і швидкості знезараження в печінці. Тому вміст індикану служить
показником функціонального стану печінки.
Метаболізм лікарських препаратів включає окислення, що
каталізується мікросомальними оксидазами. Вони представляють собою ферментні
комплекси, що вимагають молекулярного кисню та НАДФ•Н2.
Ферментні системи, що каталізують знезараження лікарських
препаратів і других сполук, що проникають з зовнішнього середовища, не були
сформовані в організмі в еволюційному процесі. Здатність до знезараження в
організмі набута. З віком ця властивість у печінки зростає.
Активність оксидаз може бути підсилена індукторами, що
представлють собою різні хімічні агенти і лікарські сполуки (гормони, лікарські
препарати, інсектициди, канцерогени).
Відомі сполуки, що гальмують активність мікросомальних систем
окислення - інгібітори.
Класичний приклад - фенобарбітал. При його введенні кількість
цитохромму Р450 збільшується в 3-4 рази. Це супроводжується
інактивацією етилморфіну, антипіріну, кумаринових препаратів. Після відміни
фенобарбіталу індукція гальмується, що викликає підсилення ефекту інших
лікарських препаратів. Наприклад, доза кумаринових препаратів на фоні відміни
фенобарбіталу, може бути токсична. Другий приклад - етанол. Його перетворення в
ацетальальдегід протікає з участю оксидаз мікросом. У людей, що споживають
великі дози алкоголю, концентрація цитохрому Р450 підвищена. Тому у
алкоголіків в тверезому стані виведення барбітуріатів підсилене і вони не дають
терапевтичного ефекту. Напроти, епізодичний прийом алкоголю гальмує інактивацію
барбітуратів тому, що етанол конкурує з ними за фермент. До угнітаючої дії
етанолу приєднується дія барбітуратів, що може привести до смерті.
Індуктори можуть бути використані як лікарські препарати. Так
введення фенобарбіталу може знизити концентрацію білірубіну.
Зараз відома ціла група речовин, що викликають рак -
канцерогени - бензапірен, бензантрицен, циклічні ароматичні вуглеводи.
Особливістю їх перетворення є те, що їх метаболіти теж є концерогенами. Так,
бензантрацен в процесі перетворення, перетворюється в оксид-концероген.
Друга група - ароматичні аміни, що використовуються для
виробництва анілінових барвників. Вони можуть викликати рак слизової оболонки.
Афротоксини - метаболіти деяких видів плісняви, афлотоксин В1
може викликати рак печінки.
Печінка виконує в організмі основну антитоксичну функцію і не
терпить до себе зневажуючого відношення.
5. Роль печінки у підтриманні і забезпеченні гомеостазу
організму
Важливу роль виконує печінка у водно-мінеральному обміні та
підтриманні гомеостазу. Вона є депо крові і міжклітинної рідини, натрію, калію,
магнію, заліза. В печінці синтезуються білки, що зв’язують ці мінеральні
речовини і транспортирують по крові феритин (Fе) церулоплазмін (Сu) .
Печінка - місце інактивації гормонів, що регулюють гомеостаз
-альдостерону, вазопресину.
6. Ліпотропні речовини та їх роль. Склад та роль жовчі
В клітинах печінки утворюється жовч, яка поступає по
жовчовивідних шляхах в жовчні протоки і поступає в жовчний міхур, де
накопичується та згушається. В період перетравлення їжі жовч поступає через
жовчний проток в дванандцятипалу кишку. Ємкість жовчного міхура 30-40 мл, за
добу поступає жовчі 500-800 мл. Жовч складна за складом рідина - 97,5% Н2О
и 2,5% сухого залишку. В жовчному міхурі вона згущується - 84% Н2О,
сухий залишок - 14%. Через стінку жовчного міхура в кров просочується також Na2CO3,
NaCl. Стінка жовчного міхура виділяє муцин і збагачує ним жовч.
Найважливіші складові жовчі - жовчні кислоти (0,6-0,7%),
жовчні пігменти, холестерин (0,6%), ТАГ, жирні кислоти, фосфоліпіди, муцин,
сечовина, сечова кислота, мінеральні речовини, Са, Fе. Вміст холестерину і Са,
Fе в жовчі вище ніж у крові, вони виділяються з жовчу з організму.
Жовчні кислоти грають важливу роль в процесах перетравлення
ліпідів. Це полімерні похідні холестерину серед яких найважливіші глікохолева,
хенодезоксихолева, які піддаються перетворенням під дією бактеріальних ферментів.
Зворотнє всмоктування жовчних кислот відбувається в тонкому
кишечнику (90-95%), а частина виділяєється в складі фекалій.
7. Показники, що характеризують функціональний стан печінки
В лабораторній практиці для дослідження функціонального стану
печінки застосовують слідуючі біохімічні тести, що носять назву комплексу
печінкових проб: білірубін та його фракції, тимолова проба, АLТ, АSТ, ЛДГ,
загальний білок та його фракції, показник А/Г, холестерин, фібриноген,
протромбін. Функціональний стан печінки вивчається двома шляхами:
- визначення вмісту в сироватці крові речовин, що
синтезуються в печінці (фібриноген, протромбін, білки сироватки крові, жовчні
пігменти);
- проби на здатність печінки виводити введені в
організм речовини, наприклад глюкозу - шляхом синтезу глікогену, бензойну
кислоту - шляхом утворення гіпуринової кислоти. Проба на синтез гіпуринової
кислоти носить назву проби Квіка. В організм людини вводять бензойну кислоту -
слабо отруйну речовину, а потім на протязі декількох годин визначають в окремих
порціях сечі вміст гіпуринової кислоти. При захворюваннях печінки виведення з
організму гіпуринової кислоти зменшується.
Лекція № 14. СИСТЕМА ЗГОРТАННЯ КРОВІ
1. Сучасні уявлення про систему
гемостазу
Система згортання крові, або інакше
система гемостазу, виконує в організмі життєво важливу функцію підтримку крові
в рідкому стані у кровоносних судинах і разом з тим попереджує й зупиняє
кровотечу з ушкоджених кровоносних судин. Ця система перебуває в тісному
взаємозв'язку з іншими фізіологічними системами живого організму. Регулюється
центральною й периферичною нервовими системами, ендокринною системою, а також
на неї впливають простагландини, кініни і біогенні аміни (серотонін, гістамін і
ін.).
Функціональними компонентами системи
гемостазу є судинна стінка, тромбоцити, інші клітини крові й деякі білки плазми
крові, відповідальні як за, згортальний так і за протизгортальний процеси.
Залежно від механізму зупинки кровотечі прийнято розрізняти два типи гемостазу:
первинний і вторинний.
2. Коагуляційний гемостаз. Плазмові
та тромбоцитарні фактори згортання крові, регуляція
Первинний, мікроциркуляторний або
судинно-тромбоцитарний гемостаз, забезпечує зупинку кровотечі з капілярів,
дрібних вен і артерій. У його реалізації приймають участь судинна стінка й
тромбоцити. При травмі кровоносної судини виникає її спазм у місці ушкодження,
у перші хвилини це припиняє або, принаймні, значно знижує крововтрату. Відразу
ж слідом за судинним спазмом відбувається адгезія (прилипання) тромбоцитів до
країв ушкодженої судини і їхня агрегація (склеювання між собою). Вивільнювані
при цьому із тромбоцитів АДФ (аденозини-фосфат), серотонін і адреналін
підсилюють судинний спазм і агрегацію тромбоцитів, а вивільнений з ушкоджених
тканин і ендотелію судин, тканинний тромбопластин взаємодіє з білковими
факторами згортання крові і утворюється деяка кількість тромбіну. У результаті
агрегація тромбоцитів стає незворотною і формується первинний, так званий,
білий тромбоцитарний тромб. На цьому кровотеча із дрібних кровоносних судин
зупиняється. При лабораторному обстеженні хворих, для характеристики реакцій
первинного гемостазу, використовуються тести, по-перше, що характеризують стан
судинної стінки - це час кровотечі по Дуке або Айбі, по-друге досліджуються
тромбоцити - робиться підрахунок кількості тромбоцитів у периферичній крові і
досліджується їх функціональна активність - проби на адгезію і агрегацію
тромбоцитів.
При кровотечах з більших судин
тромбоцитарного тромбу недостатньо для зупинки крові, такий тромб виштовхується
і тому автоматично підключається коагуляційний гемостаз.
Вторинний, макроциркуляторний, або
коагуляційний гемостаз забезпечується системою згортання крові, яка в нормі
складається із двох взаємно врівноважених ланок - прокоагуляційного
(згортального) і антикоагуляційного (протизгорталь-ного). Прокоагуляторна
система базується на 15 білкових плазмових і клітинних факторах згортання
крові. Головною функцією прокоагулянтної ланки є утворення фібринового згустку.
Плазмові фактори скорочено
позначаються римськими цифрами, а в повній їх назві закладені або виконувана
функція, або прізвище хворих, у яких уперше був виявлений дефіцит відповідного
фактора, плазмові фактори постійно циркулюють у кров'яному руслі, але
перебувають вони в неактивній формі. Переходять у активний стан тільки при
необхідності, коли включається механізм гемостазу.
Таблиця 5. Міжнародна номенклатура
плазмових факторів згортання крові
|
Скорочене
позначення
|
Повна назва
|
|
I
|
Фібриноген
|
|
ІІ
|
Протромбін
|
|
ІІІ
|
Тканинний
тромбопластин
|
|
IV
|
Іони кальцію
|
|
V
|
Проакцелерин
(лабільний)
|
|
VІІ
|
Проконвертин
(стабільний)
|
|
VIII
|
Антигемофільний
глобулін
|
|
IX
|
Кристмасс-Фактор,
плазмовий тромбопластиновий компонент, антигемофільний фактор В.
|
|
X
|
Фактор
Стюарта-Прауэр
|
|
XI
|
Фактор Розенталя,
плазмовий попередник тромбопластину, антигемофільный фактор С.
|
|
XIІ
|
Фактор Хагемана,
фактор контакту.
|
|
XIII
|
Фібриназа,
фібриностабілізуючий фактор.
|
|
Додаткові фактори:
|
фактор Віллебранда
фактор Флетчера (прекаллікреїн) фактор Фітцджеральда (кініноген).
|
Тромбоцитарні фактори позначаються
арабськими цифрами. Із тромбоцитарних факторів найбільш важливим для процесу
згортання крові є фактор 3-тромбоцитарный тромбопластин, що містить фосфоліпід.
Він поряд із плазмовими факторами бере участь в утворенні тромбіну із
протромбіну.
З факторів згортання інших клітин
крові варто назвати лізосомальні білки і лейкоцити здатні викликати
преципітацію фібриногену й впливати на полімеризацію фібрину. Вони мають певною
антикоагулянтну і фібринолітичну активністю. Еритроцити також беруть участь у
гемостазі, виділяючи при порушенні цілісності своїх мембран речовину, що
аналогічна 3-му фактору зсідання крові.
Тканинним фактором гемостазу є
тканинний тромбопластин, що утвориться при руйнуванні тканин і запускає процес
згортання крові по зовнішньому механізму. Суть процесу згортання крові загалом
можна представити в такий спосіб: під впливом якого-небудь ініціюючого агента
утвориться активний кров'яний тромбопластин, що переводить протромбін у активну
форму - тромбін. Той у свою чергу впливає на фібриноген, перетворюючи його в
нерозчинний фібрин, що випадає з русла у вигляді тромбу.
Якщо розгорнути наведену вище схему,
то необхідно відзначити що весь процес згортання крові умовно ділять на 4 фази:
перша - протромбіноутворення; друга - тромбіноутворення; третя - утворення
фібрину; четверта - посткоагуляційна. Перша фаза - протромбіноутворення
найбільш тривала, в процесі згортання крові вона займає 4-6 хв. Реакції,
характерні для цієї фази, можуть розвиватися по внутрішньому і по зовнішньому
механізмах. В першому випадку процес починається з активації 12 фактору
яким-небудь пусковим агентом (ушкоджена судинна стінка, імунні комплекси,
хіломікрони й ін.). Потім відбувається ланцюгова реакція, у якій беруть участь
каликреин, кінін і ряд факторів, яка закінчуються утворенням ферментативного
комплексу, здатного перетворювати протромбін у тромбін. Тому даний комплекс,
якому приписується ферментна активність за аналогією з ферментами, названий
протромбиназою. Зовнішній механізм утворення активної протромбінази починається
з появи в кров'яному руслі ІІІ фактору (тканинний тромбопластин), що надходить
із ушкоджених тканин, а в нормальних умовах у плазмі крові відсутній. Кожний з
наведених механізмів утворення протромбинази відбувається паралельно. З
утворенням протромбинази завершується перша фаза згортання крові.
Наступні фази гемостазу протікають,
не роздвоюючись в одному варіанті. У другій фазі відбувається утворення
тромбіну з його неактивного попередника-протромбіну під впливом протромбінази.
Фаза швидкоплинна. На неї йде 2-5 секунд.
У ході третьої фази тромбін відщеплює
від фібриногену пептиди А и В, переводячи його у фібрин - мономер. Останній,
полімеризуючись, випадає із плазми у вигляді безбарвних ниток фібрину, що
переплітаються і захоплюють з собою формені елементи крові. Тому фібриновий
згусток завжди пофарбований у червоний колір за рахунок еритроцитів. Цей пухкий
червоний тромб дуже лабільний. Може легко розчинятися фібринолізином,
сечовиною. На нього впливає 13 фактор (фібриназа), що ущільнює тромб і робить його
обмежено розчинним. Активація 13 фактору також здійснюється тромбіном у
присутності 4 фактору (іонів кальцію). Фаза триває 2-5 секунд. Остання,
четверта фаза, складається зі спонтанного фібринолізу.
. Антикоагулянтна система.
Антикоагулянти фізіологічні та патологічні, прямої і непрямої дії, синтез
Актикоагулянтна система. У її
формуванні, так само як і в прокоагулянтній ланці, беруть участь білкові
фактори плазми, тромбоцитів і тканин. Сумарна активність протизгортальної
системи крові складається з активності антикоагулянтів і системи фібринолізу.
Фізіологічна дія антикоагулянтів полягає в обмеженні функції активних
прокоагулянтів і спрямована на запобігання утворення згустків фібрину в крові.
А функція фібринолітичної системи зводиться до розчинення сформуваних в
кров'яному руслі згустків фібрину, тобто ці дві ланки протизгортальної системи
крові взаємно доповнюють одна одну. Приведемо коротку характеристику кожного з
них.
Антикоугулянти в загальному плані
прийнято ділити на природні (фізіологічні й патологічні) і штучні. Природні
антикоагулянти утворюються безпосередньо в самому організмі, а штучні - це
синтетичні препарати, які вводяться в організм ззовні. Природні антикоагулянти
в організмі підрозділяють на первинні й вторинні. Первинні синтезуються незалежно
від процесу згортання крові й постійно є присутніми у кров'яному руслі. Вони не
впливають на неактивні форми гемостазу. Вторинні антикоагулянти утворяться в
процесі згортання крові і фібринолізу. До природних (фізіологічних) первинних
антикоагулянтів відносяться: антитромбін-3,4 гепарин, α-2-макроглобулін; α-1-антитрипсин.
Найбільш виражену антикоагулянту дією
має антитромбін-3. Він забезпечує до 90% всієї антитромбінової активності
крові. Це білок, що відноситься до α2-глобулінів. Синтезується в печінці.
Вміст антитромбіну-3 у крові в нормі коливається від 70 до 140%.
Активність антитромбіну-3 багато в
чому залежить від наявності в крові гепарину. Більше того, обоє вони можуть
повноцінно реалізувати свою фізіологічну дію тільки в комплексі один з одним. У
цьому комплексі роль білкової частини виконує антитромбін-3, а його кофактором
є полісахарид гепарин. При дефіциті гепарину в кров'яному руслі активність
антитромбіну-3 знижується більше, ніж у 30 разів. А при вмісті в крові
антитромбіну-3 менше 50% від норми, гепарин повністю втрачає свої
антикоагулянтні властивості. Це враховують клініцисти при призначенні
гепаринотерапії.
Крім фізіологічних антикоагулянтів,
інгібіруючою дією на процес згортання крові володіють патологічні
антикоагулянти, у ролі яких можуть вступати антитіла до окремих
прокоагуляційних факторів, протеінази.
Штучні антикоагулянти застосовуються
при необхідності для внесення корекції в процесі гемостазу. Їхня дія звичайно
спрямована на пригнічення синтезу в печінці факторів згортання крові. До
штучних антикоагулянтів відносяться дикумарол, пелентан, синкумар та ін.
. Система фибринолізу
Система фибринолізу представлена
білком крові профібринолізином (плазміноген), що після активації перетворюється
в активний фібринолізин (плазмін), що володіє ферментними властивостями,
характерними для протеіназ. Сюди ж входять активатори й інгібітори фібриноліза.
Активація плазміногена в нормі
відбувається безпосередньо на фібриновому згустку при фіксації на ньому
12а-фактора і прокалікреїна. Цим обумовлений локальний характер дії плазміну,
що не поширюється по всьому судинному руслу. Активація плазміногена може також
ініціюватися протеіназами різного походження-протеіназами тканинних клітин,
якими багаті лізосоми. При порушенні проникності клітинних мембран, наприклад,
при запальних процесах, тканинні протеінази посилено викидаються в кровоток, що
підсилює фібриноліз і нерідко закінчується спонтанними кровотечами. Інфікування
організму бактеріями супроводжується масивним надходженням у кров бактеріальних
протеіназ (стрептокіназа й ін.).
Плазмін викликає розщеплення фібрину
на окремі фрагменти-продукти деградації фібрину (ПДФ), які в нормі видаляються
фагоцитарною системою і у крові не накопичуються. Реалізувавши свою функцію,
плазмін інактивується системою інгібіторів. До них відносяться: α1-антиплазмін (α1-антитрипсин); α2-макроглобулін; антитромбін-3; α2-антиплазмін. Це природні інгібітори
фібринолізу. З лікувальною метою можуть бути використані штучні інгібітори
плазміну-кантрикал, трассиол, амінокапронова кислота. Остання є інгібітором
тільки фібринолізину, яки не адсорбований на нитках фібрину.
. Патологія системи гемостазу
Прийнято розрізняти три основні форми
порушення процесу згортання крові: гіпокоагуляції, гіперкоагуляції й
дискоагуляції. У всіх цих випадках має місце патологія системного характеру, а
не локальні деструктивні процеси. Гіпокоагуляції проявляються кровоточивістю
(геморрагіями) різного ступеня виразності. Залежно від переважаючого механізму,
в розвитку кровоточивості їх прийнято розділяти на: коагулопатії,
тромбоцитопенії й тромбоцитопатії, вазопатії. Коагулопатії пов'язані з
порушенням вторинного гемостазу і можуть проявлятися типом кровоточивості, що
характерний тільки для порушень внутрішнього механізму утворення протромбінази.
При цьому значні крововиливи відбуваються переважно в суглоби, м'язи, підшкірну
клітковину тобто в місцях більшої травматизації. Уроджені коагулопатії
пов'язані з дефіцитом або повною відсутністю ряду плазмових факторів згортання
крові, а також компонентів калікреїнкінінової системи. Найбільш характерним
захворюванням з даної групи коагулопатій є гемофілія. Це спадкове захворювання,
що передається по материнській лінії до синів, розвивається внаслідок дефіциту
одного із плазмових факторів, наприклад VІІІ (антигемофільний глобулін А).
Найбільш виражена кровоточивість відзначається при гемофіліях типу А. Гемофілія
проявляється серйозними кровотечами тільки в екстремальних ситуаціях - при
великих травмах, хірургічних операціях, пологах.
Коагулопатії придбаного характеру
можуть бути зв'язані зокрема з гіперактивацією протизгортальної системи крові.
Наприклад, спонтанні кровотечі супроводжують патологічні процеси в легенях,
підшлунковій залозі, матці. Клітини цих органів особливо багаті лізосомальними
протеїназами й при їхніх запаленнях, коли порушується нормальна проникність
клітинних мембран, протеїнази надходять у великій кількості в кров. Це викликає
гіперактивацію плазміногену. Утворений плазмін розщеплює не тільки фібрин, але
й фібриноген. Продукти їхнього розщеплення у свою чергу блокують тромбін. Вони
є інгібіторами прокоагулянтної ланки і підсилюють кровотечу.
Кровоточивість при тромбоцитарних
порушеннях носить петехіально-плямистий тип у шкірних покривах. Відзначаються
ясеневі, носові й маткові кровотечі. Аналогічний тип кровоточивості може
спостерігатися і при дефіциті фібриногену.
Вазопатії (враження судинної стінки)
проявляються особливим типом кровоточивості на фоні запаленої набряклої шкіри з
розширеною капілярною мережею.
При лабораторному дослідженні
гемостазу у випадку гіпокоагуляції визначається характерна картина
недостатності прокоагулянтної ланки, що нерідко супроводжується гіперактивністю
антикоагулянтної системи.
Гіперкоагуляція. Це стани, пов’язані
з підвищеною схильністю крові до згортання. Проявляються тромбоемболічною
хворобою, що супроводжується такими грізними ускладненнями як інфаркт міокарда,
ішемічний інсульт мозку, тромбофлебіт, тромбоз магістральних артерій або інших
кровоносних судин. У механізмі розвитку гіперкоагуляції відіграють роль
коагулопатії, гіперактивація тромбоцитів, враження судинної стінки
(склеротичні, запальні) і ряд факторів ризику - емоційні стреси, гіподинамії,
недостатність кровообігу. З коагулопатії можна визначити стани, що
супроводжуються гіперактивацією прокоагулянтної ланки - збільшення індексу
контактної активації, тромбопластинової активації - збільшення концентрації
фібриногену, поява в крові фібриногену В, мономерів фібрину. Зниження
противозгортальної активності крові - антитромбінової (особливе зниження вмісту
антитромбіну-3), антитромбопластинової і фібринолітичної активності.
Лабораторне дослідження повинне бути
спрямоване на характеристику всіх ланок гемостазу.
Дискоагуляції. Сюди прийнято
відносити ДВЗ-синдроми (диссемованого внутрішньосудинного згортання крові).
Виникають у результаті розбалансування гемостазу на різних його рівнях. Завжди
носять придбаний характер, і ускладнюють такі критичні стани для організму як:
сепсис, важкі травми, хірургічні втручання, ускладнені пологи, гострий внутрішньосудинний
гемоліз, синдром масивних трансфузій крові, термінальні стани.
В протіканні ДВЗ-синдромів
розрізняють фазу гіперкоагуляції і гіпокоагуляції. На фазі гіперкоагуляції
розвивається надмірна активація факторів гемостазу. Це фаза швидкоплинна й
важка для діагностики, тому що зовні практично нічим не проявляється. Тільки
при лабораторному дослідженні гемостазу виявляються характерні зміни: помірне
зниження тромбоцитів, підсилюється агрегація й адгезія тромбоцитів. Через
присутність у крові тромбіну й інших активованих прокоагулянтних факторів
коротшають час згортання крові по Лі-Уайту, активований час рекальцифікації й
тромбіновий час, відзначається гіперкоагуляція на аутокоагулограмі, знижується
антитромбінова активність, активується фібриноліз. Через появу в крові великої
кількості продуктів деградації фібрину і фібриногену позитивними стають
етанолова і протамінсульфатна проби.
Не діагностовано і не перервана
лікувальними заходами фаза гіпоркоагуляції трансформується в наступну фазу -
гіпокоагуляції. Наступає посилене споживання факторів гемостазу й різке падіння
гемостатичних функцій крові і судин, фаза гіпокоагуляції супроводжується
профузними кровотечами із внутрішніх органів, синцями на тілі, функціональною
недостатністю всіх систем і органів. На цій фазі може наступити загибель
хворого. При дослідженні системи гемостазу відзначається виражена
тромбоцитопенія. Подовжується до 12 хв. і більше час згортання крові по
Лі-Уайту, подовжується активований час рекальцифікації і тромбіновий час,
відзначається гіпокоагуляція по аутокоагуляційному тесту, знижується
протромбіновий індекс, різко знижується кількість фібриногену, підвищені
антикоагулянтні властивості крові, значно активується фібриноліз, етанолова
проба негативна протамінсульфатна проба залишається позитивною. Це розцінюють
як свідчення глибоких порушень гемостазу. При адекватно проведеній терапії
можливий успішний вихід із ДВЗ-синдрому.
Література
1. Ермолаев МЛ. Биологическая
химия. - М.: Медицина, 1989.
2. Іваницька Г.І., Люленко Л.В.
Практикум з клінічної біохімії. - К.: Здоров'я, 2001.
. Клінічна лабораторна
діагностика: Практичні заняття з клінічної біохімії / За ред. М.А. Базарнової,
З.П. Гетте. - К.: Вища шк., 1994.
. ЛюбинаА.Я., Ильичева Л.П.,
Катасанова П.В., Петросова СА. Клинические лабораторные исследования. - М.:
Медицина, 1984.
. Ронин В.С., Старобинец Г.М.
Руководство к практическим занятиям по методам клинических лабораторных
исследований. - М.: Медицина, 1989.
. Руководство по клинической
лабораторной диагностике. Ч..3. Клиническая биохимия / Под ред. М.Б.
Базарновой, В.Т. Морозовой. - К.: Вища шк., 1986.
. Комаров Ф.И., Коровкин Б.Ф.,
Меньшиков В.В. Биохимические исследования в клинике. - Элиста АПП
"Джангар", 1998.
. Бышевский А.Ш., Терсенов
О.Я. Биохимия для врача: Уральский рабочий, 1994.
. Камышников В.С. Справочник
по клинико-биохимической лабораторной диагностике. В 2-х томах. - Минск:
Беларусь, - 2000.
. Маршал В.Дж. Клиническая
биохимия. - М., 1999.
. Николаев А.Я. Биологическая
химия. - М.: Высшая школа, - 1998.
. Гонський Я.І., Максимчук
Т.П., Калинський Н.І. Біохімія людини. - Тернопіль: Укрмедкнига, - 2002.