|
Желто-зеленая окраска
Систематическим называют полный анализ исследуемого объекта,
осуществляемый путем разделения исходной пробы на несколько групп в определенной
последовательности на основе сходства и различий их аналитических свойств.
Методика проведения анализа:
1. Осмотр образца
При осмотре образца (твердый) обратите внимание на окраску образца и его
составляющих. Отсутствие окраски свидетельствует об отсутствии ионов [Hg2]2+,
Cr3+, Fe3+, Cu2+, Co2+, Ni2+.
. Предварительный анализ
Наличие в образце Sn2+ обнаруживают в отдельной порции образца
реакцией с висмутатом натрия - появление черного осадка указывает на наличие
двухвалентного олова.
Наличие в образце Bi3+ обнаруживают в отдельной порции образца
реакцией с станитом натрия - появление черного осадка указывает на наличие
катионов висмута (Bi3+).
Обнаружение ионов NH4+ в отдельной порции образца
реакцией с NaOH при нагревании по выделению газообразного аммиака.
Открытие катионов Fe2+ проводят с помощью качественной реакции
с гексацианоферратом калия (K3[Fe(CN)6] - образование
осадка «турнбулевой сини» свидетельствует о присутствии Fe2+
Открытие катионов Fe3+ проводят с помощью качественной реакции
с гексацианоферритом калия (K4[Fe(CN)6] - образование
осадка «берлинской лазури» свидетельствует о присутствии Fe3+.
Открытие Cr3+ проводят в отдельной порции раствора путем
окисления иона Cr3+ в CrO42- в щелочной среде
при действии пероксида водорода и превращения CrO42- в
надхромовую кислоту H2CrO6.
Открытие Mn2+ проводят в отдельной порции раствора образца,
используя реакцию окисления Mn2+ в MnO4-.
. Отделение катионов II аналитической группы
Анализируемый раствор (0,5-1 мл) помещают в пробирку, добавляют по каплям
6М HCl, через 5-10 минут если выпадает осадок, то его отделяют
центрифугированием. Осадок промывают дистиллированной водой с добавлением
нескольких капель 6М HCl, получают:
|
Осадок 1
|
Раствор 1
|
|
AgCl, PbCl2, Hg2Cl2
|
Катионы I, III, IV, V, VI групп
|
. Открытие ионов Pb2+
К осадку 1 добавляют дистиллированной воды и нагревают до кипения, при
этом PbCl2 растворяется. Затем декантируют порцию горячего раствора
(или отфильтровывают через бумажный фильтр около 0,5 мл) в чистую пробирку и
проводят реакцию золотого дождя.
Осадок 1 отмывают от PbCl2 горячей водой, затем обрабатывают
25%-ным раствором аммиака и хорошо перемешивают смесь; при наличии ионов ртути
осадок моментально чернеет:
|
Осадок 2
|
Раствор 2
|
|
Hg + NH2HgCl2
|
[Ag(NH3)2]+
|
В растворе 2 обнаруживают ионы серебра, подкислив раствор азотной
кислотой и проведя какую-либо характерную реакцию на Ag+. Осадок 2
не анализируется.
. Отделение катионов III аналитической группы
К раствору 1 добавляют при нагревании 1М раствор H2SO4,
охлаждают и центрифугируют, получают:
|
Осадок 3
|
Раствор 3
|
|
CaSO4, SrSO4, BaSO4, может
присутствовать PbSO4, Ca2+
|
Катионы I, IV, V, VI групп, может присутствовать часть
ионов
|
. Превращение сульфатов CaSO4, SrSO4, BaSO4 в
карбонаты CaСO3СO3, BaСO3, при наличии ионов
свинца в образце, предварительно осадок 3 обрабатывают 30%-ным раствором
ацетата натрия или аммония, нагревают до кипения и центрифугируют, раствор не
анализируют; к осадку добавляют насыщенный раствор Na2CO3
и кипятят полученную смесь, затем осадок центрифугируют, промывают дважды
водой. Полученные карбонаты обрабатывают 2М раствором уксусной кислоты -
получают раствор 4.
. Обнаружение и отделение ионов бария
К нескольким каплям раствора 4 добавляют CH3COONa и K2Cr2O7
(раствор должен быть желтым). Образование желтого осадка BaCrO4
указывает на присутствие ионов бария в образце. Если осадок образовался, то ко
всему раствору 4 добавляют CH3COONa до рН = 5-6, затем по каплям -
раствор K2Cr2O7 до тех пор, пока раствор не
окрасится в оранжево-желтый цвет. Осадок отделяют центрифугированием (не
исследуется), получают раствор 5. Ионы Sr2+,Ca2+ и
избыток K2Cr2O7
От избытка K2Cr2O7 освобождают раствор
следующим образом: к раствору добавляют Na2CO3 (тв.) до
рН меньше 10, смесь нагревают почти до кипения и при наличие ионов Sr2+,Ca2+
образуется осадок, который отделяют центрифугированием.
|
Осадок 4
|
Раствор
|
|
CaСO3, SrСO3
|
Раствор не исследуется
|
. Отделение ионов Sr2+ и их обнаружение
Осадок 4 растворяют в нескольких каплях 2М CH3COOН и, если
раствор не совсем прозрачен, осадок (муть) отделяют центрифугированием и
отбрасывают, получают раствор 5. К 2-3 каплям раствора 5 добавляют 3-4 капли
насыщенного раствора (NH4)2SO4 и нагревают до
кипения. Появление осадка (SrSO4) будет свидетельствовать (мути) о
наличии в растворе ионов стронция. Если ионы Sr2+ присутствуют, то
ко всему раствору прибавляют избыток (NH4)2SO4
и несколько капель NH4OH, смесь нагревают, получают:
|
Осадок 5
|
Раствор 6
|
|
SrSO4 (не исследуется)
|
ионы Ca2+
|
9. Обнаружение ионов Ca2+
В растворе 6 ионы Ca2+ обнаруживают по капельной реакции с
родизонатом натрия. На фильтровальную бумагу наносят 1-2 капли раствора 6,
затем наносят на пятно 2-3 капли раствора щелочи и обрабатывают полученную на
бумаге гидроокись кальция свежеприготовленным раствором родизоната натрия (Na2C6O6).
В присутствии ионов кальция в растворе появляется фиолетовое пятно,
которое исчезает при нанесении на него раствора HCl.
. Отделение катионов IV-VI групп
Раствор 3 делят на две части. К одной части раствора добавляют по каплям
концентрированный раствор NH4OH до слабощелочной реакции. Образуется
осадок, который отделяют центрифугированием.
|
Осадок 6
|
Раствор 7
|
|
Гидроксиды, основные соли, карбонаты катионов IV-VI групп
|
Катионы I группы
|
. Обнаружение ионов Na+, K+
Раствор 7 делят на две части. К одной из них добавляют 1М раствор Na2CO3
и кипятят до полного удаления солей аммония.
Осадок отделяют центрифугированием и отбрасывают.
Раствор нейтрализуют до рН = 4-5 2М СН3СООН и обнаруживают
ионы К+ реакцией с Na3[Co(NO2)6]. К
другой части раствора добавляют 1М раствор K2CO3 и
кипятят до полного удаления солей аммония.
Осадок отделяют центрифугированием и отбрасывают.
Раствор нейтрализуют до рН = 7 2М СН3СООН и обнаруживают ионы
Na+ реакцией с KH2SbO4.
. Отделение катионов IV группы от катионов V-VI групп
К осадку 6 добавляют несколько капель 3%-ного раствора пероксида водорода
и обрабатывают 10%-ным раствором NaOH (избыток - до щелочной реакции),
нагревают и тщательно перемешивают. Избыток H2O2
Удаляют кипячением. Полученную смесь центрифугируют.
|
Осадок 7
|
Раствор 8
|
|
Fe(OH)3,H2MnO3,Co(OH)3,Cd(OH)2,
Ni(OH)2, Cu(OH)2, Mg(OH)2, Bi(OH)3,
HgO
|
Катионы I группы AlO2-,
ZnO22-, SnO32-, CrO42-
- ионы
|
13. Отделение ионов Al3+ и Sn(IV) в виде гидроксидов
К раствору 8 добавляют небольшими порциями кристаллический NH4Cl
и упаривают раствор до небольшого объема. Полученную смесь центрифугируют.
|
Осадок 8
|
|
Al(OH)3, Sn(OH)4
|
[Zn(NH3)4]2+, CrO42-
|
. Открытие ионов Al3+ и Sn (IV)
Осадок 8 обрабатывают 2М раствором HCl. Полученный раствор делят на две
части. В каждой порции раствора открывают ионы Al3+ и [SnCl6]2-:
К одной части раствора приливают несколько капель 25%-ного раствора
аммиака (реакцию ведут в аммиачной среде. Мешают проведению реакции ионы Cr3+,
Zn2+, Fe3+, Sn (II) и добавляют 4-5 капель раствора ализарина.
Образование ализаринового лака (розовато-красный осадок) будет наблюдаться в
присутствии ионов Al3+.
В другой части раствора обнаруживают ионы олова. Предварительно
восстанавливают Sn(IV) до Sn(II) металлическим магнием или железом:
[SnCl6]2- + Fe = Sn2+ + 6Cl-
+ Fe2+
Затем в чистую пробирку берут порцию раствора, содержащего Sn2+,
и приливают несколько капель свежеприготовленного висмутата натрия NaBiO2
(реакции проводят в щелочой среде).
. Обнаружение ионов Zn2+
К раствору 9 добавляют несколько капель концентрированного раствора Na2CO3
и нагревают до полного удаления аммиака. Полученную смесь центрифугируют.
Получают раствор(не исследуется) и осадок, в котором открывают ионы цинка, для
этого к осадку добавляют дитизон. Появление красной окраски органического и
водного слоя будет наблюдаться в присутствии ионов цинка.
. Отделение катионов V группы от катионов VI группы
К осадку 7 добавляют при нагревании концентрированный раствор NH4OH.
Полученную смесь центрифугируют.
|
Осадок 9
|
Раствор 10
|
|
Mg(OH)2, Mn(OH)2,
Bi(OH)3, Fe(OH)3, Fe(OH)2
|
Аммиакаты Cd2+, Hg2+, Co2+, Ni2+,
Cu2+
|
17. Отделение и обнаружение ионов Mg2+
К осадку 9 добавляют 2М NH4Cl и 3%-ный раствор Н2О2.
Полученную смесь центрифугируют
|
Осадок 10
|
Раствор 11
|
|
MnО(OH)2, Mn(OH)2, Fe(OH)3,
Bi(OH)3
|
Mg2+
|
В растворе 11 обнаруживают Мg2+ по реакции с 8-оксихинолином.
Образование желто-зеленного осадка свидетельствует о присутствие ионов магния.
. Осадок 10 промывают и обрабатывают2М раствором HNO3 и
концентрированным раствором Н2О2. Появление
фиолетово-розовой окраски свидетельствует, что в растворе присутствует марганец
(MnO4-). Смесь центрифугируют - получают:
|
Осадок 11
|
Раствор 12
|
|
Mn(OH)4
|
Fe(NO3)3, Bi(NO3)3
|
19. Обнаружение висмута Bi3+
К раствору 12 добавляют 2М раствор NH4OH до появления осадка
BiOCl. Осадок отделяют и обрабатывают станнитом натрия (соль олова + раствор
щелочи до растворения). При восстановлении Bi3+ появляется черный
осадок металлического висмута.
. Разрушение аммиакатов VI группы
К раствору 10 добавляют до кислой реакции 1М раствор H2SO4
, затем при нагревании концентрированный раствор Na2S2O3.
Полученную смесь центрифугируют.
|
Осадок 12
|
Раствор 13
|
|
Cu2S, S
|
NiSO4, CdSO4, CoSO4
|
. Отделение и обнаружение Cu2+
Осадок 12 обрабатывают при нагревании 2М раствором азотной кислоты.
Полученную смесь центрифугируют. В растворе обнаруживают медь по реакции с
раствором аммиака.
. Обнаружение Co2+, Ni2+, Cd2+
Раствор 13 делят на три части. В одной из них открывают кобальт реакцией
с роданидом аммония (реакцию ведут при избытке реагента в присутствии амилового
спирта). Во второй - никель реакцией с диметилглиоксимом (реакцию ведут в
аммиачной среде при рН = 6-9) . В третьей - при рН = 0,5 осаждают желтый осадок
CdS сероводородом.
катион
проба сульфат барий
Химический анализ образца
Индивидуальный образец №16
Цель работы: освоить методику проведения качественного химического
анализа смеси катионов I-VI
групп.
Задачи:. Осмотр образца.. Подготовка образца к анализу
методом квартования.. Проведение предварительного анализа образца.. Проведение
систематического анализа образца.. Установление результата и выводы о
проделанной работе.
Осмотр образца.
Образец представляет собой белый порошок, содержащий кристаллы разного
размера и формы, из чего можно сделать вывод, что в смеси отсутствуют цветные
катионы Cr3+, Ni2+, Co2+, Cu2+ и Fe3+. Образец частично растворяется в
воде, образование хлопьевидного осадка не наблюдается, из чего можно сделать
вывод об отсутствии в смеси ионов Sn2+ и Bi3+. При прокаливании образца можно
отчетливо заметить окрашивание пламени в фиолетовый цвет, что свидетельствует о
наличии ионов K+.
Подготовка образка к анализу методом квартования.
Для проведения дальнейшего анализа необходимо приготовить раствор
образца. Для этого высыпаем ровным слоем образец на лист чистой фильтровальной
бумаги и делим на четыре части (квартуем), из них две противоположные удаляем,
а две оставшиеся перемешиваем, затем квартуем еще раз. Отобранную пробу
растворяем в дистиллированной воде.
Предварительный анализ.
. К отдельной порции раствора образца добавляем 1 M раствор соляной кислоты. Выпадение
белого осадка свидетельствует о наличии катионов II аналитической группы. Т.к. для выполнения учебной работы не
использовались ионы ртути и серебра, делаем вывод о наличии в образце катионов Pb2+.
Pb2+ + Cl- → PbCl2↓
. К отдельной порции раствора образца добавляем 1 М раствор серной
кислоты. Выпадение белого осадка свидетельствует о возможном наличии в образце
катионов III аналитической группы. Возможно,
также, что мы наблюдаем осадок PbSO4. Наличие
ионов III аналитической группы следует
подтвердить в систематическом анализе.
Ca2+(Sr2+/Ba2+) + SO42-
→ CaSO4(SrSO4/BaSO4)↓2+
+ SO42- → PbSO4↓
. Растворяем порцию образца в избытке раствора щелочи NaOH. Наблюдается образование осадка
телесного цвета, темнеющего на воздухе. Очевидно, в образце присутствуют ионы Mn2+:
Mn2+ + 2OH- → Mn(OH)2↓
Mn(OH)2 + O2 → MnO(OH)2 → MnO2↓ + H2O
телесный цвет
К щелочному раствору образца приливаем свежеприготовленный раствор
висмутата натрия. Если бы в образце присутствовали соли Sn2+, то мы бы наблюдали выпадение
черного осадка металлического висмута:
5Sn2+ + 2NaBiO3 + 18NaOH → 2Bi↓
+ 5Na2SnO3 + 9H2O + 10Na+5+ +5e →
Bi0 5 2Ox2+ -2e → Sn4+ 2 5Red
Однако выпадение черного осадка не наблюдается. В смеси отсутствуют
катионы Sn2+.
. Вновь растворяем порцию образца в избытке щелочи и добавляем
свежеприготовленный раствор станнита натрия. Если бы в образце присутствовали
соли Bi3+, то мы бы наблюдали выпадение
черного осадка металлического висмута:
2Bi3+ + 3Na2SnO2 + 6NaOH →
2Bi↓ + 3Na2SnO3 + 3H2O + 6Na+3+
+3e → Bi0 3 2Ox2+ -2e → Sn4+ 2
3Red
Однако осадок не наблюдается, следовательно, соли висмута в образце
отсутствуют.
. К порции раствора образца добавляем щелочь и нагреваем раствор
до кипения. Чувствуется характерный запах аммиака, пары окрашивают индикаторную
бумагу в малиновый цвет:
NH4+ + NaOH → NH3↑
+ Na+ + H2O
Проверим реакцию с реактивом Несслера:
NH4+ + 2K2HgI4 + 3NaOH →
[OHg2NH2]I↓ + 4KI + 3NaI + 2H2O + H+
красно-коричневый осадок
Наблюдаем образование осадка красно-коричневого цвета, что подтверждает
наличие в образце ионов аммония.
Fe2+ + K3[Fe(CN)6] →
KFe[Fe(CN)6]↓ + 2K+
Однако образования турнбулевой сини не наблюдается. Делаем вывод об
отсутствии ионов Fe2+.
. Для выявления в смеси ионов трехвалентного железа приливаем к
порции образца раствор желтой кровяной соли, предварительно создав кислую среду
добавлением к образцу соляной кислоты. Если бы в образце наличествовали соли
двухвалентного железа, то мы бы наблюдали образование осадка берлинской лазури:
Fe3+ + K4[Fe(CN)6] →
KFe[Fe(CN)6]↓ + 3K+
Образования берлинской лазури не наблюдается. Делаем вывод об отсутствии
ионов Fe3+.
. Чтобы убедиться в отсутствии ионов Cr3+, к образцу, растворенному в щелочи, добавили пероксид
водорода. Раствор приобрел желтый цвет, что может свидетельствовать об
образовании хромата CrO42-:
Cr3+ + 3H2O2 + NaOH →
HCrO4 + 3H2O + Na+
жёлтый цвет3+ -3e → Cr6+ 31Red- +1e → O2- 1 3Ox
Известно, что в кислой среде хроматы переходят в дихроматы. При
добавлении избытка серной кислоты до кислой реакции среды появления оранжевой
окраски, характерной для дихроматов, не наблюдается.
CrO42- + 2H+ → Cr2O72- + H2O
оранжевый цвет
Следовательно, ионы хрома в образце отсутствуют.
. Открытие Mn2+ проводят, используя реакцию
окисления Mn2+ в MnO4-, имеющего малиновую окраску. Окисление проводим
висмутатом натрия в кислой среде. Сначала готовим раствор висмутата натрия
реакцией соли висмута с пероскидом водорода в щелочной среде:
Bi(NO3)3 + H2O2 +
4NaOH → NaBiO3 + 3NaNO3 + 3H2O3+
-2e → Bi5+ 21Red- +1e → O2- 1 2Ox
Затем приливаем концентрированную азотную кислоту (pH=3) и полученный раствор добавляем к
раствору образца. Должно произойти окисление иона Mn2+ до перманганат-иона:
2Mn2+ + 5NaBiO3 + 14HNO3 →
2NaMnO4 + 4Bi(NO3)3 + Bi3+ + 3Na+
+ 7H2O
малиновый цвет
Mn2+ -5e → Mn7+ 5 2Red
Bi5+ +2e → Bi3+ 2 5Ox
Окрашивания раствора в малиновый цвет не наблюдается. Наличие иона Mn2+ вызывает сомнения, его присутствие
должно быть установлено в систематическом анализе. Результат по
предварительному анализу.
Возможно присутствуют: Pb2+, NH4+,
K+.
Отсутствуют: Cr3+, Ni2+, Co2+, Cu2+, Fe3+, Fe2+.
Необходим повторный анализ: Mn2+, катионы III группы, Sn2+, Bi3+.
Систематический анализ
Для проведения систематического анализа приготовили отдельную порцию
раствора образца, предварительно проведя квартование.
. Отделение катионов II аналитической группы.
В 1 мл раствора образца добавили по каплям концентрированную HCl. Выпал осадок белого цвета,
содержащий катионы II аналитической
группы.
Pb2+ + 2Cl- → PbCl2↓
Осадок отделили центрифугированием.
Осадок 1Раствор 1
PbCl2Катионы I, III, IV, V и VI групп
. Открытие ионов Pb2+
К осадку 1 добавляем дистиллированной воды и нагреваем до кипения, чтобы
осадок растворился. Затем проводим реакцию «золотого дождя». Приливаем к
раствору KJ, после чего выпадает мутный желтый
осадок.
Pb2+ + 2I- → PbI2↓
Затем добавляем немного уксусной кислоты и нагреваем до растворения
осадка. Уксусная кислота необходима для предотвращения гидролиза, который
происходит при смешивании соли свинца с водой:
Pb2+ + H2O → PbOH+ + H+
При быстром охлаждении раствора получаются золотистые блестки иодида
свинца. Следовательно, в образце содержатся катионы Pb2+.
. Отделение катионов III аналитической группы
К раствору 1 добавляем 1М серную кислоту при нагревании, затем охлаждаем.
При наличии катионов III
группы должен выпадать осадок сульфатов:
Ca2+(Sr2+/Ba2+) + SO42-
→ CaSO4(SrSO4/BaSO4)↓
Осадок не выпадает, можно сделать вывод об отсутствии в образце катионов III аналитической группы (Ca2+, Ba2+, Sr2+).
. Отделение катионов IV-VI групп
К раствору 1 (содержит катионы I, IV, V, VI групп)
добавляем по каплям концентрированный раствор аммиака до слабощелочной реакции
(проверяем индикаторной бумагой). Образуются осадки гидроксидов (или основных
солей) катионов IV-VI групп:
Zn2+ + 2NH4OH → Zn(OH)2↓
+ 2NH4+
Mg2+ + 2NH4OH → Mg(OH)2↓
+ 2NH4+2+ + NH4OH + Cl- →
CdOHCl↓ + NH4+
Осадок отделяем центрифугированием. Получаем:
Раствор 2 Осадок 2
Катионы I группы Катионы IV-VI групп
(гидроксиды и основные соли)
Катионы первой группы были обнаружены в предварительном анализе. Наличие
катионов аммония было установлено качественной реакцией с реактивом Несслера.
Катионы натрия, при их наличии, хорошо видно при прокаливании над пламенем
горелки: пламя окрашивается в ярко-желтый цвет. В предварительном анализе
подобного окрашивания не наблюдалось, следовательно ионы натрия в смеси
отсутствуют. Ионы калия окрашивают пламя в фиолетовый цвет, что отчетливо
наблюдалось в предварительном анализе. Чтобы полностью убедиться в их наличии,
проведем качественную реакцию на калий с кобальтинитритом натрия Na3[Co(NO2)6]. При наличии ионов калия должен
образоваться желтый кристаллический осадок:
2K+ + Na+ + [Co(NO2)6]3-
→ K2Na[Co(NO2)6]↓
Для проведения реакции добавляем в раствор 2 уксусную кислоту 1М до
кислой реакции среды, затем приливаем раствор кобальтинитрита натрия.
Наблюдается образование желтого осадка, что свидетельствует о наличии в смеси
ионов калия.
Переходим к анализу осадка 2, содержащего ионы IV-VI групп, а
именно:
IV
группы - Zn2+, Al3+, Sn2+ (Cr3+ отброшен в ходе предварительного анализа и осмотра образца);
V
группы - Mg2+, Mn2+, Bi3+ (Fe2+ и Fe3+ были отброшены в ходе
предварительного анализа);
VI
группы - Cd2+ (Cu2+, Co2+ и Ni2+ были отброшены в ходе осмотра образца).
. Отделение катионов IV группы
К осадку 2 добавляем 3%-ный раствор пероксида водорода в щелочной среде.
Нагреваем до кипячения и наблюдаем бурное выделение газа. Кипятим до тех пор,
пока газ не перестает выделяться, чтобы избавиться от избытка пероксида.
Наблюдаем выпадение темно-коричневого осадка. Т.к. гидроксиды алюминия и цинка
обладают амфотерными свойствами, они вступают реакции со щелочью, образуя
растворимые алюминат и цинкат натрия:
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O
Zn(OH)2 + 2OH- → ZnO22- + 2H2O
Al(OH)3 + NaOH → NaAlO2 + 2H2O(OH)3
+ OH- → AlO2- + 2H2O
Гидроксид олова в окисляется пероксидом водорода, образуя станнат(IV) натрия:
Sn(OH)2 + H2O2 + 2NaOH →
Na2SnO3 + 3H2O2+ -2e → Sn4+
2 1Red- +1e → O2- 1 2Ox(OH)2 + H2O2
+ 2OH- → SnO32- + 3H2O
Нерастворимые осадки гидроксидов катионов V-VI групп отделяем
центрифугированием. Получаем:
Осадок 3 Раствор 3
Mg(OH)2, Mn(OH)2, Bi(OH)3,
Cd(OH)2AlO2-, ZnO22-,
SnO32-
. Отделение ионов Al3+ и Sn(IV) в виде
гидроксидов
К раствору 3 добавляем небольшими порциями кристаллический NH4Cl и упариваем до небольшого объема.
AlO2- + NH4Cl + H2O
→ Al(OH)3↓+ NH3↑ +Cl-33-
+ 2NH4Cl + H2O → Sn(OH)4↓ +
2NH3↑ + 2Cl-22- + 4NH4Cl
→ [Zn(NH3)4]2+ + 2H2O + 4Cl-
При этом образуются осадки гидроксидов алюминия и олова(IV), ионы цинка же остаются в растворе
в виде образовавшегося аммиачного комплекса, хорошо растворимого в воде.
Осадок 4 Раствор 4
Al(OH)3, Sn(OH)4 [Zn(NH3)4]2+
. Открытие ионов Al3+ и Sn4+
Осадок 4 обрабатываем 2М раствором HCl. При этом осадок растворяется:
Al(OH)3 + 3H+ → Al3+ + H2O
Sn(OH)4 + 6HCl → [SnCl6]2-
+ 4H2O + 2H+
Делим раствор на две части, в первой обнаруживаем ионы алюминия.
Приливаем 25%-ный раствор аммиака и добавляем несколько капель ализарина. Если
в растворе присутствуют катионы Al3+, то будет наблюдаться образование
осадка ярко-красного цвета (ализариновый лак):
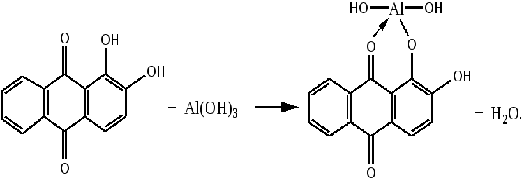
Однако изменения цвета раствора не наблюдалось, что свидетельствует об
отсутствии в смеси ионов алюминия.
Во второй части раствора обнаруживаем ионы олова. Для этого их
предварительно восстанавливаем до Sn2+ металлическим железом.
[SnCl6]2- + Fe0 → Sn2+
+ 6Cl- + Fe2+
Fe0 - 2e → Fe2+ 2 1Red4+
+2e → Sn2+ 2 1Ox
Затем в отдельную пробирку берем порцию раствора с ионами Sn2+ и приливаем несколько капель
свежеприготовленного висмутата натрия. Если катионы олова имеются в растворе,
то произойдет их окисление с восстановлением металлического висмута:
3Sn2+ + 2NaBiO2 + 10NaOH → 2Bi↓
+ 3Na2SnO3 + 5H2O + 6Na+3+ +3e →
Bi0 3 2Ox2+ -2e → Sn4+ 2 3Red
Однако образования черного осадка не наблюдается, что подтверждает
отсутствие ионов олова в смеси.
. Обнаружение ионов Zn2+
К раствору 4 добавляем несколько капель насыщенного раствора карбоната
натрия и нагреваем до полного удаления аммиака.
[Zn(NH3)4]2+ + Na2CO3
+ H2O → 2Na+ + Zn(OH)2↓ + 4NH3↑
+ CO2↑
После центрифугирования получаем белый осадок гидроксида цинка,
полученный раствор не исследуется.
К осадку добавляем дитизон. В присутствии ионов цинка должно наблюдаться
ярко-красное окрашивание раствора:
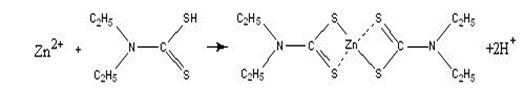
ярко-красный
Однако изменения цвета раствора не произошло, что свидетельствует об
отсутствии ионов цинка в смеси.
. Отделение катионов V группы от катионов VI
группы
К осадку 3, предположительно содержащему гидроксиды Mg2+, Mn2+, Bi3+ и Cd2+, добавляем концентрированный раствор аммиака. При этом
гидроксид кадмия растворяется, переходя в аммиакат:
Cd(OH)2 + 4NH4OH → [Cd(NH3)4]2+
+ 4H2O
Полученный раствор отделяем центрифугированием.
Осадок 5 Раствор 5
Mg(OH)2, Mn(OH)2, Bi(OH)3
[Cd(NH3)4]2+
10. Обнаружение ионов Cd2+
Разрушаем аммиакат реакцией раствора 5 с серной кислотой при нагревании:
[Cd(NH3)4]2+ + SO42-
→ Cd2+ + 4NH3↑ + SO42-
Приливаем еще концентрированного раствора серной кислоты до pH<1, затем добавляем по каплям
раствор Na2S. Наблюдаем осаждение желтый осадка сульфида кадмия:
Cd2+ + S2- → CdS↓
Реакция свидетельствует о наличии в смеси ионов кадмия.
. Отделение и обнаружение ионов Mg2+
К осадку 5 добавляем 2М раствор NH4Cl и пероксид водорода, при этом
гидроксид магния переходит в раствор:
Mg(OH)2 + NH4Cl → Mg2+
+ NH4OH + Cl-
Полученную смесь центрифугируем.
Осадок 6 Раствор 6
Mn(OH)2, Bi(OH)3Mg2+
В растворе 6 обнаруживаем катион магния по реакции с 8-оксихинолином.
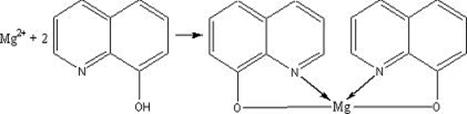
желто-зеленый осадок
Образование желто-зеленого мутного раствора свидетельствует о наличии в
смеси ионов Mg2+.
. Обнаружение ионов Mn2+
Обрабатываем осадок 6 раствором HNO3 с концентрированным раствором пероксида водорода. При этом происходит
окисление иона марганца(II) в
марганец (IV):
Mn(OH)2 + 2H2O2 + 2H+
→ Mn(OH)4↓ + 2H2O
В то время как катионы висмута переходят в раствор:
Bi(OH)3 + 3HNO3 → Bi(NO3)3
+ 3H2O(OH)3 + 3H+ → Bi3+ + 3H2O
Смесь центрифугируем, получаем:
Осадок 7 Раствор 7
Mn(OH)4 Bi(NO3)3
Для обнаружения катионов марганца в осадке 7 используется реакция их
окисления до перманганат-иона, имеющего малиновую окраску. Окисление проводим
свежеприготовленным раствором висмутата натрия с добавлением азотной кислоты:
2Mn2+ + 5NaBiO3 + 14HNO3 →
2NaMnO4 + 4Bi(NO3)3 + Bi3+ + 3Na+
+ 7H2O
малиновый цвет
Mn2+ -5e → Mn7+ 5 2Red
Bi5+ +2e → Bi3+ 2 5Ox
Наблюдается образование бледно-малинового раствора, что свидетельствует о
присутствии в смеси ионов марганца.
. Обнаружение ионов Bi3+
К раствору 7 добавляем свежеприготовленный станнит натрия. При наличии
ионов висмута должен образоваться черный осадок металлического висмута:
2Bi3+ + 3Na2SnO2 + 6NaOH →
2Bi↓ + 3Na2SnO3 + 3H2O + 6Na+3+
+3e → Bi0 3 2Ox2+ -2e → Sn4+ 2
3Red
Однако осадок не наблюдается, следовательно, соли висмута в образце
отсутствуют.
Заключение
В результате проведенной контрольной работы была освоена методика
систематического анализа смеси катионов различных аналитических групп. Был
проведен осмотр образца, после чего были сделаны выводы об отсутствии в нем
солей цветных катионов; был освоен метод квартования в качестве способа
подготовки образца к качественному анализу. Затем был проведен предварительный
анализ образца, в ходе которого были открыты некоторые катионы, определение
которых возможно в присутствии других групп. Так были открыты NH4+ и K+. В ходе систематического анализа
проводилось раздельное определение каждого катиона на основании свойств групп и
индивидуальных качественных реакций. В результате были обнаружены 6 катионов.
Обнаруженные катионы: NH4+, K+, Pb2+, Mn2+, Cd2+, Mg2+.
Похожие работы на - Анализ смеси катионов I-VI аналитических групп
|