Анализ метода плазмохимической конверсии HCl в Cl2
Федеральное
агентство по образованию Российской Федерации
ГОУВПО
"Ивановский
государственный химико-технологическиий университет"
Кафедра
ТП и МЭТ
Квалификационная
работа бакалавра
Анализ
метода плазмохимической конверсии HCl в Cl2
Студент гр. 4/10:
Филимонов В.Г.
Руководитель:
Ефремов А.М.
Иваново
2008
Аннотация
В данной работе рассмотрены основные
лабораторные и промышленные методы получения хлора, определены достоинства и
недостатки отдельных методов. Проведен анализ кинетики плазмохимических
процессов, определены основные механизмы конверсии. Показана возможность
получения хлора методом окислительной деструкции HCl в условиях плазмы.
Подобраны оптимальные параметры проведения процесса.
Объем квалификационной работы бакалавра 44 страницы,
включая 13 рисунков, 5 таблиц и список используемых источников из 9
наименований.
хлор плазма конверсия окислительный
Содержание
Введение
.
Литературный обзор
.1
Применение хлора
.2
Методы получения хлора
.2.1
Лабораторные методы получения хлора
.2.2
Основы электролиза
.2.3
Устройство электролизера
.2.4
Промышленные способы получения хлора
.3
Плазма: основные понятия и свойства. Процессы, протекающие в плазме. Применение
плазмы
Заключение
.
Методическая часть
.1
Инструмент исследований
.2
Объект исследований
.
Обсуждение результатов
.1
Анализ кинетики плазмохимических процессов в чистом HCl
.2
Анализ возможности получения хлора методом окислительной деструкции HCl в
плазме смеси HCl+O2
Основные
выводы по работе
Список
используемой литературы
Введение
В наши дни хлор нашел широкое применение во
многих отраслях хозяйства и промышленности. Он может применяться как в чистом
виде так и в составе более сложных соединений. А так же использоваться на
промежуточных стадиях производства каких-либо соединений. В промышленности
хлор, главным образом, получают электролизом водного раствора NaCl.
Электрохимическое получение хлора является одной из самых больших технологий в
мире, однако она имеет существенных недостатка:
1. В технологии используются вредные и опасные
вещества;
2. Колоссальные затраты электроэнергии.
Этот недостатки делают необходимимым разработку
новой, альтернативной методики получения хлора.
В настоящее время одним из развивающихся
направлений в науке являются плазмохимические технологии, которые имеют ряд
преимуществ перед электрохимическими методами.
Целью настоящей работы являлось исследование
возможности плазмохимической конверсии HCl в Cl2.
1. Литературный обзор
.1 Применение хлора
Хлор представляет собой зеленовато-желтый газ с
резким раздражающим запахом, состоящий из двухатомных молекул.
При обычном давлении он затвердевает при -101°С
и сжижается при -34°С.
Плотность газообразного хлора при нормальных
условиях составляет 3,214 кг/м3, то есть он примерно в 2,5 раза
тяжелее воздуха и вследствие этого скапливается в низких участках местности,
подвалах, колодцах, тоннелях. Газ растворим в воде: в одном объеме воды
растворяется около двух его объемов.
Образующийся желтоватый раствор часто называют
хлорной водой. Химическая активность его очень велика - он образует соединения
почти со всеми химическими элементами.
Поэтому применение его разнообразно.
Хлор применяют во многих отраслях
промышленности, науки и бытовых нужд:
1. В производстве поливинилхлорида,
пластикатов, синтетического каучука, из которых изготавливают: изоляцию для
проводов, оконный профиль, упаковочные материалы, одежду и обувь, линолеум и
грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов,
строительные материалы. Поливинилхлорид производят полимеризацией винилхлорида,
который чаще всего получают, обрабатывая ацетилен хлористым водородом:
HC ≡ CH + HCl → CH2 =
CHCl (1.1.1)
2. Отбеливающие свойства хлора известны с
давних времен, хотя не сам хлор "отбеливает", а атомарный кислород,
который образуется при распаде хлорноватистой кислоты:
+ H2O → HCI + HCIO → 2HCI + O•
(1.1.2)
Этот способ отбеливания тканей, бумаги, картона
используется уже несколько веков.
3. Производство хлорорганических
инсектицидов - веществ, убивающих вредных для посевов насекомых, но безопасные
для растений. На получение средств защиты растений расходуется значительная
часть производимого хлора. Один из самых важных инсектицидов -
гексахлорциклогексан (часто называемый гексахлораном). Это вещество впервые
синтезировано еще в 1825 году Фарадеем, но практическое применение нашло только
через 100 с лишним лет - в 30-х годах нашего столетия.
4. Использовался как оружие массового
поражения и в производстве других отравляющих веществ массового поражения:
иприт, фосген. Иприт был впервые использован как оружие массового поражения в
1915 году немецкими войсками в бельгийском городке Ипр, отсюда и название -
"иприт".
5. Для обеззараживания воды (хлорирования)
применяют хлор, двуокись хлора, хлорамин и хлорную известь. Наиболее
распространённый способ обеззараживания питьевой воды основан на способности
свободного хлора и его соединений угнетать ферментные системы микроорганизмов,
катализирующие окислительно-восстановительные процессы.
. В химическом производстве для производства
соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов,
лекарств, удобрений.
7. В металлургии для производства чистых
металлов: титана, олова, тантала, ниобия.
8. Как индикатор солнечных нейтрино в
хлор-аргонных детекторах [1].
Более наглядно масштабы применения хлора
представлены на рис. 1.1.1:
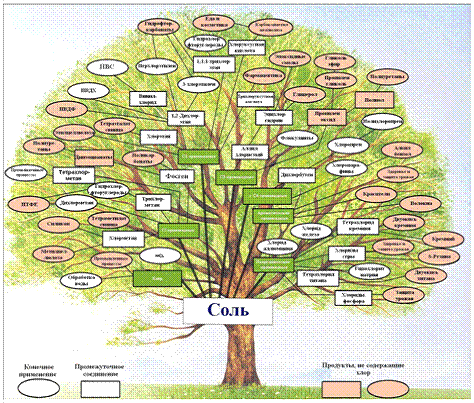
Рис. 1.1.1 Масштабы применения хлора
.2 Методы получения хлора
.2.1 Лабораторные методы получения хлора
В лабораторных условиях хлор получают действием
различных окислителей на соляную кислоту, например:
МnО2 + 4НСl = МnСl2 + Сl2↑ + 2Н2О
(1.2.1.1)
Еще более эффективно окисление проводится такими
окислителями, как РbО2, КМnО4, КСlO3, К2Сr2О7 [2]. Или перманганатом калия на
соляную кислоту [1]:
KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑
+8H2O (1.2.1.2)
Так же хлор можно получить термическим
разложением хлорида меди:
CuCl2 = 2CuCl + Cl2↑ (1.2.1.3)
Однако в промышленных масштабах хлор получают
электрохимическим способом. В результате электролиза раствора соли получают
хлор и каустическую соду. Чаще всего используют хлорид натрия NaCl, однакотакже
можно применять хлорид калия KCl [3].
2NaCl + 2H2O = Cl2 ↑ + 2NaOH
+H2 ↑ (1.2.1.4)
В основе электрохимической технологии лежит
процесс электролиза водного раствора NaCl .
.2.2 Основы электролиза
Электролиз - совокупность электрохимических
окислительно-восстановительных процессов, происходящих при прохождении
электрического тока через электролит с погруженными в него электродами. На
катоде катионы восстанавливаются в ионы более низкой степени окисления или в
атомы, например:
Feі+ + e- = FeІ+ (1.2.2.1)
СuІ+ + 2е-
= Сu
(1.2.2.2)
Нейтральные молекулы могут участвовать в
превращениях на катоде непосредственно или реагировать с продуктами катодного
процесса, которые рассматриваются в этом случае как промежуточные вещества
электролиза. На аноде происходит окисление ионов или молекул, поступающих из
объема электролита или принадлежащих материалу анода; в последнем случае анод
растворяется или окисляется. Например:
OH- + 4e- = 2H2O + O2 (1.2.2.3)+ + 3OH- +H2O =
CrO42- + 5H+ + 3e- (1.2.2.4)
Электролиз включает два процесса: миграцию
реагирующих частиц под действием электрического поля к поверхности электрода и
переход заряда с частицы на электрод или с электрода на частицу. Миграция ионов
определяется их подвижностью и числами переноса. Процесс переноса нескольких
электрических зарядов осуществляется, как правило, в виде последовательности
одноэлектронных реакций, то есть постадийно, с образованием промежуточных
частиц (ионов или радикалов), которые иногда существуют некоторое время на
электроде в адсорбированном состоянии.
Скорости электродных реакций зависят от состава
и концентрации электролита, материала электродов, электродного потенциала,
температуры, гидродинамических условий. Мерой скорости служит плотность тока -
количество переносимых электрических зарядов через единицу площади поверхности
электрода в единицу времени. Количество образующихся при электролизе продуктов
определяется законами Фарадея [4]. Согласно 1-му закону, масса вещества т,
прореагировавшего в процессе электролиза, прямо пропорциональна силе тока I и
времени электролиза t, то есть количеству пропущенного электричества Q = I*t
(предполагается, что I не зависит от t; в противном случае масса т
пропорциональна t1∫t2J*dt, где t1 и t2 - моменты включения и выключения
тока). Согласно 2-му закону, для разных электродных процессов при одинаковом
количестве пропущенного электричества Q массы прореагировавших веществ
относятся друг к другу так же, как эквиваленты химические этих веществ. Оба
закона Фарадея объединяются одним уравнением:
=(1/F)*Q*M/z , (1.2.2.5)
где M - молярная масса вещества, участвующего в
электролизе, z - число элементарных зарядов, соответствующее превращению одной
молекулы этого вещества, 1/F - коэффициент пропорциональности, общий для всех
веществ, F - постоянная Фарадея, равная 96484,56 Кл/моль [5].
Для выделения 1 грамм-эквивалента вещества на
электроде необходимо количество электричества, равное 26,8 А* ч. Если на каждом
из электродов одновременно образуется несколько продуктов в результате ряда
электрохимических реакций, доля тока (в %), идущая на образование продукта
одной из реакций, называется выходом данного продукта по току.
В электродном процессе участвуют вещества,
требующие для переноса заряда наименьшего электрического потенциала. Это могут
быть не те вещества, которые обуславливают перенос электричества в объеме
раствора. Например, при электролизе водного раствора NaCl в миграции участвуют
ионы Na+ и Сl-, однако на твердых катодах ионы Na+ не разряжаются, а протекает
энергетически более выгодный процесс разряда протонированных молекул воды [4]:
Н3О+ + е- = 1/2H2 + Н2О (1.2.2.6)
В промышленности процесс электролиза проводится
в специальных аппаратах - электролизерах.
1.2.3 Устройство электролизера
Конструкция промышленных аппаратов для
проведения электролитических процессов определяется характером процесса. В
гидрометаллургии и гальванотехнике используют преимущественно так называемые
ящичные электролизеры, представляющие собой открытую емкость с электролитом, в
которой размещают чередующиеся катоды и аноды, соединенные соответственно с
отрицательным и положительным полюсами источника постоянного тока. Для
изготовления анодов применяют графит, углеграфитовые материалы, платину, оксиды
железа, свинца, никеля, свинец и его сплавы; используют малоизнашивающиеся
титановые аноды с активным покрытием из смеси оксидов рутения и титана
(оксидные рутениево-титановые аноды), а также из платины и ее сплавов. Для
катодов в большинстве электролизеров применяют сталь, в том числе с различными
защитными покрытиями с учетом агрессивности электролита и продуктов
электролиза, температуры и других условий процесса. Некоторые электролизеры
работают в условиях высоких давлений, например: разложение воды ведется под давлением
до 4 МПа. В современных электролизерах широко применяют пластичные массы,
стекло и стеклопластики, керамику.
Во многих электрохимических производствах
требуется разделение катодного и анодного пространств, которое осуществляют с
помощью диафрагм, проницаемых для ионов, но затрудняющих механическое смешение
и диффузию. При этом достигается разделение жидких и газообразных продуктов,
образующихся на электродах или в объеме раствора, предотвращается участие
исходных, промежуточных и конечных продуктов электролиза в реакциях на
электроде противоположного знака и в приэлектродном пространстве. В пористых
диафрагмах через микропоры переносятся как катионы, так и анионы в количествах,
соответствующих числам переноса. В ионообменных диафрагмах (мембранах) происходит
перенос либо только катионов, либо анионов, в зависимости от природы входящих в
их состав ионогенных групп. При синтезе сильных окислителей используют обычно
бездиафрагменные электролизеры, но в раствор электролита добавляют К2Сr2О7. В
процессе электролиз на катоде образуется пористая хромит-хроматная пленка,
выполняющая функции диафрагмы. При получении хлора используют катод в виде
стальной сетки, на которую наносят слой асбеста, играющий роль диафрагмы. В
процессе электролиза рассол подают в анодную камеру, а из анодной камеры
выводят раствор NaOH.
Электролизер, применяемый для получения магния,
алюминия, щелочных и щелочно-земельных металлов, представляет собой
футерованную огнеупорным материалом ванну, на дне которой находится
расплавленный металл, служащий катодом, аноды же в виде блоков располагают над
слоем жидкого металла. В процессах мембранного получения хлора, в
электросинтезе используют электролизеры фильтр-прессного типа, собранные из
отдельных рам, между которыми помещены ионообменные мембраны.
По характеру подключения к источнику питания
различают монополярные и биполярные электролизеры (рис. 1.2.3.1). Монополярный
электролизер состоит из одной электролитической ячейки с электродами одной
полярности, каждый из которых может состоять из нескольких элементов,
включенных параллельно в цепь тока. Биполярный электролизер имеет большое число
ячеек (до 100-160), включенных последовательно в цепь тока, причем каждый
электрод, за исключением двух крайних, работает одной стороной как катод, а
другой как анод. Монополярные электролизеры обычно рассчитаны на большой ток и
малые напряжения, биполярные - на сравнительно небольшой ток и высокие
напряжения. Современные электролизеры допускают высокую токовую нагрузку:
монополярные до 400-500 кА, биполярные эквивалентную 1600 кА [4].

Рис. 1.2.3.1 Виды электролизеров по характеру
подключения к источнику питания
.2.4 Промышленные способы получения хлора
В настоящее время хлор вырабатывается тремя
электрохимическими методами, два из которых представляют собой электролиз с
твердым катодом: диафрагменный и мембранный методы. Третий метод - электролиз с
жидким ртутным катодом. В ряду электрохимических методов производства самым
легким и удобным способом является электролиз с ртутным катодом, но этот метод
наносит значительный вред окружающей среде в результате испарения и утечек
металлической ртути [1].
Для новых производственных мощностей
предпочитают использовать мембранный процесс, поскольку он более экономичен,
более безопасен для окружающей среды и дает возможность получить конечный
продукт более высокого качества.
В технологии с использованием диафрагменного
электролизера солевой рассол подают в первую камеру (рис. 1.2.4.1), в которой
установлен титановый анод с покрытием из солей рутения и других металлов. У
верхней пластиковой стенки электролизера скапливается тепло и влажный
газообразный хлор, получаемый на аноде.
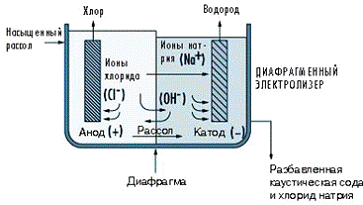
Рис. 1.2.4.1 Схема диафрагменного электролизера
С помощью всасывающего насоса хлор подают в
коллектор для дальнейшей обработки, состоящей из процесса охлаждения, сушки и
сжатия газа. Воду и не вступивший в реакцию рассол отводят через пористый
диафрагменный сепаратор в камеру, где расположен катод и где в результате взаимодействия
воды и стального катода образуется гидрохлорид натрия (каустическая сода) и
водород. Диафрагма разделяет хлор, полученный в анодной камере, и гидрохлорид
натрия, полученный на катоде. Эти два вещества, вступая в соединение, образуют
хлорную известь или хлорат натрия. Чаще всего диафрагму изготавливают из
асбеста и фторполимера. При производстве хлора в диафрагменных электролизерах
слабый раствор гидроокиси натрия содержит не вступившую в реакцию соль.
Следовательно, для получения каустической соды нужной концентрации требуется
дополнительный процесс выпаривания и удаление большей части соли, чтобы
получить каустическую соду стандартного качества.
В мембранном электролизере протекают те же
химические реакции, что и в диафрагменном электролизере. Вместо пористой
диафрагмы используют катионную мембрану (Рис. 1.2.4.2).

Рис. 1.2.4.2 Схема мембранного электролизера
Мембрана препятствует проникновению ионов хлора
в католит, за счет чего непосредственно в электролизере можно получить
каустическую соду почти без соли, концентрацией от 30 до 35%. Поскольку
исчезает необходимость отделять соль, выпаривание обеспечивает получение
50%-ной коммерческой каустической соды значительно проще и при меньших
капиталовложениях и энергозатратах. Поскольку каустическая сода в мембранном
процессе значительно большей концентрации, то в качестве катода используют
дорогостоящий никель.
Ртутный электролизер состоит из двух
электролитических камер (Рис. 1.2.4.3). В первой камере на аноде протекает
следующая реакция:
Cl- = Cl2 + 2e- (1.2.4.1)
В первой камере на катоде протекает следующая
реакция:
+ + Hg + e- = Na*Hg (1.2.4.2)
Рассол затекает по стальному наклонному желобу,
покрытому по бокам резиной. Ртуть, являющаяся катодом, протекает под рассолом.
Титановые аноды с покрытием подвешены в рассоле для получения хлора, который из
электролизной камеры поступает в систему накопления и переработки. Натрий
подвергается электролизу и амальгамируется ртутью в первой электролизной
камере. Амальгама направляется во вторую электрохимическую камеру, называемую
разлагателем амальгамы. Разлагатель амальгамы - это электролизер с графитовым
катодом и амальгамой в качестве анода.
В разлагателе амальгамы происходит следующая
реакция:
2Na*Hg + 2H2O = 2NaOH + 2Hg +H2 ↑
(1.2.4.3)
С помощью ртутного электролизера также получают
каустическую соду с концентрацией до 50% на выходе из второй камеры
электролизера [3].
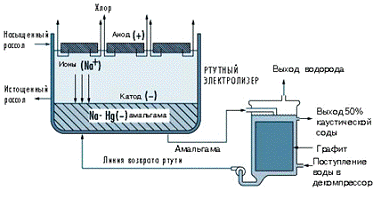
Рис. 1.2.4.3 Схема ртутного электролизера
В 2006, около 84% всего производства хлора около
59 миллионов тонн получали диафрагменным и мембранными методами, и только 13%
при помощи ртутных электролизеров.
Сравнение промышленных методов получения хлора
проведено в таблице 1.2.4.1 [6]:
Таблица 1.2.4.1
Сравнение промышленных способов получения хлора
|
Метод
получения
|
Ртутный
|
Диафрагменный
|
Мембранный
|
|
Рабочая
плотность тока (кА/м2)
|
8
- 13
|
0,9
- 2,6
|
3
- 5
|
|
Напряжение
ячейки (В)
|
3,9-4,2
|
2.9
- 3,5
|
3.0
- 3,6
|
|
Концентрация
NaOH (%)
|
50
|
12
|
33
- 35
|
|
Потребление
энергии (кВт*ч/MT Cl2) при плотности тока (кА/м2)
|
3360
(10)
|
2720
(1,7)
|
2650
(5)
|
|
Потребление
пара (кВт*ч/MT Cl2) при онцентрации NaOH 50%
|
0
|
610
|
180
|
Электрохимическое получение хлора - одна из
самых больших технологий в мире, которая, однако имеет два существенных недостатка:
1) Электрохимическое производство является
вредным и опасным в связи с использованием ртути, выделением водорода в
качестве побочного продукта и др. факторов.
2) Электрохимическое производство хлора
является очень энергетически интенсивным процессом, потребляющим 2400
миллиардов кВт*ч электроэнергии в год. Это более 60% электроэнергии,
потребляемой всей мировой химической промышленностью.
В связи с этим проблема поиска альтернативных
методов получения хлора является очень актуальной.
.3 Плазма: основные понятия и свойства.
Процессы, протекающие в плазме. Применение плазмы
Плазма - состояние вещества, характеризующееся
высокой степенью ионизации и равенством концентраций положительных и
отрицательных зарядов (квазинейтральностъю). Плазма в стационарном состоянии
может существовать только при наличии факторов, восполняющих убыль заряженных
частиц. В газовом разряде плазма в стационарном состоянии поддерживается за
счёт внешнего электрического поля, энергия которого расходуется на ионизацию
газа. Газ в состоянии плазмы находится в следующих видах разряда:
· положительный столб тлеющего и
дугового разряда:
· дуговой разряд низкого давления с
накаленными электродами:
· отдельные области высокочастотного и
сверхвысокочастотного разрядов.
Плазма в общем случае состоит из электронов,
ионов и нейтральных частиц - атомов и молекул (радикалов), находящихся как в
основном, так и в возбужденных состояниях: вращательных, колебательных,
электронных. Концентрация заряженных частиц в плазме достигает 1017 1/см3 и по
своей электропроводности плазма приближается к проводникам. Плазму нельзя
представлять как механическую смесь компонент, так как все частицы плазмы
находятся в непрерывном взаимодействии друг с другом, и плазма в целом обладает
рядом специфических свойств, которые вовсе не присущи отдельным её
составляющим. Различают изотермическую и неизотермическую плазму.
Изотермической плазме отвечает ионизированный
газ при высокой температуре, когда энергии (температуры) всех составляющих
плазму частиц равны (Те =Tt =Tg) и все процессы обмена являются равновесными.
Неизотермическая плазма характеризуется тем, что
средняя энергия (температура) электронов во много раз превышает энергию ионов и
нейтральных частиц (Те"Тi=Tg). Такое состояние реализуется при
относительно небольшом выделении джоулевой теплоты за счет высокой теплоемкости
газа тяжелых частиц и быстрого уноса теплоты из зоны разряда. Существование
неизотермической плазмы поддерживается за счёт внешних факторов, например
электромагнитного поля, при этом процессы обмена энергией являются
неравновесными. Последнее связано с тем, что электроны, как наиболее легкие из
заряженных частиц, преимущественно отбирают энергию внешнего поля, однако в
силу своей малой массы не способны эффективно перераспределять ее при столкновениях
с "тяжелыми" частицами. Наиболее часто применяется в технологии
микроэлектроники один из видов неизотермической плазмы - неравновесная
низкотемпературная газоразрядная плазма (ННГП) пониженного давления.
ННГП представляет собой слабо ионизованный газ
при давлениях 10-1 - 103 Па со степенью ионизации 10-5 - 10-3. Средняя энергия
электронов составляет 1-10 эВ (концентрация электронов 109 - 1012 1/см3),
а средняя энергия тяжелых частиц (атомов, молекул и ионов) ниже в среднем на
два порядка величины. К внешним (задаваемым) параметрам ННГП относятся тип
плазмообразующего газа, его давление и расход газа, ток разряда (в случае ВЧ и
СВЧ разрядов - удельная мощность, вкладываемая в разряд), а также геометрия
плазмохимического реактора и его конструкционные материалы, находящиеся в
контакте с зоной разряда и послесвечения. Количественное описание плазменных
процессов требует знания концентраций частиц всех типов, а также их
энергетических, пространственных и временных распределений. Одним из
определяющих факторов, формирующих стационарное состояние неизотермической
плазмы, является кинетика процессов при электронном ударе, которая, в свою
очередь, определяется функцией распределения электронов по энергиям (ФРЭЭ). К
параметрам, определяющим вид ФРЭЭ. следует отнести приведенную напряженность
электрического поля (E/N или Е/Р, где N - общая концентрация нейтральных частиц
в реакторе. Р - давление газа), транспортные коэффициенты электронов, а также
первичный состав нейтральных частиц. Величина E/N и другие внутренние параметры
устанавливаются на уровне, обеспечивающем баланс скоростей образования и гибели
заряженных частиц. Таким образом, плазма является сложной самоорганизующейся и
самосогласованной системой, в которой внутренние параметры, определяющие кинетику
и механизмы плазменных процессов, сами зависят от скоростей и направлений этих
процессов.
Под действием электронного удара в плазме
протекают различные элементарные процессы взаимодействия электронов с атомами,
молекулами или ионами, в результате которых происходит изменение их
энергетического или химического состояния. Виды этих процессов представлены в
таблице 1.3.1.
В силу того, что энергия электронов существенно
превышает энергию тяжелых частиц, именно эти процессы количественно определяют
скорости диссоциации, ионизации и электронного возбуждения, которые имеют
высокие пороговые энергии. Соударения электронов с молекулами газа делятся на
упругие и неупругие. При упругих соударениях происходит перераспределение
кинетической энергии взаимодействующих частиц без изменения их внутренней
энергии (процесс 1. табл. 1.3.1). Максимальная доля энергии, передаваемой при
упругом соударении, пропорциональна отношению масс сталкивающихся частиц:
=2me/M (1.3.1)
где me - масса электрона, М- масса молекулы
газа.
Данное выражение справедливо, если молекула газа
неподвижна. Если энергией молекул газа пренебречь нельзя по сравнению с
энергией электронов, то выражение для X принимает вид:
=2me/M*(1-Eg/E), (1.3.2)
где E и Eg - энергии электрона и
"тяжелой" частицы, соответственно.
Таблица 1.3.1
Типы элементарных процессов
|
Реакция
|
Схема
реакции
|
|
1.
|
Передача
импульса
|
AB
+ e(p1) → AB + e(p2)
|
|
2.
|
Возбуждение
|
AB
+ e → AB* + e
|
|
3а.
|
Диссоциативное
прилипание
|
AB
+ e → A- + B
|
|
3б.
|
Образование
ионной пары
|
AB
+ e → A- + B+ + e
|
|
4
|
Отлипание
|
A-
+ e → A + 2e
|
|
5
|
Диссоциация
|
AB
+ e → A + B + e
|
|
6
|
Ионизация
|
AB
+ e → AB+ + e
|
|
7
|
Диссоциативная
ионизация
|
AB
+ e → A+ + B + 2e
|
При неупругих столкновениях столкновение
электронов с атомами или молекулами сопровождается изменением внутренней энергии
или химического состояния последних (процессы 2-7. таблица 1.3.1). Неупругие
соударения могут быть первого рода и второго рода. При неупругих соударениях
первого рода происходит передача энергии от электронов к атомам или молекулам
газа. Неупругие соударения второго рода сопровождаются передачей энергии от
возбуждённых атомов или молекул к электронам [7].
Наибольший прогресс в практическом использовании
плазмы низкого давления к настоящему времени достигнут в электронной
промышленности и прежде всего в микроэлектронике. Здесь плазмохимическими
методами решаются задачи нанесения тонких диэлектрических, проводящих и
полупроводниковых слоев, создания поверхностной конфигурации интегральных схем
путем локального плазменного травления указанных поверхностных слоев, а также
очистки поверхностей неорганических материалов от органических веществ, включая
удаление резистивных слоев в литографических операциях. Достаточно широко
известно применение неравновесной плазмы для поверхностной обработки металлов в
машиностроении. В последние 15-20 лет начался интенсивный процесс проникновения
плазменных технологических процессов в технологию легкой и текстильной
промышленности, хотя реальные достижения здесь еще скромны. Основу этого
направления составляет модифицирование поверхностных свойств полимерных
(пленочных или тканых) материалов путем обработки в плазме травящих пли
полимеризующихся газов. Получаемые разнообразные технологические эффекты чаще
всего связаны с приданием поверхностям гидрофильных или гидрофобных свойств.
Однако наблюдаются эффекты, которые не могут быть объяснены лишь этими
причинами и пока до конца не выяснены. Широкое практическое применение
плазмохимических процессов в легкой промышленности тормозится рядом причин,
среди которых нужно отметить отсутствие необходимого оборудования, к тому же
весьма далекого от традиционно используемого, а также недостаточную изученность
устойчивости и потребительской ценности достигаемых эффектов.
Разумеется, три указанных сферы применения
плазмы низкого давления не охватывают всего многообразия ее уже реализуемых
возможностей. Однако физико-химические основы упомянутых в иных плазменных
технологических процессов и способы их технической реализации в достаточной
степени общие [8].
Заключение
Из представленного обзора литературы видно, что
существующая технология промышленного получения хлора имеет серьезные
недостатки, связанные с негативным действием на окружающую среду, опасностью
производства и высокой энергоемкостью. Альтернативой классическим химическим
технологиям могут служить плазмохимические технологии. Особенности
плазмохимических технологий является то, что в них имеет место неравновесная
активация химических реакций (не термически, а электронным ударом), при этом
достигаемые степени превращения веществ также могут существенно превышать
равновесные.
Целью настоящей работы являлось исследование
возможности плазмохимической конверсии HCl в Cl2. Выбор в качестве исходного
реагента HCl обусловлен тем, что хлороводород является побочным продуктом
многих химических производств, который мало востребован в основном
производстве. В результате большая часть хлороводорода утилизируется в
нейтрализаторах на NaOH.
2. Методическая часть
.1 Инструмент исследований
В качестве основного инструмента исследований
было выбрано моделирование плазмы. Для определения взаимосвязей между входными
параметрами процесса и концентрациями частиц использовалась глобальная
(0-мерная) модель, оперирующая величинами, усредненными по объему реактора. В
ходе анализа литературных данных был составлен набор процессов, протекающих в
плазме чистого хлороводорода и в смесях HCl с кислородом. Этот список включает
93 реакции для частиц в основном состоянии и возбужденных атомов кислорода в
состоянии 1d. Список компонентов и список процессов приведены в таблицах 2.1 и
2.2, соответсвенно.
Таблица 2.1
Реагенты и продукты реакции
|
Компоненты
|
|
На
входе в реактор:
|
HCl,
O2
|
|
Зона
плазмы:
|
HCl, O2, O(3p), O(1d), Cl2, Cl,
H2, H, H2O, OH, ClO, ClO2
|
|
На
выходе из реактора:
|
HCl,
O2, Cl2, H2, H2O
|
Таблица 2.2
Набор процессов для моделирования плазмы
|
Номер
реакции
|
Реакция
|
Константа
скорости при T=300 K
|
|
Реакции
электронного удара:
|
|
|
Р1
|
HCl
+ e ® H + Cl +
e
|
Eq.(2)
|
|
Р2
|
O2
+ e ® O(3p) +
O(3p) + e
|
Eq.(2)
|
|
Р3
|
O2
+ e® O(3p) +
O(1d) + e
|
Eq.(2)
|
|
Р4
|
O(3p)
+ e ® O(1d) + e
|
Eq.(2)
|
|
Р5
|
H2
+ e ® H + H + e
|
Eq.(2)
|
|
Р6
|
Cl2
+ e ® Cl + Cl +
e
|
Eq.(2)
|
|
Р7
|
H2O
+ e ® H + OH +
e
|
Eq.(2)
|
|
Р8
|
OH
+ e ® O(3p) + H
+ e
|
Eq.(2)
|
|
Р9
|
ClO
+ e ® Cl +
O(3p) + e
|
Eq.(2)
|
|
Р10
|
ClO2 + e ® ClO +
O(3p) + e
|
Eq.(2)
|
|
Реакции
взаимодействия атомов и радикалов:
|
|
|
Р11
|
HCl
+ Cl ® Cl2 + H
|
3.16´10-20
|
|
Р12
|
HCl
+ H ® Cl + H2
|
6.31´10-14
|
|
Р13
|
HCl
+ O(3p) ® OH + Cl
|
3.16´10-12
|
|
Р14
|
HCl
+ OH ® H2O + Cl
|
1.26´10-11
|
|
Р15
|
H2
+ Cl ® HCl + H
|
3.98´10-14
|
|
Р16
|
H2
+ O(3p) ® OH + H
|
5.01´10-17
|
|
Р17
|
H2
+ O(1d) ® OH+H
|
2.00´10-10
|
|
Р18
|
H2
+ OH ® H2O + H
|
6.31´10-15
|
|
Р19
|
H2O
+ O(3p) ® OH + OH
|
3.98´10-24
|
|
Р20
|
H2O
+ O(1d) ® OH + OH
|
2.00´10-10
|
|
Р21
|
H2O
+ H ® H2 + OH
|
2.51´10-25
|
|
Р22
|
Cl2
+ H ® HCl + Cl
|
6.31´10-12
|
|
Р23
|
Cl2
+ O(3p) ® ClO + Cl
|
7.94´10-14
|
|
Р24
|
Cl2
+O(1d) ® ClO + Cl
|
1.58´10-10
|
|
Р25
|
O2
+ H ® O(3p) +
OH
|
2.51´10-22
|
|
Р26
|
O2
+ O (1d) ® O(3p) +
O2
|
2.51´10-11
|
|
Р27
|
O(3p)
+ O (1d) ® O(3p) +
O(3p)
|
2.51´10-12
|
|
Р28
|
Cl
+ O(1d) ® Cl +
O(3p)
|
2.51´10-12
|
|
Р29
|
OH
+ O(3p) ® H + O2
|
5.01´10-11
|
|
Р30
|
OH
+ H ® O(3p) +
H2
|
5.01´10-18
|
|
Р31
|
OH
+ OH ® H2O +
O(3p)
|
6.31´10-13
|
|
Р32
|
OH
+ Cl ® ClO + H
|
2.00´10-17
|
|
Р33
|
ClO
+ O(3p) ® O2 + Cl
|
3.16´10-12
|
|
Р34
|
ClO
+ O(1d) ® O2+Cl
|
3.18´10-11
|
|
Р35
|
ClO
+ Cl ® Cl2 + O
|
1.26´10-15
|
|
Р36
|
ClO
+ ClO ® Cl2 + O2
|
1.00´10-12
|
|
Р37
|
ClO
+ ClO ® ClO2 + Cl
|
1.58´10-12
|
|
Р38
|
ClO
+ H2 ® HCl + OH
|
5.01´10-16
|
|
Р39
|
ClO
+ H ® HCl +
O(3p)
|
5.11´10-11
|
|
Р40
|
ClO
+ H ® Cl + OH
|
2.00´10-13
|
|
Р41
|
ClO2
+ O(3p) ® ClO + O2
|
1.58´10-12
|
|
Р42
|
ClO2
+ Cl ® ClO + ClO
|
1.58´10-12
|
|
Р43
|
ClO2
+ Cl ® Cl2 + O2
|
1.58´10-11
|
|
Р44
|
ClO2 + ClO2 ® Cl2 + O2
+ O2
|
1.58´10-15
|
|
Реакции
тройного соударения:
|
Cl + Cl + HCl ® Cl2 + HCl
|
5.21´10-32
|
|
Р46
|
Cl
+ Cl + O2 ® Cl2 + O2
|
5.21´10-32
|
|
Р47
|
Cl
+ Cl + H2 ® Cl2 + H2
|
5.21´10-32
|
|
Р48
|
Cl + Cl + H2O ® Cl2 + H2O
|
5.21´10-32
|
|
Р49
|
Cl
+ Cl + Cl2 ® Cl2 + Cl2
|
5.21´10-32
|
|
Р50
|
Cl
+ Cl + Cl ® Cl2 + Cl
|
5.21´10-32
|
|
Р51
|
Cl + Cl + OH ® Cl2 + OH
|
5.21´10-32
|
|
Р52
|
H
+ H + HCl ® H2 + HCl
|
1.00´10-32
|
|
Р53
|
H
+ H + O2 ® H2 + O2
|
1.00´10-32
|
|
Р54
|
H
+ H + H2 ® H2 + H2
|
1.00´10-32
|
|
Р55
|
H
+ H + Cl2 ® H2 + Cl2
|
1.00´10-32
|
|
Р56
|
H
+ H + H2O ® H2 + H2O
|
1.00´10-32
|
|
Р57
|
H
+ H + H ® H2 + H
|
1.00´10-32
|
|
Р58
|
H + Cl + HCl ® HCl + HCl
|
5.13´10-32
|
|
Р59
|
H
+ Cl + O2 ® HCl + O2
|
5.13´10-32
|
|
Р60
|
H
+ Cl + H2 ® HCl + H2
|
5.13´10-32
|
|
Р61
|
H + Cl + H2O ® HCl + H2O
|
5.13´10-32
|
|
Р62
|
H + Cl + Cl2 ® HCl + Cl2
|
5.13´10-32
|
|
Р63
|
H + Cl + Cl® HCl +Cl
|
5.13´10-32
|
|
Р64
|
H
+ Cl + H ® HCl + H
|
5.13´10-32
|
|
Р65
|
H + Cl + OH ® HCl + OH
|
5.13´10-32
|
|
Р66
|
O(3p)
+ O(3p) + O2 ® O2 + O2
|
1.20´10-32
|
|
Р67
|
O(3p) + O(3p) + HCl ® O2 + HCl
|
1.20´10-32
|
|
Р68
|
O(3p)
+ O(3p) + Cl2 ® O2 + Cl2
|
1.20´10-32
|
|
Р69
|
O(3p)
+ O(3p) + H2 ® O2 + H2
|
1.20´10-32
|
|
Р70
|
O(3p) + O(3p) + H2O(3p) ® O2 + H2O
|
1.20´10-32
|
|
Р71
|
O(3p)
+ O(3p) + O(3p) ® O2 +
O(1d)
|
1.20´10-32
|
|
Р72
|
H + OH + HCl ® H2O + HCl
|
1.26´10-31
|
|
Р73
|
H
+ OH + H2 ® H2O + H2
|
1.26´10-31
|
|
Р74
|
H
+ OH + O2 ® H2O + O2
|
1.26´10-31
|
|
Р75
|
H
+ OH + H2O ® H2O + H2O
|
1.26´10-31
|
|
Р76
|
H
+ OH + Cl2 ® H2O + Cl2
|
1.26´10-31
|
|
Р77
|
Cl + O(3p) + HCl ® ClO + HCl
|
1.00´10-32
|
|
Р78
|
Cl
+ O(3p) + O2 ® ClO + O2
|
1.00´10-32
|
|
Р79
|
Cl
+ O(3p) + H2 ® ClO + H2
|
1.00´10-32
|
|
Р80
|
Cl + O(3p) + H2O ® ClO + H2O
|
1.00´10-32
|
|
Гетерогенные
реакции:
|
|
|
Р81
|
Cl
® Cl(s)
|
1.00´10-2
|
|
Р82
|
H
® H(s)
|
2.00´10-2
|
|
Р83
|
O(3p)
® O(s)
|
1.00´10-2
|
|
Р84
|
O(1d)
® O(3p)
|
1
|
|
Р85
|
Cl
+ Cl(s) ® Cl2
|
1.00´10-7
|
|
Р86
|
H
+ Cl(s) ® HCl
|
1.00´10-7
|
|
Р87
|
O(3p)
+ Cl(s) ® ClO
|
1.00´10-7
|
|
Р88
|
Cl
+ H(s) ® HCl
|
1.00´10-7
|
|
Р89
|
H
+ H(s) ® H2
|
1.00´10-7
|
|
Р90
|
O(3p)
+ H(s) ® OH
|
1.00´10-7
|
|
Р91
|
Cl
+ O(s) ® ClO
|
1.00´10-7
|
|
Р92
|
H
+ O(s) ® OH
|
1.00´10-7
|
|
Р93
|
O(3p)
+ O(s) ® O2
|
1.00´10-7
|
Для реакций из таблицы 2.2 кинетические
уравнения были сформированы как:
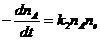
+ B ® продукты реакции
(11 - 30, 32 - 35, 38 - 43, 85 - 93)
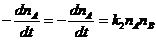
+ A ® продукты реакции
(31, 36, 37, 44)
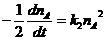
+ A + A ® продукты реакции
(50, 57, 71)
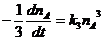
A + A + B ® продукты реакции
(45 - 49, 51 - 56, 63, 64, 66 - 70)

+ B + C ® продукты реакции
(58 - 62, 65, 72 - 76, 77 - 80)
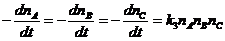
® продукты реакции (81 - 84)
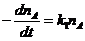
Для решения дифференциальных кинетических
уравнений был использован метод Гира. Расчеты проводились с использованием
готового программного обеспечения.
Константы скорости для реакций электронного
удара 1-10, представленных в таблице 2.2 были рассчитаны по уравнению:
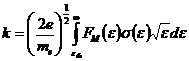 (2.1)
(2.1)
в использованием максвэлловского приближения для
функции распределения электронов по энергиям. Необходимые для расчета сечения
процессов брали из справочной литературы. Температура электронов задавалась
парамеррически как 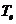 = 1.5-2.0 эВ, что
является типичными значениями для стационарных разрядов, возбуждаемых при
атмосферном давлении. Константы скоростей реакций 11-80 были взяты из
справочника [9, 10]. Константы скорости гетерогенной рекомбинации оценивались
предположении о первом кинетическом порядке рекомбинации (механизм Или-Ридила)
по формуле
= 1.5-2.0 эВ, что
является типичными значениями для стационарных разрядов, возбуждаемых при
атмосферном давлении. Константы скоростей реакций 11-80 были взяты из
справочника [9, 10]. Константы скорости гетерогенной рекомбинации оценивались
предположении о первом кинетическом порядке рекомбинации (механизм Или-Ридила)
по формуле
 (2.2)
(2.2)
где 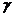 -
вероятность рекомбинации,
-
вероятность рекомбинации, 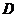 - коэффициент
диффузии частиц и
- коэффициент
диффузии частиц и 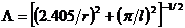 - эффективная
длина диффузии, определяемая геометрическими параметрами реактора (
- эффективная
длина диффузии, определяемая геометрическими параметрами реактора (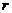 ,
,
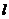 ).
).
.2 Объект исследований
Объектом исследований служил идеализированный
плазмохимический реактор, состоящий из трех резко разграниченных зон (рис.
2.1).

Рис. 2.1. Схема реактора
Исходные реагенты подаются в зону 1, где
происходит их смешение. Далее смесь поступает в зону 2, где подвергается
воздействию плазмы. Под действием электронных ударов идет образование атомов и
радикалов, которые участвуют в различных химических реакциях. Затем газ,
содержащий как стабильные, так и нестабильные частицы, поступает в зону 3, где
происходит рекомбинация атомов и радикалов до стабильных продуктов. При этом
принимались следующие допущения:
1) Профили концентрации и температуры
электронов в зоне плазмы являются изотропными;
2) Инициирование химических реакций
электронным ударом в зонах 1 и 3 отсутствует;
) Транспорт газа не оказывает влияния на
кинетику химических реакций в зоне 2 (малая скорость потока, обеспечивающая tпр
> 1 сек)
В таблице 2.3 приведены внешние параметры
процесса, использованные в расчетах.
Таблица 2.3.
Параметры процесса
|
Входные
параметры
|
|
Температура
газа:
|
300
K
|
|
Температура
(средняя энергия) электронов:
|
2
эВ
|
|
Давление:
|
1.33´105 Па
|
|
Время
пребывания газа в зоне 2:
|
1-3
sec
|
|
Концентрация
электронов в плазме:
|
задавалась
параметрически в диапазоне 106 - 1016 см-3
|
3. Обсуждение результатов
.1 Анализ кинетики плазмохимических процессов в
чистом HCl
При анализе кинетики плазмохимических процессов
в чистом хлороводороде кинетическая схема включала в себя 26 реакций, а именно
Р1,5,6,11,12,15,22,45,47,49,50,52,54,55,57,58,60,62-64,81,82,85,86,88,89 из
таблицы 2.2.
Расчеты показали, что степень превращения (соотношение
между концентрациями компонентов в зонах 1 и 3) заметно зависит от концентрации
электронов. При малых концентрациях электронов (~107 см-3 , см. рис. 3.1.1)
стационарные концентрации продуктов конверсии Cl, H, Cl2 и H2 на несколько
порядков величины ниже концентрации молекул хлороводорода. Очевидно, что это
связано с низкой скоростью диссоциации HCl электронным ударом. Так как в зоне
плазмы имеет место выполнение неравенства [H], [Cl] << [H2], [Cl2], при
переходе в зону 3 полная рекомбинация атомов практически не увеличивает
концентрацию молекул. При этом концентрация целевого продукта - молекул Cl2 - в
430 раз ниже концентрации HCl, что говорит о пренебрежимо малых степенях
превращения. Увеличение концентрации электронов (до ~1016 см-3 , см. рис.
3.1.2) улучшает ситуацию, но не изменяет ее принципиально. Очевидно, что рост
концентрации электронов приводит как к росту скорости диссоциации хлороводорода
по реакции Р1, так и увеличивает скорости разложения молекулярных продуктов
реакции. Поэтому, хотя в зоне плазмы концентрации атомов хлора и водорода имеют
один порядок величины с концентрацией HCl, количество H2 и Cl2 в тех же
условиях значительно ниже. При переходе в зону 3 концентрации молекулярных
компонентов несколько возрастают из-за рекомбинации атомов, однако стационарная
концентрация Сl2 все равно остается ниже концентрации HCl в 5 раз. Формально
это соответствует степени превращения 28%, однако встает вопрос о методе
возбуждения плазмы для достижения такой концентрации электронов. По нашему мнению,
даже если такой метод может быть найден и реализован, его суммарная стоимость
будет соизмерима с затратами на электролиз.
Рассмотрим подробнее кинетику плазмохимических
процессов в хлороводороде при концентрации электронов ~1011 см-3, которая легко
достигается в условиях тлеющего или дугового разряда атмосферного давления.
Зона 2. Как видно из рис. 3.1.3, атомы Cl и H
образуются с одинаковой скоростью и имеют приблизительно равные концентрации
вплоть до времени протекания процесса 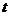 ~
10-9 сек. Наличие одинакового количества атомов H и Cl объясняется реакцией
взаимодействия HCl c электронами (Р1), а близкими скоростями их гибели в
реакциях Р45, Р52 и Р58. Затем концентрация атомов Cl начинает интенсивно
увеличиваться по отношению к H, и в результате разница между стационарными
концентрациями H и Cl составит примерно 2 порядка величины. Это связано с
эффективным протеканием реакции Р12, которая расходует атомы H и одновременно
генерирует атомы хлора. Немонотонное поведение концентрации H связано с
конкурирующим действием реакций 1 и 12.
~
10-9 сек. Наличие одинакового количества атомов H и Cl объясняется реакцией
взаимодействия HCl c электронами (Р1), а близкими скоростями их гибели в
реакциях Р45, Р52 и Р58. Затем концентрация атомов Cl начинает интенсивно
увеличиваться по отношению к H, и в результате разница между стационарными
концентрациями H и Cl составит примерно 2 порядка величины. Это связано с
эффективным протеканием реакции Р12, которая расходует атомы H и одновременно
генерирует атомы хлора. Немонотонное поведение концентрации H связано с
конкурирующим действием реакций 1 и 12.
Хотя молекулы H2 и Cl2 образуются по одним и тем
же реакциям, таким как Р45 и Р52, концентрация H2 увеличивается быстрее вплоть
до 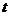 =
10-4 - 10-3 сек. Дело в том, что молекулы Cl2 эффективно распадаются в Р22, в
том время как по Р12 идет образование молекул H2. Однако при наступлении
стационарного состояния процесса концентрации обоих компонентов выравниваются.
Это результат уменьшения скоростей реакций Р12 и Р22 из-за уменьшения
концентрации атомов H. Исходный реагент НCl незначительно расходуется в Р12, а
его стационарная концентрация определяется балансом между Р1 и Р58. При данном
значении
=
10-4 - 10-3 сек. Дело в том, что молекулы Cl2 эффективно распадаются в Р22, в
том время как по Р12 идет образование молекул H2. Однако при наступлении
стационарного состояния процесса концентрации обоих компонентов выравниваются.
Это результат уменьшения скоростей реакций Р12 и Р22 из-за уменьшения
концентрации атомов H. Исходный реагент НCl незначительно расходуется в Р12, а
его стационарная концентрация определяется балансом между Р1 и Р58. При данном
значении 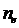 ,
максимальная концентрация Cl2 достигается после (6 - 8)Ч10-3 с. Тем не менее
HCl остается в качестве основного газообразного компонента, и степень конверсии
HCl в Cl2, при условии, что HCl чистый, ничтожно мала.
,
максимальная концентрация Cl2 достигается после (6 - 8)Ч10-3 с. Тем не менее
HCl остается в качестве основного газообразного компонента, и степень конверсии
HCl в Cl2, при условии, что HCl чистый, ничтожно мала.
Зона 3. Хотя стационарная концентрация
атомарного Cl выше чем Cl2, рекомбинация атомов в зоне 3 не обеспечивает
увеличения концентрации Cl2. Напротив, концентрация Cl2 слабо уменьшается
поскольку эффект Р45 компенсируется реакцией Р22. Кроме того, процесс
рекомбинации Cl протекает не только по Р45, но и по реакции Р58, которая не
приводит к образованию Cl2. Реакция Р22 обеспечивает быструю гибель атомов H, в
то время как высокое время жизни атомов Cl обусловлено их регенерацией по
реакции Р12 (реакция Р11 практически не работает из-за высокой пороговой
энергии и низкой константы скорости реакции).
Изложенные выше результаты могут быть обобщены в
виде следующих положений:
1. Плазма в чистом хлороводороде не
обеспечивает степеней конверсии выше 4% при типичных условиях, реализуемых в
тлеющем разряде постоянного тока или высокочастотном разряде атмосферного
давления.
2. Для повышения степени конверсии
необходимо привлекать дополнительные механизмы диссоциации HCl не связанные с
электронным ударом. Это позволило бы поддерживать относительно низкие
концентрации электронов при высоких скоростях диссоциации HCl, предотвращая тем
самым деструкцию целевого продукта - молекулярного хлора - по реакции Р6.
Как показывают литературные данные, одним из
таких механизмов может являться окислительная деструкция HCl в плазме смеси
хлороводорода с кислородом. Действительно, из табл.2.2 можно видеть, что
константа скорости взаимодействия HCl с атомами кислорода (Р13) на два порядка
величины выше константы скорости аналогичного процесса с участием молекул хлора
(Р23). Более того, продуктом Р13 является радикал ОН, который сам является
сильным окислителем и также взаимодействует с HCl по реакции Р14. Таким
образом, можно ожидать, что в такой системе будет происходить преимущественное
разложение HCl с накоплением молекулярного хлора.
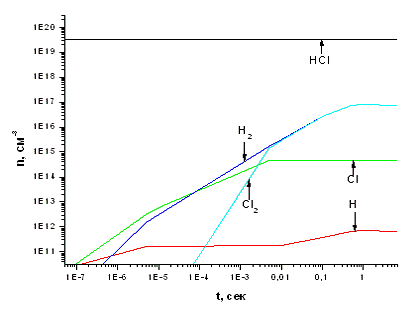
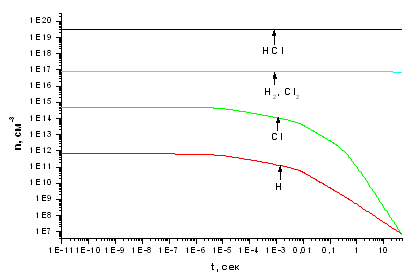
Рис. 3.1.1 Зависимость концентраций компонентов,
участвующих в процессе, от времени при концентрации электронов 1*107 см -3

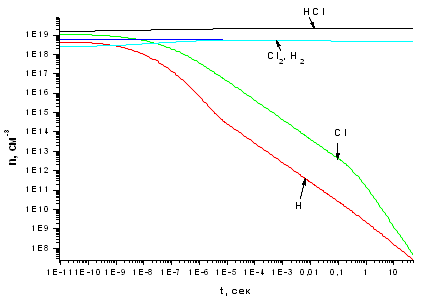
Рис. 3.1.2 Зависимость концентраций компонентов,
участвующих в процессе, от времени при концентрации электронов 1*1016 см -3
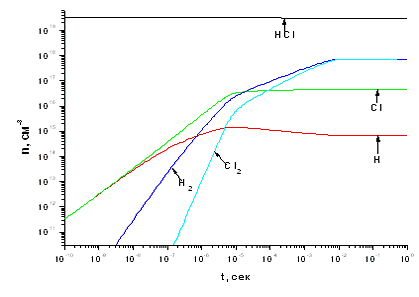
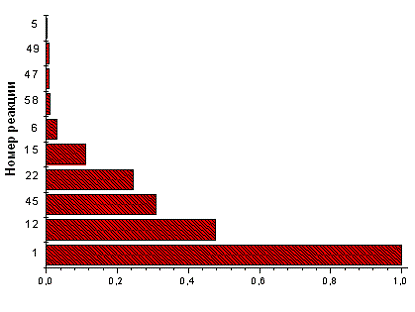
Рис. 3.1.3 Зависимость концентраций компонентов,
участвующих в процессе, от времени и расположение реакций, протекающих в
реакторе, по степени важности при концентрации электронов 1*1011 см -3

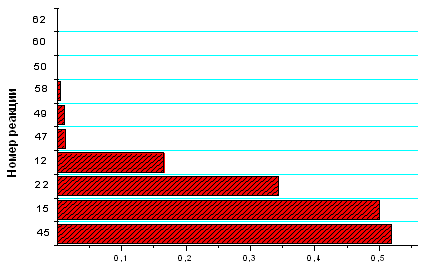
Рис. 3.1.4 Зависимость концентраций компонентов,
участвующих в процессе, от времени и расположение реакций, протекающих на
выходе из реактора, по степени важности при концентрации электронов 1´1011
см -3
.2 Анализ возможности получения хлора методом
окислительной деструкции HCl в плазме смеси HCl+O2
Для определения оптимальных параметров
проведения процесса было проведено исследование зависимости степени превращения
от начального состава смеси HCl+O2 и концентрации электронов. Соответствующие
данные представлены на рис. 3.2.1. Для характеристики степени превращения
использовалось отношение концентраций хлороводорода к хлору, наблюдаемых в зоне
3. Очевидно, что оптимизация процесса направлена на минимизацию этого параметра.
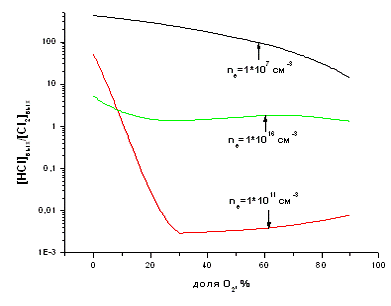
Рис. 3.2.1 График зависимости отношения HCl к
Cl2 на выходе из реактора от доли кислорода в смеси
Низкая степень конверсии при концентрации
электронов 107 см-3 объясняется низкими скоростями инициирования химических
процессов, и, в первую очередь, низкими скоростями Р1, Р2 и Р3. При ne = 1016
см-3 достигаются значительно более высокие степени превращения, однако
лимитирующим фактором служит высокая скорость диссоциации целевого продукта при
электронном ударе. Наиболее оптимальный вариант имеет место при ne = 1011 см-3,
когда в зоне 3 концентрация целевого продукта примерно в 100 раз превышает
концентрацию HCl. Для этих условий зависимость степени превращения от доли
кислорода в смеси имеет явно выраженный максимум в области 30% О2.
Рассмотрим подробнее кинетику процесса при
концентрации электронов 1011 см-3 и соотношении концентраций исходных
компонентов смеси HCl - 70%, O2 - 30%.
1. Как видно из рис. 3.2.1, вплоть до 10-6
- 10-5 сек, кинетика образования Cl2 не проявляет существенных отличий по
сравнению с плазмохимической обработкой чистого HCl. Это связано с тем, что
количество частиц O и OH недостаточно велико и поэтому можно пренебречь
процессами с их участием, в том числе Р13 и Р14. При больших временах воздействия
плазмы на газовую смесь, когда концентрация O и ОH достигает 1011 - 1012 см-3,
влияние реакций Р13 и Р14 ускоряет разрушение молекул HCl и образование атомов
Cl. Одновременно по Р14 идет образование H2O из радикалов OH, являющихся
продуктом Р13. Так же частицы OH задействованы в Р31, Р72-76. Поэтому при
достижении времени возбуждения 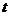 > 10-6 - 10-5
сек идет интенсивное накопление Cl, Cl2 и H2O. Это и является основным отличием
разрядов в чистом хлороводороде и в смеси HCl/O2.
> 10-6 - 10-5
сек идет интенсивное накопление Cl, Cl2 и H2O. Это и является основным отличием
разрядов в чистом хлороводороде и в смеси HCl/O2.
2. Из-за влияния реакций Р13 и Р14
концентрация HCl достигает более низких величин, чем в случае с обработкой
чистого HCl, и это обеспечивает более высокую степень превращеня HCl в Cl2.
Максимальная степень конверсии, характеризуемая максимальными значениями
отношения концентраций HCl/Cl2 и HCl/H2O достигается при 30-60% кислорода в
смеси. Во всем этом диапазоне кинетика процесса показывает одни и те же
закономерности, как это было рассмотрено выше на примере смеси 70% HCl + 30%
O2. Смесь 70% HCl + 30% O2 также является предпочтительной по соображениям
экономии кислорода и наблюдения близких к максимальным степеней конверсии.
Когда доля кислорода в смеси становится ниже 20 - 30% степень конверсии
ограничивается быстрым расходованием образующегося атомарного кислорода
(фактически, низкой скоростью образования атомарного кислорода при диссоциации
О2 электронным ударом) и снижением скоростей процессов R13 и R14. В случае если
доля кислорода в смеси превышает 60 - 70%, степень конверсии снижется по сравнению
с максимальным значением из-за разлодения молекул хлора по реакциям R23 и R24
. Присутствие кислорода и
кислород-содержащих соединений не оказывает существенного влияния на кинетику
продуктов конверсии в зоне 3. Фактически, аналогично предыдущему случаю,
максимальные стационарные концентрации Cl2 и H2O формируются в зоне 2 и не
изменяются за счет рекомбинации атомов в зоне 3. Высокое время жизни в зоне 3
для Cl и ClO, а также быстрое разрушение атомов O обусловлено влиянием Р23.

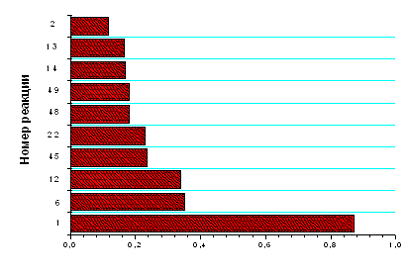
Рис. 3.2.2 Зависимость концентраций компонентов,
участвующих в процессе, от времени при концентрации электронов 1*1011 см -3 и
степень важности реакций, соотношение HCl:Cl2=70:30
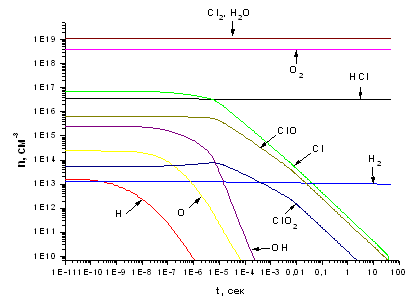

Рис. 3.2.2 Зависимость концентраций компонентов,
участвующих в процессе, от времени и расположение реакций, протекающих на
выходе из реактора, по степени важности при концентрации электронов 1*1011 см
-3
Основные выводы по работе
1. Проведен анализ литературы по промышленным
методам получения хлора. Определены достоинства и недостатки отдельных методов.
2. Показана принципиальная возможность
получения хлора методом окислительной деструкции HCl в условиях плазмы.
. Проведен анализ кинетики
плазмохимических процессов, определены основные механизмы конверсии.
Список используемой литературы
1. http://ru.wikipedia.org/wiki/Хлор
2. http://chemi.org.ru/html/index109.php
. http://base.safework.ru/iloenc?print&nd=857200174&spack=110LogLength26
. http://www.chemport.ru/chemical_encyclopedia_article_4474.html
. http://www.chemport.ru/chemical_encyclopedia_article_3967.html
. http://electrochem.cwru.edu/ed/encycl/art-b01-brine.htm
. Ефремов
А.М., Светцов В.И., Рыбкин В.В. Вакуумно-плазменные процессы и технологии:
учебное пособие / Иваново: ИГХТУ,2006.- 260 с.
. Низкотемпературная
плазма, Т. 4 (отв. Редакторы д.х.н. профессор В.Д. Пахроменко, академик Ю.Д.
Третьяков) / плазмохимическая технология, Новосибирск: Наука. Сиб. Отделение,
1991. - 392 с.
. Кондратьев
В.Н. Константы скоростей газофазных реакций (Справочник). М: Наука, 1971. 351
с.
10. Lide
D.R. Handbook of Chemistry and Physics. CRC Press, New York, 1998-1999. 940 p.
11. Денисов
Е.Т. Кинетика гомогенных химических реакций. М.: Высшая школа, 1988, 392 с