Новые кандидаты в лекарства и новые терапевтические цели в лечении туберкулёза
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ХИМИЧЕСКИЙ ФАКУЛЬТЕТ
Кафедра радиационной химии и химико-фармацевтических технологий
КУРСОВАЯ РАБОТА
Новые кандидаты в лекарства и новые
терапевтические цели в лечении туберкулёза
Исполнитель:
студент 3 курса 7 группы
Рылко Р.В.
Руководитель:
Сорокин В.Л.
Минск 2014
Оглавление
туберкулёз инфекция лечение терапевтический
Введение
Глава
1. Общие сведения о заболевании и о методах борьбы с ним
Глава
2. Новые терапевтические цели в лечении туберкулёза и новые кандидаты на роль
противотуберкулёзных агентов
Заключение
Список
литературы
Введение
Туберкулёз
- это широко
распространённое в мире инфекционное заболевание. Возбудителем туберкулеза
человека является представитель обширной группы микобактерий Mycobacterium
tuberculosis (МТБ).
Достаточно, чтобы инфицированный закашлял, чихнул или просто заговорил -
и возбудитель может передаться окружающим.
В статистике причин смерти туберкулез занимает первое место среди всех
инфекционных заболеваний, причем лидирует с внушительным отрывом. Из года в год
Всемирная организация здравоохранения регистрирует почти 10 миллионов новых
случаев заболевания, ежегодно от этой болезни умирают 1,7 миллиона человек, большинство из которых можно было бы
спасти. Проблема заключается в том, что многие больные не имеют доступа к
медицинской помощи, а те кто лечится часто не выдерживают долговременного
приёма лекарственных средств.
Туберкулез (ТБ) является второй по значимости причиной
смерти от какого-либо одного инфекционного агента, уступая лишь ВИЧ/СПИДу. В
2013 году 9 миллионов человек заболели туберкулезом и 1,5 миллиона человек
умерли от этой болезни. Более 95% случаев смерти от туберкулеза происходит в
странах с низким и средним уровнем дохода, и эта болезнь является одной из трех
основных причин смерти женщин в возрасте от 15 до 44 лет.
Кроме того, туберкулез эволюционирует быстрее, чем фармокология. В
последние годы замечено увеличение числа случаев резистентности возбудителя к
нескольким наиболее эффективным лекарственным средствам. Что еще более тревожно
- появляются штаммы, невосприимчивые ни к каким известным антибиотикам.
Несмотря на такую мрачную картину, у нас есть основания надеяться на
лучшее. Новейшие биомолекулярные технологии позволяют детально исследовать
сложные взаимоотношения между возбудителями заболевания и организмом человека,
чему способствуют успехи в изучении генетики бактерий, что в свою очередь
является точкой опоры в разработке новых технологических тестов.
Всё более широкое распространение заболевания, появление штаммов,
резистентных к существующим противотуберкулёзным препаратам, - всё это
заставляет ученых использовать новейшие стратегии поиска более эффективных
лекарственных средств, а также вести разработку новых методов лечения и
диагностики.
Глава 1.
Общие сведения о заболевании и о методах борьбы с ним
Туберкулёз - широко распространённое в мире
инфекционное заболевание
<https://ru.wikipedia.org/wiki/%D0%98%D0%BD%D1%84%D0%B5%D0%BA%D1%86%D0%B8%D0%BE%D0%BD%D0%BD%D1%8B%D0%B5_%D0%B7%D0%B0%D0%B1%D0%BE%D0%BB%D0%B5%D0%B2%D0%B0%D0%BD%D0%B8%D1%8F>
человека и животных, вызываемое различными видами микобактерий
<https://ru.wikipedia.org/wiki/%D0%9C%D0%B8%D0%BA%D0%BE%D0%B1%D0%B0%D0%BA%D1%82%D0%B5%D1%80%D0%B8%D0%B8>
из группы Mycobacterium tuberculosis complex
<https://ru.wikipedia.org/wiki/Mycobacterium_tuberculosis> (M.
tuberculosis и другими близкородственными видами). Туберкулёз обычно поражает
лёгкие <https://ru.wikipedia.org/wiki/%D0%A2%D1%83%D0%B1%D0%B5%D1%80%D0%BA%D1%83%D0%BB%D1%91%D0%B7_%D0%BB%D1%91%D0%B3%D0%BA%D0%B8%D1%85>,
реже затрагивая другие органы и системы. Mycobacterium tuberculosis
<https://ru.wikipedia.org/wiki/Mycobacterium_tuberculosis> передаётся
воздушно-капельным путём при разговоре, кашле и чихании больного. Чаще всего
после инфицирования микобактериями заболевание протекает в бессимптомной,
скрытой форме (тубинфицированность), но примерно один из десяти случаев скрытой
инфекции в конце концов переходит в активную форму.
Классические симптомы туберкулёза лёгких - длительный кашель
<https://ru.wikipedia.org/wiki/%D0%9A%D0%B0%D1%88%D0%B5%D0%BB%D1%8C> с
мокротой
<https://ru.wikipedia.org/wiki/%D0%9C%D0%BE%D0%BA%D1%80%D0%BE%D1%82%D0%B0>,
иногда с кровохарканьем <https://ru.wikipedia.org/wiki/%D0%9A%D1%80%D0%BE%D0%B2%D0%BE%D1%85%D0%B0%D1%80%D0%BA%D0%B0%D0%BD%D1%8C%D0%B5>,
появляющимся на более поздних стадиях, лихорадка
<https://ru.wikipedia.org/wiki/%D0%9B%D0%B8%D1%85%D0%BE%D1%80%D0%B0%D0%B4%D0%BA%D0%B0>,
слабость, ночная потливость и значительное похудение.
Различают открытую и закрытую формы туберкулёза. При открытой форме в
мокроте или в других естественных выделениях больного - моче, свищевом
отделяемом, кале (как правило при туберкулёзе пищеварительного тракта, редко
при туберкулёзе лёгочной ткани) обнаруживаются микобактерии туберкулёза.
Открытой формой считаются также те виды туберкулеза органов дыхания, при
которых, даже в отсутствие бактериовыделения, имеются явные признаки сообщения
очага поражения с внешней средой: каверна (распад) в лёгком, туберкулёз бронха
(особенно язвенная форма), бронхиальный или торакальный свищ
<https://ru.wikipedia.org/wiki/%D0%A1%D0%B2%D0%B8%D1%89>, туберкулёз
верхних дыхательных путей. Если больной не соблюдает гигиенических мер
предосторожности, он может стать заразным для окружающих. При «закрытой» форме
туберкулёза микобактерии в мокроте доступными методами не обнаруживаются,
больные такой формой эпидемиологически не опасны или малоопасны для окружающих.
Бактерии обычно скапливаются в альвеолах легких, поскольку предпочитают
богатую кислородом среду. В большинстве случаев иммунная система держит
размножение попавших в организм бактерий под контролем, направляя к месту их
расположения защитные клетки - макрофаги. Последние заключают туберкулезные
палочки в оболочку и тем самым обезвреживают их. Но у 10% инфицированных
бактерии прорывают оболочку, выходят наружу и начинают размножаться.
Неподконтрольные иммунной системе, частицы бактерии разрушают ткань легких, что
способствует появлению таких симптомов как неудержимый кашель, боль в груди,
кровохарканье. Некоторые из них попадают в кровоток и поражают другие части
тела - головной мозг, почки, кости скелета. Так же инфекция может
распространяться и на другие органы. У детей возбудитель часто проникает в позвоночник,
вызывая при этом лихорадку и кому - состояние, известное как туберкулезный
менингит. При отсутствии лечения больные погибают, в основном вследствие
разрушения легочной ткани.
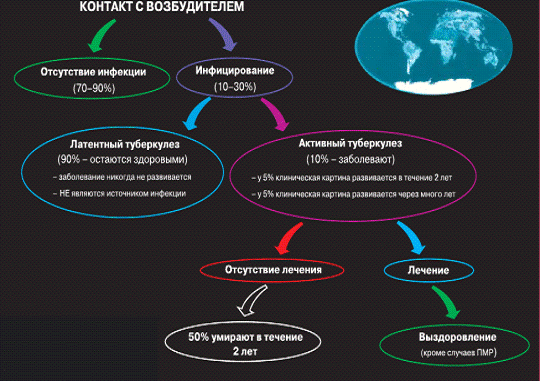
Рис.1. Варианты течения туберкулёзной инфекции
Около века назад эффективных средств борьбы не существовало. Больных
изолировали - помещали в специальные медицинские учреждения, для того чтобы
предотвратить распространение заболевания.
Первые попытки в борьбе с туберкулезом были осуществлены в 1919-1921 г.,
когда французские иммунологи Альбкрт Кальмет и Камиль Герен создали
противотуберкулезную вакцину на основе ослабленной культуры микобактерии
бычьего типа (БЦЖ). Введение вакцины новорожденным с последующей ревакцинацией
позволило резко снизить заболеваемость туберкулезом, прежде всего у детей.
Спустя 22 года группа американских микробиологов под руководством Селмана
Ваксмана открыла стрептомицин, который стал первым эффективным
противотуберкулезным препаратом, хотя и обладал спектром побочных действий. В
1950-х гг., были синтезированы сразу несколько антибиотиков, лишенных
недостатков свойственных стрептомицину.
Эти достижения положили конец тактике изоляции больных туберкулезом и
существенно снизили заболеваемость в странах, обладающих достаточными
финансовыми ресурсами и инфраструктурой, необходимой для лечения больных. К
началу 1970-х гг. у многих экспертов сложилось мнение, что туберкулез в этих
странах побежден. Но все оказалось не так просто. Процессы глобализации,
возможность путешествовать по всему миру способствовали распространению
инфекции из эндемичных регионов, и сейчас мы стоим на пороге новой пандемии.
Хуже всего приходится жителям беднейших стран, которые первыми столкнулись с
другим смертельно опасным заболеванием - СПИДом.
Со второй половины 80-х годов прошлого века туберкулёз стал существенной
проблемой в ряде регионов мира. В частности, заболевание, образно говоря,
вернулось в США и страны Европы, где считалось эрадицированным, однако наиболее
неблагоприятная картина сложилась в Азии и экваториальной Африке, где и сейчас
проживает свыше 80% всех зарегистрированных больных. В 1993 году Всемирная
организация здравоохранения признала туберкулёз глобальной медицинской
проблемой, после чего началась реализация программы ранней диагностики
туберкулёз и обеспечения реальной доступности. С тех пор эпидемиологическая
ситуация стабилизировалась или же наметились тенденции ее улучшения, за
исключением стран Африки южнее пустыни Сахара, а также - Соединенного
Королевства и ряда государств Восточной Европы. Так, по сведениям UK Health
Protection Agency press statement (2006), только за период с 2004 по 2005 год
число случаев туберкулёз в Англии, Уэльсе и Северной Ирландии возросло на
10,8%. При этом, если в указанных трех странах новых пациентов типично выявляли
и выявляют среди обитателей трущобных районов крупных городов, то в Восточной
Европе наблюдаемая картина отражает национальную проблему, что связывают с
низким государственным финансированием противотуберкулезных программ здравоохранения.
В регионах мира с высокой распространенностью ВИЧ, одновременное с
последним инфицирование туберкулёз стало критически угрожающим явлением,
усугубляющим появление новых случаев фтизиатрической патологии. При этом
соинфекция ВИЧ не только вызывает увеличение числа случаев активных форм ТБ, но
и обусловливает труднопреодолимые проблемы в терапии ввиду лекарственных
взаимодействий противотуберкулезных средств и агентов терапии ВИЧ инфекции.
Терапию ТБ проводят средствами первой и второй линии. Препараты агентов
первой линии обеспечивают (при адекватном согласии пациента) успех лечения в
~95% случаев и представлены рифампицином, изониазидом, пиразинамидом,
этамбутолом (и их комбинированными лекарственными формами), а также -
стрептомицином, хотя последний применяют ограниченно ввиду развития
резистентности и необходимости внутримышечного введения. Ко второй линии
противотуберкулезных средств относят антибиотики канамицин, капреомицин и
циклосерин, причем в некоторых клинических руководствах их упоминают как
средства группы резерва. Последнее обусловлено тем, что указанные агенты не
разрабатывались целенаправленно в качестве противотуберкулезных, чаще вызывают
побочные эффекты и, в целом, менее эффективны.
Таблица 1. Характеристика основных современных средств терапии
туберкулёза
|
Агент
|
Свойства
|
Начало производства
|
Производитель
|
Механизм антибактериальной активности
|
|
Рифампицин (рифампин)
|
Антибиотик широкого спектра
|
1963
|
CIBA Ltd (в настоящее время - Novartis)
|
Ингибитор синтеза нуклеиновых кислот
|
|
Изониазид
|
Гидразид изоникотиновой кислоты, эффективен исключительно
против микобактерий
|
1952
|
Roche
|
Ингибитор синтеза клеточной стенки
|
|
Пиразинамид
|
Бактериостатическое и бактерицидное действие
|
1954
|
Lederle (в настоящее время - Wyeth_Pfizer)
|
Ингибитор энергетического обмена
|
|
Этамбутол
|
Противомикобактериальный агент бактериостатического
действия
|
1962
|
Lederle (в настоящее время - Wyeth_Pfizer)
|
Ингибитор синтеза клеточной стенки
|
|
Стрептомицин
|
Антибиотик группы аминогликозидов
|
1948
|
Merck
|
Ингибитор синтеза белка на уровне субъединиц 30S рибосом
|
Пожалуй, наибольшие опасения вызывает рост числа штаммов, устойчивых к
антибиотикам. Для того чтобы проиллюстрировать, как может возникнуть подобная
резистентность, рассмотрим обычную практику борьбы с туберкулезом. Схема,
разработанная еще в 1960-е гг., предусматривает прием четырех препаратов
первого ряда, созданных в 1950-х и 1960-х гг.: изониазида. этамбутола.
пиразинамида и рифампина. За весь курс пациент должен принять 130 доз
препаратов, лучше всего - под наблюдением врача.
Такая комбинация крайне эффективна против туберкулеза в активной форме,
но только если весь курс длительностью до девяти месяцев не прерывается.
По оценкам ВОЗ. примерно 5% из 9 млн ежегодно инфицируемых несут штаммы,
устойчивые к двум чаще всего применяемым препаратам первого ряда: изониазиду и
рифампииу. В большинстве случаев эти так называемые мультирезистентные штаммы
все-таки отступают под натиском химиотерапии, но тогда необходимо в течение
двух лет принимать препараты второго ряда, дающие серьезные побочные эффекты.
Если учитывать, что резистентность встречается чаще всего в странах третьего
мира, то приходится признать, что лечение обычно неосуществимо. Несвоевременная
диагностика, мультирезистентность и высокая стоимость лечения приводят к тому,
что лишь 2% нуждающихся в помощи больных получают ее в полной мере.
Но еще хуже то, что недавно появился штамм, невосприимчивый почти ко всем
высокоэффективным препаратам второго ряда [XDR. extensively drug-resistant]. Он был основным виновником вспышки
туберкулеза в 2006 г в провинции Квазулу-Наталь. ЮАР. XDR-штамм гораздо менее распространен, чем MDR. но опасен тем, что может
видоизменяться и стать устойчивым абсолютно ко веем известным
противотуберкулезным препаратам. По данным ВОЗ, этот штамм зарегистрирован уже
в 49 странах. Это минимальная оценка, поскольку далеко не везде есть
лаборатории, достаточно хорошо оснащенные для выявления XDR-штамма.
Глава 2.
Новые терапевтические цели в лечении туберкулёза и новые кандидаты на роль
противотуберкулёзных агентов
Противотуберкулезные препараты первого ряда, применяемые сейчас, были
созданы в 1950-1960-х гг. Лечение занимает от шести до девяти месяцев.
Преждевременное его прекращение приводит к появлению резистентных форм МТБ.
Сейчас, как никогда ранее, важно найти новые лекарственные средства -
недорогие, не требующие столь долговременного приема и направленные на другие
уязвимые места МТБ.
Глубоко ошибочным было бы считать, что ученые полагали, будто препараты
первого ряда, созданные в 1950-х гг. - это защита от туберкулеза на все
времена. Но поскольку подавляющее большинство больных проживали в беднейших
странах, у крупных фармацевтических компаний не было никаких финансовых
стимулов к разработке новых препаратов. До сих пор считается, что стоимость
изысканий (от $115 млн до $240 млн на одно средство) и потраченное время (до
десяти лет) несопоставимы с потребностями в таких продуктах.
И все же в этом направлении кое-что делается. Правительственные программы
и частные пожертвования, например от фонда Билла и Мелинды Гейтс, позволили
начать поиски противотуберкулезных антибиотиков, эффективных в отношении
резистентных штаммов, и сократить время лечения больных, инфицированных
обычными штаммами.
В настоящее время в разных стадиях разработки пребывают несколько
потенциальных фармакотерапевтических агентов.
Таблица 2.Перспективные препараты
|
Препарат
|
Механизм действия
|
Фаза клинических испытаний
|
Преимущества
|
|
Класс фторхинолоны 1.Гатифлоксацин  2.Моксифлоксацин 2.Моксифлоксацин 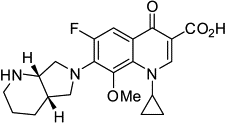
|
Подавляют репликацию и транскрипцию ДНК
|
Фаза III
(масштабные испытания на эффективность)
|
Сокращение периода терапии до 4-х месяцев
|
|
Класс Нитроимидазолы 1.РА-824 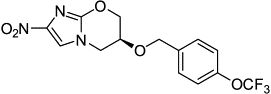
|
Подавляет синтез клеточной стенки и клеточное дыхание
|
Фаза II
(на эффективность)
|
Эффективность при полимедикаментозной резистентности,
замена двум современным агентам
|
|
Класс Диарилхинолоны 1.ТМС-207 
|
Подавляет синтез АТФ
|
Фаза II
|
Прием 1 раз в неделю, эффективность при ПМР, низкий
потенциал медикаментозных взаимодействий
|
|
Класс Диамины 1. SQ-109 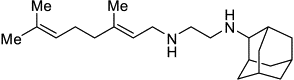
|
Подавляет синтез клеточной стенки
|
Фаза I
(на безопасность)
|
Сокращение длительности терапии на 25%
|
Оба представителя класса фторхинолонов, применяемые в терапии
инфекционных заболеваний кожи и дыхательных путей, проходят фазу III
клинических испытаний при ТБ. Из них, для моксифлоксацина уже имеются
обнадеживающие данные в пользу удовлетворительной переносимости терапии при
периоде применения 4 месяца, что достаточно для эрадикации возбудителя. Что
касается гатифлоксацина, то наряду с успешным проведением серии клинических
испытаний, в том числе - двух с участием 2500 и 1800 пациентов, опубликованы
сведения о неблагоприятном влиянии лечения на состояние углеводного обмена.
Более высокая, в сравнении с современными противотуберкулезными средствами,
активность моксифлоксацина и гатифлоксацина позволяет сократить период терапии
туберкулёза, успешно достигать эрадикации ПМР микобактерий туберкулеза при
отсутствии взаимодействий с антиретровирусными средствами терапии.
Ингибиторы синтеза АТФ - диарилхинолоны (TMC207 и R207910) - считаются
перспективными агентами для лечения и латентных, и активных форм туберкулёза.
При этом особо выигрышными представляются преимущества препаратов таких
соединений с точки зрения приверженности больных (длительный период
полувыведения позволяет создать лекарственные формы для приема 1 или 2 раза в
неделю). Примечательно, что группа учёных в 2005 году впервые провела полное
секвенсирование генома выделенных ПМР микобактерий, благодаря чему удалось
идентифицировать потенциальную “мишень” - субъединицу с АТФ-синтетазы.
Актуальность активных исследований диаминовых соединений была несомненной
уже длительное время ввиду относительной слабости антимикобактериального
действия этамбутола, как агента первой линии. Среди более чем 60000 родственных
соединений, отбор по критериям стабильности в плазме и биодоступности у
млекопитающих позволил идентифицировать три вещества - SQ37, SQ59 и SQ109,
последнее из которых оказалось наиболее подходящим, исходя из селективности
действия, минимальной величины концентрации подавления и способности
воздействовать на внутриклеточные формы возбудителя.
Надежды эффективно воздействовать на микобактерии туберкулеза в латентном
состоянии связаны с успехами в получении препаратов на основе
нитроимидазола/нитроимидазопирана (таковые активны исключительно в отношении
микроаэрофильных и анаэробных бактерий, а гипоксия и является одним из факторов
перехода возбудителя туберкулёза в упомянутое состояние). В отличие от
родоначальника фармакотерапевтического класса - метронидазола - более новые
соединения, как например РА-824 и ОРС-67683, демонстрируют выраженный
противотуберкулезный эффект. Первый из агентов претерпевает в макроорганизме
активацию при участии F420 зависимой глюкозо-6-фосфатдегидрогеназы и Rv3547
(нитрозоредуктаза - мутантный гипотетический протеин) и в равной мере со вторым
из соединений (ингибитор синтеза миколевых кислот) обладает свойствами,
определившими начало клинических испытаний. Препятствием здесь может оказаться
недостаточная биодоступность обоих агентов ввиду гидрофобных свойств молекул.
Путь к открытию новых средств терапии туберкулёза связывают также и с
уникальными для возбудителя особенностями. Так, микобактерии туберкулеза
продуцируют свыше 20 изоформ цитохрома Р450 (что нетипично для прокариот), а
указанные энзимы у патогенных грибов избраны в качестве цели применения
азоловых производных, в свете чего группы исследователей заинтересовались
противотуберкулезными свойствами последних. Другое необычное свойство
возбудителя туберкулёза роль серин/треониннпротеинкиназ в сигнальных механизмах
(в частности, энзим PknB облигатно необходим для процессов роста). Поскольку же
именно данный класс ферментов активно изучается в онкологии в качестве объектов
приложения соответствующих ингибиторов (иматиниб и родственные агенты), то
расширение спектра исследований в область микробиологии уже позволило получить
как подавление активности протеинкиназ in vitro, так и бактерицидный эффект в
культуре микобактерий туберкулеза.
В результате несколько обнадеживающих веществ уже проходят клинические
испытания. Среди них - агент SQ109,
который подавляет синтез клеточной стенки бактерий. Недавно завершилось его
тестирование на безопасность (фаза I). Еще один кандидат на роль
противотуберкулезного средства - вещество РА-824. Оно эффективно в отношении
как активно делящихся бактерий, так и бактерий в латентной фазе, что дает
надежду на уменьшение сроков лечения больных туберкулезом. РА-824 проходит фазу
II клинических испытаний, в которой
проверяется его эффективность.
Как показывает статистика, только 10% антибиотиков, прошедших первые
стадии испытаний, получают одобрение FDA. В значительной мере это обусловлено применением устаревшей практики
поиска подобных лекарственных средств, согласно которой сначала идентифицируют
ферменты, жизненно важные для бактерии и не имеющие аналогов в организме
человека, затем проводят скрининг библиотек веществ, способных служить
ингибиторами данных ферментов, потом синтезируют производные ингибиторов и,
наконец, оптимизируют их свойства, например повышают способность проникать из
желудка в кровоток. Даже крупным фармацевтическим компаниям, мастерам своего
дела, не всегда удается достичь успеха на этом пути. Поле битвы с туберкулезом
сплошь усеяно отвергнутыми кандидатами на роль спасительных лекарственных
веществ, многие из которых представляют собой высокоспецифичные мощные
ингибиторы бактериальных белков. Некоторые, ловко расправляясь с изолированными
ферментами, оказались бессильны перед целыми клетками, другие успешно
уничтожали бактерий в пробирке, но не действовали в организме подопытных
животных. Вообще туберкулез - уникальное заболевание в смысле несоответствия
результатов воздействия на возбудителя in vitro и in vivo. В большинстве случаев разработчики
не могут высказать никаких предположений относительно причин подобных различий.
Суть проблемы в том. что туберкулезная палочка - абсолютно автономная живая
система, выработавшая в ходе эволюции способность адаптироваться к любым
условиям и противостоять любым угрозам. Подобно современному самолету, она
оснащена разнообразными системами страховки, маневрирования, безопасности и
быстрого реагирования. До тех пор, пока не разберутся во всех тонкостях
взаимодействия этой изощренной бактерии с организмом человека, создание новых
эффективных средств борьбы с ней будет обречено на неудачу. Обнадеживает то,
что такая работа уже началась.
В ходе изучения генома МТБ генетики обнаружили, что в ДНК штамма,
используемого для создания вакцины, отсутствует крупный сегмент. Вскоре учёные
выяснили, что «выпавшие» гены обеспечивали вирулентность микроорганизма. Все это
послужило основанием к повышению специфичности теста на туберкулез. По
соображениям исследователей, тест, в котором фиксируется только иммунный ответ
на факторы вирулентности, отсутствующие у штамма «основателя» вакцины, позволил
бы разграничить инфицированных и тех, кто когда-то был вакцинирован. Именно
такой тест получил в 2005 г. разрешение FDA; его эффективность была подтверждена многократными
проверками. К сожалению, процедура остается дорогостоящей и используется только
в развитых странах.
Геном МТБ - не единственный источник данных, проливающий свет на уязвимые
места патогена. Сегодня биологи имеют возможность детально исследовать все его
компоненты и все внутриклеточные процессы - от синтезируемых МТБ белков до
матричных РНК, промежуточных и конечных продуктов метаболизма. В ходе
дальнейших исследований было обнаружено, что в процессе метаболизма
лекарственного препарата МТБ высвобождает оксид азота, защитное соединение, в
норме вырабатываемое иммунными клетками человека. Теперь ученые пытаемся синтезировать
вещество, стимулирующее высвобождение оксида азота в большем количестве, чем
это делает РА-824.
Роль липидов в патогенезе туберкулезной (ТБ) инфекции несомненна: жирные
кислоты в гораздо большей мере, нежели углеводы стимулируют процессы окислительного
метаболизма у микобактерий туберкулеза (МТБ) при их выделении из ткани легких. Изоциратлиазы катализируют
ключевые реакции глиоксилатного шунта, позволяющий бактерии синтезировать
углеводы и восполнять промежуточные продукты трикарбонового цикла за счет
ацетиллкоэнзима А, образующегося из жирных кислот. Для многих бактерий такой
механизм необходим для роста с утилизацией жирных кислот, как единственного
источника углерода. Для МБТ же метаболизм жирных кислот, как оказалось,
критически важен и для поддержания резистентности к активированной иммунной
системе макроорганизма. Эссенциальные
для выживания и роста МБТ энзимы изоцитратлиазы,
отсутствующие в организме человека, представляются реальными объектами
воздействия потенциальных противотуберкулезных агентов. В уже проведенных
исследованиях 3-нитропропионат - ICL-ингибитор-прототип - блокировал рост МБТ в
среде с жирными кислотами и дозозависимым образом препятствовал репликации
бактерий в макрофагах лабораторных мышей и человека. Усилия теперь направлены в
область поиска менее токсичных ингибиторов обеих форм изоцитратлиаз.
Специалисты в области структурной геномики ищут также способы определения
трехмерной конфигурации всех белков МТБ. Это необходимо для выяснения их
функций (для многих белков она остается неизвестной) и для создания
лекарственных веществ, мишенью которых был бы определенный участок важной для
МТБ белковой молекулы. За решение задачи взялся коллектив ученых из 17 стран.
Пока определена структура примерно 10% белков туберкулезной палочки.
Еще одно направление, достойное упоминания - химическая геноми-ка. Ее
отличительная черта - обратный общепринятому подход к поиску лекарственных
средств. Вместо того чтобы заниматься поисками веществ, подавляющих активность
бактериального белка с известной структурой, исследователи начинают работу с
вещества, обладающего тем или иным ценным признаком, например, способностью
блокировать размножение МТБ в культуре, и движутся в обратном направлении -
пытаются идентифицировать бактериальный фермент, на который данное вещество
действует. Само вещество может быть продуктом химического синтеза, иметь
растительное происхождение, вырабатываться микроорганизмами и даже животными.
Бактериальные экосистемы проходили через пресс естественного отбора по
много раз, и в большинстве случаев другие бактерии выработали механизмы
контроля над микобактериями. Если бы удалось идентифицировать этот арсенал, то
ученые смогли бы проверить его компоненты па способность атаковать МТБ, найти
те мишени, на которые они действуют и открыть целый класс новых лекарственных
веществ. В отличие от уже известных противотуберкулезных агентов новые будут
выводить из строя целые системы патогенов, а не отдельные биохимические
процессы.
Для того, чтобы использовать весь потенциал новых биотехнологий,
исследователям необходимо освоить приемы и инструменты информационных
технологий, которые позволят оперировать большими массивами данных. Фактически
это всё приведет к созданию новой научной дисциплины - биоинформатики, и только
будучи вооруженными новыми знаниями и навыками существует возможность
выработать другой подход к созданию новых средств борьбы с туберкулезом. Этот
подход будет основываться на предсказании поведения биологических систем в
целом, что невозможно сделать исходя из сведений об основных биологических
свойствах их компонентов.
Что касается поведения МТБ in vitro, то одно из неожиданных его
проявлений состоит в образовании «связок» - извивающихся цепочек бактериальных
частиц. Свойства этих структур невозможно предсказать исходя из свойств
молекул, участвующих в их формировании. В организме человека в результате их
взаимодействия с клетками иммунной системы образуется гранулема - крупный
агрегат из клеток хозяина и бактериальных частиц, в который лекарственным
веществам проникнуть крайне трудно.
С помощью биоинформатики ученые надеются установить, как ведут себя все 4
тыс. генов МТБ, кодируемые ими белки и побочные продукты метаболизма в
присутствии нового лекарственного вещества in vitro. За последние десять лет они кое-что узнали об особенностях
поведения возбудителя туберкулеза в организме-хозяине в отличие от поведения в
пробирке. А их конечная цель создание - компьютерной модели МТБ, которая будет
обладать всеми свойствами реальной бактерии, обитающей в организме человека.
Значение такой работы трудно переоценить - ведь учёные смогут с определенностью
предсказывать, какие компоненты бактериальной частицы будут наилучшей мишенью
для лекарственных веществ и какие из этих веществ будут наиболее эффективными.
Для этого необходимо детально изучить все биохимические пути
(последовательности химических превращений) и идентифицировать ключевые
свойства микроорганизма, которые ими определяются. Впрочем, данная область
стремительно развивается, что дает основания надеяться на создание в ближайшие
20 лет компьютерной модели МТБ точного аналога бактерии, выросшей в пробирке, а
возможно - и в теле человека.
Общеизвестно, что болезнь легче предотвратить, чем лечить. Ученые не
отказываются от попыток создания противотуберкулезных вакцин, более эффективных,
чем БЦЖ. Но пока они действуют методом проб и ошибок, нет возможности
установить, почему созданный ими вариант не работает, и предвидеть, какая
вакцина будет успешной.
Противотуберкулезная вакцина БЦЖ была создана французскими учеными
микробиологом Альбером Кальметтом и ветеринаром Камилем Гереном из вирулентного
штамма микобактерий туберкулеза (МБТ) бычьего вида (Mycobacterium bovis) путем
230 последовательных пассажей на неблагоприятной для роста МБТ картофельной
среде с добавлением глицерина и бычьей желчи.
В бывшем Советском Союзе вакцинация БЦЖ новорожденных была начата в 1926
году на Украине, затем - в Москве и Саратове, а с 1928 года - в Ленинграде. До
1933 года вакцинация проводилась, в качестве экспериментальной меры, только в
семьях больных-бактериовыделителей. Учитывая достигнутые результаты по снижению
заболеваемости, показания для вакцинации вскоре были расширены и ее проведение
распространили на семьи больных с активными формами ТБ и на проживающих в
перенаселенных условиях (общежития, бараки). С 1937 года, в соответствии с
постановлением Наркомздрава (эквивалент министерства здравоохранения) в СССР
была введена массовая вакцинация. В 1941 году Е.Н. Лещинская и А.М. Викенгут
создали препарат лиофилизированной сухой вакцины БЦЖ со сроком годности 12
месяцев для замены жидкой вакцины со сроком годности 2 недели. С 1985 года при
первичной иммунизации в СССР, а затем - в России и странах СНГ применяется
вакцина БЦЖ-М с уменьшенным вдвое содержанием антигена, благодаря чему частота
осложнений отмечается лишь в 0,004-0,02% случаев. Вакцины БЦЖ зарубежных стран
(Англия, Дания, Франция и др.), изготовлены из иных субштаммов БЦЖ и содержат
иное количество жизнеспособных бактерий, обладая, нередко, большей
реактогенностью - частота осложнений при их применении достигает, по разным
сведениям, 1,2- 3,1-4%.
В настоящее время специфическая иммунизация вакциной БЦЖ официально
рекомендована в 118 странах мира и обязательна в 64 из них. Вакцинированными
являются, по усредненным оценкам экспертов ВОЗ, ~2 млрд. человек (все
возрасты).
Лишь по опубликованным данным, в настоящее время ведется разработка
десятков новых вакцин против туберкулёза. Так, например, Всемирным фондом
вакцин против туберкулеза Аэрас созданы самостоятельно и в рамках
сотрудничества с партнерами 10 вакцин-кандидатов, из числа которых продукт
AERAS-402 (проходит фазу II клинических испытаний) разработан на основе
запатентованных технологий PER.C6® и AdVac® компании Crucell. Речь идет о
методике вакцинации по технологии первичного форсирования в виде
первоначального применения традиционной вакцины BCG с последующим (через 3 и 6
месяцев) введением упомянутой вакцины-кандидата. При этом путь введения
инновационного препарата отличается от такового для БЦЖ, что обеспечивает иной
уровень контакта иммунной системы с антигенами. Еще один препарат - BCG-Ad35 -
прошел фазу I двойного слепого рандомизированного плацебо-контролируемого
клинического исследования. Другая группа потенциальных вакцин представлена
препаратами очищенных протеинов БЦЖ вместо цельных бактериальных тел, что
призвано обеспечить принципиально меньшую частоту и выраженность
неблагоприятных реакций. Трудность здесь доселе заключалась в достижении
достаточной иммуногенности, однако вакцина-кандидат ММ72 (рекомбинант двух
туберкулёзных протеинов с адъювантом) вполне реально может стать фаворитом.
В отличие от других инфекционных заболеваний, при которых успешно
преодоленная первичная инфекция гарантирует от повторного заражения, туберкулез
может атаковать одну и ту же жертву по много раз. Таким образом, вакцина на
основе ослабленного штамма МТБ долго работать не будет. И если для ускорения
разработки новых лекарственных средств достаточно компьютерной копии одной
только бактерии, то для создания вакцины необходима и модель человеческого организма.
Заключение
Никогда человечество не нуждалось в более точных методах диагностики
туберкулеза, новых лекарственных средствах и вакцинах так, как сейчас.
Противотуберкулезные препараты, применяемые сейчас, были созданы в
1950-1960-х гг. Лечение занимает от шести до девяти месяцев, преждевременное
его прекращение приводит к появлению резистентных форм МТБ. Сейчас, как никогда
ранее, важно найти новые лекарственные средства - недорогие, не требующие столь
долговременного приема и направленные на другие уязвимые места МТБ.
Совсем недавно начались детальные исследования свойств МТБ, основанные на
результатах анализа генетического материала и других компонентов бактерии. Цель
- изучение патологического процесса с момента заражения и выяснение причин
уязвимости человеческого организма. Предполагается найти гораздо более
эффективный способ подавления синтеза АТФ, вещества, снабжающего бактериальную
клетку энергией. Возможно, удастся идентифицировать вещества, которые будут
стимулировать бактерию к высвобождению больших количеств оксида азота
ингибитора клеточного дыхания, чем это делают имеющиеся препараты.
Перспективным представляется и блокирование синтеза ниацина, основного
переносчика энергии в бактериальной клетке
В перспективе создание компьютерной копии МТБ, имитирующей поведение
реальной бактерии в организме человека. Это позволит предугадать реакцию МТБ на
различные лекарственные вещества с гораздо большей точностью, чем раньше.
Список
литературы
1. Барри
К. Новая тактика борьбы с туберкулезом / К. Барри, М. Чеун // В мире науки.
2009. № 6. С.56-63
2. Борг
И. В борьбе с туберкулезом - свыше 40 лет «застоя» и новые надежды / И. Борг //
Новая медицина тысячелетия. 2009. № 2. С.16-19
. Ваксман
Ю. Противотуберкулёзные вакцины - когда? / Ю. Ваксман // Новая медицина
тысячелетия. 2009. №2. С. 20-22
. МакГёрн
А.-М. Микобактерия туберкулёза и липиды - оружие агрессора против него самого /
А.-М. МакГёрн // Новая медицина тысячелетия. 2009. №2. С. 23-24
. Всемирная
организация здравоохранения. Проект глобальной стратегии и цели в области
профилактики, лечении и борьбы с туберкулёзом. 2014. С. 4-7
. Бен
Амор Я. Профилактика следующего поколения возбудителей туберкулёза с широкой
лекарственной устойчивостью / Я. Бен Амор, М. С. Дэй, Н. В. Шлугер //
Международный журнал «Туберкулёз и лёгочные заболевания». 2011. Т.2. №1. С.
103-106