Данное заболевание является одной из ведущих причин
деменции в современном обществе и, вследствие этого, представляет собой
социально значимую проблему. Клинически несколько чаще встречается у женщин.
Проявляется прогрессирующим распадом когнитивных
функций, среди которых первое место занимают нарушения памяти. Возможны острые
психотические эпизоды - бред, галлюцинации, делирий. Реже встречаются
гиперкинетические расстройства и синдром паркинсонизма, эписиндром.
Постоянно прогрессирующие симптомы деменции:
деградации интеллекта и памяти вплоть до полной потери способностей к
узнаванию, ориентировке в пространстве и времени - больные теряются в новой
обстановке и могут заблудиться во время прогулки или вождения автомобиля.
Начинают наблюдаться расстройства речи, особенно понимание чужой речи и
называние предметов. В некоторых случаях выраженная афазия появляется уже в
начале заболевания.
Согласно МКБ - 10 выделяют пресенильную и сенильную
формы болезни Альцгеймера. О пресенильной форме говорят при начале заболевания
в возрасте до 65 лет, а о сенильной форме - при начале после 65 лет.
Такое разделение отражает представления прошлых лет,
когда предполагали, что первичные дегенеративные деменции с началом в раннем и
позднем возрасте представляют собой два разных заболевания. Пресенильную форму
называли собственно болезнью Альцгеймера, а сенильную форму - сенильной деменцией
альцгеймеровского типа или просто сенильной деменцией. Сегодня исходя из
единства морфологии и пресенильную, и сенильную форму деменции рассматривают
как одно заболевание и обозначают термином «болезнь Альцгеймера».
Тем не менее нельзя отрицать существенных клинических
различий между пресенильной и сенильной формами болезни Альцгеймера.
Пресенильная форма характеризуется более быстрым прогрессированием и ранним
присоединением афазии, апраксии и агнозии, в большинстве случаев можно
проследить семейный анамнез заболевания. Сенильная болезнь Альцгеймера
прогрессирует медленнее, нарушения памяти длительное время остаются главным
симптомом, в то время как другие когнитивные нарушения представлены мягко,
семейный анамнез обычно не прослеживается (табл. 1).
|
|
Пресенильная форма
|
Сенильная форма
|
Часто
|
Редко
|
|
Клиническая картина
|
Нарушения памяти,
выраженные афазия, апраксия, агнозия
|
Доминируют нарушения памяти
|
|
Прогрессирование
|
Быстрое
|
Медленное, возможны периоды
стабилизации (плато)
|
Этиология
Согласно современным представлениям болезнь
Альцгеймера - генетически детерминированное заболевание. На сегодняшний день
точно установлено четыре патологических гена, носительство которых связано с
высоким риском болезни Альцгеймера:
• ген, кодирующий предшественник амилоидного белка
(хромосома 21);
• пресенилин-1 (хромосома 14);
• пресенилин-2 (хромосома 1);
• ген, кодирующий аполипопротеин Е-4 (хромосома 19).
Наиболее высок риск болезни Альцгеймера у носителей
гена, кодирующего предшественник амилоидного белка, - пресенилин - 1 и
пресенилин - 2. Носительство указанных генов означает почти 100% вероятность
развития болезни Альцгеймера в возрастном промежутке между 40 и 65 годами
(пресенильная форма).
Носительство гена, кодирующего аполипопротеин Е-4,
связано с повышенным риском развития болезни Альцгеймера после 65 лет
(сенильная форма). Оно увеличивает риск болезни Альцгеймера приблизительно
вдвое. Так, в возрастной группе 80-84 года заболеваемость в течение 1 года
среди носителей гена аполипопротеина Е-4 составляет 5,6%, в то время как у лиц
без этого гена - 2,9%.
При болезни Альцгеймера, в отличие от всех других
нейродегенеративных заболеваний, максимальные изменения определяются в
гиппокампах.
Именно поэтому для диагностики используются
специальные программы высокого разрешения с прицельным исследованием височных
долей.
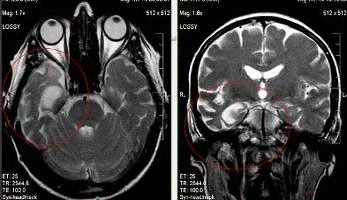
При этом на корональных томограммах при прицельном
исследовании височных долей определяется асимметричная атрофия гиппокампов с
истончением коры, расширением щелей Биша с двух сторон и височных рогов боковых
желудочков. Эти изменения являются наиболее ранними. Также выявляется атрофия
теменных и затылочных долей с расширением субарахноидальных пространств.
болезнь альцгеймер метаболизм ген
Выраженная атрофия на уровне крючка и тел гиппокампа
справа с истончением коры и белого вещества и расширением височного рога и
гиппокампальной щели.
Патогенез
Болезнь Альцгеймера поражает в первую очередь нервные
клетки височной доли коры головного мозга игиппокампа (контролирующих память).
Также нарушены следующие отделы мозга:
лобная доля, отвечающая за принятие решений,
индивидуальность, движение, речь;
теменная доля, контролирующая речь, тактильные,
болевые, пространственные и температурные ощущения;
миндалина (отвечающая за эмоциональный контроль).
Обнаружение нескольких генов БА объясняет клиническую
гетерогенность симптомов БА. Будучи этиологически гетерогенным заболеванием, БА
характеризуется одним общим патологическим фенотипом - прогрессирующей
деменцией.
Ключевое звено патогенеза болезни Альцгеймера -
нарушение метаболизма предшественника амилоидного белка.
При микроскопическом исследовании обнаруживаются два
основных гистологических признака болезни Альцгеймера:
) амилоидные (сенильные) бляшки в паренхиме мозга,
главным компонентом которых являются фибриллярные агрегаты гидрофобного пептида
(амилоида, состоящего из 39-43 аминокислот);
) нейрофибриллярные клубки, представляющие собой
спаянные попарно скрученные филаменты измененных нейронов, легко выявляемые при
импрегнации серебром. Характерно также выпадение нейронов, глиоз, наличие
единичных телец Леви. Отмеченные изменения наиболее выражены в коре больших
полушарий и гиппокампе.
Сенильные бляшки представляют собой нерастворимые
сферические образования диаметром около 0,2 мм состоящие из нескольких белков,
в том числе, альфа-антихимотрипсина, АPOЕ, бета-амилоида (Абета42) (накопление
Абета42 в паренхиме наблюдается при начале развития БА и, по-видимому,
инициирует формирование белковых агрегатов Амилоидные бляшки часто окружают
капилляры и более крупные сосуды и встречаются в основном в коре головного
мозга, а также в некоторых других структурах мозга.
В норме предшественник амилоидного белка расщепляется α-секретазой на одинаковые по величине
полипептиды (непатогенные). При генетической дефектности этого белка или
дефектности ферментных систем предшественник амилоидного белка расщепляется на
различные по длине фрагменты. При этом длинные фрагменты являются
нерастворимыми и поэтому откладываются в паренхиме головного мозга и стенках
церебральных сосудов (стадия диффузного церебрального амилоидоза). Далее в
паренхиме головного мозга происходит агрегация нерастворимых фрагментов в
патологический белок - β-амилоид. «Гнёздные» отложения этого белка в паренхиме
головного мозга называют сенильными бляшками. β-Амилоид обладает нейротоксическими
свойствами. β-амилоид активирует тканевые медиаторы воспаления, усиливает
выброс возбуждающих медиаторов, способствует повышенному образованию свободных
радикалов. Результатом всего этого сложного каскада процессов становится
повреждение и гибель нейронов. При этом в первую очередь и в наибольшей степени
страдают нейроны, окружающие сенильные бляшки.
Нейрофибриллярные клубки - это внутриклеточные
включения, состоящие из гиперфосфорилированного тау-протеина и нейрофибрилл.
В норме тау-протеин входит в состав внутренней
нейрональной мембраны, образуя цитоскелет, скрепляет и стабилизирует микротрубочки,
обеспечивающие перенос через цитоплазму нейронов клеточных органелл,
гликопротеидов и других образований. Способность тау-белка скреплять
микротрубочки отчасти объясняется наличием у него нескольких фосфатных групп
Изменение биохимических свойств тау-протеина с формированием нейрофибриллярных
сплетений приводит к повреждению внутренней мембраны нейрона, что в конечном
счёте вызывает гибель клетки. После гибели нейрона нейрофибриллярные сплетения
выходят в межклеточное пространство.
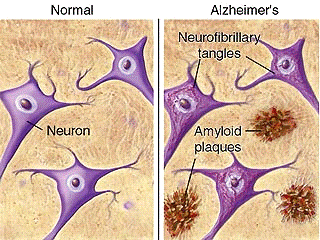
Рис. 2
Ненормальные белковые образования внутри нейронов.
Состоят из: Альфа-синуклеин - белок, состоящий из 140 аминокислот, выявляющийся
в головном мозге главным образом в пресинаптических терминалях и в значительно
меньшей степени в телах нейронов и дендритах. Он не имеет четкой вторичной
структуры и, возможно, участвует во взаимодействиях между различными белками,
хотя точно его функции неизвестны. Предполагают, что образование телец Леви
связано с патологической агрегацией а-синуклеина, обусловленной нарушениями его
метаболической деградации в клетке, расстройством его аксонального транспорта
или иными факторами. Другой структурообразующий компонент телец Леви -
фосфорилированные и подвергшиеся частичному протеолизу белки нейрофиламентов, в
норме формирующих цитоскелет аксонов. Связанные поперечными сшивками, они,
по-видимому, образуют плотный гиалиновый стержень. Агрегированный а-синуклеин и
белки нейрофиламентов формируют нитевидные структуры, к которым могут
присоединяться и другие белковые компоненты. Некоторые из них связаны с
защитной реакцией клетки на образующиеся включения, другие попадают в
формирующиеся структуры случайно, как в «ловушку».
Важнейшим компонентом телец Леви является также
убиквитин. Он представляет собой небольшой протеин, состоящий из 76 аминокислот
и участвующий в АТФ-зависимой нелизосомальной деградации белков. Убиквитин
метит патологические или поврежденные. Вероятно, агрегаты а-синуклеина и
нейрофиламентных белков подвергаются убиквитинизации, однако ферментативные
системы нейрона в силу тех или иных причин оказываются не в состоянии их
переработать. В отличие от а-синуклеина, убиквитин обнаруживается не во всех
ТЛ. Кроме того, тельца Леви содержат киназы и фосфатазы, вовлеченные в процесс
фосфорилирования, другие белки, связанные с цитоскелетом (например, тубулин),
предшественник амилоидного белка, амилоидный р-протеин, белки пресинаптических
терминалей (синаптофизин, белок синаптических везикул и др.)

Рис. 3
Следует отметить, что начальные признаки
альцгеймеровской дегенерации, такие, как диффузный церебральный амилоидоз и
даже сенильные бляшки, обнаруживают у подавляющего большинства пожилых людей с
нормальными когнитивными функциями. Поэтому обязательный морфологический
критерий диагностики болезни Альцгеймера - присутствие не только ранних, но и
поздних признаков, таких, как нейрофибриллярные сплетения и определённая
концентрация данных изменений на единицу объёма мозгового вещества. При этом
выраженность когнитивных нарушений не коррелирует с количеством сенильных
бляшек или нейрофибриллярных сплетений, но коррелирует с уменьшением количества
синапсов между нейронами.
Различные отделы головного мозга страдают
неравномерно. наибольшую концентрацию сенильных бляшек, нейрофибриллярных
сплетений и гибель нейронов отмечают в гиппокампе и глубинных отделах височных
долей головного мозга. Также весьма рано в патологический процесс вовлекаются
медиобазальные отделы лобных долей головного мозга.