Методы ПЦР в диагностике онкологических заболеваний
Курсовая
работа
Методы
ПЦР в диагностике онкологических заболеваний
Содержание
Обозначения
и сокращения
Введение
Глава
1. Сущность и Принципы метода ПЦР
1.1
Применение метода ПЦР
1.2
Достоинства и недостатки метода ПЦР
1.3
Разновидности ПЦР
1.4
Mеханизмы ПЦР. Стадии постановки ПЦР
Глава
2. Онкомаркеры в клинической диагностике
2.1
Алгоритм исследования на онкомаркеры
Заключение
Список
использованных источников
Обозначения и сокращения
ПЦР
- Полимеразная цепная реакция;
УПФ
- условно-патогенная флора;
ДНК
- дезоксирибонуклеиновая кислота;
дНТФ
- дезоксинуклеотидтрифосфат ;
дЦТФ
- дезоксицитозинтрифосфат ;
дТТФ
- дезокситимидинтрифосфат ;
ИФА
- иммуноферментный ;
ИЛА
- иммунолюминесцентный ;
РИА
- радиоиммунный ;
ЯМР
- ядерный магнитный резонанс;
АФП
- альфа-фетопротеин;
РЭА
- раково-эмбриональный антиген;
СА
- раковый антиген;
МСА
- муциноподобный ассоциированный антиген;
β-ХГ
- Бета-хорионический гонадотропин;- антиген плоскоклеточной карциномы ;
ПСА
- Простатический специфический антиген;
сПСА
- Свободный простатический специфический антиген;- Нейронспецифическая
енолаза;- Фрагмент цитокератина;
ВТА
- Опухолевый антиген мочевого пузыря;
ОМ
- онкомаркер ;- международная классификация стадий злокачественных
новообразований.
Введение
Достижения генетики и молекулярной биологии
последних десятилетий оказали огромное влияние на понимание природы
инициализации и прогрессии злокачественных образований. Окончательно
установлено, что рак представляет собой гетерогенную группу заболеваний, каждое
из которых вызывается комплексом генетических нарушений, определяющих свойство
неконтролируемого роста и способность к метастазированию. Эти современные
знания открыли принципиально новые возможности в диагностике и лечении
злокачественных новообразований [1].
ДНК-диагностика - это один из наиболее
современных высокотехнологичных методов исследования. ДНК-анализы широко
применяются в диагностике инфекционных заболеваний, позволяя обнаруживать даже
единичные микроорганизмы в организме человека [10].
ДНК-диагностика объединяет несколько методов
исследования, самый распространенный из них - метод ПЦР (полимеразной цепной
реакции, Polymerase chain reaction, PCR diagnostics) [6] .
Изобретение ПЦР К.Муллисом и его сотрудниками в
1985 году революционизировало молекулярную биологию и молекулярную медицину. До
этого в истории медицины врачи не имели такого быстрого, эффективного, и
главное высокоточного метода ранней диагностики различных заболеваний. Данный
метод широко распространен в современном мире, имеет большое количество
достоинств и обладает высокой точностью. Широкое внедрение в область
практического здравоохранения ПЦР обусловлено простотой ее выполнения, низкой
себестоимостью и надежностью. Вместе с тем, сегодня уже очевидно, что
дальнейшее развитие ПЦР получит в области количественного определения
нуклеиновых кислот (ДНК и РНК) инфекционных агентов [5].
Полимеразная цепная реакция (ПЦР, PCR -
polymerase chain reaction) - современный метод клинической лабораторной
диагностики, имитирующий естественную репликацию ДНК и позволяющий обнаружить
единственную специфическую молекулу ДНК в присутствии миллионов других молекул.
Метод основан на многократном избирательном копировании определённого участка
ДНК при помощи ферментов в условиях in vitro. При этом происходит копирование
только того участка, который удовлетворяет заданным условиям, и только в том
случае, если он присутствует в исследуемом образце. В отличие от амплификации
ДНК в живых организмах, (репликации), с помощью ПЦР амплифицируются
относительно короткие участки ДНК. В обычном ПЦР-процессе длина копируемых
ДНК-участков составляет не более 3000 пар оснований. Прежде можно было получить
только минимальные количества специфического гена, теперь с использованием ПЦР
даже единичная копия может быть амплифицирована до миллиона копий за несколько
часов [7].
Методика ПЦР стала необходимой для многих
обычных процедур, таких как клонирование специфических фрагментов ДНК,
выявление и идентификация генов в диагностике и в судебной медицине, а также в
процессе изучения характера экспрессии генов. В последнее время метод ПЦР
позволил проводить исследования в новых областях, таких как контроль
аутентичности пищевых продуктов, анализ наличия генетически модифицированной
ДНК или микробиологического заражения [3].
Существует большое количество способов получить
данные о концентрации нуклеиновых кислот в пробе методом ПЦР, но все они
требуют дополнительных трудоемких этапов работы, связанных с предварительной
раститровкой выделенной из анализируемой пробы ДНК, или полученных в ходе ПЦР
ампликонов, что приводит к увеличению времени, необходимого для постановки
анализа и сложности интерпретации полученных результатов. Также, наличие
дополнительных этапов работы увеличивает вероятность ошибки и получения
недостоверного результата.
Актуальность данной темы заключается в том, что
метод ПЦР ориентирован на предупреждение распространения и ликвидацию инфекций,
диагностики наследственных, онкологических и других заболеваний [12].
Предмет исследования - онкомаркеры, используемые
для диагностики онкологических заболеваний .
Целью данного исследования является обзор и
систематизация научной и специальной литературы по методам ПЦР в диагностике
онкологических заболеваний.
Задачи исследования:
Обзор и обобщение научной литературы об основных
принципах ПЦР;
Систематизировать данные литературы об основных
онкомаркерах в диагностике методом ПЦР.
Провести анализ данных литературы о перспективах
применения метода ПЦР в диагностике онкологических заболеваний.
Глава 1. Сущность и принципы метода ПЦР
Метод ПЦР основан на механизме репликации ДНК in
vivo: двухцепочечная ДНК (dsДHK) раскручивается до одноцепочечных ДНК (ssДHK),
дуплицируется и снова закручивается. Эта методика состоит из повторяющихся
циклов:
• Денатурация ДНК путем плавления при повышенной
температуре для превращения двухцепочечной ДНК в одноцепочечную ДНК
• Отжиг (гибридизация) двух олигонуклеотидов,
используемых в качестве праймеров для целевой ДНК
• Удлинение цепи ДНК, начиная от праймеров,
путем добавления нуклеотидов с использованием ДНК полимеразы в качестве
катализатора и в присутствии ионов Мg2+ .
Достоинство метода заключается в его
универсальности: ПЦР позволяет обнаруживать любые ДНК и РНК, даже когда
бессильны другие методы. Оборудование, используемое для ПЦР, стандартно, оно не
зависит от того, что именно и где именно мы ищем [8].
Следующий плюс - высокая специфичность. В
материале, направленном на исследование, определяется уникальная
последовательность нуклеотидов, характерная только для конкретного возбудителя.
Таким образом, можно говорить, что специфичность метода достигает 100%. Кроме
того, это позволяет одновременно, в одном и том же материале, проводить поиск
нескольких возбудителей без какого-либо ущерба для качества ответа [8,9].
.1 Применение метода ПЦР
Результатом открытия ПЦР стало почти немедленное
практическое применение метода. Перспективы практического использования
ПЦР-диагностики . В настоящее время наиболее быстро развиваются пять основных
направлений генодиагностики:
диагностика инфекционных заболеваний;
диагностика онкологических заболеваний;
диагностика лейкемий и лимфом;
диагностика рака груди;
диагностика других злокачественных заболеваний;
диагностика генетических заболеваний;
идентификация личности;
судебная медицина, криминалистика;
трансплантация органов и тканей;
определение отцовства;
диагностика патогенов в пище.
В медицине ПЦР применяют при диагностике
инфекционных и наследственных заболеваний (метод ПЦР позволяет обнаружить
единственную копию чужеродной ДНК в образце),при диагностике рака и иммунных
патологий. ПЦР используют для идентификации личности и определения
биологического родства индивидов [12].
.2 Достоинства и недостатки метода ПЦР
Процесс ПЦР заключается в большом числе циклов
синтеза (амплификации) специфического фрагмента ДНК, накоплении большого числа
копий, которые затем могут быть выявлены обычными методами детекции [9].
ПЦР используется во многих областях для
проведения анализов и в научных экспериментах.
Преимущества метода ПЦР:
для анализа методом ПЦР пригоден абсолютно любой
биологический материал;
специфичность ПЦР равна 100% (при правильном
выполнении ПЦР ложноположительный результат невозможен);
высокая чувствительность (ПЦР позволяет выявить
от нескольких копий до одного возбудителя в образце);
одновременно можно выявить несколько
возбудителей в одном образце;
динамика численности возбудителя заболевания
(ПЦР позволяет определять количество копий возбудителя в образце, что позволяет
оценить эффективность проводимой терапии);
процесс полностью автоматизирован и результат
ПЦР можно получить через несколько часов после начала исследования [8].
Недостатки метода ПЦР:
Несмотря на вышеуказанные достоинства метод ПЦР
все же не лишен некоторых недостатков, которые следует учитывать при оценке
результатов исследований:
.Амплифицируется ДНК как живого, так и погибшего
микроорганизма. Это налагает определенные требования при использовании ПЦР для
контроля эффективности лечения. В общем случае подобный контроль должен
проводиться спустя промежуток времени, втечение которого происходит полная
элиминация возбудителя. Однако, метод NASBA выявляет РНК только живых
микроорганизмов и позволяет избежать этих ограничений.
.Высокая чувствительность. Ряд микроорганизмов
(условно - патогенная флора, УПФ) в норме может существовать у человека в малом
количестве. При помощи метода ПЦР определяются даже самые малые количества УПФ,
даже при отсутствии патологии. Однако эта проблема решена с появлением метода
количественного определения ДНК.
.Различия при использовании разных тест систем.
Как говорилось выше, для амплификации можно использовать различные участки
генома возбудителя. Однако в случае различных мутации микроорганизмов возможно
изменение или утрата генов. Это приводит к разным результатам при использовании
тест систем разных производителей.
Контаминация - попадание из внешней среды в
реакционную смесь специфических молекул ДНК, способных служить мишенями в
реакции амплификации и давать ложноположительные результаты [4].
.3 Разновидности ПЦР
Вложенная ПЦР (Nested PCR (англ.)) - применяется
для уменьшения числа побочных продуктов реакции. Используют две пары праймеров
и проводят две последовательные реакции. Вторая пара праймеров амплифицирует
участок ДНК внутри продукта первой реакции.
Инвертированная ПЦР (Inverse PCR (англ.)) -
используется в том случае, если известен лишь небольшой участок внутри нужной
последовательности. Этот метод особенно полезен, когда нужно определить
соседние последовательности после вставки ДНК в геном. Для осуществления
инвертированной ПЦР проводят ряд разрезаний ДНК рестриктазами с последующим
соединением фрагментов (лигирование). В результате известные фрагменты
оказываются на обоих концах неизвестного участка, после чего можно проводить
ПЦР как обычно.
ПЦР с обратной транскрипцией (Reverse
Transcription PCR, RT-PCR (англ.)) - используется для амплификации, выделения
или идентификации известной последовательности из библиотеки РНК. Перед обычной
ПЦР проводят на матрице мРНК синтез одноцепочечной молекулы ДНК с помощью
ревертазы и получают одноцепочечную кДНК, которая используется в качестве
матрицы для ПЦР. Этим методом часто определяют, где и когда экспрессируются
данные гены.
Асимметричная ПЦР (англ. Asymmetric PCR) -
проводится тогда, когда нужно амплифицировать преимущественно одну из цепей
исходной ДНК. Используется в некоторых методиках секвенирования и
гибридизационного анализа. ПЦР проводится как обычно, за исключением того, что
один из праймеров берется в большом избытке.[9].
Количественная ПЦР (Quantitative PCR, Q-PCR
(англ.)- используется для непосредственного наблюдения за измерением количества
конкретного ПЦР продукта в каждом цикле реакции. В этом методе используют
флуоресцентно-меченые праймеры или ДНК-зонды для точного измерения количества
продукта реакции по мере его накопления.
Ступенчатая ПЦР (Touchdown PCR (англ.)) - с
помощью этого подхода уменьшают влияние неспецифического связывания праймеров.
Первые циклы проводят при температуре выше оптимальной температуры отжига,
затем каждые несколько циклов температуру отжига постепенно снижают до
оптимальной. С.
Метод молекулярных колоний (ПЦР в геле, англ.
Colony - PCR Colony) - акриламидный гель полимеризуют со всеми компонентами ПЦР
на поверхности и проводят ПЦР. В точках, содержащих анализируемую ДНК,
происходит амплификация с образованием молекулярных колоний[3,7].
ПЦР длинных фрагментов (англ. Long-range PCR) -
модификация ПЦР для амплификации протяженных участков ДНК (10 тысяч и более
оснований). Используют смесь двух полимераз.(англ. Random Amplification of
Polymorphic DNA), ПЦР со случайной амплификацией полиморфной ДНК - используется
тогда, когда нужно различить близкие по генетической последовательности
организмы, например, разные сорта культурных растений, породы собак или
близкородственные микроорганизмы.
Групп-специфическая ПЦР (англ. group-specific
PCR) - ПЦР для родственных последовательностях внутри одного или между разными
видами, используя консервативные праймеры к этим последовательностям.
Противоположный этому методу является - уникальная ПЦР (англ. unique PCR), в
котором задача состоит в подборе праймеров для амплификации только конкретной
последовательности среди родственных последовательностей.
ПЦР с использованием горячего старта (англ.
Hot-start PCR) - модификация ПЦР с использованием ДНК-полимеразы, в которой
полимеразная активность блокируется при комнатной температуре антителами или
имитирующие антитела небольшими молекулами типа Affibody, то есть в момент
постановки реакции до первой денатурации в ПЦР. Обычно первая денатурация
проводится при 95 °C в течение 10 минут.
Виртуальная ПЦР (англ. in silico PCR, цифровая
ПЦР, электронная ПЦР, е-ПЦР) - математический метод компьютерного анализа
теоретической полимеразной цепной реакции c использованием списка
последовательностей праймеров (или ДНК-зондов) для предсказания потенциальной
амплификации ДНК исследуемого генома, хромосомы, кольцевой ДНК или любого
другого участка ДНК.
ПЦР в реальном времени (или количественная ПЦР,
англ. Real-time PCR, qPCR, qRT-PCR) -Метод включает в себя одновременно
детекцию и количественное определение (измерение непосредственно количества
копий, либо измерение копий относительно внесенной ДНК или дополнительных
калибровочных генов) специфической последовательности ДНК в образце. Метод
использует общие принципы ПЦР. Основное отличие состоит в том, что измеряется
количество амплифицированной ДНК в реальном времени после каждого цикла
амплификации [11].
1.4 Mеханизмы ПЦР. Стадии постановки ПЦР
Вся методика базируется на способности
нуклеиновых кислот к самостоятельной репликации, что в данном случае проводится
искусственно в условиях лаборатории. Воспроизведение ДНК может начаться не в
любой области молекулы, а только в участках с определенной последовательностью
нуклеотидов - стартовых фрагментах. Для того чтобы полимеразная цепная реакция
началась, нужны праймеры (или ДНК-зонды). Для проведения полимеразной цепной
реакции необходимо соблюдение ряда условий:
Наличие в реакционной смеси ряда компонентов:
Праймеры - олигонуклеотид, выполняющий роль
затравки и инициирующий синтез полинуклеотидной цепи на ДНК- или РНК-матрице.
Правильно подобранные праймеры обеспечивают специфичность и чувствительность
тест-системы. полимераза - термостабильный фермент, обеспечивающий достраивание
3’-конца второй цепи ДНК согласно принципу комплементарности.
Смесь дезоксинуклеотидтрифосфатов (дНТФ) -
дезоксиаденозинтрифосфат (дАТФ), дезоксигуанозинтрифосфат (дГТФ),
дезоксицитозинтрифосфат (дЦТФ) и дезокситимидинтрифосфат (дТТФ) -
"строительный материал", используемый Taq-полимеразой для синтеза
второй цепи ДНК;
Буфер - смесь катионов и анионов в определенной
концентрации, обеспечивающих оптимальные условия для реакции, и стабильное
значение рН;
Анализируемый образец - подготовленный к
внесению в реакционную смесь препарат, который может содержать искомую ДНК,
служащую мишенью для последующего многократного копирования (например, ДНК
микроорганизмов) [14].
Циклический температурный режим:
Ход реакции: обычно при проведении ПЦР
выполняется 20-35 циклов, каждый из которых состоит из трёх стадий:
. Денатурация. На первом этапе необходимо
денатурировать ДНК, находящуюся в образце. Для этого реакционную смесь
нагревают до 92-95° С, в результате чего двухцепочечные молекулы ДНК
расплетаются с образованием двух одноцепочечных молекул. Этот процесс длится не
менее 1 минуты.
. Отжиг. На втором этапе температуру смеси
понижают до 55°С праймеры присоединяются к одноцепочечной ДНК-мишени. Праймеры
выбирают так, что они ограничивают искомый фрагмент и комплементарны противоположным
цепям ДНК.
Отжиг происходит в соответствии с правилом
комплементарности Чаргаффа.
. Элонгация (синтез). На третьем этапе
температуру в реакционной смеси доводят до оптимума работы Taq-полимеразы -
75°С, и начинается синтез комплементарной цепи ДНК, инициируемый
3’-гидроксильной группой праймера, с максимальной эффективностью.
Все реакции проводят в пробирках, погруженных в
термостат. Смена температурного режима и его поддержание осуществляется
автоматически.
Первый цикл. ДНК-мишень фланкирована
определенными последовательностями. К образцу ДНК добавляют праймеры (Р1 и Р2),
ДНК-полимеразу Tag и четыре дНТФ. Здесь каждая из новосинтезированных цепей
имеет гораздо большую длину, чем расстояние от 3’-гидроксильной группы
"её" праймера до концевого нуклеотида последовательности,
комплементарной второму праймеру.
Во втором цикле двухцепочечную ДНК, состоящую из
исходной и новосинтезированной ("длинная матрица") цепей, вновь
денатурируют, а затем отжигают с праймерами [13].
В третьем цикле все гетеродуплуксы,
образовавшиеся ранее, одновременно подвергаются денатурации и отжигу с
праймерами, а затем реплецируются. При отжиге праймеры гибридизуются с
комплементарными участками исходных цепей, а также "длинных" и
"коротких" матриц.
В последующих циклах число "коротких
матриц" становится все больше.
Таким образом, специфические фрагменты,
ограниченные на концах праймерами, впервые появляются в конце второго цикла,
накапливаются в геометрической прогрессии и очень скоро начинают доминировать
среди продуктов амплификации.
Эффект «плато»
Используют для описания процесса накопления
продуктов ПЦР на последних циклах амплификации. В зависимости от условий и
количества циклов реакции амплификации, на момент достижения эффекта “плато”
влияют утилизация субстратов (дНТФ и праймеров), стабильность реактантов (дНТФ
и фермента) и др.
Стадии постановки ПЦР:
Подготовка пробы биологического материала
Амплификация
Приборное обеспечение
Детекция молекул РНК
Оценка результатов реакции
Метод горизонтального электрофореза
Метод вертикального электрофореза
Метод гибридизационных зондов
Контроль за прохождением реакции амплификации
[12]
Глава 2. Онкомаркеры в клинической диагностике
Онкозаболевания как причина смертности стоят на
втором месте после сердечно-сосудистой патологии. Среди злокачественных
новообразований наиболее часто встречаются: рак легкого - 27%, рак молочной
железы - 18%, колоректальные опухоли - 12%. Затраты на лечения таких больных
могут неоправданно возрастать за счет несвоевременной диагностики (в основном
позднего выявления в неоперабельных стадиях) и отсутствия послеоперационного
мониторинга эффективности операции и химиотерапии [17].
Определение осуществляется двухэтапным методом
(обратная транскрипция + ПЦР в реальном времени). В настоящий момент разработаны
наборы для определения следующих РНК-онкомаркеров. А также определением в крови
онкомаркеров методами иммуноферментного (ИФА), иммунолюминесцентного (ИЛА)
радиоиммунного (РИА) анализа.
Онкомаркеры - это специфические белки,
продуцируемые опухолевыми клетками, содержание которых в крови коррелирует с
наличием или прогрессирующим ростом злокачественной опухоли. В настоящее время
нет "идеального" маркера со 100% специфичностью (т.е. не
обнаруживающегося у здоровых) и 100% чувствительностью (т.е. обязательно
выявляемого у всех больных даже в начальной стадии рака).
Поэтому они ни в коем случае не должны
определяться при массовых обследованиях бессимптомных пациентов в качестве
скрининга на выявление злокачественного роста. Тем не менее, существуют маркеры
с достаточно высокими специфичностью и чувствительностью, позволяющие применять
их и для первичной диагностики в группах риска или у имеющих симптоматику рака
пациентов [15].
Ценность цитологических методов диагностики рака
не подлежит сомнению, но в 10 - 20% случаев биопсий не удается получить
материал, содержащий опухолевые клетки при наличии злокачественной опухоли.
Недоступность ЯМР-томографии как массового метода диагностики для большинства
пациентов в России не позволяет визуализировать опухоли внутренних органов и
метастазы размером до 0.5 - 1см. В таких случаях только определение
онкомаркеров дает возможность решить диагностические проблемы, особенно при
определении их в динамике: прирост уровня онкомаркера за 1 - 2 месяца вдвое
даже при исходно нормальном уровне - верный признак роста опухоли.
Альфа-фетопротеин (АФП) в сыворотке
Содержание АФП в сыворотке в норме:
у взрослых - до 10 МЕ/мл;
у беременных с 8 нед. его содержание повышается
и составляет во II - III триместре 28 - 120 МЕ/мл;
АФП - онкомаркер, гликопротеин, вырабатываемый
желточным мешком эмбриона. Время полужизни 7 сут.
АФП как онкомаркер имеет следующее клиническое
применение:
для выявления и мониторинга первичной
гепатоцеллюлярной карциномы, которая возникает, как правило, в цирротической
печени;
для выявления тератобластомы яичка .
для оценки эффективности терапии этих
заболеваний.
Повышенный уровень АФП определяется у 9%
пациентов с метастатическим поражением печени при злокачественных опухолях
молочной железы, бронхов и колоректальной карциноме, при гепатитах различной
этиологии (повышение при этом носит временный характер).
Определение содержания АФП в сыворотке
применяют:
для диагностики и мониторинга лечения
гепатоцеллюлярного рака;
для диагностики герминогенных опухолей;
для диагностики метастазов любой опухоли в
печень;
для скрининга в группе высокого риска (цирроз
печени, гепатит, дефицит α1-антитрипсина);
для пренатальной диагностики (пороки развития
нервного канала, синдром Дауна у плода);
для оценки степени зрелости плода [20].
Раково-эмбриональный антиген (РЭА) в сыворотке
Содержание РЭА в сыворотке:
в норме составляет 0 - 5 нг/мл;
у страдающих алкоголизмом - 7 - 10 нг/мл;
у курящих - 5 - 10 нг/мл.
РЭА - гликопротеин, формируемый при
эмбриональном развитии в желудочно-кишечном тракте. На уровень РЭА влияют
курение и в меньшей степени прием алкоголя. Небольшое повышение уровня РЭА
наблюдается у 20 - 50% больных с доброкачественными заболеваниями кишечника,
поджелудочной железы, печени и легких. Основное применение РЭА - мониторинг
развития заболевания и эффективности терапии у больных с колоректальной
карциномой. Чувствительность теста составляет при:
колоноректальном раке - 50% при концентрации
более 7,0 нг/мл;
раке печени - 33% при концентрации более 7,0
нг/мл;
раке молочной железы - 28% при концентрации
более 4,2 нг/мл;
раке желудка - 27% при концентрации более 7,0
нг/мл;
раке легких - 22% при концентрации более 7,4
нг/мл.
Уровень РЭА в сыворотке крови больных раком
толстой кишки коррелирует со стадией заболевания и служит показателем
эффективности оперативного вмешательства, химио- и лучевой терапии. РЭА может
использоваться в качестве раннего индикатора рецидивов и метастазов [17].
Повышенный уровень РЭА выявляется у 30 - 50%
больных раком молочной железы, у 33 - 36% больных раком легкого. Уровень РЭА
может повыситься при хронических заболеваниях легких, аутоиммунных
заболеваниях, но после выздоровления этот уровень нормализуется.
Содержание РЭА в сыворотке:
мониторинг течения и лечения рака прямой кишки
(повышение концентрации до 20 нг/мл - диагностический признак злокачественных
опухолей различной локализации);
мониторинг опухолей желудочно-кишечного тракта,
опухолей легких, опухолей молочной железы;
ранняя диагностика рецидивов и метастазов рака;
мониторинг в группах риска (цирроз, гепатит,
панкреатит).
Карбогидратный антиген СА-19-9 в сыворотке
Содержание СА-19-9 в сыворотке в норме - до 37
МЕ/мл.
СА-19-9 - гликопротеин, обнаруживаемый в
фетальном эпителии поджелудочной железы, желудка, печени, тонкой и толстой
кишки, легких. СА-19-9 выводится исключительно с желчью, поэтому даже
незначительный холестаз может быть причиной значительного повышения его уровня
в крови. Повышение концентрации СА-19-9 может наблюдаться также при
доброкачественных и воспалительных заболеваниях желудочно-кишечного тракта и
печени (до 100 и даже 500 МЕ/мл), при муковисцидозе. Как онкомаркер СА-19-9
имеет чувствительность 82% в случае карциномы поджелудочной железы.
СА-19-9 имеет чувствительность от 50 до 75% при
гепатобилиарной карциноме. В настоящее время СА-19-9 является вторым по
значимости маркером (после РЭА) для диагностики карциномы желудка. Его
повышение наблюдается у 42 - 62% больных раком желудка [18].
Чувствительность СА-19-9 составляет:
у больных раком поджелудочной железы - 82% при
Cut-off более 80 МЕ/мл;
у больных раком печени - 76% при Cut-off более
80 МЕ/мл;
у больных раком желудка - 29% при Cut-off более
100 МЕ/мл;
у больных колоноректальным раком - 25% при
Cut-off более. 80 МЕ/мл.
Определение содержания СА-19-9 в сыворотке
применяют:
для диагностики и мониторинга лечения рака
поджелудочной железы;
для раннего обнаружения метастазирования опухоли
поджелудочной железы;
для мониторинга рака толстой кишки, желудка,
желчного пузыря и желчных протоков.
Муциноподобный ассоциированный антиген (МСА) в
сыворотке
Содержание МСА в сыворотке в норме составляет до
11 МЕ/мл.
МСА - опухолеассоциированный антиген,
присутствующий в клетках молочной железы. Представляет собой сывороточный
муцин-гликопротеид. Концентрация МСА в сыворотке увеличивается при раке
молочной железы и у 20% больных с доброкачественными заболеваниями молочной
железы. МСА применяют для мониторинга течения карциномы молочной железы. При
уровне Cut-off 11 МЕ/мл МСА имеет специфичность 84% и чувствительность до 80% в
зависимости от клинической стадии опухоли. При сочетании его определения с
другими маркерами чувствительность не повышается. Исследование МСА применяют
для мониторинга эффективности оперативного, химио- и лучевого лечения рака
молочной железы [31].
Содержание МСА в сыворотке:
мониторинг больных раком молочной железы;
диагностика отдаленных метастазов рака молочной
железы [17].
Раковый антиген СА-125 в сыворотке
Содержание СА-125 в сыворотке в норме у здоровых
лиц составляет до 35 МЕ/мл; при беременности сроком 1 - 2 нед - до 100 МЕ/мл.
СА-125 - гликопротеин, присутствующий в серозных
оболочках и тканях. Концентрация антигена повышается при заболеваниях этих
тканей, беременности и менструации. Значительное увеличение уровня СА-125 в
крови наблюдается иногда при различных доброкачественных гинекологических
опухолях, а также при воспалительных процессах, вовлекающих придатки.
Незначительный подъем уровня этого маркера выявляется также в I триместре
беременности, при различных аутоиммунных заболеваниях, гепатите, хроническом
панкреатите и циррозе печени. Применяют главным образом для мониторинга рака
яичников и диагностики его рецидивов. При уровне Cut-off 65 МЕ/мл СА-125 имеет
чувствительность до 87% в зависимости от стадии и гистологического типа
опухоли. У 83% больных раком яичника его уровень составляет в среднем 124 - 164
МЕ/мл.
Опухоли желудочно-кишечного тракта, карцинома
бронхов и карцинома молочной железы могут также в некоторых случаях быть
причиной значительного подъема уровня СА-125.
Определение содержания СА-125 в сыворотке
применяют:
для диагностики рецидивов рака яичника;
для мониторинга лечения и контроль течения рака
яичников;
для диагностики новообразований родовых путей,
брюшины, плевры;
для диагностики серозного выпота в полости
(перитонит, плеврит);
для диагностики эндометриоза[17].
Карбогидратный антиген СА-72-4 в сыворотке
Содержание СА-72-4 в сыворотке в норме у
здоровых лиц составляет 0 - 4,0 МЕ/мл.
СА-72-4 - муциноподобный опухолеассоциированный
антиген метастазирующих опухолевых клеток. Повышение его концентрации
характерно для рака желудка, яичников и легких. Особенно высокая концентрация в
крови определяется при карциноме желудка. При уровне Cut-off 3 МЕ/мл СА-72-4
имеет специфичность 100% и предельную чувствительность 48 для карциномы желудка
при дифференциации ее с доброкачественными желудочно-кишечными заболеваниями.
СА-72-4 является полезным маркером для мониторинга течения заболевания и
эффективности терапии при карциноме желудка. Определение СА-72-4 имеет особое
значение при слизеобразующей карциноме яичника. Повышенный уровень СА-72-4
изредка обнаруживается при доброкачественных и воспалительных процессах.
Определение содержания СА-72-4 в сыворотке
применяют:
для мониторинга бронхогенного немелкоклеточного
рака легкого;
для мониторинга лечения и контроль течения рака
желудка;
для диагностики рецидивов рака желудка;
для мониторинга лечения и контроль течения
муцинозного рака яичника [28].
Раковый антиген СА-15-3 в сыворотке
Содержание СА-15-3 в сыворотке в норме у
здоровых лиц составляет до 27 МЕ/мл; в III триместре беременности - до 40
МЕ/мл.
Определение концентрации СА-15-3 используют для
мониторинга лечения и диагностики рецидивов рака молочной железы и легких [28].
Бета-хорионический гонадотропин
(β-ХГ)
в сыворотке
Содержание β-ХГ
в сыворотке в норме:
у взрослых - до 5 МЕд/л;
при беременности 7 - 10 дней - более 15 МЕд/л,
30 дней - 100 - 5000 МЕд/л, 10нед - 50000 - 140000 МЕд/л, 16 нед - 10000 -
50000 МЕд/л.
β-ХГ - гликопротеид,
выделяемый синцитиальным слоем трофобласта во время беременности. Он
поддерживает активность и существование желтого тела, стимулирует развитие
эмбриобласта. Выделяется с мочой. Обнаружение β-ХГ
в сыворотке служит методом ранней диагностики беременности и патологии ее
развития. В онкологии определение β-ХГ
используется для контроля за лечением трофобластических и герминогенных
опухолей. Период полужизни β-ХГ
- 3 дня. У мужчин и небеременных женщин патологическое повышение уровня β-ХГ
является признаком наличия злокачественной опухоли.
Чувствительность определения уровня β-ХГ
в крови:
при карциноме яичника и плаценты - 100%,
при хорионаденоме - 97%,
при несеминоматозных герминомах - 48 - 86%,
при семиноме - 7 - 14%.
Повышенный уровень β-ХГ
наблюдается у 100% больных с опухолями трофобласта и у 70% больных с
несеминоматозными опухолями яичка, содержащими элементы синцитиотрофобласта. Опухоль,
содержащая 104-105 трофобластических клеток, продуцирует 1 МЕд/л β-ХГ,
определяемого в крови или моче. Снижение уровня β-ХГ
при лечении трофобластических опухолей может служить критерием эффективности
терапии и благоприятного прогноза, поскольку подавляется рост наиболее
агрессивных элементов опухоли.
Среди плацентарных трофобластических опухолей
распространенность неинвазивной хорионаденомы составляет 1 случай на 2000
беременностей, а инвазивной хорионаденомы и хорионэпителиомы - 1 случай на
100000 беременностей.
Герминомы яичек относятся к одним из наиболее
частых онкологических заболеваний молодых мужчин (20 - 34 лет). В связи с тем,
что гистологический тип опухоли может меняться в ходе терапии, рекомендуется
проводить сочетанное определение β-ХГ
и АФП при герминомах. Семиномы, дисгерминомы и дифференцированные тератомы
всегда АФП-негативны, опухоли желчного мешка в чистом виде всегда
АФП-позитивны, в то время как карциномы или комбинированные опухоли в
зависимости от массы эндодермальных структур могут быть либо АФП-позитивными,
либо АФП-негативными. Таким образом, для термином β-ХГ
является более важным маркером, чем АФП. Совместное определение АФП и β-ХГ
особенно показано в ходе лечения термином.
Сочетанное определение АФП и β-ХГ
позволяет достичь чувствительности 86% при диагностике рецидивов
несеминоматозных опухолей яичка. Возрастающая концентрация АФП и/или β-ХГ
указывает (часто на несколько месяцев раньше других диагностических методов) на
прогрессирование опухоли и, следовательно, на необходимость изменения лечения.
Изначально высокие значения АФП и β-ХГ
в крови говорят о плохом прогнозе [24].
Антиген плоскоклеточной карциномы (SCC) в
сыворотке
Содержание SCC в сыворотке в норме - до 2 нг/мл.
Антиген плоскоклеточной карциномы представляет
собой гликопротеид с молекулярной массой 42000 дальтон. Наиболее часто
определение этого маркера применяют для мониторинга течения и эффективности
терапии плоскоклеточной карциномы шейки матки (чувствительность 70 - 85%),
носоглотки и уха. SCC является маркером выбора для мониторинга течения и
эффективности терапии плоскоклеточной карциномы шейки матки. Определение уровня
SCC в крови позволяет не только обнаружить рецидив на ранней стадии, но
отражает реакцию уже обнаруженной карциномы на проводимую терапию. Повышенный
уровень SCC выявляется в 17% случаев не мелкоклеточного рака и в 31% случаев
плоскоклеточной карциномы легких (95% специфичности). Курение не оказывает
влияния на уровень SCC [20-26].
Простатический специфический антиген (ПСА) в
сыворотке
Содержание ПСА в сыворотке в норме: у мужчин до
40 лет - до 2,5 нг/мл, после 40 лет - до 4,0 нг/мл.
ПСА - гликопротеид, выделяемый клетками эпителия
канальцев предстательной железы. В связи с тем, что ПСА образуется в
парауретральных железах, только очень малые количества его могут обнаруживаться
у женщин. Период полужизни ПСА составляет 2 - 3 дня.
Значительное повышение уровня ПСА в сыворотке
иногда обнаруживается при гипертрофии предстательной железы, а также при
воспалительных ее заболеваниях. При уровне Cut-off 10 нг/мл специфичность по
отношению к доброкачественным заболеваниям предстательной железы составляет
90%. Исследование ПСА применяют для диагностики и мониторинга лечения рака
предстательной железы, при котором его концентрация увеличивается, а также для
мониторинга состояния пациентов с гипертрофией железы в целях как можно более
раннего обнаружения рака этого органа. Уровень ПСА выше 4,0 нг/мл
обнаруживается примерно у 80 - 90% больных раком и у 20% больных аденомой
предстательной железы. Таким образом, повышение уровня ПСА в крови не всегда
свидетельствует о наличии злокачественного процесса. В нашей стране у 50%
больных доброкачественная гиперплазия предстательной железы сопровождается
хроническим простатитом. Увеличение уровня ПСА в крови у больных раком этого
органа происходит быстрее, чем у больных с доброкачественной гиперплазией.
Уровень общего ПСА более 50 нг/мл указывает на экстракапсулярную инвазию в 80%
случаев и поражение региональных лимфатических узлов у 66% больных раком
предстательной железы. Имеется корреляция между уровнем ПСА в крови и степенью
злокачественности опухоли. В настоящее время считается, что увеличение ПСА до
15 нг/мл и выше вместе с низко-дифференцированным типом опухоли в 50% случаев
указывает на экстракапсулярную инвазию и должно приниматься во внимание при
определении объема оперативного вмешательства. При значениях ПСА от 4 до 15
нг/мл частота выявления рака составляет 27 - 33%. Значения ПСА выше 4 нг/мл
отмечаются у 63% больных раком предстательной железы стадии Т1 и у 71% больных
- стадии Т2 [15-18].
Определение уровня ПСА в сыворотке применяют для
диагностики и мониторинга лечения рака предстательной железы, а также в
качестве диспансерного теста у всех мужчин старше 50 лет [16].
Свободный простатический специфический антиген
(сПСА) в сыворотке
Содержание сПСА в сыворотке в норме составляет
более 15% от общего ПСА.
Клиническая ценность определения ПСА в крови
значительно возрастает при определении различных его форм, соотношение которых
соответствует виду патологического процесса, протекающего в предстательной
железе. В сыворотке крови ПСА содержится в двух формах: свободной и связанной с
различными антипротеазами. Большая часть ПСА находится в комплексе с α1-антихимотрипсином.
Незначительная часть ПСА связана с α2-макроглобулином
и не определяется обычными ИФА методами. Уровень свободного ПСА меняется в
зависимости как от индивидуальных особенностей организма, так и от вида
заболевания предстательной железы. При раке железы в клетках опухоли не только
повышается продукция ПСА, но и значительно возрастает синтез α1-антихимотрипсина,
в результате чего увеличивается количество связанной и снижается содержание
свободной фракции ПСА при увеличении общей концентрации этого антигена. В
результате содержание свободной фракции ПСА в сыворотке крови при раке
предстательной железы значительно ниже, чем в норме и при доброкачественном
процессе. На этом основана дифференциальная диагностика рака и гиперплазии
этого органа[19].
Сущность исследования заключается в параллельном
определении общего ПСА и свободной фракции ПСА и расчете процента их
соотношения:
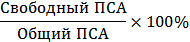
Нейронспецифическая енолаза (NSE) в сыворотке
Содержание NSE в сыворотке у здоровых лиц в
норме - до 13,2 нг/мл.- цитоплазматический гликолитический фермент,
присутствующий в клетках нейроэктодермального происхождения, нейронах головного
мозга и периферической нервной ткани. Повышение содержания NSE в сыворотке
имеет место при мелкоклеточном раке легкого и нейробластомах, лейкозах, после
лучевой и рентгенотерапии, после рентгенологического обследования. Концентрация
NSE до 20 нг/мл и более может встречаться при доброкачественных заболеваниях
легких, поэтому для клинической диагностики злокачественных заболеваний
предпочтителен выбор уровня Cut-off - более 25 нг/мл. Необходимо помнить, что
NSE присутствует в эритроцитах, поэтому гемолиз завышает результаты
исследования.тест наиболее показан для диагностики и мониторинга эффективности
терапии при мелкоклеточном раке легкого. Уровень NSE выше 25 нг/мл отмечается у
60% больных и выше 70 нг/мл - у 40% больных с мелкоклеточным раком легкого.
Сочетанное определение NSE и CYFRA-21-1 увеличивает чувствительность
диагностики карциномы легкого до 62%, в то время как при комбинации NSE и РЭА
достигается чувствительность 57%.
Уровень NSE является ценным показателем при
нейробластоме. При уровне Cut-off 25 нг/мл чувствительность по отношению к
данной опухоли составляет 85%.
Определение уровня NSE в сыворотке необходимо
для диагностики и мониторинга лечения мелкоклеточного рака легкого,
нейробластомы [15].
Фрагмент цитокератина-19 (CYFRA-21-1) в
сыворотке
Содержание CYFRA-21-1 в сыворотке у здоровых лиц
в норме до 3,3 нг/мл.
Цитокератины - нерастворимые каркасные белки. В
отличие от цитокератинов фрагменты цитокератина растворимы в сыворотке.
Цитокератины играют важную роль в дифференциации тканей. CYFRA-21-1 обладает
хорошей специфичностью по отношению к доброкачественным заболеваниям легких,
уровень Cut-off 3,3 нг/мл обеспечивает специфичность 95%. Незначительный подъем
уровня CYFRA-21-1 до 10 нг/мл обнаруживается при прогрессирующих
доброкачественных заболеваниях печени и особенно при почечной
недостаточности.-1 является маркером выбора для немелкоклеточной карциномы
легкого. При специфичности 95% CYFRA-21-1 имеет значительно более высокую
чувствительность (49%), чем РЭА (29%). Чувствительность CYFRA-21-1 при
плоскоклеточной карциноме легких заметно выше (60%), чем чувствительность РЭА
(18%). CYFRA-21-1 и РЭА обнаруживают сходную диагностическую чувствительность
(42 и 40% соответственно) при аденокарциноме легких. Сочетание этих двух
маркеров увеличивает чувствительность до 55%.-1 - наиболее эффективный из всех
известных маркеров для мониторинга течения мышечно-инвазивной карциномы
мочевого пузыря. При специфичности 95% CYFRA-21-1 имеет чувствительность 56%
для инвазивных опухолей всех стадий.
Чувствительность CYFRA-21-1 зависит от стадии
заболевания: 4% - в I стадии, более 33% - во II стадии, 36% - в III стадии и до
73% - в IVстадии рака мочевого пузыря [21].
Опухолевый антиген мочевого пузыря (ВТА) в моче
ВТА в норме в моче не обнаруживается.
Рак мочевого пузыря занимает четвертое место по
распространенности форм рака у мужчин и девятое - у женщин. Каждый пятый
пациент в настоящее время умирает от этого заболевания в течение 5 лет.
Определение ВТА в моче является скрининговым методом для диагностики рака
мочевого пузыря, а также для динамического наблюдения за пациентами после
оперативного лечения. Антиген выявляется у 70 - 80% больных при раке мочевого
пузыря в стадии Т1-Т2-ТЗ. При эффективном оперативном лечении ВТА в моче
исчезает, его появление свидетельствует о рецидиве заболевания.
Бета-2-микроглобулин в сыворотке и моче
Содержание β2-микроглобулина
в норме:
в сыворотке крови - 660 - 2740 нг/мл,
в моче - 3,8 - 251,8 нг/мл.
β2-микроглобулин (β2-МГ)
- низкомолекулярный белок поверхностных антигенов клеточных ядер. Присутствие
его в сыворотке обусловлено процессами деградации и репарации отдельных
элементов клеток. β2-МГ свободно
проходит через мембрану почечных клубочков, 99,8% его затем реабсорбируется в
проксимальном отделе почечных канальцев. Период полураспада β2-микроглобулина
составляет приблизительно 40 мин. Уменьшение клубочковой фильтрации
способствует повышению уровня β2-МГ
в сыворотке крови, нарушение функции почечных канальцев приводит к экскреции
больших количеств β2-МГ с мочой.
Верхний предел реабсорбционной способности почечных канальцев достигается при
концентрации β2-МГ в сыворотке 5000
нг/мл. К состояниям, при которых повышается уровень сывороточного β2-МГ,
относятся: аутоиммунные заболевания, нарушения клеточного иммунитета (например,
пациенты со СПИДом), состояния после трансплантации органов [23].
Концентрация β2-микроглобулина
в крови повышается при почечной недостаточности, острых вирусных инфекциях,
иммунодефицитах, в том числе СПИДе, аутоиммунных заболеваниях, гемобластозах
(В-клеточных), миеломе, острых лейкозах и лимфомах с поражением ЦНС.
Концентрация β2-микроглобулина
в моче повышается при диабетической нефропатий, интоксикации тяжелыми металлами
(соли кадмия).
2.1 Алгоритм исследования на онкомаркеры (ОМ)
Специфичность ОМ - процент здоровых лиц и
больных с доброкачественными новообразованиями, у которых тест дает
отрицательный результат.
Чувствительность ОМ - процент результатов,
которые являются истинно положительными в присутствии данной опухоли[25].
Пороговая концентрация (Cut-off) - верхний
предел концентрации ОМ у здоровых лиц и больных незлокачественными
новообразованиями.
Факторы, влияющие in vitro на уровень ОМ в крови:
условия хранения сыворотки (нужно хранить в
холоде);
время между взятием образца и центрифугированием
(не более 1 ч);
гемолизированная и иктеричная сыворотка
(повышается уровень нейроспецифической енолазы - НСЕ);
контаминация образца (повышается уровень раково-эмбрионального
антигена - РЭА и карбогидратного антигена - СА-19-9);
прием лекарственных препаратов (повышают уровень
простатического антигена - ПСА: аскорбиновая кислота, эстрадиол, ионы 2- и
3-валентных металлов, аналоги гуанидина, нитраты, митамицин).
Факторы, влияющие in vivo на уровень ОМ в крови:
продукция опухолью ОМ;
выделение в кровь ОМ;
масса опухоли;
кровоснабжение опухоли;
суточные вариации (взятие крови на исследование
в одно и то же время);
положение тела в момент взятия крови;
влияние инструментальных исследований
(рентгенография повышает НСЕ, колоноскопия, пальцевое исследование - ПСА;
биопсия - α-фетопротеина -
АФП);
катаболизм ОМ - функционирование почек, печени,
холестаз;
алкоголизм, курение.
Определение ОМ в клинической практике:
дополнительный метод диагностики онкологических
заболеваний в комбинации с другими методами исследований;
ведение онкологических больных - мониторинг
терапии и контроль течения заболевания, идентификация остатков опухоли,
множественных опухолей и метастазов (концентрация ОМ может быть повышена после
лечения за счет распада опухоли, поэтому исследование проводить спустя 14 - 21
дней после начала лечения);
раннее обнаружение опухоли и метастазов
(скрининг в группах риска - ПСА и АФП);
Схема назначения исследований ОМ:
определить уровень ОМ перед лечением и в
дальнейшем исследовать те онкомаркеры, которые были повышены;
после курса лечения (операции) исследовать через
2 - 10 дней (соответственно периоду полужизни маркера) с целью установления
исходного уровня для дальнейшего мониторинга;
для оценки эффективности проведенного лечения
(операции) провести исследование спустя 1 мес;
дальнейшее изучение уровня ОМ в крови проводить
с интервалом в 3 мес в течение 1 - 2 лет, далее с интервалом 6 мес в течение 3
- 5 лет;
проводить исследование ОМ перед любым изменением
лечения;
определить уровень ОМ при подозрении на рецидив
и метастазирование;
определить уровень ОМ через 3 - 4 нед после
первого выявления повышенной концентрации [16].
Для рационального использования опухолевых
маркеров необходимо, чтобы получаемая в результате тестирования информация была
не только сама по себе корректной, но и представляла практическую ценность
[28].
Заключение
Методы морфологической диагностики опухолей, начиная
с традиционных гистологии и цитологии и кончая современными
молекулярно-генетическими методами, включая ПЦР, позволяет практически во всех
случаях точно идентифицировать гистогенетическую принадлежность
новообразования, степень его злокачественности и дать достаточно достоверную
прогностическую оценку. Все это необходимо для выработки адекватной тактики
лечения, согласно разработанным международным протоколам. Наиболее
перспективным направлением с точки зрения морфологической диагностики опухолей
является объединение методов полимеразной цепной реакции и гибридизации in situ
в один метод полимеразной цепной реакции in situ.
К маркерам злокачественного роста относятся
вещества разной природы: антигены, гормоны, ферменты, гликопротеины, липиды,
белки, метаболиты. Синтез маркеров обусловлен особенностями метаболизма раковой
клетки, которые обеспечивают ее автономность, агрессивность роста, способность
к метастазированию. Анормальная экспрессия генома - один из основных механизмов
продукции маркеров опухолевыми клетками, который обусловливает синтез
эмбриональных, плацентарных и эктопических ферментов, антигенов и гормонов.
Известен широкий спектр маркеров при различных локализациях рака, однако лишь
единичные могут в какой-то мере соответствовать понятию «идеальный маркер»
[27].
Диагностическая значимость опухолевого маркера
зависит от его чувствительности и специфичности. Пока не существует опухолевых
маркеров, отвечающих определению идеальных, т.е. маркеров с почти 100%
специфичностью (не обнаруживаемых при доброкачественных заболеваниях и у
здоровых людей) и 100% чувствительностью (обязательно выявляемых даже на ранних
стадиях развития опухоли). При исследовании онкомаркеров большое значение имеет
такое понятие, как Cut-off (отсекающий уровень). Cut-off представляет собой
допускаемую верхнюю границу концентрации опухолевого маркера у здоровых людей и
у пациентов с доброкачественными опухолями. Если ставится задача выявить как
можно больше пациентов с опухолями, Cut-off должен быть установлен на низком уровне
для увеличения чувствительности, ценой неизбежного увеличения процента
ложноположительных результатов (уменьшения специфичности). Если необходимо
увеличить вероятность соответствия положительного результата теста наличию
опухоли, Cut-off следует установить на высоком уровне для увеличения
специфичности за счет увеличения процента ложноотрицательных результатов [21].
Таким образом, на основании вышесказаного можно
сделать следующие выводы:
Был проведен обзор и обобщение научной
литературы об основных принципах метода ПЦР, его огромное значение в
клинической диагностике.
Провели анализ данных литературы о перспективах
применения метода ПЦР в диагностике онкологических заболеваний.
Систематизировали данные литературы об основных
онкомаркерах в диагностике методом ПЦР. Выделили следующие основные
онкомаркеры:
Альфа-фетопротеин (АФП)
Раково-эмбриональный антиген (РЭА)
Карбогидратный антиген СА-19-9
Муциноподобный ассоциированный антиген (МСА)
Раковый антиген СА-125
Карбогидратный антиген СА-72-4
Раковый антиген СА-15-3
Бета-хорионический гонадотропин
(β-ХГ)
Антиген плоскоклеточной карциномы (SCC)
Простатический специфический антиген (ПСА)
Свободный простатический специфический антиген
(сПСА)
Нейронспецифическая енолаза (NSE)
Фрагмент цитокератина-19 (CYFRA-21-1)
Опухолевый антиген мочевого пузыря (ВТА)
Бета-2-микроглобулин (β2)
Список использованных источников
Абелев
Г. И. Альфа-фетопротеин: биология, биохимия, молекулярная генетика //
Иммунология.- 1993.- №3.- C. 4-10.
Арцимович
И. Г., Ломакин И. С.. Казинский Д. В., Настоящая Н.Н. Биологически активные
молекулы, ассоциированные с клетками печени // Успехи современной биологии.-
1991,- Т. III. вып.6,- С.932- 947.
Хансон
К.П. Перспективы молекулярной диагностики в онкологии, - С. Петербург, 1999. -
С. 2 - 5.
Херсонская
А.М., Амон Е.П. Типовые ошибки при диагностике методом ПЦР // Справочник
заведующего КДЛ 2008. - №5- С.30-36
Шевцова
А. И. Альфа-фетопротеин: биохимические свойства, функции и
клинико-диагностическое значение// Укр. биохим. журн., 1995-Т.67, №6.- С.11-
20.
Медицинская
лабораторная диагностика / под редакцией А. И. Карпищенко, - С.-Петербург:
Интермедика, 1997. -304 с.
Четверина
Е.В., Четверин А.Б. Наноколонии: обнаружение, клонирование и анализ
индивидуальных молекул // Успехи биол. химии. - 2008. Т. 48. С. 3-10
Ллуэлин
М.Б. Молекулярная клиническая диагностика //. М.: Мир; 1999. 19 с.
Маккерди
Б.Дж., Чимера Д.А. Обнаружение и идентификация паттогенных микроорганизмов
молекулярными методами. // Мол. Клиническая диагностика.. М.; Мир ,1999.
С.63-75
Щербо
С.Н. ПЦР в клинической лабораторной диагностике: реальности и перспективы
//Справочник заведующего КДЛ 2006. - №10- С. 45-48
Тарасенко
И.М. Правила организации работы КДЛ с патогенными биологическими агентами //
Справочник заведующего КДЛ 2007. - №6- 78с.
Ивлев
А. С., Селюжинский И. В., Кижаев Е. В. и др. Клинико-диагностическое значение
опухолеассоциированных антигенов (опухолевых маркеров)/ Методич. рекомендации.
- М.: Б. И., 1992. - 32 с.
Винницкий
В. Б., Мосиенко Л\.Л., Глинских Г. В. и др. Биология маркеров рака и
беременности.- Киев: Наук. думка, -1990. - 252 с.
Херсонская
А.М. Современные методы клинической диагностики: ПЦР в режиме реального времени
// Дис. работа заведующего КДЛ 2007. №11 с.31-36
Камышников
В.С. Онкомаркеры: методы определения, референтные значения, интерпретация
тестов / МЕДпресс-информ, 2012. - 3-е изд. - 128 с. : ил. ISBN
978-5-98322-872-6
Чухловин.А.Б.
Метод ПЦР в клинической лабораторной диагностике // Дис. Работа заведующего
КДЛ. 2008. - №4 -С.46-50
Маркеры
цитолиза и печеночноклеточных некрозов // Подымова С.Д. Болезни печени. - М.:
Медицина, 1993.- С. 79- 84.
Медицинская
лабораторная диагностика / под редакцией А. И. Карпищенко, - С.-Петербург:
Интермедика, 1997. -304 с.
Татаринов
Ю. С. Трофобластический бета-гликопротеин // Успехи современной биологии.-
1983.- Т. 95, вып. 1.- С. 57-64.
Гинцбург
А.Л. Генодиагностика инфекционных заболеваний // Журн. Микробиол. Эпидем.
Иммунобиол. 1998. - № 3. - С. 86 - 95.
Carter
H.B., Rearson Y.D. et al. Longitudinal evaluation of
prostate-specific antigen in men with and without prostate disease. JAMA ,1992;
- 267: -2215-20 р.
Bon
G.G. Clinical relevance of the tumor marker CA 15-3 in the management of cancer
patients. Acad Press, Netherlands 1990; 111-2 р.P.,
Tseng L., Brioschi P.A. et al. Cancer antigen 125 is produced
by human endometrial stromal cells. Hum Reprod 1986; -7: 423-62 р.
Четверин
А.Б., Четверина Е.В. Научные и практические приложения молекулярных колоний //
Молекуляр. Биология, 2007. -Т. 41. - С. 84-96.
Алексеева
М.Л., Гусарова Е.В., Понкратова Т.С., Муллабаева С.М. Онкомаркеры, их
характеристика и некоторые аспекты клинико-диагностического использования //
РАМН, Москва.,2005. -79 с.
Алексеева
М.Л., Фанченко Н.Д., Новиков Е.А. и др. Опухолевые маркеры в гинекологии./
Акуш. и гин., 1995; - 5: 14с.
Алексеева
M.JI., Щедрина Р.Н., Фанченко Н.Д. и др. СА 125 при беременности / Пробл.
Репрод., 1996; 4: 31-40.
Гаврилова
Ю. Значение определения уровней онкомаркеров СА 125, СЕА, СА 19-9 при
эндометриозе в ближайшие и отдаленные сроки после операционного лечения. //
Тез. докл. V всероссийского форума «Мать и дитя», 2003, -101 с.
Иевлева
Е.С., Пугачей К.К., Демидов В.П. Опухолевые маркеры и рак молочной железы.
Материалы семинара «Диагностические аспекты применения ИФА тест-систем», 1996;
-С. 44-56.Y.S., Knapp R.C., Malakasian G.D. et al. CA 125 serum levels
correlated with second look operations among ovarian cancer patients. Obstet
Gynecol, 1986; -67: 685-9 . полимеразная цепная
реакция онкомаркер
Armbruster
D. Prostate-specific antigen - biochemistry, analytical methods and clinical
application. Clin Chem, 1993; 39: 181-95 .L. V, Alexeeva M.L., Kulakov VI. et
al. Cancer
antigens С A 125, CA 19-9, CEA in monitoring of the combined treatment of
severe genital endometriosis using GNRH-agonists. Gynecol Endocrinol 1996; 10:
97-100.
Abelev
G.L. Study of the regulation of alpha-fetoprotein synthesis in ontogenesis and
carcinogenesis. Sov Sci Rev Sect D Biol Rev NY 1980; 1: 371-97.