Магнитные наночастицы, как средство влияния на релаксационные свойства водородосодержащих биологических сред
Оглавление
Введение
. Обзор литературы
.1 Наночастицы магнетита, их свойства и возможности
использования в фармакологии и медицине
.1.1 Наночастицы магнетита, основные свойства
.1.2 Магнитные свойства НЧОЖ. Суперпарамагнетизм и
ферримагнетизм
.2 Протонная релаксометрия
.3 Применение наночастиц магнетита в качестве основы для
контрастного средства при МРТ диагностике
.3.1 Метод МРТ-диагностики
.3.2 Клиническое применение МРТ
.3.3 Показаниями для проведения МРТ с контрастным средством
.3.4 Противопоказания к МРТ
.4 Классификация магнитно-резонансных контрастных средств
.5 Взаимодействие наночастиц оксида железа с клетками. Роль
стабилизации
. Материалы и методы
.1 Методика экспериментального исследования
.2 Исследуемые соединения и реактивы
.3 Методика получения суперпарамагнитных и ферримагнитных
наночастиц сложного оксида железа
2.4 Просвечивающая электронная микроскопия
2.5 Измерения протонно-релаксационных свойств НЧОЖ
.6 Клеточная культура фибробластов крысы
2.7 МТТ-тест
2.8 Методы статистической
обработки данных
3. Результаты и их обсуждение
.1 Синтез растворов на основе наночастиц
.2 Анализ кривых спада времен релаксации
3.3 Оценка влияния соединений железа на жизнеспособность
фибробластов МТТ-тестом
Выводы
Список литературы
Список сокращений
SPIO -
суперпарамагнитный оксид железа
НЧОЖ - наночастицы оксида железа
ЯМР- ядерно-магнитный резонанс
МРТ - магнитно-резонансная томография
МРВ - магнитно-резонансная визуализация
МРКС - магнитно-резонансные контрастные средства
РЭС - ретикуло-эндотелиальная система
ГЭБ - гемато-энцефалический барьер
РЧИ - радиочастотный импульс
RV-
резовист
Введение
На сегодняшний день невозможно представить современную медицину без
лучевой диагностики, включающую в себя протонно-эмиссионную томографию,
рентгеновскую и магнитно- резонансную томографию (МРТ). Внедрение в клиническую
практику метода МРТ позволило вывести диагностические возможности медицины на
качественно новый уровень. За свои работы по изучению магнитно-резонансной
визуализации (МРВ) Пол С. Латербур и Питер Менсфилд получили Нобелевскую премию
в 2003 году[44].
Оптимизация результатов диагностической картины достигается
использованием магнитно-резонансных контрастных средств (МРКС). Визуализация с
применением контрастного средства позволяет значительно увеличить объем
диагностической информации, позволяя оценивать динамику патологических
процессов с необходимыми временными и пространственными разрешениями, повысить
разрешение и контрастность при анализе малых объектов, достоверно отличить
очаги патологий от здоровых тканей[57]. Основными областями применения
контрастных средств являются диагностика и идентификация онкологических
образований, в том числе метастазирования, а также заболеваний
сердечно-сосудистой системы.
На настоящий момент используются парамагнитные контрастные средства,
содержащие гадолиний, имеющие ряд недостатков: токсичность и визуализация
объектов только по одному основному параметру Т1(время спин-решеточной
релаксации)[26]. В связи с чем, актуальным является разработка нового
контрастного средства для МРТ - диагностики, превосходящего по функциональным
свойствам уже существующие препараты.
Альтернативным контрастным средством может служить препарат,
синтезированный с применением современных нанотехнологий, на основе
суперпарамагнитных частиц сложного оксида железа - магнетита. Наночастицы
магнитных материалов, с размером частиц соизмеримым с размером магнитного
домена, при внесении их во внешнее магнитное поле, выстраиваются в нем без
энергетических потерь на междоменное взаимодействие, что позволяет значительно
повлиять на характерные времена протонной релаксации исследуемых сред и
ключевые параметры для магнитно-резонансной визуализации. Требованием,
предъявляемым к новому контрастному средству, кроме достижения необходимых
релаксационных свойств, является биологическая совместимость используемых
наночастиц с основными тканями организма, а также длительная стабильность
водного раствора на их основе[43]. Анализ литературных данных показал, что
основные свойства наночастиц, а также растворов на их основе, определяются их
размером, который контролируется выбором метода и режимов их синтеза [3].
Необходимо учитывать, что практическое применение принципиально нового
контрастного средства может потребовать корректировку существующих МРТ -
методик анализа очагов патологий [31].
В связи с выше изложенным, целью данной работы является получение
коллоидных растворов, содержащих наночастицы оксида железа различных размеров,
и исследование их протонно-релаксационных свойств.
Для достижения данной цели были поставлены следующие задачи:
) Определить режимы метода химического синтеза наночастиц сложного
оксида железа с учётом требований к их функциональным свойствам.
) Определить релаксирующую способность полученных растворов
наночастиц оксида железа.
) Определение цитотоксичности раствора наночастиц сложного оксида
железа с помощью МТТ- теста.
1. Обзор литературы
.1 Наночастицы магнетита, их свойства и возможности использования в
фармакологии и медицине
.1.1 Наночастицы магнетита, основные свойства
Сложный оксид железа - магнетит Fe3O4 (FeO х Fe2O3) относится к классу
веществ называемых ферритами, в структуре которого ионы кислорода образуют
кубическую гранецентрированную решетку, где на один двухвалентный ион железа
приходятся два трехвалентных иона железа[34].В результате образуются две
магнитных подрешетки - одна из которых состоит из половины трехвалентных ионов
железа, а вторую составляют оставшаяся половина его трехвалентных и
двухвалентных ионов( рис.1).
Рис 1. Строение кристаллической решетки Fe3O4.
А. Красные шары - O2-, фиолетовый шар - Fe2+.
Б. Красные шары -O2-,
зеленые шары - Fe3+.
В. Четыре узла А и четыре узла Б формируют элементарную ячейку кристалла
магнетита.Г. Взаимная ориентация векторов магнитных спинов ионов Fe3+ и Fe2+.
Зеленые шары - Fe3+. Фиолетовый шар - Fe2+.
Магнитные моменты подрешеток направлены антипараллельно, поэтому
магнитные моменты трехвалентных ионов компенсируются, а моменты двухвалентных
образуют спонтанную намагниченность. Материалы с некомпенсированным антиферромагнетизмом
относят к классу ферримагнетиков. Магнитный домен магнетита обычно составляет 8
молекул оксида железа, суммарный магнитный момент которого близок к суммарному
моменту отдельных ионов. Магнетит характеризуется достаточно высокой
температурой Кюри (температура плавления)- 850 К, а при температуре 123 К, в
результате изменения кристаллической структуры, магнетит испытывает переход
Вервея (переход металл-изолятор)[36].
Четыре узла А и четыре узла Б формируют элементарную ячейку кристалла
магнетита.
Согласно законам термодинамики формирование упорядоченной системы требует
затрат энергии и связано с уменьшением энтропии, а значит требует воздействий
на систему внешних сил и не должно протекать самопроизвольно. Кристаллическая
структура магнетита такова, что в результате сложных взаимодействий
электрической и магнитной природы, между атомными носителями магнетизма
возникает положительная обменная энергия, и становится выгодным параллельное
расположение магнитных моментов. В результате возникает некий вектор
намагниченности у каждого отдельного домена. При размере наночастиц,
сопоставимым с размером домена 5-20 нм, получаем однородно намагниченную
однодоменную частицу, обладающую оптимальными магнитными свойствами, вследствии
отсутствия междоменного взаимодействия при внесении частицы во внешнее
магнитное поле[34]. В случае массивного материала из-за разнонаправленности
отдельных доменов их вектора компенсируются и при отсутствии внешнего
магнитного поля суммарная намагниченность материала равна нулю. Системы малых
частиц магнетита, находящихся в немагнитной матрице, обладают парамагнитными
свойствами, а в случае однодоменного состояния - суперпарамагнитными. [6].
Поведение суперпарамагнитных веществ во внешнем магнитном поле
существенно отличается от обычных парамагнетиков и ферромагнетиков. При
воздействии внешнего поля каждый отдельный магнитный домен принимает тоже
направление, что и внешнее поле [37]. В таких системах потери при поглощении и
испускании исследуемой средой энергии внешнего магнитного поля сводиться к
минимуму, что делает их идеальной основой для магнитно - резонансного
контрастного средства при МРТ- исследованиях. Намагниченность
суперпарамагнетиков, связанная с поведением спинов отдельных атомов и
отсутствия влияния междоменных стенок, в некоторых случаях, во много раз больше
намагниченности обычных парамагнетиков. В случае наночастиц магнетита, со
средним размером, около 30-50 нм, они обладают ярко выраженными ферримагнитными
свойствами, при этом, при попадание во внешнее магнитное поле определенной
частоты они, накапливая энергию, нагреваются до пороговой температуры,
соответствующей переходу из ферримагнитного состояния в немагнитное. Это
свойство ферримагнитных наночастиц магнетита возможно использовать при лечение
онкологических заболеваний.
Исследования показали, что поведение наночастиц, при введение их в
организм через кровоток, также существенно зависят от размера объекта. Частицы
со средним размером 30-50 нм активно поглощаются клетками
ретикулоэндотелиальной системы (РЭС) и достаточно быстро накапливаются в печени
и лимфатических узлах. В отдельных случаях, с целью увеличения времени
циркуляции наночастиц их поверхность специально модифицируют, например
полиэтиленгликолем. Однако, наночастицы с размером 5-10 нм, как свидетельствуют
публикации, длительно циркулируют в кровотоке и поглощаются в очаге
онкологических заболеваний[51]. Обнаружено, что наночастицы размером 5-10 нм
обладают возможностью проникновения через ГЭБ, что открывает большие
возможности для применения их при диагностики и лечения патологий головного
мозга.
Практический интерес представляют суперпарамагнитные и ферримагнитные
наночастицы оксида железа. Возможности применения наночастиц магнетита, а также
наносистем на его основе, непосредственно опираются на его физические и
фармакологические свойства[52].
.1.2 Магнитные свойства НЧОЖ. Суперпарамагнетизм и ферримагнетизм
Суперпарамагнетизм - квазипарамагнитное поведение веществ во внешнем
магнитном поле, состоящих из очень малых ферро- или ферримагнитных частиц, слабо
взаимодействующих друг с другом, и ведущих себя во внешнем магнитном поле как
отдельные атомы[35]. Гистерезис в таких структурах отсутствует. Внешнее поле
ориентирует магнитные моменты частиц по полю без изменения направления самих
частиц, в то время как, например, у парамагнитных газов магнитные моменты
переориентируются вместе с их носителями. Необходимым условием существования
суперпарамагнетизма является соизмеримость геометрического размера частицы с
размером магнитного домена (3-10 нм), так как при этом удается избежать влияния
междоменных стенок (стенок Блоха). Этот эффект возможен только в системах на
основе наночастиц.
При воздействии внешнего магнитного поля каждый отдельный магнитный домен
принимает тоже направление, что и внешнее поле. Отсутствие магнитного
гистерезиса приводит к тому, что потери при поглощении и испускании,
исследуемой средой энергии внешнего магнитного поля, сводиться к минимуму[55].
Относительное увеличение размера наночастиц таких материалов до 30-50 нм,
приводит к наличию у них ярко выраженных ферримагнитных свойств, причем в
некоторых случаях наблюдается рост намагниченности таких наночастиц по
сравнению с массивным аналогом. Рассматривается возможность использовать такие
частицы для осуществления адресной доставки лекарственных средств в очаги
заболевания, путем локализации магнитных наночастиц с помощью внешнего
магнитного поля, а также для профилактики и лечения онкологических
заболеваний[54]. Особый интерес представляет применение ферримагнитных
наночастиц в терапевтических методах лечения, связанных с применением стволовых
клеток при лечении ими различных заболеваний. С помощью таких наночастиц можно
обеспечить доставку клеток в очаги заболеваний, контроль миграции при введение
в организм и предварительную сепарацию[51].
.2 Протонная релаксометрия
При
описании ядерной магнитной релаксации пользуются моделью, в которой магнитные
моменты, или спины, отдельных ядер составляют в своей совокупности спиновую
систему данного вещества. Спиновая система имеет температуру, в общем случае
отличающуюся от температуры ее окружения («решетки») или температуры данного
вещества. Такая модель позволяет рассматривать два не зависящих друг от друга
процесса: обмен энергией внутри спиновой системы (спин-спиновая релаксация) и
обмен энергией между спиновой системой и решеткой (спин-решеточная
релаксация)[32]. Первый процесс обеспечивает восстановление нарушенного
каким-либо образом термодинамического равновесия внутри спиновой системы, тогда
как второй процесс - восстановление термодинамического равновесия между
спиновой системой и решеткой. Каждый из этих процессов протекает во времени с
некоторой определенной скоростью и характеризуется своей постоянной - временем
спин-спиновой релаксации Т2 и временем спин-решеточной релаксации Т1.
Обратные величины этих времен являются мерой скорости соответствующей
релаксации, причем всегда 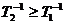 [30].
[30].
Термодинамическое
равновесие в простейшей спиновой системе, состоящей из ядер одного сорта со
спинами I=1/2, характеризуется больцмановским распределением населенностей этих
ядер по двум спиновым уровням с магнитными квантовыми числами m1=+1/2 и m1=-1/2.
Энергии этих спиновых уровней отличаются друг от друга только в том случае,
когда спиновая система находится в постоянном магнитном поле. В отсутствие
такого поля спиновые уровни вырождены и их энергии имеют одинаковую величину.
Очевидно,
что в тот момент, когда вещество помещают в магнитное поле, вырождение
снимается, и происходит нарушение больцмановского распределения населенностей
уровней и, следовательно, термодинамического равновесия в спиновой системе,
поскольку такое распределение не устанавливается мгновенно, а происходит с
постоянной времени, равной времени ядерной магнитной релаксации.
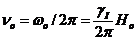 (1.1)
(1.1)
где 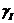 - гиромагнитное отношение ядер, составляющих спиновую
систему вещества.
- гиромагнитное отношение ядер, составляющих спиновую
систему вещества.
Под действием частоты 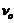 в спиновой системе происходят энергетические переходы между
ядерными уровнями, в результате которых нарушается больцмановское распределение
населенностей этих уровней. После прекращения действия импульса, заполненного
частотой
в спиновой системе происходят энергетические переходы между
ядерными уровнями, в результате которых нарушается больцмановское распределение
населенностей этих уровней. После прекращения действия импульса, заполненного
частотой 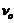 , спиновая система самопроизвольно
возвращается к больцмановскому распределению населенностей уровней или к
термодинамическому равновесию за счет процесса ядерной магнитной релаксации.
При этом в приемной катушке импульсного спектрометра ЯМР индуцируется
электрический сигнал, пропорциональный ядерной намагниченности. Этот сигнал
наблюдается с помощью регистрирующих устройств в течение времени сохранения
фазовой когерентности между отдельными ядерными магнитными моментами,
сравнимого со временем спин-спиновой релаксации.
, спиновая система самопроизвольно
возвращается к больцмановскому распределению населенностей уровней или к
термодинамическому равновесию за счет процесса ядерной магнитной релаксации.
При этом в приемной катушке импульсного спектрометра ЯМР индуцируется
электрический сигнал, пропорциональный ядерной намагниченности. Этот сигнал
наблюдается с помощью регистрирующих устройств в течение времени сохранения
фазовой когерентности между отдельными ядерными магнитными моментами,
сравнимого со временем спин-спиновой релаксации.
Собственно процесс релаксации происходит за счет взаимодействий каждого
ядерного магнитного момента в спиновой системе с локальным магнитным полем hl (t), которое создается соседними с данным ядром ядерными и
электронными магнитными моментами и токами. Величина локального магнитного поля
постоянно модулируется (флуктуирует) под влиянием случайного теплового движения
молекул и атомов, составляющих решетку данного вещества[47].
Флуктуации локального магнитного поля содержат компоненты многих частот,
но процесс ядерной магнитной релаксации вызывает только та компонента, частота
которой равна 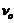 .
.
Практически все современные методы магнитно-резонансной визуализации
(МРВ) или магнитно-резонансной томографии (МРТ) основываются на получении
сигнала от ядер водорода живых систем (гиромагнитное отношение протонов
1H=42,58 МГц/Тл). Они широко представлены в любом биологическом объекте в высокой
концентрации (относительная распространенность изотопа 99,98%) .
Когда атомные ядра помещаются в магнитное поле, они могут поглощать
радиоволны соответствующих частот, зависящих от типа ядер, величины магнитного
поля, физического и магнитного окружения ядер, что является основой явления
магнитного резонанса, используемого для получения МР-визуализации[56].
Для протонов в магнитном поле существуют два движения прецессии или
конуса прецессии, сориентированные вдоль направления силовых линий магнитного поля.
Первый - для ядер в состоянии с низкой энергией (стабильное состояние), и
другой - в противоположном направлении - для ядер в состоянии высокой энергии
(нестабильное состояние).Частота движения прецессии определяется из следующего
уравнения, называемого уравнением Лармора[39]:
= г * Bо
где f - частота Лармора (единица измерения МГц), г - гиромагнитное
отношение (единица измерения МГц/Тесла), которое в соответствии с названием
является механическим магнитным свойством ядра и зависит от типа ядра, Во
- вектор индукции магнитного поля. Реальная живая ткань содержит большое число
ядер. Таким образом, мы наблюдаем суммарный эффект от всех микроскопических
событий, который эквивалентен одному большому магнитному моменту Мо, величина
которого равна сумме величин от индивидуальных ядер, направленных вдоль
внешнего магнитного поля Во. Направление и величина этого магнитного момента не
изменяются во времени, если на ткань не действует радиочастотный импульс (РЧИ).
После облучения РЧИ соответствующей частоты, суммарная намагниченность
протонсодержащего объекта, (М0) отклоняется от своего равновесного положения.
Для возбуждения спиновой системы более эффективно воздействие радиоволнами
большой интенсивности в короткий промежуток времени (импульсный магнитный резонанс).
Частота радиоволн должна быть равна или близка частоте Лармора. Импульс,
отклоняющий М0 на 900 в плоскость XY, называется 90-градусным импульсом
(1800-РЧИ). При облучении импульсом, как правило, удвоенной длительности,
называемым 180-градусным импульсом (1800-РЧИ), намагниченность изменяет свое
направление на противоположное, т. е. инвертируется.
При прекращении действия поля 1H спиновая система самопроизвольно
возвращается к больцмановскому распределению населенностей уровней или к
термодинамическому равновесию за счет процессов ядерной магнитной релаксации
[45]. Сигнал, получаемый от объекта в однородном магнитном поле после
воздействия РЧИ, называется сигналом затухания свободной индукции (ССИ).
Процесс перехода из возбужденного состояния в равновесное называется
спин-решеточным (продольным) релаксационным процессом. Он характеризуется
временем спин-решеточной релаксации T1. Т1 характеризует постоянную времени, с
которой спины протонов стремятся вернуться к направлению магнитного поля.
Намагниченность в направлении z, начиная с нуля, за время, равное Т1, достигнет
63% своей конечной максимальной величины.
После возбуждения РЧ-импульсами спины ведут себя как когерентная система,
т.е. все микроскопические составляющие намагниченности прецессируют в одной
фазе вокруг направления внешнего магнитного поля. Однако, в результате
статистической неоднородности магнитных полей между спинами происходит потеря
фазовой когерентности из-за различия в частотах Лармора. Поскольку спины
постепенно расфокусируются, сигнал магнитного резонанса с течением времени
уменьшается. Этот процесс характеризуется спин-спиновым (поперечным) временем
релаксации T2, т.е. время, за которое намагниченность в плоскости XY теряет 69%
от своей первоначальной величины.
Рис. 2. Поперечное время релаксации.
Где MXY
- Временная константа,
описывающая поведение поперечной намагниченности
Т2- время необходимое для уменьшения поперечной намагниченности с
коэффициентом е.
.3 Применение наночастиц магнетита в качестве основы для контрастного средства
при МРТ диагностике
.3.1 Метод МРТ-диагностики
Магнитно-резонансная томография (МРТ) является одним из современных
методов лучевой диагностики, позволяющим неинвазивно получать изображения
внутренних структур тела человека. Важнейшим преимуществом МРТ по сравнению с
другими методами лучевой диагностики является отсутствие ионизирующего
излучения и, как следствие, эффектов канцеро- и мутагенеза, с риском
возникновения которых сопряжено (хотя и в очень незначительной степени)
воздействие рентгеновского излучения [41]. Устаревшее название метода
“ядерно-магнитно-резонансная томография” (ЯМРТ) в настоящее время не
используется, чтобы избежать неправильных ассоциаций с ионизирующим излучением.
МРТ позволяет проводить исследование в любых плоскостях с учетом анатомических
особенностей тела пациента, а при необходимости - получать трехмерные
изображения для точной оценки взаиморасположения различных структур [16,17].
МРТ обладает высокой мягкотканной контрастностью и позволяет выявлять и
характеризовать патологические процессы, развивающиеся в различных органах и
тканях тела человека [49]. Более того, МРТ является единственным методом
неинвазивной диагностики, обладающим высокой чувствительностью и специфичностью
при выявлении отека и инфильтрации костной ткани [42]. Развитие
МР-спектроскопии и диффузионной МРТ, а также создание новых органотропных
контрастных препаратов является основой развития “молекулярной визуализации” и
позволяет проводить гистохимические исследовании in vivo.
1.3.2 Клиническое применение МРТ
Исторически первым применением МРТ было исследование головного мозга,
открывшее новые горизонты в диагностике неврологических заболеваний [57]. МРТ
оказалась единственным методом, позволяющим визуализировать бляшки рассеянного
склероза и определить наличие активной воспалительной демиелинизации [40]. На
сегодняшний день МРТ стала основным методом нейровизуализации [38], оттеснив на
второй план КТ. Современные методики МР-обследования головного мозга, доступные
на высокопольных томографах, позволяют получить информацию о кровотоке на
капиллярном уровне, количественно оценить движение молекул воды через мембраны
клеток, определить концентрацию метаболитов, таких как N-ацетиласпартат,
лактат, холин, мио-инозитол, в веществе мозга или измерить pH ткани мозга
визуализировать ход проводящих путей головного мозга, картировать
функциональные зоны коры головного мозга.
Основным преимуществом МРТ в травматологии и ортопедии по сравнению с
рентгенологическим исследованием и КТ является возможность визуализации мягкотканных
структур, в том числе внутрисуставных связок, менисков, синовиальных складок. В
целом ряде исследований было показано, что МРТ позволяет выявлять инфильтрацию
и деструкцию костной ткани, замещение костного мозга задолго до появления
рентгенологических (в том числе КТ) признаков. По этой причине МРТ является
методом выбора для ранней диагностики аваскулярного некроза головок бедренных
костей, стрессовых и рентгенологически скрытых переломов [46].
МРТ органов брюшной полости может проводиться только на высокопольных
томографах, причем наилучшее качество томограмм достигается при томографии с
задержкой дыхания . МРТ является методом выбора для дифференциальной
диагностики образований паренхиматозных органов брюшной полости и забрюшинного
пространства.
В настоящее время МРТ является наиболее информативным методом в
диагностике и дифференциальной диагностике очаговых поражений печени -
метастазов, гемангиом, аденом, фокальной узловой гиперплазии,
печеночно-клеточного рака и других опухолей. МРТ позволяет с высокой точностью
дифференцировать злокачественные и доброкачественные образования надпочечников
с помощью специальных протоколов, высокочувствительных к наличию
внутриклеточного жира в аденомах. МРТ хорошо выявляет солидные и кистозные
опухоли поджелудочной железы. Применение МРТ в урологии существенно расширило
возможности предоперационной дифференциации атипичных кист и кистозных опухолей
почек, определения стадии рака почки, выявления инвазии почечной вены опухолью
почки [46].
Применение эндокавитарных датчиков (в том числе эндоректальных) впервые
позволило визуализировать при МРТ капсулу предстательной железы, целостность
которой является одним из основных критериев операбельности пациента с раком
предстательной железы.
Возможности МРТ в акушерстве и гинекологии пока еще недооценены в России
представителями соответствующих клинических специальностей, в первую очередь в
силу высокой информативности и распространенности УЗИ. Вместе с тем уже
доказано, что МРТ должна использоваться для определения стадии рака эндометрия
и шейки матки (эндоректальные датчики), дифференциации миомы и аденомиоза,
предоперационной оценки миом матки, уточнения характера врожденных аномалий
матки. Диагностические возможности МР-ангиографии наиболее широко
раскрываются при обследовании сосудов виллизиева круга, синусов головного мозга
, сонных артерий, грудной и брюшной аорты. МР-ангиография сосудов головы и шеи
может проводиться без введения контрастного вещества и является рекомендуемым
исследованием перед хирургическим вмешательством на внутренних сонных артериях
(рис. 6) [46].
При исследованиях сердца МРТ стала эталонным методом оценки
сократительной функции миокарда, объемов камер сердца и массы миокарда. С
помощью методики кино-МРТ возможна оценка функции клапанов, а посредством
фазово-контрастной МРТ можно проводить количественную оценку кровотока в
камерах сердца и сосудах. МРТ конкурирует с радионуклидными методами в изучении
перфузии и жизнеспособности миокарда. Перспективной является методика
МР-коронарографии.
.3.3 Показаниями для проведения МРТ с контрастным средством
Основными показания для проведения магнитно-резонансной томографии с
контрастом являются [48]:
· Опухоли спинного мозга (глиомы, астроцитомы, глиобластомы)
· Опухоли головного мозга (менингиомы, невриномы)
· Опухоли печени
· Рак молочной железы
· Аденомы гипофиза
· Необходимость определения активности рассеянного склероза
· Инфаркты миокарда (для определения точного размера ишемии)
· Дегенеративные поражения позвоночника
Это
далеко не весь перечень показаний для проведения магнитно-резонансной
томографии с контрастом. МРТ контрастирование применяется и во многих других
случаях, если специальные методики проведения данной процедуры, такие как
МР-артрография <#"819437.files/image006.gif">
Рис.7а.
Электронная микрофотография исходного коллоидного раствора наночастиц оксида
железа.
Рис.7б. Гистограмма распределения наночастиц по размеру.
Фазовый состав полученного раствора подтверждался с помощью
рентгенофазового анализа. Ядро атома железа обладает достаточно высоким
зарядом, поэтому полученный раствор обладает рентгенопоглощающими свойствами,
что и потвердели дополнительные исследования. В случае необходимости его можно
использовать в качестве рентгеноконтрастного средства.
Рис. 8а. Электронная микрофотография коллоидного раствора с
дополнительной обработкой
Рис. 8б. Гистограмма распределения наночастиц по размеру.
Раствор содержит наночастицы оксида железа двух размерных фракций с
диаметрами 8 нм и 37 нм.
Раствор содержит наночастицы оксида железа диаметром 8,2 нм
Анализ изображений, полученных с помощью просвечивающего электронного
микроскопа, показал, что после дополнительной обработки раствор содержит
наночастицы с узким распределением по размерам и средним диаметром около 8,2
нм(рис.8б).
Следующим этапом работы являлась оценка полученных растворов с помощью
метода протонной релаксометрии.
3.2 Анализ кривых спада времен релаксации
Влияние полученных растворов наночастиц на времена спин-спиновой и спин-решеточной
релаксации аналогов биологических жидкостей, исследовались с помощью метода
протонной релаксометрии. В результате были получены кривые спада значений
времен релаксации Т1 и Т2 в зависимости от концентрации вводимого реагента.
Таблица 3. Зависимость обратных величин времен релаксации Т1 и Т2 от
концентраций НЧОЖ(5-8 нм)
|
Концентрация НЧОЖ, г/л
|
0,02
|
0,04
|
0,06
|
0,08
|
0,1
|
0,12
|
0,14
|
0,16
|
|
1/Т1 ,1/мс
|
0,002
|
0,0035
|
0,0047
|
0,006
|
0,008
|
0,009
|
0,011
|
0,013
|
|
1/Т2 ,1/мс
|
0,009
|
0,012
|
0,017
|
0,021
|
0,026
|
0,029
|
0,032
|
Таблица 4. Зависимость обратных величин времен релаксации Т1 и Т2 от
концентраций НЧОЖ(30-50нм)
|
Концентрация НЧОЖ, г/л
|
0,02
|
0,04
|
0,06
|
0,08
|
0,1
|
0,12
|
0,14
|
0,16
|
|
1/Т1 ,1/мс
|
0,002
|
0,003
|
0,004
|
0,0045
|
0,006
|
0,0065
|
0,007
|
0,008
|
|
1/Т2 ,1/мс
|
0,006
|
0,012
|
0,016
|
0,022
|
0,026
|
0,035
|
0,042
|
0,051
|
Рис.9. Зависимость обратных значений величин времен релаксации Т1 -
черная линия и Т2 - синяя линия от концентрации вводимых в водный раствор
наночастиц оксида железа со средним размером 5-8 нм.
Рис.10. Зависимость обратных значений величин времен релаксации Т1 -
черная линия и Т2 - синяя линия от концентрации вводимых в водный раствор
наночастиц оксида железа со средним размером 30-50 нм.
Анализ кривых показал, что растворы наночастиц со средними размерами -
5-8 нм (суперпарамагнитные) и 30-50 нм (ферримагнитные) обладают контрастными
свойствами. Однако в случае суперпарамагнитных частиц контрастные свойства
проявлялись как по параметру Т1, так и по Т2 (рис. 9.), а в случае боле крупных
частиц преимущественно по Т2. Интенсивность спада кривой по времени Т2 у
суперпарамагнитных частиц существенно превышала интенсивность по Т1, в
особенности на малых и очень высоких концентрациях вводимых наночастиц.
Превышение интенсивности спада кривых Т2 по отношению к Т1 является
отрицательным фактором для создания железосодержащего контрастного средства для
клинических МРТ-томографов, так как процесс формирования сигнала таков, что
сильное укорачивание Т2 приводит к существенному снижению интенсивности сигнала
на томографе[49], хотя применяемый метод релаксометрии этого не показывал. На
первом этапе решение этой проблемы достигалось выбором оптимальной концентрации
вводимых наночастиц, выбираемой таким образом, чтобы при приемлемом конечном
значении Т1, относительный спад по кривой Т2 был минимален. Анализ кривых спада
времен релаксации Т1 и Т2 в зависимости от концентрации введенного раствора
показал, что максимальная концентрация вводимых в водный раствор наночастиц,
соответствующая пределу измерения для суперпарамагнитных наночастиц, составляет
0.5 мг/мл - после чего значение времен релаксации уходит в «ноль».
По результатам исследований была определена основная физическая величина,
характеризующая контрастирующую способность контрастного вещества -
релаксирующая способность (тангенс угла наклона). Для комбинаций на основе
суперпарамагнитных наночастиц она составила 12,1л/(ммоль*с) для величины Т1 и
30.1 л/(ммоль*с) для Т2. С целью оценки полученных значений они были сравнены с
характеристиками существующего на рынке парамагнитного гадолинйсодержащего
контрастного средства «Магневист» (Bayer AG),
предназначенного для визуализации по времени Т1. Значение релаксирующей
способности, в условиях эксплуатации установки, для него составило 5.64
л/(ммоль*с).
Для комбинаций на основе ферримагнитных частиц релаксирующая способность
для Т2 составила 35 л/(ммоль*с) и для Т1 3,2 л/(ммоль*с).
Таким образом крупные частицы пригодны только для контрастирования по Т2,
а мелкие частицы являются универсальными, то есть могут использоваться для
контрастирования как по Т1 так и по Т2.
Исследования поведения кривых спада времен релаксации в среде на основе
альбумина, не выявило никаких аномалий, что свидетельствует об отсутствии
процесса связывания наночастиц с данным белком и это необходимо учитывать при
возможном клиническом использование полученного раствора в качестве контраста.
По результатам исследований можно сделать вывод о возможности создания нового
контрастного средства для МР-томографии, на основе синтезированных наночастиц
сложного оксида железа, превосходящего по своим характеристикам существующие
аналоги.
.3 Оценка влияния соединений железа на жизнеспособность фибробластов МТТ-тестом
Для оценки влияния, наночастиц оксида железа и соединений гадолиния, на
жизнеспособность клеток фибробластов, на первом этапе использовался МТТ-тест.
В планшете инкубировали клетки фибробластов под воздействием соединений с
различными концентрациями железа и лунки контроля, относительно которых
рассчитывали достоверность эффекта соединений.
Рассмотрим цитотоксичность веществ сложного оксида железа -2-х образцов
коллоидного раствора магнетита(Fe3O4), различающиеся преимущественно размером. Первый
образец имеет размер 5-8 нм. Второй образец - 30-50 нм. (№1 и №2
соответственно). В качестве препарата сравнения использован «Резовист» (RV).
Таблица 5. Оптическая плотность ячеек планшета с культурой фибробластов в
присутствии соединений (МТТ-тест), усл.ед.:
|
конц. соед-я.
|
Контроль
|
0,01%
|
0,05%
|
0,1%
|
0,5%
|
1%
|
5%
|
10%
|
|
НЧОЖ №1
|
0,24±0,08
|
0,23±0,01
|
0,24± 0,02
|
0,22±0,05
|
0,19±0,02*
|
0,16±0,01*
|
0,12±0,01*
|
0,10±0,01*
|
|
№2
|
0,24±0,08
|
0,23±0,01
|
0,25± 0,05
|
0,23±0,04*
|
0,24±0,01*
|
0,21±0,02*
|
0,15±0,04*
|
|
RV
|
1,07±0,18
|
|
1,19±0,07
|
0,92±0,04
|
1,07±0.32
|
1,42±0,12*
|
|
|
Примечание:*-Достоверные отличия от контроля при р<0,05
После обработки результаты были представлены в процентах от контроля
Таблица 6 . Жизнеспособность клеток в присутствии соединений (% от
контроля):
|
конц. соед-я
|
контроль
|
0,01%
|
0,05%
|
0,1%
|
0,5%
|
1%
|
5%
|
10%
|
|
№1
|
100
|
95
|
100
|
91
|
79
|
66
|
50
|
41
|
|
№2
|
100
|
95
|
104
|
91
|
95
|
100
|
87
|
62
|
|
RV
|
100
|
|
111
|
86
|
99
|
133
|
|
|
Для расчета использовано значение оптической плотности «чистого»
контроля.
По данным таб.5 и таб.6 построена нижеследующая диаграмма, представленные
на рис. 11.
Ось абсцисс: исследуемые соединения в концентрации 0,01-10%
По оси ординат отложены значения жизнеспособности клеток в
процентах(контроль 100%)
У препарата RV в концентрации
1% наблюдается достоверное отличие в сторону увеличения жизнеспособности на 33%
Это возможно происходит при повышении цитотоксичности, такой эффект встречается
в литературе как метаболическая стимуляция (активация метаболических процессов,
при токсическом ответе).
Рис.11. Влияние соединений железа на жизнеспособность фибробластов
(МТТ-тест)
Примечание:*-Достоверные отличия от контроля при р<0,05
Наибольшую токсичность в максимальной концентрации проявили образцы НЧОЖ
№1 и №2. В Концентрациях 10% и 5% наблюдалось достоверное снижение
жизнеспособности фибробластов на 40-60%.
Согласно данному исследованию образец №1 имеет большую токсичность, по
сравнению с образцом №2 и препаратом сравнения.
При 10% концентрации у образца №1 происходило снижение жизнеспособности
на 59%. Тогда как у образца №2 при такой же концентрации снижение
жизнеспособности на 38%.
Здесь хотелось бы обратить внимание на следующее:
Токсичность исследуемых веществ №1 и №2 статистически неотличима от
токсичности препарата сравнения (резовиста) при равной конечной концентрации
железа 0,1% и 0,05%.
Выводы
. В ходе данной работы были получены образцы НЧОЖ,
стабилизированные цитратом натрия, размерами 5-8 нм и 30-50нм.(рН 6,2- 7,2 )
. Методом протонной релаксометрии показано, что частицы размером
5-8нм имеют релаксирующую способность 12,1л/(ммоль*с) для Т1 и 30.1 л/(ммоль*с)
для Т2.
. Показано, что частицы размером 30-50 нм имеют релаксирующую
способность 3,2 л/(ммоль*с) для Т1 и 35 л/(ммоль*с) для Т2.
. Выявлено, что в концентрациях менее 0,5мг/мл по данным МТТ-теста
частицы не проявляют токсического действия на нормальные клетки фибробластов.
. Экспериментально обнаружено, что токсичность исследуемых веществ
№1 и №2 статистически неотличима от токсичности препарата сравнения (резовиста)
при равной конечной концентрации железа 0,1% и 0,05%.
Список литературы
1) Berry C., Curtis A. Functionalisation of magnetic
nanoparticles for applications in biomedicine // J. Phys. D. Appl. Phys. 2003.
V. P.36.
) Bruce I.J., Sen T. Surface Modification of magnetic
nanoparticles with alkoxysilanes and their application in magnetic
bioseparations // Langmuir. 2005. V. 21. P. 7029-7035.
) Ch. H. Vestal, Z.John Zhang // Int.J.of
Nanotechnology, V.1, p.240 (2004).(6)
) Edward A. Neuwelt, Bronwyn E. Hamilton, Csanad G.
Varallyay, William R. Rooney,Robert D. Edelman6, Paula M. Jacobs and Suzanne G.
Watnick Ultrasmall superparamagnetic iron oxides (USPIOs): a future alternative
magnetic resonance (MR) contrast agent for patients at risk for nephrogenic
systemic fibrosis (NSF)?//Kidney International (2009) 75, 465-474;
) Fuentes M., Mateo C., Rodriguez A. et al. Detecting
minimal traces of DNA using DNA covalently attached to superparamagnetic
nanoparticles and direct PCR-ELISA // Biosensors and Bioelectronics. 2006. V.
21. P. 1574-1580.
) He X.X., Wang K., Tan W. et al. Bioconjugated
nanoparticles for DNA protection from cleavage // J. Am. Chem. Soc. 2003. V.
125. P. 7168-1769.
) Hong J., Gong P., Xu D. et al. Stabilization of
chymotrypsin by covalent immobilization on amine-functionalized
superparamagnetic nanogel // J. of Biotechnology. 2007. V. 128. P. 597-605.
) Jain T.K., Morales M.A., Sahoo S.K. et al. Iron
oxide nanoparticles for sustained delivery of anticancer agents // Am. Chem.
Soc. 2003. V. 125 (51). P. 15754 -15755.
) Koneracka M., Kopcansky P., Antalik M. et al.
Immobilization of proteins and enzymes to fine magnetic particles // J. Magn.
Magn. Mater. 1999. V. 201. P. 427.
) Koneracka M., Kopcansky P., Timko M. et al. Direct
binding procedure of proteins and enzymes to fine magnetic particles // J.
Magn. Magn. Mater. 2002. V. 252. P. 409.
) Kouassi G.K., Irudayaraj J., McCarty G. Activity of
glucose oxidase functionalized onto magnetic nanoparticles // BioMagnetic
Research and Technology 2005. V. 3
) Kin Man Ho, Pei Li. Design and Synthesis of Novel Magnetic Core- Shell
Polymeric Particles. American Chemical Society 2008;24(5): 1801-1807
) Lacava L.M. et al. Magnetic resonance of a
dextran-coated magnetic fluid intravenously administered in mice // Biophys. J.
2001.V. 80. P. 2483-2486.
) Liao M.-H., Chen D.-H. Immobilization of yeast
alcohol dehydrogenase on magnetic nanoparticles for improving its stability //
Biotechnology Letters. 2001. V. 23. P. 1723-1727.
16) Li X
<http://www.ncbi.nlm.nih.gov/sites/entrez?Db=pubmed&Cmd=Search&Term=%22Li%20X%22%5BAuthor%5D&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DiscoveryPanel.Pubmed_RVAbstractPlus>,
Du X
<http://www.ncbi.nlm.nih.gov/sites/entrez?Db=pubmed&Cmd=Search&Term=%22Du%20X%22%5BAuthor%5D&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DiscoveryPanel.Pubmed_RVAbstractPlus>,
Huo T
<http://www.ncbi.nlm.nih.gov/sites/entrez?Db=pubmed&Cmd=Search&Term=%22Huo%20T%22%5BAuthor%5D&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DiscoveryPanel.Pubmed_RVAbstractPlus>,
Liu X <http://www.ncbi.nlm.nih.gov/sites/entrez?Db=pubmed&Cmd=Search&Term=%22Liu%20X%22%5BAuthor%5D&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DiscoveryPanel.Pubmed_RVAbstractPlus>,
Zhang S
<http://www.ncbi.nlm.nih.gov/sites/entrez?Db=pubmed&Cmd=Search&Term=%22Zhang%20S%22%5BAuthor%5D&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DiscoveryPanel.Pubmed_RVAbstractPlus>,
Yuan F
<http://www.ncbi.nlm.nih.gov/sites/entrez?Db=pubmed&Cmd=Search&Term=%22Yuan%20F%22%5BAuthor%5D&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DiscoveryPanel.Pubmed_RVAbstractPlus>.
Specific targeting of breast
tumor by octreotide-conjugated ultrasmall superparamagnetic iron oxide
particles using a clinical 3.0-Tesla magnetic resonance scanner.// Acta Radiol.
2009 Jul;50(6):583-94.
17) Louie A.Y., Huber M.M., Ahrens E.T. et al. In vivo
visualization of gene expression using magnetic resonance imaging // Nat.
Biotechnol. - 2000. - Vol. 18. - P. 321-325.
) Martinez-Mera I., Espinoza-Pesqueira M.E.,
Perez-Hernandez R., Arenas-Alatorre J., “Synthesis of magnetite (Fe3
O4 ) nanoparticles without surfactants at room temperature”,
Materials Letters, 2007, 61, 4447-4451
19)MacNeil S
<http://www.ncbi.nlm.nih.gov/pubmed?term=MacNeil%20S%5BAuthor%5D&cauthor=true&cauthor_uid=21826007>,
Bains S <http://www.ncbi.nlm.nih.gov/pubmed?term=Bains%20S%5BAuthor%5D&cauthor=true&cauthor_uid=21826007>,
Johnson C
<http://www.ncbi.nlm.nih.gov/pubmed?term=Johnson%20C%5BAuthor%5D&cauthor=true&cauthor_uid=21826007>,
Idйe JM <http://www.ncbi.nlm.nih.gov/pubmed?term=Id%C3%A9e%20JM%5BAuthor%5D&cauthor=true&cauthor_uid=21826007>,
Factor C
<http://www.ncbi.nlm.nih.gov/pubmed?term=Factor%20C%5BAuthor%5D&cauthor=true&cauthor_uid=21826007>,
Jestin G <http://www.ncbi.nlm.nih.gov/pubmed?term=Jestin%20G%5BAuthor%5D&cauthor=true&cauthor_uid=21826007>,
Fretellier N
<http://www.ncbi.nlm.nih.gov/pubmed?term=Fretellier%20N%5BAuthor%5D&cauthor=true&cauthor_uid=21826007>,
Morcos SK
<http://www.ncbi.nlm.nih.gov/pubmed?term=Morcos%20SK%5BAuthor%5D&cauthor=true&cauthor_uid=21826007>.
Gadolinium contrast agent associated stimulation of human fibroblast collagen
production.//InvestRadiol. <http://www.ncbi.nlm.nih.gov/pubmed/21826007>
2011 Nov;46(11):711-7.
20) Molday R.S., MacKenzie D. Immunospecifc
ferromagnetic iron-dextran reagents for the labeling and magnetic separation of
cells // J.Immunol. Methods. 1982. V. 52. P. 353-367.
21) Mossman Т. // J. Immunol. Methods, 1983, V. 65, р. 55-63.-45&catid=55:s-22006&Itemid=52
) M. Taupitz, S. Wagner, J. Schnorr, et al. Phase I Clinical
Evaluation of Citrate-coated Monocrystalline Very Small Superparamagnetic Iron
Oxide Particles as a New Contrast Medium for Magnetic Resonance Imaging.
Investigative Radiology 2004;39:394-405.
) Pardoe H., Chua-Anusorn W., St. Pierre T. G., Dobson
J. Structural and magnetic properties of nanoscale iron oxide particles
synthesized in the presence of dextran or polyvinyl alcohol // J. Magn. Magn.
Mater. V. 225. P. 41-46.
) PangS.C., Chin S.F., Anderson M.A., “Redox
Equilibria of iron oxides in aqueous-based magnetite dispersions: Effect of the
pH and redox potential”, J. Colloid and Interface Sci., 2007, 311, 94-101
) Pedro Tartaj P., Serna C.J. Synthesis of
monodisperse superparamagnetic Fe/Silica nanospherical composites // J. Am.
Chem. Soc. 2003. № 125 (51). Р. 15754-15755.
) Port M., Idee J.M., Medina C. et al. Efficiency,
thermodynamic and kinetic stability of marketed gadolinium chelates and their
possible clinical consequences: a critical review // Biometals. -2008. - Vol.
21. - P. 469-490.
) Portet D., Denoit B., Rump E. et al. Nonpolymeric
coatings of iron oxide colloids for biological use as magnetic resonance
imaging contrast agents // J. Coll. Inter. Sci. 2001. V. 238. P. 37-42.
) Robinson D.B., Persson H.H.J., Zeng H. et al.
DNA-Functionalized MFe2O4 (M = Fe, Co, or Mn) Nanoparticles and Their
Hybridization to DNA-Functionalized Surfaces // Langmuir 2005. V. 21. P.
3096-3103.
) Salata O.V. Applications of nanoparticles in biology
and medicine
30) Абрагам А., Ядерный магнетизм, пер. с англ., М., 1963
) Акопджанов А.Г, Шимановский Н.Л., Науменко В.Ю., Семейкин
А.В., Старостин К.М., Быков И.В., Манвелов Э.В.. Перспективы применения
суперпарамагнитных наночастиц магнетита в качестве магнитно-резонансного
контрастного средства. Сборник статей IV съезда фармакологов России. Сентябрь
2012. с.8.
) Александров И.В., Теория магнитной релаксации. Релаксация в
жидкостях и твердых неметаллических парамагнетиках, М., 1975
) Баранов Д.А., «Магнитные наночастицы: проблемы и достижения
химического синтеза», 2009.
) Белов К.Л. Электронные процессы в магнетите. Успехи
физических наук.- 1993г. - Том 163 №5.
) Вонсовский С. В., Суперпарамагнетизм, в кн.: Физический
энциклопедический словарь, т. 5, М., 1966, с. 103; его же, Магнетизм, М., 1971,
с. 805.
) Губин С.П., Кокшаров Ю.А., Хомутов Г.Б., Юрков Г.Ю.
Магнитные наночастицы: методы получения, строение и свойства. Успехи химии. -
2005. - № 74(6). - С. 539-574.
) Зильберман Г.Е. Электричество и магнетизм, М.:Наука, 1970.-
384с.
) Коновалов А.Н., Корниенко В.Н., Пронин И.Н.
Магнитно-резонансная томография в нейрохирургии. - М.: Кондор-М., 1997. - 697
с.
) Ландау Л.Д., Лифшиц Е.М., Теория поля, 7 изд., М., 1988;
Ахиезер А.И., Ахиезер И.А., Электромагнетизм и электромагнитные волны, М.,
1985.
) Лучевая диагностика рассеянного склероза: Т.Н. Трофимова,
Н.А. Тотолян, А.В. Пахомов - Санкт-Петербург, ЭЛБИ-СПб, 2010 г.- 128 с.
) Магнитно-резонансная спектроскопия: Под редакцией Г.Е.
Труфанова, Л. А. Тютина - Москва, ЭЛБИ-СПб, 2008 г.- 240 с
) Магнитно-резонансная томография: практическое руководство
К. Уэстбрук, ТД Бином, 2012г.
) Нам И.Ф., Яновский В.А., Шипунов Я.А. Современные тенденции
создания контрастных средств для магнитно-резонансной томографии // СМЖ
(Томск). 2012. №3. С.134-137.
) НиТ. Нобелевские лауреаты, 2003
) Сивухин Д. В. Общий курс физики. - В 5 т. - Т. II.
Термодинамика и молекулярная физика. - М.: ФИЗМАТЛИТ, 2005
) Синицын В.Е., С.П. Морозов, Справочник поликлинического
врача Том 04/N 4/2006
) Сликтер Ч., Основы теории магнитного резонанса, пер. с англ.,
2 изд., М., 1981
) Стандарты РКТ и МРТ-исследований с внутривенным
контрастированием в онкологии / Долгушин Б.И. и соавт., Российский
онкологический научный центр им. Н.Н.Блохина. - РАМН, 2011. - 58 с.
) Хорнак Дж.П. Основы МРТ (1996-1999)
) Черепович В.С, Е.В. Волочник, Е.В. Антоненко, Е.С. Лоткова,
Т.В. Романовская, В.В. Гринев Оптимизация критических параметров МТТ-теста для
оценки клеточной и лекарственной цитотоксичности БГМУ
) Шимановский Н.Л., Науменко В.Ю., Акопджанов А.Г., Манвелов
Э.В. Возможности применения наночастиц магнетита для диагностики и лечения
онкологических заболеваний. Лекарственные средства №1(2) 2011.
) Шимановский Н.Л., Акопджанов А.Г., Сергеев А.И., Манвелов
Э.В.,
Семейкин А.В., Науменко В.Ю., Панов В.О., Быков И.В.
Фармакологические свойства наночастиц сложного оксида железа
как
субстанции магнитно-резонансного контрастного средства.
) Шимановский Н.Л. Контрастные средства: руководство по
рациональному применению. - М.: ГЭОТАР_Медиа, 2009. - 464 с.: ил. (Библиотека
врача специалиста).
) Н.Л. Шимановский, М.А. Епинетов, М.Я. Мельников,
Молекулярная и нанофармакология, 2010.
) Экспериментальная и клиническая фармакология. Том №73 №6
с.23-28. 2010.
) Ядерный магнитный резонанс; под ред. П.М. Бородина, Л.,
1982;
57) Якобсон М.Г., Подоплелов А.В., Рудых С.Б. Введение в
МР-томографию. - Новосибирск: СО РАМН. - 1991. - 271 с.