Термическая стерилизация в аптечном производстве
НОУ
ВПО МИ "Реавиз"
Курсовая
по фармацевтической технологии
на
тему: "Термическая стерилизация в аптечном производстве"
Выполнила:
Студентка 532гр 5
курса
Абросимова М.С.
Самара,
2014
Содержание
I.
Введение. Обзор литературы
.
Способы и объекты стерилизации в аптеке. Режимы стерилизации
.
Оборудование для стерилизации
.
Контроль качества стерилизации.Экспериментальная часть
.
Методы, объекты и аппаратура термической стерилизации в аптеке
.
Соответствие организации и состояния термической стерилизации в аптеке
соответствующим требованиям
.
Контроль качества термической стерилизации в аптеке
.
Рекомендации по совершенствованию термической стерилизации
в
аптеке. Выводы и предложения. Литература
I. Введение
Организм человека в процессе эволюции
приспособился к защите от окружающей его микрофлоры. Наиболее важные органы и
биологические жидкости организма (кровь, спинномозговая жидкость, мозг, сердце
и др.) стерильны. Дыхательные пути, желудочно-кишечный тракт, слизистые, кожа,
естественные отверстия обеспечены разнообразными системами, удаляющими
микрофлору, не позволяющими ей развиваться или даже вызывающими ее гибель. В
частности, при непрерывно протекающем шелушении кожи с ее поверхности вместе с
эпидермисом удаляется микрофлора. Эпителий и слизь дыхательных путей
задерживают проникновение микроорганизмов в альвеолы. Кислая среда желудка
обусловливает гибель патогенной микрофлоры. Слезная жидкость, содержащая
лизоцим и орошающая слизистую глаза, лизирует микроорганизмы.
Следует отметить, что все указанные механизмы
защиты человека от проникновения и развития микрофлоры появляются в нем не
сразу. В неонатальный период (до 2-3 недель со дня рождения) и в грудной период
(до 12 месяцев) ребенок еще в значительной степени беззащитен от вредного
воздействия многих внешних факторов, том числе от микрофлоры. Детский организм
постепенно приспосабливается к новым для него условиям внеутробной жизни и
требует тщательного гигиенического ухода, защиты от микроорганизмов, в том
числе при использовании различных лекарств.
Организм больного человека может быть резко
ослаблен и в значительной степени лишен присущих ему защитным механизмов, в
частности, при ряде глазных заболеваний, ахилии желудка и других патологиях.
С другой стороны, человек подвергается опасности
инфицирования при введении лекарств с нарушением защитных барьеров - прежде
всего, при инъекциях, в особенности - при введении растворов в кровяное русло,
стерильные полости, а также лечении ранений, травм, обморожений и ожогов.
В указанных случаях использование загрязненной
микрофлорой лекарств может привести к инфицированию больных, тяжелым
заболеваниям или даже к смерти. Описаны случаи потери зрения в результате
применения лекарства, загрязненного Ps. aeruginosa, гибели сотен людей при использовании
нестерильных инъекционных лекарств; заболеваний сальмонеллезом при приеме
таблеток из экстракта щитовидной железы; тяжелых поражений кожи и слизистых при
использовании мазей, обсемененных стафилококками, стрептококками и грибками.
Вторым аспектом опасности микробного загрязнения
лекарств является воздействие микрофлоры на ингредиенты лекарства, разложение
микроорганизмами действующих и вспомогательных веществ. Это приводит к потери
их терапевтического эффекта, появлению неприятного запаха и вкуса, а в
отдельных случаях - к образованию токсичных продуктов. Микробы и продукты их
жизнедеятельности, а также убитые микробные тела, содержащиеся в инфузионных
растворах, при внутрисосудистых введениях приводят к тяжелым пирогенным
реакциям.
Таким образом, микробная загрязненность лекарств
несет в себе опасность, как инфицирования больных, так и порчи лекарств с
появлением нежелательных или даже токсичных свойств у последних.
И следовательно очень важно знать, что в
производстве стерильной продукции (инъекционные растворы, глазные лекарственные
формы, лекарственные формы с антибиотиками, лекарственные формы для детей, вода
для инъекций) одну из ведущих ролей играет стерилизация препаратов. Она
необходима для возможности парентерального введения лекарственных препаратов,
применения на слизистую оболочку глаза и др. ввиду того, что с ее помощью
достигается полная стерильность, и риск развития неблагоприятных реакций
снижается в разы.
II. Обзор литературы
1. Способы и объекты стерилизации в аптеке.
Режимы стерилизации
Стерилизация - полное уничтожение в том, или
ином объекте живых микроорганизмов и их спор. Стерилизация имеет большое
значение при изготовлении всех лекарственных форм и особенно инъекционных. В
данном случае следует стерилизовать посуду, вспомогательный материал,
растворитель и готовый раствор. Таким образом, работа по изготовлению растворов
для инъекций должна начинаться со стерилизации и стерилизацией заканчиваться.
ГФXI определяет стерилизацию как процесс
умерщвления в объекте или удаление из него микроорганизмов всех видов,
находящихся на всех стадиях развития.
Сложность процесса стерилизации заключается, с
одной стороны, в высокой жизнестойкости и большом разнообразии микроорганизмов,
с другой стороны - термолабильностью многих лекарственных веществ и
лекарственных форм или невозможностью по ряду причин использовать другие методы
стерилизации. Отсюда, исходят требования к методам стерилизации: сохранить
свойства лекарственных форм и освободить их от микроорганизмов.
Методы стерилизации должны быть удобны для
использования в аптеки, особенно в аптеках ЛПУ, в рецептуре которых
инъекционные растворы составляют до 60-80%.
Все работы по стерилизации изделий проводятся в
асептических условиях в специальных помещениях, подготавливаемых как
операционный блок (квар-цевание, генеральная уборка). Персонал использует
стерильную спецодежду, перчатки, очки. Ополаскивание изделий проводится в 2-3
сменах стерильной воды, по 5 минут в каждой.
В технологии лекарственных форм используют
разные методы стерилизации: термические методы, стерилизация фильтрованием,
радиационная стерилизация, химическая стерилизация.
Термическая стерилизация
К термическим методам стерилизации относят
стерилизацию паром под давлением и воздушную стерилизацию, стерилизация текучим
паром исключена из ГФXI.
Воздушная стерилизация
Этот метод стерилизации осуществляется горячим
воздухом в воздушном стерилизаторе (сухожаровом шкафу) при температуре 160-200ºС
. При этом погибают все формы микроорганизмов за счет пирогенетического
разложения белковых веществ.
Эффективность воздушной стерилизации зависит от
температуры и времени. Равномерность прогрева объектов зависит от степени
теплопроводности и правильности расположения внутри стерилизационной камеры для
обеспечения свободной циркуляции горячего воздуха. Стерилизуемые объекты должны
быть расфасованы в соответствующую тару или укупорены и свободно размещены в
стерилизаторе. В связи с тем, что воздух обладает не высокой теплопроводностью,
прогрев стерилизуемых объектов происходит довольно медленно, поэтому загрузка
должна производится в не нагретые стерилизаторы или когда температура внутри
них не превышает 60ºС. Время,
рекомендуемое для стерилизации, должно отсчитываться с момента нагрева в
стерилизаторе до температуры 180-200°С
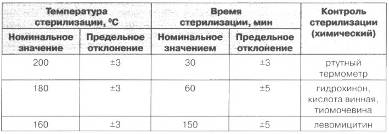
Таблица. Режимы и контроль стерилизации сухим
горячим воздухом
Воздушным методом стерилизуют медицинские
изделия, детали приборов и аппаратов из коррозионностойких металлов, стекла с
пометкой 200°С, изделия из силиконовой резины. Перед стерилизацией воздушным
методом изделия подвергаются предстерилизационной очистке и обязательно
высушиваются в сушильном шкафу при температуре 85°С до исчезновения видимой
влаги. Полный цикл составляет до 150 минут. Преимущество стерилизации горячим
воздухом по сравнению с паровым методом состоит в низкой себестоимости
оборудования. Недостатками являются: длинный полный цикл стерилизации (не менее
30 мин), опасность повреждения инструментов высокими температурами,
невозможность стерилизации тканей и пластмасс, только один контрольный параметр
- температура, высокие энергозатраты.
Воздушный метод стерилизации используется для
стерилизации термостойких лекарственных веществ, масел, жиров, ланолина,
вазелина, воска, а также изделий из стекла, металла, силиконовой резина,
фарфора, установки для стерилизации фильтрованием с фильтрами, мелкие
стеклянные и металлические предметы.
Для стерилизации растворов этот метод не
используют.
Паровая стерилизация
Паровым методом стерилизуют медицинские изделия,
детали приборов и аппаратов из коррозионностойких металлов, стекла,
хирургическое белье, перевязочный и шовный материал, изделия из резины
(катетеры, зонды, трубки), из латекса, пластмасс. При паровом методе
стерилизующим средством является водяной насыщенный пар под избыточным
давлением 0,05 МПа (0,5 кгс/см2) - 0,21 МПа (2,1 кгс/см2) (1,1-2,0 бар)
температурой 110-134°С. Процесс стерилизации происходит в стерилизаторах
(автоклавах). Полный цикл составляет от 5 до 180 минут (табл.). Согласно ГОСТ
17726-81, название данного класса устройств: «Стерилизатор паровой». Несмотря
на то, что обработка паром достаточно эффективна, она не всегда может
обеспечить стерилизацию инструмента. Причина этого состоит в том, что воздушные
полости в стерилизуемых объектах могут послужить тепловым изолятором, как
например, стоматологические турбинные наконечники. Для решения этой проблемы в
автоклавах используется функция создания предварительного вакуума в импульсном
режиме. Преимущества метода - короткий цикл, возможность стерилизации нетермостойких
изделий, применение различных типов упаковки. Недостатком является высокая
стоимость оборудования.
Режимы и условия парового метода стерилизации.
. При температуре 132 °С, давлении пара в
стерилизационной камере 2 атм. в течение 20 мин рекомендуют стерилизацию для
изделий из антикоррозийного материала, стекла, текстильных материалов.
. При температуре 120 °С, давлении пара 1,1 атм.
в течение 45 минут рекомендуют стерилизацию для изделий из резины и латекса,
полимерных материалов.
Срок сохранения стерильности изделий,
простерилизованных, в коробках без фильтров равен трем суткам, в
стерилизационных биксах с фильтром - до 20 суток.
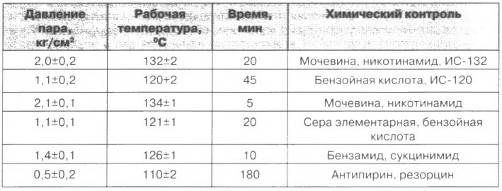 Таблица.
Режимы и контроль паровой стерилизации
Таблица.
Режимы и контроль паровой стерилизации
При этом методе стерилизации происходит
комбинированное действие на микроорганизмы высокой температуры и влажности.
Надежным методом стерилизации является стерилизация насыщенным паром при
избыточном давлении, а именно: давлении 0,11 мПа (1,1 кгс/см²)
и
температуре 120°С или давлении0,2 мПа (2,2 кгс/см²) и
температуре 132°С .
Насыщенный пар - это пар, находящийся в
состоянии равновесия с жидкостью, из которой он образуется. Признаком
насыщенного пара является строгая зависимость его температуры от давления.
Стерилизация паром при температуре 120°С
рекомендуется для растворов термостабильных лекарственных веществ. Время
стерилизационной выдержки зависит от физико-химических свойств веществ и объема
раствора.
|
Объем,
мл
|
Минимальное
время выдержки, мин
|
|
До
100 От 100 до 500 От 500 до 1000
|
8
12 15
|
Стерилизация инъекционных лекарственных веществ
проводят в герметично укупоренных, предварительно простерилизованных флаконах.
Этим методом также стерилизуют жиры и масла в
герметично укупоренных сосудах при температуре 120°С в течение 2 часов; изделия
из стекла, фарфора, металла, перевязочный и вспомогательный материал (вата,
марля, бинты, халаты, фильтровальную бумагу, резиновые пробки, пергамент) -
время выдержки 45 мин при температуре 120°С или 20 мин при температуре 132°С .
В исключительных случаях стерилизуют при
температуре ниже 120°С. Режим стерилизации должен быть обоснован и указан в
частных статьях ГФXI или другой нормативно-технической документации.
Данный метод стерилизации наиболее часто
используется в аптечных учреждениях для стерилизации инъекционных растворов при
этом надо учитывать следующие требования:
. Стерилизация должна проводится не позднее, чем
3 часа с момента изготовления раствора;
. Стерилизация проводится только один раз,
повторная стерилизация не допускается;
. К заполненным коробкам или упаковкам должна
быть прикреплена бирка с наименованием содержимого и датой стерилизации;
. Проведение контроля термической стерилизации
при стерилизации инъекционных растворов обязательно;
. Стерилизацию имеет право проводить только
человек, прошедший специальную подготовку и проверку знаний и имеющий документ
удостоверяющий это. °
Стерилизация фильтрованием.
Микробные клетки и споры могут рассматриваться
как не растворимые образования с очень малым (1-2 мкм) поперечником. Подобно
другим включениям они могут быть отделены от жидкости механическим путем -
фильтрованием сквозь мелкопористые фильтры. Этот метод стерилизации также
включен в ГФXI для стерилизации растворов термолабильных веществ.
Лучистая энергия губительно действует на клетки
живых организмов, в том числе и на различные микроорганизмы. Принцип
стерилизующего эффекта радиационного излучения основан на способности вызывать
в живых клетках при определенных дозах поглощенной энергии такие изменения,
которые неизбежно приводят их к гибели за счет нарушения метаболических
процессов. Чувствительность микроорганизмов к ионизирующему излучению зависит
от многих факторов: наличия влаги, температуры и др.
Радиационная стерилизация является эффективной
для крупных производств.
Химическая стерилизация.
Этот метод основан на высокой специфической
чувствительности микроорганизмов к различным химическим веществам, что
обуславливается физико-химической структурой их оболочки и протоплазмы.
Механизм антимикробного действия веществ еще недостаточно изучен. Считают, что
некоторые вещества вызывают коагуляцию протоплазмы клетки, другие действуют как
окислители, ряд веществ влияют на осмотические свойства клетки, многие
химические факторы вызывают гибель микробной клетки благодаря разрушению
окислительных и других ферментов.
Химическую стерилизацию применяют для
стерилизации посуды, вспомогательных средств, изделий из стекла, фарфора,
металла, применяют также для дезинфекции стен и оборудования.
Разъемные изделия стерилизуют в разобранном
виде. Во избежание нарушения концентрации стерилизационных растворов,
погружаемые в них изделия должны быть сухими. Цикл обработки составляет 240-300
минут, что является существенным недостатком метода. Кроме того, недостатком
является высокая стоимость дезинфектантов. Преимущество - нет специального
оборудования. Промытые стерильные изделия после удаления жидкости из каналов и
полостей используют сразу по назначению или после упаковки в двухслойную
стерильную х/б бязь, помещают в стерильную коробку, выложенную стерильной
простыней, на срок не более 3 суток.
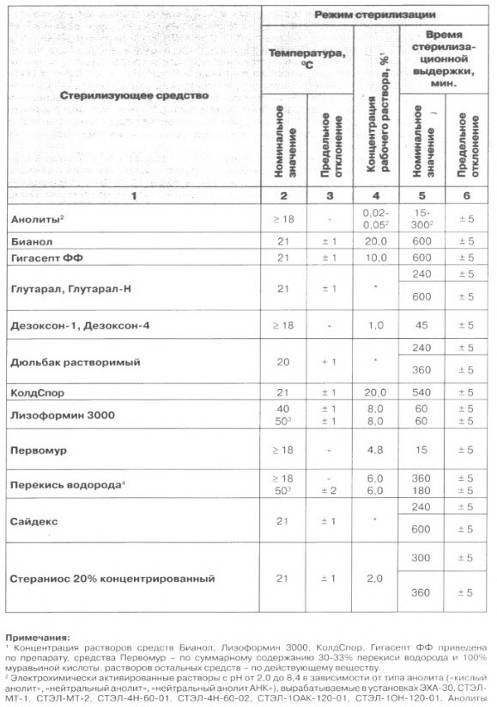

. Оборудование для стерилизации
Стерилизационное оборудование - изделия
медицинской техники, предназначенные для уничтожения микроорганизмов на
хирургических инструментах, шприцах, перевязочном материале, операционном
белье, изделиях из термолабильных материалов, в инъекционных растворах
лекарственных средств, на посуде и других медицинских и микробиологических
объектах с помощью высокой температуры или химических веществ. К
стерилизационному оборудованию относятся стерилизаторы, дезинфекционные
кипятильники, стерилизационные коробки, а также вспомогательные устройства для
загрузки и выгрузки стерилизуемых объектов.
Стерилизаторы состоят из стерилизационной
камеры, блока управления процессом стерилизации и вспомогательного оборудования
(вакуумные и водяные насосы, компрессоры, вентиляторы, парогенераторы, дозаторы
и др.). Широко применяются паровые и воздушные стерилизаторы.
Наиболее эффективны и надежны в связи с высокой
проникающей способностью пара паровые стерилизаторы. Пар из внешнего или
внутреннего источника парообразования под избыточным давлением на определенное
время поступает в герметично закрытую стерилизационную камеру с находящимися в
ней объектами стерилизации. Перед началом стерилизационной выдержки и после
окончания цикла стерилизации в камере современных стерилизаторов, как правило,
создается разрежение, ускоряющее выход аппарата на режим стерилизации, последующую
сушку объектов стерилизации и охлаждение стерилизационной камеры. Выпускаются
паровые стерилизаторы с объемом стерилизационной камеры от 4 до 560 л (цифра в
шифре стерилизатора соответствует объему стерилизационной камеры, выраженному в
кубических дециметрах). Наибольшее распространение получили стерилизаторы с
объемом стерилизационной камеры 100 л. Стерилизатор ГК-100-3 (рис. 1) имеет
стерилизационную камеру, снабженную паровой рубашкой из листовой нержавеющей
стали, наружная поверхность которой покрыта теплоизоляционным материалом.
Внутри камеры расположен выдвижной контейнер для размещения объектов
стерилизации. Для обеспечения процесса стерилизации паром имеется
парогенератор, а для создания вакуума в стерилизационной камере конденсатор.

Рис.1 Стерилизатор паровой ГК-100-3
При эксплуатации стерилизатора его
парогенератор заполняют водой до установленного уровня. В стерилизационную
камеру загружают подлежащие стерилизации объекты, после чего ее герметично закрывают.
Включают нагревательные элементы, которые обеспечивают нагрев воды и подъем
давления пара до заданного значения (1,3 кгс/см2 - I режим и 2,2 кгс/см2 - II
режим). Затем пар впускается в камеру. На первом этапе осуществляется
«продувка» камеры, т.е. вытеснение из нее воздуха, затем с помощью конденсатора
в камере создается разрежение. В последующем она заполняется паром, и по
достижении необходимого давления в камере, соответствующего режиму
стерилизации, начинается этап собственно стерилизации. Он продолжается
определенное время: 45 мин при давлении 110 кПа (1,1 кгс/см2) и температуре
120° или 20 минпри давлении 200 кПа (2 кгс/см2) и температуре 132°. В течение
всего времени стерилизационной выдержки в камере автоматически поддерживается
постоянное давление, контролируемое по показаниям приборов. По окончании
стерилизации подача пара в камеру прекращается, давление снижается, создается
разряжение. При этом происходит интенсивная сушка объектов стерилизации. Затем
давление в камере выравнивается с атмосферным, производятся охлаждение как
объектов стерилизации,
так
и стерилизационной камеры и выгрузка стерильных объектов.
Для дезинфекции хирургических инструментов,
игл, шприцев в кипящей дистиллированной воде при атмосферном давлении служат
дезинфекционные кипятильники с огневым или электрическим подогревом.
Воздушные стерилизаторы применяются для
стерилизации изделий из стекла и материалов, не выдерживающих влажную паровую
обработку. Принцип действия воздушных стерилизаторов заключается в том, что в
стерилизационную камеру с находящимися в ней объектами стерилизации непрерывно
в течение определенного времени (стерилизационная выдержка 60 мин) подается
воздух, нагретый до определенной температуры (180°). После окончания
стерилизации нагрев воздуха прекращается и стерилизационная камера охлаждается.
Выпускаются воздушные стерилизаторы с объемом камеры от 10 до 1300 л.
Наибольшее распространение получили воздушные стерилизаторы с емкостью
стерилизационной камеры 40 л (рис. 2), выполненные из тонколистовой стали
(корпус) и алюминия (камера). Объекты стерилизации на кассетах помещают в
стерилизационную камеру. Избранный температурный режим (85°, 120°, 160°, 180°)
обеспечивается автоматически.

Рис. 2 Воздушный стерилизатор
Газовые стерилизаторы применяются
для стерилизации изделий из термолабильных материалов газами или их смесью. В
нашей стране созданы газовые стерилизаторы с емкостью стерилизационной камеры
100 л и 250 л.
В лечебно-профилактических
учреждениях организуются централизованные стерилизационные отделения,
оснащенные специальным стационарным оборудованием: паровыми и воздушными
стерилизаторами с двусторонней механизированной загрузкой и выгрузкой
обрабатываемых объектов, моечными машинами, блоками парогенераторов и
управления процессом стерилизации. Наиболее распространена централизованная
установка ЦСУ-1000 (рис. 3), обеспечивающая три режима стерилизации -
операционного белья и перевязочных материалов, хирургических инструментов и
изделий из резины. Загрузка объектов стерилизации в камеры производится в
стерилизационных коробках, которые затем используются как для хранения
стерильных материалов, так и для доставки их к месту использования. Применяются
круглые и прямоугольные коробки емкостью от 3 до 36 л с биологическим фильтром.

Рис. 3 Стерилизатор ЦСУ-1000
3. Контроль качества стерилизации
В комплексе мероприятий по
стерилизации изделий медицинского назначения важное значение имеет организация
и проведение контроля за ее эффективностью. Используемые до настоящего времени
методы и средства контроля не всегда позволяют выявить дефекты стерилизации,
что влечет за собой повышение уровня внутрибольничных инфекций.
Контроль качества стерилизации
проводиться в целях эффективности процесса и предусматривает:
Использование совокупности различных
методов контроля;
Анализ полученных данных;
Протоколирование результатов;
Принятие управленческого решения в
отношении материалов и инструментов, прошедших стерилизационную обработку
(разрешение к использованию, проведение повторной стерилизации и т.д.)
Контроль эффективности работы
стерилизационного оборудования осуществляется физическими, химическими и
биологическим (бактериологическим) методами. Надежность этих методов
неодинакова. Физические и химические методы предназначены для оперативного
контроля и позволяют контролировать соблюдение параметров режимов паровой,
газовой, воздушной стерилизации, температуру, давление, экспозицию. Недостаток
этих методов заключается в том, что они не могут служить доказательством
эффективной стерилизации. Достоверным для определения эффективности является
только бактериологический метод.
Физические методы термическая
стерилизация техника медицинская
Физические методы контроля
осуществляются с помощью средств измерения температуры (термометры, термопары),
давления (манометры, мановакуумметры) и времени (таймеры). Современные
стерилизаторы оснащены также записывающими устройствами, фиксирующими отдельные
параметры каждого цикла стерилизации.
Химические методы
В течение десятков лет для
проведения химического контроля применялись химические вещества, изменяющие
свое агрегатное состояние или цвет при температуре, близкой к температуре
стерилизации (бензойная кислота для контроля паровой стерилизации, сахароза,
гидрохинон и ряд других веществ - для контроля воздушной стерилизации). При
изменении цвета и расплавлении указанных веществ результат стерилизации
признавался удовлетворительным. Однако многолетние наблюдения и данные
литературы указывают, что при удовлетворительных результатах химического
контроля с помощью названных индикаторов, бактериологический контроль в ряде
случаев (до 12%) выявляет неудовлетворительный результат стерилизации.
Кроме того, эти вещества имеют
существенный недостаток. Переход их в другое агрегатное состояние не дает
представления о продолжительности воздействия температуры, при которой
происходит их расплавление.
Принимая во внимание недостаточную
достоверность использования указанных индикаторов для контроля, а также
значительную трудоемкость и неудобство их практического применения, в 70-х
годах были разработаны химические индикаторы, изменение цвета которых
происходит при воздействии температуры, принятой для данного режима, в течение
времени, необходимого для стерилизации. По изменению окраски этих индикаторов
можно судить о том, что основные параметры процесса стерилизации - температура
и время - выдержаны. Длительное применение таких индикаторов показало их
высокую надежность.
Более сложные индикаторы
предназначены для контроля критических параметров процесса стерилизации.
Критическими параметрами являются: для парового метода стерилизации -
температура, время воздействия данной температуры, водяной насыщенный пар; для
воздушного метода стерилизации - температура и время воздействия данной
температуры; для газовых методов стерилизации - концентрация используемого
газа, температура, время воздействия, уровень относительной влажности; для
радиационной стерилизации - полная поглощенная доза.
До конца 80-х годов не существовало
стандартов на выпускаемые различными фирмами химические индикаторы и не было
попыток классифицировать их. Лишь в 1995 году международная организация по
стандартизации (ISO) опубликовала документ "Стерилизация медицинских
изделий. Химические индикаторы. Часть 1".
С января 2002 года в России введен в
действие ГОСТ Р ИСО 11140-1 "Стерилизация медицинской продукции.
Химические индикаторы. Общие требования". Согласно этому документу
химические индикаторы распределены на шесть классов.
Индикаторы 1-го класса являются
индикаторами ("свидетелями") процесса. Примером такого индикатора
является термоиндикаторная лента, наклеиваемая перед проведением стерилизации
на текстильные упаковки или стерилизационные коробки. Изменение цвета ленты
указывает, что упаковка подверглась воздействию процесса стерилизации. Такие же
индикаторы могут помещаться в наборы хирургических инструментов или
операционного белья.
-й класс индикаторов предназначен
для использования в специальных тестовых процедурах, например, при проведении
теста Бовье-Дика (Bowie-Dick test). Этот тест не контролирует параметры
стерилизации, он оценивает эффективность удаления воздуха из камеры парового
стерилизатора.
Индикаторы 3-го класса являются
индикаторами одного параметра. Они оценивают максимальную температуру, но не
дают представления о времени ее воздействия. Примерами такого рода индикаторов
являются описанные выше химические вещества.
-й класс - это многопараметровые
индикаторы. Они содержат красители, изменяющие свой цвет при сочетанном
воздействии нескольких параметров стерилизации, чаще всего - температуры и
времени. Примером таких индикаторов служат термовременные индикаторы для
контроля воздушной стерилизации.
-й класс - интегрирующие индикаторы.
Эти индикаторы реагируют на все критические параметры метода стерилизации.
Характеристика этого класса индикаторов сравнивается с инактивацией
высокорезистентных микроорганизмов.
-й класс - индикаторы-эмуляторы. Эти
индикаторы должны реагировать на все контрольные значения критических
параметров метода стерилизации.
Биологический метод
Наряду с физическими и химическими
применяется бактериологический метод контроля стерилизации. Он предназначается
для контроля эффективности стерилизационного оборудования. До недавнего времени
для контроля паровой и воздушной стерилизации использовались пробы садовой
земли, содержащей микроорганизмы, высокорезистентные к воздействию
стерилизующих факторов. Однако устойчивость микроорганизмов в различных пробах
неодинакова, что не позволяет стандартизировать результаты контроля.
В настоящее время для проведения
бактериологического контроля используются биотесты, имеющие дозированное
количество спор тест-культуры. Контроль эффективности стерилизации с помощью
биотестов рекомендуется проводить 1 раз в 2 недели. В зарубежной практике
принято применять биологическое тестирование не реже 1 раза в неделю.
В ряде случаев возникает
необходимость проведения контроля с помощью биотестов каждой загрузки
стерилизатора. Прежде всего, речь идет о стерилизации инструментов,
используемых для выполнения сложных оперативных вмешательств, требующих
применения высоконадежных стерильных материалов. Каждая загрузка имплантируемых
изделий также должна подвергаться бактериологическому контролю. При этом
использование простерилизованных материалов задерживается до получения
отрицательных результатов контроля. Тех же принципов при определении
периодичности контроля рекомендуется придерживаться в отношении газовой
стерилизации, являющейся по сравнению с другими методами более сложной.
III. Экспериментальная часть
На основе данных аптеки, ООО
"Фармлекс" (аптека №42),
по адресу: ул. Энтузиастов, 26 г.
Самары.

. Методы, объекты и аппаратура
термической стерилизации в аптеке
Стерилизация медицинских
инструментов, лекарственных форм - важный вопрос, приобретающий особую
актуальность в свете распространения большого количества инфекционных
заболеваний, с трудом поддающихся лечению. Чтобы исключить опасность для
пациентов и медицинского персонала, в исследуемой мной аптеке применяется
автоклав ВК 75 - модель (рис 1), 1988г.выпуска, зав.номер 3951, разработанная с
учетом основных требований к процессу стерилизации медицинского инструментария,
изделий медицинского назначения и лекарственных форм, подвергающихся стерилизации
водным насыщенным паром под давлением (растворов). Автоклав ВК 75 позволяет
проводить быструю и эффективную стерилизацию изделий из металла (хирургических
инструментов), шприцев, инъекционных игл, перевязочных материалов, перчаток и
медицинских изделий из стекла и резины. При этом воздействие насыщенного пара
не вызывает изменений структуры стерилизуемых материалов.
Основной принцип действия устройства
- подача под давлением значительного объема пара на размещенные внутри
предметы, подлежащие очистке и обеззараживанию.

Рис.1 Автоклав ВК- 75
Среди основных особенностей
технического исполнения модели автоклава ВК 75, - вертикальная загрузка и
цилиндрическая форма камеры, а также - закрывающаяся вручную крышка. Камера и
водопаровая рубашка объединены в одну систему сварным методом и изготовлены из
высоколегированной нержавеющей стали, что позволяет исключить процесс коррозии
и обеспечить долговечность эксплуатации устройства. Давление пара в камере
поддерживается в автоматическом режиме.
После стерилизации медицинские инструменты и материалы подвергаются вакуумной
сушке в стерилизационной камере стерилизатора ВК 75.
Среди основных достоинств
стерилизатора ВК 75, стоит отметить:
Высокую надежность конструкции;
Ремонтопригодность, отсутствие
дефицитных запчастей (за счет простой и экономичной конструкции);
Простоту в эксплуатации и
обслуживании;
Автоматизированный процесс
стерилизации;
Применение различных режимов
вакуумирования и сушки;
Возможность стерилизации медицинских
растворов;
Способность работать с устройством
даже в отсутствие канализации и водопровода (воду можно заливать прямо через
воронку водоуказательной колонки в парогенератор);
Наличие предварительного
вакуумирования для эффективного удаления воздуха из стерилизационной камеры;
Возможность применения различных
режимов предварительного вакуумирования и сушки.
Паровой стерилизатор ВК 75 имеет два
режима стерилизации:
132° C - 20 мин при давлении 0,2 МПа;
120° C - 45 мин при давлении 0,11 МПа.
При температуре 132 °С, давлении
пара в стерилизационной камере 2 атм. в течение 20 мин рекомендуют стерилизацию
для изделий из антикоррозийного материала, стекла, текстильных материалов.
При температуре 120 °С, давлении
пара 1,1 атм. в течение 45 минут рекомендуют стерилизацию для изделий из резины
и латекса, полимерных материалов.
Объекты, стерилизуемые насыщенным
паром: вода очищенная и для инъекций, растворы, жирные масла, изделия из
стекла, фарфора, металла, перевязочные и вспомогательные материалы (вата,
марля, бинты, фильтровальная бумага, пергамент), спецодежда, резиновые перчатки
и др. (их стерилизуют в стерилизационных коробках - биксах или в двухслойной
упаковке из бязи, пергамента). Воду, масла, растворы стерилизуют в герметично
укупоренных, предварительно стерилизованных бутылях, флаконах, ампулах. Время
стерилизации зависит от физико-химических свойств объекта, объема или массы
раствора, используемого оборудования. Например, жирные масла в герметично
укупоренных сосудах стерилизуют при 120°С в течение 2 ч (табл.1).
Таблица 1. Продолжительность
стерилизации насыщенным паром в зависимости от вида объекта
|
Объект
|
мин,при
120 °С
|
мин,при
132 °С
|
|
Водные
растворы: до 100 мл 100 - 500 мл 500-1000 мл
|
8
12 15
|
-
- -
|
|
Посуда,
воронки цилиндры, ступки, шпатели (в биксах или двуслойных упаковках из бязи,
пергамента)
|
45
|
20
|
|
Вспомогательный
материал (ватные тампоны, марлевые салфетки, пергаментные прокладки, фильтры
бумажные - в биксах)
|
45
|
20
|
|
Одежда,
перевязочный материал, салфетки, полотенца (в биксах)
|
45
|
-
|
|
Резиновые
пробки, изделия из латекса (в биксах)
|
120
|
-
|
|
Масла
жирные, масляные растворы, вазелин, ланолин безводный в герметичной таре
|
120
|
-
|
Конкретизация отдельных режимов (например, при
температуре ниже 120 °С) применительно к определенным объектам в
соответствовать требованиям НД.
. Соответствие организации и состояния
термической стерилизации в аптеке соответствующим требованиям
В исследуемой мной аптеке, ООО
"Фармлекс" (аптека №42), полностью соблюдаются требования к
термической стерилизации.
Асептический блок аптеки состоит из следующих
комнат: асептической, предасептической (тамбура), аппаратной. В асептической
производятся непосредственное приготовление лекарств, в аппаратной размещается
тепло- и паровыделяющая аппаратура (автоклав, дистилляционные аппараты и др.).
Асептическая и аппаратная сообщаются через тамбур, выполняющий роль шлюза,
который препятствует загрязнению воздуха асептической извне. Тамбур
используется для подготовки сотрудников к работе. В нем обрабатываются руки,
надевают стерильную одежду и респиратор. В перегородке, отделяющей асептическую
от аппаратной и асептическую от смежного с ней помещения ассистентской
(изготавливаются лекарственные формы для внутреннего употребления и наружного
применения), имеется окно-шлюз, оснащенное бактерицидными лампами, для передачи
приготовленных лекарств и необходимых материалов.
В тамбуре и аппаратной смонтированы умывальники
с подводкой холодной и горячей воды. Также в аппаратной устроены краны для
питания дистилляционного аппарата и водоструйного насоса. В тамбуре имеются
встроенные шкафы - для хранения спецодежды, спецобуви, биксов с комплектами
стерильной одежды; в стерилизационной- для хранения инвентаря.
Стерильную посуду и приборы в аптеке хранят под
стеклянными колпаками.
В асептическом блоке постоянно поддерживается
безупречная чистота: пол, стены и оборудование ежедневно моется теплой водой с
мылом. За 1 1/2-2 ч до начала работы включают потолочные (ПБО) и настенные
(НБО) бактерицидные облучатели.
Ассистенты, занятые изготовлением стерильных
лекарств, соблюдают все правила личной гигиены: работают в стерильных наглухо
закрытых (хирургических) халатах и специальных обуви, рот и нос закрывают
стерильной марлевой повязкой (маской), перед работой тщательно моют руки теплой
водой, мылом и щеткой и обсушивать их стерильным полотенцем или над
обогревателем.
Помещения асептического блока в аптеке
расположено с учетом рациональной организации всего производственного цикла,
вдали от торгового зала, санитарного узла, так как воздух этих помещений
наиболее загрязнен.
В исследуемой мной аптеке стерилизацию проводят
в автоклаве К-75, имеющим 2 режима стерилизации : 132° C - 20 мин при давлении
0,2 МПа;
120° C - 45 мин при давлении 0,11 МПа.
Стерилизацию проводит специалист, прошедший
специальную подготовку и проверку знаний и имеющий документ удостоверяющий это.
Стерилизация растворов проводится не позднее, чем 3 часа с момента изготовления
раствора, в герметично укупоренных флаконах или бутылках. Стерилизация проводится
только один раз, повторная стерилизация не допускается. Стерилизацию объектов
проводят в стерилизационных коробках, биксах или в двухслойной упаковке из бязи
или пергамента. К заполненным коробкам или упаковкам прикрепляют бирку с
наименованием содержимого и датой стерилизации. При стерилизации инъекционных
растворов обязательно проводят контроль термической стерилизации.
Для достижения максимальной эффективности
стерилизации из стерилизационной камеры и стерилизуемых объектов полностью
удаляют воздух. Объекты в стерилизационной камере должны быть расположены так,
чтобы обеспечить свободное проникновение к ним пара. Стерилизаторы снабжены
паровой рубашкой для сокращения продолжительности цикла стерилизации и
равномерности прогрева объема стерилизационной камеры.
Загрузку стерилизационной камеры осуществляют
только растворами одного наименования, одной партии, одинакового объема при
наполнении бутылки не более 0,8 - 0,83 % ее полной вместимости. Извлекают
бутылки из стерилизационной камеры, во избежание их растрескивания, при
температуре не выше 60 °С. Статистика показывает, что бой стеклянных бутылок с
растворами в среднем составляет 5 -6 %.
При загрузке автоклава тяжелые инструменты
располагают на нижних поддонах, а более легкие - на верхних, чтобы водяной пар
свободно циркулировался, а конденсат - своевременно выводился.
. Контроль качества термической стерилизации в
аптеке
В исследуемой мной аптеке контроль качества
стерилизации осуществляется согласно методическим указаниям МУ N 90-9908
«Контроль качества стерилизации изделий медицинского назначения».
Контроль качества термической стерилизации в
аптеке осуществляют с помощью контрольно-измерительных приборов, химических
тестов, бактериологического контроля (споры-тест).
Самоконтроль работы стерилизаторов проводит
персонал ЛПУ физическим и химическим методами - при каждой загрузке
стерилизаторов, бактериологическим - ежемесячно. Специалисты
санитарно-эпидемиологических учреждений проводят плановый контроль согласно
действующим нормативным документам.
Перед началом стерилизации специалист проверяет
состояние автоклава и контрольно-измерительных приборов. Проводит физический
метод контроля эффективности работы стерилизационного оборудования: с помощью
средств измерения температуры (термометров), давления (манометров) и времени
(таймера). Температурный режим парового стерилизатора проверяют максимальными
термометрами со шкалой на 150 °С или термопарами. Погрешность измерения не
должна превышать ±1°С. Проверку температурного режима максимальными термометрами
проводят 1 раз в две недели. С помощью максимального термометра можно
установить неисправность манометра.
Физический метод контроля качества стерилизации:
берется пробирка, куда насыпают какое-либо вещество, плавящееся при температуре
около 120 градусов - бензойная кислота. Недостаток этого способа контроля
состоит в том, что мы видим что порошок расплавился и значит необходимая
температура достигнута, но мы не можем быть уверены что она была такой на
протяжении всего времени экспозиции.
Химический контроль: берут фильтровальную
бумагу, помещают ее в раствор крахмала, после чего погружают в раствор Люголя.
Она приобретает темно-бурый цвет. После экспозиции в автоклаве крахмал при
температуре свыше 120 градусов разрушается, бумажка обесцвечивается. Метод имеет
тот же недостаток что и физический.
Для контроля термической стерилизации с помощью
химических тестов используют вещества, изменяющие свой цвет или физическое
состояние при определенных параметрах стерилизации. В качестве химического
термоиндикатора парового метода используют смесь бензойной кислоты с фуксином
(10 : 1). Температура плавления этой смеси 121 °С. Ее фасуют по 0,3 - 0,5 г в
стеклянные запаянные трубочки (ампулы) или в герметично укупоренные флаконы
вместимостью 5-10 мл. Индикаторы закладывают вместе со стерилизуемыми
предметами. Расплавление порошка и превращение его в сплошную массу
свидетельствует, что температура стерилизации была равна точке плавления
контрольного вещества или превышала ее.
Для контроля стерилизации материалов, подвергаемых
обработке при 120 °С (45 мин) и 132°С (20 мин), используют термовременные
индикаторы ИС-120 и ИС-132, которые показывают не только температуру, но и
время стерилизации, - полосок бумаги с индикаторным слоем, изменяющим свой цвет
до эталонного или темнее. Отработанные индикаторы подклеивают в «Журнал
контроля работы стерилизаторов».
Медицинский персонал, использующий средства
физического и химического контроля, регистрирует результаты контроля в журнале
по форме N 257/у.
Бактериологический контроль работы
стерилизационной аппаратуры осуществляют с помощью биотестов, оценивающих
гибель спор термоустойчивых микроорганизмов. Биотесты представляют собой
дозированное количество спор тест-культуры на носителе (или в нем), помещенном
в упаковку, которая предназначена для сохранения целостности носителя со
спорами и предупреждения вторичного обсеменения после стерилизации. В качестве
носителей можно использовать инсулиновые флаконы, чашечки из алюминиевой фольги
(для паровых стерилизаторов). Упакованные биотесты помещают в те же контрольные
точки стерилизационной камеры, что и средства физического и химического
контроля.
Основанием для заключения об эффективной работе
стерилизационной аппаратуры является отсутствие роста тест-культуры при
бактериологических исследованиях всех биотестов в сочетании с
удовлетворительными результатами физического и химического контроля.
|
Контролируемые
показатели
|
Контролируемые
позиции
|
|
Обеспечение
требуемых значений параметров режимов стерилизации
|
Работа
стерилизационного аппарата (с помощью средств физического, химического и
бактериологического контроля) Химическое стерилизующее средство: качество
средства (соответствие регламентированным значениям контролируемых
показателей); соблюдение срока и условий хранения средства; соблюдение правил
приготовления, хранения и применения рабочих растворов. Режим стерилизации
раствором химического средства: концентрация действующего вещества в растворе
(при наличии соответствующих химических индикаторов), температура раствора,
время выдержки в растворе.
|
|
Обеспечение
необходимых сопутствующих условий стерилизации
|
Стерилизационная
упаковка: соответствие упаковочного материала методу стерилизации; соблюдение
правил применения упаковочного материла. Правильность загрузки/размещения
изделий при стерилизации в емкостях с растворами, в упаковках, в рабочих
камерах оборудования. Обеспечение асептических условий после прекращения
действия стерилизующего объекта.
|
|
Результат
совокупного действия всех факторов осуществленного процесса стерилизации
|
Результат
совокупного действия всех факторов осуществленного процесса стерилизации.
Стерильность изделий.
|
Виды контроля стерилизации в аптеке.
. Рекомендации по совершенствованию термической
стерилизации в аптеке
Изучив теоретический материал и проведя
исследование можно сделать вывод, что все условия стерилизации соблюдаются в
исследуемой мной аптеке.
Единственный недостаток, на мой взгляд - старое
оборудование.
Сейчас есть возможность использования больших
паровых стерилизаторов (напр.UNISTERI HP, SYERIVAP, SYERIVAP HP, SELECTOMAT PL,
SELECTOMAT SL).Объем их камер составляет от 73 до 1490 литров, по сравнению с
ВК-75, используемый в исследуемой мной аптеке - 75л, т.е. одновременно можно
стерилизовать большую партию растворов или изделий медицинского назначения. Эффект
стерилизации обеспечивается за счет непосредственного воздействия насыщенного
водяного пара при заданных значениях температуры, давления и продолжительности
стерилизации. Обычно применяются температуры 121 ºС
и 134 ºС
при времени экспозиции стерилизации от 4 до 60 мин в зависимости от назначения.
Управление на базе двух микропроцессоров, независимый процесс управления и
регистрации цикла стерилизации, широкий набор программного обеспечения, включая
сервисные программы.
Для контроля и архивации документации процессов стерилизации служит принтер,
входящий в стандартное оснащение. Для обеспечения современного и удобного
способа представления протоколов отдельных циклов и их надежного хранения на
жестком диске аппарат можно подключить к компьютеру или компьютерной сети.
Таким образом, можно повысить эффективность работы при упаковке инструментов и
возможность прослеживания и хранения данных процессов упаковки, стерилизации и
использования инструментов.
Определенный интерес представляет также
совершенствование конструкции уже существующих моделей стерилизаторов (ВК-75).
В паровом стерилизаторе ВК-75-1 предусмотрено автоматическое управление циклом
стерилизации, что выгодно отличает аппарат от отечественного аналога ВК-75. В
стерилизаторе имеется возможность установки 2 фиксированных режимов, кроме
того, предусмотрен свободный выбор параметров режимов стерилизации в диапазоне
температур от 110 до 141°С и возможность ручного управления процессом. Автоклав
обзавелся более надежными кранами и предохранительным клапаном.
Также о необходимости нового оборудование может
свидетельствовать то, что в исследуемой мной аптеке, при извлечении стеклянных
бутылок с растворами из стерилизационной камеры - бой в среднем составляет 5
-6%. Для снижения боя бутылок современные паровые стерилизаторы оборудуют
устройством принудительного охлаждения объектов и устройством для создания
противодавления сжатым стерильным воздухом.
IV.Выводы и предложения
Стерилизация изделий медицинского назначения,
медицинских инструментов, растворов - процесс удаления микроорганизмов всех
видов, находящихся на всех стадиях развития.
Качество проводимых стерилизационных мероприятий
во многом зависит от правильного выбора метода и аппаратуры стерилизации. При
выборе стерилизующих средств и метода стерилизации учитывают особенности
стерилизуемых изделий, особенности стерилизующих средств.
В технологии лекарственных форм используют
разные методы стерилизации: термические методы (паровой и воздушный),
стерилизация фильтрованием, радиационная стерилизация, химическая стерилизация
(газовая или химическими растворами (стерилянтами)).
Термические методы стерилизации имеют ряд
преимуществ: надёжность, отсутствие необходимости удаления стерилянтов с
предметов медицинского назначения, удобство работы персонала, стерилизация
проводится в упаковках, что позволяет сохранить стерильность некоторый период
времени. Паровая стерилизация под давлением считается наиболее эффективным
методом, так как чем выше давление, тем выше температура пара, стерилизующего
материал; бактерицидные свойства пара выше, чем воздуха, поэтому для
стерилизации применяют пересыщенный пар.
В исследуемой мной аптеке используется паровой
стерилизатор ВК-75, обслуживающий персонал аптеки привык им пользоваться и
высоко о нем отзывается, благодаря простому, удобному и интуитивно понятному
управлению. Паровой метод стерилизации служит единственным гарантированным
методом стерилизации термоустойчивых изделий медицинского назначения в производственных
аптеках.
В исследуемой мной аптеке контроль качества
лекарственных средств полностью контролируется в соответствии приказом МЗ РФ №
309 от 21.10.97 “Об утверждении инструкции по санитарному режиму аптечных
организаций (аптек)”, приказом МЗ РФ № 214 от 16.07.97 “О контроле качества
лекарственных средств, изготовляемых в аптеках” и др.
Контроль качества термической стерилизации в
исследуемой мной аптеке осуществляют с помощью контрольно-измерительных
приборов, химических тестов, бактериологического контроля (споры-тест).
V. Литература
.
Государственная фармакопея XI издания.
.
Государственная Фармакопея X издания. - Москва. - "Медицина", 1968 г.
.
Чуешов В.И. Промышленная технология лекарств (2 тома). Учебник для ВУЗов. Том
2. Издательство НФАУ, 2002 год. - 716 с.
.
Муравьев И.А. Технология лекарств (2 тома). Том 2. Издательство
"Медицина", 1980 год. - 704 с.
.
Технология лекарственных форм под редакцией Л.А. Ивановой. Том II. Москва,
"Медицина", 1991 г., 544 с.
.
Бобылев Р.В., Грядунова Г.П., Иванова Л.А. и др. Технология лекарственных форм.
/ Бобылев Р.В. - М.: «Медицина», 1991, т. 2, с. 491-503
.
Кондратьева Т.С., Иванова Л.А., Зеликсон Ю.И. и др. Технология лекарственных
форм. Том 1./ Т.С. Кондратьева, Л.А. Иванова, Ю.И. Зеликсон и др.; Под редакцией
Т.С. Кондратьевой. - М.: Медицина, 1991 - 333 - 416 с.
.
Лекции кафедры.
.
Макарова В.Г., Узбекова Д.Г., Якушева Е.Н. и др. Рецептура. Учебное пособие. -
Рязань, 2002. - 165с.
.
Муравьев И.А. Технология лекарств. Изд. 3-е, перераб. и доп. Т.1. - М.:
Медицина, 1980. - 623с.
.
Николаев Л.А. Лекарствоведение: учебное 2-е изд., испр. и под. - Минск: Высшая
школа, 1988. - гл.5.
.
Приказ МЗ РФ № 309 от 21.10.97 “Об утверждении инструкции по санитарному режиму
аптечных организаций (аптек)”.
.
Приказ МЗ РФ № 214 от 16.07.97 “О контроле качества лекарственных средств,
изготовляемых в аптеках”.
.
Руководство к лабораторным занятиям по аптечной технологии лекарственных форм.
Под ред. Т.С. Кондратьевой. - М.: Медицина, 1986. - 347с.
.
Синев Д.Н., Марченко Л.Г., Синева Т.Д. Справочное пособие по аптечной
технологии лекарств. Изд. 2-е, перераб. и доп. - СПб: Издательство СПХФА,
Невский Диалект, 2001. - 428с.
.
Справочник фармацевта. Под ред. Тенцовой А.И. - М.: Медицина, 1995. - 276с.
.Стерилизация
изделий медицинского назначения сухим горячим воздухом при температуре 160°С /
Н.В.Рамкова, Р.Л.Гутерман и др.//Вопросы дезинфекции и стерилизации ,1986 .-С
.54-68.
.
Химические тесты для контроля температурных параметров режимов работы паровых и
воздушых стерилиэаторов. Совремешше методы в средства дезинфекции и,
стерилизация / Р.Л.Гутерман, В.А. Попков, Л.А.Сарян 1989.-С.78-82.
.
Использование термического анализа для разработки химических тестов
стерилизации / Р. Л.Гутерман ,Н.В.Рамкова, В.А.Попков, Л.А.Сарян. В.Ю.Решетняк,
З.Е. Лаяинина, H.A. Маторина, М.И.Леви - 1989.
.
Бактериологический контроль эффективности работы паровых и воздушных
стерилизаторов в лечебно-профилактических учреждениях г.Москвы / Р.Л.Гутерман,
ВЛ.Бессонова, Е.М.Гагуа, М.М.Лившиц.
.
Гутерман Р.Л. Оперативный контроль работы паровых и воздушных стерилизаторов с
использованием химических тестов // Актуальные вопросы совершенствования
дезинфекционных и стерилизационных мероприятий. -М.,1990. -4.2. -С.46-51.
.
Гутерман Р.Л. Средства контроля работы паровых и воздушных стерилизаторов //
Дезинфекционное дело. - 1992 - С.18-22.