Лекарственные средства стероидных гормонов и их синтетические аналоги
Лекарственные
средства стероидных гормонов и их синтетические аналоги
Введение
Гормональные препараты − это
лекарственные средства, которые содержат гормоны
<#"818930.files/image001.gif">
Стероидные гормоны разделяются
на три группы:
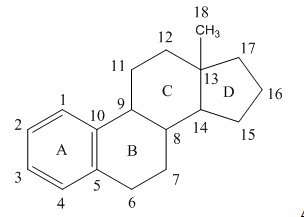
. Эстран, образуемый путем
присоединения к стерану метильной группы СН3, является материнским соединением
для всех эстрогенных гормонов, в состав которых входят 18 атомов углерода.
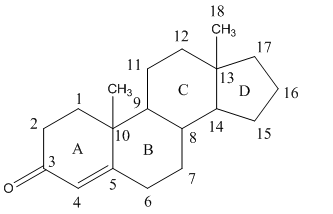
. Андростаи, образуемый путем
присоединения к стерану двух метильных групп, является материнским соединением
для андрогенов.
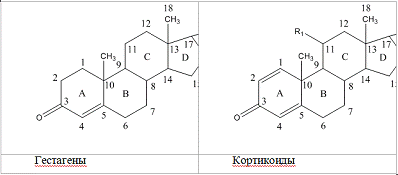
. Группа С 21 атомом углерода
(С21), к которой относятся гестагеиы (прогестероновые соединения), а также
кортикоиды. Они содержат две метальные группы (СН3), а к 17-му атому углерода
присоединена этильная группа СН2-СН3.
По физиологическому действию
выделяют четыре наиболее общие группы стероидных гормонов: минералкортикоиды,
глюкокортикоиды, андрогены и эстрогены. Основными представителями этих каждой
из этих групп являются альдостерон, кортизол, тестостерон и эстрадиол
соответственно. Кроме того, выделяют группу прогестагенов, основным
представителем которой является прогестерон.
Дополнительно разделяют
стероидные гормоны из этих пяти групп на две условные группы: половые гормоны
(прогестагены, андрогены и эстрогены) и кортикостероиды (минералкортикоиды и
глюкортикоиды).
1.1 Кортикостероиды и их
синтетические аналоги
Корковый слой надпочечниковых
желез вырабатывает гормоны, которые называют кортикостероидами. Во всех
гормонах этого ряда в положении 3 стероидного цикла всегда находится
кетогруппа, двойная связь в положении 4. В положении 17 у всех кортикостероидов
есть лабильная б-кетольная группа и поэтому они все являются восстановителями.
По действию на организм
кортикостероиды условно разделяют на две группы: минералокортикоиды и
глюкокортикоиды. Первая из них активно регулирует минеральный обмен и слабо
влияет на углеводный и белковый обмен. Проявлению минералокортикоидной
активности способствует отсутствие кислородной функции (кето- или оксигруппы) в
положении 11 стероидного цикла и оксигруппы в положении 17. Минералокортикостероидом,
который чаще всего применяется в медицинской практике, является
дезоксикортикостерона ацетат (ДОКСА).
Основными представителями
второй группы - эндогенными (природными) глюкокортикостероидами являются
кортизол (гидрокортизон) и кортизон. Они активно влияют на углеводный и
белковый обмены, но менее активны относительно водного и солевого обменов.
Способствуют накоплению в печени гликогена, повышают содержание глюкозы в
крови, вызывают увеличение выведения азота с мочой. Глюкокортикостероиды
проявляют противовоспалительное, десенсибилизирующее и антиаллергическое
действие, имеют противошоковый и антитоксический эффект.
Высокая терапевтическая
активность кортизона и гидрокортизона сопровождается рядом нежелательных
побочных эффектов: нарушением водно-солевого обмена и обмена азота, отеками,
повышением содержания сахара в крови. Длительное применение приводит к
угнетению функций коры надпочечниковых желез.
С целью уменьшения побочных
эффектов, усиления противовоспалительной, десенсибилизирующей и антигистаминной
активности получен ряд синтетических аналогов кортизона и гидрокортизина. Так,
введением двойной связи в положении 1 синтезирован преднизолон.
Введение атома фтора в 9 б-,
метильной или оксигрупп в 16 б- положение получены дексаметазон и триамцинолон.
Они обладают минимальной минералокортикоидной активностью, но их
противовоспалительная активность в 20 -40 раз превышает активность
гидрокортизона.
Флуметазона пивалат и
флуоцинолона ацетонид (синафлан), которые содержат атомы фтора в 9 б- и 6 б-
положениях, имеют очень высокую противовоспалительную активность (в 150 - 300
раз превышают активность гидрокортизона). Вместе с тем они практически не
всасываются при местном применении и поэтому, в отличие от других
кортикостероидов, не вызывают побочных эффектов.
.1.1 Свойства и идентификация
кортикостероидов
Гормоны кори надпочечников и их
синтетические аналоги - это белые кристаллические вещества, которые иногда
имеют желтоватый или кремовый оттенок, без запаха. Они практически нерастворимы
в воде, тяжело или мало растворимы в большинстве органических растворителей.
Дезоксикортикостерона ацетат и кортизона ацетат легко растворяются в
хлороформе. Кортикостероиды и их аналоги являются правовращающими оптическими
изомерами.
В методах идентификации лекарственных
веществ из группы кортикостероидов и их аналогов много общего. При нагревании
на водяной бане смеси спиртового раствора вещества и медно-тартратного реактива
выпадает красно - оранжевый осадок купрум (I)
оксида. Реакция обусловлена восстановительными свойствами б - кетольной группы,
которая легко окисляется до карбоксильной:
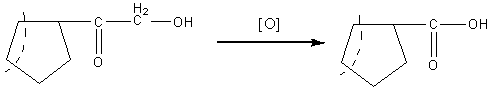
Кроме медно-тартратного реактива,
как окислители могут быть использованы аммиачный раствор серебра нитрата
(реакция «серебряного зеркала»), фосфорномолибденовая кислота, соли железа (III).
При окислении кортикостероидов
этанольным раствором трифенилтеразолия хлоридом в присутствии раствора
тетраметиламмония гидроксида, как продукт восстановления образуются окрашенные
в красный цвет фармазоны:
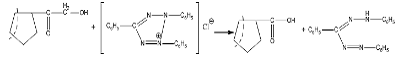
Реакцию используют для идентификации
и количественного определения методом спектрофотометрии.
.1.2 Лекарственные субстанции из
группы кортикостероидов
Дезоксикортикостерона
ацетат
Desoxycorticosteroni
acetas
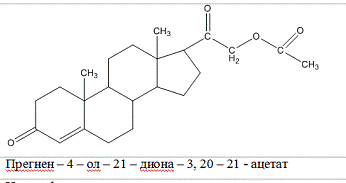
Идентификация:
Восстанавливает
медно-тартратный реактив (б - кетольная группа); дает красно-коричневое
окрашивание в реакции гидроксамовой пробы (21-ацетат). При растворении в
сульфатной концентрированной кислоет и дальнейшем добавлении воды появляется
вишневое окрашивание с зеленовато-коричневой флюоресценцией. После добавления
хлороформа и встряхивания нижний слой окрашивается в желтый цвет, верхний - в
зеленый (стероидный цикл).
Количественное
определение:
Спектрофотометрия в УФ-свете.
В 0,5 % масляном растворе для
инъекций содержание действующего вещества определяют фотоколориметрическим
методом после нагревания с фосфорной концентрированной кислотой.
Применение:
Для лечения болезни Аддисона,
миастении, астении, общей мышечной слабости и других заболеваний.
Кортизона ацетат
Cortisoni
acetas
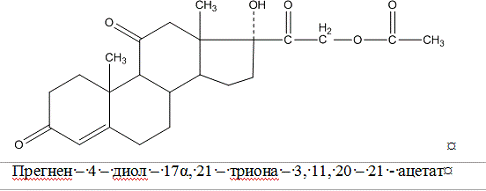
Идентификация:
Дает желтое окрашивание с
фенилгидразина сульфатом (кетогруппа в положении 3); восстанавливает
медно-тартратный реактив (б - кетольная группа); дает темно-вишневое
окрашивание в реакции гидроксамовой пробы (21 - ацетат). При растворении в
сульфатной концентрированной кислоте постепенно появляется желтое окрашивание
(стероидный цикл); через 15 -20 мин. наблюдается желтая флюоресценция (отличие
от преднизолона).
Количественное
определение:
Спектрофотометрия в УФ-свете в
спиртовом растворе при л=238 нм при сравнении со стандартным раствором.
Гидрокортизона
ацетатaсetas
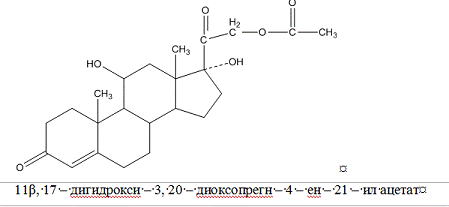
Свойства:
Кристаллический порошок белого
или практически белого цвета. Практически нерастворимый в воде, малорастворимый
в этаноле и метиленхлориде. Плавится при температуре около 2200 с
разложением.
Идентификация:
1. Физико-химические методы:
ИК-спектроскопия, тонкослойная хроматография.
. При растворении в сульфатной
концентрированной кислоте образуется интенсивное коричневато-красное
окрашивание с зеленой флюоресценцией, особенно интенсивной в УФ-свете.
Полученный раствор добавляют в воду и перемешивают; раствор обесцвечивается, а
флюоресценция не исчезает (стероидный цикл).
. Субстанция дает характерную реакцию
на ацетил.
. Нефармакопейные реакции: а)
восстановление медно-тартратного реактива; б) с трифенилтетразолия хлоридом в
спиртовой среде в присутствии калия гидроксида дает красное окрашивание (б -
кетольная группа); в) вступает в реакцию образования этилацетата и
ацетилгидроксамата железа (III)
(21 - ацетат); г) с изониазидом в присутствии хлористоводородной кислоты или
фенилгидразином в присутствии сульфатной кислоты дает желтое окрашивание
(кетогруппа в положении 3).
Количественное
определение:
Спектрофотометрия. Содержание
действующего вещества расчитывают по методу удельного показателя поглощения.
Дексаметазон
Dexamethasonum
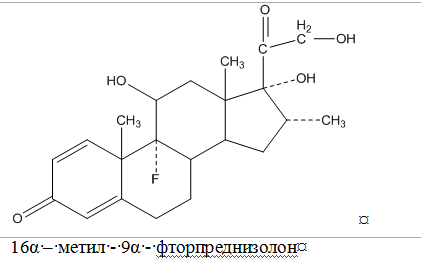
Идентификация:
При нагревании спиртового
раствора дексаметазона с фенилгидразина сульфатом появляется желтое окрашивание
(кетогруппа в положении 3). При растворении субстанции в сульфатной
концентрированной кислоте через 5 мин. появляется слабое красно-коричневое
окрашивание, которое исчезает после добавления воды (стероидный цикл). Возможно
применение УФ- и ИК-спектроскопии, а также тонкослойной хроматографии.
Триамцинолон
Triamcinolonum
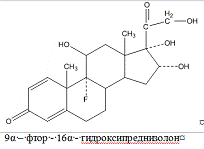
Идентификация:
Наличие фтора в структуре
триамцинолона определяют после сжигания в колбе с кислородом по реакции с тория
нитратом в присутствии ализаринового красного в среде буферного раствора калия
гидрофталата. Параллельно проводят контрольный опыт. Окрашивание контрольного
опыта должно быть интенсивнее, чем в исследуемом растворе. Также возможно
применение УФ- и ИК-спектроскопии.
Количественное определение:
спектрофотометрия.
Флюоцинола ацетонид
Fluocinoli
acetonidum
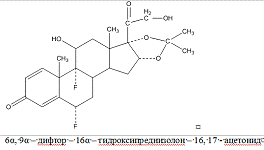
Идентификация:
ИК-спектроскопия, тонкослойная хроматография.
Количественное
определение: проводится спектрофотометрически по
продуктам реакции с трифенилтетразолия хлоридом.
Флюметазона пивалат
Flumetasoni
pivalus
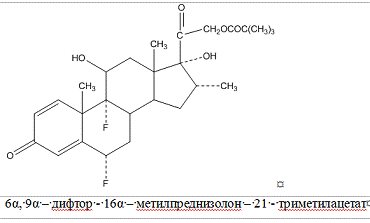
3. Расчетная задача
Rp.:
Tab.
Prednisoloni
0,005
Идентификация:
1 г порошка растертых таблеток помещают в
небольшую колбу, прибавляют 20 мл хлороформа, взбалтывают в течение 5 мин. и
фильтруют. Фильтрат упаривают приблизительно до 5 мл и добавляют 15 мл
изооктана. Выпавший осадок отфильтровывают. Полученный осадок используют для
проведения реакций идентификации.
. 1 мг осадка растворяют в 1 мл метилового
спирта, прибавляют 5 мл фенилгидразина сульфата и нагревают на водяной бане;
через 5 мин. появляется желтое окрашивание.

. 0,01 г осадка растворяют в 1 мл метилового
спирта, прибавляют 1 мл реактива Фелинга и нагревают на водяной бане;
образуется красно-оранжевый осадок.
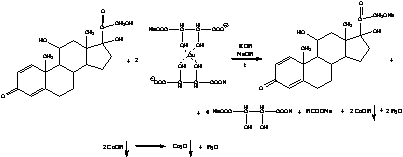
3. 1 мг осадка растворяют в 2 мл
концентрированной серной кислоты; через несколько минут появляется красное
окрашивание (отличие от преднизолона и кортизона ацетата).
. Температура плавления 227 - 2300
(с разложением).
. Удельное вращение от +960
до +1040 (1% раствор в диоксане из высушенного осадка).
Количественное определение:
0,06-0,07 г (точная навеска) порошка
растертых таблеток помещают в небольшой стакан, прибавляют 10 мл метилового
спирта и растворяют преднизолон при легком подогревании на водяной бане и
помешивают палочкой в течение 10 минут. После охлаждения раствор фильтруют в
мерную колбу емкостью 100 мл с притертой пробкой. Стакан промывают метиловым
спиртом, фильтруют через тот же фильтр. Объем раствора доводят метиловым
спиртом до метки и хорошо перемешивают. Измеряют оптическую плотность
полученного раствора на спектрофотометре при длине волны 242 нм в кювете с
толщиной слоя 1 см. в качестве контрольного раствора применяют метиловый спирт.
Содержание преднизолона в одной
таблетке в граммах (Х) вычисляют по формуле:
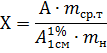
Содержание преднизолона должно быть
0,0045 - 0,0055 г, считая на средний вес одной таблетки.
Расчеты:
|
m
ср.т=
0,05 г X=0,005 г m
н=0,06543
г 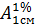 =
415 =
415
|
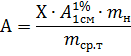 А
= 2,72 Ответ: А=2,72 А
= 2,72 Ответ: А=2,72
|
Заключение
Гормональные препараты − это
лекарственные средства, которые содержат гормоны
<http://ru.wikipedia.org/wiki/%D0%93%D0%BE%D1%80%D0%BC%D0%BE%D0%BD%D1%8B>
или гормоноиды, которые проявляют фармакологические
<http://ru.wikipedia.org/wiki/%D0%A4%D0%B0%D1%80%D0%BC%D0%B0%D0%BA%D0%BE%D0%BB%D0%BE%D0%B3%D0%B8%D1%8F>
эффекты подобно гормонам.
Стероидные гормоны - группа
физиологически активных веществ (половые гормоны, кортикостероиды и др.), регулирующих
процессы жизнедеятельности у животных и человека.
Стероидные гормоны - один из
главных классов гормональных соединений всех видов позвоночных и многих видов
беспозвоночных животных. Они являются регуляторами фундаментальных процессов
жизнедеятельности многоклеточного организма - координированного роста,
дифференцировки, размножения, адаптации, поведения.
Все стероидные гормоны берут
начало от углеводорода стерана, структурной основой которого является
циклопентанпергпдрофенантреновое ядро, образованное четырьмя соединенными между
собой углеродными кольцами: три кольца состоят из 6, а четвертое - из 5
углеродных атомов.
По физиологическому действию
выделяют четыре наиболее общие группы стероидных гормонов: минералкортикоиды,
глюкокортикоиды, андрогены и эстрогены.
Корковый слой надпочечниковых
желез вырабатывает гормоны, которые называют кортикостероидами. Во всех
гормонах этого ряда в положении 3 стероидного цикла всегда находится
кетогруппа, двойная связь в положении 4. В положении 17 у всех кортикостероидов
есть лабильная б-кетольная группа и поэтому они все являются восстановителями.
По действию на организм кортикостероиды условно
разделяют на две группы: минералокортикоиды и глюкокортикоиды.
Гормоны кори надпочечников и их
синтетические аналоги - это белые кристаллические вещества, которые иногда
имеют желтоватый или кремовый оттенок, без запаха.
В методах идентификации
лекарственных веществ из группы кортикостероидов и их аналогов много общего.
Для количественного определения
чаще всего применяют спектрофотометрию.
Список литературы
стероидный гормон фармакологический
лекарственный
1. Фармацевтична хімія. Підручник
для студентів вищ. фармац. начальних закладів і фарм. фак. вищих мед.
навчальних закладів III-IV рівнів
акредитації / За заг. ред. П.О. Безуглого. - Вінниця: Нова книга, 2008. - 560
с.
. Беликов В.Г. Фармацевтическая
химия. В 2 частях. Часть 1. Общая фармацевтическая химия: Учеб. для фармац.
ин-тов и фак. мед. ин-тов. -- М.: Высш. шк., 1993. - 432 с.
. Глущенко Н.Н. Фармацевтическая химия:
Учебник для студ. сред. проф. учеб. заведений / Н.Н. Глущенко, Т.В. Плетенева,
В.А. Попков; Под ред. Т.В. Плетеневой. -- М.: Издательский центр «Академия»,
2004. -- 384 с.
4. Государственная фармакопея
Украины / Государственное предприятие «Науково-експертний фармакопейний центр».
- 1-е изд. - Х.: РІРЕГ, 2001. - 503 с.
. Государственная фармакопея
СССР. - ХІ изд. - М.: Медицина; Вып. 1. - 1987. - 336 с.; Вып. 2 - 1989. - 400
с.
6. Компендиум
2013 - лекарственные препараты; под ред. В. Н. Коваленко, А.П. Викторова. - К.:
МОРИОН, 2013 - 1458 с.
7. Коренман И.М. Фотометрический
анализ - М.: Химия, 1970
.
Машковский М.Д. Лекарственные средства: В 2-х т. Т. 1. - 14-е изд. - М.: ООО
«Изд-во Новая волна», 2000. - 540 с.
9. Мелентьева Г.А., Антонова Л.А.
Фармацевтическая химия. -- М.: Медицина, 1985.-- 480 с.
. Фармацевтическая химия: Учеб.
пособие / Под ред. Л.П. Арзамасцева. - М.: ГЭОТАР-МЕД, 2004. - 640 с.
. Фармацевтический анализ
лекарственных средств / Под общей редакцией В.А. Шаповаловой - Харьков: ИМП «Рубикон»,
1995
. Фармацевтичний аналіз: Навч.
посіб. для студ. вищ. фармац. навч. закл. III--IV рівнів акредитації/П.О.
Безуглий, В.О. Грудько, С.Г. Леонова та ін.; За ред. П.О. Безуглого,-- X.:
Вид-во НФАУ; Золоті сторінки, 2001.-- 240 с.
. Халецкий A.M. Фармацевтическая
химия - Ленинград: Медицина, 1966