Кондуктометрическое титрование лекарственного препарата: фенибут
Тольяттинский
государственный университет
Институт
химии и Инженерной Экологии
Кафедра
«Химия и химические технологии и процессы»
Отчёт
о лабораторной работе
Кондуктометрическое
титрование лекарственного препарата: фенибут
Студент: Щеголева А.И.
Преподаватель: к.х.н.,
доцент, Писарева В.С.
Тольятти,
2014 г.
Теоретическая часть
Электрохимические методы основаны на
измерении электрических параметров электрохимических явлений, возникающих в
исследуемом растворе. Такое измерение осуществляют с помощью электрохимической
ячейки, представляющей собой сосуд с исследуемым раствором, в который помещены
электроды. Электрохимические процессы в растворе сопровождаются появлением или
изменением разности потенциалов между электродами или изменением величины тока,
проходящего через раствор.
Одной из разновидностей
электрохимических методов является кондуктометрия.
Метод заключается в измерении
электропроводности исследуемого раствора электролита. Таким образом,
аналитический сигнал, используемый в данном методе - электропроводимость
раствора.
Электропроводность - физическая
величина, характеризующая способность вещества проводить электрический ток под
воздействием электрического поля. [1] Единицы измерения электропроводности -
сименс на метр (См/м, См/см).
Области применения кондуктометрии
можно разделить на три большие группы:
. Кондуктометрия в физических
и физико-химических исследованиях как один из методов исследования строения
чистого вещества, растворов и кинетики физико-химических процессов.
. Аналитическая
кондуктометрия, в том числе и автоматические методы, применяемые для контроля
производственных процессов, используемая как один из методов электрохимического
анализа вещества.
. Кондуктометрическое
титрование, включая автоматические методы кондуктометрического титрования, как
один из методов объемного химического анализа, при котором точка
эквивалентности устанавливается кондуктометрически.
Аналитическую кондуктометрию обычно
разделяют на две группы методов: прямая и косвенная кондуктометрия.
В методах прямой кондуктометрии
концентрация вещества определяется по электропроводности раствора, если между
ними существует прямая пропорциональность. Метод используют для анализа
однокомпонентных растворов. Возможно также определение одного из компонентов в
двухкомпонентном растворе, если концентрация второго компонента неизменна.
<…>
Косвенная кондуктометрия заключается
в определении одного компонента в многокомпонентном растворе, при использовании
для анализа, кроме кондуктометрии, еще второго метода физико-химического
анализа (определения рефракции, вязкости, рН, плотности и т. п.). К косвенной
кондуктометрии относится также определение концентрации различных газов, когда
после реакции указанных газов в растворе с определенными веществами изменяется
электропроводность раствора. <…>
В кондуктометрическом титровании для
анализа индивидуальных веществ и разнообразных смесей используются самые
различные типы химических реакций: нейтрализации, осаждения и
комплексообразования в водных и неводных растворах. [4]
Кондуктометрию осуществляют с
помощью кондуктометров - приборов, измеряющих электропроводность веществ. Для
этого прибор, состоящий из двух электродов, погружают в кондуктометрическую
ячейку (рис.1) с исследуемым раствором известной концентрации. Высота слоя над
электродами должна быть не менее 3-4 см. Это необходимо потому, что в переносе
тока участвуют не только ионы, находящиеся в объеме между электродами, но и в
близлежащих слоях.
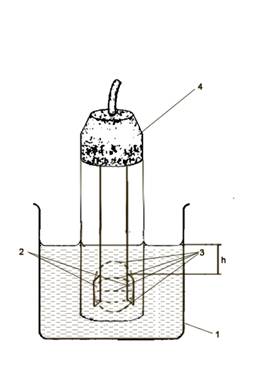
Рисунок 1 - Кондуктометрическая
ячейка: 1 - корпус ячейки; 2 - платиновые электроды; 3 - силовые линии в
межэлектродном пространстве; h - уровень раствора; 4 - корпус кондуктометра с
выводом к приборной панели и источнику тока
Принцип работы кондуктометра связан
с измерением сопротивления в растворе и расчете электропроводности как единицы,
обратной сопротивлению. Ионы в растворе под действием электрического тока
направленно перемещаются вдоль электрического поля, создавая электрическую
проводимость. Участие в электрической проводимости раствора принимают оба вида
ионов - катионы и анионы, но перемещаются в поле в противоположных
направлениях, поскольку имеют противоположные заряды. Сопротивление в растворе
создается за счет тормозящего действия на ионы молекул растворителя и
противоположно заряженных ионов. [3]
При кондуктометрическом титровании
электропроводность измеряют после добавления каждой порции титранта.
Зависимость электропроводности раствора от количества добавленного титранта
изображают графически. Полученный график называется кривой кондуктометрического
титрования (рис.2). Кондуктометрические кривые имеют излом, соответствующий
точке эквивалентности.
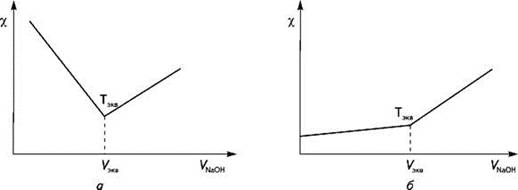
Рисунок 2 - Кривые кондуктометрического
титрования: а - титрование сильной кислоты; б - титрование слабой кислоты
Наблюдаемый ход кривых
кондуктометрических титрований легко объясним. При титровании сильной кислоты
электропроводность в исходном растворе высока, так как в нем присутствуют в
большой концентрации Н+-ионы, имеющие высокие значения
электропроводности. При титровании их концентрация уменьшается вследствие
реакции нейтрализации. На смену им начинают приходить низкопроводящие катионы
Na+, что приводит к уменьшению электрической проводимости.
Минимальное значение электропроводности будет достигнуто в точке
эквивалентности. Добавление избытка титранта приводит к росту электрической
проводимости вследствие появления в растворе избытка высокопроводящих ОН--ионов.
[3]
При титровании слабых кислот,
например уксусной, электрическая проводимость раствора в начале титрования
будет низкой из-за невысокой степени ионизации кислоты. При добавлении титранта
электрическая проводимость раствора начнет незначительно возрастать в результате
увеличения концентрации ионов Na+ и ацетат-ионов. Влияние H+-ионов
на электрическую проводимость раствора до точки эквивалентности будет невелико
в результате образования буферной системы CH3COOH + CH3COONa.
После точки эквивалентности электрическая проводимость раствора резко
возрастает вследствие появления в растворе избытка высокопроводящих OH--ионов.
[3]
Однако изменение электропроводности
раствора при титровании не всегда происходит линейно. Нелинейный ход кривой
титрования имеет место в тех случаях, когда реакция протекает неколичественно
или же в процессе титрования изменяется степень диссоциации или степень
гидролиза веществ, участвующих в реакции. [2] Для получения резких изломов на
кривых титрования необходимо учитывать эффект разбавление раствора. Его влияние
можно существенно снизить, применяя для титрования большие объемы разбавленного
анализируемого вещества и концентрированные растворы титранта. [3]
Кондуктометрическое титрование имеет
ряд преимуществ перед методом прямой кондуктометрии: высокую селективность,
возможность дифференцированного титрования смесей кислот или оснований,
возможность титрования мутных и окрашенных растворов. [3]
Цели и задачи работы
кондуктометрическое титрование
лекарственный фенибут
Цель работы: определение содержания
активного компонента в лекарственном препарате методом кондуктометрического
титрования.
Задачи:
1. Подготовить лекарственный
препарат к анализу.
2. Рассчитать теоретический
объем титранта, требуемый для титрования данного препарата.
. Подобрать индикатор для
кислотно-основного титрования.
. Провести кислотно-основное
титрование лекарственного препарата.
. Провести
кондуктометрическое титрование лекарственного препарата.
. Построить кривую
кондуктометрического титрования и найти точку эквивалентности.
. Определить относительную
погрешность и сделать выводы о проделанной работе.
Расчетная часть
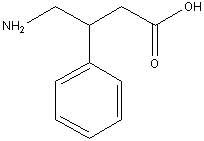
Препарат: фенибут (активное
вещество: аминофенилмасляная кислота).
Масса активного
вещества: 250 мг
Состав на 1 таблетку:
действующее вещество -
фенибут;
вспомогательные
вещества - лактоза, крахмал картофельный, кальция стеарат.
ИЮПАК: (±)-4-амино-3-фенилбутановая
кислота
Брутто-формула: C10H13NO2
Молярная масса: 179,216 г/моль.
Константа диссоциации: pKa = 4,05
Молекула препарата имеет две
функциональные группы: аминогруппу, проявляющую основные свойства, и
карбоксильную группу, обладающую кислотными свойствами.
Титровать препарат будем по
карбоксильной группе, т.е. как слабую кислоту. Титрант - сильное основание
NaOH.
Стандартизация раствора щелочи по
стандартному раствору хлороводородной кислоты:
. Предварительно вымытую бюретку
ополаскивают 2-3 раза малыми порциями (3.00-5.00 мл) приготовленного раствора
NaOH. Заполняют бюретку раствором щелочи выше деления «0», удаляют пузырьки
воздуха из носика бюретки, уровень раствора выставляют на нулевое деление по
нижнему мениску.
2. Отбирают аликвоту (20.00 мл)
стандартного раствора хлороводородной кислоты в коническую колбу для титрования
вместимостью 250.00 мл и добавляют 2-3 капли фенолфталеина.
. Титруют раствором щелочи сначала
быстро, а под конец по каплям до перехода бесцветной окраски в розовую,
одновременно содержимое колбы перемешивают плавным вращательным движением руки.
Операцию повторяют до получения не менее трех значений, расходящихся не более
чем на 0.30 %.
. Результаты измерений сводят в
таблицу 1.
Таблица 1. Стандартизация раствора
щелочи
|
№
|
V(0,1 н HCl), мл
|
V(NaOH), мл
|
Vсреднее(NaOH), мл
|
|
1
|
20,0
|
22,0
|
22,0
|
20,0
|
22,0
|
22,0
|
|
3
|
20,0
|
22,0
|
22,0
|
. Молярную концентрацию раствора
щелочи рассчитывают по формуле:
(NaOH) = C (HCl) * V (HCl) / V
(NaOH),
где V(HCl) - объем хлороводородной
кислоты в конической колбе, мл; V(NaOH) - объем щелочи, израсходованной на
титрование кислоты, мл; c(HCl) - молярная концентрация хлороводородной кислоты,
моль/л. Если значения молярной концентрации щелочи по результатам трех
титрований различаются не более чем на 0.30%, берут среднее арифметическое.
В итоге, концентрация
стандартизированного раствора щелочи:
C (NaOH) = 0,1 * 20 / 22 = 0,0909
моль/л
Расчет расхода титранта:
Одна таблетка препарата содержит 250
мг активного вещества. Рассчитаем, какой теоретический объем 0,0909 М титранта
потребуется для титрования.
Молярная масса аминофенилмасляной
кислоты М=179,216 г/моль.
Количество молей активного вещества:
(к-ты)= m/M = 0,25 г / 179,216
г/моль = 1,4*10-3 моль.
эквивалент аминофенилмасляной
кислоты вступает во взаимодействие с 1 эквивалентом щелочи. Объем 0,0909 М
щелочи, необходимый на титрование 1,4*10-3 моль вещества:
(NaOH) = (1,4*10-3 моль /
0,0909 моль/л)*1000 мл = 15,4 мл.
Аминофенилмасляную кислоту массой
250 мг (n = 1,4*10-3 моль) растворяем в 100 мл воды. На титрование
отбираем 25 мл. Таким образом, количество аминофенилмасляной кислоты в 25 мл
раствора:
(к-ты) = (0,25 г * 25 мл) / 100 мл =
0,35*10-3 моль;(к-ты) = 0,35*10-3 моль * 179,216 г/моль =
6,27*10-2 г.
На 0,25 г кислоты затрачивается 15,4
мл NaOH, тогда на 6,27*10-2 г кислоты щелочи понадобится:
(NaOH) = (6,27*10-2 г *
15,4 мл)/ 0,25 г = 3,86 мл.
Таким образом, на титрование
препарата должно затратиться 3,86 мл 0,0909 М раствора NaOH.
Подбор индикатора для титрования:
Индикатор должен менять цвет около
точки эквивалентности. Следовательно, для выбора индикатора необходимо
рассчитать показатель кислотности, характерный для точки эквивалентности:
= 7 +
½pKa + ½pCсоли
Количество моль соли, образующееся в
ходе титрования эквивалентно количеству моль кислоты n = 0,35*10-3
моль.
Концентрация соли, образующейся в
результате взаимодействия 25 мл раствора кислоты и 3,86 мл раствора щелочи:
Ссоли = (0,35*10-3
моль) / (25 мл + 3,86 мл) = 1,21*10-5 моль/мл = 1,21*10-2
М.соли = -lg Cсоли = -lg (1,21*10-2) = 1,917
Таким образом, показатель
кислотности среды, характерный для точки эквивалентности:
= 7 +
½pKa + ½pCсоли = 7 + ½*4,05 + ½*1,917
= 9,98
Интервал перехода окраски
фенолфталеина (8,2 - 10,0) находится вблизи полученного значения. Индикатор
меняет цвет с бесцветного (8,2) на малиновый (10,0).
Экспериментальная
часть
. Подготовка лекарственного
препарата к анализу
Измельчили с помощью фарфоровой
чашки и пестика 1 таблетку препарата, содержащую 250 мг активного вещества.
Навеску перенесли в стакан емкостью 50 мл и растворили в дистиллированной воде,
затем перенесли раствор в мерную колбу на 100 мл и довели до метки.
. Кислотно-основное
титрование
) Взяли пробу 25 мл
полученного раствора, перенесли в коническую колбу и добавили 3 капли
фенолфталеина.
) Заполнили бюретку на 25 мл
приготовленным раствором NaOH, доведя уровень раствора до нулевой отметки по
нижнему мениску.
) Оттитровали раствор кислоты
при постоянном помешивании до перехода бесцветной окраски раствора в розовую.
На нейтрализацию 25 мл раствора
кислоты потребовалось 4,0 мл раствора щелочи концентрацией 0,0909 М.
. Кондуктометрическое
титрование
) Взяли пробу раствора 25 мл,
перенесли в стакан емкостью 50 мл.
) В стакан опустили электрод
кондуктометра и измерили начальную электропроводность раствора.
) Затем добавляли по 1 мл
раствора титранта и каждый раз снимали показания кондуктометра. Полученные
данные занесены в таблицу 2.
Таблица 2. Данные
кондуктометрического титрования
|
Объем титранта, мл
|
Электропроводность, мкСм/см
|
|
0
|
592
|
|
1
|
547
|
|
2
|
522
|
|
3
|
488
|
|
4
|
492
|
|
5
|
638
|
|
6
|
742
|
На основании этих данных построена
кривая кондуктометрического титрования и определена точка эквивалентности (рис.
3).
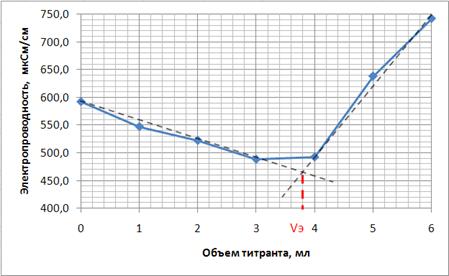
Рисунок 3 - Кривая
кондуктометрического титрования
Из графика найдена точка
эквивалентности, соответствующая объему затраченного титранта 3,8 мл. Таким
образом, на титрование аминофенилмасляной кислоты потрачено 3,8 мл 0,0909 М
раствора NaOH.
. Расчет содержания активного
компонента в препарате
· по данным
кислотно-основного титрования
Эквивалентный объем титранта
составил:
э = 4,0 мл
= 0,0909 M * 4*10-3 л =
0,3636*10-3 моль
Отсюда масса активного вещества в 25
мл пробе раствора:= M*n = 179,216 г/моль * 0,3636*10-3 моль = 6,5 *
10-2 г
В 100 мл раствора (1 таблетка) масса
активного вещества составляет:
= (6,5 * 10-2 г * 100 мл)
/ 25 мл = 0,26 г
· по данным кондуктометрического
титрования
Эквивалентный объем титранта
составил: Vэ = 3,8 мл
Количество молей щелочи, затраченной
на титрование, составило:
= 0,0909 M * 3,8*10-3 л =
0,3454*10-3 моль
Отсюда масса активного вещества в 25
мл пробе раствора:
= M*n = 179,216 г/моль * 0,3454*10-3
моль = 6,19 * 10-2 г
В 100 мл раствора (1 таблетка) масса
активного вещества составляет:
= (6,19 * 10-2 г * 100
мл) / 25 мл = 0,2476 г
. Расчет относительной
погрешности
Относительная погрешность
определяется по следующей формуле:
δ =
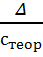
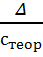 · 100%,
· 100%,
где стеор -
теоретическое (расчетное) значение величины; Δ - абсолютная
погрешность, рассчитываемая по формуле:
Δ = |спрак
- стеор|
· для
кислотно-основного титрования
Δ
(NaOH) = |4,0 мл - 3,86 мл| = 0,14 мл
δ (NaOH)
= 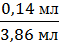
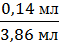 · 100% = 3,63%
· 100% = 3,63%
Δ
(фенибут) = |0,26 г - 0,25 г| = 0,01 г
δ (фенибут)
= 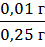
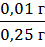 · 100% = 4%
· 100% = 4%
· для
кондуктометрического титрования
Δ
(NaOH) = |3,8 мл - 3,86 мл| = 0,06 мл
δ (NaOH)
= 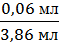
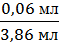 · 100% = 1,55%
· 100% = 1,55%
Δ
(фенибут) = |0,2476 г - 0,25 г| = 0,0024 г
δ (фенибут)
= 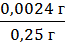
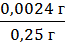 · 100% = 0,96%
· 100% = 0,96%
Заключение
В ходе данный работы был усвоен
метод кондуктометрического титрования веществ, проведено кондуктометрическое и
кислотно-основное титрование лекарственного препарата - фенибута.
В ходе кислотно-основного титрования
было затрачено 4,0 мл раствора титранта и определено содержание активного
вещества фенибута в препарате массой 2,60±0,01 г. Относительная погрешность
измерений составила 4%.
В ходе кондуктометрического
титрования было затрачено 3,8 мл титранта, содержание активного вещества по
данным этого титрования составило 0,2476±0,0024 г. Относительная погрешность
измерений составила 0,96%.
Истинное содержание вещества по
данным фармацевтической компании составляет 0,25 г.
По полученным результатам можно
сделать вывод, что преимуществом кондуктометрического титрования перед
кислотно-основным методом является его большая объективность и точность.