Синтез и действие противовирусных препаратов на основе адмантана
Введение
На сегодняшний день проблема
профилактики и лечения вирусных инфекций, а именно заболевания гриппом,
является очень актуальной. Это связано с большим числом штаммов вируса, их
быстрой мутацией, и, как следствие, распространение эпидемий.
Согласно статистике ВОЗ,
смертность от гриппа невысока и составляет порядка 18 смертей на 100 000
жителей. Наиболее опасными являются осложнения, вызываемы данным заболеванием,
такие как пневмония, миокардит перикардит и другие. После гриппа часто
наблюдаются обострения хронических заболеваний: бронхиальной астмы,
хронического бронхита, пиелонефрита. К тому же наиболее подвержены риску
заболеваемости гриппом дети в возрасте до двух лет и взрослые старше 65. В этих
возрастных группах смертность от осложнений, перенесенных после гриппа,
составляет 86%.
В настоящее время разработано
большое количество противовирусных средств, которые помогают снизить
заболеваемость. Противовирусные средства представляют собой соединения
природного или синтетического происхождения, применяющиеся для лечения и
профилактики вирусных инфекций, действие которых избирательно направлено на
разные стадии ее развития и жизненного цикла вирусов.
По химической структуре их
можно классифицировать следующим образом:
• аналоги нуклеозидов
(зовудин, ацикловир)
• производные липидов
(саквинавир)
• производные адамантана
(адмантадин, ремантадин)
• производные
ладолкарболовой кислоты (фоскарнет)
• производное -
аминоциклогексенкарбоновой кислоты (озельтамивир)
• производные
тиосемикарбазона (метисазон)
• препараты,
продуцируемые клетками макроорганизма (интерфероны)
В своей курсовой работе я
рассмотрела противовирусные лекарственные препараты, по химической природе
относящиеся к производным адмантана - римантадин, и производным
аминоциклогексенкарбоновой кислоты - озельтамивир.
Данные препараты имеют
различные механизм действия: римантадин - блокатор М - каналов, озельтамивир -
ингибитор фермента нейромидазы, разные фармакокинетические и
фармакодинамические показатели, а соответственно разную эффективность при
лечении и профилактики гриппа.
Поэтому в данной работе я
сравнила их относительно эффективности, биодоступности, токсичности, что
напрямую связано со строением и физико-химическими свойствами.
1. Озельтамивир
противовирусный
озельтамивир адмантан римантадин

МНН: Озельтамивир
ИЮПАК:
Этил-(3R,4R,5S)-4-ацетамидо-5-амино-3-(1-этилпропокси)-циклогекс-1-ен-1-карбоксилат
.Изомерия
Изомерия озельтамивира
обусловлена наличием в молекуле трех ассиметрических атомов углерода ( при С₃,
С₅,
С4), таким образом, количество стереоизомеров составляет восемь (по формуле 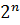 =
=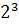 =8).
Стереоизомеры озельтамивира представлены в таблице 1:
=8).
Стереоизомеры озельтамивира представлены в таблице 1:
Таблица 1. Стереоизомеры
озельтамивира
|
Формула
изомера
|
Название
ИЮПАК
|
|

|
Этил-(3R,4R,5S)-4-ацетамидо-5-амино-3-(1-этилпропокси)-
циклогекс-1-ен-1-карбоксилат
|
|

|
Этил-(3S,4R,5R)-4-ацетамидо-5-амино-3-(1-этилпропокси)-
циклогекс-1-ен-1-карбоксилат
|
|

|
Этил-(3R,4S,5S)-4-ацетамидо-5-амино-3-(1-этилпропокси)-
циклогекс-1-ен-1-карбоксилат
|
|

|
Этил-(3R,4R,5R)-4-ацетамидо-5-амино-3-(1-этилпропокси)-
циклогекс-1-ен-1-карбоксилат
|
|
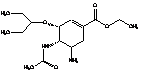
|
Этил-(3R,4S,5R)-4-ацетамидо-5-амино-3-(1-этилпропокси)-
циклогекс-1-ен-1-карбоксилат
|
|

|
Этил-(3S,4R,5S)-4-ацетамидо-5-амино-3-(1-этилпропокси)-
циклогекс-1-ен-1-карбоксилат
|
|
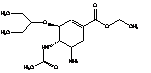
|
Этил-(3S,4S,5R)-4-ацетамидо-5-амино-3-(1-этилпропокси)-
циклогекс-1-ен-1-карбоксилат
|
|

|
Этил-(3S,4S,5S)-4-ацетамидо-5-амино-3-(1-этилпропокси)-
циклогекс-1-ен-1-карбоксилат
|
Активным является только один
стереоизомер -
этил-(3R,4R,5S)-4-ацетамидо-5-амино-3-(1-этилпропокси)-циклогекс-1-ен-1-карбоксилат,
так как именно такое положение в пространстве ацетамидной и карбоксильной
группировок отвечают за связывание с каталитическим участком фермента -
нейромидазы. Изменение положения ацетамидной группы в пространстве нарушает
связывание озельтамивира с ферментом и способствует уменьшению его
противовирусной активности.
. Получение озельтамивира
В настоящее время существует
несколько методик синтеза данной субстанции. Основным является способ
получения, разработанный Gilead Sciences - американской биотехнологической
компанией. Начинается синтез с реакции этерификации шикимовой кислоты:

Важной стадией является
получение смеси изомеров мезилатов, которые путем взаимодействия с
гидрокарбонатом натрия дают эпоксид. Эпоксиды имеют высокую реакционную способность
по сравнению с эфирами, поэтому имеют большее значение при синтезе.
Раскрытие эпоксида происходит
при взаимодействии с азидом натрия, образующиеся азиды дают азиридин:


В результате раскрытия цикла
азиридина получается амин, кислотный гидролиз которого способствует удалению
иминов из процесса синтеза.
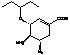

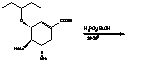

Последняя стадия -
ацетилирование уксусным ангидридом, в результате последующей кристаллизации
получается конечный продукт - озельтамивир, преобразуемый до озельтамивира
фосфата путем реакции с фосфорной кислотой.
Конечный продукт получается
достаточно чистым (99,7%), а общий выход составляет 17-22%.
В некоторых источниках также
рассматривается синтез озельтамивира, не использующий шикимовую кислоту:
Синтез Кори - основан на
реакции Дильса-Альдера бутадиена и акриловой кислоты.
Синтез Шибасаки - начинается с
энантиоселективной дессимметризации азиридина с триметилсилил азидом (TMSN3).
Синтез Фукуяма - начинается
синтез с реакции Дильса-Альдера пиридина и акролеина.
При использовании данных
методов получения озельтамивира особенно важно учитывать стереоизмерию, ввиду
получения неактивного изомера озельтамивира.
Наиболее перспективным является
синтез Троста - это самый короткий способ получения озельтамивира на
сегодняшний день. Он связан с получением лактона путем взаимодействия бутадиена
и акриловой кислоты.
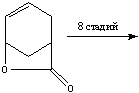

Выход в данном случае
составляет примерно 30%, а исходный материал является достаточно дешевым.
4.Основные примеси
В соответствие с Британской
Фармакопей XII издания, при анализе субстанции озельтамивира надо учитывать
присутствие следующих примесей:
Таблица 2. Примеси
озельтамивира
|
Примесь
|
Формула
|
Название
ИЮПАК
|
|
А
|

|
(3R,4R,5S)-5-ацетамидо-4-амино-3-(1-этилпропокси)-циклогекс-1-ен-1-карбоновая
кислота
|
Жидкостная
хроматография; 0,1%
|
|
В
|
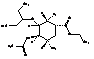
|
Этил-(1R,2R,3S,4R,5S)-5-амино-4-ацетамидо-2-азидо-3-(1-этилпропокси)-циклогексан-карбоксилат
|
Жидкостная
хроматография совместно с масс-спектрометрией; 0,01%
|
|
С
|
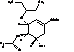
|
(3R,4R,5S)-4-ацетамидо-5-амино-3-(1-этилпропокси)
-циклогекс-1ен-1-карбоновая кислота
|
Жидкостная
хроматография; 0,3%
|
|
D
|
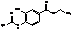
|
Этил-4-ацетамидо-3-гидроксибензоат
|
Жидкостная
хроматография; 0,1%
|
|
E
|
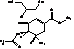
|
Метил-(3R,4R,5S)-4-ацетамидо-5-амино-3-(1-этилпропокси)-циклогекс-1ен-1-карбоксилат
|
Жидкостная
хроматография; 0,1%
|
|
F
|
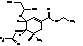
|
Этил-(3R,4R,5S)-4-ацетамидо-5-амино-3-
(1-метилпропокси)-циклогекс-1ен-1-карбоксилат
|
Жидкостная
хроматография;0,1%
|
|
G
|
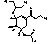
|
Этил-(3R,4R,5S)-5-ацетамидо-4-амино-3-(1-этилпропокси)-циклогекс-1ен-1-карбоксилат
|
Жидкостная
хроматография; 0,1%
|
|
H
|
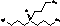
|
Трибутилфосфин
|
Газовая
хроматография; 0,15%
|
Специфическими примесями для
субстанции озельтамивира являются: B, C и H (по таблице 2). Их присутствие
связано с процессом синтеза.
Также для фармацевтического
использования данного вещества имеет значение определение примесей: A, D, E, F,
G. Они имеют близкое строение с активным изомером озельтамивира и могут
связываться с каталитическим участком нейромидазы, тем самым уменьшать его
фармакологический эффект, так как сами не имеют противовирусной активности.
В соответствие с Британской
Фармакопеей общее (суммарное) содержание примесей не должно превышать 0,7%.
Допустимо не принимать во внимание при анализе субстанции на чистоту наличие
какой-либо примеси в пределах 0,05%. Содержание воды в чистой субстанции должно
быть не более, чем 0,5% (содержание определяют на 0,500 г).
. Состав препарата
На данный момент на
фармацевтическом рынке озельтамивир представлен только оригинальным препаратом,
выпускаемый под торговым названием «Тамифлю» («Tamiflu»), на данный
лекарственный препарат действует патент до 2016 года.
Таблица 3. Состав и формы
выпуска лекарственного препарата «Тамифлю»
|
ЛФ
|
Состав
(в мг)
|
Производитель
|
|
Активные
вещества
|
Вспомогательные
вещества
|
|
|
Капсулы,
по 75 мг
|
озельтамивир
фосфат - 98,5 (что соответствует 75 мг)
|
Крахмал
прежелати-низированный - 46,4, повидон К30- 6,7; кросскармелоза натрия -3,4;
тальк - 8,3; натрия стеарилфумарат - 4,7. оболочка капсулы: 63 мг (желатин)
|
Ф.
Хоффманн-Ля Рош Лтд., Швейцария (F.Hoffmann-La Roche Ltd.)
|
|
Порошок
для приготовления суспензий
|
озельтамивир
фосфат - 39,4 (что соответствует 30 мг)
|
Сорбитол,
титана диоксид, натрия бензоат, мононатрия цитрат, натрия сахарин,
ароматические добавки (пермасил 11900-31 Тутти-Фрутти)
|
|
6. Биотрансформация в организме
и механизм действия
Озельтамивир фосфат является
пролекарством. В организме (в печени) подвергается гидролизу, под действием
печеночных эстераз (CES1) до активного метаболита - озельтамивира карбоксилата:
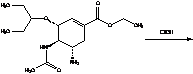
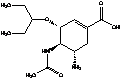
Карбоксилат не подвергается
дальнейшей биотрансформации и выводится в неизменном виде из организма.
Метаболизм озельтамивира в
организме связан с превращением сиаловой кислоты, которая способствует
распространению вирусной инфекции. Механизм ее превращения под действием
нейромидазы выглядит следующим образом:
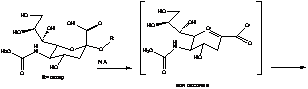
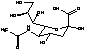
Так, активная форма препарата -
озельтамивир карбоксилат является аналогом сиаловой кислоты и, связываясь с
активным каталитическим участком фермента нейромидазы, ингибирует ее.
7. Связь строения с действием
В своей курсовой работе связь
строения и действия озельтамивира я рассмотрела в сравнении с лекарственным
препаратом той же фармакологической группы, обладающие аналогичным механизмом
действием - занамивиром.
Таблица 4. Связь строения с
действием
|
МНН
и формула ЛП
|
Группа
|
Обусловленное
действие
|
|
Озельтамивир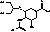
|
Карбоксильная
группа
|

|
Участвует
в связывании с каталитическим участком нейромидазы
|
|
Ацетамидная
группа
|
|
|
Кольцо
циклогексена
|
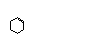
|
Большая
химическая стабильность, чем кольцо дигидропирана у занамивира, увеличение
липофильности и биодоступности.
|
|
Алкильные
радикалы
|

|
Влияют
на процесс ингибирования нейромидазы
|
|
Занамивир
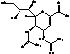
|
карбоксильнаягруппа
|

|
Участвует
в связывании с каталитическим участком нейромидазы
|
|
ацетамиднаягруппа
|
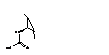
|
Участвует
в связывании с каталитическим участком нейромидазы
|
|
кольцо
дигидропирана
|

|
Меньшая
стабильность по сравнению по сравнению с циклогексаном в молекуле
озельтамивира.
|
|
Гидроксильные
группировки
|
-OH
|
Большая
гидрофильность, меньшая биодоступность при пероральном приеме
|
|
гуанидиновая
группа
|
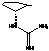
|
Противовирусная
активность, токсичность.
|
Таким образом, лекарственный
препарат занамивир обладает высокой гидрофильностью, что обуславливает его
меньшую биодоступность при пероральном приеме и его использование в виде ингаляций.
Озельтамивир имеет же высокую липофильность, большую стабильность и может
применяться перорально. Оба соединения являются активными в отношении вируса
гриппа, так как имеют в своем строении карбоксильную и ацетамидную группу,
обуславливающие ингибирование нейромидазы. Помимо этого, в молекуле занамивира
имеется гуанидиновая группа, которая обладает противовирусной активностью, но
может и придавать токсичность соединению.
В некоторых источниках
рассматриваются результаты SAR исследований (структура-активность), которые
показали, что изменение в длину и увеличение ветвления цепи алкильных радикалов
оказывает влияние на увеличение способности к ингибированию нейромидазы, а
введение в структуру радикалов - Cl; -SCH3 уменьшает противовирусную активность.
На мой взгляд, перспективна
разработка нового соединения этой группы, в котором радикалы, не участвующие в
связывании с каталитическим участком нейромидазы, будут заменены на
гидрофобные, что увеличит липофильность и биодоступность соединения. Например,
за счет увеличение числа или разветвленности алкильных радикалов или замены
аминогруппы на менее полярную.
Физико-химические свойства
В соответствие с Британской
Фармакопеей (XII издание) субстанция озельтамивира фосфата представляет собой
белый или почти белый кристаллический порошок без запаха, легко растворимый в
воде и метаноле, практически нерастворим в дихлорэтане.
Так как лекарственный препарат
представляет собой соль фосфат, то хорошо всасывается в желудочно-кишечном
тракте и проникает в ткани, где он и проявляет свою активность.
Значение рН 10% водного
раствора составляет от 3,3 до 5,3.
Температура плавления 192 - 196
° C.
Угол удельного оптического
вращения от -30,7 до -32,6 (определяют у безводной субстанции, при 25єС)
Подлинность
Для подтверждения подлинности
субстанции озельтамивира фосфата проводят следующие испытания:
Фармакопейные методы анализа.
Абсорбционная
ИК-спектрофотометрия:
ИК - спектры испытуемого
вещества снимают в сравнении с эталоном, применяя метод с использованием
бромида калия (KBr) в пресс дисках. Растворителем является метанол. Анализируют
безводную субстанцию, предварительно выпарив испытуемое вещество досуха
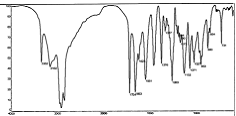 см-№
см-№
Рисунок № 1. ИК-спектр
озельтамивира
Как видно из рис.№1, спектр
озельтамивира фосфата имеет полосы поглощения в области 3100-700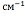 .
Наличие пиков в области наиболее высоких частот 3100-2800
.
Наличие пиков в области наиболее высоких частот 3100-2800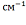 может свидетельствовать о наличие связей О-Н, С-Н, N-H (см. таблицу):
может свидетельствовать о наличие связей О-Н, С-Н, N-H (см. таблицу):
|
Группа
|
Волновое
число,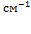
|
|
-
СН₃
|
29602870
|
|
-NH₂
|
3362
|
|
-OH
|
3552
|
Полосы поглощения, находящиеся
в области 1500-700 свидетельствуют о
наличии связей C-C, C-O, C-N в скелете молекулы (см. таблицу):
свидетельствуют о
наличии связей C-C, C-O, C-N в скелете молекулы (см. таблицу):
|
С-С
|
1350
|
|
С-О
|
1173
|
|
C-N
|
1307
|
Кратная связь дает полосы
поглощения в области 1800-1500 (см таблицу):
(см таблицу):
Для фосфата характерна полоса
поглощения в области 1027 .
.
Проводят реакции подлинности на
фосфат-ион:
. Реакция с раствором нитрата
серебра:
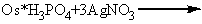
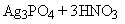
В результате данной реакции
выпадает желтый кристаллический осадок фосфата серебра, нерастворимый при
добавлении аммиака и, цвет которого не изменяется при кипячении.
. Реакция с молибдатом аммония:

Образуется желтый
кристаллический осадок, растворимый в растворе аммиака.
Альтернативные методы анализа
на подлинность.
УФ-спектроскопия в области
200-400 нм:
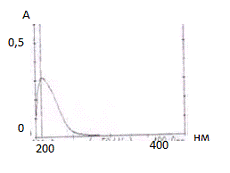
Определение подлинности
проводят, предварительно растворив субстанцию озельтамивира фосфата в метаноле.
Толщина поглощающего слоя - 1см. Максимум поглощения находиться в области 208,5
нм.
Реакция на фосфат-ион с магния
сульфатом, в растворе аммиака:
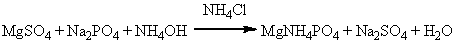
Образуется белый
кристаллический осадок, растворимый в разведенных минеральных кислотах.
Количественное определение
Фармакопейные методы
количественного определения:
Количественное определение
проводят с помощью ВЭЖХ.
Условия проведения анализа:
колонки из нержавеющей стали,
заполненные силикагелем для хроматографии с размером частиц 5 мкм;
спектрофотометрический детектор
с рабочей длиной волны 207 нм;
скорость потока 1,2 мл в минуту
(расход подвижной фазы);
температура колонки 50°C;
объемы анализируемого и
раствора сравнения, используемые в хроматографии 15 мкл;
Подвижная фаза: 43,5 части
метанола и 56,5 части 0,05 М дигидроортофосфата калия, рН которого должен быть
доведен до 6,0 4 М гидроксидом калия.
Приготовление раствора
сравнения: количество озельтамивира фосфата, достаточное для получения
раствора, содержащего 0,08 % озельтамивира, растворяют в смеси 135 частей
ацетонитрила, 245 частей метанола и 620 объемов воды для хроматографирования.
Приготовление испытуемого
раствора: точное количество озельтамивира, достаточное для получения 0,015%
растворяют в подвижной фазе, затем 10 мл полученного раствора доводят до 100 мл
подвижной фазой.
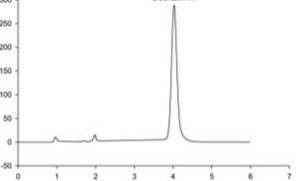
Рисунок № 3. Хроматограмма
озельтамивира
Содержания озельтамивира в
анализируемо пробе определяют по площади и времени удерживания соответсвующего
пика на хроматограмме.
Таким образом, содержание
озельтамивира фосфата в анализируемой субстанции должно быть эквивалентно
0,7612 мг озельтамивира (в соответствие с Британской Фармакопеей).
Альтернативные методы.
УФ - спектроскопия раствора в
метаноле. См. определение подлинности.
Хранение
Озельтамивир хранят в
защищенном от света месте. При неправильном хранении данной субстанции может
произойти ионизация данного вещества и его кристаллизация:
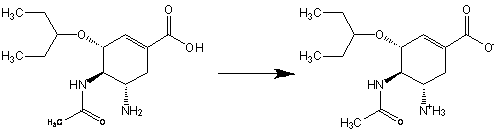
. Римантадин

МНН: римантадин
ИЮПАК:
альфа-метилтрицикло[3.3.1.1.7]декан-1-метанамин гидрохлорид
Изомерия
Изомерия римантадина
представлена двумя стереоизомерами:

Так как римантадин представляет
собой циклическую насыщенную систему и нельзя изменить конфигурацию, не нарушив
жесткую структуру адамантана, изомеры связанные с конфигурацией трицикла
отсутствуют, несмотря на наличие четырех ассиметрических атомов.
Синтез римантадина
В настоящее время известно
несколько способов получения римантадина гидрохлорида:
из 1-ацетиладамантана с
получением оксима и восстановлением его до конечного продукта алюмогидридом
лития в тетрагидрофуране.
из 1-адамантанкарбоновой
кислоты
из адамантана, который последовательно
превращается в 1-бромадамантан (промышленный синтез)
Наиболее рациональным является
синтез из адамантана:

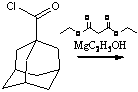
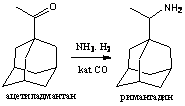
Синтез начинается с реакции бромирования
адамантана в среде четыреххлористого углерода с использованием меди в качестве
катализатора. Последующее превращение бром-адамантана связано с образованием 1-
адамантан карбоновой кислоты в реакции карбоксилирования и дальнейшем
получением ее ангидрида. Важная стадия - получение ацетиладамантана. Данный
продукт также может использоваться для получения римантадина по второму
способу, в реакции с образованием оксима:
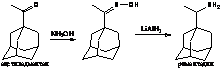
В новых методиках в качестве
растворителя используют толуол, без добавления пиридина, так как толуол
является менее токсичным, чем пиридин.
Основные примеси
В соответствие с Фармакопеей
США выделяют следующие примеси:
Неорганические примеси -
тяжелые металлы, допустимое содержание 0,2%
Неспецефические органические
примеси, наличие которых связанно с процессом синтеза (ацетиладамантадин),
содержание которых определяют тонкослойной хроматографией.
Специфической примесью является
толуол, используемый как растворитель, при получении римантадина. Его определение
проводят методом газовой хроматографии, допустимое содержание 0,1%.
Состав и ЛФ оригинального
препарата и дженериков
На данный момент на
фармацевтическом рынке в России римантадин представлен оригинальным препаратом,
выпускаемым под торговым названием «Флумадин» («Flumadine»), и достаточно
большим количеством дженерических препаратов.
Таблица 5. Состав, формы
выпуска лекарственных средств, содержащих римантадин
|
Торговое
название и производитель
|
Состав
|
Биодоступность
|
|
активные
вещества
|
вспомогательные
вещества
|
|
|
таблетки:
|
|
Флумадин
Forest Laboratories - Форест Лаб. (США)
|
римантадин
гидрохлорид, 100 мг
|
стеарат
магния, микрокристаллическая целлюлоза, крахмал картофельный
|
54%
|
|
Полирем
НИИ гриппа РАМН, Россия
|
римантадин
гидрохлорид, 50 мг
|
кальция
стеарат, магния карбонат, целлюлоза микрокристаллическая, крахмал
картофельный
|
50%
|
|
Римантадин
-СТИ Ирбитский ХФЗ, ОАО
|
римантадин
гидрохлорид, 50 мг
|
лактоза,
крахмал картофельный, стеарат
|
40%
|
Римантадин
гидрохлорид, 50 мг
|
лактозы
моногидрат, крахмал картофельный, тальк, кальция стеарата моногидрат
|
30-40%
|
|
Ремантадин
Олайнфарм, Латвия
|
Римантадин
гидрохлорид, 50 мг
|
лактоза,
крахмал картофельный, стеарат
|
40%
|
|
Ремантадин
У Фарма, Украина
|
Римантадин
гидрохлорид, 50 мг
|
лактоза,
крахмал картофельный, стеарат
|
30-40%
|
|
сиропы
для детей:
|
|
Флумадин
Forest Laboratories - Форест Лаб. (США)
|
римантадин
гидрохлорид, 50мг/5мл
|
вода
очищенная, сорбитол, мононатрия цитрат, сахарин натрия, ароматические добавки
|
50%
|
|
Альгирем
ЗАО «Корпорация Олифен», Россия
|
римантадин
гидрохлорид, 2 мг
|
сахар;
натрия альгинат; кислотный красный 2С; вода очищенная
|
45%
|
|
Орвирем
ЗАО «Корпорация Олифен», Россия
|
римантадин
гидрохлорид, 10 мг
|
альгинат
натрия; сахар; краситель E122; вода очищенная
|
45%
|
Таким образом, составы
оригинального препарата («Флумадин») и дженериков отличаются по содержанию
активного компонента. Вспомогательные компоненты у оригинального препарата и
дженериков схожи, несмотря на это большую биодоступность имеет оригинальный
препарат, а, следовательно, и высокую эффективность.
Биотрансформация
Биотрансформация римантадина
происходит в печени. В гепатоцитах под действием печеночных эстераз происходит
гидролиз римантадина, с образованием 3-гидроксиримантадина:
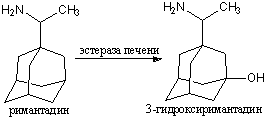
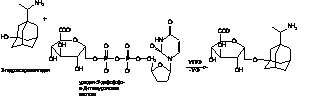
Далее происходит присоединение
глюкуроновой кислоты, при этом образуются глюкораниды, при участии фермента
уридин-фосфат-глюкоруронозил трансферазы (УГТФ):
Связь строения с действием
Связь строения с действием
римантадина я рассмотрела в сравнении с препаратами, производными адамантана:
Таблица 6. Связь строения с
действием
|
МНН
|
Формула
|
Фармакологическое
действие
|
Липофильность
|
|
римантадин
|
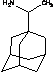
|
противовирусное
|
+++
|
|
амантадин
|

|
противовирусное,
антипаркинсоническое, дофаминэргическое
|
++
|
|
мемантин
|
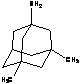
|
антипаркинсоническое,
средство для терапии дегенеративных заболеваний головного мозга
|
+++
|
|
сомантадин
|
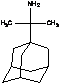
|
противовирусное
|
+++
|
|
кемантан
|
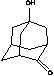
|
иммуностимулирующее,
противопаркинсоническое
|
++
|
Исходя из данной таблицы,
следует:
Наличие в молекуле адамантана
алкильного или гидроксильного заместителя обеспечивает противовирусную
иммуностимулирующую активность препаратов, производных адмантана.
При введении аминогруппы
появляется противопаркинсоническое действие. Наличие большего числа метильных
заместителей делает препарат более липофильным и он может применяться для
лечения дегенеративных заболеваний головного мозга.
Трициклическая система
адмантана обуславливает высокую липофльность данных препаратов, поэтому данные
лекарственные препараты хорошо проникают в ткани.
Физико-химические свойства
В соответствие с Фармакопеей
США римантадин представляет собой белый или белый с желтоватым оттенком
порошок, трудно растворимый в воде, растворимый в спирте. Плохая растворимость
в воде объясняется структурой молекулы, данный лекарственный препарат, является
достаточно липофильным.
Температура плавления
составляет 373 - 375 ° C.
Значение pH от 1,0 до 5,0.
Подлинность
Для определения подлинности
проводят следующие испытания:
Фармакопейные методы
определения подлинности.
Абсорбционная
ИК-спектрофотометрия:
ИК-спектры испытуемого вещества
снимают в сравнении с эталонным, проводят анализ безводной субстанци.
Рисунок № 4. ИК - спектр
римантадина
Как видно из данного рисунка,
спектр римантадина гидрохлорида имеет полосы поглощения в области 1650-700 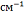 .
.
Полосы поглощения, находящиеся
в области 1500-700 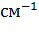 свидетельствуют о
наличии связей C-C, C-N в скелете молекулы (см. таблицу):
свидетельствуют о
наличии связей C-C, C-N в скелете молекулы (см. таблицу):
ВЭЖХ:
время удерживания пика анализируемого
раствора римантадина на хроматограмме должно соответствовать времени
удерживания пика стандартного образца.
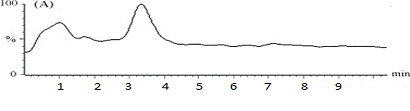
Рисунок №5. Хроматограмма
римантадина
Условия хроматографии:
колонка из нержавеющей стали,
заполненная силикагелем;
флуоресцентный детектор с
рабочей длиной волны 340 нм;
подвижная фаза: метанол,
фосфатный буфер, для создания pH 3.0.
Альтернативный метод
определения подлинности.
Реакция на хлорид-ион с
нитратом серебра:
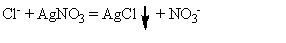
В результате выпадает белый
творожистый осадок хлорида серебра, растворимый в избытке раствора аммиака.
УФ - спектрофотометрия:
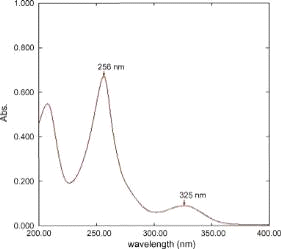
Рисунок № 6. УФ - спектр
римантадина гидрохлорида
Определение подлинности
проводят, предварительно растворив субстанцию в метаноле. Толщина поглощающего
слоя составляет 1см. Максимум поглощения наблюдается в области 256 и 325 нм.
Количественное определение
Фармакопейные методы
(Фармакопея США):
Определение содержания
римантадина гидрохлорида проводят методом газовой хроматографии:
Условия проведения анализа:
колонки из стекла 4 мм  1.8
м, заполненные силикагелем;
1.8
м, заполненные силикагелем;
используют
пламенно-ионизационный детектор;
температура колонки 160°C;
температура детектора 250°C;
газ-носитель: инертный азот;
объем анализируемого раствора,
вводимого с помощью шприца 2 мл;
Анализ проводят, сравнивая
стандартный и исследуемый растворы. Определяют площадь пика на хроматограмме
обоих растворов. Содержание римантадина гидрохлорида должно составлять 90-110%.
Альтернативные методы.
ВЭЖХ. См. определение
подлинности.
УФ - спектроскопия. См.
определение подлинности
Аргентометрия (метод Фаянса):
HInd + H₂O
 Indˉ
+ H₃O⁺
Indˉ
+ H₃O⁺
NaCl + AgNO₃
= AgCl + NaNO₃ˉ + AgCl + AgNO₃
= [(AgCl) Ag⁺] Indˉ + NO₃⁺
Титрование проводят в уксусной
среде, с использованием индикатора - бромфенолового синего.
Хранение
Хранят в сухом, защищенном от
света месте. При температуре 15-30єС.При нарушении условий хранения возможны
процессы окисления:
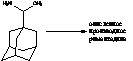
Также при неправильном хранении
может произойти отсыревание таблеток.
.Ситуационная задача
На анализ в
контрольно-аналитическую лабораторию поступил порошок озельтамивира фосфата.
При его количественном определении методом ВЭЖХ получены следующие результаты:
площадь пика анализируемого раствора составляет 18,5 ,
стандартного раствора - 22
,
стандартного раствора - 22 . Рассчитайте
содержание озельтамивира фосфата, если известно, что для приготовления
анализируемого раствора в метаноле растворили 0,02 г озельтамивира, а для
приготовления раствора РСО использовали 0,05 г.
. Рассчитайте
содержание озельтамивира фосфата, если известно, что для приготовления
анализируемого раствора в метаноле растворили 0,02 г озельтамивира, а для
приготовления раствора РСО использовали 0,05 г.
Сделайте заключение о качестве.
Заключение: Поступившее на
анализ вещество не соответствует требованиям нормативной документации по
показателю количественное определение.
Заключение
Таким образом, в данной работе
было проведено сравнение лекарственных препаратов, применяемых для профилактики
и лечения гриппа по их физико-химическим свойствам, путям метаболизма,
биодоступности и токсичности. Данные показатели имеют большое значение при
использовании римантадина и озельтамивира в терапии вирусных инфекций.
|
Показатель
|
Озельтамивир
|
Римантадин
|
|
Механизм
действия
|
ингибитор
нейромидазы
|
блокатор
М - каналов
|
|
Эффективность
|
вирус
гриппа типа A, B
|
вирус
гриппа А, вирус клещевого энцефалита
|
|
Биодоступность
|
75-80%
|
40-50%
|
|
Пути
метаболизма
|
гидролиз
до карбоксилата
|
Гидролиз,
с последующим глюкуронированием
|
|
LD₅₀,
токсичность
|
500
мг/кг; канцерогенность при приеме дозы свыше 400 мг/ кг в стуки
|
Как видно из данной таблицы, не
смотря на большую эффективность в отношении разных типов вирусов, большую
биодоступность озельтамивир является более токсичным препаратом, по сравнению с
римантадином. К тому же римантадин, является более изученным средством.
Нельзя не принять во внимание и
то, что озельтамивир достаточно новый препарат и многие штаммы вируса гриппа
чувствительны к нему, но устойчивы к действию римантадина, о чем
свидетельствуют научные исследования.
Все вышесказанное стоит
учитывать при подборе лекарственного препарата для рациональной терапии и
профилактики гриппа, особенно в периоды сезонных эпидемий.
Список используемой литературы
1.The
British Pharmacopoeia XII, 2012 г.
.U. S.
Pharmacopoeia 32, 2009 г.,
с.
71-73
.Burger's
Medicinal Chemistry and Drug Discovery, v.2. Drug
Discovery and Drug Development, 2003, с.208 - 209, 212
4.Burger's
Medicinal Chemistry and Drug Discovery, v.5. Chemotherapeutic Agent, 2003, с.
266, 364-376, 388-389
.Material
safety data sheet of Oseltamivir Phosphate
.Cui
Shuangjin, Feng Fang, Liu Han, Ma Ming, “New method for high-performance liquid
chromatographic determination of rimantadine in rat plasma” Journal of
Pharmaceutical and Biomedical Analysis, выпуск
5, 3 сентября
2007 г.
.Michael D.
Green , Henry Nettey, Robert A. Wirtz “Determination of Oseltamivir Quality by
Colorimetric and Liquid Chromatographic Methods”; EID Journal; изд.
14, апрель
2008г.
.C.S. Rauta,
D.S. Ghargea “Development and validation of oseltamivir by UV -
spectrophotometr”, март
2010 г.
9.Свердлова О.В.
Электронные спектры в органической химии, 1985г., с. 86-91, 97-98,103-113
.Энциклопедия
Википедия - http://ru.wikipedia.org
.Текстовая база
данных медицинских публикаций - http://www.pubmed.ru
.Интернет-энциклопедия
фармацевтических препаратов - http://www.drugs.com