Использование нанотехнологий в создании лекарственных средств. Нанопрепараты, возможности применения и методы анализа
Государственное бюджетное
образовательное учреждение высшего профессионального образования
«Сибирский Государственный
Медицинский Университет»
Министерства здравоохранения
Российской Федерации
Кафедра фармацевтической химии
Курсовая работа
Использование нанотехнологий в
создании лекарственных средств. Нанопрепараты, возможности применения и методы
анализа
Выполнила: студентка IV курса ФФ Гр.3002
Денисова Е.А.
Проверила: доцент, к. ф. н
<#"817342.files/image001.jpg">
Фармакология уже имеет в своем арсенале наночастицы,
которые содержат лекарственные средства и могут доставлять их в клетки.
Эти частицы представляют собой липосомы - сферические
двухслойные мембраны, содержащие внутри лекарственные вещества. История липосом
начинается с 60-х годов ХХ века, когда английский ученый Алек Бэнгхем вместе с
коллегами, проводя исследования поведения фосфолипидов в водных средах, на
электронных микрофотографиях увидел слоистые частицы, похожие на мембранные
структуры клетки. Дальнейшие исследования показали, что неорганические ионы,
присутствующие в растворе, включаются внутрь этих частиц и удерживаются там
длительное время. Так впервые было установлено, что фосфолипиды, являющиеся
основными компонентами клеточных мембран, способны самопроизвольно образовывать
в воде замкнутые мембранные оболочки, которые захватывают часть окружающего
водного раствора, а образующая их фосфолипидная мембрана обладает свойствами
полупроницаемого барьера.
Фармакотерапевтические преимущества липосом
обусловлены рядом факторов, среди которых природная биосовместимость материала
липосом, избирательность депонирования относительно клеток, находящихся в
состоянии гипоксии, возможность регулировать липидный состав липосом и, тем
самым изменять, их фармакокинетику и фармакодинамику.
Меняя липидный состав липосом можно направленно
изменять их фармакологические эффекты.
Несколько препаратов на основе липосом уже
производятся: «Липодокс» (липосомный доксорубицин), «Липин» (противогипоксический),
«Лиаолив» (гепатопротекторный). Клинические испытания проходят два
противоопухолевых препарата: «Цисплатин» и «Фторурацил». Начинаются клинические
испытания еще трех препаратов: «Антилипошок» (антигеморрагический), «Баларпан»
(ранозаживляющий) и «Хлорофилипт» (противовоспалительный). Биологические
испытания проходят «Аминофосфатид» (против гемолитической болезни
новорожденных), «Бетусом» (антимеланомный), «Фотосом» (противоопухолевый),
«Рифамицин» и «Изоцианид» (противотуберкулезные)[4].
2.1.1 Магнитные липосомы для
управляемой доставки лекарств
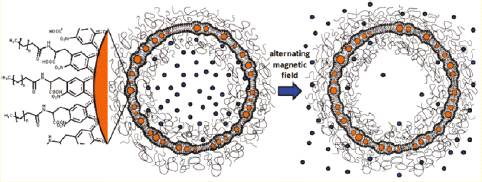
Высвобождение препарата происходит при разрушении
липосом, например, под действием температуры, которая обычно близка к
температуре тела. Такой подход не очень удобен, т.к. липосомы начинают
разрушаться сразу после введения в организм, не дойдя до желаемого места,
поэтому ученые стараются придумать различные ухищрения, чтобы иметь возможность
инициировать высвобождение груза по требованию. Например, можно внедрить в
липосомы плазмонные наночастицы золота, которые будут нагреваться под действием
света и приводить к разрушению липосом, однако в этом случае естественным
ограничением является прозрачность тканей. Более интересным способом является
внедрение в липосомы суперпарамагнитных наночастиц оксида железа, которые
способны нагреваться под действием переменного магнитного поля, но такие
липосомы, как правило, склонны к агрегации и оказываются нестабильны в
коллоидном состоянии.
Способность липосом высвобождать груз была испытана на
флуоресцентном красителе флуорексоне. Ученые определили, что липосомы с
суперпарамагнитными наночастицами в мембране работают существенно эффективнее
тех, которые содержат их внутри полости. Таким образом, выделение доставляемого
вещества можно не только управляемо включать, но и выключать, т.е.
контролировать дозу и продолжительность терапии.
2.1.2 Липосомные наночастицы для
вакцинации
Инженеры разработали новый тип наночастиц, которые
могли бы эффективно и безопасно доставлять вакцины.
Частицы состоят из концентрических сфер, которые могут
нести синтетические версии белков, производимых вирусами. Тем самым они
вызывают сильный иммунный ответ, сопоставимый с ответом на вакцины на основе
живых вирусов, но при этом они гораздо безопаснее. Принцип действия вакцин
основан на воздействии инфекционным агентом, который «приучает» иммунную
систему быстро реагировать на будущие атаки этого патогена. Во многих случаях
(например, при полиомиелите и оспе) используются мёртвые или повреждённые формы
вирусов. В других препаратах (к примеру, от дифтерии) применяются синтетические
версии белка или других веществ, производимых патогеном.
В случае заболеваний, при которых возбудитель остаётся
внутри клеток (например, ВИЧ), нужен мощный ответ от Т-лимфоцитов. Наилучший
способ спровоцировать эти клетки заключается в использовании мёртвых или
недееспособных вирусов, но ВИЧ чрезвычайно трудно сделать безвредным. Чтобы
обойти опасности использования живых вирусов, учёные работают над созданием
синтетических вакцин против ВИЧ-вакцин и других вирусных инфекций (того же
гепатита B). Одно плохо: эти препараты не провоцируют должную Т-лимфоцитную
реакцию. В последнее время специалисты пытались «обернуть» вакцины липосомами
-- то есть создать имитацию вируса, однако липосомы не обладают стабильностью
при попадании в кровь.
Ученые решил помещать вакцину не в капли, а
концентрические сферы липосом. Как только они сливаются вместе, их стенки
химическим образом «сшиваются» друг с другом, что делает структуру более стабильной.
И наоборот: когда наночастицы поглощаются клетками, они быстро растворяются,
выпуская вакцину и провоцируя Т-лимфоциты.
2.1.2 Протоклетки
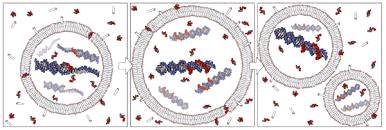
Объединив нанотехнологические методы с результатами
медицинских исследований, ученые Национальной лаборатории и лечебного
онкологического центра разработали эффективную стратегию использования
наночастиц для уничтожения раковых клеток.
Наночастицы и окружающие их образованные из липосом
мембраны, практически аналогичные клеточным, вместе составляют комбинацию,
которую можно рассматривать как «протоклетку»: мембрана «запечатывает»
смертоносный груз и модифицируется молекулами (пептидами), специфически
связывающимися с рецепторами, сверхэкспрессирующимися на поверхности раковых
клеток. Наночастицы обеспечивают стабильность мембраны и содержат
терапевтический (или диагностический, например, квантовые точки) груз,
высвобождая его внутри клетки.[4]
2.1.3 Нанокапсулы

Нанокапсула представляет собой сферическую полую
частицу, состоящую из полимеров или фосфолипидов (в этом случае она называется
липосомой или наносомой), внутри которой находится низкомолекулярное вещество.
Оболочка нанокапсул может быть изготовлена также из других материалов,
например, гидроксиапатита или силиката кальция., а также определенным образом
организованных молекул ДНК. Нанокапсулы должны быть химически стабильны, биоактивны,
биосовместимы с организмом, защищать капсулированное вещество от нежелательного
воздействия, например, растворения в жидкостях. Размеры нанокапсул обычно не
выходят за пределы 100 нм, а микрокапсул - 600 нм. Нанокапсулы обладают высокой
проникающей способностью и могут проходить даже в такие «закрытые» зоны
организма, как головной мозг. Малый размер делает их невидимыми для клеток
иммунной системы, что позволяет нанокапсулам длительное время циркулировать в
кровотоке.
Нанокапсулы применяют для контролируемого введения
инкапсулированных биологически активных веществ: лекарственных препаратов (в
том числе нерастворимых в воде или нестабильных), пептидов и белков (имеющих
функции гормонов и цитокинов), а также генетических конструкций, несущих гены ферментов,
гормонов и цитокинов. Диапазон капсулированных веществ широк - от средств
противоопухолевой терапии и морфогенетических белков костной ткани до средств
косметологии. Для целевой доставки поверхность нанокапсул может быть
модифицирована специфическими антигенами, рецепторами или лигандами. Мембрана
липосом состоит из природных фосфолипидов, что определяет ее способность при
определенных условиях поглощаться клетками. Мембрана липосом может сливаться с
клеточной мембраной, что приводит к внутриклеточной доставке их содержимого.
Перспективными также представляются подходы доставки нанокапсул внутри
эритроцитов или бактерий.
2.1.5 Антибиотики, помещённые в
нанокапсулы, эффективны в борьбе с микроорганизмами, устойчивыми к действию
лекарств
Возможность помещать антибиотики в нанокапсулы
позволяет уничтожать бактерий устойчивых к действию лекарственных препаратов
По словам авторов исследований, предложенная ими
методика выгодна тем, что она достаточно быстро способна стать способом лечения
пациентов, страдающих от бактериальной инфекции, не чувствительной к действию
часто применяемых лекарственных средств.
2.1.6 Пористые нанокапсулы из
гидрокcиапатита

Для доставки лекарственных средств в нужное место
организма могут быть использованы миниатюрные капсулы с нанопорами. Уже
испытываются подобные микрокапсулы для доставки и физиологически регулируемого
выделения инсулина при диабете 1-го типа. Использование пор с размером порядка
6 нм позволяет защитить содержимое капсулы от воздействия иммунной системы
организма. Это дает возможность помещать в капсулы инсулин-продуцирующие клетки
животного, которые иначе были бы отторгнуты организмом.
Гидроксиапатит (ГАП) и силикат кальция в последнее
время вызывают огромный интерес в связи с их использованием в качестве
биоматериалов. Они химически стабильны, биоактивны, биосовместимы и могут
применяться для конструирования костной ткани и доставки лекарств.
Наноструктурированые полые частицы на основе этих материалов могут быть нагружены
различными веществами, например, противовоспалительными препаратами, коллагеном
или костными морфогенетическими белками (BMP), которые будут способствовать
исцелению костных повреждений.
2.1.7 Нанокапсулы для дистанционной
магнитно-инициируемой доставки лекарств
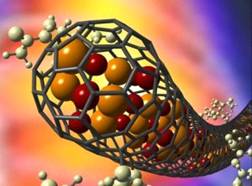
Магнитные нанокапсулы со структурой ядро / оболочка
давно рассматриваются в качестве носителей лекарств для их адресной доставки.
Ученые вновь предложили один из вариантов создания таких капсул. В качестве
сердцевины капсулы они взяли наночастицы оксида железа и термочувствительный
блоксополимер плюроник F68, представляющий собой цепочку чередующихся
полиэтиленоксида и полипропиленоксида. Роль оболочки играет ультратонкая пленка
оксида кремния, регулирующая выход лекарств из капсулы до и после воздействия
магнитного поля.
На первом этапе магнитные наночастицы смешивали с
гидрофобным лекарством в органическом растворителе для формирования однородной
массы. Затем с использованием миниэмульсии, применяя в качестве связующего
плюроник и поливиниловый спирт, были получены самоорганизующиеся нанокомпозиты.
Благодаря тому, что ПВС и плюроник являются амфифильными, магнитные наночастицы
отделились от гидрофобного лекарства в отдельные агломераты. После постепенного
испарения органического растворителя произошла инкапсуляция наночастиц и
лекарства вследствие возникновения водородных связей и диполь-дипольных
взаимодействий между гидроксильными группами ПВС и плюроника и поверхностью
оксида железа. После этого полученные нанокомпозиты были покрыты слоем оксида
кремния с помощью гидролиза и конденсации тетраэтоксисилана.
В работе варьировали количества ПВС, плюроника и
наночастиц, чтобы изучить влияние состава на термочувствительность.Капсулы
имеют средний диаметр около 76 нм и покрыты оболочкой толщиной около 7 нм. На
каждую капсулу приходится 2-5 наночастиц, а полимерная матрица занимает большую
часть объема, но предоставляет достаточно места для загрузки лекарств. Покрытие
из оксида кремния плотное и протяженное. Защитная «скорлупа» достаточно хорошо
предотвращает преждевременный выход содержимого капсулы наружу.
2.1.8 ДНКсомы
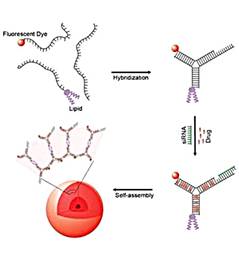
Ученые создали мультифункциональные наночастицы,
способные одновременно доставлять в клетки несколько лекарственных препаратов и
молекулы для подавления экспрессии генов - малые интерферирующие РНК. Частицы
названы ДНКсомами, так как их строительными блоками являются короткие цепочки
синтетической ДНК
ДНКсомы могут нести различные препараты, а также
молекулы РНК, разработанные для специфического подавления экспрессии генов. Их
эффективность значительно выше, чем у таких систем доставки, как липосомы
(крошечные «обертки» из фосфолипидных молекул, составляющих природные клеточные
мембраны) или полимерные наночастицы. Кроме того, ДНКсомы менее токсичны для
клеток.[4]
.
. Наночастицы как лекарства
липосомный нанокапсула наночастица
лекарственный
В период 1998-2005 г.г. опубликовано более 200 научных
работ, демонстрирующих эффективность применения фуллеренов (фуллерены -
молекулярные соединения углерода, пребывающие в виде наночастиц, нанотрубочек,
наношариков и дендримеров) при лечении целого ряда заболеваний, включая рак,
склероз, вирусные и бактериальные инфекции (менингит и ВИЧ). В России ведутся
работы и получены положительные результаты, подтвержденные публикациями и
патентами, в области применения фуллеренов и их модификаций для лечения гриппа,
онкологических заболеваний и бактериальных инфекций (туберкулез). Получены
данные о возможности использования наночастиц для производства эффективных
вакцин.
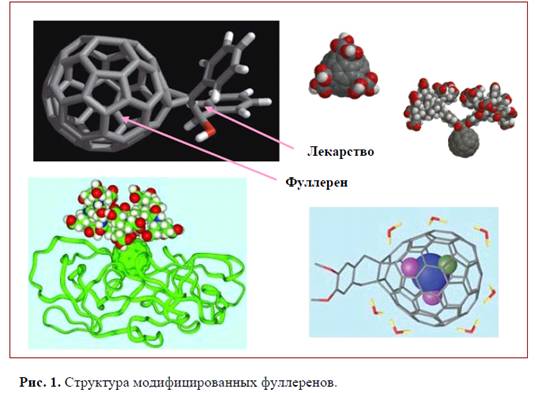
Разнообразие технологий производства фуллеренов и их
производных позволяет планировать существенное расширение спектра применения
наночастиц как лекарств.
Исследования на протяжении тридцати лет привели к
созданию нанолекарства - препарата «ФОСФОГЛИВ». Также разработана инъекционная
форма лекарственного препарата «ФОСФОГЛИВ» с использованием наночастиц.
ЭТАПЫ СОЗДАНИЯ ФОСФОГЛИВА
. НАУЧНО- ИССЛЕДОВАТЕЛЬСКИЕ РАБОТЫ ПО СОЗДАНИЮ КОМПОЗИЦИИ
ФОСФОГЛИВА (1975 - 1985 гг)
. ДОКЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ ФОСФОГЛИВА (1985-1992гг)
. РАЗРАБОТКА ТЕХНОЛОГИИ И СОЗДАНИЕ ОПЫТНО -
ПРОМЫШЛЕННОГО ПРОИЗВОДСТВА ФОСФОГЛИВА(1993-1998 гг)
. КЛИНИЧЕСКИЕ ИСПЫТАНИЯ ФОСФОГЛИВА -1\2\3- ФАЗЫ(1999-
2003гг)
. РЕГИСТРАЦИЯ ФОСФОГЛИВА (2001-2002гг)
Наносистема лекарственного средства ФОСФОГЛИВ
представляет собой частицы диаметром не более 50 нм и содержит соевый
фосфатидилхолин и глицирризиновую кислоту. При клиническом применении препарата
отмечается его ингибирующее действие на репликативную активность вирусов
гепатита В и С, а также положительное влияние на иммунный интерфероновый
статус. Ремиссия при лечении гепатита С с использованием препарата составила
70%.
«ФОСФОГЛИВ» обладает очень низкой токсичностью, не
вызывает аллергических реакций, устойчив при хранении. Получают препарат
эмульгированием активных компонентов в водном растворе мальтозы под давлением
1500 атм. Потом следуют процессии ультрафильтрации и лиофилизации раствора в
флаконах. Получено также изображение частиц препарата с помощью АСМ. Основная
масса частиц имеет размеры около 40 нм.
ФОСФОГЛИВ - НОВЫЙ ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ
ПЕЧЕНИ, В ТОМ ЧИСЛЕ ВИРУСНЫХ ГЕПАТИТОВ
Рис. Лекарственные формы ФОСФОГЛИВА.
Сейчас ФОСФОГЛИВ - сертифицированный лекарственный
препарат из группы гепатопротекторов, обладает также противовирусной
активностью.
Фосфатидилхолин в составе средства, действуя наподобие
«мембранного клея», восстанавливает структуру поврежденных мембран гепатоцитов,
восстанавливая функцию печени. Глицирризиновая кислота в виде натриевой соли
подавляет репродукцию вируса в печени и других органах за счет стимулирующего
действия на продукцию интерферона, увеличения активности естественных киллеров
и др.
Препарат показан при острых и хронических гепатитах
(А, B, C и D), дегенеративных изменениях печени, при лекарственном и
алкогольном поражении печени, при псориазе, экземе и бронхиальной астме.[6]
.1 Препараты в стадии разработок
Некоторые нанопрепараты находятся на этапе клинических
испытаний и разработок, так например препарат АВР-560
Разрабатываемый препарат АВР-560 является ингибитором
нового класса, кардинально отличающимся от всех известных разрабатываемых в
настоящее время препаратов против HCV и обладающим значительным экспортным
потенциалом.
Гепатит С - заболевание печени, вызываемое вирусом
гепатита С (ВГ С), входит в перечень социально значимых заболеваний и перечень
заболеваний, представляющих опасность для окружающих. Попадая в организм,
вирусная инфекция повреждает основные функциональные клетки печени (гепатоциты)
и в большинстве случаев приводит к развитию хронической формы заболевания. По
данным ВОЗ около 150 миллионов человек хронически инфицированы вирусом гепатита
С, и ежегодно более 350 000 человек умирают от связанных с гепатитом С болезней
печени.
АВР-560 подавляет распространение инфекции ВГС в
культуре клеток не только посредством секретируемых вирусных частиц, но также и
распространение инфекции, осуществляемое через тесный клеточный контакт. Данное
свойство является принципиально важным преимуществом, т.к. распространение
вирусной инфекции через клеточный контакт играет большую роль в поддержании
инфекции в печени при хроническом гепатите С.
В проведенном в 2013 году клиническом исследовании
Фазы I на здоровых добровольцах была оценена безопасность, переносимость и
фармакокинетика однократного приема АВР-560 в дозах 50, 100 и 150 мг. Было
продемонстрировано, что препарат обладает хорошей переносимостью и
благоприятным профилем безопасности. Полученные данные позволили обоснованно
продолжить клинические исследования[7].
Нанолекарство от рака
Лекарство - точнее, действующее вещество - доцетаксел.
Это, в общем-то, давно известный препарат растительного происхождения,
подавляющий рост раковых клеток, то есть цитостатик. Как и абсолютное
большинство используемых в химиотерапии рака веществ, доцетаксел обладает
массой побочных эффектов вкупе с перечнем особых указаний на пару страниц...
но, увы, подавить рост одних клеток и не навредить другим практически
невозможно. Можно лишь попытаться уменьшить побочный эффект, и вот тут-то на
сцену выходят нанотехнологии. Их принцип, изложенный отдельно от всех
технологических нюансов, довольно прост. Молекулы доцетаксела загружаются в
микроскопические капсулы, а капсулы покрываются антителами к опухолевым белкам.
Антитела сами являются белками, которые прилипают лишь к своей мишени, так что
мимо здоровых тканей и органов такие нанокапсулы должны проходить без задержки,
прицепляясь лишь к клеткам опухоли. Сливаясь с раковой клеткой капсулы
высвобождают доцетаксел адресно и вместо ковровой бомбардировки мы получаем
точечную «полицейскую операцию» с уничтожением только опухоли, без поражения
здоровых почек или слизистых оболочек желудка.
Адресная доставка лекарства прямо к клеткам-мишеням
при помощи наносистем: направление, в котором ведутся очень активные работы по
всему миру. Разные группы ученых и врачей пытаются подобрать состав частиц,
само действующее вещество и способ доставки. В клиниках уже испытывается более
десятка подобных препаратов, а число проверяемых на клеточных культурах и
животных комбинаций вовсе исчисляется сотнями[2].
Нанолекартсво для продления молодости
Ученые создали первые в мире нанолекарства, основная
задача которых продлить жизнь человечеству. Эти нанолекарства способны продлить
жизнь аж до 200 лет. Продлить жизнь на столь длительный срок удалось благодаря
открытой ими возможности нано структур бороться с агрессивными свободными
радикалами, которые образуются в организме человека, а также восстанавливать
нервные клетки прямо на месте.
В настоящие время столь полезное изобретение проходить
крупное тестирование. Если они увенчаются успехом, то многие фармацевтические и
IT-компании готовы вложить в развитие разработки многомиллионные суммы. Как
говорят специалисты тестирование уже показывает довольно хорошие результаты. В
ходе тестирования ученым удалось вернуть молодость 104-летнему добровольцу из
штата Айдахо, правда, облик мужчины претерпел некоторые изменения. В будущем
планируется продолжить разработки, потенциал которых позволяет даже воскрешать
вовремя замороженные тела[7].
3.2 Достижения Томских ученых
Против рака
Ученые Института физики высоких технологий (ИФВТ)
Национального Исследовательского Томского политехнического университета (НИ
ТПУ) создадут новые лекарства точечного действия, в частности противораковые
препараты, которые пока не производятся в России. "Мы, основываясь на
недавно открытых нами методах органического синтеза, разработали несколько
групп препаратов. Основные усилия были направлены на создание противораковых
лекарств. Мы химически пришиваем к поверхности особых наночастиц белки, которые
"прилипают" к раковым клеткам и губят их. По такому же принципу мы
делаем диагностические препараты, например, магнитные контрасты, которые
используются для таких видов исследований, как магнитно-резонансная томография.
В России используют эти препараты, но не производят", - процитировала пресс-служба
заведующего кафедрой биотехнологии и органической химии ТПУ Виктора Филимонова.
Против рассеянного склероза
Оценить способности регенерации мозга при ишемии или
рассеянном склерозе позволит совместное исследование ученых Томского
государственного университета и Университета Вашингтона.
Нейро- и глиогенез - процессы образования новых
нервных клеток (нейронов и глии), то есть регенерации головного мозга.
Оказалось, эти процессы усиливаются при повреждении мозга, управление этими
ими, скоро можно будет использовать более эффективные терапии ишемии мозга,
болезни Гентингтона, Альцгеймера и Паркинсона, мозговых травм, рассеянного
склероза. Однако в настоящее время отследить ход нейрогенеза можно только одним
способом - по срезам мозга.
Проект ученых ТГУ направлен на создание методики
количественной оценки нейрогенеза с использованием МРТ. Ученые, разрабатывал
новые методы диагностики сердечно-сосудистых и неврологических заболеваний с
помощью современных МРТ-техник. Эти методы запатентованы и широко используются
в больницах и научно-исследовательских центрах в США, Европе и Китае.
Исследование будет проводиться на моделях двух
социально значимых заболеваний - ишемии мозга и рассеянного склероза - с
использованием уникального магнитно-резонансного томографа Института цитологии
и генетики СО РАН.
Ранозаживляющие повязки VitaVallis
Представляет собой повязку, оказывающую
ранозаживляющее действие. Защищает раны от инфекции, не оказывает на них
токсического воздействия, способствует очищению, стимулирует регенерацию и минимизирует
образование рубцов. Снижает болевые ощущения.
Повязка сорбирует из раны микроорганизмы, подавляет их
размножение. Хорошо драпируется, безболезненно и без остатков удаляется. При
этом повязка не содержит антибиотиков и фармпрепаратов.
Разработана специалистами Института физики прочности и
материаловедения СО РАН, учеными Сибирского государственного медицинского
университета (СибГМУ) и НИИ фармакологии СО РАМН. Производством занимается
резидент томской особой экономической зоны (ОЭЗ) «Аквелит». Повязка продается в
аптеках по всей России и за рубежом.
Неиназивный глюкометр «Глюкоскан»
Портативный прибор предназначен для контроля уровня
глюкозы в крови больных диабетом. Использование традиционных глюкометров
болезненно для пациента - чтобы взять кровь на анализ, требуется прокол кожи.
Кроме того, это довольно дорогое удовольствие из-за высокой стоимости
материалов.
«Глюкоскан» позволяет контролировать уровень сахара в
крови человека оптико-спектроскопическим методом: лазер подносится к мочке уха
с одной стороны, а с другой - специальный приемник излучения. Лазер
просвечивает мочку, приемник получает сигнал, после чего прибор обрабатывает и
анализирует данные.
Прибор разработали специалисты Института сильноточной
электроники СО РАН, производством занимается «Медицинская электроника».
Средства на организацию мелкосерийного производства прибора выделяли Российская
венчурная компания (РВК) и Британский венчурный фонд Oxford Russia Business
Innovation Trust.
Эндопротезы
Эндопротезы малых суставов из наноструктурной
цирконоксидной керамики.Эндопротезы различных суставов, стоматологические
имплантаты и межпозвоночные диски для шейного отдела позвоночника
изготавливаются из цирконоксидной керамики, которая очень прочна, обеспечивает
максимальное скольжение между компонентами, минимальное трение и истирание.
Технология костеподобной модификации поверхности
эндопротезов суставов, вступающей в прямой контакт с костными тканями,
позволяет ускорить достижение прочной фиксации имплантатов и сократить
длительность лечения, а также расширить спектр имеющихся показаний.
Производством занимается резидент томской ОЭЗ компания «МОЙЕ
Керамик-Имплантате», которыая в 2012 году запустил в Томске первое в России
производство таких эндопротезов[1].
Заключение
Исходя из материалов статей, различных научных журналов, можно говорить о
большой популярности нанотехнологий и нанопрепаратов в медицине, и фармации.
Многие учёные занимаются проблемами нанотехнологий и стремятся изучить
всевозможное их применение в различных областях науки.
В настоящее время имеется большой арсенал наночастиц, с помощью которых
создаются наиболее эффективные и безопасные лекарственные средства.
Нанотехнологии позволяют доставлять вещества в конкретные участки
организма, контролировать их высвобождение, избирательно действовать на клетки.
Хочется надеяться, что многие препараты пройдут испытания и выйдут на
фармацевтический рынок, и помогут спасти немало жизней.
Список литературы
1. Наноновости nanonewsnet.ru
[Электронный ресурс]. - Электрон. дан. - Режим доступа:
<http://www.nanonewsnet.ru/articles/2013/desyat-tomskikh-razrabotok-kotorye-mogli-izmenit-mir>
. Исследовательский Институт
Химического Разнообразия iihr.ru [Электронный ресурс]. - Электрон. дан. - Режим
доступа: <http://www.iihr.ru/i-news/detail.php?ID=2617>
. Нанотехнология. Современное
состояние и перспективы. "Новые информационные технологии". Тезисы
докладов XII Международной студенческой школы-семинара / C.Б. Нестеров //
МГИЭМ. - 2004. - C. 21-22.
4. Gholam, A.
Micro- and nanoparticulates / A. Gholam //Advanced Drug Delivery Reviews. -
2005. - V.57. - P. 2047-2052.
5. Наномедицина ru.wikipedia
[Электронный ресурс]. - Электрон. дан. - Режим доступа:
<http://ru.wikipedia.org/wiki/Наномедицина>
. Нанолекарства elibrary.ru
[Электронный ресурс]. - Электрон. дан. - Режим доступа:
<http://elibrary.ru/query_results.asp>
. АВР-560 rusnanonet.ru wikipedia [Электронный ресурс].
- Электрон. дан. - Режим доступа: <http://www.rusnanonet.ru/news/99802/>
8. Алфимова М.М. Занимательные
нанотехнологии. - М.: Бином, 2011. - С. 96.
. Эрлих Г. Малые объекты -
большие идеи. Широкий взгляд на нанотехнологии.. - М.: Бином, 2011. - С. 254.
10. Nanotechnology
in Medicine and the Biosciences, by Coombs RRH, Robinson DW. 1996, ISBN
2-88449-080-9
<http://ru.wikipedia.org/wiki/%D0%A1%D0%BB%D1%83%D0%B6%D0%B5%D0%B1%D0%BD%D0%B0%D1%8F:%D0%98%D1%81%D1%82%D0%BE%D1%87%D0%BD%D0%B8%D0%BA%D0%B8_%D0%BA%D0%BD%D0%B8%D0%B3/2884490809>
. Wagner V,
Dullaart A, Bock AK, Zweck A. (2006). «The emerging nanomedicine landscape
<http://www.ncbi.nlm.nih.gov/sites/entrez?db=pubmed&uid=17033654&cmd=showdetailview>».
Nat Biotechnol. 24 (10): 1211-1217. DOI <http://ru.wikipedia.org/wiki/%D0%98%D0%B4%D0%B5%D0%BD%D1%82%D0%B8%D1%84%D0%B8%D0%BA%D0%B0%D1%82%D0%BE%D1%80_%D1%86%D0%B8%D1%84%D1%80%D0%BE%D0%B2%D0%BE%D0%B3%D0%BE_%D0%BE%D0%B1%D1%8A%D0%B5%D0%BA%D1%82%D0%B0>:10.1038/nbt1006-1211
<http://dx.doi.org/10.1038%2Fnbt1006-1211>. PMID 17033654
<http://www.ncbi.nlm.nih.gov/pubmed/17033654?dopt=Abstract>
. Эрлих Г. Малые
объекты - большие идеи. Широкий взгляд на нанотехнологии.. - М.: Бином, 2011. -
С. 254