Доказова медицина: передумови виникнення, історичні відомості, визначення, методологічні засади
Курсова робота
Доказова медицина: передумови виникнення, історичні відомості,
визначння, методологічні засади
1.
Історія розвитку доказової медицини
лікування доказовий медицина
Протягом століть погляди
медіків базувалісь на дослідженнях Галена (Рис. 1). Цей давньогрецький лікар
зробив суттєвий внесок в розвиток анатомії і фізіології, практикуючи
анатомування трупів людей і здійснюючи досліди на тваринах. На відміну від
Аристотеля, описував головний мозок як орган зосередження чуттєвості, психічної
діяльності та руху. Описав близько 300 м'язів, а також середній мозок, сім пар
черепномозкових нервів, блукаючий нерв; здійснюючи дослідження з перерізування
спинного мозку свиней наочно продемонстрував функціональну відмінність між
передніми (руховими) і задніми (чуттєвими) корінцями спинного мозку.
На основі спостережень
відсутності крові у лівих відділах серця забитих тварин і загиблих гладіаторів,
а також у виявлених ним під час анатомування трупів недоношених немовлят отвору
у міжшлунковому перепоні створив першу в історії фізіології теорію кровообігу,
за якою, як стверджував Гален, артеріальна і венозна кров різні за природою
рідини. Причому перша, артеріальна, «розносить рух, тепло і життя», а друга,
венозна, покликана «живити органи».

Рис. 1. Гален
Пергамський
Концепція Галена надовго
пережила автора, проіснувавши аж до відкриттів Андреаса Везалія (Рис. 2) та
Вільяма Гарвея (Рис. 3).


Рис.
2. Андреас Везалій. Рис. 3. Вільям Гарвей
Вивчаючи праці Галена і
його погляди на будову людського тіла, Везалий виправив понад 200 помилок
канонізованого античного автора. Підсумком став трактат Про будову людського
тіла (De humani corporis fabrica, 1543). Засновник сучасної фізіології та
ембріології У. Гарвей (1578-1657) (Рис. 3), який відкрив великий і малий кола
кровообігу, виклав вчення про кровообіг і вперше висловив думку, що «все живе
походить з яйця» [2].
Однак, незважаючи на
дослідження А. Везалія, У. Гарвея, їх послідовників Р. Коломбо (1516-1559), М.
Сервета (1511-1553), Т. Сиденгама (1624-1689) та ін., лікарське мислення
продовжувало опиратися на старі уявлення. Аж до XIX в. багато лікарів вважали
істинної гуморальную теорію виникнення захворювань, згідно з якою стан здоров'я
людини залежить від співвідношення між чотирма рідинами організму - крові,
слизу, жовтої та чорної жовчі [3].
Необхідно відзначити, що
аж до початку XIX в. діагностиці захворювань не приділялося належної уваги.
Лабораторні методи дослідження в той час були недоступні, захворювання
діагностували тільки на підставі клінічної картини. Хвороби розглядалися як
клінічні синдроми, і діагностика зводилася до вміння їх розпізнавати.
Обстеження хворого було вельми поверхневим - розпитування, загальний огляд,
оцінка стану пацієнта, визначення характеру пульсу, кольору сечі і її осаду,
температури тіла на дотик.
У медицині донауковий
період тривав набагато довше, ніж в інших галузях науки. Користь від багатьох
методів лікування в ту епоху була дуже сумнівною, а іноді воно навіть
представляло реальну загрозу життю пацієнта. Так, загальноприйнятим було
лікування вогнепальних ран шляхом припікання розпеченим залізом і киплячим
маслом. Під час італійської кампанії в 1536, коли запаси масла вичерпалися,
французький лікар А. Паре (1510-1590) почав накладати на рани пов'язки, як йому
здавалося, з недієвим складом на мазевой основі. У своєму щоденнику він писав,
як провів безсонну ніч, переживаючи за нещасних солдатів, яких він лікує таким
нетрадиційним способом, і як він був вражений ранок, переконавшись, що поранені
«були задоволені, немов лугові жайворонки», а ті, які напередодні отримали
традиційне лікування, продовжували страждати від лихоманки і болю.
Пізніше розвивається
клініко-анатомічний напрямок в медицині, основоположником якого є Д.Б. Морганьи
(Рис. 5.). Прихильники даного напрямку проводили ретельне клінічне обстеження
пацієнтів, а після їх смерті співвідносили клінічні симптоми з анатомічними
змінами, виявленими при розтині.
До початку XIX в. була
значною мірою втрачена колишня віра в застарілі теорії та і великої кількості
методів лікування. Песимістичний настрій, який був присутній в оточенні
лікарів, найкраще відображає витяг з заміток, опублікованих в одному з журналів
тих часів: «У медичну науку ще так і не прийшов свій Ньютон, і, на жаль, ми
правомочні припускати, що, можливо, не зустрінемо генія, здатного привнести у
розвивається медицину то самого, що фізика взяла у математики, а хімія - на
шальках лабораторних ваг. Медицина залишається тим, чим були дві ці науки сто
років тому - набором умовисновків, що слабо співвідносяться один з одним».
Настав час для народження нового і вельми критичного відношення до медицини.
Першовідкривачами
кількісної методу оцінки ефективності профілактики діагностики та лікування
стали лікарі П. Луї (1787-1872) і Ж. Гавар (1809-1890). [4] П. Луї одним з
перших засумнівався в ефективності кровопускання як методу лікування, поставивши
під сумнів догмат про те, що його необхідно виконувати якнайшвидше. Він
порівнював результати лікування пацієнтів, яким кровопускання виконувалося при
перших симптомах хвороби і в набагато більш пізні терміни, і виявив, що вони
ніяк не залежали від термінів флеботоміі.
До цього моменту вже
розроблялися основні закони статистики як прикладного інструмента. Ж. Гавар
одним з перших почав впроваджувати їх в медичну практику. Він говорив, що
висновки про переваги одних методів над іншими не повинні базуватися на
емпіричних уявленнях, а повинні випливати з тих результатів, які отримані в
процесі уважного спостереження за досить великими вибірками пацієнтів, яким
призначено лікування по порівнюваним методикам. Гавар зазначав: «Щоб віддати
перевагу одному з втручань, воно повинно не тільки демонструвати «набагато»
кращий результат, ніж порівнювані способи лікування, а й відмінності в їх
ефективності повинні перевищувати якесь порогове значення, яке пов'язане з
числом спостережень. Якщо ж різниця нижче прийнятого порогового значення, то
його слід швидше за все ігнорувати і не вважати суттєвим». Іншими словами, саме
Ж. Гавар розробив безпосередньо статистичний підхід, на якому і базується вся
доказова медицина.
Виникненню в медицині
контрольованих випробувань призначив свої роботи І. Фібігер, який в 1898 р
описав результати клінічного дослідження, в якому порівнювалися підсумки
лікування пацієнтів з дифтерією, розбитих по групах отримували і не отримували
відповідну сироватку. Але дослідження не звернуло на себе погляд консервативно
налаштованих професіоналів медицини. Тільки лише в 1948 р були надруковані
результати вимірювання ефекту стрептоміцину у пацієнтів з туберкульозом. Саме
це дослідження вважається першим контрольованим, яке відповідало методологічним
правилам рандомизации і виконання статистичних норм і аналізу В 50-х з'явилася
безліч нових методів лікування захворювань. Як правило, прихильники нового
методу базували свою думку лише на тому, що витікає з ізестний фактів
патогенезі захворювання. Але після було позначено, що значна частка з них
зовсім марні.
Англійського клінічного
епідеміолога Арчі Кохрана прийнято вважати піонером, адже саме він в 70-і
запропонував ревізію накопичених до того часу медичних знаннях і відокремити
методи і способи впливу з ефективністю, достовірність яких здобута в
рандомізованих дослідженнях, від методів, достовірність яких цим способом не
підтверджена. Він розробив технологію виконання подібного мета-аналізу. В 90-і,
вже після, учнями і послідовниками, створюється об'єднання «Коxрановское
співпрацю». Основна мета організації - допомога практикуючим лікарям усього
світу в об'єктивно і науково обґрунтованому виборі клінічно перевіреного
лікарського препарату або методу лікування. Це досягається за допомогою
ретельного пошуку та аналізу відомостей про виконані рандомізованих
контрольованих випробуваннях. Історія медицини вчить, що вибір клінічного
рішення, заснований тільки на теоретичних даних (незалежно від того, в
донаучний або науковий період вони з'явилися) і на результатах неконтрольованих
експериментальних досліджень, ненадійний. У зв'язку з цим рішення лікаря по
можливості повинна спиратися на результати контрольованих досліджень. Такі
дослідження, якщо вони добре сплановані і проведені на високому методологічному
рівні, зводять до мінімуму ймовірність виникнення помилок, характерних для
неконтрольованих досліджень [5,6]. Головним інструментом доказової медицини та
клінічної епідіміологіі стала статистика. Статистика - наука, що вивчає прийоми
систематичного вивчення масових процесів складанням кількісних їх характеристик
і науковим їх описом. Саме за допомогою біомедичної статистики описуються й
обговорюються висновки будь-яких біологічних і медичних випробувань в
кількісному вигляді. Сам термін «доказова медицина» запропонований в 90-і роки
клінічними епідеміологами з Мак Мастерського університету в м Торонто.
2. Передумови виникнення
доказової медицини
2.1 Першопрохідці
доказової медицини
У XVII столітті Жан
Баптиста ван Хельмонт, лікар і філософ, оскаржив практику кровопускання. Він
запропонував, напевно, перший клінічне випробування з великим числом учасників,
рандомізацією і статистичним аналізом. Передбачалося залучення 200 - 500
бідняків, яких планувалося розділити (випадково, шляхом жеребка) на дві групи,
в одній з яких флеботомії уникали, а в іншій - пацієнтам робили стільки
кровопускань, скільки лікарі вважали за потрібне. Ефективність кровопускання
передбачалося оцінювати по числу… похоронів в кожній групі. На цей час
невідомо, чому цей чудовий експеримент не був виконаний. Хоча можна припустити,
що ідея проведення такого роду експерименту не зустріла схвалення переважної
більшості лікарів того часу. І факти, що дійшли до нас - перші спроби
проведення експерименту для оцінки ефективності того чи іншого втручання.
Сучасна ж наукова медицина бере свій початок в Парижі середини XIX століття в
роботах і вченні П'єра Шарля Олександра Луї (Pierre Charles Alexandre Louis)
(Рис. 4)

Рис. 4. П'єр Шарль
Олександр Луї (1887-1872)
Саме він вперше при
оцінці медичного лікування і показав, що кровопускання є марним видом лікування
(хоча це не змінило практики лікарів того часу). Незважаючи на цю провідну
роботу, дуже мало лікарів закликало до того, щоб результати клінічних
випробувань були взяті на озброєння. Навіть після того, як в 20х роках XX
століття Рональдом Фішером (Ronald Fisher) були введені принципи кількісного
експериментального дизайну. Ці ідеї почали істотно впливати на клінічну
практику тільки після Другої світової війни за допомогою робіт сера Аустін
Бредфорда Хілла (Austin Bradford Hill) і його послідовників, британських
епідеміологів - особливо Річарда Долла (Richard Doll) і Арчі Кокрана (Archie
Cochrane). Чому вона виникла? У середині минулого століття визначилися чіткі
передумови для появи і розвитку так званої «медицини, заснованої на доказах».
Тим більш, що це був час активного розвитку науки - з'явилися нові
інструментальні та апаратні методи діагностики, фармакологічні препарати.
2.2 Причини виникнення
доказової медицини
Одна з очевидних причин
виникнення доказової медицини - збільшення обсягу наукової інформації, зокрема
в галузі клінічної фармакології. Щорічно в клінічну практику впроваджуються все
нові і нові препарати. Вони активно вивчаються в численних клінічних дослідженнях,
результати яких нерідко виявляються неоднозначними, а іноді й прямо
протилежними. Одночасно спростився доступ до наукової інформації. Сьогодні
будь-який користувач Інтернет може протягом декількох хвилин отримати відомості
про сотні чи тисячі статей по цікавій для нього проблеми. Однак щоб
використовувати отриману інформацію на практиці, її необхідно не тільки
ретельно проаналізувати, а й узагальнити.
Інша причина - брак
коштів, пов'язана із зростанням витрат на охорону здоров'я. У цій ситуації серед
великої кількості лікарських препаратів необхідно вибрати саме ті засоби, які
мають найбільш високу ефективність і кращу переносимість. Слід зазначити, що
новизна або висока вартість нового препарату не є гарантією його більш високої
ефективності. Проблема раціонального витрачання коштів особливо актуальна для
нашої країни, тому що з одного боку бюджет української охорони здоров'я явно
недостатній, а з іншого боку продовжують широко використовуватися лікарські
препарати, ефективність яких не доведена (або навпаки доведена неефективність)
або викликає сумнів. Очевидно, що немає сенсу намагатися здешевити лікування
шляхом використання недорогих, але мало ефективних препаратів (наприклад,
застосовувати препарати часнику або нікотинової кислоти - замість статинів при
дисліпідемії), але треба знати - профілі гіперліпідемії (їх 5 різновидів). Але
настільки ж безглуздо призначати дорогі лікарські засоби в тих випадках, коли
не менший або навіть більший ефект можуть дати більш дешеві засоби. І те, і
інше в кінцевому підсумку призводить до збільшення витрат. Але для цього є
фармакоекономіка і кілька десятків клінічних провізорів.
Сам термін «доказова
медицина» може викликати неоднозначне ставлення лікарів, так як необхідність
підтвердження ефективності та безпеки лікарських засобів, навряд чи, у кого
викликає сумніви. Питання полягає в тому, що може служити доказом ефективності
та безпеки лікування. Мабуть, кожен лікар цілком обгрунтовано вважає, що він у
своїй практиці орієнтується на реальні наукові факти, проте чи так це
насправді? Одним із шляхів розробки нових препаратів є вивчення механізмів
розвитку захворювання, яке дозволяє визначити «мішені» для дії лікарських
речовин. Відповідно, лікарі зазвичай вважають, що препарат, сприятливо впливає
на ту чи іншу ланку патогенезу хвороби, ефективний у її лікуванні. Але на
практиці ми часто стикаємося із зворотного ситуацією. Наприклад, одним з
основних медіаторів бронхоспазму є гістамін, проте антигістамінні засоби мало
ефективні в лікуванні бронхіальної астми.
Приклади необґрунтованих
підходів до лікування поширених захворювань:
- Застосування
сульфаніламідів при гострих респіраторних вірусних інфекціях;
- Широке
застосування клофеліну і комбінованих препаратів (типу адельфана) на першому
етапі лікування артеріальної гіпертонії;
Використання
т.зв. гепатопротекторів для лікування цирозу печінки;
Застосування
кокарбоксилази, рибоксина для лікування серцевої недостатності;
Парентеральне
введення вітамінів з метою допоміжного лікування захворювань внутрішніх органів
У медицині велику роль
відіграє суб'єктивний фактор, зокрема особистий досвід лікаря, думка експертів
і т. п. У певних ситуаціях, наприклад, при виборі антибіотика для емпіричної
терапії інфекцій, індивідуальний досвід має - дуже важливе значення, однак в інших
випадках він не може принести будь-якої користі. Приклад - застосування
аспірину з метою вторинної профілактики інфаркту міокарда. Очевидно, що при
вирішенні питання про доцільність профілактичного лікування лікар може
орієнтуватися тільки на результати клінічних досліджень. Іноді особистий досвід
призводить до формування хибних уявлень про лікарський препарат. Наприклад,
лікарі часто намагаються використовувати нові засоби при найбільш важких формах
хвороби. Відсутність будь-якого ефекту нерідко призводить до їх повного
розчарування, хоча той же препарат міг би виявитися незамінним засобом
лікування легких або середньо - тяжких форм хвороби або пацієнтів будь-якої
певної групи (літніх людей, пацієнтів, які страждають супутніми захворюваннями,
тощо.).
В останні роки
відзначається явна тенденція до ширшого використання перевірених методів
лікування, ефективність яких доведена в адекватних клінічних дослідженнях.
Відображенням цієї тенденції є спроби стандартизації підходів до лікування
поширених захворювань (рекомендації з лікування артеріальної гіпертонії,
ВІЛ-інфекції, пневмонії, хронічного гепатиту і т.д.). Такі спроби можуть
викликати критику у прихильників індивідуалізованого лікування, проте подібні
заперечення, навряд чи, обгрунтовані. По-перше, рекомендації, як правило,
залишають достатньо широке поле для маневру (наприклад, рекомендації з
лікування гіпертонії припускають вибір засобу першого ряду серед шести груп
антигіпертензивних препаратів), що дозволяє забезпечити індивідуальний підхід
до терапії. І, по-друге, що найголовніше, подібні рекомендації ґрунтуються на
реальних фактах і виключають широке використання неадекватних методів
лікування.
На жаль, в Україні
частіше доводиться стикатися з протилежною ситуацією. Незрозумілою популярністю
як і раніше користуються абсолютно необгрунтовані методи лікування, деякі з
яких перераховані вище. По суті справи вони являють собою стереотипи, які
тиражуються в наукових статтях і деяких навчальних посібниках.
Деякі з наведених
положень взагалі не вимагають обговорення. Наприклад, очевидно, що немає сенсу
застосовувати сульфаніламіди у хворих з вірусними інфекціями або призначати
т.зв. гепатопротектори для лікування цирозу печінки.
2.3 Принципи доказової
медицини в формуванні поглядів молодих спеціалістів
Принципи медицини,
заснованої на доказах, мають важливе значення для викладання. Студенти та
молоді лікарі, які не мають досвіду лікування хворих, найбільш схильні до
впливу суб'єктивних факторів, тому у них досить легко формуються хибні уявлення
про підходи до лікування тих чи інших хвороб. Звичайно, немає потреби вводити в
програму навчання в медичних вузах новий предмет, однак саме в інституті слід
прищеплювати прагнення до критичного аналізу наукової інформації. До речі, в
галузі викладання стикаються з ще однією важкою проблемою. Підручники, якими
користуються студенти, звичайно застарівають вже до моменту виходу в світ, так
як для їх підготовки потрібно кілька років, а за цей період багато чого
змінюється.
2.4 Області застосування
доказової медицини
Принципи медицини,
заснованої на доказах, необхідні кожному лікарю, клінічним провізору,
провізору, які повинні критично аналізувати та інтерпретувати наукові дані і
використовувати їх на практиці. Сьогодні існують різні погляди на медицину,
засновану на доказах. Є досить багато критиків цього підходу. Наприклад, у США
доказову медицину часто порівнюють з кухонної книгою, в якій містяться рецепти
лікування хвороб. З іншого боку радикальні прихильники медицини, заснованої на
доказах, доводять до абсолюту значення рандомізованих контрольованих
досліджень. Звичайно, істина знаходиться посередині (знайти треба золоту
середину). Сучасна медицина наближається до точних наук, проте все одно ніколи
нею не стане, тому індивідуальний досвід і особистість лікаря завжди мали і
матимуть - важливе значення. Однак сьогодні було б неправильним при виборі
лікування орієнтуватися тільки на почуття і ігнорувати результати праці
дослідників, спеціально займалися відповідною проблемою. Зрештою, практика
доказової медицини передбачає поєднання індивідуального клінічного досвіду та
оптимальних доказів, отриманих шляхом систематизованих досліджень.
Процес торкнувся
практично всі галузі медицини, зумовивши обвальний приріст інформації, що дає
часом суперечливі дані, що в підсумку призвело до інформаційного «кризи
надвиробництва» в медицині. З іншого боку, пацієнти більше не хочуть бути
учасниками «лотереї», відчуваючи на собі методи лікування і покладаючись тільки
на кваліфікацію лікаря. Крім того, прагнучи забезпечити високоякісну медичну допомогу
населенню, держави всього світу зіткнулися з наростаючими труднощами при
відповіді на питання: «Скільки коштує якісна медична допомога?» І «Що конкретно
можна вважати якісною допомогою?» Підсумком стало чітке розуміння того, що
пріоритети, в першу чергу в програмах державних гарантій, в умовах
невідповідності між потребою в медичній допомозі і ресурсами охорони здоров'я,
потрібно розставляти на підставі достовірних відомостей про клінічну
ефективність різних втручань. Стало ясно, що не всяка медична допомога
ефективна і що її найкраще оцінювати за кінцевими наслідків. Все це вкупі
призвело до підвищення значущості сумарних клінічних досліджень і підняло на
належну висоту тих, хто в змозі виконати такі дослідження і правильно
інтерпретувати їх результати.
3. Визначення основних
термінів доказової медицни
Наприкінці 1990-х років
в англомовній медицині сформувалася нова галузь знань - клінічна епідеміологія.
Канадські вчені з Університету Мак-Мастера (Торонто, провінція Онтаріо) вперше
намагалися розглянути лікувальне мистецтво з погляду суворих наукових
принципів, які справляють великий вплив на стиль медичної практики і світогляд
лікарів. Головним постулатом клінічної епідеміології є те, що кожне клінічне
рішення має базуватися на достеменно доведених наукових фактах. Цей постулат
отримав назву Evidence-Based Medicine (далі - ЕВМ). Офіційно вважається,
що термін «ЕВМ» був запропонований у 1990 р. канадськими вченими на чолі з D.
Sackett, а на сторінках журналу Journal Club він з’явився 1991 р. Опублікована
1997 р. праця D. Sackett під назвою «Evidence-Based medicine: How to practice
and teach EBM» стала першою подібною монографією. В ній було окреслено проблеми
правильного формулювання клінічних питань і пошуку доказів [7]. У 1998 р.
кардіологи Канади, США, Великої Британії видали монографію «Evidence-Based
Cardiology».
При спробах тлумачення
терміна «ЕВМ» основні труднощі викликало словосполучення evidence-based, яке
намагалися перекладати як «емпірична, прикладна, науково обґрунтована,
раціональна, аналітична, оптимальна, інформаційна» тощо. У дослівному перекладі
«ЕВМ» - це «медицина, заснована на фактах» чи, що більш точно відображає
значення терміна, «науково обґрунтована медична практика», «науково-доказова
медицина» або «доказова медицина».
Доказова медицина (EBM) - це розділ медицини, заснований на об’єктивних, науково
обґрунтованих фактах, які передбачають пошук, порівняння, узагальнення і широке
поширення отриманих доказів для використання їх в інтересах хворого
(Evidence-Based Medicine Working Group, 1993).
Міжнародна система EBM
розвивається в геометричній прогресії: з часу її становлення на початку 1990-х
років і дотепер кількість центрів, публікацій (монографій, статей) та форумів,
присвячених цій проблемі, обчислюється сотнями. При провідних університетах і
наукових організаціях різних країн світу зростає число центрів з окремих
проблем (здоров’я дітей, первинної допомоги, загальної практики, психічного
здоров’я та ін.). Загальним для всього напрямку є використання принципу
доказовості на будь-якому рівні прийняття рішень - від державної програми до
призначення індивідуальної терапії хворому.
У фармакотерапії під доказами
розуміють результати клінічних випробувань лікування різних захворювань, рівні
доказовості яких розрізняються ступенем контролю над факторами перешкод і
зменшуються в такому порядку: багатоцентрове рандомізоване дослідження з
подвійним сліпим контролем, рандомізоване контрольоване, нерандомізоване
контрольоване, нерандомізоване з історичним контролем, когортне, випадок-контроль,
перехресне, результати спостережень, опис випадків.
У 1948 р. англійськими
лікарями були оприлюднені результати першого клінічного випробування
ефективності стрептоміцину при туберкульозі. Одну групу хворих лікували
стрептоміцином, іншу - за стандартними на той час схемами фармакотерапії.
Розподіл пацієнтів за групами проводили згідно з таблицею випадкових чисел.
Принцип рандомізації (від англ. random - випадковий) - «випадково відібраних груп» -
став золотим стандартом медицини. Найбільш прийнятним і достовірним є
багатоцентрове рандомізоване дослідження з принципом подвійного сліпого
контролю.
У ході проведення рандомізованого
дослідження ефективності лікарського засобу при певному захворюванні групи
хворих (щонайменше дві) розподіляють випадковим методом. Цим досягається
практична ідентичність груп учасників за кількісними та якісними показниками.
Аналізують і оцінюють ефективність певного виду медичного втручання.
Нерандомізовані
дослідження передбачають розподіл
пацієнтів на групи невипадковим чином за неможливості випадкового розподілу з
технічних причин або етичних міркувань.
Когортні дослідження передбачають формування двох чи більше груп (когорт) пацієнтів, з
яких лише в одній здійснюється оцінка відповідного медичного чи лікувального
втручання, хоча клінічний результат реєструється в усіх групах. Спостереження
можуть тривати роками (вплив куріння на розвиток раку легень). Для когортних
досліджень інформацію можна отримати з великих баз даних лікувальних установ,
але висновки при цьому завжди будуть менш обґрунтованими, ніж при
рандомізованих.
Поперечні (або
одномоментні) дослідження
проводять методом опитування, обстеження, збору відповідей на конкретне
запитання серед лікарів та пацієнтів. Обстеження та збирання інформації про
пацієнта (чи групу пацієнтів) проводять одноразово. Це дає можливість
установити картину захворювання в одного хворого (чи групи хворих), уточнити
симптоматику, визначити окремі прояви і ступінь тяжкості хвороби. Кінцевим
результатом є опис захворювання в окремого пацієнта, а в сукупності варіантів -
це дослідження зв’язку деяких ознак з варіантом перебігу хвороби.
Дослідження типу
«випадок-контроль» виконують у
ситуаціях, коли очікуваний клінічний ефект реєструється дуже рідко чи
розвивається помірно. Формують групу осіб з окремих випадків відповідного
захворювання чи клінічного ефекту. Далі підбирають контрольну групу з осіб без
такого захворювання чи стану, але схожу за важливими прогностичними
характеристиками - віком, статтю, супутніми патологіями. Розраховують в усіх групах
кількість пацієнтів, які зазнали певних несприятливих та небажаних впливів.
Проводять кореляцію результатів з урахуванням відомих і вимірюваних
прогностичних факторів.
Опис випадку чи серії
випадків - це короткі
повідомлення про успішне лікування чи прояви загрозливих ускладнень
фармакотерапії, що вкрай необхідно для оперативної медичної інформації.
Цінність методу полягає в отриманні оперативного повідомлення щодо ускладнення
лікування, виникнення побічної дії тощо, адже чекати роками відповідної більш
достовірної інформації чfсто недоцільно.
Натепер у науковій
літературі під терміном «ЕВМ» різні автори розуміють:
. Сумлінне, точне й
осмислене використання результатів найбільш доказових з наявних клінічних
досліджень для вибору методів лікування (переважно медикаментозного) конкретних
хворих.
. Гарантування найбільш
ефективного, безпечного й економічно обґрунтованого лікування, заснованого на
найнадійніших і доступних інформаційних джерелах клінічної епідеміології.
. Збирання,
інтерпретацію та інтеграцію об’єктивних, з використанням сучасних приладів
клінічних даних, отриманих у результаті повідомлень пацієнтів, спостережень
фахівців і при проведенні випробувань.
. Технологію пошуку й
аналізу отриманих даних, узагальнення результатів клінічних спостережень за
допомогою сучасних статистичних методів, а також використання медичної
інформації, що дозволяє приймати оптимальні рішення щодо проведення
фармакотерапії конкретного захворювання.
. Процес безперервного
самокерованого навчання як медичного персоналу, так і хворого, що дозволяє
інтегрувати найнадійніші серед наявних факторів клінічної епідеміології з
індивідуальним досвідом лікаря.
. Набір еволюційних
принципів діагностики та лікування, стратегій і тактик у фармакотерапії.
. Нову парадигму
клінічної медицини, яка відрізняється від колишньої меншим впливом
суб’єктивного фактора на вибір критеріїв діагностики й терапії, що потребує від
лікаря критичної оцінки поглядів різних експертів і результатів клінічних
досліджень з метою оптимізації фармакотерапії.
. Інформаційну
технологію вибору оптимальних варіантів медичної діяльності, узагальнення
набутого досвіду в медицині, впорядкування системи збору, збереження, обробки,
аналізу й подання наукової медичної інформації.
. Нову програму
клінічної медицини з використанням в інтересах хворого достовірної медичної
інформації, що містить сучасні критерії діагностики та терапії з урахуванням
застосованих статистичних методів обробки результатів узагальнених досліджень
не тільки певного клінічного випадку, але й захворюваності в популяції.
. Використання досягнень
медичної науки, збір, інтерпретацію та інтеграцію отриманих результатів
клінічних досліджень із сучасною технологією пошуку, узагальнення і
застосування медичної (статистично обробленої) інформації з метою більш
широкого впровадження науково обґрунтованих методів дослідження в медичну
практику.
Застосування принципів
ЕВМ у практичній діяльності зумовлене непередбаченою клінічною ефективністю не
тільки нових медикаментів, а й препаратів, що використовуються тривалий час,
але не піддавалися ретельній перевірці через складність методичних підходів.
Незважаючи на сучасний
високий рівень фахової обізнаності лікарів, жоден клініцист не має достатнього
досвіду, який дозволяв би йому вільно орієнтуватися в усьому розмаїтті
клінічних ситуацій і призначенні необхідних медикаментів при певному
захворюванні та варіантах його перебігу. Покладатися ж на думки фахівців,
авторитетні керівництва і довідники не завжди надійно через так званий ефект
запізнювання, зумовлений тим, що перспективні методи впроваджуються у практику
дуже повільно і досвід експертів накопичується через досить тривалий час (5-10
років) після доведення їхньої ефективності. Дані в підручниках, керівництвах і довідниках
застарівають ще до їх публікації, а вік досвідченого лікаря-консультанта
(точніше, час після закінчення ним навчання) негативно корелює з прогнозом
захворювань, з приводу яких він призначає лікування або здійснює консультацію.
Характерно, що ці висновки були отримані за допомогою основного статистичного
інструмента ЕВМ - метааналізу.
Вимагати від
практикуючого лікаря, щоб він сам шукав, оцінював і узагальнював необхідну
інформацію про результати досліджень щодо ефективності фармакотерапії, котра міститься
у 2 млн статтях, які публікують щорічно в понад 40 тис. біомедичних часописів,
неможливо. Вирішення проблеми полягає в залученні експертів, що узагальнюють
результати клінічних спостережень у вигляді рекомендацій, систематизованих
оглядів і реферативних аналітичних видань з актуальних проблем медицини. Саме
такі функції беруть на себе центри ЕВМ.
Технологічний процес
створення нормативних стандартів для оцінки отриманих результатів ефективності
лікування хворих включає підготовку протоколу дослідження і отримання
об’єктивної інформації з проблеми ЕВМ. Клінічні випробування мають бути науково
обґрунтованими, чітко визначеними й деталізованими. Їх проводять згідно з
установленим протоколом дослідження, заздалегідь схваленим незалежними
рецензійною радою і етичним комітетом. Велике значення має те, на яких
клінічних базах проведено дослідження, а також методологія пошуку: ключові
слова або словосполучення, автори, джерела баз Інтернету (MedLine, Cochrane
Library, Adonis тощо). Однак навіть при найретельнішому і найбільш
кваліфікованому пошуку необхідну інформацію щодо проведених клінічних
випробувань не завжди вдається віднайти (наприклад, через неякісне індексування
або небажання компаній-спонсорів публікувати негативні результати). У такому
разі комп’ютерний відбір потрібно доповнювати ручним пошуком даних, відсутніх в
електронних базах, аналізом бібліографічних посилань у вже знайдених джерелах,
запитами до фірм-виробників і т. п.
Узагальненню результатів
передує етап ретельної «фільтрації» відібраних за формальними ознаками
публікацій, більшість з яких виявляються непридатними для подальшого аналізу
через недостатність висвітлення проблеми та неповноту осмислення отриманих
результатів або неможливість зіставлення чи порівняння очікуваних параметрів, тобто
виявляються якісні розходження кінцевих результатів. Результати узагальненої
інформації з використанням статистичного підходу («фільтрації» інформаційного
пошуку) дозволяють визначати доцільність чи шкідливість фармакотерапевтичних
заходів при певній патології та відмовитися від малоефективних, а часом і
шкідливих методів надання медикаментозної допомоги. Так, наприклад, з 1854
знайдених і ретельно розглянутих публікацій за 1966-1996 рр. щодо використання
теофіліну при гострих нападах астми в дітей і підлітків тільки 6 статей
методологічно відповідали необхідним вимогам. Проте їх виявилося достатньо для
клінічної та статистичної значущості твердження, що застосування теофіліну в
цій ситуації радше шкідливе, ніж корисне.
Для стандартного
представлення інформації необхідно надати структурований реферат, що включає в
себе:
Ø мету дослідження;
Ø тип випробування;
Ø характеристику клінічної бази;
Ø опис хворих;
Ø види лікування;
Ø критерії оцінки клінічних випадків;
Ø основні результати (переважно у вигляді таблиць);
Ø висновки
Необхідність
стандартизації цього етапу випливає із загальновідомої істини «усе пізнається в
порівнянні», яке краще проводити «за інших рівних умов». З рефератів формується
систематизований огляд із певної проблеми, що і є основною продукцією центру
ЕВМ, яка допомагає у прийнятті конкретних клінічних рішень.
Кількісне узагальнення
одержаних у цифровому або графічному вигляді результатів проводять за допомогою
створеного для ЕВМ статистичного підходу - метааналізу, що являє собою методологію
об’єднання різнорідних і виконаних різними науковцями досліджень з однієї
проблеми і призначений для підвищення достовірності оцінок однойменних
результатів. Ідея метааналізу проста: при збільшенні кількості даних
звужуються довірчі інтервали та зростає достовірність розходжень, що забезпечує
більшу надійність при прийнятті клінічного рішення в конкретній ситуації. При
цьому надто важливо, щоб кількісні дані були статистично однорідні, для чого
метааналіз має у своєму розпорядженні відповідні критерії перевірки. Існує
кілька різновидів метааналізу: звичайний, кумулятивний (нагромадження в часі,
що демонструє крива накопичення оцінок у процесі появи нових доказів),
проспективний (клінічні дослідження визначені певним планом проведення з
позитивним чи негативним результатом), для індивідуальних даних і деякі інші,
призначені для різних типів клінічних випробувань.
Клінічна епідеміологія
розробляє наукові основи лікарської практики - правила прийняття практичних
рішень на основі головного постулату: кожне клінічне рішення базується на
чітко доведених наукових фактах. На відміну від фундаментальних
медико-біологічних наук, клінічну медицину цікавлять дослідження тільки на
живих людях, а не на піддослідних тваринах, культурах тканин чи клітинних
мембранах. Клінічне дослідження не є чистим експериментом, оскільки об’єктом
вивчення виступає пацієнт, вільний у визначенні своїх учинків, а
експериментатор - це лікар з особистим професійним досвідом, переконаннями та
подеколи помилковими судженнями. Тому в клінічних дослідженнях завжди закладена
небезпека помилок (упередженості), уникнути яких можна дотримуючися чітких
наукових принципів. Рандомізовані контрольовані клінічні дослідження повною
мірою відповідають науковим принципам.
При рандомізованому
дослідженні обов’язково передбачається наявність експериментальної
(досліджуваної) та контрольної груп. Хворих розподіляють за групами випадковим
чином (рандомізація), стежачи при цьому, аби групи не розрізнялися за
параметрами, що впливають на результат лікування. Лікар-дослідник, а тим паче
сам пацієнт не знає, одержує хворий плацебо чи ліки (подвійний сліпий метод).
За всіма хворими спостерігають протягом певного, часто досить тривалого
відрізка часу (проспективне дослідження), після закінчення якого порівнюють
частоту виникнення клінічно важливих кінцевих точок, таких як одужання, смерть
чи ускладнення, в експериментальній або контрольній групах. У багатьох випадках
для проведення подібних випробувань залучаються тисячі й десятки тисяч хворих у
різних наукових центрах і країнах. Це і є мультицентровими дослідженнями.
Відповідно до сучасних
стандартів, жоден новий метод лікування, профілактики або діагностики не може
бути визнаний без обов’язкової ретельної перевірки в ході рандомізованих
контрольованих досліджень. Новими є науково обґрунтовані підходи до пошуку
джерел інформації та її критичного осмислення. Поширення інформаційних
технологій - електронних баз даних і надрукованих статей у часописах,
мультимедійних навчальних програм на компакт-дисках і в Інтернеті дає можливість
лікарям отримувати найсучаснішу оперативну інформацію. Відповідно виникає
необхідність визначити можливості таких технологій і з’ясувати їхнє місце, роль
і взаємозв’язок із традиційними друкованими виданнями. Науково обґрунтована
медична практика і клінічна епідеміологія навчають лікаря мистецтву критичного
аналізу інформації та вмінню співвідносити результати дослідження з конкретною
клінічною ситуацією. Для сучасного лікаря навички критичної оцінки настільки ж
важливі й необхідні, як, наприклад, уміння аускультувати хворого. Багато
провідних медичних університетів прийшли до усвідомлення, що клінічна
епідеміологія має бути введена до обов’язкового навчального курсу як одна з
фундаментальних дисциплін. Приміром, Британська королівська колегія лікарів
загальної практики включила до програми іспиту розділ з критичної оцінки
наукової публікації. Медичне навчання, що ґрунтується на розумінні деталей
патологічного процесу в конкретного хворого, пропонує об’єктивні дані щодо
ефективності та сутності терапії. Отже, знаючи механізми захворювання, можна
передбачити його перебіг і обрати найефективніше лікування.
Однак клінічні прогнози,
засновані на знанні патології, - це лише гіпотези, які повинні витримати
перевірку в ході клінічних досліджень. Річ у тім, що механізми розвитку хвороб
зрозумілі тільки частково і на результат впливає багато інших факторів
(генетичних, екологічних, соціальних). Численні приклади переконують у тому, що
чинники, які теоретично повинні забезпечувати лікувальний ефект, насправді не спрацьовують.
Наприклад, добре відомо, що пацієнти, які перенесли інфаркт міокарда, нерідко
раптово помирають. Механізм раптової смерті при цьому теж відомий - шлуночкові
порушення ритму серця. Логічним виглядає припущення, що усунувши або зменшивши
шлуночкові аритмії за допомогою антиаритмічних засобів, можна знизити ризик
раптової смерті. Багато лікарів, дотримуючися подібної логіки й анітрохи не
сумніваючись у користі цього лікування, призначали таким пацієнтам
антиаритмічну терапію. Так тривало доти, доки рандомізоване контрольоване
дослідження CAST не показало, що антиаритмічні препарати не тільки не знижують
ризик раптової смерті, але, навпаки, збільшують його.
Клінічна епідеміологія
розробила критерії оцінки наукового рівня публікацій. Наукові дослідження можна
розподілити на дві категорії: одні проводяться для висування гіпотез, інші -
для їхньої перевірки. Для перевірки гіпотез більш доцільні рандомізовані
контрольовані дослідження. Інші необхідні насамперед для висування гіпотез, і
саме з цих позицій варто ставитися до їхніх результатів. Це не означає
неповноцінності одних досліджень порівняно з іншими, вони просто слугують
різним цілям. Нормальний розвиток наукового процесу припускає спочатку
висування, а потім перевірку гіпотези. Важливо вміти відрізняти пілотне
дослідження, що висуває гіпотези, від дослідження, яке претендує на остаточне
вирішення проблеми. Часом автори схильні переоцінювати результати своєї роботи,
тому справою читача є оцінити ступінь її наукової доказовості, вирішити, чи
відповідає дизайн дослідження поставленим завданням (так звана внутрішня
обґрунтованість).
Припустімо, що отримані
в дослідженнях експериментальні результати містять велике число змінних, які за
своїми характеристиками ніяк не пов’язані між собою. Якщо такі дані чисто
механічно піддати обробці для виявлення взаємозв’язку між змінними, то за
теорією ймовірності кожна двадцята кореляція виявиться статистично достовірною
з рівнем статистичної значущості р<0,05! Дуже часто в наукових статтях
зустрічається поєднання випадково виявлених взаємозв’язків з упередженим
поданням тільки «цікавих» фактів. Для уникнення випадкових взаємозв’язків
досліджувані параметри, індекси або ознаки, які формулюються в ході аналізу
даних однієї групи пацієнтів, необхідно обов’язково перевіряти на іншій групі.
На сучасному етапі розвитку експериментальної медицини науковці не надають
суттєвого значення результатам чи індексам, що отримані та перевірені на одній
і тій самій групі хворих або не перевірені зовсім.
Не менш важливим
завданням при критичній оцінці публікації є визначення, якою мірою її
результати можна поширити на конкретну клінічну ситуацію (так звана зовнішня
обґрунтованість, або узагальненість дослідження). Лікарі схильні до розширеного
трактування результатів публікацій. Не завжди правомірно переносити на людину
результати, одержані на експериментальних тваринах, а результати обстеження
вузько обмеженої групи хворих - на загал пацієнтів, які відрізняються за віком
або ступенем тяжкості захворювання, або ж поширювати дані про ефективність
конкретного препарату на всю лікарську групу. Наприклад, твердження типу
«гіпохолестеринемічні препарати знижують смертність» експериментально
обґрунтоване дослідженнями, але безглузде з погляду клінічної практики, тому що
доведене тільки для певних категорій хворих на атеросклероз і невеликої групи
препаратів (статинів, фібратів, сорбентів).
Отже, традиційно в
процесі прийняття клінічних рішень лікар висуває власну інтерпретацію
механізмів захворювання й керується особистим досвідом. Часто виникають
ситуації, коли ні знань, ні досвіду не вистачає, тоді лікар вдається до
допомоги досвідченіших колег або експертів у цьому питанні чи звертається до
медичної літератури.
4. Методологічні засади
Оцінка рівня доказовості
є основним робочим інструментом ДМ (рис. 5). Тому найважливішим механізмом,
який дає змогу лікарю орієнтуватися у великій кількості публікацій медичних
даних, є рейтингова система оцінки наукових досліджень. _ротее до цього часу
відсутня загальноприйнята шкала оцінки ступеня доказовості. Категорій доказів
дослідження може бути декілька - від 3 до 7. Найменша цифра відповідає
найбільшій доказовості [8]. Зазвичай розрізняють три категорії доказів
дослідження:
· Категорія І -
результати належно розроблених масштабних рандомізованих контрольованих
досліджень, дані мета-аналізів та систематичних оглядів.
· Категорія ІІ -
результати когортних досліджень та досліджень типу «випадок-контроль».
Категорія ІІІ - результати неконтрольованих досліджень та консенсуси
спеціалістів.
Практичні рекомендації
щодо діагностики та лікування можуть ґрунтуватися як на даних досліджень, так і
на їхній екстраполяції. З урахуванням цих обставин рекомендації поділяють на
3-5 рівнів, які прийнято позначати латинськими літерами А, В, С, D, E.
А - докази переконливі: є вагомі дані на користь застосування
певного методу.
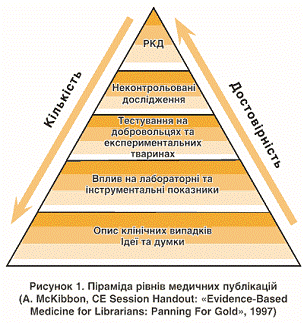
Рис. 5. Піраміда рівнів
медичних публікацій (A. McCibbon, CE Session Handout:» Evidence-Based Medicine
for Librarianse: Panning Por Gold», 1997)
В - відносна переконливість доказів: є достатня кількість даних на
користь того, щоб рекомендувати певне положення.
С - достатніх доказів немає: дані є недостатніми для надання
рекомендації, але вони можуть бути представлені з урахуванням деяких обставин.
D - достатньо негативних доказів: їх вистачає, щоб рекомендувати
відмовитися від використання певного методу в конкретній ситуації.
Е - вагомі негативні докази: вистачає суттєвих доказів, щоб
виключити певний метод із рекомендацій.
Американське Агентство з
політики в галузі охорони здоров’я і наукових досліджень (Agency for Health
Care Policy and Research) запропонувало спрощену шкалу таких рівнів доказів (у
порядку зменшення їхньої вірогідності):
І а - дані мета-аналізу рандомізованого контрольованого дослідження
(РКД);
І b - результати як мінімум одного РКД;
ІІ а - результати добре організованого контрольованого дослідження без
рандомізації;
ІІ b - результати як мінімум одного належно організованого
квазіекспериментального дослідження;
ІІІ - результати неекспериментальних досліджень;
ІV - звіт експертного комітету чи думка та/або клінічний досвід
авторитетних спеціалістів) [9].
Для практикуючих
лікарів, які мають лише елементарні уявлення про клінічну епідеміологію та
статистику, цілком прийнятною може бути оцінка вірогідності доказів із різних
джерел згідно з рекомендаціями Шведської ради з оцінки методології в охороні
здоров’я (Swedish Council on Technology Assessment in Health Care), за якими
вірогідність результатів знижується в такому порядку:
· рандомізоване контрольоване клінічне дослідження;
· нерандомізоване клінічне дослідження з одночасним контролем;
· нерандомізоване клінічне дослідження з історичним контролем;
· когортне дослідження;
· дослідження типу «випадок-контроль»;
· перехресне клінічне дослідження;
· результати спостережень.
Проте зростання
кількості та збільшення якості клінічних досліджень за останні 10 років
відіграють важливу роль у прийнятті практичних рішень у повсякденній клінічній
діяльності. Практикуючому лікарю досить складно розібратись у безперервно
зростаючому інформаційному потоці; суттєву допомогу в цьому йому надають систематизовані
огляди з різних проблем профілактики, діагностики та лікування багатьох
захворювань. Головна перевага огляду - об’єднання інформації з декількох
досліджень, що дає змогу одержати об’єктивне уявлення про клінічний ефект
втручання, яке аналізується порівняно з окремо взятим клінічним дослідженням.
Систематизовані огляди є однією з найбільш важливих складових доказової
медицини [10].
Одним із різновидів
систематизованих оглядів є мета-аналіз. Часто мета-аналіз розглядається як
вищий ступінь доказовості і стає основним у виборі найбільш ефективних
лікувально-профілактичних та діагностичних втручань. Метою мета-аналізу є
оцінка ефективності досліджуваного втручання, а також виявлення і пояснення
неоднорідності або гетерогенності результатів досліджень у підгрупах пацієнтів.
Він повинен представити точкові та інтервальні (95% довірчий інтервал) оцінки
узагальненого ефекту втручання (рис. 6) [11].
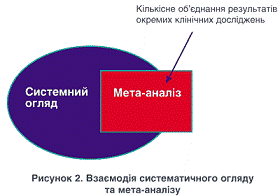
Рис. 6. Система взаємодії Системного
огляду та мета-аналізу
З іншого боку, відомо,
що результати наукових медичних досліджень усе більше впливають не тільки на
розробку нових стандартів та протоколів ведення пацієнтів, але й на
фармацевтичний бізнес. Тому актуальнішою стає проблема аналізу інформації, яку
репрезентують різні медичні видання, представники фармацевтичних компаній та
провідні у своїй галузі спеціалісти.
Висновки
Лікарю необхідно
навчитися самостійно оцінювати вірогідність інформації та відрізняти її від
прихованої реклами. Крім того, йому потрібно зважено підходити до думки
авторитетів та чужого досвіду. Насамперед, джерелами, які можуть бути
використані лікарем для підтримки свого професійного рівня та розв’язання
клінічних проблем, мають бути виключно наукові статті та рекомендації МОЗ.
Перелік використаної
літератури
1. http://uk.wikipedia.org/wiki/Клавдій_Гален
2. Гарвей У.
Анатомические исследования о движении сердца и крови у животных. - М.; Л.,
1948.
. Мирський
М.Б. Хірургія від давнини до сучасності (Нариси історії). - М., 2000
. http://vnauke.by/schkola/Osnovy-dokazatelnoj-mediciny-Biomedicinskaja-statistika/Istoriya-vozniknoveniya-dokazatelnoj-mediciny-35
. Begg C.,
Cho M., Eastwood S. et al. // JAMA. - 1996. - V. 276. - P.637-639
. Chalmers
I., Altman DG Systematic reviews. - London: BMJ Publishing Group, 1995.
. Бащинский
С.Е. // Междунар. журнал мед. практики. - 2005. - №1. - С. 32-3
. http://rpht.com.ua/article/1398.html
. DerSimonian
R., Laird N. Meta-analysis in trials. Control Clin Trials 1986; 7: P. 177-188
. Lubsen J.
Mega-trialis: is meta-analysis an alternative? Eur J Clin Pharm 1996; 49; P.
29-33