Разработка проекта МВИ 'Определение содержания фосфора в растительных маслах спектрофотометрическим методом'
Учреждение
образования «БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ»
Факультет
ТОВ
Кафедра
физико-химических методов сертификации продукции
Специальность
1-54 01 03 «Физико-химические методы и приборы контроля качества продукции»
Специализация
1-54 01 03 02 «Сертификация продовольственных товаров»
Курсовая
работа
по
дисциплине «Методы контроля»
Тема
«Разработка проекта МВИ «Определение содержания фосфора в растительных маслах
спектрофотометрическим методом»»
Исполнитель
студентка 4 курса
группы 14
Палёха Н. В.
Руководитель
Гудинская О. В.
Минск
2011
Реферат
спектрофотометрический
фосфор продукт масло
Пояснительная записка 37 с., 24 источника, 1
прил.
МЕТОД, КОНТРОЛЬ, АНАЛИЗ, ФОСФОР, РАСТИТЕЛЬНЫЕ
МАСЛА, СПЕКТРОФОТОМЕТРИЯ, ОПРЕДЕЛЕНИЕ, ПРОЕКТ МВИ, КАЧЕСТВО
Целью выполнения курсового проекта является
разработка проекта МВИ для определения фосфора в растительных маслах
спектрофотометрическим методом.
Проведен аналитический обзор ТНПА и различных
литературных источников по определению содержания фосфора в растительных
маслах, дано обоснование необходимости контроля содержания фосфора в пищевых
продуктах и выбран метод анализа - спектрофотометрический анализ, оптимальный
для контроля заданного параметра, проанализированы методы, которые могут быть
использованы для определения фосфора, рассмотрены теоретические основы
спектрофотометрического метода определения.
В результате разработана методика контроля
содержания фосфора в растительных маслах.
Содержание
Введение
1.
Аналитический обзор литературы
.1
Характеристика фосфора
.2
Методы определения фосфора
.3
Характеристика спектрофотометрического метода определения
.
Разработка проекта МВИ
Заключение
Список
использованных источников
Список
использованных ТНПА
Приложение
А
Введение
Методика выполнения измерений представляет собой
установленную совокупность операций и правил (технологический процесс)
проведения измерений. В данной работе будет осуществлена разработка проекта МВИ
для определения фосфора в растительных маслах спектрофотометрическим методом.
Фосфор в больших количествах присутствует во
многих пищевых продуктах. Наибольшее его количество человек получает из
молочных продуктов, сыра, яиц и яичных продуктов, мяса и рыбы, икры. А также
фосфор содержится в растительной пище: в фасоли, горохе, овсяной, перловой и
ячневой крупах, ягодах, орехах, петрушке, капусте, моркови, чесноке, шпинате.
Он является вторым, после кальция, наиболее
распространенным в организме минералом. Значение фосфора для организма человека
огромно. Он оказывает на него преимущественно кислотное действие, принимает
участие в обмене белков, жиров и углеводов, построении клеточных элементов,
костной ткани, ряда ферментов, гормонов и многих других органических соединений
(фосфопротеиды, фосфолипиды, фосфорные эфиры углеводов, фосфокреатин,
адениловая кислота, фосфотиамин, фосфопиридоксаль и др.). Лабильные фосфатные
связи выполняют роль аккумуляторов энергии (накопители энергии). Они регулируют
жизнеобеспечение организма, активизируют умственную и физическую деятельность
человека. Фосфор находится в биосредах в виде фосфат-иона, который входит в
состав неорганических компонентов и органических биомолекул, присутствует во
всех тканях, входит в состав нуклеиновых кислот, нуклеотидов, фосфолипидов.
Фосфор так или иначе, участвует практически во всех процессах жизнедеятельности
организма, но наибольшее значение он имеет для нервной ткани и деятельности
печени и почек. Фосфор укрепляет зубы, в значительном количестве содержится в
зубной ткани в составе фторфосфата кальция и придает ей прочность. Его
соединения являются самыми распространенными в организме компонентами, активно
участвующими во всех обменных процессах. Многие соединения фосфора с белком,
жирными и другим кислотами образуют комплексные соединения, отличающиеся высокой
биологической активностью. K ним относятся нуклеопротеиды клеточных ядер,
фосфопротеиды (казеин), фосфатиды (лецитин) и др.
Фосфор входит в состав нуклеиновых кислот,
которые принимают участие в процессах роста, деления клеток, хранения и
использования генетической информации, регулирует кислотно-щелочное равновесие.
Соединения фосфора (фосфаты) являются компонентом буферной системы крови и
других биологических жидкостей организма, играют важную роль в поддержании
кислотно-щелочного баланса.
Фосфор активизирует ферментные реакции. Он
участвует в реакциях фосфорилирования витаминов, что приводит к образованию их
активных форм.
Даже незначительная нехватка фосфора в организме
может привести к остеопорозу костных тканей, заметному снижению интеллектуальных
данных и общей работоспособности. Это будет проявляться в потере
кратковременной памяти, частых проявлениях слабости, сонливости и головных
болях. У человека с дефицитом макроэлемента фосфора может пропасть интерес к
жизни, к новым знаниям. Если вовремя не восполнить его запас в организме,
симптомы станут еще более тревожными: появятся боли в костях, человек станет
уставать даже после незначительных нагрузок, затем появится тревожность и
необоснованная раздражительность. Также могут быть перебои в дыхании,
периодическое онемение и дрожание конечностей.
Избыток фосфора связан с количеством кальция,
попадающего в организм с пищей. Если соотношение кальция к фосфору 1:1,5, тогда
эти вещества создают необходимые для жизнедеятельности человека нерастворимые соединения,
способствующие нормальному протеканию процессов в организме. При нарушении
такого соотношения фосфор начинает накапливаться и не выводится из тканей и
костей, что приводит к нарушению работы почек, нервной системы и костных
тканей. Одновременно тормозится всасывание кальция, замедляется образование
витамина D, нарушаются функции паращитовидных желез.
В почках могут образоваться камни, также
появится угроза железодефицитной анемии и заболеваний сосудов.
Поэтому необходимо следить за содержанием фосфора
в различных продуктах питания. Для этого могут быть использованы различные
методы, самым распространенным и наиболее часто применяемым из которых является
спектрофотометрический.
Создание методик количественного химического
анализа продуктов питания, содержащих фосфор, для человека является актуальным
и имеет большую практическую значимость.
Цель работы - разработка проекта МВИ для
определения фосфора. Для достижения поставленной цели необходимо решить
следующие задачи:
рассмотреть значение фосфора для организма
человека;
сделать аналитический обзор ТНПА и литературных
источников по методам определения содержания фосфора в продуктах питания,
определить наиболее рациональный метод анализа,
аргументировать свой выбор путем сравнения выделенного метода со всей
совокупностью методов определения,
описать основы выбранного метода.
1.
Аналитический обзор литературы
1.1 Характеристика фосфора
Фосфор в больших количествах присутствует во
многих пищевых продуктах. Наибольшее его количество человек получает из
молочных продуктов, творога, сыра, яиц и яичных продуктов, мяса и рыбы, икры,
говяжьей печени. А также фосфор содержится в растительной пище: в фасоли,
горохе, овсяной, перловой и ячневой крупах, ягодах, орехах, петрушке, капусте,
моркови, чесноке, шпинате [1].
Фосфор усваивается из продуктов растительного
происхождения на 55-60 %, из животных - на 95 %. Усвоение происходит легче и
полнее, если соотношение фосфора с кальцием составляет 1,5:1. Избыток богатой
им пищи приводит к вымыванию кальция из костей, а при избытке последнего
развивается мочекаменная болезнь.
Кальций и фосфор тесно связаны в организме и
уравновешивают друг друга при осуществлении многих функций. Этот баланс
частично регулируется гормонами, в частности, гормон околощитовидной железы уменьшает
вторичную абсорбцию фосфата почками.
Для правильного функционирования фосфора также
важно достаточное количество витамина D в организме. Переизбыток железа,
алюминия и магния делает влияние фосфора неэффективным.
Усвояемость этого макроэлемента также связана с
содержанием белка в пищевом рационе и другими сопутствующими факторами.
Некоторые соединения фосфора плохо всасываются. Это прежде всего фитиновая
кислота, которая в виде фитиновых соединений содержится в злаках.
Однако недостаточно знать и употреблять в пищу
продукты, содержащие фосфор. Важно понимать, что он усваивается лишь в
правильном сочетании с кальцием, поэтому следует выбирать продукты с таким
необходимым сочетанием, или комбинировать их таким образом, чтобы получались
правильные сочетания фосфора и кальция в разных продуктах.
Забегая вперед, скажем, что наиболее оптимальное
сочетание этих веществ содержится в жирном твороге и фундуке, приемлемое - в
свекле, капусте, моркови. Самое большое содержание фосфора - в икре осетровых,
говяжьей печени, грецких орехах, фасоли, овсяной, пшенной и гречневой крупах.
Продукты, в которых кальций с фосфором находятся
в наименее подходящих сочетаниях: пшено, гречка, свинина, картофель, томаты,
яблоки. Для соблюдения баланса в питании их нужно употреблять с продуктами с
высоким содержанием кальция.
Большая часть потребляемого с пищей фосфора
всасывается в проксимальном отделе тонкого кишечника. Всасывание, распределение
и выведение его в организме в значительной мере связано с кальциевым обменом.
Содержание фосфора в теле взрослого человека
около 1% (примерно 700 г на 70 кг массы тела). Суточная потребность человека в
макроэлементе составляет 1,3 г. При больших энергозатратах (тяжелый физический
труд, большая мышечная нагрузка у спортсменов и т. д.) или при недостаточном
поступлении белка с пищей потребность в фосфоре возрастает в 1,5-2 раза.
Беременные и кормящие грудью женщины нуждаются в увеличении его суточного
количества до 1,5 г.
В организме основное количество фосфора
содержится в костях (около 85%), много его в мышцах и нервной ткани. Вместе с
кальцием, фтором и хлором он формирует зубную эмаль. Фосфор укрепляет зубы, в
значительном количестве содержится в зубной ткани в составе фторфосфата кальция
и придает ей прочность. Поэтому правильный баланс кальция и фосфора в организме
человека предохраняет от кариеса. Совместно с кальцием он является основой
костной ткани, участвует в распаде углеводов [2].
Значение фосфора для организма человека огромно.
Он находится в биосредах в виде фосфат-иона, который входит в состав
неорганических компонентов и органических биомолекул. Фосфор присутствует во
всех тканях, входит в состав белков, нуклеиновых кислот, нуклеотидов,
фосфолипидов. Соединения фосфора АДФ и АТФ являются универсальным источником
энергии для всех живых клеток. Они регулируют жизнеобеспечение организма,
активизируют умственную и физическую деятельность человека. Значительная часть
энергии, образующаяся при распаде углеводов и других соединений, аккумулируется
в богатых энергией органических соединениях фосфорной кислоты. Фосфор
способствует усвоению некоторых питательных веществ, в частности, глюкозы. Он
взаимодействует со многими ферментами и активизирует действие витаминов группы
B и витамина D.
Растворимые соли фосфорной кислоты формируют
фосфатную буферную систему, ответственную за постоянство кислотно-щелочного
равновесия внутриклеточной жидкости. Труднорастворимые (кальциевые) соли
фосфорной кислоты составляют минеральную основу костной и зубной ткани. Фосфор
играет важную роль в деятельности головного мозга, сердца, мышечной ткани [3].
Фосфор оказывает преимущественно кислотное
действие на организм, принимает участие в обмене белков, жиров и углеводов,
построении клеточных элементов, костной ткани, ряда ферментов, гормонов и
многих других органических соединений (фосфопротеиды, фосфолипиды, фосфорные
эфиры углеводов, фосфокреатин, адениловая кислота, фосфотиамин,
фосфопиридоксаль и др.). Он играет важную роль в обменных процессах,
протекающих в мембранных внутриклеточных системах и мышцах (в том числе в
сердечной).
Многие соединения фосфора с белком, жирными и
другим кислотами образуют комплексные соединения, отличающиеся высокой
биологической активностью. K ним относятся нуклеопротеиды клеточных ядер,
фосфопротеиды (казеин), фосфатиды (лецитин) и др.
Кроме влияния на рост костей и зубов, фосфор
помогает правильному росту клеток и нормальной работе сердца и почек. Кроме
этого, он участвует в процессе усвоения витаминов и преобразования пищи в
жизненную энергию.
Можно сказать, что практически все процессы
жизнедеятельности человека связаны с содержанием фосфора в организме, так как
его соединения снабжают организм энергией, использующейся в мышечных
сокращениях, проявлениях нервных импульсов, биосинтезе других органических
веществ, а также в поступлении веществ и их соединений в клетки. Таким образом,
фосфор участвует во всех обменных процессах организма, а это означает, что
обойтись без него просто невозможно [2].
Соединения фосфора присутствуют в каждой
клеточке тела и участвует практически во всех физиологических химических
реакциях. Он входит в состав нуклеиновых кислот, которые принимают участие в
процессах роста, деления клеток, хранения и использования генетической
информации. Фосфор также участвует в передаче нервных импульсов, помогает обмену
жиров и крахмалов [4].
Фосфор - обязательный компонент содержащихся в
крови и клетках липидов, которые поддерживают питательные вещества в жидком
состоянии для их свободного продвижения через клеточные мембраны.
Фосфор активизирует ферментные реакции. Он
участвует в реакциях фосфорилирования витаминов, что приводит к образованию их
активных форм.
Содержание фосфора и фосфатов определяют в
крови, моче, проводят изучение активности паратгормона. Об избытке фосфора в
организме судят по гипертрофии паращитовидных желез, образованию камней в
органах мочевыводящей системы, кальцификатов в мягких тканях, а также по
развитию остеомаляции и остеопороза.
Интоксикация соединениями фосфора сопровождаются
нарушениями функции печени и почек, сердечно-сосудистой системы,
желудочно-кишечного тракта, расстройствами деятельности других органов и
систем; развиваются гипохромная анемия, появляются многочисленные геморрагии.
При избыточном поступлении фосфора в организм может повышаться уровень
выведения кальция, что создает риск быстрого развития остеопороза. Повышение
его уровня в волосах часто указывает на его усиленное выведение из организма и
может наблюдаться при нарушениях соотношения Са/Р.
Причинами избытка фосфора в организме человека
являются следующие:
избыточное поступление фосфора ("белковый
перекорм");
избыточное употребление консервированных
продуктов, лимонадов;
длительный контакт с фосфорорганическими
соединениями;
нарушение регуляции обмена.
Основные проявления избытка фосфора:
отложение в тканях малорастворимых фосфатов;
почечно-каменная болезнь;
поражение печени, желудочно-кишечного тракта;
развитие анемии, лейкопении;
кровотечения, кровоизлияния;
декальцинация костной ткани.
Летальная доза фосфора для человека составляет
60 мг Р4.
Недостаток фосфора в организме, прежде всего,
ассоциируется с астеническим состоянием, слабостью, недомоганием. В целом же
для людей с дисбалансом фосфора характерна повышенная интеллектуальная
активность, которая обычно быстро сменяется нервным истощением. Как правило, у
таких людей за всплесками эмоциональной реакции на окружающее наступают апатия
и депрессия [3].
Даже незначительная нехватка фосфора в организме
может привести к остеопорозу костных тканей, заметному снижению
интеллектуальных данных и общей работоспособности. Это будет проявляться в
потере кратковременной памяти, частых проявлениях слабости, сонливости и
головных болях. У человека с дефицитом макроэлемента фосфора может пропасть
интерес к жизни, к новым знаниям. Если вовремя не восполнить его запас в
организме, симптомы станут еще более тревожными: появятся боли в костях,
человек станет уставать даже после незначительных нагрузок, затем появится
тревожность и необоснованная раздражительность. Также могут быть перебои в
дыхании, периодическое онемение и дрожание конечностей [2].
Причины дефицита фосфора:
нарушение регуляции обмена;
недостаточное поступление в организм (низкое
потребление белка);
повышенное поступление в организм соединений
кальция, алюминия, магния, бария;
избыточное потребление искусственных напитков
(лимонады и пр.);
длительные хронические заболевания;
интоксикации, наркозависимости, алкоголизм;
заболевания щитовидной железы;
болезни околощитовидных желез;
заболевания почек;
искусственное вскармливание грудных детей.
Основные проявления дефицита фосфора:
повышенная утомляемость, снижение внимания,
слабость, истощение;
боли в мышцах;
снижение сопротивляемости к инфекциям к
простудным заболеваниям;
недостаточность белоксинтезирующей функции
печени;
дистрофические изменения в миокарде;
кровоизлияния на коже и слизистых оболочках;
остеопороз;
иммунодефицитные состояния [3].
Недостаток фосфора необходимо регулярно
восполнять, употребляя в пищу содержащие фосфор продукты.
Значительное снижение уровня фосфора в крови -
гипофосфатемия - симптом следующих заболеваний:
недостаток гормона роста
дефицит витамина D (рахит)
пародонтоз
нарушение всасывания фосфора, тяжелый понос,
рвота
гиперкальциемия
повышенная функция паращитовидных желез
(гиперпаратиреоз)
подагра
гиперинсулинемия (при лечении сахарного диабета)
[4].
Восполнение дефицита фосфора в организме
происходит путем увеличения потребления богатых фосфором пищевых продуктов,
БАДП и лекарственных препаратов (АТФ, рибоксин, фосфоколин, глицерофосфаты,
фитин и др.).
Таким образом, фосфор играет важную роль в
биологических процессах, протекающих в организме. Необходимо контролировать
поступление этого микроэлемента, так как переизбыток или недостаток его может
привести к тяжелым последствиям, связанным с самыми различными заболеваниями,
поэтому для анализа и был выбран данный элемент. Для определения содержания
фосфора в продуктах питания можно воспользоваться методами, предложенными в
следующем подразделе.
1.2 Методы определения фосфора
Для определения фосфора в продуктах питания
могут быть использованы следующие методы:
) титриметрический метод (содержание фосфора
составляет от 0, 3 до 1,2 %). Данный метод основан на осаждении фосфора в виде
фосфоромолибдата аммония, растворении осадка в титрованном растворе щелочи и титровании
избытка ее раствором кислоты.
Для проведения анализа навеску сплава массой 1 г
помещают в коническую колбу вместимостью 250 см3, добавляют 20 см3 смеси кислот
накрывают часовым стеклом и растворяют при нагревании. Стекло ополаскивают
концентрированной соляной кислотой, раствор упаривают до объема 2-3 см3,
добавляют 10 см3 бромистоводородной кислоты и выпаривают досуха. В колбу
добавляют 10 см3 концентрированной соляной кислоты и вновь выпаривают досуха.
Выпаривание с концентрированной кислотой повторяют 3-4 раза для полного
удаления олова. К сухому остатку добавляют 10 см3 соляной кислоты, разбавленной
1:1, добавляют 80-100 см3 воды и нагревают до 60-70 °C для растворения солей.
Добавляют раствор марганцовокислого калия для выпадения осадка двуокиси
марганца, приливают по каплям раствор азотистокислого осадка до исчезновения
осадка двуокиси марганца. Затем добавляют 10 г азотнокислого аммония и 30 см3
молибдатного реагента, хорошо перемешивают 3-5 мин до выпадения желтого
фосфоромолибдата и оставляют стоять на ночь.
Осадок отфильтровывают на полный фильтр с
фильтробумажной массой. Стакан и осадок на фильтре промывают раствором
азотнокислого калия до исчезновения кислой реакции (проба по индикаторной
бумаге) или поступают следующим образом: в пробирку помещают 1-2 см3 фильтрата,
2-3 капли раствора фенолфталеина и каплю раствора гидроокиси натрия. Розовая
окраска свидетельствует о полноте промывания осадка.
Промытый осадок переносят в колбу, в которой
проводилось осаждение, растворяют в 0,1 моль/дм3 растворе гидроокиси натрия,
размельчают фильтр перемешиванием, добавляют 3-5 капель раствора фенолфталеина
и оттитровывают избыток гидроокиси натрия 0,1 моль/дм3 раствором соляной
кислоты до обесцвечивания раствора.
Расхождения результатов параллельных определений
(сходимость) не должны превышать 0,05 %.
Расхождения результатов анализа, полученных в
двух различных лабораториях, или двух результатов анализа, полученных в одной
лаборатории, но при различных условиях (воспроизводимость), не должны превышать
0,07 %.
) фотометрический метод определения фосфора (от
0,01 до 0,5 %).
В настоящее время в промышленной практике
наибольшее применение получили фотометрические методы определения массовой доли
фосфолипидов в растительных маслах, отличающиеся подготовкой и минерализацией
пробы масла, типами применяемых окислителей и восстановителей. Известен способ
определения массовой доли фосфора в растительных маслах, основанный на сухом
сжигании масла с окисью магния и последующем определении фосфора
фотометрическим методом с использованием молибденовокислого натрия или аммония.
Недостатком указанного способа является обязательная минерализация пробы путем
сухого сжигания в муфельной печи при температуре 800oC в течение 0,3-1,0 ч.
Данный метод основан на образовании желтого фосфорнованадиевомолибденового
комплекса и фотометрическом измерении оптической плотности этого комплекса
относительно раствора сравнения, содержащего известное количество фосфора при
длине волны от 430 до 450 нм.
Для проведения анализа используется фотоэлектроколориметр
типа КФК и ФЭК-56М (светофильтр №4), спектрофотометр типа СФ-26 или аналогичные
приборы, обеспечивающие необходимую точность измерения, с кюветами и толщиной
поглощающего свет слоя раствора 10 мм. Для подготовки пробы к испытаниям
навеску продукта массой 1 г при массовой доле фосфора от 0,005 до 0,1% помещают
в стакан вместимостью 250-300 см3, добавляют 20 см3 смеси кислот для
растворения, стакан накрывают часовым стеклом и растворяют сначала на холоду, а
затем при нагревании до полного растворения пробы. К раствору приливают 1 см3
перекиси водорода, нагревают до кипения и кипятят 3 мин до удаления окислов
азота (не следует допускать бурного и длительного кипения раствора).
Стенки стакана и стекло ополаскивают водой,
приливают 10 см3 раствора ванадиевокислого аммония, 10 см3 раствора
молибденовокислого аммония, хорошо перемешивают, охлаждают и переводят раствор
в мерную колбу вместимостью 50 см3, доливают до метки водой и перемешивают.
Оптическую плотность раствора измеряют на
фотоэлектроколориметре с синим светофильтром в кювете с толщиной поглощающего
слоя 3 см или на спектрофотометре в кювете поглощающего слоя 1 см при длине
волны 440 нм.
В качестве раствора сравнения используют раствор
того же образца, только без добавления ванадиевокислого аммония и
молибденовокислого аммония.
Расхождения результатов параллельных определений
(сходимость) не должны превышать 0,02 %.
Расхождения результатов анализа, полученных в
двух различных лабораториях, или двух результатов анализа, полученных в одной
лаборатории, но при различных условиях (воспроизводимость), не должны превышать
0,03 %.
) весовой магнезиальный метод определения
фосфора.
Данный метод основан на определении массы осадка
пирофосфата магния, полученного из прокаленного магнийаммонийфосфата, образованного
при осаждении фосфат-иона.
Для проведения анализа 100 см3 раствора помещают
в стакан вместимостью 400 см3, добавляют 10 см3 раствора соляной кислоты и
кипятят в течение 15-20 мин. Раствор охлаждают, приливают 10 см3 раствора
лимоннокислого аммония и нейтрализуют 10 %-ным раствором аммиака по
фенолфталеину. Затем медленно при непрерывном помешивании палочкой приливают 35
см3 щелочной магнезиальной смеси, а через 10-15 добавляют 20 см3 25 %-ного
раствора аммиака. Содержимое стакана выдерживают 30-40 мин. Отстоявшуюся
жидкость декантируют на фильтр, осадок количественно переносят на фильтр,
смывая его из стакана порциями по 8-10 см3 2,5 %-ного раствора аммиака.
Кристаллы, прилипшие к стенкам и дну стакана, тщательно снимают стеклянной
палочкой с резиновым наконечником. Осадок на фильтре промывают 3-4 раза 2,5
%-ным раствором аммиака.
Фильтр с осадком помещают в предварительно
прокаленный до постоянной массы тигель, высушивают, озоляют при доступе воздуха
при 700-800 °C и прокаливают в печи при 1000-1050 °C до побеления осадка (20-30
мин). Затем тигель с осадком охлаждают в эксикаторе в течение 40-60 мин и
взвешивают.
Одновременно проводят контрольный опыт в тех же
условиях и с тем же количеством реактивов, но без анализируемого раствора.
Обработка результатов
Массовую долю фосфора, растворимого в 0,4 %-ном
растворе соляной кислоты, в пересчете на Р2О5 (Х2) в процентах вычисляют по
формуле:
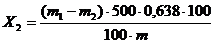 (1)
(1)
где т1 - масса прокаленного осадка
анализируемого раствора, г;
т2 - масса прокаленного осадка
контрольного раствора, г;
т - масса навески анализируемой
пробы, г;
,638 - коэффициент пересчета Mg2P2O3
на Р2О5.
Массовую долю фосфора, растворимого
в 0,4 %-ном растворе соляной кислоты, в пересчете на Р (Х) в процентах
вычисляют по формуле:
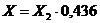 (2)
(2)
где Х2 - массовая доля фосфора,
растворимого в 0,4 %-ном растворе соляной кислоты, в пересчете на Р2О5, %;
,436 - коэффициент пересчета Р2О5 на
Р.
Допускаемые расхождения между двумя
параллельными определениями при доверительной вероятности Р = 0,95 не должны
превышать: 0,3 % (при массовой доле Р2О5 от 25 до 40 %); 0,4 % (при массовой
доле Р2О5 от 40 до 60 %).
) весовой метод определения фосфора
основан на сухом сжигании пробы масла с окисью магния, последующей обработке
смесью азотной и серной кислот, осаждения образующегося осадка с помощью
молибденовокислого аммония и сушке осадка на фильтре до постоянного веса при
температуре 100oC. Указанный метод достаточно трудоемок и длителен (10-12 ч).
Кроме того, при определении содержания фосфолипидов весовым методом вместе с
фосфором под действием молибденовокислого реагента соосаждаются присутствующие
в масле ионы железа, что приводит к завышенным и недостоверным результатам
анализа [5].
) Существует хроматографический
способ определения группового состава фосфолипидов, основанный на способности
отдельных групп фосфолипидов различно адсорбироваться на бумаге, пропитанной
кремниевой кислотой. Существенным недостатком способа является то, что он
предназначен прежде всего для качественной характеристики фосфолипидов и дает
данные лишь о приблизительном содержании их в масле. Известен также метод тонкослойной
хроматографии для определения фосфолипидов в растительных маслах и фосфатидных
концентратах. Он состоит из операций выделения и обезжиривания фосфолипидов с
помощью диализа, последующего разделения их хроматографированием в тонких
слоях, минерализации пробы, проведения колориметрической реакции и измерения
оптической плотности окрашенного комплекса при аналитической длине волны.
Диализ длится в течение 3-х суток при смене растворителя каждые 24 часа при
комнатной температуре.
) способ ускоренного определения
массовой доли фосфора в растительных маслах, заключающийся в
жидкость-жидкостной экстракции пробы масла ледяной уксусной кислотой с
последующим колориметрическим определением массовой доли фосфора в экстракте с
использованием молибденовокислого аммония. Согласно этому способу в пробирке
вместимостью 5 мл на весах 2 кл взвешивают (1-2) ± 0,01 г масла с записью
результата до второго десятичного знака. К содержимому пробирки пипеткой
добавляют 1 мл ледяной уксусной кислоты. Пробирку плотно закрывают пробкой и
интенсивно встряхивают в течение 1 минуты, после чего жировую и уксуснокислую
фазы разделяют центрифугированием в течение 5 минут при факторе разделения
210-650. Затем пробирку открывают, пипеткой отбирают аликвотную часть
уксуснокислого экстракта: 50 мкл - для нерафинированного и гидратированного
масел и 1 мл - для рафинированных масел и переносят в другую пробирку
вместимостью 10 мл. При анализе рафинированных масел аликвотную часть экстракта
упаривают в 1,5-2,0 раза на водяной бане с помощью водоструйного насоса при
температуре (50±2)oC и остаточном давлении (3,9±0,1) кПа или в вакуумсушильном
шкафу при той же температуре и давлении.
К содержимому пробирки приливают пипеткой 0,4 мл хлороформа и 0,1 мл
хромогенного реагента, содержащего молибдат аммония, солянокислое олово, серную
кислоту, метиловый спирт и дистиллированную воду.
Пробирку помещают в водяную баню и кипятят с обратным холодильником в течение 1
мин, затем охлаждают до комнатной температуры и вновь добавляют пипеткой еще 5
мл хлороформа. Образующийся хлороформенный слой отбирают пипеткой и измеряют
его оптическую плотность относительно контрольного раствора при длине волны 670
нм в слое 1 см.
Недостатками этого способа являются:
необходимость применения в качестве восстановителя дефицитного реагента
солянокислого олова; необходимость использования специального реагента -
метилового спирта, на применение и хранение которого нужно иметь особое
разрешение; сложность приготовления хромогенного реагента; необходимость
применения специального оборудования (центрифуги) для разделения фаз;
необходимость и сложность приготовления модельных образцов масла с известным
содержанием фосфолипидов для построения градуировочного графика. Задачей
изобретения является упрощение и интенсификация способа количественного
определения массовой доли фосфора в растительных маслах за счет сокращения
количества операций, продолжительности проведения анализа и количества
используемых реагентов [6].
) атомно-эмиссионный анализ с
использованием индуктивно-связанной плазмы основан на сгорании минерализата в
зоне плазмы, с атомарным излучением на определенных длинах волн. По
интенсивности характерного излучения определяют количественное содержание
анализируемых элементов.
Данный метод имеет низкие пределы
обнаружения химических элементов, характеризуется высокой воспроизводимостью
результатов измерений, широким диапазоном измеряемых концентраций. Для
атомно-эмиссионной спектрометрии характерны лишь спектральные помехи, которые
легко могут быть сведены к минимуму, а влияние матричных эффектов не столь
существенно, как для пламенной абсорбционной спектроскопии.
Измерения проводятся на
атомно-эмиссионном спекотрометре ICP ARL 3410 + с индуктивно связанной
аргоновой плазмой. Определение фосфора проводится с использованием аналитических
линий 396,984 нм.
Метод атомно-эмиссионной
спектроскопии является чувствительным, точным и эффективным аналитическим
методом исследований продукции со сложной органической матрицей [5].
) среди колориметрических методов
определения фосфора широкое распространение нашли чувствительные методы,
основанные на определении оптической плотности образовавшихся
фосфорномолибденовых синих комплексов. Фосфат-ионы в кислой среде в присутствии
избытка молибдата образуют фосфорномолибденовую кислоту слабо-желтого цвета.
При восстановлении фосфорномолибденовой кислоты слабыми восстановителями
получают фосфорномолибденовый синий («фосфорномолибденовая синь»).
Восстановление проводят в мягких условиях во избежание восстановления свободных
ионов молибдата. Состав и интенсивность окраски фосфорномолибденового синего
зависят от типа восстановителя и кислотности раствора. Определению фосфора
мешают сильные восстановители и окислители а также мышьяк (V), кремний,
германий, титан, цирконий.
Определение фосфора проводят после
минерализации вещества или после предварительной обработки с последующей
минерализацией либо спектрофотометрическим методом при двух длинах волн в
ультрафиолетовой области.
Для каждого раствора регистрируют
спектр поглощения с определением максимума в данных условиях, так как он может
смещаться при измерении на фотоэлектроколориметре, а не на спектрофотометре
[7].
1.3 Характеристика
спектрофотометрического метода определения
Физические основы метода.
Метод анализа, основанный на
измерении поглощения излучения УФ- и видимого диапазона веществом, находящимся
в молекулярном состоянии, очень часто называют фотометрическим. Этот метод
является методом молекулярной абсорбционной спектроскопии, в основе которой
лежит изменение электронно-колебательно-вращательного состояния вещества при
его взаимодействии с электромагнитным излучением УФ- и видимого диапазона.
Фотометрический анализ подразделяют
на колориметрию, фотометрию и спектрофотометрию. Спектрофотометрические методы
основаны на применении для оценки интенсивности поглощения света
фотоэлектронных устройств - фотоэлементов, фотодиодов и фотоэлектронных
умножителей. Этот метод может быть использован для проведения качественной
идентификации и количественного определения не только окрашенных веществ, но и веществ,
прозрачных в видимой области спектра. При проведении спектрофотометрического
анализа для монохроматизации излучения, пропускаемого через анализируемую
пробу, применяют монохроматоры призменного или дифракционного типа, что
позволяет повысить чувствительность и точность определения, так как достигается
более точная установка прибора на максимум полосы поглощения определяемого
вещества.
При образовании молекул из атомов
внешние атомные орбитали перестраиваются, изменяются их энергетические уровни,
образуются молекулярные орбитали. При этом для упрощения считается, что
внутренние электроны атомов и внешние электроны, не участвующие в образовании
связей, сохраняют ту же энергию, что и в индивидуальном атоме.
В органических соединениях различают
два типа электронов, ответственных за поглощение видимого и УФ-излучения:
непосредственно участвующие в
образовании связи, таким образом связанные более чем с одним атомом;
несвязывающие (неспаренные) внешние
электроны, локализованные большей частью у атомов таких элементов, как
кислород, галогены, сера, азот.
В зависимости от характера исходных
атомных орбиталей, т.е. от того какие атомы участвуют в образовании молекулы,
могут образовываться молекулярные орбитали σ- и π-типа. σ-связями
называют связи, которые имеют цилиндрическую симметрию относительно линии,
соединяющей атомы. π-связи - это
связи, симметричные относительно плоскости, проходящей через линию, соединяющую
центры атомов.
При отсутствии внешнего воздействия
максимум электронной плотности в σ- и π-связях
находится между ядрами, стягивая их, такие орбитали называются стягивающими.
Орбитали, не принимающие участия в
образовании связей, например образованные неспаренными электронами азота,
кислорода и др., так называемыми n-электронами, называются несвязывающими
n-орбиталями.
При некоторых условиях, например при
воздействии электромагнитного излучения, конфигурация молекулярных орбиталей
может измениться - максимум электронной плотности сместится к наружной стороне
ядер, увеличивая отталкивание между ними. Образуются так называемые
разрыхляющие орбитали, которые обозначаются σ⃰ и π⃰.
Таким образом, при поглощении
электромагнитного излучения УФ- и видимого диапазона могут происходить
электронные переходы со связывающих σ- и π-орбиталей и
несвязывающих n-орбиталей на разрыхляющие σ⃰- и π⃰-орбитали.
Наибольшую разность энергий имеют σ- и σ⃰-орбитали.
Вследствие этого σ-σ⃰ переход
может произойти при поглощении веществом излучения с относительно высокой (в
пределах рассматриваемого диапазона) энергией и, соответственно, в спектре
поглощения полоса поглощения будет наблюдаться в коротковолновой (дальней УФ)
области.
Электронные переходы со связывающей π-орбитали на
разрыхляющую π⃰-орбиталь
происходят при поглощении меньшей, но все же достаточно большой энергии, и соответствующие
спектральные линии наблюдаются в области среднего ультрафиолета. n - π⃰ и n - σ⃰ -переходы
могут происходить при поглощении еще меньших квантов и наблюдаются в области
ближнего ультрафиолета или даже в видимой части спектра.
Электронные спектры поглощения
вещества - графическое изображение распределения поглощаемой энергии по длинам
волн. Способы представления спектров различаются величинами, откладываемыми по
осям x и y. По оси абсцисс может быть отложена длина волны, частота, волновое
число. По оси y откладывают оптическую плотность, логарифм оптической
плотности, пропускание. Выбор системы координат определяется задачами анализа,
исследуемой областью спектра и др. Вид спектров, изображенных в разных системах
координат, отличается.
Так как поглощаемая энергия приводит
к изменению не только электронного, но и колебательного, и вращательного
состояний поглощающих молекул, наблюдаемые спектры поглощения представляют
собой широкие полосы с одним или несколькими максимумами в непрерывной области
поглощения или несколькими максимумами в различных областях, разделенных
областями пропускания.
Полосы поглощения в электронном
спектре характеризуются длиной волны и интенсивностью, измеряемыми в максимуме.
Положение полосы на шкале длин волн определяется разностью энергий состояний,
между которыми происходит переход. Интенсивность полосы поглощения определяется
вероятностью перехода.
Структурный элемент молекулы,
ответственный за появление полосы поглощения в спектре, называют хромофором.
Поглощение света данным изолированным хромофором характеристично, то есть имеет
определенные значения λmax и εmax полосы
поглощения. Некоторые атомы или группы атомов, присоединенные к хромофорной
системе, смещают характерные полосы поглощения. Такие атомы и группы называются
ауксохромами.
Например, в ряду соединений:
уксусный альдегид, ацетон, хлоруксусный ангидрид полоса поглощения хромофорной
группы С=О (λmax = 280
нм), причиной появления которой является n-π⃰-переход, с
увеличением электроотрицательности заместителя сдвигается в сторону меньших
длин волн - синий или гипсохромный сдвиг и некоторое увеличение интенсивности -
гиперхромный эффект. Для смещения в сторону длинных волн принят термин красный
или батохромный сдвиг, а для понижения интенсивности - гипохромный эффект.
Все эти и другие взаимосвязи,
используются для установления строения химических соединений, изучения влияний
различных условий на состояние соединения.
Анионы некоторых элементов при
определенных степенях окисления, например хрома, марганца в виде соединений
K2Cr2O7, K2CrO4, KMnO4, поглощают в различных частях видимого диапазона.
Катионы элементов первых периодов
системы Менделеева в видимой и ближней УФ-частях спектра не поглощают, то есть
их растворы бесцветны.
Катионы тяжелых металлов поглощают
или не поглощают УФ- и видимое излучения в зависимости от заполнения
d-орбиталей. При полностью заполненных d-орбиталях, например у цинка и кадмия,
растворы солей бесцветны. У кобальта, никеля, меди - элементов, d-орбитали
которых недостроены, растворы солей поглощают излучение видимого диапазона.
Молекулярные спектры поглощения в
УФ- и видимой областях (особенно в УФ) имеют низкую специфичность - полосы
поглощения многих хромофоров перекрываются, они широкие и очень сильно
искажаются примесями, смещаются под действием растворителей. Поэтому проводить
идентификацию неизвестного вещества только по его спектру поглощения
практически нельзя, за исключением некоторых ионов и их сольватокомплексов,
например лантаноидов (элементы 58-71), актиноидов (элементы 90-103), которые
имеют дискретную структуру, сходную со структурой спектров атомарных газов.
Наоборот, для целей количественного
анализа фотометрия в различных вариантах используется очень широко.
Спектрофотометрические методики количественного определения разработаны для
большинства контролируемых компонентов пищевых продуктов, очень многих
компонентов промышленной продукции. По своей применимости в практике заводских,
контролирующих и исследовательских лабораторий фотометрия является самым
распространенным методом, что объясняется:
а) доступностью, дешевизной,
простотой работы и обслуживания используемого оборудования -
фотоэлектроколориметров, спектрофотометров;
б) достаточно высокими
аналитическими характеристиками метода: предел обнаружения определяемого
компонента может достигать 10-4-10-5 %, точность анализа - 1-2 %; метод
экспрессен, не требует высокой квалификации персонала при выполнении массовых
анализов.
Количественный фотометрический
анализ в большинстве случаев основан на переводе определяемого компонента его
взаимодействием с соответствующим реагентом в соединение, поглощающее свет УФ-
или видимого диапазона, и измерении оптической плотности:
Dλ=lg
(I0/I) (3)
или пропускания
τλ= (I / I0)*100 %
(4)
этого раствора на длине волны λ,
соответствующей,
как правило, максимуму поглощения (пропускания). Здесь I0 - интенсивность
излучения источника на длине волны λ; I
- интенсивность этого излучения, прошедшего через кювету с анализируемым
веществом.
Соединение анализируемого компонента,
поглощающее свет в удобной для проведения анализа части спектра, может быть
получено при воздействии неорганических реагентов. Например, при взаимодействии
бесцветных соединений Fe(III) с роданидом калия образуется комплекс
ярко-красного цвета, при взаимодействии Ni(II) с аммиаком - ярко-синий
комплекс. Но таких реакций также сравнительно мало. Чаще для фотометрических
определений используются многочисленные реакции неорганических ионов с
органическими реактивами, сопровождающимися образованием окрашенных соединений.
Например, для определения меди используют дитизон, образующий комплексное
соединение, характеризующееся λmax=430
нм. Цинк с дитизоном образует комплекс с λmax=538
нм, никель - с λmax=665 нм.
Оптическая плотность анализируемого раствора
связана с его концентрацией и другими условиями измерений законом
Бугера-Ламберта-Бера:
Dλ=lg
(I0/I)=lg (1/T)=ελcl,
(5)
где ελ,
л/моль х см - молярный коэффициент поглощения или экстинции. Этот коэффициент
является молекулярной характеристикой вещества, не зависящий от концентрации и
толщины поглощающего слоя;
С - концентрация определяемого компонента,
моль/л; - толщина кюветы, см.
Если закон Бугера-Ламберта-Бера в анализируемой
системе соблюдается, то при фиксированной толщине слоя вещества (кюветы)
оптическая плотность линейно зависит от концентрации вещества. Однако в
реальных системах закон Бугера-Ламберта-Бера соблюдается не всегда.
Причины отклонения D от линейной связи с
концентрацией вещества:
а) химические - межмолекулярные взаимодействия
компонентов смеси, включая специфические (водородная связь, образование
ассоциатов) и химические взаимодействия. Химические отклонения чаще всего
существенны при высоких концентрациях вещества;
б) инструментальная - слишком высокая или
слишком низкая интенсивность излучения, ширина щели монохроматора, превышает
собственную ширину полосы поглощения, а также эффекты отражения, рассеяния
излучения.
При проведении количественных определений всегда
проводится проверка соблюдения закона светопоглощения и чаще всего строятся
градуировочные графики по растворам известной концентрации.
Главное требование к используемым растворителям
- отсутствие собственного поглощения растворителя на длине волны, на которой
проводится измерение.
Приборы, которые используются для проведения
спектрофотометрического анализа - спектрофотометры. Они должны выполнять две
основные задачи:
разлагать полихроматический свет по длинам волн
и выделять нужный интервал длин волн;
Прибор включает источник излучения, устройство
дл выделения нужного интервала длин волн (монохроматор), кюветное отделение,
детектор, преобразователь сигнала, индикатор сигнала (шкалу или цифровой
счетчик).
Типичные источники излучения в фотометрии -
лампа накаливания с вольфрамовой нитью, дейтериевая или галогенокварцевая
лампы. Эти источники дают излучение в широкой области спектра, поэтому
излучение нужно монохроматизировать. Монохроматиация излучения, поступающего на
кювету с исследуемым веществом, осуществляется в современных спектрофотометрах
с помощью дисперсионных монохроматоров, в которых диспергирующим элементом
является дифракционная решетка.
В фотометрии измеряется не абсолютное значение
оптической плотности, а разность оптических плотностей исследуемого раствора и
раствора, оптическая плотность которого принята за ноль (раствор сравнения).
Кювету, в которую помещают исследуемый раствор, называют рабочей, а кювету для
раствора сравнения - кюветой сравнения. Обе кюветы должны быть по возможности
идентичными. Основное требование к кюветам - прозрачность в наблюдаемой области
спектра. Для работы в видимой области кюветы изготавливают из стекла, для
УФ-области кюветы должны быть изготовлены из кварца.
Приемники излучения - фотоэлементы и
фотоумножители Приборы могут иметь однолучевую и двухлучевую оптические схемы.
Применение этого вида анализа в контроле
качества продукции как пищевого, так и промышленного назначения самое широкое и
разнообразное. Фотометрия используется для количественного определения таких
компонентов продуктов питания как белки, сахара, жиры, нитриты и нитраты,
токсичные элементы. Они используются при определении содержания многих
компонентов разнообразных промышленных товаров. Широкое применение метода
связано, в первую очередь, с доступностью, дешевизной и простотой обслуживания
приборов, используемых для осуществления метода, - спектрофотометров. При этом
аналитические характеристики метода достаточно высокие. Например,
чувствительность большинства разработанных фотометрических методик достигает
10-5 моль/л, точность определения - 1-2 %. Метод в отношении многих
определяемых компонентов отличается высокой универсальностью и избирательностью
[8].
Спектрофотометрический способ определения
фосфора относится к методам технологического контроля производства в
масложировой промышленности, а именно, к способам количественного определения
фосфолипидов в вырабатываемых растительных маслах. В процессе добывания
растительных масел значительная часть фосфолипидов, содержащихся в масличном
сырье и локализующихся преимущественно в гелевой части семян, растворяется в
масле и извлекается вместе с ним. В зависимости от природы и качества семян,
способов и режимов получения и переработки масел содержание фосфолипидов в них
колеблется от 0,05 до 3,5% в пересчете на стеароолеолецитин. Обладая важными
физиологическими свойствами, фосфолипиды в то же время осложняют ведение
последующих этапов переработки растительных масел и отрицательно влияют на
технико-экономические показатели рафинации и гидрирования в целом.
В мировой и отечественной практике существуют
различные методы удаления фосфолипидов - гидратация водой, паром, растворами
электролитов, минеральными и органическими кислотами и другие.
Поэтому для оценки эффективности и оперативного
управления технологическим процессом получения и переработки растительных
масел, а также для оперативного контроля за качеством вырабатываемых масел и
жиров необходим экспресс-метод количественного определения фосфолипидов в
растительных маслах.
Рассматриваемый метод основан на осуществлении
жидкость-жидкостной экстракции пробы масла спиртоэфирным раствором в
соотношении 1: 1 - 1:2 к массе пробы с последующей кислотной обработкой путем
введения в полученную мисцеллу 1,5-3,0 мл 10 N раствора серной кислоты, причем
нагревание ведут при температуре 20-50oC в течение 30-90 с.
Как известно, растворы фосфолипидов в неполярных
растворителях, таких как глицериды природных растительных масел, образуют
коллоидную мицеллярную структуру, полярные группы которых направлены внутрь
мицеллы, а гидрофобные цепи - наружу. Жидкость-жидкостная экстракция пробы
масла спирто-эфирным раствором приводит к изменению структуры, формы, характера
и энергии связей внутри и между мицеллами фосфолипидов с образованием
мономеров. Поляризующее соединение, как спирт вклинивается в ядро мицеллы фосфолипидов
и способствует проникновению водного раствора серной кислоты внутрь мицеллы. В
результате снижается энергия связи фосфолипидов с неполярной средой и наоборот
возрастает энергия связи их с водной фазой. Это позволяет свести в одну стадию
извлечение фосфора из анализируемой пробы масла, получение водорастворимых
комплексов и перевод их в водно-спиртовую фазу. Установлено, что в мицеллах
концентрацией менее 25% извлечение фосфолипидов осуществить практически
невозможно. В мицеллах концентрацией выше 50% резко повышается вязкость
масляных растворов, сильнее проявляются гидрофобные свойства фосфолипидов, в
результате чего также резко снижается эффективность извлечения последних.
Показано, что оптимальная концентрация
полученной мицеллы, при которой значительно снижается диффузное сопротивление
массопереноса, должна находиться в пределах 25-50%, что соответствует
соотношению масло: спиртоэфирный раствор 1:1 - 1:2. Оптимальное значение
температуры на стадии жидкость-жидкостной экстракции находилось в пределах
20-50oC. При температуре ниже 20oC резко повышается вязкость жидких масел, в
результате значительно осложняется процесс растворения пробы масла в
спиртоэфирной смеси, сильно замедляется скорость извлечения фосфолипидов из
анализируемой жировой фазы в кислую водно-спиртовую. Вместе с тем, при
температуре выше 50oC начинается интенсивное испарение жира. Это приводит к
нарушению системы и ухудшению условий взаимодействия реагирующих компонентов.
Продолжительность обработки, обеспечивающая
требуемую глубину извлечения фосфолипидов, определяется скоростью
взаимодействия реагирующих компонентов. Опытным путем также установлено, что
при интенсивном смешении реагирующих фаз минимальное время контактирования
составляет 30 сек. При продолжительности обработки менее 30 сек степень
извлечения фосфолипидов из анализируемой пробы масла существенно снижается.
Дальнейшее увеличение продолжительности контактирования фаз (свыше 90 с) не
оказывает влияние на эффективность процесса экстракции. Исходя из этих данных
продолжительность обработки масла спиртоэфирным раствором и 10 N раствором
серной кислоты должна находиться в пределах 30-90 с.
Что касается количества (1,5-3,0 мл) раствора
серной кислоты, оно соответствует известному положению о том, что для полного
отсечения кислой водно-спиртовой фазы критический избыток водного раствора
кислоты должен пятикратно превышать количество спирта в реакционной среде.
Граничные условия определялись экспериментально.
Среди множества методов определения фосфора для
более подробного изучения был избран спектрофотометрический метод, поскольку он
позволяет осуществить оперативный контроль за качеством вырабатываемых масел и
жиров. Этот метод обеспечивает упрощение и интенсификацию способа
количественного определения массовой доли фосфора в растительных маслах за счет
сокращения количества операций, продолжительности проведения анализа и
количества используемых реагентов. Также он позволяет исключить применение
специальных и дефицитных реагентов [6].
2.
Разработка проекта МВИ
Методика выполнения измерений (МВИ) представляет
собой установленную совокупность операций и правил (технологический процесс)
проведения измерений, выполнение которых обеспечивает получение результатов
измерений с известной погрешностью.
МВИ согласно ГОСТ 8.010 должна включать
следующие структурные элементы:
Назначение МВИ
Метод измерений
Показатели точности МВИ
Требования к средствам измерений,
вспомогательным устройствам, материалам, растворам
Условия выполнения измерений
Требования к обеспечению безопасности выполняемых
работ
Требования к обеспечению экологической
безопасности
Требования к квалификации операторов
Операции при подготовке к выполнению измерений
Операции при выполнении измерений
Операции обработки и вычислений результатов
измерений
Алгоритм оценивания неопределенности измерения
Контроль лабораторного смещения
Контроль стабильности результатов измерений в
лаборатории
Требования к оформлению результатов измерений
Приложения
Назначение МВИ
В этом разделе приводится характеристика
определяемого параметра, перечень анализируемых объектов, на которые
распространяется методика, а также интервал определяемых концентраций.
Например, настоящая методика устанавливает
порядок выполнения процедур по определению содержания фосфора в животных и
растительных маслах и жирах методом спектрофотометрии с использованием
спектрофотометра.
Интервал определяемых концентраций составляет от
0 до 125 мг/кг.
Методика предназначена для технохимического
контроля производства в масложировой промышленности.
Метод измерений
Приводиться характеристика и сущность метода с
указанием особенностей его реализации.
Например, для определения содержания фосфора в
растительных маслах используется спектрофотометрический метод, основанный на
определении оптической плотности раствора, которая используется для расчета
массовой доли фосфора.
Сущность метода заключается в проведении
жидкость-жидкостной экстракции пробы масла спиртоэфирным раствором, кислотной
обработки мисцеллы раствором серной кислоты, нагревании и нахождении искомой
величины спектрофотометрическим измерением.
Показатели точности МВИ
Указываются конкретные значения показателей
точности, установленные для данной методики экспериментально-расчетным путем.
Требования к средствам измерений,
вспомогательным устройствам, материалам, растворам
.1 Средства измерений
Приводится перечень необходимых для реализации
методики средств измерений, с указанием действующих ТНПА и технических
характеристик.
Например, спектрофотометр, подходящий для
проведения измерений при длине волны 670 нм.
Кюветы спектрофотометра, шириной в 1см и 4 см,
подходящие для измерений при длине волны 670 нм.
Весы лабораторные общего назначения по ГОСТ
24104-88 второго класса точности, с наибольшим пределом взвешивания 200 г
(погрешность составляет 0,7500 мг).
Термометр с диапазоном измерения от 0ºС
до 100ºС,
с ценой деления 1ºС по ГОСТ
28498-90.
Цилиндр мерный лабораторный 3-100-1 с
допускаемой погрешностью не более ±0,5 см3 по ГОСТ 1770-74.
Пипетки исполнения 2, второго класса точности,
вместимостью 5; 10; 50 см3 по ГОСТ 29227-91.
Секундомер.
Колбы конические вместимостью 100 см3
(погрешность составляет 0,15 мл); 250 см3 (погрешность составляет 0,2 мл) по
ГОСТ 25336-82.
Пробирки вместимостью 10-15 см3 по ГОСТ 1770-74.
.2 Вспомогательные устройства
Приводится перечень необходимых для реализации
методики вспомогательных устройств, с указанием действующих ТНПА и технических
характеристик.
Например, баня водяная или термостат,
позволяющий поддерживать температуру в пределах от 20 до 80 ºС
с отклонением 0,5 ºС от
заданной.
.3 Материалы и реактивы
Приводится перечень необходимых для реализации
методики материалов и реактивов, с указанием действующих ТНПА и требуемой
чистоты.
Например, серная кислота 25% ГОСТ 2184-77;
Спирт этиловый по СТБ 645-2004;
Эфир этиловый по ГОСТ 8981-78;
Аммоний молибденовокислый по ГОСТ 3765-78;
Вода дистиллированная по ГОСТ 6709-72;
Гидразин сернокислый по ГОСТ 5841-74.
.4 Растворы
Описывается порядок приготовления всех видов и
типов растворов (основные, рабочие, буферные и т.д.), используемых при
реализации методики, а также условия и сроки их хранения.
Например, для приготовления спиртоэфирного
раствора в пробирку вместимостью 10 см3 отбирают пипеткой 1,3 см3 этилового
эфира и 0,6 см3 этилового спирта, затем раствор перемешивают.
Указываются условия, которые должны
поддерживаться при выполнении измерений по данной методике
Например, при выполнении измерений должны быть
соблюдены следующие условия:
температура воздуха (20±5)
°С;
атмосферное давление 84,0-106,7 кПа (630-800 мм
рт.ст.);
влажность воздуха не более 80 % при температуре
20оС;
напряжение питающей сети (220±22)
В;
При нагревании раствора температуру поддерживают
в пределах 20-50оС.
Требования к обеспечению безопасности
выполняемых работ
Указываются ссылки на инструкции и ТНПА,
выполнение которых обязательно для соблюдения требований безопасности при
реализации разрабатываемой методики.
Например, анализ по данной методике должен
выполняться согласно инструкции «Основные правила безопасности работы в
химических лабораториях» - М.: Химия, 1979 г. и инструкции по эксплуатации
спектрофотометра. Следует руководствоваться установленными правилами работы с
электрооборудованием. Требования электробезопасности - по ГОСТ 12.2.003-91,
ГОСТ 12.2.007.0-75, ГОСТ 12.3.019-80.
Требования пожарной безопасности - по ГОСТ
12.1.004-91.
Требования к обеспечению экологической
безопасности
Приводиться характеристика вредных для
окружающей среды факторов, которые могут возникнуть при реализации методики.
Например, в процессе выполнения анализа по
данной методике образуются выбросы и отходы, опасные для окружающей среды.
Приготавливаемые анализируемые растворы являются токсичными и перед сливом в
канализацию обрабатываются.
Требования к квалификации операторов
Указываются требования к образованию и
специальной подготовки операторов.
Например, к выполнению измерений допускаются
квалифицированные операторы, имеющие высшее или среднее специальное
образование, изучившие настоящую методику, требования безопасности и
эксплуатационную документацию на используемые средства измерений и
вспомогательное оборудование, обученные практическому применению методики,
прошедшие подготовку для работы в качестве оператора анализатора
спектрофотометрического.
Операции при подготовке к выполнению измерений
Описывается порядок и сущность операций,
выполняемых при подготовке к выполнению измерений по данной методике.
Типовой перечень подготовительных операций:
приготовление растворов;
подготовка измерительной аппаратуры;
установление градуировочной зависимости;
подготовка пробы.
Например, спектрофотометр готовят к работе
согласно инструкции по эксплуатации.
Отбор проб растительного масла осуществляют по
ГОСТ 5471-83.
Операции при выполнении измерений
Описывается порядок и сущность всех операций в
процессе измерений.
Например, в пробирку вместимостью 10-15 мл на
весах 2 класса точности взвешивают 1 -2 г масла с записью результата до второго
десятичного знака. К содержимому пробирки последовательно приливают пипеткой
1-2 мл спиртоэфирного раствора из расчета 1:1 - 1:2 и 1,5 - 3,0 мл 10 N
раствора серной кислоты. Пробирку плотно закрывают пробкой и интенсивно
встряхивают в течение 30-90 сек.
Аликвотную часть экстракта осторожно переносят в
другую пробирку и далее известными спектрофотометрическими методами в экстракте
анализируют содержание фосфора.
Операции обработки и вычислений результатов
измерений
Приводится последовательное изложение порядка
всех расчетов, в том числе промежуточных.
Например, массовую долю фосфора (ω), в %,
рассчитывают, используя установленную градуировочную зависимость (п. 9.3), по
следующей формуле:

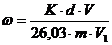 (6)
(6)
12 Алгоритм оценивания
неопределенности измерения
Содержится ссылка на приложение к
документу, где приведена методика оценивания неопределенности результатов
измерения.
Контроль лабораторного смещения
Приводится описание порядка оценки
лабораторного смещения и интерпретации полученных данных или ссылка на
соответствующие документы (например, п. 5 СТБ 5725-4).
Обязательно указываются требования к
образцу, используемому в качестве эталонного материала.
Например, оценка лабораторного
смещения осуществляется по п. 5 СТБ 5725-4.
В качестве эталонного материала при
оценке лабораторного смещения используются модельные образцы масел с известным
содержанием фосфолипидов, установленным другим стандартным методом, имеющим
характеристики точности не меньше, чем у методики, описанной в настоящем
документе.
Контроль стабильности результатов
измерений в лаборатории
Приводится описание процедур
контроля стабильности повседневных результатов измерений в лаборатории и
стабильности результатов измерений, полученных в условиях воспроизводимости, а
также используемые для этих целей методы.
Возможна ссылка на соответствующие
пункты СТБ 5725-6.
Например, контроль стабильности
результатов измерений в лаборатории проводится по п. 6 СТБ 5725-6.
Требования к оформлению результатов
измерений
Указывается форма представления
результатов количественного химического анализа по данной методике.
Например, Результат количественного
химического анализа по данной методике представляют по следующей формуле:
Х± 2∙ uc (7)
где Х - результат анализа, мг/100 г;
- коэффициент охвата для выбранного
уровня доверия р=0,95;- суммарная неопределенность, мг/100 г.
Значения содержания фосфора в пробе
и суммарная неопределенность должны содержать одинаковое количество знаков
после запятой.
Результат испытаний оформляют по
форме, установленной действующей в лаборатории системой регистрации данных.
Результаты должны включать следующую
информацию:
наименование (шифр) пробы;
дату проведения измерений;
результаты измерений, включая все
необходимые данные и промежуточные расчёты;
результаты параллельных определений;
окончательный результат измерений;
значение приписанной или
рассчитанной погрешности измерения;
фамилию оператора.
Заключение
В ходе выполнения данной курсовой работы были
изучены методы, применяемые в настоящее время для определения фосфора в
продуктах питания, был проведен сравнительный анализ их характеристик и выбран
спектрофотометрический метод анализа как наиболее подходящий для определения
данного компонента в пищевых продуктах. Этот метод универсален и применим к
многочисленному кругу объектов. Применение этого вида анализа в контроле
качества продукции как пищевого, так и промышленного назначения самое широкое и
разнообразное. Фотометрия используется для количественного определения таких
компонентов продуктов питания как белки, сахара, жиры, нитриты и нитраты,
токсичные элементы. Они используются при определении содержания многих
компонентов разнообразных промышленных товаров. Широкое применение метода связано,
в первую очередь, с доступностью, дешевизной и простотой обслуживания приборов,
используемых для осуществления метода, - спектрофотометров. При этом
аналитические характеристики метода достаточно высокие. Например,
чувствительность большинства разработанных фотометрических методик достигает
10-5 моль/л, точность определения - 1-2 %. Метод в отношении многих
определяемых компонентов отличается высокой универсальностью и
избирательностью. Также была проанализирована имеющаяся литература с описанием применения
различных методов для определения фосфора в продуктах питания и выбран наиболее
актуальный продукт - растительные масла, которые в настоящее время играют
важную роль в рационе питания человека. Для данного продукта была также
приведена методика определения в нем фосфора с использованием
спектрофотометрического метода.
Список использованных источников
1
Фосфор, недостаток в организме, суточная потребность, источники [Электронный
ресурс]. - 2009. - Режим доступа: http: // e - pitanie. ru / mineralnie_veshchestva
/ fosfor. рhp. - Дата доступа: 15.03.2011.
Микроэлемент
фосфор. Продукты, содержащие фосфор. Переизбыток и недостаток фосфора в
организме. Как усваивается фосфор[Электронный ресурс]. - 2010. - Режим доступа:
http: // inmoment. ru / beauty / health-body / phosphorus. html. - Дата
доступа: 15.03.2011.
Фосфор
Р - АНО «Центр биотической медицины» [Электронный ресурс]. - 2010. - Режим
доступа: http: // microelements. ru / P. -Дата доступа: 15.03.2011.
Биологическое
значение фосфора крови. Содержание элемента фосфора в продуктах [Электронный
ресурс]. - 2009. - Режим доступа: http: // policlinica. ru / analiz 3-31. -
Дата доступа: 15.03.2011.
Гонта,
П.П. Определение содержания кальция и фосфора в молочном сырье
атомно-эмиссионным методом / П.П. Гонта // Здоровье и окружающая среда. - 2007.
- № 10. - С. 393-395.
Способ
количественного определения фосфора в растительных маслах [Электронный ресурс].
- 2010. - Режим доступа: http: // ru - patent. info / 21/00-04 / 2103681.html.
- Дата доступа: 05.04.2011.
Глоба,
И.И. Оптические методы и приборы контроля качества продукции: учеб.пособие /
И.И.Глоба. - Минск: БГТУ, 2003. - 121с.
СТП
БГТУ 002-2007 Проекты (работы) курсовые. Требования и порядок подготовки,
представление к защите и защита.
Список использованных ТНПА
1
Точность (правильность и прецизионность) методов и результатов измерений. Часть
4. Основные методы определения правильности стандартного метода измерений: СТБ
ИСО 5725-4-2002. - Введ. 01.07.2003. - Минск: Госстандарт: Белорус. гос. ин-т
стандартизации и сертификации, 2000. -31 с.
Точность
(правильность и прецизионность) методов и результатов измерений. Часть 6. Использование
значений точности на практике: СТБ ИСО 5725-6-2002. - Введ. 01.07.2003. -
Минск: Госстандарт: Белорус. гос. ин-т стандартизации и сертификации, 2000. -
50 с.
Государственная
система обеспечения единства измерений. Методика выполнения измерений. Основные
положения: ГОСТ 8.010-99. - Введ. 01.06.2001. - М.: Межгос. совет по
стандартизации, метрологии и сертификации: Белорус. гос. ин-т стандартизации и
сертификации, 1999. - 23 с.
Весы
лабораторные. Общие технические требования: ГОСТ 24104-88. - Введ. 01.01.89. -
Москва: ИПК Издательство стандартов, 1988. - 15 с.
Термометры
жидкостные стеклянные. Общие технические требования. Методы испытаний: ГОСТ
28498-90. - Введ. 01.01.91. - Москва: Стандартинформ, 2007. - 10 с.
Посуда
мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие
технические условия: ГОСТ 1770-74. - Введ. 01.01.76. - Москва: Стандартинформ,
2005. - 21 с.
Посуда
лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования:
ГОСТ 29227-91. - Введ. 01.01.94. - Москва: Стандартинформ, 2006. - 10 с.
Посуда
и оборудование лабораторные стеклянные. Типы, основные параметры и размеры:
ГОСТ 25336-82. - Введ. 01.01.84. - Москва: Стандартинформ, 2004. - 102 с.
Кислота
серная техническая. Технические условия: ГОСТ 2184-77. - Введ.01.07.78. -
Москва: Стандартинформ, 2006. - 21 с.
Спирт
этиловый денатурированный. Технические условия: СТБ 645-2004. - Введ.
01.07.2004. - Минск: БелГиСС, 2004. - 16 с.
Эфиры
этиловый и нормальный бутиловый, уксусной кислоты технические. Технические
условия: ГОСТ 8981-78. - Введ. 01.01.80. - Москва: Издательство стандартов,
1993. - 16 с.
Реактивы.
Аммоний молибденовокислый. Технические условия: ГОСТ 3765-78. - Введ. 01.01.79.
- Москва: ИПК Издательство стандартов, 1998. - 7 с.
Вода
дистиллированная. Технические условия: ГОСТ 6709-72. - Введ. 01.01.74. -
Москва: Стандартинформ, 2007. - 10 с.
Масла
растительные. Правила приемки и методы отбора проб: ГОСТ 5471-83. - Введ.
01.01.84. - Москва:Стандартинформ, 2001. - 10 с.
Реактивы.
Гидразин сернокислый: ГОСТ 5841-74. - Введ. 01.01.76. - М.: Государственный
комитет стандартов Совета Министров СССР, 1976. - 5 с.
ПРИЛОЖЕНИЕ А
Методика определения содержания фосфора в
растительных маслах
МВИ. ХХХХ ─ ХХ
РАЗРАБОТАНО
Учреждение образования
Белорусский Государственный
Технологический Университет
Заведующий кафедрой ФХМСП
________ Ветохин С.С.
«__» ___________ 2011г
студентка ТОВ-4-14
________ Палёха Н.В.
«__» ___________ 2011г
Минск 2011
Назначение МВИ
Настоящая методика устанавливает порядок выполнения
процедур по определению содержания фосфора в животных и растительных маслах и
жирах методом спектрофотометрии с использованием спектрофотометра, подходящего
для проведения измерений при длине волны 670 нм.
Интервал определяемого содержания фосфора составляет
0,05 - 3,5 %.
Методика предназначена для технохимического
контроля производства в масложировой промышленности, а именно для
количественного определения фосфолипидов в растительных маслах.
Метод измерений
Для определения содержания фосфора в растительных
маслах используется спектрофотометрический метод, основанный на определении
оптической плотности раствора, которая используется для расчета массовой доли
фосфора.
Сущность метода заключается в осуществлении
жидкость-жидкостной экстракции пробы масла спиртоэфирным раствором в
соотношении 1: 1 - 1:2 к массе пробы с последующей кислотной обработкой путем
введения в полученную мисцеллу 1,5 - 3,0 мл 10 N раствора серной кислоты,
причем нагревание ведут при температуре 20 - 50oC в течение 30 - 90 с.
Требования к средствам измерений,
вспомогательным устройствам, материалам, растворам.
.1 Средства измерений
Спектрофотометр, подходящий для проведения
измерений при длине волны 670 нм.
Кюветы спектрофотометра, шириной в 1см и 4 см,
подходящие для измерений при длине волны 670 нм.
Весы лабораторные общего назначения по ГОСТ
24104-88 второго класса точности, с наибольшим пределом взвешивания 200 г
(погрешность составляет 0,7500 мг).
Термометр с диапазоном измерения от 0ºС
до 100ºС,
с ценой деления 1ºС по ГОСТ
28498-90.
Цилиндр мерный лабораторный 3-100-1 с
допускаемой погрешностью не более ±0,5 см3 по ГОСТ 1770-74.
Пипетки исполнения 2, второго класса точности,
вместимостью 5; 10; 50 см3 по ГОСТ 29227-91.
Секундомер.
Колбы конические вместимостью 100 см3
(погрешность составляет 0,15 мл); 250 см3 (погрешность составляет 0,2 мл) по
ГОСТ 25336-82.
Пробирки вместимостью 10-15 см3 по ГОСТ 1770-74.
Колбы мерные исполнения 2 вместимостью 100, 500
и 1000 см3 по ГОСТ 1770-74.
.2 Вспомогательные устройства
Баня водяная или термостат, позволяющий
поддерживать температуру в пределах от 20 до 80 ºС
с отклонением 0,5 ºС от
заданной.
.3 Материалы и реактивы
Серная кислота 25% ГОСТ 2184-77;
Спирт этиловый по СТБ 645-2004;
Эфир этиловый по ГОСТ 8981-78;
Аммоний молибденовокислый по ГОСТ 3765-78;
Вода дистиллированная по ГОСТ 6709-72;
Гидразин сернокислый (сульфат гидразина) по ГОСТ
5841-74, раствор с массовой долей 1%.
.4 Растворы
спиртоэфирный раствор;
раствор молибденовокислого аммония;
раствор сравнения;
раствор гидразинсульфата с массовой долей 1%;
10 N раствор серной кислоты.
Условия выполнения измерений
При выполнении измерений должны быть соблюдены
следующие условия:
температура воздуха (20±5)
°С;
атмосферное давление 84,0-106,7 кПа (630-800 мм
рт.ст.);
напряжение питающей сети (220±22)
В;
При нагревании раствора температуру поддерживают
в пределах 20-50оС.
Требования к обеспечению безопасности
выполняемых работ
Анализ по данной методике должен выполняться
согласно инструкции «Основные правила безопасности работы в химических
лабораториях» - М.: Химия, 1979 г. и инструкции по эксплуатации
спектрофотометра. Следует руководствоваться установленными правилами работы с
электрооборудованием. Требования электробезопасности - по ГОСТ 12.2.003-91,
ГОСТ 12.2.007.0-75, ГОСТ 12.3.019-80.
Требования пожарной безопасности - по ГОСТ
12.1.004-91.
Требования к обеспечению экологической
безопасности
При выполнении определения содержания фосфора
соблюдают следующие требования: условия окружающей среды, в которых проводят
измерения, не должны отрицательно влиять на результаты и искажать точность
измерений. Помещение для проведения измерения должно быть защищено от
воздействия таких факторов, как повышенные температуры, пыль, влажность, пар,
шум, вибрация, электромагнитные возмущения.
В процессе выполнения анализа по данной методике
образуются выбросы и отходы, опасные для окружающей среды. Приготавливаемые
анализируемые растворы являются токсичными и перед сливом в канализацию
обрабатываются.
Требования к квалификации операторов
К подготовке образцов для проведения анализа, к
выполнению измерений и обработке их результатов допускаются квалифицированные
операторы, имеющие высшее или среднее специальное образование, изучившие
настоящую методику, требования безопасности и эксплуатационную документацию на
используемые средства измерений и вспомогательное оборудование, обученные
практическому применению методики, прошедшие подготовку для работы в качестве
оператора анализатора спектрофотометрического.
Операции при подготовке к выполнению измерений
.1 Приготовление растворов
. Приготовление спиртоэфирного раствора
Спиртоэфирный раствор содержит 2 части этилового
эфира и 1 часть этилового спирта. Для приготовления спиртоэфирного раствора в
пробирку вместимостью 10 см3 отбирают пипеткой 1,3 см3 этилового эфира и 0,6
см3 этилового спирта, затем раствор перемешивают.
. Приготовление раствора молибденовокислого
аммония
Раствор с массовой долей молибденовокислого
аммония 5% готовят следующим образом: 50,0 г молибденовокислого аммония
взвешивают (результат взвешивания записывают с точностью до первого десятичного
знака), растворяют в 500 см3 воды, нагретой примерно до 50 °C. Раствор
охлаждают, доливают водой до 1 дм3, перемешивают и фильтруют.
. Приготовление раствора сравнения
Для приготовления раствора сравнения в пробирку
вместимостью 10 см3 отбирают пипеткой 0,3 мл 10 N раствора серной кислоты, 0,3
мл 2,5% водного раствора молибденовокислого аммония, 0,5 мл 0,25% водного
раствора гидразинсульфата, объем раствора доводят дистиллированной водой до 5
мл.
. Приготовление раствора гидразинсульфата с
массовой долей 1%
Навеску массой (5,0 ± 0,1) г гидразина
сернокислого растворяют в 200 см3 подогретой до 40-50 ºС
дистиллированной воды, переносят в мерную колбу вместимостью 500 см3 и дововдят
объем до метки водой.
. Приготовление 10 N раствора серной кислоты
В стакан из термостойкого стекла отбирают
пипеткой 1,5 мл дистиллированной воды, к ней добавляют 0,5 мл серной кислоты.
.2 Подготовка измерительной аппаратуры
Спектрофотометр готовят к работе согласно
инструкции по эксплуатации.
.3 Установление градуировочной зависимости
Для установления градуировочной зависимости
используют модельные образцы масел с известным содержанием фосфолипидов.
Для построения градуировочного графика готовят
раствор сравнения: в пробирку вместимостью 10 см3 отбирают пипеткой 0,3 мл 10 N
раствора серной кислоты, 0,3 мл 2,5% водного раствора молибденовокислого
аммония, 0,5 мл 0,25% водного раствора гидразинсульфата, объем раствора доводят
дистиллированной водой до 5 мл.
Затем в пробирку вместимостью 15 мл на весах 2
кл точности отвешивают 1 г образца масла с записью результата до второго
десятичного знака.
К содержимому пробирки последовательно приливают пипеткой 1 мл спиртоэфирного
раствора, что соответствует соотношению 1:1 и 1,5 мл 10 N раствора серной
кислоты. Пробирку плотно закрывают пробкой и интенсивно встряхивают в течение
60 сек. После разделения фаз пробирку осторожно открывают и пипеткой отбирают
0,3 мл водно-спиртового раствора.
Аликвотную часть переносят в другую пробирку,
добавляют пипеткой 0,3 мл 2,5% водного раствора молибденовокислого аммония, 0,5
мл 0,25% водного раствора гидразинсульфата и дистиллированную воду до метки 5
мл.
Смесь нагревают на кипящей водяной бане в
течение 10 мин, охлаждают и измеряют ее оптическую плотность в кювете толщиной
1 см при длине волны 670 нм по отношению к контрольной пробе.
По полученным данным строят градуировочный
график, откладывая на оси абсцисс величины концентрации фосфолипидов, а на оси
ординат - соответствующие значения оптических плотностей.
Каждая точка градуировочного графика должна
представлять собой среднеарифметическое значение результатов двух параллельных
измерений.
Градуировочный график строят параллельно с
проведением анализа. Он имеет вид прямой линии, с помощью которой по известному
содержанию фосфолипидов и измеренной оптической плотности строят градуировочный
график и определяют градуировочный коэффициент для постоянного объема
колориметрируемого раствора. Далее расчеты ведутся по формуле (1).
.4 Осуществление отбора проб
Проба, которую принимает лаборатория, не должна
быть повреждена или изменена в процессе тестирования и хранения. Отобранные
пробы хранят в стеклянных или полимерных бутылках.
Отбор проб осуществляют по ГОСТ 5471-83.
.5 Подготовка испытуемой пробы
Если проба при комнатной температуре не является
полностью жидкой, ее нагревают до температуры, не более чем на 10°C выше
температуры плавления.
Если проба в жидком виде не является однородной,
ее гомогенизируют путем тщательного перемешивания перед взятием навески для
исследования. Существенно, чтобы любой осадок, который может быть обогащен
фосфором, являлся включенным в гомогенизированный образец пробы.
Операции при выполнении измерений
В пробирку вместимостью 10-15 мл на весах 2
класса точности взвешивают 1 -2 г масла с записью результата до второго
десятичного знака. К содержимому пробирки последовательно приливают пипеткой
1-2 мл спиртоэфирного раствора из расчета 1:1 - 1:2 и 1,5 - 3,0 мл 10 N
раствора серной кислоты. Пробирку плотно закрывают пробкой и интенсивно
встряхивают в течение 30-90 сек. При анализе твердых жиров пробирку помещают в
водяную баню с температурой воды 40-50oC и при необходимости выдерживают в ней
в течение 30-90 сек, периодически встряхивая содержимое пробирки. После
разделения фаз пробирку осторожно открывают и пипеткой отбирают 0,3-0,6 мл
водноспиртового раствора, предварительно отметив его общий объем, который
должен быть в пределах 1,8-3,6 мл. Аликвотную часть экстракта осторожно
переносят в другую пробирку, добавляют пипеткой 0,3 мл 2,5% водного раствора
молибденовокислого аммония, 0,5 мл 0,25% водного раствора гидразинсульфата и
дистиллированную воду до метки 5 мл.
Смесь нагревают на кипящей водяной бане в
течение 10 мин, охлаждают и измеряют ее оптическую плотность в кювете толщиной
1 см при длине волны 670 нм по отношению к контрольной пробе.
Контрольная проба состоит из 0,3 мл 10 N
раствора серной кислоты, 0,3 мл 2,5% водного раствора молибденовокислого
аммония, 0,5 мл 0,25% водного раствора гидразинсульфата и дистиллированной
воды, добавляемой до объема 5 мл.
Операции обработки и вычислений результатов
измерений
Массовую долю фосфора (ω), в %,
рассчитывают, используя установленную градуировочную зависимость (п. 9.3), по
следующей формуле:

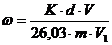 (6)
(6)
где
K - градуировочный коэффициент для постоянного объема колориметрируемого
раствора, г (для объема 5 мл K*100=0,055 г); - масса пробы масла, взятого для
анализа, г;- оптическая плотность экстракта;- объем 10 N раствора H2SO4, взятый
для экстракции;- аликвотная часть спиртоводной кислой фазы, взятой для
проведения колориметрической реакции.
Контроль
лабораторного смещения
Оценка
лабораторного смещения осуществляется по п. 5 СТБ 5725-4.
В
качестве эталонного материала при оценке лабораторного смещения используются
модельные образцы масел с известным содержанием фосфолипидов, установленным
другим стандартным методом, имеющим характеристики точности не меньше, чем у
методики, описанной в настоящем документе.
Контроль
стабильности результатов измерений в лаборатории
Проводится
по п. 6 СТБ 5725-6.
Требования
к оформлению результатов измерений
Результат
количественного химического анализа по данной методике представляют по
следующей формуле:
Х± 2∙ uc (7)
Где Х - результат анализа, мг/100 г;
- коэффициент охвата для выбранного уровня
доверия р=0,95; - суммарная неопределенность, мг/100 г.
Значения содержания фосфора в пробе и суммарная
неопределенность должны содержать одинаковое количество знаков после запятой.
Результат испытаний оформляют по форме,
установленной действующей в лаборатории системой регистрации данных.
Результаты должны включать следующую информацию:
наименование (шифр) пробы;
дату проведения измерений;
результаты измерений, включая все необходимые
данные и промежуточные расчёты;
результаты параллельных определений;
окончательный результат измерений;
значение приписанной или рассчитанной
погрешности измерения;
фамилию оператора.