Препараты серы. История открытия, анализ качества
Кафедра
фармакогнозии, фармацевтической химии и технологии лекарств ФПО
Реферат
Препараты
серы. История открытия, анализ качества
Студентки 3 курса 1 группы
Запорожского государственного
медицинского университета
Фармацевтического факультета
Гладской Юлии
Запорожье,
2015
Содержание
1.
Что представляет собой сера?
.
Физические свойства
.
Химические свойства
.
История открытия
.
Способы добывания
.
Биологическая роль серы в организме человека
.
Показания к применению
.
Препараты серы
.
Анализ качества
Список
литературы
1. Что представляет собой сера?
Сера - элемент 16-й группы (по устаревшей
классификации - главной подгруппы VI группы), третьего периода периодической
системы химических элементов Д.И. Менделеева, с атомным номером 16. Проявляет
неметаллические свойства. Обозначается символом S (лат. sulfur). В водородных и
кислородных соединениях находится в составе различных ионов, образует многие
кислоты и соли. Многие серосодержащие соли малорастворимые в воде.
. Физические свойства
Сера существенно отличается от кислорода
способностью образовывать устойчивые цепочки и циклы из атомов. Наиболее
стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую
и моноклинную серу. Это кристаллическая сера - хрупкое вещество жёлтого цвета.
Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями.
Такой состав имеет пластическая сера, вещество коричневого цвета, которая
получается при резком охлаждении расплава серы (пластическая сера уже через
несколько часов становится хрупкой, приобретает жёлтый цвет и постепенно
превращается в ромбическую). Формулу серы чаще всего записывают просто S, так
как она, хотя и имеет молекулярную структуру, является смесью простых веществ с
разными молекулами. В воде сера нерастворима, но хорошо растворяются в
органических растворителях, например в сероуглероде, скипидаре.
Плавление серы сопровождается заметным
увеличением объёма (примерно 15%). Расплавленная сера представляет собой жёлтую
легкоподвижную жидкость, которая выше 160°C превращается в очень вязкую
тёмно-коричневую массу. Наибольшую вязкость расплав серы приобретает при
температуре 190°C; дальнейшее повышение температуры сопровождается уменьшением
вязкости и выше 300°C расплавленная сера снова становится подвижной. Это
связано с тем, что при нагревании серы она постепенно полимеризуется,
увеличивая длину цепочки с повышением температуры. При нагревании серы свыше
190°C полимерные звенья начинают рушиться.
. Химические свойства
Горение серы
На воздухе сера горит, образуя сернистый
ангидрид - бесцветный газ с резким запахом:
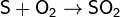
С помощью спектрального анализа установлено, что
на самом деле процесс окисления серы в двуокись представляет собой цепную
реакцию и происходит с образованием ряда промежуточных продуктов: моноокиси
серы S2O2, молекулярной серы S2, свободных атомов серы S и свободных радикалов
моноокиси серы SO. Восстановительные свойства серы проявляются в реакциях серы
и с другими неметаллами, однако при комнатной температуре сера реагирует только
с фтором:
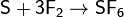
Расплав серы реагирует с хлором, при этом
возможно образование двух низших хлоридов (дихлорид серы и дитиодихлорид):
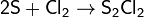
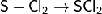
При избытке серы также образуются разнообразные
дихлориды полисеры типа SnCl2. При нагревании сера также реагирует с фосфором,
образуя смесь сульфидов фосфора, среди которых - высший сульфид P2S5:
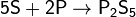
Кроме того, при нагревании сера реагирует с
водородом, углеродом, кремнием:
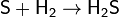 (сероводород)
(сероводород)
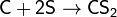 (сероуглерод)
(сероуглерод)
При нагревании сера взаимодействует со многими
металлами, часто - весьма бурно. Иногда смесь металла с серой загорается при
поджигании. При этом взаимодействии образуются сульфиды:
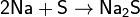
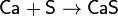
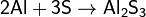
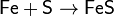
Растворы сульфидов щелочных металлов реагируют с
серой с образованием полисульфидов:
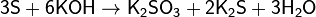
Из сложных веществ следует отметить, прежде
всего, реакцию серы с расплавленной щёлочью, в которой сера диспропорционирует
аналогично хлору:
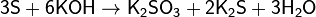
Полученный сплав называется серной печенью.
С концентрированными кислотами-окислителями
(HNO3, H2SO4) сера реагирует только при длительном нагревании:
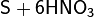 (конц.)
(конц.) 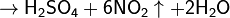
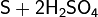 (конц.)
(конц.) 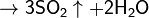
При увеличении температуры в парах серы
происходят изменения в количественном молекулярном составе. Число атомов в
молекуле уменьшается:
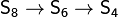
При 800-1400 °C пары состоят в основном из
двухатомной серы:
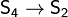
А при 1700°C сера становится атомарной:
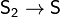
. История открытия
Сера в самородном состоянии, а также в виде
сернистых соединений известна с древнейших времён. С запахом горящей серы,
удушающим действием сернистого газа и отвратительным запахом сероводорода
человек познакомился, вероятно, ещё в доисторические времена. Именно из-за этих
свойств сера использовалась жрецами в составе священных курений при религиозных
обрядах. Сера считалась произведением сверхчеловеческих существ из мира духов
или подземных богов. Очень давно сера стала применяться в составе различных
горючих смесей для военных целей. Уже у Гомера описаны "сернистые
испарения", смертельное действие выделений горящей серы. Сера, вероятно,
входила в состав "греческого огня", наводившего ужас на противников.
Около VIII в. китайцы стали использовать её в пиротехнических смесях, в частности,
в смеси типа пороха. Горючесть серы, лёгкость, с которой она соединяется с
металлами с образованием сульфидов (например, на поверхности кусков металла),
объясняют то, что её считали "принципом горючести" и обязательной
составной частью металлических руд. Пресвитер Теофил (XII в.) описывает способ
окислительного обжига сульфидной медной руды, известный, вероятно, ещё в
древнем Египте. В период арабской алхимии возникла ртутно-серная теория состава
металлов, согласно которой сера почиталась обязательной составной частью
(отцом) всех металлов. В дальнейшем она стала одним из трёх принципов
алхимиков, а позднее "принцип горючести" явился основой теории
флогистона. Элементарную природу серы установил Лавуазье в своих опытах по
сжиганию. С введением пороха в Европе началось развитие добычи природной серы,
а также разработка способа получения её из пиритов; последний был распространён
в древней Руси. Впервые в литературе он описан у Агриколы. Таким образом, точно
происхождение серы не установлено, но, как сказано выше, этот элемент
использовался до Рождества Христова, а значит знаком людям с давних времён.
В древности и в средние века серу добывали,
вкапывая в землю большой глиняный горшок, на который ставили другой, с
отверстием в дне. Последний заполняли породой, содержащей серу, и затем
нагревали. Сера плавилась и стекала в нижний горшок.
5. Способы добывания
В настоящее время серу получают главным образом
путём выплавки самородной серы непосредственно в местах её залегания под
землёй. Серные руды добывают разными способами - в зависимости от условий
залегания. Залежам серы почти всегда сопутствуют скопления ядовитых газов -
соединений серы. К тому же нельзя забывать о возможности её самовозгорания.
При добыче руды открытым способом экскаваторами
снимают пласты пород, под которыми залегает руда. Взрывами рудный пласт дробят,
после чего глыбы руды отправляют на сероплавильный завод, где из концентрата
извлекают серу.
В 1890 г. Герман Фраш предложил плавить серу под
землёй и через скважины, подобные нефтяным, выкачивать её на поверхность.
Сравнительно невысокая (113°C) температура плавления серы подтверждала
реальность идеи Фраша. В 1890 г. начались испытания, приведшие к успеху.
Известно несколько методов получения серы из
серных руд: пароводяные, фильтрационные, термические, центрифугальные и
экстракционные.
Также сера в больших количествах содержится в
природном газе в газообразном состоянии (в виде сероводорода, сернистого
ангидрида). При добыче она откладывается на стенках труб и оборудования, выводя
их из строя. Поэтому её улавливают из газа как можно быстрее после добычи.
Полученная химически чистая мелкодисперсная сера является идеальным сырьём для
химической и резиновой промышленности.
Серу из природного сернистого газа получают
методом Клауса. Для этого используются так называемые серные ямы, где
происходит дегазация серы, на выходе получают модифицированную серу - продукт,
широко использующийся в производстве асфальта. Технологические установки для
получения серы обычно включают в себя ямы недегазированной серы, ямы дегазации,
ямы хранения дегазированной серы, а также налив жидкой серы и склад комовой
серы. Стены ямы обычно делают из кирпича, дно заливают бетоном, а сверху
закрывают яму алюминиевой крышей. Так как сера - это весьма агрессивная среда,
ямы периодически приходится полностью реконструировать.
. Биологическая роль серы в организме человека
Сера, необходимый для организма макроэлемент,
является обязательным условием для здоровых кожи, волос и ногтей, за что ее
часто называют "минералом красоты"
Сера участвует в обменных процессах в организме
и способствует их нормализации; является составным элементом ряда аминокислот,
витаминов, ферментов и гормонов (в том числе инсулина); играет важную роль
поддержании кислородного баланса; улучшает работу нервной системы; стабилизирует
уровень сахара в крови; повышает иммунитет; оказывает противоаллергическое
воздействие.
Улучшают усвояемость серы такие элементы как
фтор и железо, а такие как мышьяк, свинец, молибден, барий и селен наоборот
ухудшают ее усвоение.
А еще сера…
участвует в формировании хрящевой и костных
тканей, улучшает работу суставов и связок
влияет на состояние кожи, волос и ногтей (входит
в состав коллагена, кератина и меланина)
укрепляет мышечную ткань (особенно в период
активного роста у детей и подростков)
участвует в образовании некоторых витаминов и
усиливает эффективность витамина В1, биотина, витамина В5 и липоевой кислоты
оказывает ранозаживляющий и
противовоспалительный эффект
уменьшает суставные, мышечные боли и судороги
способствует нейтрализации и вымыванию шлаков и
токсинов из организма
стабилизирует уровень сахара в крови
помогает печени выделять желчь
повышает устойчивость к радиоизлучению
Суточная потребность
Суточная потребность взрослого здорового
человека в сере составляет 4-6 г.
Симптомы дефицита серы:
запоры
тусклость волос
ломкость ногтей
боли в суставах
тахикардия
аллергии
гипергликемия
выпадение волос
заболевания печени
Подтвержденная информация о токсичности серы,
содержащейся в пищевых продуктах, в различных источниках отсутствует.
Источники серы
Растительные
Капуста, лук, злаки, крупы, бобовые, горчица,
хрен, крыжовник, виноград, яблоки, чеснок, спаржа, хлебобулочные изделия.
Животные
Постная говядина, рыба, куриные яйца, молоко и
молочные изделия.
Показания к применению препаратов, содержащих в
составе элемент серы:
Сера и её соединения при местном действии на
кожу обладают кератопластическими, антипаразитарными и антисептическими
свойствами.
Сера действует антисептически, антипаразитарно,
в небольших концентрациях (до 10%) сера действует противовоспалительно и
кератопластически, способствуя формированию клеток эпидермиса.
В высоких концентрациях (более 10%) препараты
серы растворяют клетки эпидермиса (кератолитическое действие, обусловленное
образованием дисульфидов и сероводорода в глубоких слоях эпидермиса) и ведёт к
поверхностному шелушению кожи (отшелушивающее действие).
Небольшое количество серы может добавляться в
состав индифферентных средств, назначаемых в прогрессирующей стадии заболеваний
кожи. В регрессирующей стадии мази с добавлением серы применяются с учётом их
редуцирующих свойств.
Препараты серы, применяемые в дерматологии и
косметике часто содержат осаждённую серу, очищенную и коллоидную серу.
Органически связанная сера содержится в ихтиоле,
который оказывает противовоспалительное, местное обезболивающее и некоторое
антисептическое действие.
Входит сера и в состав мазей (серная мазь),
применяемых в официальной и народной медицине для лечения кожных заболеваний.
При приёме внутрь сера возбуждает перистальтику
толстого кишечника (вследствие образования в щелочном содержимом кишечника
сульфгидрата натрия и сероводорода) и действует как слабительное.
При выделении серы через дыхательные пути
возникает отхаркивающий эффект.
При парентеральном введении препараты серы
вызывают ряд реакций, характерных для неспецифической терапии раздражением,
повышают тонус вегетативной нервной системы и в ряде случаев усиливают
способность организма к обезвреживанию ядов эндогенного и экзогенного
происхождения (металлы, синильная кислота).
При внутримышечном введении суспензия серы
действует пирогенно (повышает температуру тела).
. Показания к применению
Применение препаратов серы:
Наружно (в 10-30% мазях) сера применяется в
дерматологии при лечении различных заболеваний кожи (экзема, чесотка, фурункулёз,
фолликулиты, псориаз, себорея, жирная себорея кожи лица, красные угри,
вульгарные угри, сикоз, отрубевидный лишай и др.);
Как отшелушивающие средства препараты серы
применяются при веснушках и пигментных пятнах;
Препараты серы применяются как лёгкие
слабительные средства при хронических запорах и геморое;
Как противоглистные средства при энтеробиозе
(глистной инвазии острицами);
Как неспецифические раздражающие средства при
хронических полиартритах, ишиасе (парентеральное введение серы);
При острых и хронических отравлениях тяжёлыми
металлами, в особенности ртутью, а также при отравлении синильной кислотой;
Для повышения температуры тела при лечении
прогрессивного паралича (пирогенная терапия) - в виде 2% суспензии по 0,3-1,0,
внутримышечно.
8. Препараты серы
Сера очищенная - применяется внутрь как лёгкое
слабительное и отхаркивающее средство, назначается для лечения энтеробиоза.
Наружно очищенная сера применяется в составе сложных мазей и присыпок при
кожных заболеваниях (псориаз, себорея, чесотка, сикоз и др.). Как
неспецифическое средство лечения используется для внутримышечного введения при
пирогенной терапии.
Сера осаждённая применяется наружно в виде мазей
(5%, 10%, 20%) или присыпок для лечения кожных заболеваний (сикоз, псориаз,
себорея и др.).
Коллоидная сера - Sulfur colloidale - играет
значительную роль в дерматологии, так как вследствие своей растворимости в воде
(до 10%) имеет много преимуществ перед нерастворимыми препаратами серы.
Серная мазь используется для смазывания
поражённых участков кожи при чесотке и других заболеваниях кожи.
Сульфозин - 1% стерильный раствор очищенной серы
в персиковом масле. Применяется в психиатрии (шизофрения, прогрессивный паралич
и др.) для пирогенной терапии.
Сульфолан - Sulfolan - мазь, содержащая 5% серы,
10% окиси цинка и 85% ланолина. Применяется при зудящих высыпаниях - чесотке,
экземе и др.
Тиолан - Thiolan - мазь, в состав которой входят
сера, нафталан, окись цинка, зелёное мыло, дёготь и бура. Применяется при
заболеваниях кожи, сопровождающихся кожным зудом.
Вилькинсона мазь
Международное название: Деготь+Мыло
зеленое+Нафталанская нефть+Сера (Pix liquida+Sapo viride+Naphthalan
petroleum+Sulfur)
Лекарственная форма: мазь для наружного
применения
Фармакологическое действие: Вилькинсона мазь -
комбинированный препарат; оказывает антисептическое, противовоспалительное,
противогрибковое и противопаразитарное действие.
Показания: Трихофития, чесотка; раны,
трофическая язва, пролежни.
Мозолин
Международное название: Салициловая кислота+Сера
(Salicylic acid+Sulfur)
Лекарственная форма: пластырь
Фармакологическое действие: Мозолин -
комбинированный препарат, оказывает антисептическое и кератолитическое
действие.
Показания: Сухие мозоли, омозолелости,
натоптыши.
Международное название: Аира масло+Мяты перечной
масло+Сера+Терпентинное масло (Acori calami oleum+Menthae piperitae
oleum+Sulfur+Terbinthinae oleum)
Лекарственная форма: капсулы
Фармакологическое действие: Олиметин -
комбинированный препарат растительного происхождения, действие обусловлено входящими
в состав препарата растительными эфирными маслами: оказывает спазмолитическое,
желчегонное и противовоспалительное действие.
Показания: Холелетиаз, нефроуролитиаз.
Салипод
Международное название: Салициловая кислота+Сера
(Salicylic acid+Sulfur)
Лекарственная форма: пластырь
Фармакологическое действие: Салипод -
комбинированный препарат, оказывает антисептическое и кератолитическое
действие.
Показания: Сухие мозоли, омозолелости,
натоптыши.
Серная мазь
Международное название: Сера (Sulfur)
Лекарственная форма: мазь для наружного
применения
Фармакологическое действие: Антисептическое
средство. При нанесении на кожу сера, взаимодействуя с органическими
веществами, образует сульфиды и пентатионовую кислоту, которые ...
Показания: Себорея, псориаз, чесотка.
Серно-дегтярная мазь
Международное название: Деготь+Сера (Pix
liquida+Sulfur)
Лекарственная форма: мазь для наружного
применения
Фармакологическое действие: Серно-дегтярная мазь
- комбинированный препарат для наружного применения. Деготь оказывает дезинфицирующее,
инсектицидное и местнораздражающее ...
Показания: Чесотка.
Серно-салициловая мазь
Международное название: Салициловая кислота+Сера
(Salicylic acid+Sulfur)
Лекарственная форма: мазь для наружного
применения
Фармакологическое действие: Серно-салициловая
мазь - комбинированный препарат для наружного применения. При нанесении на кожу
сера, взаимодействуя с органическими веществами, ...
Показания: Себорея, псориаз.
Солодкового корня порошок сложный
Международное название: Сенны лист+Сера+Солодки
корни+Фенхеля плодов экстракт (Sennae folia+Sulfur+Glycyrrhizae
radiсes+Foeniculi fructuum extract)
Лекарственная форма: порошок для приготовления
суспензии для приема внутрь, порошок для приема внутрь
Фармакологическое действие: Солодкового корня
порошок сложный - комбинированный препарат растительного происхождения,
оказывает слабительное действие.
Показания: Запоры, геморрой.
9. Анализ качества
Качественный анализ препаратов, содержащих
разнообразные соединения сульфура, а также среди них натрия тиосульфат и натрия
сульфат.
Натрия тиосульфат
(Natrii thiosulfas)
S2O3 . 5H2O
Впервые натрия тиосульфат получен в 1799 г.
кипячением смеси раствора сульфита натрия с серой:
SO3 + S → Na2S2O3
Окончание процесса устанавливают по
отрицательной реакции на сульфит ионы с раствором хлорида кальция.
Затем отфильтровывают избыток серы и сгущают
фильтрат до кристаллизации.
Этот способ используется и в настоящее время.
Источниками получения препарата могут служить сульфиды (Na2S и CaS) или
полисульфиды (CaS2), которые подвергают окислению кислородом или диоксидом
серы:
2Na2S + 3 SO2 → 2 Na2S2O3 + S↓
CaS2+3O2→2Ca2S2O3
Ca2S2O3 + Na2SO4 → Na2S2O3 + CaSO4
сера препарат биологический организм
Идентифицируют натрия тиосульфат по реакции на
ион натрия и тиосульфат ион. на Na+: окрашивание пламени в желтый цвет и
реакция с цинк-уранил ацетатом - желтый осадок. на S2O32-:
а) Na2S2O3+2HCl→SO2↑+2NaCl+S↓+H2O
запах, опалесценция диоксида серы
б) Na2S2O3+2AgNO3изб.→Ag2S2O3↓+2NaNO3
белый осадокSO3+S↓+H2O→Ag2S↓+H2SO4 желтеет, буреет, затем
чернеет
Доброкачественность
Допустимы: Cl-, Fe, тяжелые металлы.
Недопустимы: SO42- и сульфиты, открывают
добавлением 0,1 н раствора I2 до желтого окрашивания и последующим прибавлением
раствора Ba (NO3)2; раствор должен быть прозрачным.- открывают раствором
нитропруссида натрия в присутствии раствора аммиака; не должно быть фиолетового
окрашивания.
Na2S +Na2[Fe(CN)5NO] →
Na4[Fe(CN)5NOS]
Недопустимы так же Сa2+, As, селен.
Количественное определение
Йодометрия: метод основан на
окислительно-восстановительной реакции тиосульфата натрия с йодом:
+ 2Na2S2O3 → 2NaI + Na2S4O6
Процесс происходит в присутствии KI, при этом I2
образует сначала комплекс KI3, который затем взаимодействует с тиосульфатом
натрия. Индикатор - крахмал.
Хранят в хорошо укупоренной таре, так как в
сухом и теплом помещении - выветривается, а во влажном - расплывается, при 500С
плавится в своей кристаллизационной воде.
Применяют в качестве противотоксического и
десенсибилизирующего средства.
При отравлениях цианидами используют 10% раствор
тиосульфата натрия для связывания CN- и образования менее токсичных
тиоцианатов:
+ Na2S2O3 → KCNS+ Na2SO3
При отравлении солями тяжелых металлов (Ag, As,
Pb) тиосульфат натрия связывает их в малорастворимые сульфиды. Йод
восстанавливается до йодид-иона. При аллергии тиосульфат натрия вводят
внутривенно в виде 10-30%-ных растворов. Так же применяют наружно 60% раствор,
как инсектицид в составе жидкости Демьяновича.
Натрия сульфат декагидрат
SO4 . 10H2O
Получают из карбоната натрия действием кислоты
сульфатной:
Na2CO3+
H2SO4
→ Na2SO4
+ CO2 + H2O
Свойства: Кристаллический порошок белого цвета
или бесцветные прозрачные кристаллы. Легко растворим в воде, практически
нерастворим в 96-% спирте.
Идентификация: Субстанция дает характерные
реакции на сульфаты и натрий.
Количественное определение:
Субстанцию титруют раствором плюмбум нитрата в
присутствии HCl и метанола потенциометрически.
Na2SO4 + Pb(NO3)2 → PbSO4↓
+ 2NaNO3
2. Гравиметрия.
К
водному раствору субстанции добавляют раствор барий хлорида, полученный раствор
барий сульфата высушивают до постоянной массы и взвешивают:
SO4 + BaCl2 → BaSO4↓ + 2NaCl
(Sulfur ad usum externum)
Получение: Путем тщательного помола очищенной
серы на коллоидной мельнице. В результате образуется аморфный порошок
бледно-желтого цвета.
Свойства: Мельчайший бледно-желтый порошок без
запаха. Нерастворим в воде, растворим в смеси натрий гидроксида и этилового
спирта, а также в жирных маслах при нагревании. Растворим при кипячении в
спиртовом растворе натрий гидроксида.
Идентификация:
. Горит синим пламенем:
+ O2→SO2↑
. Раствор лекарственного вещества в
горячем пиридине в присутствии натрия гидрокарбоната при кипячении окрашивается
в голубой или зеленый цвет.
Количественное определение
Обратная алкалиметрия в присутствии окислителя,
индикатор - метиловый оранжевый.
Препарат растворяют в спиртовом титрованном
растворе калия гидроксида:
12S
+6KOH→ 2K2S5
+ K2S2O3
+3H2O
Спирт отгоняют, к избытку добавляют воду и
пергидроль:
S + 2KOH
+ 3H2O2
→ K2SO4
+4H2O
Избыток калий гидроксида оттитровывают кислотой:
+ HCl → KCl + H2O
Хранение: в закупоренной таре в сухом месте.
Применение: наружно при лечении кожных
заболеваний - псориаза, чесотки и др. Как противогельминтное средство при
энтеробиозе.
Список литературы
1. Сера,
химический элемент // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах
(82 т. и 4 доп.). - СПб., 1890-1907.
. Малышев
А.И Сера в магматическом рудообразовании. - ИГГ УрО РАН, 2004. - 189 с.
. Т.Л.
Богданова, Е.А. Солодова. Биология: Справочник для старшеклассников и
поступающих в ВУЗы. - М.: АСТ-ПРЕСС КНИГА. - 2011. - С. 85
. www.piluli.kharkov.ua/drugs/drug/2475/
. Глинка
Н.Л. Общая химия. - М.: "Химия", 1977, переработанное. - С. 382. -
720 с.
. Б.В.
Некрасов. Основы общей химии. - 3-е изд., исправленное и доп. - М.: Химия,
1973. - Т. 1. - 656 с.