|
Найменування
|
Категорія і номер НТД
|
Показники НТД, обов’язкові для
перевірення
|
Функціональне призначення
|
Допоміжні показники, рекомендовані
до перевірення
|
Примітка
|
|
1. Основна сировина
|
Калус клітин женьшеню ТУ
підприємства
|
Вміст сухої речовини, поліферальні
р-ни, спецефічність
|
Стимулююча біологічна активність
|
Поглинання УФ, стерильність, залиш
за екстрагенту
|
рекомендовано
|
|
2. Допоміжна сировина
|
Живильна середа для культури
рослинних клітин
|
Міжнародні стандарти
|
Для нарощення біомаси калустної
культури
|
Біологічна доцільність та
достатність
|
Обов’язково
|
|
3. Матеріали
|
Фільтри, детергенти, екстрагенти
|
Згідно ТУ підприємства
|
Екстракція, виділення, фасовка
|
Стерильність, безпечність, згідно
ст..МОЗ України
|
Обов’язково
|
|
4. Напівпродукти
|
Суцільний гомогенат клітин калуса
кореня женьшеню Густий екстракт панаксозидів
|
ТУ підприємства ТУ
підприємства
|
Первинна стадія для виготовлення
екстракту Спецефічність панаксозидів, УФ, СФ-спектроскопи,
ВЖХ-хроматографія
|
Щільність, густина, РН, вміст
сухих речовин, поліфеноли, вміст панаксозидів згідно ТУ Стерильність,
відсутність залишок, екстрагентів, алергійність
|
Згідно ТУ підприємства У галузі
|
3.2Характеристика
сировини, матеріалів та напівпродуктів
Показники,
що регламентують вимоги до якості сировини, матеріалів та напівпродуктів, що
використовуються у виробництві гензинозиду наведені у таблиці 3.1
Таблиці
3.1 - Показники, що регламентують вимоги до якості сировини, матеріалів та
напівпродуктів
3.3Обгрунтування вибору
технологічної схеми
Культура клітин вищих
рослин є альтернативним способом отримання рослинної сировини для медицини,
ветеринарії, парфумерії та харчової промисловості. Суть способу полягає в
отриманні біомаси культивованих клітин рослин у стерильних умовах в
біореакторах промислового обсягу. Суть методу виражається в наступному: з
одиничного рослини виділяють клітини і отримують за відпрацьованою технологією
культуру клітин цієї рослини, тобто клітини, здатні активно рости при
багаторазових пересіву. Для нарощування значних кількостей клітинної біомаси
використовують біореактори значних обсягів, аж до десятків куб. м. Часто
біомаса клітин in vitro перевершує за властивостями природне або плантаційне
сировину. На сьогоднішній день природні сировинні запаси лікарських рослин
виснажуються, багато видів (женьшень, золотий і маралів корінь, солодка)
знаходяться на межі зникнення. Плантаційний спосіб вирощування часто
нерентабельний, непридатний для тропічних рослин, рідкісних, зникаючих видів
лікарських рослин і передбачає використання гербіцидів, інсектицидів, що
негативно позначається на якості одержуваного сировини та її екологічності.
Таким чином, за відсутності ареалу виростання високоцінної лікарської рослини
або у зв'язку з його вкрай рідкісною зустрічаються на будь-якому з континентів
земної кулі отримання біомаси культур клітин виявляється незамінною. При цьому
аналоги розробляються в проекті лікарських засобів за хімічною структурою,
біологічної ефективності і спектру властивостей у світовій практиці фактично
відсутні.
Переваги біопрепарату:
Не дивлячись на те, що дані біологічні субстанції загальновідомі в світовій
практиці, пропоновані до комерціалізації біопрепарати є принципово новими
продуктами на відповідному ринку біопрепаратів:
) вперше пропонується
випускати клітинні біомаси, отримані в штучно відтворених «природних» умовах,
що стали можливими завдяки: - Оригінальному штаму клітинної культури,
створеному автором і не має аналогів у світі (де стабільний синтез вторинних
метаболітів у клітинах in vitro можливий тільки для з'єднань, що сприяють
проліферації клітин - ця концепція ефективно використовується для
цілеспрямованого отримання штамів-продуцентів культур рослинних клітин); -
Унікальної біотехнології відтворення клітинної маси, розробленої за участю
вчених МДУ і ІФР (не дивлячись на неодноразові спроби біотехнологів, заяву
аналогічного продукту на Західному ринку не відбулося саме через відсутність
рівноцінних стабільних технологій продукування клітинної маси, зокрема з
Dioscorea deltoidea. Автором вивчений зростання суспензійних культур клітин
рослин і розроблена ефективна система і способи їх вирощування, де
застосовуються закономірності росту культур клітин в періодичному,
напівпроточних, проточному (хемостат, закритий протока) режимах культивування в
біореакторах різної конструкції і обсягу).
) вперше пропонується
екстенсивно вийти на ринок космоцевтікі з біопрепаратом даного класу
(субстанції фуростанолового глікозидів стабільного контрольованого змісту), що
стало можливим завдяки розробленій за участю авторів тексту оригінальною
технологією масового виробництва субстанції з культивованої клітинної культури
Dioscorea deltoidea
) авторами розробки
реалізовані багаторазово менш трудомісткі і менш витратні методи виділення
діючої субстанції з клітинної маси.
) Продукція вирішує
проблеми споживачів:рядовий споживач вирішує для себе проблему забезпечення
доступним і, що дуже важливо - ефективним і безпечним лікувально-профілактичним
засобом за доступною ціною. Біопрепарат відповідає таким критеріям:
Широкий спектр дії
біопрепаратів;
Ефективність (явний
оздоровчий ефект);
Порівняно низька ціна;
Добрі рекомендації (від
лікарів, спеціалістів, які мають досвід збуту БАДів на ринку РФ, вченими і
т.д.)
Виробники вирішують для
себе проблему необхідності додаткової експансії на ринку, підвищення
конкурентоспроможності своєї продукції, що випускається. Так, виробники
харчової продукції, що орієнтуються на сектор продуктів функціонального
призначення (тут - лікувально-профілактичних продуктів харчування), отримують
можливість проривного виходу на ринок з продуктами незвичайного, досить нового
і широкого спектру лікувально-профілактичної дії. Виробники косметичної
продукції - кремів, бальзамів, пін і т. п. - отримують у своє розпорядження
інгредієнт, який будучи застосовуємо в мізерних кількостях (отже - мала
націнка) надає ефективну і зриме захисне і відновлює дію на шкіру. Для таких
виробників дуже важлива динамічна реакція споживачів на що випускається
косметичний продукт, так як вкладення в запуск і розкручування його на ринку,
як правило, вельми великі в цій області. Наявність таких яскраво виражених
актопротекторний характеристик у пропонованого препарату, на нашу думку, буде відразу
відзначено і підтверджено споживачами.
3.4 Характиристика
біологічного об’єкту
Основним типом
культивованої рослинної клітини є калус. Значно рідше культивують клітини
пухлин рослин різного походження. Культури пухлинних клітин незалежно від
способу культивування на рівні морфології мало відрізняються від культур
калусних клітин. Значною фізіологічною відміною між ними є гормононезалежний
пухлинних клітин, що дозволяє їм ділитися і рости на поживних середовищах без
добавок фітогормонів або їх аналогів. Однак пухлинні клітини позбавлені
здатності давати початок нормально організованим структурам. У деяких випадках
вони здатні утворювати тератоми (потворні органоподобні структури), нормальний
розвиток яких не походить. Калусні клітини в пересадковій культурі можуть
спонтано отримати гормононезалежність. Природа такої незалежності до ауксину і
цитокинин, найчастіше застосовуваним при вирощуванні клітинних культур рослин,
може бути генетичної (результат мутації) або епігенетичної (результат експресії
генів, що визначають гормононезалежність клітини). При генетичній
гормононезалежності калусні клітини поводяться як пухлинні, при епігенетичної
вони мають ознака в ряду перетворень клітина - рослина - клітина. Калусних
клітина, в результаті поділу якої виникає калусная тканина, або калус,
представляє один з типів клітинної диференціювання, притаманній вищій рослині.
Для рослини калус є тканиною, що виникає при виняткових обставинах (зазвичай
при травмах) і функціонуючої нетривалий час.
Ця тканина захищає
травмоване місце, накопичує живильні речовини для анатомічної регенерації або
генерації органу. Для отримання культивованих калусних клітин in vitro
фрагменти тканин різних органів вищих рослин (експланти) поміщають на штучне
живильне середовище в пробірки, колби, чашки Петрі. Процес отримання первинного
калусу і підтримка пересадковою культури вимагає строго стерильних умов. Для
цього за допомогою стерильних розчинів, що містять хлор або ртуть (гіпохлорити,
сулема, діацід), до яких для кращого змочування додані детергенти, стерилізуют
експланти, ретельно відмиваючи їх потім від використовуваного розчин стерильною
водою. Живильні середовища, розчини, інструменти, матеріали, необхідні для
роботи, стерилізують в автоклавах або сухожарових шафах. Всі маніпуляції з культурами
проводять в мікробіологічних боксах, опромінюваних перед роботою
ультрафіолетом, або ламінарбоксах, де стерильність досягається постійною
подачею стерільной повітря в робочий об'єм. Особливості дедіфференціровкі
клітин експланти і каллусогенеза залежать від епігенетичних характеристик
складових його тканин. Клітини спеціалізованих тканин, експлантованних на
живильне середовище, що містить мінеральні солі, джерела вуглецю, вітаміни і
гормоноподібні речовини, тобто структури, характерні для їх специфічної функції
в рослині, і повернутися до стану ділиться клітини. Часто експланти, що
використовують для отримання калусу, є фрагментом органу і включає тканини,
клітини яких по-різному диференційовані. Різне тканинне походження первинних
калусних клітин є однією з причин гетерогенності культури калусної тканини, так
як деякі функциональні особливості вихідних диференційованих клітин передаються
у ряді клітинних поколінь як стійкі модифікації або епігенетично успадковані
ознаки. У клітинах експланти, що складається з неподілених спеціалізованих
клітин, на самому початку культивування можуть спостерігатися зміни в
метаболізмі, що викликаються і травматичними синтезами, і діференцировка, і
підготовкою до процесу розподілу. Для розділення цих процесів можна застосовувати
предінкубацію експлантів на середовищі без гормонів протягом декількох діб
(3-6). Це дозволяє виключити не тільки зміни, пов'язані з травмою, але й
можливе неконтрольоване вплив ендогенних гормонів експлантати на досліджувані
процеси. У підготовлювану до поділу клітці стимулюється синтез всіх типів РНК,
зникають тканспеціфічні білки-антигени і з'являються білки, специфічні для
клітин, які діляться і калусної тканини. Це свідчить про зміну активності генів
і білкового апарату клітин при діференціровці. Освіта калусу не у всіх випадках
пов'язане з травматичним впливом. Калус може виникнути в результаті
проліферації внутрішніх тканин експланти без зв'язку з поверхнею зрізу.
Зростаючий калус розриває шари тканини і розвивається на поверхні. Освіта калусу
при експлантуванні фрагмента тканини в умовах in vitro свій-ного дводольним і
однодольних покритонасінних і голонасінних рослинам, папоротям, мохам,
печеночникам. Первинний калус, що виник на експланти через 4-6 тижнів (залежно
від швидкості росту клітин), переноситься на свіжу живильну середу
(субкультівіється). Розмір трансплантації при культивуванні на агаризованому
живильному середовищі зазвичай становить від 60 до 100 мг маси тканини на 30-40
мл живильного середовища. Таким чином, техніка культивування тканин рослин
дозволяє отримати тривалу пересадочних калусних культуру з будь-яких живих
тканинних клітин інтактного рослини. Клітини різному дифференцирувати (у тому
числі і меристематические) переходять in vitro до складного процесу
дедиференціації, втрачають притаманну їм структурне організацію і специфічні
функції і індукуються до справжньої, утворюючи первинний калус. [8] У процесі
субкультування формується штам, характеризує індивідуальними генетичними і
фізіологічним можливостям. При культивуванні рослинних клітин і при вирощуванні
культури тканин застосовуються середовища Мурасіге - Скуга, Нагата - Такебе,
Хеллера, Нича-Нича, Кнудсон та інші в різних модифікаціях. Основними
компонентами поживних середовищ для культури клітин і тканин рослин є мінеральні
солі (макро-і мікроелементи), джерело вуглецевого живлення (зазвичай сахароза
або глюкоза), вітаміни, регулятори росту. Іноді до складу поживних середовищ
включають комплексні органічні добавки (гідролізат казеїну або суміш
амінокислот, дріжджовий екстракт, екстракти з різних органів рослин).
Методи вирощування
культури калусних тканин
Поверхневе
культивування. Культура калусних
тканин вирощується поверхневим способом на напіврідкому агаризованому
середовищі (концентрація агару - 0,6-1%), де із застосуванням інших желюючих
полімерів або на містках з фільтрувального паперу або дисках з пінополіуретану,
занурених у рідке живильне середовище. Калусна тканина, що вирощується
поверхневим способом, представляє собою аморфну масу
тонкостінних паренхімних клітин, що не має чітко визначеної анатомічної
структури. Колір маси може бути білим, жовтуватим, зеленим або червоним;
пігментованим повністю або зонально.

Рисунок
3.4-Культивування калусу на живильному середовищі.
Залежно від походження і
умов вирощування калусних тканини бувають:
) пухкими, сильно
обводненими, легко розсипається на окремі клітини,
) середньої щільності, з
добре вираженіми меристематические вогнищами;
) щільними, із зонами
редукуватиго камбію і судин.
Як правило, в тривалій
пересадковою культурі, на середовищах, де є ауксини, особливо синтетичний
аналог ауксину - 2,4 - дихлор-феноксиуксусной кислоту (2,4 - Д), калусні
тканини втрачають пігментацію і стають більш пухкими. У циклі вирощування
калусні клітини після низки поділів проходять звичайний для клітини рослин
онтогенез: вони приступають до зростання розтягуванням, потім диференціюються
як зрілі калусниі клітини і, нарешті, деградують. Калусні клітини, вирощувані
поверхневим способом, часто застосовують для збереження в зростаючому стані
колекцій різних штамів, ліній, мутантів, для регенерації рослин, з них також
виходять суспензії клітин, культивованих в рідкому живильному середовищі. [4]
Суспензійне
культивування. Культури клітин
рослин, що вирощуються в рідкому живильному середовищі, зазвичай називають
суспензійного культурами. Термін цей не є строго науковим і точним, так як не
пояснює основний особливості поведінки клітин при такому вирощуванні. Отримано
ще порівняно мало культур клітин вищих рослин, за своїми параметрами повністю
задовольняють вимогам суспензіоного (глибинного) культивування. Значною мірою
це ґрунтується труднощами отримання культури клітин, що складається переваг
громадської з окремих клітин або невеликих їх агрегатів. Безумовно, вирощування
клітинних суспензій в рідкій живильної середи має ряд переваг перед
вирощуванням калусних клітин поверхневим способом. Суспензійні культури
зручніше для проведення біохімічних і молекулярно-біологічних експериментів -
вивчення індукції ферментів і зв'язку їх з подіями клітинного циклу, експресії
та репресії певних генів, ізолювання і характеристик мутантів. Суспензійну
культуру можна отримати з фрагментів органу рослини (диски запасаючої паренхіми
м'ясистих коренів моркви, петрушки, бульб картоплі та ін), проте цей шлях більш
трудомісткий і вимагає більшого часу. Клітини експланти повинні при цьому
утворювати первинний калус, і тільки після цього поверхневі калусні клітини, що
потрапили в рідку середу і розмножилися в ній, дадуть початок лінії, здатної
рости в суспензії. Зазвичай для отримання культури клітин використовується
культура калусной тканини. Пухкі обводнені культури калусних тканин більш
придатні для переведення в суспензію, ніж структуровані щільні калус[9].
Оптимальними підходами для отримання суспензії є вирощування калусів на
середовищі з 2,4 - Д, виключення з середовища іонів кальцію, обробка пектиназа
трансплантації, призначеного для вирощування в суспензійний культурі. Для
отримання культури клітин береться найбільш життєздатна частину калусної
тканини, а її кількість повинна бути в 15-20 разів більше в розрахунку на обсяг
живильного середовища, ніж при серійному культивуванні на агарі. При цьому може
використовуватися живильне середовище того ж складу, що і для поверхневого культивування,
але в деяких випадках збільшують кількість ауксинів і (або) зменшують кількість
цитокінів. Режим перемішування та аерації при ініціації культури клітин
зазвичай такий же, як і при подальших серійних субкультуванні культур клітин на
ролерах і гойдалках (кругова гойдалка -10-12 оборотів / хв). Освіта первинної
суспензії рослинних клітин можна вважають результатом трьох процесів:
1) розпадання калусної
тканини на клітини і невеликі клітинні агрегати в момент внесення в рідку
живильне середовище,
) відділення клітин і
клітинних агрегатів з поверхні шматочків тканини протягом перших
субкультуванні;
) ділення і росту
клітин, що утворилися по перших двох способів, і розростаються клітинних
агрегатів на більш дрібні агрегати і клітини. Останній процес є типовим для
зростання стабілізувати розщепленої культури клітин вищих рослин. Первинну
суспензію перед субкультивуванням або в спец. циліндрі поділяють на фракції за
швидкістю седиментації (викорис - товують вехньої фракцію), або фільтрують
через 1-2 шари марлі, нейлонові або металеві сита, щоб позбутися від великих
щільних шматків калусної тканини, залишків експланти і дуже великих агрегатів.
Фільтрування рекомендується і в кількох наступних субкультуваннях до придбання
клітинної суспензією бажаних характеристик. Однак агрегованість суспензії
залежить не тільки від характеристик початкової лінії, але і від умов
культивування. Для глибинного культивування рослинних клітин застосовують
способи, розроблені для мікробіологічних цілей. Використовують закриті або
відкриті системи в періодичному або проточному режимах. Хоча при глибинному
вирощуванні рослинних клітин принцип турбідостата практично не застосовується.
Однією з причин цього є руйнування частини клітин при відведенні їх до
оптичного приладу. Вирощування суспензії клітин рослин в установках
безперервного культивування за принципом хемостат застосовується як для
вивчення метаболізму клітин, стабільно підтримуються в різних фазах клітинного
циклу, так і при промисловому вирощуванні клітинної біомаси з метою отримання
економічно важливих продуктів. Однак до теперішнього часу найбільш вивченим і
поширеним режимом глибинного культивування клітинних суспензій є закрита
періодична система. У цьому випадку для аерації та перемішування суспензії
використовують ролери, гойдалки, ферментери з механічними і магнітними
мішалками або ферментера барботажного типу, де аерація і перемішування
здійснюється повітряним потоком. Критеріями росту в циклі вирощування служить
збільшення числа клітин, їх сирої та сухої маси. Модельна ростова крива має
типові Б-подібну форму (рис. 3.5).
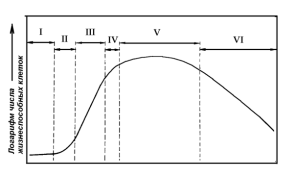
Рисунок 3.5-Модельна
ростова крива
На ній розрізняють: Фази
кривої зростання популяції рослинних клітин: I - лаг-фаза; II - експоненціальна
фаза; III - фаза лінійного росту; IV - фаза уповільненого зростання; V -
стаціонарна фаза; VI - фаза відмирання
) латентну (лаг) фазу, в
якій видимий ріст інокуляту не так видно не по одному з критеріїв. При цьому
спостерігається висока інтенсивність дихання, максимальні значення
енергетичного рівня, інтенсивний синтез ДНК, РНК, білків та інших компонентів
клітини, але низький мітотичний рівень. Тривалість періоду адаптації залежить
від кількості та фізіологічного стану інокуляту й умовний культивування;
) експонентну фазу, що
характеризується зростанням з максібітної швидкістю, максимальними величинами
мітотичної активності, а також переважанням дрібних клітин меристематичниго
типу;
) лінійну, протягом якої
швидкість росту постійна;
) фазу уповільненого
зростання, пов'язаного з субстратним лімітованих та інгібуванням продуктами
обміну, що характеризується незбалансованим зростанням популяції за основними
критеріями, зниженням рівня дихання, переходом частини клітин в диференційоване
складаючись, збільшенням частки великих вакуолізірованние клітин, збільшенням
синтезу вторинних метаболітів (серцевих глікозидів, антрахінону, диосгенина);
) стаціонарну фазу, що
характеризується ще малою швидкістю деградації клітин, яка врівноважується
поділом клітин, високіми біосинтетичними і біотрансформуються потенціями
життєздатних диференційованих клітин, низьким рівнем дихання і явищем
надзвичайно великих вакуолізуванням клітин;
) фазу деградації клітин
з питомою швидкістю росту, що приймає негативне значення. Форма реальних
ростових кривих може значно відрізнятися тривалістю фаз від модельної. Процеси
ростового циклу залежать від виду рослини, кількості внесеного матеріалу і умов
культивування (склад живильного середовища, температура, початкове значення рН,
склад газової фази, швидкість перемішування). Первинний і вторинний метаболізм
культивованих клітин рослин відоспеціфічний, залежить від типу диференціювання
вихідних клітин рослини і регулюється умовами вирощування. Генетична мінливість
клітин як наслідок їх культивування поза організмом, зникнення одних і поява
інших стійких ознак, що передаються у ряді клітинних поколінь, призводить до
виникнення з первинної калусної тканини генетично і фенотипічно розрізняються
ліній клітин. Це дозволяє відібрати або створити експериментально лінії, що
зберігають біосинтетичні системи, характерні для вихідної рослини, і лінії, що
синтезують принципово нові речовини. Культивування окремих клітин джерелом
окремих (одиночних) клітин є клітинні суспензії в рідкому живильному
середовищі, мацерація тканин рослин, ізольованої протопласти після відновлення
ними клітинної стінки. Причому ізольовані протопласти є ідеальними окремими
клітинами. Культивування окремих клітин дозволяє отримувати клони і
досліджувати генетичну і фізіологічну стабільність чи мінливість при
вирощуванні клонового матеріалу. Окремі клітини важливі для клонової селекції
мутантних, гібридних, трансформованої ліній. Зазвичай в ці клітини вводять
маркерні гени або створюють маркерні ознаки для забезпечення селективних умов
відбору. Мацерованної клітини тканини рослини є гарною моделлю для
порівняльного вивчення фізіологічних процесів в тканини і відслушною клітині.
Разом з тим при культивуванні цих клітин на середовищі, стимулюючої поділ
клітин, вони диференціюються і утворюють калусні клітини. Для отримання окремих
мацерованної клітин використовують спеціальні мацеріруєтся ферментативні
препарати, що містять мацеразу (полігалактуронази), пектиназу,
полівінілпіролідон, сульфат калію, сорбіт (маніт),
2-ГЯ-морфоліно-етансульфонова кислоту. Дана процедура проводиться в ламінарному
боксі в умовах суворої стерильності. Окремі клітини також можуть бути отримані
з суспензій із використанням мікроманіпулятора, проточного цитофлюориметрів або
шляхом послідовних розбавлень. У цьому випадку суспензії готуються різними
способами:
) 1 -2 мл суспензії
відбирають з супернатанта після осідання основної маси клітин,
) суспензію фільтрують
через фільтри з зменшеним діаметром пор. Для послідовних разкладів
використовують плати для мікротітрувань, що дозволяє мікроскопічно контролювати
клітинний склад при послідовних розведеннях.Індукція поділок окремих клітин
можлива при застосуванні дуже багатою живильного середовища, причому об'єм
середовища повинен бути мінімальним. Однак навіть при дотриманні всіх цих умов
відсоток розділилися клітин залишається дуже низьким. Більш ефективні методи
«годуючого шару» або «тканини-няньки». Для створення «годуючого шару» беруть
суспензію клітин того ж виду рослини. Клітинна суспензія повинна знаходитися в
ранній стадії ростового циклу. Калусна культура, що служить «тканиною-нянькою»,
також повинна бути в стадії активного зростання. При досягненні колонією, що
виросла з окремої клітини, розміра 0,5-1 мм, вона може бути перенесена для
подальшого вирощування на агаризоване живильне середовище безпосередньо або на
фільтр, поміщений на поверхню поживного агару. Використання «годуючого шару»,
«тканини-няньки» або мінімального обсягу середовища, в яку поміщається окрема
клітина, пов'язане з явищем, званим «дія фактора кондиціонування». Незважаючи
на численні спроби визначити природу речовин, які індукують поділ окреної
клітини, і механізм дії фактора кондиціонування, дане питання остаточно не
вирішене. Вивчення механізму взаємодії клітин при розмноженні їх в популяції -
важлива наукова проблема, яка вирішується на рівні культивування окремих
клітин. [9]
Принципи складання
поживних середовіщ
Всі живі клітини
потребуються екзогенних джерелах живлення, что тримаються в поживних
середовищах. Живильне середовище забезпечує жіттєдіяльність, ріст і розвиток
біооб'єктів. Перш ніж починати роботи з культівування різніх тіпів клітін,
звітність, точно знаті їх.
Постійнім компонентом
поживної середи є вода, в якій потребуються всі живі клітини. Живильні речовини
утворюють (мінеральнісолі, цукри, амінокислоти, карбонові кислоти, спирту,
альдегіди) або колоїдні (білки, ліпіді, неорганічні з'єднання) розчини. Деякі
компоненти поживних середовищ, що знаходяться в твердому агрегатному стані,
можуть або утворюваті придонних облог, або рівномірно розподілятіся по всьому
об'єму у вигляді суспензії, або плавати на поверхні розчин (частки вугілля).
Жидкі вуглеводні при внесенні у воду утворюють фракцію, что не змішується. У
живильному середовіщі повинні буті присутні всі елєменти, необхідні для
побудова компонентів живих клітін в доступній для усвійськовій формі. У великих
кількостях клітинам необхідні макроелементи: вуглець, азот, кисень, воден,
фосфор, сірка, калій, кальцій, магній. Постачання клітін киснем здійснюється за
рахунок води. Вуглець є складових частин всех органічних з'єднань и его джерела
численні и різноманітні: найчастіше цукри, багатоатомні спиртами и органічні
кислоти. У якості азотного субстрату для виготовлення поживніх середовищ
службовців у основного білки твариного і рослиного походження. Крім макроелементів,
клітини потрібні деяк мікроелементах: натрій, марганець, нікель, кобальт, хлор,
цинк, мідь, кремній, молібден, бор, ванадій и деякі інші. Крім основних
пластичних и енергетичних компонентів, живильне середовища може містити і так
звані чинниками зростання. Це органічні з'єднання (вітаміни, амінокислоти,
пурінові и пірімідінові підстави та ін), в яких потребуються ауксотрофності
клітини и які сінтезувати не в змозі. Відсутність таких речовин приводить до
порушення обмінних процесів и припиненням зростання клітин. В якості необхідніх
компонентів поживної середи можуть виступати гази: (КН3, Н2б), помірно (С02)
або погано (1ч2, 02, Н2, СН4) розчинні у воді. Живильні середовища можуть мати
невизначений склад, тобто включати біогенні добавки (рослиного, твариного або
мікробного оходження). Застосовують також середовища, приготовані з чисто
хімічних. Сполука у заздалегідь визначених співвідношеннях. Це так звані
синтетичні середовища. Застосування знаходять и полусинтичні поживних
середовища, що поєднують у своєму складі компоненти як натуральних, так и
синтетичних середовіщ. Середовіща даних типів мают як переваги, так и недоліки.
З Економічної точки зору
найбільш доцільно використання природного, більш дешевої сировини, ніж речовини
в чистому вигляді. Однак тільки застосування середи дозволяє точно реєструвати
и регулювати протікання в культуральному середовищі.
Процеси, які допомагають
їх оптімізації. Компромісним підходом є використання напівсинтетичних
середовищ, до складу яких поряд із з'єднаннями відомої хімічної природи входять
біогенні добавки. В якості біологічних добавок для індукції первинного калусу
можно використовувати рослинні екстракти (10-15% від загального обсягу
середовища): кокосове молоко (рідкий ендосперм кокосового горіха), витяжки з незрілих
зернівок кукурудзи (краще в період молочної стиглості), які містять цитокініни
- кинетин і зеатин (6-ти заміщені амінопурин) і NN-діфенілмочевіна.У культурі
in vitro застосовують рідкі та агаризовані (тверді) середовища. Рідкі
середовища використовуються для культивування суспензій, калусов, ізольованих
органів і тканин, рослин - регенерантів. При цьому для підтримки експлантів в
пробірці з середовищем поміщають спеціальні містки - підтримки з
фільтрувального паперу або синтетичних пористих матеріалів. Агаризовані
середовища готують на основі агар-агару - полісахариду, що входить до складу
морських водоростей, який утворює з водою гель при pH 5,6-6,0. іноді в якості
ущільнювача і замінника агар-агару використовують поліакриламідні гелі
(біогелі) P10 і P200. Для штучних поживних середовищ розчини макро-і мікросолей
готують заздалегідь і використовують багато разів. Це маткові (концентровані)
розчини. Їх зберігають у спеціальних умовах: макро-і мікросолі в холодильнику в
посудинах з притертими пробками при 0… +4 оС; вітаміни, фітогормони, ферменти,
рослинні екстракти - при-20 оС в невеликих по 5-10 мл посудинах з пробками
(пеніцилові флакони). Маткові розчини макросолей зазвичай перевершують
робітники по концентрації в 10-40 разів, мікросолей - в 100-1000 разів,
вітамінів - в 1000 разів. Розчини фітогормонів бажано готувати безпосередньо
перед роботою з середовищами. Для приготування маточного розчину макро-і
мікросолей кожну сіль розчиняють в окремому стаканчику при нагріванні, потім
зливають і доводять до потрібного обсягу. В охолоджену суміш мікросолей
останнім додають розчин солей молібдену, а в макросолі - розчин солей магнію
(для запобігання випаданню осаду). Маткові розчини хлористого кальцію і хелату
заліза (сірчанокисле залізо + ЕДТА, або Na ЕДТА - трилон Б) готують і
зберігають окремо від інших солей. Концентровані розчини вітамінів готують
наступним чином: 10-кратні навішування розчиняють у 10 мл дистильованої води
кожен окремо. Фітогормони - це речовини, які погано розчиняються у воді. Тому попередньо
100 мг речовини розчиняють у невеликих кількостях (0,5-2,0 мл) спирту (ауксини,
гібереліни), 0,5-1н HCl або КОН (цитокініни), потім підігрівають до повного
розчинення (крім абсцизовой кислоти і кінетіна) і доводять до 100 мл об'єму (1
мл містить 1 мг речовини). У таблиці представлено склад найбільш часто
використовуваних живильних середовищ. Як правило, починаючи працювати з новим
об'єктом, дослідники модифікують складу стандартних середовищ, особливо часто
варіюючи концентрації і набір органічних компонентів. Приватні приклади
поживних середовищ (рис. 3.6).

Рисунок3.6 - Приватні
приклади поживних середовищ
3.5
Опис технологічного процесу
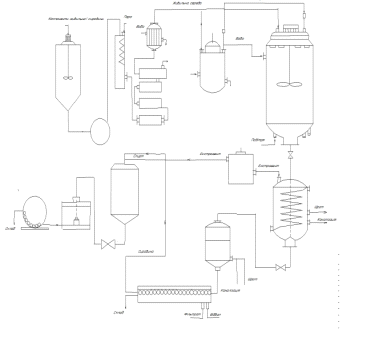
Рисунок
3.7-Гідро-пневматична схема виробництва гінзенозиду
СТ1.1-приготування
компонентів живильного середовища; Ст1.2.-підготовка води; Ст1.3-приготування
живильного середовища; ТП2-приготування спирту етилового; ТП3-нарощування
біомаси; ТП4-екстракція біомаси; ТП5-очищення витяжки; ТП6-відстоювання і
фільтрування напівфабрикату; ТП7-отримання настоянки; ПМВ1-розлив та
маркування; ПМВ2-пакування сухої речовини
Приміщення
для роботи з культурами клітин
Стерилізація
живильних середовищ, як і всі інші маніпуляції при роботі з клітинними культурами,
проводиться в боксових приміщеннях або в ламінарному боксах. Боксове приміщення
являє собою ізольовану кімнату з не сорбуючим пил покриттями, що має
передбоксник і забезпечену необхідним загальним і спеціальним освітленням,
системами припливної та витяжної вентиляції, холодним і гарячим
водопостачанням, а також підводами газів та стисненого повітря. Альтернативою
боксовим приміщенням, що вимагає менших витрат на устаткування, є
ламінар-бокси, або стерильні робочі місця. У цьому випадку в будь-якому приміщенні
може бути створений локальний стерільний об'ем, необхідний для роботи і створює
біологічну захист користувачів. Технічно завдання вирішується шляхом постійного
обдування місця проведення робіт ламінарним потоком. При роботі з завідомо
непатогенними матеріалами потік Обезпилення повітря з робочої зони виходить
безпосередньо в навколишній простір. У випадку роботи з потенційно патогенним
матеріалом повітря перед виходом з робочої зони додатково фільтрується,
можливість обдування оператора при цьому виключена. Залежно від пристрою
ламінар-боксу потік обезпилення повітря в робочій зоні може бути
горизонтальним, вертикальним або похилим.
Ламінар-бокс
з горизонтальним потоком. Обезпилення повітря типу УОБГ (установка
обеспилування біологічна з горизонтальним потоком) забезпечує очищення повітря,
що подається в робочу зону, шляхом фільтрації на фільтрах грубого і тонкого
очищення, вбудованих в прилад (у міру забруднення грубий фільтр промивається,
тонкий змінюється). Прилад має вбудовані джерела освітлення, УФ опромінення
(для стерилізації робочої зони в перервах між використанням боксу) і регулятор
швидкості повітряного потоку. [11]
Ламінар-бокс
для робіт з потенційно патогенними культурами типу БП-4004 («Бокс-Р») має деякі
відмінності. У приладі забезпечується рециркуляція повітряного потоку, яка
полягає в тому, що повітря з робочого об'єму потрапляє на спеціальний фільтр
тонкого очищення, звідки частина його виходить в навколишній простір, а решті
потік повторно проходить через фільтр тонкого очищення і знову надходить у
робочий об'єм. Цим досягається неможливість виносу оброблюваного матеріалу в
приміщення. Можливість потрапляння повітря, що виходить на оператора,
запобігається створенням зони підсосу на відкритій стороні робочого об'єму
боксу. Прилад має вбудовані джерела світла і УФ опромінення, стільницю з
нержавіючої сталі. Передню частина робочого об'єму закрита прозорим склом, що
переміщуються по висоті. Бокс забезпечений системою регулювання швидкості
потоку повітря і індикаторами забруднення фільтру тонкого очищення.
Перераховані
вище типи ламінар-боксів призначені для разміщення в будь-яких виробничих
приміщеннях, що мають припливну вентиляцію з грубої попередньої очищенням
повітря.
Прилади
та апарати для миття та стерилізації посуду. Прилади та апарати для миття та стерилізації посуду забезпечують
виконання всіх етапів технологічного процесу: попередню стерилізацію посуду, що
надходить з досвіду, насиченим водяною парою в парових стерилізаторах
(автоклавах); попереднє замочування у водних розчинах хімічних реагентів (5%
розчині гипохлоріта натрію, 3% розчині перекису водню і т.д.); полоскання після
замочування холодної або злегка нагрітою водою; миття гарячим розчином
детергенту з низьким піноутворенням; вторинне полоскання гарячою водою; фінішне
полоскання дистильованої або загальнолабораторною водою; сушку в сушильних
шафах з примусовою продувкою гарячим повітрям; упаковку і фінішну стерилізацію
в парових або повітряних стерилізаторах.
Оптимальним
варіантом для миття посуду є використання автоматичних мийних машин («Forma
Scientific», «Miele», «Hotpack-Heinicke» чи вітчизняних машин типу P3-AMM).
Прилади
для дозування, розведення і пробовідбор. У практиці робіт з клітинними культурами постійно виникає
необхідність масового дозування, пробовідбору або розведення біологічно
активних рідин. Для цього використовуються автоматичні або напівавтоматичні
пристрої, звані в різних джерелах дозатори-ділютори, автоматичні піпетки і т.
п.
Одним з
основних вимог до такого роду приладів є відсутність контакту між дозованим
розчином і частинами конструкції дозатора. Даним вимогам відповідають
напівавтоматичні та автоматичні шприцеві дозатори, які виробляють розведення
або дозування одночасно по двох каналах і можуть працювати як в автоматичному,
так і напівавтоматичному режимах.
Найбільш
часто вживаний автоматичний шприцевий дозатор типу «Дозатрон-4» призначений для
автоматичного дозування рідин в імунологічні планшети з мікрокювет. Обсяг
одиничної дози встановлюється залежно від цілей експерименту.
Піпетки
лабораторні типу ПЛ-01, дозатори піпеточні типу КДП-1 і П1 виробляють
напівавтоматичне дозування біологічно активних рідин. Піпетки лабораторні ПЛ-01
поставляються в наборах з 3 моделей. Величина дози задається користувачем у
певному діапазоні (2-20 мкл, 20-200 мкл, 200-1000 мкл). Комплект дозаторів
піпеточних КДП-1 включає 8 моделей, кожна з яких забезпечує видачу 2 фіксованих
за обсягом доз (від 5 до 1000 мкл). Комплект дозаторів П1 включає 5 моделей,
налаштованих на 1 фіксовану дозу (від 20 до 500 мкл). Всі зазначені типи
пристроїв припускають викокористування змінних наконечників, які можуть
піддаватися парової стерилізації і повторно використовуватися.
Описані
вище прилади дозволяють роботу з рідинами, нагрітими до 40° С і мають
в'язкість, близьку до в'язкості води. Тим самим не забезпечується дозування
поживних середовищ на основі агару, які для додання їм малої в'язкості повинні
бути нагріті до температури не менше 60о С. У таких випадках використовуються
прилади типу «Агар-1». Цей апарат для розливу поживних середовищ, що
складається з перистальтичного насоса-дозатора і розливного механізму,
обеспечити кільсть автоматичне одночасне заповнення протягом 1 хв 16 стеклянних
чашок Петрі діаметром 100 мм, що знаходяться в спеціальних планшетах. Стерильні
умови в апараті підтримуються шляхом УФ опромінення його внутрішнього об'єму.
В експериментах також
застосовуються пристрої малої лабораторної техніки, які не є за своєю суттю
дозаторами, але здатні полегшити цей процес. Це так звані прилади «Pipet-Aid»
(фірми «Flow», «Bellco», «Cole-Parmer» та інші), призначені для проби-відбору і
видачі дози при роботі з піпетками Пастера і будь-якими градуйованими піпетками
ємністю до 75 мл. Піпетка вставляється в спеціальний тримач, з'єднаний з
малогабаритним вакуумним насосом, що знаходяться або безпосередньо в тримачі,
або автономно. Управління роботою приладу проводиться натисненням кнопок,
розміщених на утримувачі[6].
Огляд та підготовлення
обладнання перед використанням
Під підготовкою
обладнання має на увазі очищення, миття та дезінфекційну обробку внутрішніх і
зовнішніх його поверхонь.
Підготовку обладнання
проводять перед початком або після закінчення технологічної операції, або в
кінці зміни. Її слід проводити у спеціальному одязі, призначеної для роботи у
виробничих приміщеннях відповідного класу чистоти і, при необхідності, в
респіраторі.
Для обробки обладнання
рекомендується використовувати поролонові губки або серветки з тканини без
ворсу із закладеними краями. При необхідності слід застосовувати щітки або
лопатки з синтетичних матеріалів, а також застосовувати пилосос. Після
використання матеріали перуть, а інвентар миють у розчині теплої води з миючим
засобом, потім прополіскують у чистій водопровідній воді, висушують у
спеціально призначеному для цього місці. Перед використанням матеріали та
інвентар знезаражують у розчині дезінфікуючого засобу.
Перед початком
підготовки відключають від електричного струму обладнання та електроприлади.
Видаляють за допомогою щіток, лопаток, пилососа або вологої серветки механічне
забруднення або пил з зовнішніх і внутрішніх поверхонь обладнання. Рідини
витирають, а при необхідності використовують засоби для знежирення. Обладнання
миють спочатку теплою водою (45 ±5) ºС з миючим засобом, потім промивають водою очищеною і висушують
або витирають насухо.
Проводять дезінфекційну
обробку, протираючи поверхні дезинфікуючим розчином або витримуючи в ньому.
Після дезінфікуючої обробки обладнання промивають гарячою водою очищеною.
Після
закінчення підготовки обладнання оформлюють відповідний протокол, який
підписується відповідальними особами за підготовку цього обладнання. Якість
підготовки обладнання контролюється представником відділу контролю якості.
Обладнання маркують, вказуючи його готовність до роботи. Зберігати обладнання
необхідно в чистому і сухому стані.
Вирощування
біомаси штаму-продуцента R1
Проростки
насіння женьшеню справжнього Panax ginseng CA Mеy тримісячного віку, інокулював
агробактерій Agrobacterium rhizogenes A4. Пухлини, отримані на стеблах
проростків в місцях інокуляції бактерій, переведені в стерильну культуру і є
вихідним матеріалом для отримання калусу штаму R1. Насіння женьшеню справжнього
Приморської популяції отримані з Зональної дослідної станції Всесоюзного
інституту лікарських рослин (сел. Стара Варварівка Приморського краю).
Культуральні
властивості. Зростаюча калусна
культура являє собою тканину пухкої консистенції світло-зеленого кольору, рідше
жовто-зеленого кольору без запаху. Ростової індекс культури 14 ± 2 по сирому
вагою для калусів початковою масою 80 мг, вміст сухої речовини 5,3 ± 1,3% Живих
клітин в середині експоненційної фази росту 90-94%
Спосіб
культивування вирощування в накопичувальному режимі на агаризованому живильному
середовищі за відсутності освітлення при температурі 25 ± 1оС, відносної
вологості повітря 70 ± 10% на живильному середовищі наступного складу, мг / л
води: NH4NO3350-450, KNO3 1500-2300, CaCl2,2H2O 400-480, MgSO4, 7H2O 350-400,
KH2PO 150-190, H3BO3 4,2-8,0, MnSO4.4, H2O 15,6-26,7, CoCl2, 2H2O 0,02-0,03,
CuSO4 ˙, 5H2O 0,02-0,03, ZnSO4,7H2O 6,0-10,3, Na2MoO4,2H2O 0,2-0,3, KJ
0,53-0,90, FeSO4,7H2O 25,0-30,6, Na2EDTA, 2H2O 33,6-41,0, тіаміну гідрохлорид
0,15-0,25, піридоксину гідро-хлорид 0, 4-0,6, нікотинова кислота 0,4-0,6,
мезо-інозит 80-120, казеїну гідролізат 80-1204-, хлорофеноксі-оцтова кислота
(А-СРА) 0,35-0,45, сахароза 23000-30000, агар 5800-6200рН, середовища до
автоклавування 5,6-5,8, каллус пасеруйте з інтервалом 30 діб. Номер пасажу
19-й. [13]
Цитологічна
і каріологічна характеристики штаму.
Тканина складається на 86-94% з клітин меристематичних типу круглої або
овальної форми розміром в середньому 57 х 67 мкм, і з клітин паренхімних типу
подовженої форми розміром в середньому 80 х 160 мкм. Крива мітотичної
активності має одновершинний характер з максимумом на 9-й день культивування. Середнє
число хромосом 56 ± 6 з варіацією від 24 до 190. Здатність до морфогенезу.
Спостерігається рідко спонтанний ризогенез при збільшенні тривалості
культивування калусыв в пасажі до 1,5-2,0 місяців.
Характеристика
біосинтезу гінзенозидів. Штам
продукує гінзенозиди (глікозиди дамароновой групи) Rg1, Re, Rf, NG-R2, Rb1, Rc,
Rb2, Rd в кількостях, порівнянних з їх змістом до коренях плантаційний рослин.
Гінзенозиди в середу культивування не виділяються. Загальний вміст гінзенозидів
(Rg1, Re, Rf, NG-R2, Rb1, Rc, Rb2, Rd) у калусах штаму R1 4,3 ± 1,0 мг / г
сухої маси.
У колби
Ерленмейера ємністю 100 мл розливають по 30 мл живильного середовища наступного
складу, мг / л води: NH4NO3400, KNO31900, CaCl2,2H2O 440, MgSO4,7H2O 370,
KH2PO4170, H3BO36,2, MnSO4,4H2O22,3, CoCl2,2H2O 0,025, CuSO4,5H2O 0,025,
ZnSO47, H2O 8,6, Na2MoO4,2H2O 0,25, KJ 0,83, FeSO4,7H2O 27,8, Na2EDTA, 2H2O
37,3 тіаміну гідрохлорид 0,2, піридоксину гідрохлорид 0,5; нікотинова кислота
0,5, мезо-інозит 100, казеїну гідролізат 1004, хлорофеноксі-оцтова кислота
(4-СРА) 0,4, сахароза 25000, агар 6000, рН до автоклавування 5,6. [13].Колби із
середовищем автоклавують при 117оС протягом 20 хв, потім охолоджують. На
поверхню агару поміщають калус штаму R1 в кількості 0,5 г на кожну колбу.
Культуру інкубують у темряві при 25оС і відносної вологості повітря 70%
протягом 30 діб. Потім калус витягують з колб і зважують. Після ліофільної
сушіння калусів в них визначають зміст гінзенозидів за методом, розробленим в
Тихоокеанському інституті біоорганічної хімії ДВО АН СРСР (Маханьков В.В.
Самошина Н.Ф. Малиновська Г.В. Атопкіна Л.М. Денисенко В.А. Ісаков В.В.
Калиновський А.І. Уварова Н.І.) Аналіз глікозидів дамаранового ряду в природних
і синтетичних сумішах методом високоефективної рідинної хроматографії. (Хімія
природних сполук, 1990, №1, с. 57-61).Для цього суху біомасу штаму R1 вичерпно
екстрагують 70%-ним водним метанолом. Отриманий упаренний екстракт розчиняють у
70% водному метанолі. Отриманий упаренний екстракт розчиняють у воді і
послідовно екстрагують спочатку пентаном, а потім насиченим водою н-бутанолом.
Бутанольна частина упарюють при зниженому тиску до постійної ваги, потім
розчиняють у метанолі. Отриману суму гінзенозидів аналізують за допомогою
мікроколончатого хроматографа «Міліхром» зі сталевими колонками 64 х 2 мм,
заповненими сорбентом «Сферісорб» ОДС 5 мкм. Елююють градієнтом суміші
ацетонітрил вода від 20:80 до 50:50. Час поділу 25 хв, витрата розчинника 2,5
мл. Детектування елюата здійснюють при 204 нм.
Пріготування
живильного середовища
Завдання
фахівця, оптимізуючого склад середовища для конкретного виду клітини, - вибрати
такі джерела вуглецю, азоту, фосфору та інших речовин, які найбільш виправдані
в економічному та екологічному відношеннях.
Принцип
складання поживних середовищ. Кожен конкретний вид клітин, що використовуються
в біотехнології, суворо вибірковий до живильних речовин. Потреба клітини в тих
чи інших з'єднаннях визначається фізіологічними особливостями даного виду
клітини, але у всіх випадках середовище має бути водним розчином цих
речовин і забезпечувати в певній кількості їх приплив у клітку.
Найважливішою
умовою приготування поживних середовищ є дотримання правил асептики. Для
знезараження поживних середовищ застосовують, як відомо, хімічний вплив
(дезінфекцію), вплив температури та інших фізичних факторів (ультразвуку,
ультрафіолетових променів, ультрафільтрації). Кожен з цих методів вельми
вибірковий. У біотехнології широко застосовують термічні методи знезараження
поживних середовищ (автоклавування, стерилізацію, кип'ятіння тощо). Спори
мікроорганізмів більш стійкі до високої температури, тому саме спори бактерій є
лімітуючим фактором, що визначає температурні режими стерилізації середовищ.
Для
стерилізації повітря в разі аеробних процесів культивування використовують
фільтрування і ультрафіолетове опромінення
Постійним
компонентом поживних середовищ є вода, в якій потребують всі живі клітини.
Живильні речовини утворюють у воді істинні (мінеральні солі, цукру,
амінокислоти, карбонові кислоти, спирти, альдегіди) або колоїдні (білки,
ліпіди, неорганічні сполуки) розчини. Деякі компоненти поживних середовищ, що
знаходяться в твердому агрегатному стані, можуть або утворювати придонний осад,
або рівномірно розподілятися по всьому об'єму у вигляді суспензії, або плавати
на поверхні розчину (частки вугілля). Рідкі вуглеводи при внесенні у воду
утворюють незмішану фракцію.
В
якості необхідних компонентів поживних середовищ можуть виступати гази: добре
(КН3, Н2б), помірно (С02) або погано (1ч2, 02, Н2, СН4) розчинні у воді.
Живильні середовища можуть мати невизначений склад, тобто включати біогенні
добавки (рослинного, тваринного або мікробного походження), наприклад м'ясної
екстракт, дріжджовий екстракт, кукурудзяну муку, морські водорості і т.д. Такі
живильні середовища називаються натуральними. Застосовують також середовища,
приготовані з чисто хімічних сполук у заздалегідь визначених співвідношеннях.
Це так звані синтетичні середовища. Застосування знаходять і напівсинтетичні
поживні середовища, що поєднують у своєму складі компоненти як натуральних, так
і синтетичних середовищ.
Устаткування
для очищення води
Якість
води, що використовується для приготування поживних середовищ або для миття
культурального посуду, має важливе значення. До недавнього часу така вода
приготовувалася шляхом простої і дворазовою дистиляції питної води. В даний час
поряд з традиційними широке застосування отримали методи очищення води шляхом
використання фізико-хімічних процесів зворотного осмосу, іонного обміну та
мембранної фільтрації. Водопровідна вода, що використовується в якості вихідної
і пройшла в цих установках через очищення зворотним осмосом, надходить на
фільтри з активованого вугілля, з них - на колонки з іонообмінними смолами і
потім - на мембранні фільтри з діаметром пор 0,22 мкм. При необхідності вода
додатково піддається впливу потужного потоку УФ опромінення. Для очищення води
подібним способом найбільш часто застосовуються установки типу, які з двох
конструктивно самостійних частин, що допускають незалежне використання.
Установка здійснює приготування загальнолабораторні води, висхідній за якістю
очищення дистильовану воду. Установка призначена для отримання придатної для
приготування поживних середовищ надчистої з загальнолабораторній або
дистильованої води. [10]
Приготування
спирту етилового
Спирт
етиловий 96% надходить па фармацевтичну фабрику від спиртзаводів в цистернах
або спиртових бочках і зберігається в спиртосховище.
При
надходженні кожна партія спирту етилового проходить вхідний контроль згідно з
ГОСТ 5962-67, ГОСТ 5964-93, ФС 42-3072-94, изм. 1. В кількості добової потреби
галенового цеху, спирт за вагою передається в цех, де зберігається в приймачі.
Розрахунок кількості спирту етилового 96% і води очищеної для приготування
спирту 70% ведуть відповідно з «Алкоголеметрическими таблицями» ГФ XI.
Приготування спирту етилового 70% проводять в ємності для приготування
водно-спиртових сумішей.
У
ємність, встановлену на вагах, перекачують з приймача спирт етиловий 96% по
вазі, і туди ж перекачують воду очищену із збірки для зберігання води очищеної
за вагою. Отриману водно-спиртову суміш перемішують мішалкою протягом 10 хвилин
при тиску стисненого повітря 0,1-0,15 кг/см2. Апаратник заміряє спирт
спиртоміром. На цій стадії отримують 435,6 кг спирту етилового (69,96%. про.).
Приготування
спирту етилового 70% проводять у три прийоми: 217,8 кг, 108,9 кг і 108,9 кг.
Виходячи при цьому з наступних розрахунків: при приготуванні першої порції
водно-спиртової суміші змішують 143,2 кг спирту етилового 96,7% і 74,6 кг води
очищеної; для приготування другої та третьої порцій водно-спиртової суміші
змішують з 71,6 кг спирту етилового 96,7% та 37,3 кг води очищеної. Всього на
стадії приготування етилового спирту 69,96% використовують 286,4 кг спирту
етилового 96,7% і 149,2 кг води очищеної. Вихід на стадії становить 99,9%
Обладнання
культуральних лабораторій
Лабораторні
термостати. Лабораторні термостати
для культивування клітин повинні відповідати ряду спеціальних вимог:
)
забезпечувати високу стабільність підтримки заданої температури,
)
створювати мінімальний градієнт температури по корисного об'єму;
) мати
системою швидкого відновлення температури після короткочасного відкривання
корисного об'єму;
)
внутрішній обсяг повинен виготовлятися з біологічно пасивних матеріалів, тобто
не впливають на життєдіяльність клітин і стійких до впливу компонентів поживних
середовищ. Матеріали і покриття внутрішніх та зовнішніх частин конструкції
термостата повинні дозволяти деконтамінацію водними розчинами спирту
ректифікату і стерилізацію УФ опроміненням.
ССБ-інкубатори.
Необхідність підтримки постійної
величини рН в живильному середовищі і її мінімального випаровування в період
інкубації клітин привела до розробки спеціальних приладів, аналогічних описаним
вище термостатам. Головною відмінністю є наявність систем створення і підтримки
певного складу газового середовища в корисному об'ємі і високої відносної
вологості в ньому. Це так звані інкубатори, що випускаються фірмами «Heraues»,
«Hotpack», «Flow».
Газове
середовище в камерах СО2-інкубатора містить підвищену концентрацію кисню і
вуглекислого газу, а в більшості випадків тільки вуглекислого газу. Розмір
концентрації задається за умовами культивування та підтримується автоматично. У
автоматичних СО2-інкубаторах заданий склад газового середовища підтримується
дозованим надходженням потрібного газу в потік очищеного від пилу зовнішнього
повітря, що подається у внутрішній обсяг приладу. Інший різновидністю
інкубаторів є так звані газопроточні інкубатори, де подача потрібних газів
проводиться безперервно, а процентний вміст досягається зміною швидкості
протоку.
Культивування
калустної тканини
Лабораторні
ферментери. Це комплекси приладів і
апаратів для масового суспензійного або глибинного культивування клітинних. У
лабораторній практиці ферментери застосовуються для ведення науково-дослідних
робіт або відпрацювання технології масового культивування (пілотні
біореактори).
У
загальному випадку ферментер складається з культиваційних судини, насосів і
сполучних трубопроводів (для подачі живильного середовища, газів, інокуляту та
відбору продукту), вимірювальних приладів і регуляторів, керуючих температурою
середовища в посудині, її рН, окислювально-відновним потенціалом та іншими
параметрами. У лабораторній практиці найбільш часто застосовуються ферментери з
ємністю судин від 1 до 20 л, для відпрацювання технологій - від 30 до 400 л. У
всіх випадках живильним середовищем заповнюється не більше 75% обсягу судини.
Вирощування
проводили в ферментере загальним обсягом 630 л (1Т, ОКБА, Йошкар-Ола) у
напівбезперервний режимі. Перемішування і аерацію суспензії здійснювали шляхом
барботажа стерильним повітрям при температурі 26 +1 оС. Визначали сиру і суху
масу, число клітин і життєздатність культури. Зміст семи тритерпенових
глікозидів (Rb1, Rb2, Rc, Rd, Rf, Re, Rg1) визначали методом ВЕРХ.
Було
проведено три послідовних циклу вирощування, загальний час кукси-вірування
склало 55 діб. Перший цикл вирощування (14 діб) здійснювали з використанням
сахарози, виробництва MERK (25г / л); другий і третій (по 21 діб) сахарози
марки MERK + цукру-рафінаду (1,25 г. / л +1,25 г. / л).
При
аналізі ростових характеристик культури, найбільше накопичення біомаси склало
9,48 г. / л (суха вага) наприкінці першого субкультивування, яке проводили з
використанням сахарози високого ступеня очищення. Питома швидкість росту в
експоненціальної фазі (м) склала 0,16 сут. - 1. У варіантах з використанням
сахарози харчового і хімічного очищення максимальне накопичення біомаси склало
приблизно 7 г / л по сухому вазі. Максимальна питома швидкість росту склала
0,10 сут-1. Загальна кількість гінзенозидів в біомасі також мало істотні
відмінності: в кінці першого циклу вирощування воно склало 2,17% до сухої маси
клітин, при додаванні в живильне середовище сахарози харчової ступеня очищення,
вміст гінзенозидів знизилося до 1,18% до кінця другого циклу вирощування і 0,74
\% до кінця третього.
Частини
ферментерів, що контактують з живильним середовищем (судини, з'єднувальні
трубопроводи, насоси та ін), виготовляються з біологічно пасивних, хімічно
стійких матеріалів, що дозволяють виробляти стерилізацію насиченим водяною
парою (якісна нержавіюча сталь, фторопласт, боросилікатне скло, силіконова
гума).
Більшість
перемішувальних і аеруючих культур під час росту утворюють досить багато піни.
Утворення на поверхні середовища культивування шару з бульбашок пов'язано з
наявністю в середовищі поверхнево-активних речовин (ПАР), до числа яких
відносяться продукти розпаду жирів - мила, а також білки. ПАР включають як
полярні іонні, так і неполярні угруповання. Заряджені групи мають спорідненість
до водній фазі, а нейтральні виштовхуються в повітряну фазу, де, вбудовуючись в
стінки газових бульбашок, збільшують час їхнього життя. Помірне піноутворення
сприяє зростанню багатьох рослинних клітин (пінний шар - кисневий коктейль).
Особлива увага приділяється боротьбі з надлишковою піноутворенням, якщо не
преперешкоджати цьому, піна змочує фільтри для стерилізації повітря, що
призводить до контамінації культури сторонньої мікрофлорою, зменшення корисного
об'єму біореактора, а також виходу піни назовні. Контроль піноутворення
здійснюється шляхом введення в судину спеціального датчика. Для боротьби з
надмірною піноутворенням використовується механічне та хімічне піногасіння. При
механічному піногасіння лопаті піногасника розміщуються на валу мішалки. При хімічному
піногасінні в кришці посудини передбачається спеціальний введення для реагенту
гасіння. Хімічні піногасники більш дешеві, їх використовують час від часу при
необхідності придушення піноутворення. Однак при додаванні цих речовин може
змінюватися склад живильного середовища. Піногасячі речовини рослинного
(кукурудзяна, рицинова, соєва, соняшникова олія, олія з насіння бавовнику та
інші) і тваринного (свинячий, яловичий, баранячий, китовий та інші жири)
походження можуть служити мікроорганізмам джерелом вуглецю та енергії і, отже,
стимулювати їх активний розвиток. Однак відомі випадки, коли природні
піногасники чинили негативний дію на метаболізм клітини. А такі
неметаболізовані піногасники, як силікони, у високій концентрації токсичні.
Тому піногасники, які є поверхнево-активними речовинами, слід використовувати
тільки в дуже низьких концентраціях і лише після ретельної перевірки.
Піногасники додають безпосередньо у середу перед стерилізацією або в ферментер
через спеціальний введення. На оптимальної живильному середовищі при
сприятливих значеннях рН і температури, за умови подачі необхідної кількості
повітря в середу клітин швидко починають рости і розмножуватися, забезпечуючи
накопичення біомаси продуцента і біологічно цінних метаболітів в культуральній рідині.
Для культивування рослинних клітин в промислових масштабах застосовують
ферментери (або ферментатори) - реакційні ємності, в яких за певних умов
знаходяться клітини. Основне призначення ферментатора - своєчасно забезпечити
клітини необхідними поживними речовинами і киснем (при необхідності) і відвести
продукти обміну речовин, створити однорідний склад середовища за умови слабкого
потоку культуральної рідини (при безперервному культивуванні). Для підтримки
кисневого режиму ферментатор забезпечується пристроєм підведення повітря, для
кращого перемішування середовища - мішалками різної конструкції. Для підтримки
температури середовища передбачені системи охолодження. [10]
Аератори.
Для забезпечення аерації
культурального середовища - постачання киснем - використовують повітря, а також
повітря, збагачене киснем, рідше - чистий кисень. Процеси, що протікають без
доступу кисню (анаеробні), залежать від газоподібних субстратів і вимагають
відводу газообразних продуктів життєдіяльності. Аератори - основний приклад
функціонуючих систем газопостачання та газовідводу.
Лабораторні
струшувачі. Велике значення в
оснащенні лабораторії, призначеної для культивування клітин, мають прилади, що
забезпечують примусове перемішування поживних середовищ з поміщеними в них клітинними
культурами, забезпечуючи кращий газообмін і тим самим підвищуючи ефективність
культивування. Більшість моделей струшувачів дозволяє перемішування в одному
режимі - обертальному або повернення-но-поступальному. Хоча найбільш сучасні
моделі (фірма «1 пгогв») є універсальними, тобто працюють в різних режимах
перемішування. Ролерні установки - апарати, що дозволяють успішно застосовувати
один із загальноприйнятих методів культивування клітин-вирощування їх в
циліндричних судинах з боросилікатного скла з невеликою кількістю живильного
середовища, що обертаються в горизонтальному положенні зі швидкістю 8 обертів /
хв, забезпечуючи постійне перемішування живильного середовища і інтенсивне
зростання клітин. Для підвищення ефективності масового культивування установки
забезпечені системою, що дає можливість замінювати живильне середовище і
видаляти супернатант без зупинки обертання. Для цього судини забезпечуються
спеціальними перфузійним пробками, в яких центральна частина обертається
незалежно від периферійної. У цю частину пробки вводяться трубки для зміни
живильного середовища, видалення супернатанту і введення інокуляту. До складу
даної системи також входять перістальтичні насоси і блок автоматики, регулюючий
їх роботу. [10]
Рідинна
екстракція
Екстрагенти
забезпечують перехід цільових компонентів з вичерпним (важкою) фази, найчастіше
представляє собою водний р-р, в витягує (легку) фазу (зазвичай орг. рідина).
Дві контактують рідкі фази і розподіляється між ними цільовий компонент
утворюють екстракції систему. В якості розріджувачів використовують, як
правило, рідини (гас, бензол, хлороформ та ін) або їх суміші, які в вичерпує
фазі практично нерозчинні і інертні стосовно вилученими компонентам р-ра. Іноді
до розріджувачів додають модифікатори, що підвищують екстрагування компонентів
у фазі або полегшують розшаровування фаз (спирти, кетони, трибутилфосфат і
т.д.).
До
основної стадіями екстракції рідинної відносяться:
)
приведення в контакт і диспергування фаз;
) поділ
або розшаровування фаз на екстракт (витягується фаза) і рафінат (вичерпний
фаза),
)
виділення цільових компонентів з екстракту і регенерація екстрагента, для чого
поряд з дистиляцією. часто застосовують реекстракції (процес, зворотний
екстракції рідинної), обробляючи екстракт водними розчинами в-в, які
забезпечують повний переклад цільових компонентів в р-р або осад і їх
концентрування;
)
промивання екстракту для зменшення вмісту і видалення механічно захопленого
вихідного р - ра.
Процес
екстракції проводили при температурі 4-9оС при співвідношенні рафінату і
екстрагента 1:1. Процес вели при перемішуванні з частотою 60 об / хв.
Рівноважна концентрація гінзенозидів в екстракті досягалася через 1,25 ч. Для
вилучення залишкової кількості гінзенозидів осад піддавали повторної екстракції
чистим етанолом і центрифугуванням. Отримані на першій і на другому ступені
екстракти об'єднували. Надлишок етанолу з екстракту видаляли відгонкою під
вакуумом.
Виділення
сапонінів з рослинної сировини включає в себе отримання сумарного екстракту та
очищення його від баластних речовин з подальшим поділом суміші на індивідуальні
сполуки. В основному зараз виділяють сапоніни екстракція метанолом, етанолом і
ізопропаном.
Для виявлення сапонінів в рослинному сировину використовують реакції засновані
не фізичні властивості (реакції піноутворення), кольорові (з Н2SО4
концентрованої жовтий колір переходить у червоно-рожевий; Ванілін + конц Н2SО4.
t0C отримують, що тритерпенові забарвлюються в червоний колір, а стероїдні - в
жовтий; конц Н2SО4. + Солі міді t0C - отримують сіні-зелене забарвлення) та
осадові реакції, а також засновані на біологічних властивостях сапонінів
(гемоліз). Для кількісного аналізу застосовують методи визначення
гемолітичного, риб'ячого індексу і пінного числа, а також хімічні методи. [21]
Очищення
витяжки
Водні і
водно-спиртові витяжки з малою кількістю етанолу (20-40%) містять багато
високомолекулярних сполук (водорозчинні білки, цукри, ферменти, пектини, слизи,
крохмаль), які до випарювання повинні бути обов'язково видалені. В залежності
від кількості і властивостей баластних речовин використовують різні методи
очищення. У ряді випадків очищення проводять кип'ятінням якщо - ні інактивації
БАВ. Коагульовані при цьому білки швидко відшаровуються. Іноді застосовують
адсорбенти (каолін, бентоніти, тальк тощо) або поєднання адсорбентів з
кип'ятінням. Часто застосовують спосіб видалення баластних речовин шляхом
осадження їх спиртом. Спиртоочистка проводиться з попередніми упарінням витяжок
до половинного об'єму відносно маси вихідної сировини. Після охолодження до неї
додають подвійний об'єм міцного (95-96%) етанолу. Все ретельно перемішують і
залишають на 5-6 днів при температурі не вище 10°С. Відстояний шар зливають з
осаду і фільтрують. Очищену витяжку, при необхідності, піддають подальшого
згущення.
Для
витяжок застосовують метод заміни екстрагента. При цьому до упаренної до
половинного об'єму відносно маси вихідної сировини витяжки додають воду в
кількості, рівній масі сировини. Розчинні в хлороформі хлорофіл, смолисті
речовини випадають в осад, так як вони не розчиняються у воді. Витяжку
відстоюють, фільтрують і піддають подальшій обробці. [15]
Отримання
настоянки
Настоянку
отримують методом настоювання у перколяторах об'ємом 250 л. Для
екстракції суми екстрактивних речовин із клітин кореня женьшеню використовують
спирт етиловий 69,96%.Екстракцію ведуть в перколяторах так, щоб екстрагент
проходив порційно через перколятор. У перколятор завантажені клітинами
попередньо по 20 кг. Екстрагент додають в три прийоми в перколятор: 217,7 кг,
108,8 кг, 108,8 кг, з р2о=0,8856 (69,96%). Час настоювання на кожній операції
24 години. Відповідно отримують три порції 1 зливу самопливом: 165 кг (р20=Про,
8914); 105 кг (р20=ПРО, 895О); 110 кг, які направляють послідовно в перколятор:
туди ж спрямовують і віджимання зі шроту з (t) в кількості 41,4 кг, шрот в
кількості 77,1 кг (вологість 75,2%), віджимають на гідравлічному пресі (П-1 1),
і отримують віджатий шрот в кількості 31,7 кг (вологість 32,4%) і направляють у
відвал. З другого перколятора через кожні 24 години самопливом зливають три
порції напівфабрикату настоянки: 112 кг р20=0,8940); 90,8 кг (р20=0,8972);
171,4 кг (р20=0,8960), вивантажують шрот 68,5 кг (вологість 72%) і направляють
на гідравлічний прес, де отримують 31,9 кг віджиму (р20=0,8950) і додають його
до напівфабрикату настоянки, а 34 кг віджатого шроту (вологість 38.2%)
направляють у відвал. Всього направляють у відвал 65,7 кг (вологість 35,4%)
шроту. Всього на стадії отримують 406,1 кг напівфабрикату настоянки
(р20=0,8956). Вихід на стадії становить 84,7%. [5]
.6.12
Відстоювання і фільтрування напівфабрикату настоянки
Напівфабрикат відстоюють у відстійнику в холодильній камері при температурі
+10±2°С протягом 2-3 діб, після чого ПФ фільтрують на фільтр-пресі. В якості
фільтра використовують рамний фільтр-прес. На передній частині рами укріплені
на болтах упорна плита і траверса, які стягуються двома опорними балками, на
них спираються проміжні плити і натискна плита. Фільтруючим елементом є
фільтрувальний картон, поміщений між плитами. Пакет плит в стислому стані утворює
ряд камер. Кожна камера розділена на дві половини фільтрувальним картоном. З
боку нагнітаючої магістралі камери з'єднуються з камерами для підведення
настоянки, з боку вихідний магістралі з каналами для відведення фільтрату.
Канали утворюються з отворів у припливах плит при стислих плитах. Напівфабрикат
настоянки, по трубопроводу з відстійника насосом фільтрувальної установки
подається на фільтрувальну установку. Контроль фільтрації ведеться по
манометру. РРАБ=0,1-0,15 МПа. фільтрат збирається із фільтруючих елементів у
вихідний трубопровід, з якого готова настоянка надходить в чисту ємність. Для
фільтрації ПФ настоянки можна використовувати фільтр-установку, де в якості
фільтруючого елемента використовується ватно-марлевий (4-х шаровий) фільтр або
бельтинг. Фільтруючий матеріал укріплений хомутами на фільтротримачі
перфорованому, з нержавіючої сталі. Фільтротримач порожнистий і з'єднаний з
вихідним трубопроводом, поміщений в корпус з нержавіючої сталі. З вхідного
трубопроводу напівфабрикат настоянки подається насосом фільтр-установки, що
надходить в корпус і через фільтруючий матеріал і фільтротримач збирається у
вихідний трубопровід поступає в чисту ємність. Процес фільтрації контролюється
по манометру, РРАБ=0,1-0,15 МПа. Утворюється осад, в кількості 4,4 кг
утилізується через каналізацію. Після фільтрації отримують 400,5 кг настоянки
Вихід
на стадії становить 98,6%. [7]
Маркування
та упаковка настоянки
На
кожен флакон наклеюється етикетка з наступним змістом: підприємство-виробник і
його товарний знак, назву препарату латинською та російською мовами, обсяг
препарату у мілілітрах, умови зберігання, номер реєстраційного посвідчення,
номер серії, термін придатності, штриховий код. Номер серії та термін
придатності друкується на машинах На пакувальному столі кожен флакон по 40 мл
та 50 мл вручну укладаються в пачку з картону коробкового по ГОСТ 7933-75 типу
«Хром-ерзац» або марки «А» разом з інструкцією по застосуванню препарату, з
додатком, де зазначено номер пакувальника. Пачки встановлюються вертикально в
упаковку з паперу обгорткового, поклавши паперові прокладки (зверху, знизу).
Упаковки е настоянкою по 40 мл та 50 мл - по 20 шт., обв'язують ниткою
бавовняної, на кінці якої наклеюють етикетку. Допускається обв'язка пакування
стрічкою-скотч. На груповій етикетці затвердженого зразка міститься наступна
інформація: підприємство-виробник, товарний знак, назву препарату українською
та латинською мовами, обсяг препарату у мілілітрах в одному флаконі, кількість
флаконів, умови зберігання, номер реєстраційного посвідчення, номер серії,
термін придатності, штриховий код.
Флакони
з настойкою по 5 кг, 9 кг і 19 кг упаковуються таким чином: пробку, кришку і
горловину бутлі обгортають змоченим пергаментом за ГОСТ 1341-74, обв'язують
суворими бавовняними нитками по ГОСТ 6309-80, на кінці яких наклеюють етикетку
з паперу етикеткової по ГОСТ 7625-55 або марку з товарним знаком заводу. На
етикетці вказують вагу готового продукту в кілограмах.
Флакони
з настойкою календули по 5 кг, 9 кг і 19 кг, які пройшли стадію маркування,
упаковують у дощаті ящики по ГОСТ 2991-85, заповнені пухким прокладним
матеріалом. [16]
3.6
Опис запропонованих змін в технології
У
результаті патентного пошуку було оброблено патент РФ №2101934 технічним
результатом, на досягнення якого спрямован винахід, є підвищення якості та
кількості виходів цільового продукту - гензинозиду. Технічною задачею, є
створення способу вирощування біомаси женьшеню, що дозволяє підвищити вихід
біомаси женьшеню і вміст у ньому глікозидів. Дане завдання здійснюється тим, що
в способі вирощування біомаси женьшеню клітинна культура женьшеню піддається
опроміненню вузькосмуговим джерелом оптичного випромінювання, зокрема
інжекційном лазером, світлодіодом або гелій-неоновим лазером. Спосіб
реалізується наступним чином. Клітини женьшеню опромінюються по одній з
наступних методик у рамках запропонованого способу.
.
Опромінення проводиться в один сеанс на день висадки клітин в живильне
середовище (в тому числі безпосередньо перед висадкою).
.
Опромінення проводиться в один сеанс через 7 днів після висадки клітин в
живильне середовище.
.
Опромінення проводиться в два сеанси (з однаковими дозами) у перший і
чотирнадцятий день після висадки в живильне середовище.
.
Опромінення проводиться в три сеанси (з однаковими дозами) у перший, сьомий і
чотирнадцятий дні після висадки клітин в живильне середовище.
За
пропонованим способом для кожної з чотирьох розглянутих методик загальна доза
опромінення становить 3000 Дж/м2. В якості культури женьшеню використовувався
штам «R-1». Штам інкубували агарізірованной живильному середовищі в затемненому
приміщенні. Джерелом вузькосмугового оптичного випромінювання був один з
наступних типів джерел: інжекційний лазер з довжиною хвилі випромінювання 820
нм, інжекційний лазер з довжиною хвилі випромінювання 1300 нм, гелій-неоновий
лазер з довжиною хвилі випромінювання 632,8 нм, світлодіод з довжиною хвилі
випромінювання 850 нм, світлодіод з довжиною хвилі випромінювання 850 нм,
випромінювання якого пропускалося через поляризатор, встановлений між світлодіодом
і опромінювати клітинами. Необхідно відзначити, що зазначені джерела
вузькосмугового оптичного випромінювання володіють різними параметрами,
істотними для практичного застосування, такими як потужність, надійність,
габарити, наявність високої напруги в приладі і т.д. Тому залежно від
конкретних умов представляється доцільним використання одного із зазначених
типів випромінювачів. У разі коли загальна доза опромінення клітин приймала
значення в діапазоні (жовтень 3000) Дж/м2, відбувалося збільшення одержуваного
врожаю сухої біомаси клітин женьшеню в 1,8 рази. При цьому зміст глікозидів, що
контролювалися методом хромотографии, збільшилося в біомасі в 1,6 рази.
Необхідно відзначити, що зазначений результат і значення доз опромінення, при
яких він досягається, не залежав від того, який з типів вузькосмугових джерел
оптичного випромінювання був застосований, і не залежав від того, набиралася
зазначена доза опромінення за один або кілька сеансів в зазначені моменти часу.
Відсутність цих залежностей, а також досить широкий діапазон ефективних доз
опромінення пояснюється універсальним дією вузькосмугового оптичного
випромінювання на біологічні системи. У разі, коли доза опромінення становила
менше 10 Дж/м2, збільшення біомаси та вміст біологічно активних речовин було
незначним і при дозі меншій 5 Дж/м2 це збільшення не відбувалося. У разі коли
доза опромінення приймала значення більше 3ООО Дж/м2, зазначена зміна був також
незначним, а при істотно великих дозах спостерігалося деяке (близько 10-20%)
зменшення біомаси. Таким чином опромінення клітинної культури женьшеню
вузькосмуговим оптичним джерелом випромінювання в один або кілька сеансів
опромінення при сумарній дозі Дж/м2 дозволяє збільшити вихід сухої біомаси і
збільшити вміст глікозидів в біомасі. Промислова апробація способу вирощування
біомаси женьшеню проводилася на державному підприємстві «Фарматекс» в м.
Павлодар. Цикл виробництва від моменту висадки клітин в живильне середовище до
знімання врожаю займав 35 днів. При цьому відбулося збільшення одержуваного врожаю
сухої біомаси клітин женьшеню в 1,8 рази; зміст глікозидів збільшилося в
біомасі в 1,6 рази. Отримані результати дозволяють говорити про цілком реальних
можливостях промислового виробництва женьшеню.
3.7
Контроль виробництва, стандартизації та сертифікації
Система
сертифікації продукції і товарів в Україні. Сертифікація продукції,
сертифікація товарів і послуг, сертифікат, сертифікат відповідності,
обов'язкова сертифікація продукції, знак відповідності, система сертифікації
УкрСЕПРО, продукції, яка підлягає обов'язковій сертифікації регламентована
законодавчо.
Сьогодні значення
сертифікації постійно збільшується. З боку держави це відчувається в розширенні
переліку продукції, яка підлягає обов'язковій сертифікації. Для виробників
продукції сертифікат є потужним фактором у боротьбі з конкурентами за ринок
збуту.
Сертифікація - це
процедура, за допомогою якої третя сторона дає письмову гарантію того, що
продукція (товар, процес, послуга) відповідає певним умовам. Третьою називають
сторону, яка не залежить від першої сторони (постачальника) і другої сторони
(покупця). Головним завданням сертифікації є запобігання реалізації продукції,
небезпечної і шкідливої для життя і здоров'я людей, і навколишнього середовища.
Система сертифікації -
це система виконання процедури сертифікації та управління нею за певними
правилами. Системи сертифікації можуть діяти на національному, регіональному
або міжнародному рівні. Сертифікацію проводять акредитовані в системі
сертифікації органи сертифікації продукції, які визначають схему сертифікації і
видають за результатами випробування продукції сертифікат відповідності.
Для проведення
випробувань продукції залучають акредитовані випробувальні лабораторії
(центри), а для перевірки системи якості - органи сертифікації систем якості,
акредитовані в системі сертифікації.
Продукція, яка
відповідно до законодавства підлягає обов'язковій сертифікації в Україні,
повинна вироблятися, ввозитися і реалізовуватися в Україну тільки при наявності
сертифіката відповідності.
Сертифікат відповідності
- це документ, який підтверджує те, що продукція, система якості та управління
якістю, система управління навколишнім середовищем, персонал відповідають
вимогам конкретного стандарту чи іншого нормативного документа, визначеного
законодавством.
Для контролю якості
деяких видів виробленої або ввезеної продукції, крім сертифікації,
використовується ще й державна реєстрація. Так, реєстрації підлягають лікарські
засоби, вироби медичного призначення, спеціальні харчові продукти, харчові
добавки, засоби захисту рослин тощо.
Під час проведення
сертифікації здійснюють: випробування продукції, атестацію виробництва чи
послуг, перевірку і оцінку системи якості, технічний нагляд. У кожному
конкретному випадку склад і послідовність дій при проведенні сертифікації
визначаються прийнятою схемою сертифікації.
Відповідно до Декрету
Кабінету Міністрів України «Про стандартизацію і сертифікацію» сертифікація
продукції може бути обов'язковою і добровільною. Обов'язковій сертифікації
підлягає тільки та продукція, на яку поширюються обов'язкові вимоги стандартів
або інших нормативних документів, зокрема вимоги, які гарантують безпеку
продукції для життя, здоров'я та майна громадян, її суміщення і
взаємозамінність, охорону навколишнього середовища. Обов'язкова сертифікація
проводиться виключно в Державній системі сертифікації.
За результатами
проведення сертифікації заявнику видають сертифікат відповідності, який має
затверджену форму, специфічним елементом якої є знак відповідності.
Знак відповідності - це
захищений в установленому порядку знак, який свідчить, що маркована їм
продукція відповідає конкретному стандарту або іншому нормативному документу.
В Україні функціонує
Українська державна система сертифікації продукції (УкрСЕПРО). Система
сертифікації УкрСЕПРО проводить обов'язкову і добровільну сертифікацію
продукції виробничої сірки, послуг тощо. Загальні вимоги щодо порядку
проведення сертифікації продукції в системі УкрСЕПРО, а також технічного
нагляду за сертифікованою продукцією визначені в ДСТУ 3413-96 «Порядок проведення
сертифікації продукції».
Методи
аналізу сировини, що містить сапоніни.
Наявність
сапонінів в лікарській рослинній сировині можна встановити за допомогою якісних
реакцій, які проводять безпосередньо з сировиною або з витягом з нього.
Якісні реакції на сапоніни засновані на їх фізичних, хімічних і
біологічних властивостях. Для проведення якісних реакцій готують водний настій
1:10 при нагріванні на водяній бані. Після охолодження настій фільтрують.
Реакції,
засновані на фізичних властивостях. Для
проведення реакції на піноутворення беруть дві пробірки, в одну додають 5 мл
0,1 моль / л HCl, в іншу додають 5 мл 0,1 моль / л NaOH і сильно струшують.
Якщо утворюється стійка піна в обох пробірках або в пробірці з кислотою - це
говорить про кислих тритерпенових сапонінів. Стероїдні сапоніни дають дають
багату, стійку піну в лужному середовищі.
Хімічні
методи. Відносяться реакції
осадження сапонінів і кольорові реакції.
.Із
водних розчинів сапоніни осідають гідроксидами барію і магнію, солями міді,
ацетатом свинцю. Причому тритерпенові - осідають середнім ацетатом свинцю, а
стероїдні - основним.
. З
спиртових витягів (або розчинів) стероїдні сапоніни і тритерпенові сапоніни
випадають в осад при додаванні 1% спиртового розчину холестерину у вигляді
холестерідов.
.
Стероїдні сапоніни, так само як і серцеві глікозиди, дають реакцію
Лібермана-Бухарда з оцтовим ангідридом і кислотою концентрованої сірчаної -
утворюється швидко переходить забарвлення від рожевого до зеленого і синього.
На
біологічних властивості сапонінів
заснована реакція гемолізу з 2% суспензією еритроцитів у фізіологічному
розчині. Кров стає прозорою, яскраво-червоною. Для проведення цієї реакції з
рослинної сировини готують настій на фізіологічному розчині.
Державна
фармакопея XI видання (вип. 2) рекомендує виконувати якісні реакції для
підтвердження автентичності сировини:
Коріння
женьшеню.
а)
Реакція з порошком кореня женьшеню (на глікозиди). При нанесенні конц. H2SO4 на
порошок кореня женьшеню через 1-2 хвилини з'являється цегляно-червоне забарвлення,
що переходить у червоно-фіолетове, а потім - у фіолетове.
б)
Наявність панаксозидов доводять за допомогою поділу вилучення з кореня женьшеню
в тонкому шарі силікагелю і подальшим проявом хроматограми розчином
фосфорно-вольфрамової кислоти при нагріванні. Панаксозиди проявляються у
вигляді рожевих плям.
Єдиного
методу кількісного визначення сапонінів в лікарській рослинній сировині немає.
Найчастіше
використовують фізико-хімічні методи:
.
Потенціометріческій метод. Метод заснований на визначенні зміни електрорушійної
сили (ЕРС) в результаті титрування. Метод використовується для визначення суми
гінзенозиів в корінні.
Етапи
визначення: - підготовчий; екстракція гінзенозидів метиловим спиртом і їх
кислотний гідроліз:
Рисунок
3.8-R1, R2 цукру олеаноловая кислота
-
Очищення від супутніх речовин - осадження олеанолової кислоти в результаті
зміни розчинника (розбавлення спиртового витягу водою та охолодження);
Розчинення
олеанолової кислоти в гарячій суміші метилового та изобутилового спиртів
(1:1,5);
Кількісне
визначення - титрування розчином їдкого натру (0,1 моль / л) в суміші
метилового спирту і бензолу.
Точку
еквівалентності визначають потенціометрично.
.
Спектрофотометричний метод. Метод заснований на здатності сапонінів і їх
забарвлених комплексів поглинати монохроматичне світло при певній довжині
хвилі. Метод запропонований для визначення вмісту сапонінів в наступних видах
сировини:
а)
кореневища з корінням Діоскора ніпонської. Проводять кислотний гідроліз
сапонінів з подальшим проведенням реакції вільного агликона (диосгенина) з
реактивом (п-диметиламінобензальдегідом). Утворюється забарвлений комплекс,
б)
коріння солодки. Проводять осадження глициризинової кислоти концентрованим
розчином аміаку. Осад розчиняють і визначають оптичну щільність отриманого
розчину.
.
Гравіметричний метод - визначення екстрактивних речовин. Метод заснований на
визначенні сухого залишку після висушування суми речовин, витягнутих з сировини
відповідним екстрагентом. Метод запропонований для оцінки якості сировини
женьшеню.
.
Раніше для кількісної оцінки сировини використовували визначення гемолітичного
індексу і пінного числа.
3.8 Матеріальний баланс
При виробництві
гінзенозиду основним технологічним етапом, від якого залежать усі наступні
стадії та результат процесу в цілому є ферментація. Саме тому є доцільним
розрахувати матеріальний баланс біосинтезу. Співвідношення речовин, затрачених
та отриманих у процесі основної ферментації подано у вигляді таблиці (3.3).
Розрахунок проводився на 1 кг готової продукції.
Таблиця 3.3 Ї
Матеріальний баланс ферментації
|
Затрачено
|
Отримано
|
|
Сировина
|
Маса, кг
|
Продукт
|
Маса, кг
|
|
Штам R1 клітин женьшеню
|
80
|
Синтезована біомаса каллуса
женьшеня
|
12600
|
|
Казеїну гідролізат 80-1204
|
0,4
|
|
|
|
Суцільний гомогенат клітин калуса
|
28
|
|
|
|
Густий екстракт панаксозидів
|
170
|
Діоксид вуглецю
|
807
|
|
Спирт етиловий 70%
|
2700
|
Вода
|
18466,8
|
|
Сахароза
|
23000
|
|
|
|
Тіаміну гідрохлорид
|
0,25
|
|
|
|
Піридоксину гідро-хлорид
|
0,6
|
|
|
|
Нікотинова кислота 0,4-0,6
|
0,5
|
|
|
Тепловий баланс
біореактору
У біореакторі під час
процесу життєдіяльности виділяється тепло, при підвищенні температури
зростаючої культури її зріст сповільнюється, а потім можлива й загибель. Для
запобігання цього біореактори повинні бути обладнані теплознімним пристроями
(сорочки, змієвики та ін.). Кількість тепла, відводи мого від зростаючої
культури, та витрати охолодженої води визначають з теплового балансу.
Теплові потоки
працюючого біореактору показані на рисунку 3.10
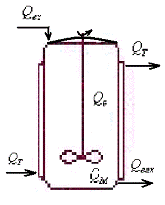
Рисунок 3.10. Теплові
потоки біореактору
Загальний тепловий
баланс процесу ферментації у реакторі можна надати у наступному вигляді:
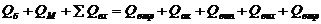 (3.1)
(3.1)
Де 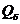 -тепло
біосинтезу;
-тепло
біосинтезу;
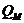 -тепло від мішалки;
-тепло від мішалки;
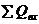 - сумарне тепло, яке
приноситься керуючим повітрям та живильним середовищем;
- сумарне тепло, яке
приноситься керуючим повітрям та живильним середовищем;
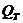 - тепло, яке підводиться
(відводиться) через сорочку та ін. пристрої
- тепло, яке підводиться
(відводиться) через сорочку та ін. пристрої
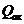 - акумульоване тепло в
системі;
- акумульоване тепло в
системі;
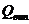 - тепло, яке втрачається
під час випарювання;
- тепло, яке втрачається
під час випарювання;
 - тепло, яке відводиться
технологічними потоками;
- тепло, яке відводиться
технологічними потоками;
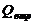 - теплові втрати.
- теплові втрати.
Значеннями 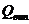 ,
,
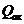 та
та
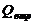 можна
знехтити в порівнянні
можна
знехтити в порівнянні 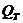 .
Тому, рівняння теплового балансу можна спростити.
.
Тому, рівняння теплового балансу можна спростити.
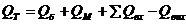 (3.2)
(3.2)
Прихід тепла за 1 годину
. З поживним середовищем
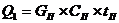 (3.3)
(3.3)
де 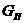 -
маса живильного середовища,
-
маса живильного середовища, 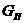 =165 кг;
=165 кг;
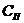 - питома теплоємність
живильного середовища,
- питома теплоємність
живильного середовища, 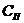 =4,6кДж/кг∙К;
=4,6кДж/кг∙К;
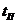 - температура живильного
середовища,
- температура живильного
середовища, 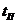 =37°С;
=37°С;
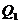 =165×4,6×37 = 28083 (кДж)
=165×4,6×37 = 28083 (кДж)
2. тепло, яке
виділяється під час біосинтезу
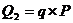
Де 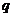 -
середня кількість тепла під час зростання культури,
-
середня кількість тепла під час зростання культури,
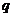 =63×103 кДж/кг∙год
=63×103 кДж/кг∙год
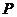 - приріст біомаси,
- приріст біомаси, 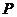 =0,055
кг/год
=0,055
кг/год
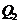 =63×103×0,055
= 3465 (кДж)
=63×103×0,055
= 3465 (кДж)
3. тепло, яке
приноситься разом з охолоджуваною водою
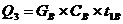 (3.3)
(3.3)
де  -
маса охолоджуваної води,
-
маса охолоджуваної води,  =13,1
кг;
=13,1
кг;
 - питома теплоємність
охолоджуваної води,
- питома теплоємність
охолоджуваної води,  =4,49
кДж/кг∙К;
=4,49
кДж/кг∙К;
 - температура води
спочатку,
- температура води
спочатку,  =
35°С;
=
35°С;
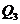 =13,1×4,49×35 = 2058,67 (кДж)
=13,1×4,49×35 = 2058,67 (кДж)
4. тепло, яке
приноситься з повітрям
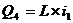 ,
,
де  - витрати повітря;
- витрати повітря;
 - ентальпія свіжого
повітря
- ентальпія свіжого
повітря
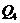 =0,15×1,293×71×4,19×13,2×10-3 = 0,76 кДж
=0,15×1,293×71×4,19×13,2×10-3 = 0,76 кДж
Витрати тепла за 1 годину
. З готовою культурою
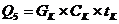 (3.4)
(3.4)
Де 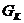 -
маса готової продукції
-
маса готової продукції 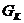 =4,3
кг;
=4,3
кг;
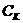 - питома теплоємність
готової культури,
- питома теплоємність
готової культури, 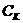 =0,92
кДж/кг∙К;
=0,92
кДж/кг∙К;
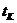 - температура готової
культури,
- температура готової
культури, 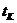 =37°С;
=37°С;
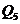 =4,3×0,92×37 = 146,36
=4,3×0,92×37 = 146,36
. з охолодженою
водою
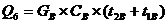 (3.5)
(3.5)
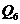 =13,1×4,49× (35 - 30) = 294 (кДж)
=13,1×4,49× (35 - 30) = 294 (кДж)
. з повітрям, яке
продувається
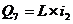 ,
,
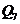 =0,15×71×1,293×24×4,19×10-3 = 1,39 кДж
=0,15×71×1,293×24×4,19×10-3 = 1,39 кДж
4. витрати тепла у
навколишнє середовище
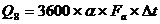 , (3.6)
, (3.6)
Де 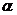 -
коефіцієнт тепловіддачи від ферментера у навколишнє середовище,
-
коефіцієнт тепловіддачи від ферментера у навколишнє середовище,
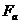 - площа ферментера
- площа ферментера
 - різниця температур,
ферментер-повітря;
- різниця температур,
ферментер-повітря;
Рівняння
теплового балансу ферментеру має вигляд:
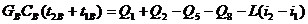 (3.7)
(3.7)
Позначимо праву
частину рівняння через Q, тоді витрати охолоджуваної води складає:
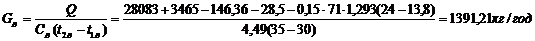
Площа поверхні
теплопередачі ферментеру
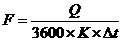 ,
,
= 0,29 м²
3.10
Розрахунок та вибір технологічного обладнання
Для
виробництва внутрішній діаметр апаратів приймають 2-3 м. Приймаємо Dвн =
3 м, висоту еліптичної частини hел = 0,75, висоту відбортування h=6
мм
Розрахуємо
висоту циліндричної частини Нц
Повний
об'єм ферментера Vп=Vц + 2Vдн. (3.1)
Об'єм
циліндричної частини Vц=Vп - 2Vдн. (3.2)
Висота
циліндричної частини ферментера,
Нц
= (Vп - 2Vдн)/F, (3.3)
де F -
площа перетину ферментера за внутрішнім діаметром, м2:
= 0,785
D2вн
Загальна
висота ферментера, м:
Нзаг
= Нц + 2 (hел + h). (3.4)
Об'єм
еліптичної частини:
ел =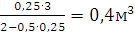 , (3.5)
, (3.5)
де Р1
- внутрішній тиск в апараті, що не перевищує 0,25 МПа;
з -
коефіцієнт міцності шва, з = 0,75-1,0.
До
розрахованої висоти апарата додають розміри електродвигуна муфти та редуктора.
Висоту культуральної рідини в апараті розраховують за рівнянням:
роб = Нк.р×0,785× D2вн + Vдн, (3.6)
якщо
коефіцієнт заповнення 0,6, то Vроб = 5×0,6= 3м3
Нк.р=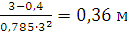
Розрахунок механічної
мішалки
При
вирощуванні мікроорганізмів на рідких поживних середовища; глибинним способом
рекомендується застосовувати турбінні мішалки Діаметр турбінної мішалки
розраховують за формулою
м =(0,3-0,33) Dвн
м = 0,3×3=0,9
Частота обертання мішалки, хв-1,
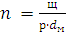 (3.7)
(3.7)
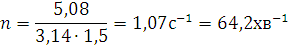
За одержаною величиною частоти
обертання мішалки приймають фактичну швидкість. За прийнятою величиною частоти
обертання мішалки за каталогом вибирають редуктор.
Знаючи dм, за каталогом
вибирають мішалку з ефективною системою перемішування. Типи пристроїв для
перемішування рідин з різною в'язкістю наведені в табл. 3.4.
Таблиця 3.4 - Оптимальні швидкості
обертання пристроїв для перемішування залежно від в'язкості середовища
|
Тип пристрою для перемішування
|
Динамічний коефіцієнт в'язкості
середовища (м), Па×с
|
Оптимальна швидкість обертання
мішалки, м/с
|
|
Лопатеві, якірні, рамні
|
0,001 - 4,0 4,0 - 8,0 8,0 - 15,0
|
3,0 -2,0 2,5 - 1,5 1,5 - 1,0
|
|
Турбінні
|
0,001 - 5,0 5,0 - 15,0 15,0 - 25,0
|
7,0 - 4,2 4,2 - 3,4 3,4 - 2,3
|
|
Пропелерні
|
0,001 - 2,0
|
4,8 - 16,0
|
Розрахунок
потужності, що споживається, Вт:
м = KNсcn3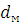 5, (3.8)
5, (3.8)
де KN
- критерій потужності, що залежить від інтенсивності перемішування і
характеризується критерієм Рейнольдса (Reц);
сc
- густина середовища, кг/м3(1060);
п -
число обертів мішалки, хв-1;
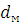 -
діаметр мішалки, м;
-
діаметр мішалки, м;
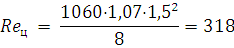
Приймаємо KN =10м=10×1060×1,07×0,95=6697 Вт
Розрахункова
потужність на валу мішалки, кВт:
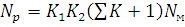 (3.9)
(3.9)
де К1
- коефіцієнт заповнення апарата культурою, що росте;
К2
- коефіцієнт, який враховує збільшення потужності, що споживається, через
підвищення опору культури в процесі її росту (К2 = 1,1);
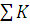 -
коефіцієнт, який враховує збільшення потужності, що споживається, на подолання
опору від допоміжних пристроїв,
-
коефіцієнт, який враховує збільшення потужності, що споживається, на подолання
опору від допоміжних пристроїв,
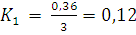 м
м
де  - висота шару рідини, що перемішується, м.
- висота шару рідини, що перемішується, м.
Якщо в
період росту культури утворюється піна, то приймають  =0,65 Нап,
=0,65 Нап,
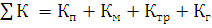 (3.10)
(3.10)
де Кп
- коефіцієнт опору перегородок, що відбивають рідину (1,5);
Км
- коефіцієнт опору додаткової мішалки (0,3);
Ктр
- коефіцієнт опору труби для підведення повітря (0,1);
Кг
- коефіцієнт опору гільзи для термометра(1).
Значення
Кп, Км, Ктр Кг, залежно від типу
мішалки наведені
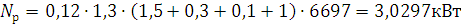
Визначення
діаметра вала мішалки проводять за формулою, виходячи з міцності його на
кручення
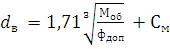 ,
(3.11)
,
(3.11)
де Моб
- момент обертання на валу мішалки, Н × м;
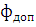 -
коефіцієнт допустимого напруження для матеріалу вала на кручення 7×104 мН/м3;
-
коефіцієнт допустимого напруження для матеріалу вала на кручення 7×104 мН/м3;
См
- поправка на корозію та зношення матеріалу вала.
Моб
= 0,163 Np / nм,
де Np
- розрахункова потужність на валу;м - запас міцності вала.
Моб
=0,163×3,0297/2,6=0,2
кВт
 ,
(3.12)
,
(3.12)
Таблиця
3.5 - Значення коефіцієнта 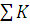 для
різних типів мішалок
для
різних типів мішалок
|
Допоміжний пристрій
|
Мішалки
|
|
Лопатеві
|
Якірні та рамні
|
Турбінні
|
Пропелерні
|
|
Чотири відбивні перегородки В=0,08
Dвн, що розміщені біля стінок основного апарата Кн
|
1
|
-
|
1,5
|
0,5
|
|
Додаткова горизонтальна лопать, що
за розмірами дорівнює лопаті основного пристрою для перемішування Км
|
0,35
|
-
|
-
|
-
|
|
Труба для пере тиснення розчину
|
0,2
|
0,2
|
0,2
|
0,1
|
|
Гільза для термометра або
поплавковий вимірювач рівня Ктр
|
0,1
|
0,1
|
0,1
|
0,05
|
|
Дві вертикальні труби, що
розміщені під кутом більше 90°
|
0,3
|
0,3
|
0,3
|
0,15
|
|
Змійовик з закруткою, який
розміщений вздовж циліндричної стінки апарата
|
2
|
-
|
-
|
-
|
|
Спіральний змійовик, який
розміщений біля дна апарата при діаметрі труби 0,33 - 0,05 м
|
2,5 - 3
|
-
|
-
|
-
|
|
Деталі для кріплення дифузора
|
-
|
-
|
-
|
0,05
|
Кінцеву
встановлену потужність Nвст (кВт) привідного електродвигуна мішалки
розраховують за формулою
вст = 1,15 (Nр + Nс)/з
де з - ККД редуктора
приводу (0,95).вст = 1,2×3,0297/0,95=3,83 кВт
За
величиною Nвст потужність 5,5 кВт та частота обертання 31 об/хв.
Розрахунок барботера
Робочий об'єм ферментера
при коефіцієнті заповнення 0,6 складає 5×0,6=3м3
Кількість повітря для
аерації, якщо питомий об'єм витрат повітря 0,017 м3пов =
0,017×3=0,051
м3
Площа всіх отворів на
барботері при швидкості витікання повітря 30 м/сотв =
0,051/30=0,0017 м2
Якщо діаметр отворів
прийняти 5 мм, то його площа складатиме 1,96×10-5 та кількість отворів на барботері складатимеотв
= 0,0017/1,96×10-5
= 86,73
При Dвн = 3
м, dм = 0,9 м діаметр кільця барботера приймаємо 0,9 м, тоді довжина
кільця складатиме= 0,9×3,14 =2,83 м, так як l=2рr
Відстань між отворами
складатиме
Д l' = 2,83×86,73 = 33 мм
Через складність
процесів, що відбуваються в апараті з механічною мішалкою та барботером,
розрахунок та проектування промислових ферментаторів мають емпіричний характер.
Приклад ферментера, який
використаний в виробництві гензинозиду з механічною мішалкою і барботером (рис.
3.11)
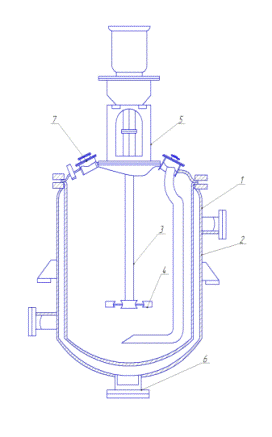
Рисунок 3.11-Ферментер
для культивування рослинних клітин
. Корпус реактора;
. Сорочка;
. Вал мішалки;
.Мішалка;
. Привід мішалки;
. Штуцер для
вивантаження продукту.
4. Економічна
ефективність проекту
В даному розділі
приведене економічне обґрунтування доцільного використання запропонованої зміни
в технології. Проведені всі необхідні розрахунки, які наведені в таблиці 4.1
Таблиця 4.1 -
Техніко-економічні показники виробництва
|
Найменування показника
|
Значення
|
|
1. Обсяг виробництва кг/рік
|
12.600
|
|
2. Виторг від реалізації
продукції, грн./рік
|
3272220
|
|
3. Ціна грн./кг
|
259,7
|
|
4. Собівартість грн./кг
|
207,7
|
|
5. Інвестиційні витрати, грн.;
|
140598,7
|
|
6. Рентабельність продукції, %
|
25
|
|
7. Фондовіддача, грн./грн.
|
46,8
|
|
8. Строк окупності інвестиційних
витрат, років
|
2
|
4.1 Розрахунок
виробничої потужності проектованого виробництва
Виробнича потужність
проектованого цеху (М) визначається по ведучому обладнанню по формулі:
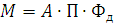 (4.1)
(4.1)
де А - кількість
однотипового обладнання, шт.;
П - максимальна
продуктивність одиниці обладнання кг/год
Фд - дійсний
фонд роботи одиниці обладнання, год/рік
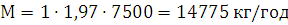
Перевіремо відповідність
заданої виробничої програми (В) розрахунковій величині (М). Обов’язкова умова
при цьому: М > В. Оптимальне співвідношення цих величин повинно бути
наступним:
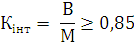
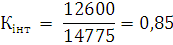
4.2 Розрахунок поточних
витрат
Собівартість одиниці
продукції і річні поточні витрати визначаємо укрупнено. Розрахунок потреби в
матеріальних ресурсах на запланований обсяг продукції визначається по кожному
виду матеріалів у рецептурі і визначається по формулі:
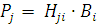 (4.2)
(4.2)
де Pj -
витрати jго компоненту сировини на 1 кг iго продукту;ji
- питома норма jго сировини чи матеріалу на 1 кг iго
продукту;i - виробництво iго продукту по проекту, кг/рік.
Розрахунок потреби
сировини, матеріалів можна здійснити у виді таблиці 4.2.
Таблиця 4.2 - Потреба в
сировині і матеріалах
|
Найменування компоненту
|
Норма витрати на 1 кг готового
продукту
|
Об’єм виробництва, кг
|
Потреба
|
|
Калус клітин женьшеню
|
0,2
|
12600
|
2520
|
|
Живильна середа
|
0,4
|
12600
|
5040
|
|
Суцільний гомогенат клітин калуса
|
0,05
|
12600
|
630
|
|
Густий екстракт панаксозидів
|
0,1
|
12600
|
1260
|
|
Спирт етиловий 70%
|
2
|
12600
|
25200
|
На підставі розрахованої
потреби в матеріальних ресурсах визначається їх вартість, що надалі
використаємо для розрахунку собівартості продукції. Вартість сировини і
матеріалів наведена у таблиці 4.3
Таблиця 4.3 - Вартість
сировини і матеріалів
|
Найменування компонента
|
Ціна, грн.
|
Потреба
|
Вартість, грн.
|
|
|
на 1 кг
|
на рік
|
на 1 кг
|
на рік
|
|
Калус клітин женьшеню
|
200
|
0,2
|
2520
|
40
|
50400
|
|
Живильна середа
|
50
|
0,4
|
5040
|
20
|
25200
|
|
Суцільний гомогенат клітин калуса
|
500
|
0,05
|
630
|
25
|
315000
|
|
Густий екстракт панаксозидів
|
300
|
0,1
|
1260
|
30
|
378000
|
|
Спирт етиловий 70%
|
15
|
2
|
25200
|
30
|
378000
|
|
Всього
|
|
|
|
145
|
768630
|
На підставі отриманих
даних, складаємо калькуляцію собівартості продукції, яка наведена у таблиці 4.4
Таблиця 4.4 -
Собівартість продукції
|
Статті витрат
|
Витрати (собівартість)
|
|
На 1 кг, грн
|
на рік, грн
|
|
Сировина і матеріали
|
145
|
1827000
|
|
Допоміжні матеріали
|
10,15
|
127890
|
|
Енергозатрати
|
14,5
|
182700
|
|
Заробітна плата осн. вироб.
робітників
|
7,25
|
91350
|
|
Нарахування на з/п
|
2,75
|
34650
|
|
Загальновиробничі витрати
|
14,49
|
182574
|
|
Виробнича собівартість
|
194,14
|
2446164
|
|
Адміністративні витрати
|
5,8
|
73080
|
|
Витрати на збут
|
7.76
|
97776
|
|
Собівартість
|
207,7
|
2617020
|
|
Ціна виробництва
|
259,7
|
3272220
|
|
Відпускна ціна
|
311,6
|
3926160
|
4.3 Визначення ціни і
обсягу реалізації продукції
) Ціна виробництва
розраховується по формулі:
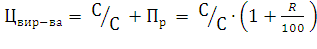 (4.3)
(4.3)
де  -
собівартість одиниці продукції, грн/од;
-
собівартість одиниці продукції, грн/од;
Пр -
прибуток, одержуваний від реалізації одиниці продукції, грн/од;- рівень
рентабельності, що задається, визначається розміром прибутку.
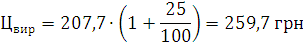
) Відпускна ціна
продукції включає ціну виробництва і податок на додаткову вартість (20%):
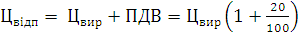 (4.4)
(4.4)
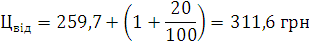
) Обсяг
реалізації продукції розраховується по формулі:
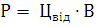 (4.5)
(4.5)
де Ц - відпускна
ціна одиниці продукції, грн/од;
В - річний випуск
продукції, кг.
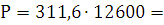 3926160
3926160
4.4 Розрахунок
інвестиційних (капітальних) витрат
Під інвестиційними
витратами розуміють первісні інвестиції (капітальні вкладення), що забезпечують
реалізацію продукту.
При визначенні суми
інвестиційних витрат, у першу чергу, необхідно визничити вартість основних
фондів проектованого виробництва, що включають вартість обладнання і виробничих
будинків і споруджень.
) Розрахунок вартості
обладнання
Розрахунок первісної
вартості устаткування здійснено у таблиці 4.5
Таблиця 4.5 - Первісна
вартість устаткування
|
Назва обладнання
|
Кількість одиниць
|
Ціна, грн./од.
|
Вартість грн.
|
|
Біореактор
|
1
|
20000
|
20000
|
|
Екстрактор
|
1
|
5600
|
5600
|
|
Сбірник живильної речовини
|
1
|
700
|
700
|
|
Сбірник готового продукта
|
1
|
700
|
700
|
|
Фільтри
|
3
|
1440
|
4320
|
|
Разом
|
28400
|
|
Невраховане обладнання
|
|
|
2840
|
|
Транспортування
|
|
|
3976
|
|
Комплектація обладнання
|
|
|
426
|
|
Заготівельно-складські витрати
|
|
|
340
|
|
Трубопроводи
|
|
Монтаж
|
|
|
7100
|
|
Спеціальні роботи
|
|
|
3408
|
|
Всього
|
|
|
47910
|
Вартість обладнання з
урахуванням ПДВ:
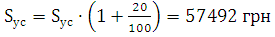 (4.6)
(4.6)
2) Розрахунок вартості
будинків і споруджень
Вартість будинків і
споруджень визначається виходячи зі структури капітальних вкладень хімічної
промисловості, у якій вартість устаткування складає 60%, а витрати на будинки і
спорудження відповідно - 40% від сумарних капітальних вкладень.
Розрахунок здійснюється
по формулі:
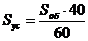 (4.7)
(4.7)
де Sоб
- вартість устаткування, грн.
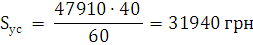
У вартість
будинку додатково включаються:
) опалення і
вентиляція - 7% - 2235,8 грн.
) водопровід і
сигналізація -12% - 3832,8 грн
) внутрішнє
висвітлення - 5% - 1597 грн
) внутрішні
водостоки - 1% - 319,4 грн
) зовнішній
благоустрій - 14% - 4471,6 грн
 = 12488,5 грн.
= 12488,5 грн.
) Визначення
інвестиційних витрат проводять враховуючи передінвестиційні витрати, витрати на
будівельно-монтажні роботи, витрати на обладнання, накладні витрати і витрати
на закупівлю пускової партії сировини і матеріалів. Сума витрат наведена у
таблиці 4.6
Таблиця 4.6 -
Інвестиційні витрати
|
Найменування
|
Сума, грн.
|
|
Передінвестиційні витрати
|
4898,7
|
|
Вартість будинків і споруджень
|
12488
|
|
Витрати на устаткування
|
57492
|
|
Накладні витрати
|
6998
|
|
Вартість пускової партії сировини
|
57330
|
|
Інші витрати
|
1392
|
|
Разом
|
140598,7
|
4.5 Показники
ефективності проектованого виробництва
) Розрахунок
фондовіддачі виконується по формулі:
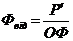 (4.8)
(4.8)
де Фвід
- фондовіддача основних виробничих фондів, грн/грн;
Р` - чистий обсяг
продаж, тобто вартість реалізованої продукції без ПДВ, грн;
ОФ - вартість
основних фондів, грн.
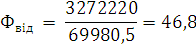
Чистий обсяг
продаж розраховується по формулі:
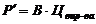 (4.9)
(4.9)
де В - річний
обсяг випуску продукції, нат. од;
Цвир-ва
- ціна виробництва одиниці продукції, грн/од.
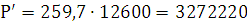
) Рентабельність
продукції розраховується по формулі:
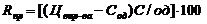 (4.10)
(4.10)
де Цвир-ва,
Сод - відповідно ціна виробництва і собівартість виготовлення
одиниці продукції, грн/од.
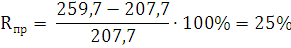
) Строк окупності
інвестицій визначається по формулі:
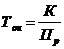 (4.11)
(4.11)
де К - сума
інвестицій витрат, грн;
Пр -
прибуток від реалізації річного обсягу продукції, грн/рік
Прибуток від
реалізації розраховується по формулі:
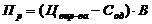 (4.12)
(4.12)
де В - річний
обсяг виробництва, нат. од.
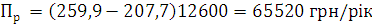
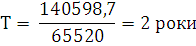
Оскільки термін
окупності менше 6 років, то інвестиції використовуються ефективно.
) Рентабельність
основних фондів розраховується по формулі:
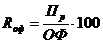 (4.13)
(4.13)
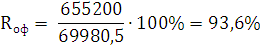
Таким чином,
можна зробити висновок, що запропоновані у дипломній роботі технічні рішення є
економічно вигідними. Строк окупності виробництва складає 2 року, що є дуже
добрим показником.
Висновок
Для збереження біоценозу
женьшеню і задоволення потреби в гінзенозидів необхідно розробляти
високоефективні біотехнологічні підходи культивування як самого женьшеню, так і
отримання панаксозидів з культури клітин рослин. Підходи, що розроблюються
повинні забезпечити високу якість продукту, значний об'єм виробництва, низьку
собівартість і доступність за ціною. Актуальність обумовлена прагненням
старіючого населення планети використовувати для профілактики хвороб та
зміцнення життєвих сил органів нативних, натуральних рослинних компонентів.
В Україні немає власної
сировини женьшеня. Спроби культивувати цілу рослину не мали широкого поширення
у виробництві. Україна щорічно закуповує різних продуктів з екстрактом женьшеню
на 2, 8 млн долларів. Необхідно знайти можливість для забезпечення населення
вітчизняною продукцією та збереження золотовалютного резерву.
За базову взята
технологія з використанням штам клітин женьшеню R1, з високою продуктивністю
гінзенозиду, який вирощують на жидкому середовищі, що забезпечено оптимальні
умови культивування, що підтверджено економічними розрахунками.
Контроль виробництва
гінзенозиду охоплює всі стадії виробництва і включає наступні етапи:
. Контроль вхідної
сировини, матеріалів і напівфабрикатів.
. Контроль процесу
основної ферментації.
. Контроль
напівпродуктів при виділенні гінзенозиду.
4.
Випробування кінцевого продукту виробництва.
Список
літератури
1. Надлежащая
производственная практика лекарственных средст. Под ред. Н.А. Ляпунова, В.А.
Загория, В.П. Георгиевского, Е.П. Безуглой. - К.: Морион, 2011. - 896 с.
2. Биотехнология.
Книга 3: Клеточная инженерия. Под ред. Бутенко Р.Г., Гусев М.В., Киркин А.Ф.,
Корженевская Т.Г., Маркарова Е.Н.-К.: «Наука», 2009. - 528 с.
. Биология
клеток высших растений in vitro и биотехнологии на их основе. Бутенко Р.Г-М.:
«Мир», 2005. - 225 с.
. Клеточная
инженерия растений. Под ред.: Глеба Ю.Ю., Сытник К.М. Киев, 1984. - 167 с.
. Тузова
Р.В. Молекулярно-генетические механизмы эволюции органического мира. Генетическая
и клеточная инженерия / Р.В. Тузова, Н.А. Ковалев; НАН Беларуси, Ин-т
экспериментальной ветеринарии им. С.Н. Вышелесского. - Минск: Беларуская
навука, 2010. - 395 с.
. Биотехнология
в селекции растений. Клеточная инженерия. науч. ред. Кильчевский А.В., Хотылева
Л.В., Генетические основы селекции растений. В 4 т. Т. 3.
. Высокомолекулярные
неорганические полифосфаты: биохимия, клеточная биология, биотехнология. Кулаев
И.В. Научный мир. 2010.112 с.
. Шлегель
Г. Общая микробиология: Пер. с нем. - Москва: Мир, 1987.
. Билай
В.И. Основы общей микробиологии. - Киев: Высшая школа, 1989.
. Чуешов
В.И., Мандрыка Л.А., Сичкарь А.А. и др. Основы пректирования производств в
химико-фармацевтической и биотехнологической промышленности. Учеб. для вузов. -
Харьков, 2009. - 460 с.
. Сидоров
Ю.І., Вязло Р.Й., Новіков В.П. Процеси і апарати мікробіологічної
промисловості. Технологічні розрахунки. Приклади і задачі. Частина ІІІ. Основи
проектування мікробіологічних виробництв. - Львів: Видавництво НУ «Львівська
політехніка», 2004. - 252 с.
. Промышленная
микробиология. Учебное пособие для вузов /Под ред. Н.С. Егорова. - М.: Высшая
школа, 2009.
. Биотехнология.
Учебное пособие для вузов. В 8 кн. /Под ред. Н.С. Егорова, В.Д. Самуилова. -
М.: Высшая школа, 2007.
. Бекер
М.Е. Введение в биотехнологию: Пер. с латыш. (Рига, 1974). - М.: 2002.
. Биотехнология.
Принципы и применение /Под ред. И. Хиггинса. - М.: Мир, 2000.
. ГНД-09-001-98.
Продукція медичної та мікробіологічної промисловості. Регламенти виробництва
лікарських засобів. Зміст, порядок розробки, узгодження та затвердження.
. Сидоров
В.А. Биотехнология растений. Клеточная селекция / АН УССР. Отделение клеточной
биологии и генетической инженерии Ин-та ботаники им. Н.Г. Холодного. - Киев: -
Наук. думка, 1990. - 280 с. - ISBN 5-12-001807-6
. Лутова
Л.А. Биотехнология высших растений: Учебник. - Изд. 2-е. СПб.: Изд-во
. Федорова
Т.А., Аппалуп М.В. // Клеточная трансплантология и тканевая инженерия. -2006. -
№1 (3). - С. 39 - 41
. Шумаков
В.И., Онищенко Н.А., Крашенинников М.Е. и др. // Вестник РАМН. - 2004. - №9. -
С. 44-47.
. Арцимович
Н.Г., Корнев А.В., Иванова Т.М., Чугунов А.В. и др. Подходы к иммунодиагностике
и лечению синдрома хронической усталости и нейроиммунных расстройств //
Иммунология. -1994. - №7. - С. 42-45.
. Брехман
И.И, Грушвицкий И.В. Женьшень как лекарственное растение, - М: Наука, 2007. -
16 с
. Лупанова
И.А. (Николаева И.А.), Минеева М.Ф., Колхир В.К. Подходы к разработке
фитопрепаратов на основе тритерпеновых гликозидов как перспективного класса
природных соединений // Сборник материалов конгресса - XVIII Российский
национальный конгресс «Человек и лекарство», Москва, 11-15 апреля 2011 г. - М.:
ЗАО РИЦ «Человек и лекарство». - 2011. - С. 508.
. Лупанова
И.А. (Николаева И.А.), Минеева М.Ф., Колхир В.К., Мартынов А.М. Тритерпеновые
гликозиды - перспективный класс природных соединений для создания новых
фитопрепаратов // Сибирский медицинский журнал. - 2011. - №6. - С. 244-246.
25. Закон
України «Про охорону праці», листопад 2002 р.
26. ГОСТ
12.0.003 - 74* ССБТ. Опасные и вредные производственные факторы. Классификация.
- Введ. 01.01.76.
. Лазарев
Н.В. Вредные вещества в промышленности / Н.В. Лазарев - М.: Химия, 1976. - Ч.
І. - 336 с.
. Лазарев
Н.В. Вредные вещества в промышленности / Н.В. Лазарев - М.: Химия, 1976. - Ч.
ІІ. - 400 с.
. Макаров
Г.В. и др. Охрана труда в химической промышленности. - М.: Химия, 1980. - 568
с.
30. ГОСТ
12.1.005-88 ССБТ. Общие санитарно-гигиенические требования к воздуху рабочей
зоны. - Введ. 01.01.89.
31. Долин
П.А. Справочник по технике безопасности / П.А. Долин - М.: Энергоатомиздат,
1984-824 с.
32. СНиП
2.04.05-91 Нормы проектирования. Отопление, вентиляция и кондиционирование
воздуха. - М.: Стройиздат, 1991.
33. ДБН
В.2.5-28-2006. Інженерне обладнання будівель та споруд. Природне і штучне
освітлення. - К.: МінбудУкр., 2010.
34. ГОСТ
12.1.003-83* ССБТ. Шум. Общие требования безопасности. - Введ. 01.01.1989.
. ПУЭ
-87. Правила устройства электроустановок. М.: Энергоатомиздат, 1987.
36. НАПБ
Б.03-002-2007 Норми визначення категорій приміщень, будинків та зовнішніх
установок за вибухопожежною та пожежною набезпекою. Наказ МНС №633 від
03.12.2007.
37. ГОСТ
12.1.004-91 ССБТ. Пожарная безопасность. Общие требования. - Введ. 01. 07. 92.
. Родионов
А.И. Техника защиты окружающей среды / А.И. Родионов, В.Н. Клушин, Н.С.
Торочешников - М.: Химия, 1989. - 512 с.
. Закон
України «Про охорону навколишнього середовища» від 25.06.1991
40. Основи
охорони праці: навчальний посібник / За ред. В.В. Березуцького. - Х.: Факт,
2009. - 480 с.
41. СНиП
II-4-79. Естественное и искусственное освещение. Нормы проектирования. - М.:
Стройиздат, 1980. - 110 с.