|
Показатель,
в 1кг пивной дробины
|
Сырая
|
Сухая
|
|
Сухое
вещество, г
|
232
|
887
|
|
Сырой
протеин, г
|
58
|
217
|
|
Лизин,
г
|
2,2
|
7,7
|
|
Метионин
+ цистин, г
|
1
|
3,5
|
|
Сырая
клетчатка, г
|
39
|
160
|
|
Безазотистые
экстрактивые вещества (БЭВ), г
|
107
|
406
|
|
Сырой
жир, г
|
17
|
60
|
|
Кальций,
г
|
0,5
|
3
|
|
Калий,
г
|
0,3
|
1,7
|
|
Фосфор,
г
|
1,1
|
6,6
|
|
Магний,
г
|
0,4
|
1,9
|
|
Натрий,
г
|
0,65
|
3
|
|
Железо,
мг
|
50
|
90
|
|
Медь
|
2,2
|
21,3
|
|
|
Цинк,
мг
|
22
|
58
|
|
|
Марганец,
мг
|
8
|
17,6
|
|
|
Кобальт,
мг
|
0,05
|
0,2
|
|
|
Йод,
мг
|
0,02
|
0,1
|
|
|
Каротин,
мг
|
1,6
|
-
|
|
|
Витамин
Е (токоферол), мг
|
14
|
23
|
|
|
Витамин
В1 (тиамин), мг
|
0,2
|
0,6
|
|
|
Витамин
В2 (рибофлавин), мг
|
0,3
|
0,9
|
|
|
Витамин
В4 (холин), мг
|
510
|
1300
|
|
|
Витамин
В5 (никотиновая кислота), мг
|
13
|
36
|
|
Зола пивной дробины содержит фосфорного
ангидрида 40,5 %, оксиды калия 3,9%, кальция 0,5%, магния 11,5%, кремния 23,3%
[56].
Обнаружены такие сахара как - манноза, ксилоза,
арабиноза, глюкоза и галактоза. Высокое содержание глюкозы (17,85%) в
трудногидролизуемой фракции показывает, что состав пивной дробины содержит
целлюлозу и трудногидролизируемый в-глюкан [64].
В жидкой фазе пивной дробины были обнаружены
липидные вещества, которые представлены в основном триглециридами, свободными
жирными кислотами и фосфолипидами [136].
Дробина обладает хорошей усвояемостью и
благоприятным влиянием ее состава на пищеварительную систему животных,
благодаря чему ее относят к ценным кормам. Протеин дробины содержит все
незаменимые аминокислоты [108].
Главный технологический показатель пивной дробины
- общий экстракт, не должен превышать 1,5-2,0 %, в том числе вымываемый
0,6-0,9% и невымываемый 0,9-1,3 % к массе сырья [88], с увеличением влажности
дробины - экстрактивность уменьшается [64].
.1.2 Способы использования пивной дробины
В пивоварении, как одной из отраслей пищевой
промышленности, образуется огромное количество различного рода отходов (до 1
млн. т). Основным из этих отходов является дробина, на долю которой приходится
около 80% от всей массы [30].
Хранят дробину в специально оборудованных
бункерах. При хранении пивной дробины в течении месяца происходит накопление
уксусной кислоты в количестве 125,7±0,13 мг/кг, что приводит к увеличению ее
экологической опасности (IV
класс опасности отхода) [72,73].
Производители пива заинтересованы в сбыте пивной
дробины, в частности в летний период года, когда она подвергается более
интенсивному разложению. Реализацию пивной дробины осуществляют по
обусловленной цене [28, 54, 96, 112, 121].
Следует выделить несколько направлений
утилизации дробины, по которым проводятся научные исследования:
использование вторичных сырьевых ресурсов (ВСР)
пивоварения в процессах солодоращения и пивоварения [72, 158, 159];
повышение питательной ценности вторичных
сырьевых ресурсов (ВСР), используемых в качестве корма, получаемый способом
гидролиза плохо усвояемых полисахаридов [72,144];
- повышение питательной ценности
углеводсодержащих отходов, идущих на кормовые цели путем добавления белка
микробного происхождения, минеральных солей, органических соединений (пептидов,
аминокислот и др.) и обезвоживания [72, 137,145,146,166];
- производство антибиотиков и других
биологически активных веществ используемых для корма или добавок в корма птице
и молодняку [72, 138,150];
- производство пищевого белка, аминокислот,
фармацевтических препаратов, косметических и парфюмерных добавок [25, 64,
72,147];
- использование отходов пивоваренной
промышленности в производстве продуктов питания [72,104,135,142,148,155].
Пивная дробина в животноводстве
В настоящее время одним из основных способов
применения пивной дробины является ее использование в качестве корма. Она
относится к лучшим видам отходов как по переваримости, вкусовым качествам, так
и по содержанию протеина, обладает относительно высокими кормовыми
достоинствами [34]. Ее охотно поедают все виды животных [41,72,103,123].
Кормовые рационы свиней примерно на 34% состоят
из пищевых отходов и 66% из комбикормов [53].
Пивную дробину рекомендуются скармливать на
голову в сутки (кг): быкам-производителям - 4…5; коровам - 15…20; нетелям -
10…12; молодняку КРС старше года - 8…10; телятам до 1 года - 4…5; откормочному
поголовью КРС -15…20; хрякам и свиноматкам - 4…5; молодняку - 2…2,5; поросятам
старше 4 месяцев и свиньям на откорме - 3…4 [81].
Пивная дробина в свежем и сухом виде является хорошим
молокогонным и белковым кормом, поэтому с успехом используется для скармливания
коровам и для откорма крупного рогатого скота и свиней. Кормовые достоинства
100 кг дробины составляет для свежей дробины 23 кормовых единицы, а для сухой -
80 единиц [46].
Как видно из табл.1, пивная дробина содержит
витамины группы В, Е, что в свою очередь является необходимыми компонентами
кормления сельскохозяйственных животных, и без них невозможно обеспечить
сбалансированное питание, а, следовательно и высокую продуктивность [26].
Однако, пивная дробина бедна минеральными
веществами и водорастворимыми витаминами, поэтому наиболее целесообразно
использовать ее для откорма КРС совместно с биотрином. В ходе опытов было
установлено, что она обогащает рацион протеином и способствует повышению обмена
его в организме коров, а также несколько улучшает использование кальция и
фосфора. В рационы коров возможно вводить до 20% (по питательности рациона)
дробины. Введение в рацион откармливаемых свиней пивной дробины до 11% по питательности
повышает среднесуточные привесы на 8%. Как показали результаты экспериментов,
расход кормов на 1кг привеса был на 0,32 кормовой единицы меньше, чем в группах
животных, получавших дробину в количестве 2% от питательности рациона. Можно
отметить, что свиньи усваивают ее несколько хуже, чем жвачные. Так, жвачные
переваривают сырой протеин дробины на 68…73%, а свиньи - только 58,9%. Наиболее
эффективно для КРС и свиней пивную дробину использовать в свежем виде [81].
Японскими учеными предложен способ приготовления
свежего корма для КРС с длительным хранением. В соответствии данному способу
вторичные сырьевые ресурсы (ВСР) пивоваренного производства, содержащие 75-85%
воды смешивают с ячменной либо пшеничной мукой, чтобы довести влагосодержание
до 75%, также вносят 0,2-0,3% сахарного сиропа, далее полученную смесь
герметично упаковывают [72].
Пивная дробина в производстве
кормопродуктов
В отечественном пивоварении 75-78%
вырабатываемого ценного экстрактсодержащего сырья используется на производство пива
разных сортов. Оставшаяся часть сухих веществ - это ВСР и отходы производства.
Наличие в них значительных количеств сырого
протеина, некрахмальных полисахаридов, витаминов и минеральных веществ
обусловливает целесообразность их применения на кормовые, пищевые и другие цели
в различных отраслях народного хозяйства РФ. В условиях слабой кормовой базы РФ
рациональное использование ВСР и отходов пивоварения в кормовых целях,
применяемых в настоящее время только в виде сырой пивной дробины со сроком
хранения 24 ч, особенно актуально [73].
Свежая пивная дробина, применяемая в виде
кормового средства обладает рядом определенных недостатков:
малая стойкость при хранении, вследствие
содержания в ней веществ, подвергающихся быстрой порче (срок хранения пивной дробины
не более 24 ч) [49,64,79];
неполная усвояемость отдельных ингредиентов
скотом.
По этой причине невозможно широкое использование
пивной дробины. При температуре 15-30єС дробина обсеменяется и прокисает,
поэтому актуален вопрос разработки и внедрения методов консервирования и
конверсии дробины, которые позволяли бы сохранять кормовые качества сырья
[74,99].
Консервирование пивной дробины
Одним из основных способов консервирования
пивной дробины является сушка.
В производстве широко распространены процессы
сушки, в частности обработка материала во взвешенном слое, что является одним
из средств интенсификации производства. За счет использования взвешенного слоя
удается сократить время обработки материалов применением более высоких
скоростей материальных потоков [37,38,82,102].
Сушка - весьма сложный комплекс тепловых,
диффузионных, биологических и химических явлений, особенно при интенсивных
режимах. Интенсификация сушки невозможна без знания ее закономерностей, без
глубоких предварительных исследований, как в теоретическом, так и в
экспериментальном плане, использования обширного математического аппарата.
Процесс сушки сопряжен с рядом специфических трудностей, среди которых
основными: малая скорость процесса, неравномерность нагрева и влагоудаления, пожароопасность
и др. Конечной целью сушки является получение качественного продукта,
удовлетворяющего условиям хранения и транспортировки [37,82,87].
Кроме сушки, существуют другие способы
консервирования пивной дробины, поскольку сушка с экономической точки зрения не
всегда оправдана. Это высокая энергоемкость (40000 - 60000 ккал на 100 кг
дробины); потеря до 15% с/в при отжатии, предшествующем сушке [110].
В связи с этим пивную дробину часто вместо сушки
обезвоживают. С целью сокращения массы транспортируемого продукта. Поэтому
сначала удаляется излишняя жидкость. Для этих целей чаще всего применяются
нутч-фильтры [72]. Далее дробину подвергают дополнительному обезвоживанию на
винтовых шнеках, в которой твердая фаза приобретает прессованный или
брикетированный вид продукта влажностью 60-65% [63].
Предложено обезвоживать пивную дробину до 30%
сухих веществ методом гравитационной фильтрации, предварительно смешивая ее с
раствором коагулянта, что способствует формированию хлопьев, которые
удерживаются на фильтрационной ткани [48,151].
Сохранность пивной дробины обеспечивает
консерванты [58] и силосование [161]. В качестве закваски для силосования
используют как продукты растительного происхождения: кормовой подсолнечник,
патоку, так и различные химические препараты: органические и минеральные
кислоты [45,139,162].
Установлено, например, что эффективными
консервантами для дробины являются растворы 0,4%-ной пропионовой кислоты,
0,2…0,4%-ной муравьиной кислоты, 0,4%ной смеси этих кислот. Обработка ими в
количестве 1% от консервируемой массы позволяет сохранить пивную дробину в
течение 14 суток [41,94].
Авторами предложен метод стабилизации дробины
препаратами заквашенной и сгущенной сыворотки. При этом начальная кислотность
дробины должна быть доведена используемым препаратом до pH
4. При этом методе качество сохранности дробины составляла 4 недели [116].
В исследованиях Сазоновой И.А., где дробина под
влиянием консервантов в анаэробных условиях органолептические свойства,
присущие пивной дробине, сохранялись в течение всех трех месяцев исследования.
В консервированной пивной дробине, практически, не изменялось содержание влаги
и минеральных веществ. В то же время в ней наблюдалось снижение pH,
а к концу опыта (90 дней) содержание лактата в дробине увеличилось в 12-15 раз,
тогда как в контрольной партии в 7 раз. К 30 дню эксперимента в контрольной
партии, по сравнению с сырой пивной дробиной, уменьшалось содержание протеина
на 40%, жира - на 14%, а клетчатки - на 28%. В опытных партиях же содержание
протеина, жира и клетчатки оставалось на исходном уровне. Аналогичные
результаты были получены и через 90 дней консервации. Следовательно, химические
консерванты, по данным исследования особенно бензоат натрия являются весьма
эффективными стабилизаторами сырой пивной дробины, биологическая ценность
которой не изменяется в процессе достаточно длительного времени, т.е. в течение
3-х месяцев [106].
Исходя из вышеизложенного, можно говорить о том,
что существуют многочисленные способы консервации пивной дробины для повышения
срока её хранения.
Авторами предложены следующие методы сохранения
дробины для кормовых целей - сушка, обезвоживание, консервирования силосование,
а также гранулирование [74,76,77].
Одним из основных способов консервирования
пивной дробины является сушка.
В США и ряде других стран пивную дробину сушат
[71,91,149].
Необходимость консервирования сырой пивной
дробины можно объяснить, если исходить из логистики, а также более длительному
сохранению ее технологических показателей [8].
С экономической точки зрения, производство сухих
кормопродуктов на основе пивной дробины имеет высокую рентабельность [47].
Обладая хорошей транспортабельностью, сухая
дробина при ее использовании для производства комбикормов может в значительной
мере способствовать рациональному регулированию кормовых балансов в
животноводстве отдельных экономических районов России [34,98,115].
Сушка пивной дробины проводится в ротационных и
пневматических сушилках при температуре не более 60єС во избежание снижения
питательной ценности [34]. Для этого применяют простейшие барабанные сушилки
разных конструкций.
Григорьевым М.А. проведены исследования, на
основании которого разработана ресурсосберегающая технология с использованием
пивной дробины и ржаного сусла для производства белково-аминокислотного
препарата. Продукт, полученный по данной технологии, может быть использован в
качестве составляющей для премиксов [45].
Одним из приемов повышения кормовой и пищевой
ценности дробины является обогащение ее белком путем смешивания с другими
отходами производства. Это позволяет восполнить запасы белка у животных без
применения других азотистых добавок. Разработчиком данной технологии является
ГНУ ВНИИПБиВП. Для производства белково - кормового продукта применяют
следующие ВСР, % на сухое вещество: дробину пивную - 80,0; дрожжи пивные - 5,5;
белковый отстой - 6,5; полировочные и аспирационные отходы [цитировано по 73].
Принципиальная технологическая схема,
предложенная ГНУ ВНИИПБиВП, включает следующие стадии: разделение и
обезвоживание, подработка пивной дробины, внесение других отходов и добавок,
выпаривание фильтрата, сушка твердой фазы, гранулирование готового кормового
продукта, упаковка. Были получены следующие показатели исследований: сухое
вещество - 90%, в том числе сырой протеин - 19-22%, кормовая ценность - 0,76
к.е. [73,110].
Для повышения кормовой ценности дробины, также
могут использованы ферментные препараты цитолитического и протеолитического
действия. При комплексной обработке этими ферментами более 50% сухих веществ
гидролизуется до растворимого состояния [157].
Авторами [108] разработан продукт с повышенной
биологической ценностью, обогащенный белком и другими ценными веществами,
полученный способом биотрансформации пивной дробины. Содержание белка
увеличивается на 58%. Также установлено увеличение содержания аминокислот
лизина и метионина на 20-25%.
Пивная дробина в роли питательной среды
По результатам многих исследований, пивную
дробину можно считать хорошим субстратом для выращивания одноклеточного белка,
который применяется в различных пищевых продуктах и кормах [72].
Под одноклеточными белками понимают - дрожжи,
бактерии, грибы и водоросли.
Белок, полученный нетрадиционным путем, то есть
из пищевых и сельскохозяйственных отходов, может быть применен в пищевых целях
в случаях, если он удовлетворяет ряду требований: 1) низкая себестоимость
продукта; 2) соответствие предъявляемым медико - биологическим требованиям; 3)
технологические свойства продукта [93].
Из этих условий особенно важно второе, поскольку
белок должен быть свободным от токсинов, не являться аллергеном и
характеризоваться высокой усвояемостью. Исходя из этого положения можно считать
наиболее перспективным направлением применение непатогенных микроорганизмов и
их выращивание на субстратах, не содержащих вредных для здоровья человека
соединений, так как очистка белков от вредных примесей без нарушения
реологических свойств продукта очень трудна, а в ряде случаев невозможна.
С целью рационального использования основных
отходов пивоваренного производства наиболее целесообразно комплексное
использование солодовой и хмелевой дробины, остатков пивных дрожжей, солодовых
ростков и белкового отстоя, при использовании также замочной воды из солодовни
вместо свежей [81].
Солодовая дробина занимает наибольшей удельный
вес (85%) среди отходов, поэтому в основу переработки их была положена
разработанная технология получения дрожжей из солодовой дробины. При этом
отходы подвергаются термоферментативному гидролизу и на полученных гидролизатах
выращивают кормовые дрожжи. Около 1/3 сухих веществ дробины, в основном
углеводов, используется на гидролиз, 2/3 остаются негидролизованными и могут
быть использованы на корм (белки, целлюлоза).
Переработка дробины путем гидролиза и
последующего выращивания кормовых дрожжей по описанной выше технологии
позволяет получить биотрин - ценную добавку в корм для свиней и птиц.
Быковой И.А. [30] на основе разработанной ей
модели управления органическими отходами отработанны различные варианты
использования пивной дробины. Один из которых предусматривает использование
пивной дробины (со сроком хранения менее 2-х суток) в качестве компонента
субстрата для выращивания дереворазрушающего гриба вешенка обыкновенная,
состоящего из соломы и лузги в соотношении 1:1. Достоинством этого варианта
использования пивной дробины является наличие в отходе одновременно клетчатки и
белка, с добавлением которых в субстрат грибы могут обогащаться азотом, что
приводит к увеличению их питательности.
Исследования показали, что в сравнении с соломой
и лузгой дробина имеет значительные преимущества, поскольку содержит протеина в
3 раза больше, чем солома, и в 3,5 раза больше, чем в лузге.
Исходя из химического состава пивной дробины,
есть основания предполагать, что пивная дробина может использоваться как
питательная среда для микробного биосинтеза
Таким образом, как показывают исследования,
использование пивной дробины, как компонент питательной среды для
культивирования микроорганизмов довольно таки перспективно.
Пивная дробина в пищевой промышленности
Пивная дробина является одним из перспективных
компонентов для использования в пищевой промышленности, для производства
биологически активных добавок к пище и функциональных композиций в
хлебопекарной, кондитерской, мясоперерабатывающей и других областях
промышленности, а также в кормопроизводстве [12].
В связи с этим, поскольку в настоящее время
очень перспективны безотходные и малоотходные технологии переработки
растительного сырья, а также ведется активный поиск новых источников, в том
числе нетрадиционных, биологически активных веществ, то целесообразным является
использование и переработка пивной дробины как ценного биологически активного
сырья в пищевых целях, а также при производстве биологически активных добавок.
Авторы предлагают следующий способ получения
биологически активной муки из пивной дробины, который включает предварительное
прессование исходной сырой пивной дробины с содержанием сухих веществ более 20%
с дальнейшим выделением твердой отпрессованной фракции и удалением жидкой
фракции. Затем твердую фракцию подвергают сушке при температуре 40-60 єС с
одновременным частичным измельчением. Далее высушенная пивная дробина поступает
в молотковую дробилку с сеткой диаметром отверстий 1мм, а оттуда измельченная
пивная дробина подается на сито с диаметром отверстий 0,2 мм с получением
биологически активной муки со степенью дисперсности 60 мкм. Конечная мука
содержит жирные кислоты в следующем составе: миристиновая до 0,85%;
пентадекановая до 0,6%; пальмитиновая до 40,0%; пальмитолеиновая до 8,93%;
гептадекановая до 0,35%; стеариновая до 6,6%; олеиновая до 11,2%; линолевая до
32,14%; линоленовая до 2,35, а также содержит витамин Е в количестве 2 мг на
100г муки. Данная технология получения биологически активной муки из пивной
дробины является универсальной, позволяет максимально сохранить все ценные
биологически активные компоненты исходной пивной дробины и обеспечивает
конечному продукту широкие функциональные оздоровительные свойства, позволяющие
использовать ее как в питании животного и человека.
Антиповым С.Т. и др. предложен способ получения
пищевой биодобавки. Изобретение относится к переработке отходов пивоваренного
производства. В данном способе получения пищевой биодобавки из вторичных
сырьевых ресурсов пивоваренного производства получение твердого компонента
осуществляют путем удаления из исходного сырья влаги в активном
гидродинамическом режиме с зонами сушки и досушки. Затем непрерывно смешивают
его с жидким компонентом. Осуществляют окончательную сушку полученной смеси в
активном гидродинамическом режиме тем же сушильным агентом, что и при получении
твердого компонента.
Задачей изобретения является повышение качества
компонентов смеси, питательной ценности твердого компонента, пивной дробины, и
эффективности сушки полученного продукта [9,10].
Предлагается использовать пивную дробину, как
продукт с высоким содержанием клетчатки в хлебопечении, т.к. дробина содержит
большое количество белка и диетической клетчатки (3:7), по питательной ценности
не уступает пшеничным отрубям [153], а также не содержит вредных веществ [135,140,141-143].
В основном дробина используется в технологии
хлебобулочных изделий в качестве пищевой добавки [62].
В Великобритании есть опыт добавления в хлеб,
печенье муку из пивной дробины. Готовый продукт при этом приобретает вкус
солода [137].
Блинковым разработана технология производства
ксилита. Исключительность технологии заключается в ее безотходности. Также все
побочные продукты находят свое применение. Из 1 тонны дробины, кроме ксилита,
получается около 50 кг белкового концентрата, которые имеют место применение в
хлебопекарной промышленности в качестве ценных добавок. Остальные полупродукты
можно использовать как корм для сельскохозяйственных животных. Особенность
технологии - в гидролизе. Слегка изменив условия гидролиза, можно как из пивной
дробины, так и из других растительных отходов, получить - этиловый спирт, а
также активированный уголь, углекислоту в виде сухого льда, некоторые
энтеросорбенты медицинского и ветеринарного назначения, фурановые кислоты
[27,105].
В университете Британской Колумбии пивная
дробина привлекла внимание по своим качествам, как возможный компонент многих
пищевых продуктов. В частности, как источник полезных балластных веществ
[163,164].
Применение пивной дробины открывает широкую
перспективу для одновременного решения трех проблем: охраны окружающей среды,
создания «экологически чистых» и высококачественных пищевых продуктов, а также
снижения себестоимости в производстве различных продуктов.
Пивная дробина в потенциале может обладать
большим спектром применения.
К примеру, Ковалев Н.Г., Рабинович Р.М., Сульман
Э.М. и др. разработали технологию получения компоста с использованием пивной
дробины. Изобретение относится к сельскому хозяйству, в частности к способам
переработки навоза и другого органического сырья. Способ включает перемешивание
послойно уложенных органических отходов и торфа, загрузку смеси в ферментер и
последующее аэробное компостирование смеси посредством периодического
вентилирования ее воздухом при влажности смеси 50-60%. В состав исходной смеси дополнительно
вводят пивную дробину в количестве 10-20% к общей ее массе, которую перед
операцией перемешивания компонентов смеси послойно укладывают с предварительно
измельченными до гранулометрического состава от 0,1 до 10 мм органическими
отходами и торфом. Органические отходы и торф вместе с пивной дробиной берут в
соотношении 50:50. Периодическое вентилирование смеси проводят в течение 7
суток по 20 секунд каждые 10 минут. Способ позволяет улучшить характеристики
компоста выражающиеся в высокой питательной ценности при использовании в
качестве удобрения [70].
В работе [30] установлено, что хранившаяся
пивная дробина, используемая в качестве органического удобрения - мелиоранта со
свойствами компоста, в дозах от 20 до 80 т/га нейтрализует кислотность солонцовых
почв и увеличивает урожайность ячменя. Оптимальной следует считать дозу дробины
80 т/га, при которой наблюдается максимальный 50% - ный прирост урожайности и
52%-ный прирост кормовой ценности ячменя.
Пивная дробина имеет также совсем нестандартное
применение. В частности, в роли реагента для обработки буровых растворов.
Относится к реагентам для обработки минерализованных буровых растворов, которые
улучшают технологичность в использовании реагентов при отрицательных
температурах [44].
Изучив литературные источники в области
использования пивной дробины, можно говорить о большом потенциале его
применения.
1.2 Электрохимическая обработка воды и растворов
.2.1 Общие сведения о ЭХА воде и технологии ее
получения
За последние 30 лет интенсивно развивается новое
научно-техническое направление - электрохимическая активация (ЭХА) воды и
водных растворов. Известно, что идеально чистой воды в природе не существует.
Даже дистиллированная вода содержит до 5мг/л примесей [13]. Вода поверхностных
источников и подземная вода для водопользования - технических целей и бытового
потребления - подвергается очистке и обезвреживанию различными методами -
фильтрацией, сорбцией, обработкой химреагентом, а также электрохимическими
способами [48].
С целью повышения активации воды применяют
следующие способы:
дегазация воды и магнитная обработка [47];
конденсация паров воды с возникновением ее
стойкой модификации с плотностью 1,4 или температурой активации воды и водных
ресурсов [50];
электрохимическая активация воды.
Электрохимическая активация как
физико-химический процесс - это совокупность осуществляемых в условиях
минимального выделения тепла электрохимического и электрофизического
воздействий на воду с содержащимися в ней ионами и молекулами растворенных
веществ в области пространственного заряда у поверхности электрода (либо анода,
либо катода) электрохимической системы при неравновесном переносе заряда через
границу “электрод-электролит” электронами.
ЭХА водных растворов - это процесс перехода
растворов в метастабильное состояние, вызванное структурно - энергетическими и
электрохимическими изменениями в электрическом поле, в результате которых
растворы в течение периода релаксации проявляют аномальные свойства в физико -
химических превращениях, в частности такими показателями, как значение pH
и ОВП (ц,окислительно - восстановительным потенциалом) [15,16,17,67,70].
Термин "электрохимическая активация"
предложен Бахиром В.М. в 1975 году после установления факта релаксационных
изменений параметров разбавленных растворов в результате предшествующего
униполярного электрохимического воздействия [15,92].
В начале 80-х годов [15] была сформулирована
концепция развития электрохимической активации: модульные электрохимические
реакторы - универсальный инструмент в руках исследователей и основа совершенных
промышленных электрохимических аппаратов для различных экологически чистых
технологий.
ЭХА водных сред используется в настоящее время в
процессе разработки новых, достаточно эффективных экологически чистых
ресурсосберегающх технологий, например технологии глубокой очистки воды и
технологии очистки поверхности полупроводниковых материалов [18,68].
На перспективность ЭХА жидкостей указывают
многочисленные примеры их использования в промышленности, сельском хозяйстве и
медицине.
ЭХА вода (католит) содержит больше минеральных
веществ по сравнению с обычной водой: калия на 19,0%; магния - на 4,5%; кальция
- на 5,7; нитратов меньше - на 7,4%.
К настоящему моменту исследования феномена и
технологий ЭХА имеют обширную географию, включая США, Англию, Германию и ряд
других стран.
ЭХА применяют с целью регулирования и
оптимизации процессов на различных технологических этапах производства.
ЭХА проводят путем униполярной обработки воды в
электролизере (активаторе) с диафрагмой - полупроницаемая перегородкой,
разделяющей его на катодную и анодную камеры (зоны), в которых расположены
соответственно катод и анод. Исследования этого явления выявили, что ЭХА
связана с комплексом воздействий на свойства водносолевых систем, протекающих
на электродах электроактиватора. В простейшем случае во время электрообработки
за счет электрохимических и химических превращений жидкость в катодной камере
(католит) превращается в раствор щелочей и восстановителей, в анодной камере -
кислот и окислителей. ЭХА осуществляют в разбавленных растворах, например, с
концентрацией веществ ≤ 0,01моль/дм3 в пресной воде, или до 5
г/дм3 [31,104] в воде с добавлением минеральных солей при высоком
значении внешней поляризующей электродвижущей силы (ЭДС). В этих растворах
наряду с продуктами электролиза растворенных веществ возрастает роль
электролиза растворителя, проявляются изменения растворителя и ионно-гидратные
образования, возникают и промежуточные состояния реагирующих частиц (ионов
различной степени окисления, молекул и радикалов) [34,55,57].
Исследовано и установлено, что в результате
обработки воды постоянным электрическим током в зоне одного из поляризованных
инертных электродов - диафрагменного электролизера, возникает метастабильное
состояние водной системы с повышенным уровнем внутренней потенциальной энергии,
которое вызывает значительное изменение в ее реакционной способности и скорости
протекания химических процессов[52].
Авторами [134] изучено перераспределение ряда
металлов - примесей воды при её электроактивации. Показано, что при
электроактивации концентрации меди, цинка, никеля, железа в католите
уменьшились (по сравнению с исходной водой) в 2-10 раз, в анолите изменения
менее значительны.
Величина рН является наиболее важным
показателем, характеризующим свойства активированной воды. Значение данного
показателя позволяет оценить состояние воды, характер физико-химических и
биохимических процессов, происходящих в ней, а также определяет направление и
длительность фазово-дисперсных превращений примесей.
В ЭХА растворах на основе минеральных солей с
различными показателями минерализации крайние сочетания pH
и ОВП следующие [86]: для анолита pH
0-1, ОВП 1000-1150 мВ; для католита pH
11,5-12,5, ОВП- 750 - -850 мВ. В обычных лабораторных условиях достичь таких
отклонений ОВП водных сред с помощью добавок различных реагентов к
неактивированной воде невозможно.
После электрохимической обработки воды
показатели pH и ОВП
(анолита и католита) выходят не только за пределы допустимого химического
регулирования, а также за пределы термодинамической устойчивости воды.
.2.2 Использование ЭХА водных растворов в
качестве дезинфицирующих средств
Описан ряд способов применения ЭХА растворов
хлорида натрия - анолита для дезинфекции в птицеводстве, животноводстве и
других отраслях. Возможность получения функционально-полезных растворов
различного назначения функционально-полезных ЭХА, как экологически чистую
технологию, весьма полезной для аграрно-промышленных предприятий, в т.ч. для
фермерских хозяйств, поскольку реализуются ЭХА с помощью малогабаритных,
высокопроизводительных, простых в обслуживании установок [24, 53, 84, 86, 97,
119,120].
Католит, полученный даже из
слабоминерализованной воды обладает повышенной адсорбционно-химической
активностью, что позволяет ему проникать в капилляры гидрофильных твердых
структур и очищать их от загрязнений, дезинфицируя [2].
Дезинфекция с помощью ЭХА водных растворов -
экологически чистый метод. Расходы в этом случае значительно ниже, чем при
применении химических и биопрепаратов.
Анолит внесён в реестр дезинфицирующих средств,
разрешённых для применения на территории РФ.
Анолит успешно применяется для дезинфекции
помещений, клеток, тары, обеззараживание грубых кормов для зверьков, для
профилактики заболеваний повышения эффективности их выращивания.
Обработка ЭХА водой обходится дешевле, чем
известными методами. В изобретении [3] используют анолит на основе 0,1-1%-ного
раствора NaCl. Степень
обеззараживания 87-95%.
В работах [1,86], с целью снижения потерь
цитрусовых плодов при хранении и увеличении продолжительности хранения
водносолевой раствор (NaCl)
обрабатывают в анодной зоне диффрагменного электролизера до pH
2-2,5 с ОВП 400-600 мВ и обрабатывают плоды в течение 3-4 минут, хранят при
относительной влажности 85-90%, поддерживаемой распылением водносолевого
католита с pH 10,6-11,5 и
ОВП- - 800 мВ. Например, за 90 суток хранения массовая доля потерь от микробной
порчи составляет 2,5% против 5,5% в контроле, от усыхания сокращаются потери от
20,5% до нуля.
.2.3 Применение ЭХА воды в пищевой промышленности
В 1998 году в США на целевую программу замены
дезинфектантов в перерабатывающей промышленности был затрачен 1 млрд долларов.
Принцип электрохимической активации воды используется для получения
активированных фракций воды: дезинфицирующих, стерилизующих - анолит и моющих -
католит. Полученные растворы применяются в медицине, сельскохозяйственном,
промышленном производстве, ветеринарии и других отраслях народного хозяйства.
Продукты, полученные в технологических процессах
с применением электрохимически активированных воды или растворов, обладают
стабильными во времени физико-химическими параметрами и характеристиками
(цитировано по [18]).
В исследованиях Бушиной И.А. [29], коньяк
приготовленный с использованием ЭХА воды получил наиболее высокую дегустационную
оценку (8,55 баллов). Этот образец отличался более мягким, гармоничным и чистым
вкусом, его дегустационная оценка была выше на 0,15-0,35 балла, по сравнению с
аналогичными образцами, приготовленными на воде, умягченной другими способами.
Анализировали купажи коньяка, приготовленные на ЭХА воде, хранившейся от 0 до 4
суток. Установлено, что все образцы купажей коньяка, приготовленные на ЭХА воде
и прошедшие послекупажный отдых не различались по своим органолептическим
показателям.
Апаликовым М.А. исследовано, что выпаивание
свиней ЭХА водой - католитом в количестве 50г/кг живой массы и увлажнение
комбикорма в расчете 3:1 этой водой, оказывает положительное влияние на
переваримость и использование питательных веществ. Так, переваримость организмом
свиней сухого вещества оказалось выше в среднем в опытных группах на 0,9-7,0
%,, органического вещества - на 0,7-6,1%, сырой клетчатки - на 1,2-7,6% по
сравнению с контрольной группой. Азот корма, кальций, фосфор лучшие
использовали опытные свиньи, чем контрольные [10].
Казидо Г.М. предложено использовать ЭХА воду в
обработки пивной дробины и использовать воду, как экстрагент для выделения
белка. При значении pH
=11,5, выход составляет 40% [61].
Из литературных данных известно о применении
ЭХА-растворов, полученных на установке «СТЭЛ-20 АК», для экстракции хмеля.
Согласно результатам эксперимента, использование ЭХА-растворов позволило
уменьшить потери б-кислот, сократить порции задачи хмеля, сохранить качество
готового пива, а также снизить себестоимость продукта [126].
Авторами исследовано, что применение
ЭХА-растворов на стадии предобработки хмеля увеличивает содержание б-кислот в
экстракте хмеля. При дегустационной оценке такой образец пива имел самую
высокую оценку. Он отличался мягким, гармоничным вкусом и имел более высокую
оценку по сравнению с аналогичным по составу образцами, приготовленными с
использованием хмеля, обработанного водой различного способа умягчения.
Параметры предобработки следующие: температура 45єС, pH
5,5, длительность экстракции 60мин. Подобранный режим предобработки хмеля
экономически целесообразен и улучшает дегустационную оценку готового пива [80].
Авторами установлено влияние ЭХА воды на
активность ферментов солода и препаратов микробного происхождения разного
спектра действия. Растворы ферментов и вытяжек, приготовленных на анолите
обладают более высокой активностью, что позволяет говорить об активации
ферментов. Эксперименты также показали, что оптимальное время воздействия 15
мин, а дальнейшая активация не приводит к нужным результатам. При применении
растворов ферментов на ЭХА-воде происходит увеличение экстрактивности солода и
несоложеных материалов на 1-2% по сравнению с контрольным образцом. Кроме того,
при уменьшении нормы задачи ферментов на 12 % экстрактивность и время
осахаривания остаются такими же, как и в контроле, что позволяет экономить
дорогостоящие ферментные препараты [127].
Раствор анолита обладает не только бактерицидной
и вирулицидной активностью, но также и спороцидной активностью, что
обусловливает его использование не только для дезинфекции, но также для
стерилизации в соответствии с методическими указаниями органов
Госсанэпиднадзора.
Авторы [18] производили смешивание анолита и
микробных культур на жидких средах. Содержание оксидантов в анолите 130-150
мг/дм3. Использовали свежий анолит, приготовленный ex-tompara,
и анолит со сроком хранения 3 дня. Исходная концентрация микроорганизмов в
культуре - 109 микробных клеток на миллилитр. Пропорции при
смешивании анолита и микробной культуры:
) 10 см3 анолита на 1 см3
культуры;
) 1 см3 анолита на 10 см3
культуры.
Данные показали, что разведение живой культуры
микробов на жидких средах в анолите в пропорциях «анолит/культура» 10:1 и 1:10
полностью подавляло жизнедеятельность микроорганизмов.
Таким образом, свежий анолит пригоден для
обеззараживания объектов методом погружения или смачивания в присутствии
органических загрязнений. При пользовании анолитом со сроком хранения 3 дня и
более необходимо предварительно удаление органических загрязнений и увеличение времени
экспозиции.
Электрохимически активированные анолиты обладают
универсальным спектром действия, т.е. оказывают повреждающее влияние на все
крупные систематические группы микробов (бактерии, грибы, вирусы и простейшие),
не причиняя вреда клеткам тканей человека и других высших организмов, т.е.
соматическим животным клеткам в составе многоклеточной системы.
Химический потенциал молекул и ионов в
электрохимически активированных биоцидных растворах (ЭХА-растворах) намного
выше, чем в неактивированных. Низкая минерализация ЭХА-растворов и их
повышенная гидратационная способность, способствующая увеличению проницаемости
клеточных стенок и мембран, создают условия для интенсивного осмотического и
электроосмотического переноса оксидантов во внутриклеточную среду. Осмотический
перенос оксидантов через оболочки и мембраны микробных клеток, ввиду
существенного различия осмотического градиента этих типов клеток. Ускоренному
электроосмотическому переносу оксидантов внутрь бактериальных клеток
способствуют многочисленные электрически заряженные микропузырьки электролизных
газов, создающие в зонах контакта с биополимерами мощные локальные
электрические поля с высокой степенью неоднородности [18].
Известно, что электрохимическая активированная
воды (в дальнейшем ЭХА вода) приобретает ряд уникальных свойств, область
применения которых может быть достаточно широка для различных отраслей пищевой
промышленности. В зависимости от способа получения воды (технологических
параметров), аппаратурного оформления процесса (конструкции аппарата, состава и
свойств его основных элементов) она может приобретать свойства антисептика для
предотвращения микробиологической порчи продуктов, реагента, гидролизующего
труднодоступные даже кислотам и щелочам субстраты и целый ряд других свойств, описанных
в литературе.
Авторов привлекло внимание способность ЭХА воды
повышать физико-химическую стабильность напитков при их бесконтактной
обработке.
Работу проводили на установке типа "труба в
трубе", внутри которой циркулировало пиво или сусло, а в наружной части
ЭХА вода, имеющая щелочные значения рН.
Бесконтактной обработке подвергали готовое пиво
(начальное содержание сухих веществ в сусле 11°), а также охмеленное и
неохмеленное сусло. Критерием оценки являлась стабильность готового пива после
обработки.
Отмечена корреляционная зависимость увеличения
стабильности пива от скорости потока при бесконтактной обработке. При этом
выявлено изменение вкуса готового пива после его обработки и сделан
предварительный вывод, что данный метод должен рассматриваться в сочетании с
корректировкой рецептур [36].
Анализируя литературные данные, можно
предположить о широком применении ЭХА воды в различных отраслях пищевой
промышленности и о её перспективности.
.3 БАД в роли активаторов процессов брожения
В настоящее время актуальной стоит задача
интенсификации процессов брожения.
Активаторы брожения - это вещества, которые,
действуя на дрожжи, как стимуляторы, активизируют их размножение и ускоряют
весь процесс брожения, т.е. скорость ферментативной реакции [85,114,118]. К
активаторам брожения относятся промежуточные продукты брожения, вещества
жирного ряда, экстракты (дрожжей, плесневых грибов), витамины, азотсодержащие
вещества, минеральные соли. Положительный эффект от применения вышеназванных
препаратов обусловлен наличием аминокислот, витаминов, микро- и макроэлементов,
что благоприятно сказывается на метаболизме дрожжей [109].
Активаторы делятся на необходимые и
несущественные [51]:
необходимый активатор - реакция идет только в
его присутствии;
- несущественный активатор - реакция идет и в
его отсутствии, но с ним ускоряется.
В качестве активаторов могут выступать ионы
металлов, органические кислоты, аминокислоты (содержащие -SH
группу - глютатион).
Ценнейшей по своим биологическим свойствам
является микроводоросль спирулина платенсис.
Спирулина платенсис (Spirulina
platensis) - это
многоклеточная спиральная нитчатая микроводоросль. Микроводоросль представлена
под микроскопом в виде сине - зеленых нитей, состоящих из цилиндрических
клеток, уложенных в неразветвленные цепи [113].
Спирулина платенсис обладает в составе
множеством необходимых компонентов питательной среды - факторами роста
(витаминами, аминокислотами, макро- и микроэлементами), которые участвуют в
процессе метаболизма дрожжей. Все эти компоненты содержатся в препарате в
сбалансированном количестве [23].
Все эти вещества по отдельности и в совокупности
при добавлении в бродящую среду дают ускорение сбраживания сахаров и накопления
биомассы [75].
Результаты исследования свидетельствуют, что
внесение водного раствора микроводоросли в сусло повышает бродильную активность
дрожжей [6,23].
В настоящее время важным является попытка
управления метаболизмом дрожжевых клеток в бродильных производствах.
Регулирование метаболизма на клеточном и субклеточном уровнях осуществляется,
прежде всего, путем регуляции синтеза и каталитической активности ферментов.
Деятельность всех биологических структур клетки тесно связана с физиологическим
состоянием организма и условиями окружающей среды. Внешние факторы определяют
химический состав дрожжей, который в свою очередь обусловливают их
биологическую функцию[131].
В качестве таких добавок используют различные
подкормки, содержащие минеральные вещества, витамины и источники азота [68].
Автором [60] установлено, что накопление такого
необходимого микроэлемента, как фосфор в биомассе дрожжей Saccharomyces
cerevisiae зависит от состава
питательной среды. Добавление в сусло такого компонента как - гидроортофосфата
аммония, позволяет получить питательную среду с высоким содержанием биомассы,
которая благоприятно влияет на жизнедеятельность дрожжей.
Также активно могут использоваться различные
гидролизаты (кукурузы, белкового отстоя, мяса и др.), являющиеся источником
аминокислот. Автором [35] было показано, что применение данных гидролизатов,
как источник аминокислот позволяет получить на 15-20% больше выхода дрожжей.
Самый простой вариант создания активирующего
комплекса - это составить набор из всех соединений, описанных в литературе, как
факторы роста для дрожжей. Безусловно, это даст ощутимый результат для
производства, но при детальном рассмотрении выявляется ряд особенностей,
зачастую не учитывающихся при создании комплексов подкормок [90].
В современном производстве продуктов брожения
важной задачей остается максимальная интенсификация процессов брожения с
обязательным условием сохранения или улучшения качества готовой продукции.
Ускорение процесса брожения в большей степени связано с биотехнологическими
свойствами пивных дрожжей, с их физиологическим состоянием, которое меняется на
различных фазах роста. Классические технологии не позволяют в полной мере
использовать и поддерживать на высоком уровне активность дрожжей, в связи с чем
процессы протекают более длительно.
Активация дрожжей - наиболее актуальная задача
современных бродильных производств.
Проникновение питательных веществ в дрожжевую
клетку является весьма сложным ферментативным и физико-химическим процессом.
Известно, что прежде чем проникнуть в цитоплазму клетки, питательные вещества
должны пройти через двойной барьер - клеточную стенку и цитоплазматическую
мембрану.
Обмен веществ у микроорганизмов неразрывно
связан с процессом их питания. Потребность дрожжевых клеток в питательных
веществах чрезвычайно разнообразна. Для нормального функционирования дрожжей необходимо,
чтобы в питательной среде присутствовали все элементы, имеющиеся в клетках.
Процесс питания дрожжевых клеток состоит из двух фаз: первая - прохождение
веществ через цитоплазматическую мембрану; вторая - сложные биохимические
реакции метаболизма, состоящие из взаимосвязанных процессов ассимиляции и
диссимиляции. Питательные вещества среды должны обладать растворимостью в воде
или липидах.
Дрожжевые клетки как гетеротрофные организмы
размножаются при наличии в среде углерода. Они используют углерод различных
органических соединений: моносахаров, дисахаров, аминокислот, альдегидов,
органических кислот, этилового спирта, глицерина и др.
Спиртовые дрожжи Saccharomyces
cerevisiae обладают
способностью преимущественно метаболизировать моносахариды (глюкозу, маннозу,
фруктозу и галактозу), а также мальтозу и мальтотриозу.
Рост и размножение дрожжей невозможны при
отсутствии в питательной среде углеродсодержащих соединений. Источниками
углерода для дрожжей являются различные углеводы: лучше всего дрожжи ассимилируют
гексозы (моно- и дисахара), некоторые виды хорошо растут на средах с пентозами.
Для нормальной жизнедеятельности в анаэробных
условиях дрожжами, как и другим микроорганизмам, необходимым азот, который они
способны усваивать в различных формах. Так, например, при размножении дрожжей
средняя потребность в азоте составляет 20-35мг/см3 среды.
Фундаментальные исследования по физиологии
спиртовых дрожжей, азотистому и фосфорному обмену веществ, проведенные проф.
Коноваловым С.А., подтвердили, что содержание азота в сбраживаемых субстратах в
значительной степени определяют скорость синтеза и образование биомассы
дрожжей. Наиболее пригодными для дрожжей, с точки зрения энергетических затрат,
является азот аминокислот.
Использование сбалансированных по аминокислотам
сред способствуют активизации процессов генерации дрожжей, синтеза биомассы и
спиртового брожения.
Аминокислоты имеют первостепенное значение при
брожении для размножения дрожжей и метаболизма не только азотистых веществ, но
и сахаристых веществ. При недостаточном содержании аминокислот в субстрате
проходит замедленное брожение, вследствие чего ухудшаются вкусовые качества
готового напитка
Дефицит аминного азота компенсируется
добавлением легко усвояемых дрожжами питательных веществ в сусло (азотсодержащие
добавки). Если говорить об азотном обмене дрожжей, то, как ни удивительно,
дрожжевой клетке легче синтезировать необходимую аминокислоту из
неорганического азота и сахаров, чем потребить их напрямую из питательной
среды. Исключение составляют лишь аспарагиновая и глутаминовая аминокислоты и
их амиды. В данном случае азот выступает именно как подкормка, т.е. как
строительный элемент и как источник энергии. Для усвоения аминокислот
необходимы определенные концентрации и сочетание их в среде [75,100].
Рост дрожжей задерживается тем сильнее, чем
больше необходимых аминокислот отсутствует в среде.
При недостатке одной из аминокислот в условиях
отсутствия свободного катиона аммония, клетка вынуждена проводить сложные
реакции трансаминирования, дезаминирования аминокислот через ряд промежуточных
соединений. Образующийся при этом NH4 используется для синтеза
недостающих аминокислот. Цепь превращений бывает очень длинной, данный процесс
энергозатратен. Такой процесс медленнее, чем прямое потребление аминокислот
[22,69].
Наличие в среде легкоусвояемого аминного азота
повышает бродильную активность дрожжей, продуктивность клеток. В результате
интенсифицируются процессы роста и размножения дрожжей, возрастает скорость
спиртового брожения, снижается образование побочных метаболитов, повышается
выход и качество спирта. Однако в случае, когда содержание аминокислот в среде
превышает их потребность, аминокислоты трансаминируются с образованием
б-оксикислот с последующим их декарбоксилированием и дальнейшим восстановлением
их до высших спиртов. Таким образом, азотное питание играет огромную роль в
процессе жизнедеятельности дрожжей, а возможность его регуляции позволяет
наметить перспективные направления совершенствования биотехнологических
процессов в бродильных производствах.
Перспективным средством для решения проблем
недоброда могут быть дрожжевые клетки или их составляющие, которые в
значительной степени лишены упомянутого выше недостатка. Так, препарат,
приготовленный из свежих дрожжей путем освобождения клеток от протоплазмы и
последующего высушивания, получивший название «дрожжевые корки», был впервые с
успехом применен в виноделии, где проблемы недоброда стоят особенно остро
(156). Было показано, что «дрожжевые корки», вносимые в количестве 0,3 - 0,4
г/дм3 возобновляли брожение. Кроме того, применение биосорбента
позволяло достичь ряда технологических преимуществ, например, успешно
сбраживать сусло при относительно малой исходной концентрации дрожжей.
«Дрожжевые корки» использовались также для устранения других нежелательных
компонентов бродящей среды в виноделии и для стимулирования яблочно-кислого
брожения [65].
Таким образом, исходя из анализа литературных
данных, можно констатировать, что пивная дробина имеет большой потенциал
применения, учитывая богатый состав сырья. После специальной обработки может
использоваться в качестве подкормки для дрожжей, что является весьма актуальным
направлением исследований.
Глава 2. Объекты и методы исследования
.1 Объекты исследования
В соответствии с целями и задачами в работе
использовались следующие объекты.
Пивная дробина. Получена на минипивоварне МГУПП,
при производстве светлого пива на стадии фильтрации затора, с содержанием сухих
веществ (СВ) 30%. Состав пивной дробины представлен в таблице 2.
Ферментные препараты представлены в таблице 3.
Таблица 2. Состав пивной дробины (в % на СВ)
|
Показатель
|
Содержание
|
|
Массовая
доля сырого протеина, %
|
21,9
|
|
Массовая
доля сырого жира, %
|
6,51
|
|
Массовая
доля сырой клетчатки, %
|
15,7
|
|
Массовая
доля углеводов, %
|
35,5
|
|
Массовая
доля сырой золы, %
|
3,85
|
|
Массовая
доля кальция, %
|
0,37
|
|
Массовая
доля фосфора, %
|
0,703
|
|
Железо,
мг/кг
|
230-500
|
|
Марганец,
мг/кг
|
20-70
|
|
Медь,
мг/кг
|
19-85
|
|
Цинк,
мг/кг
|
45-55
|
|
Йод,
мг/кг
|
0,085
|
|
Молибден,
мг/кг
|
0,985
|
|
Кобальт,
мг/кг
|
0,09-0,2
|
|
Аминокислоты,
% от общего количества белка
|
|
Серин
|
2,82
|
|
Треонин
|
2,8
|
|
Тирозин
|
1,8
|
|
Валин
|
3,6
|
|
Лизин
|
3,94
|
|
Аланин
|
3,7
|
|
Аргинин
|
3,65
|
|
Глицин
|
3,94
|
|
Гистидин
|
1,8
|
|
Изолейцин
|
2,69
|
|
Лейцин
|
6,34
|
|
Метионин
|
1,28
|
3,85
|
Таблица 3. Ферментные препараты и мультиэнзимные
композиции (МЭК), полученные на их основе.
|
Группы
|
Название
ферментного препарата
|
Фирма
- производитель
|
Характеристика
|
Активности,
ед/см3
|
Оптимальные
условия действия
|
|
|
|
|
|
t,0С
|
pH
|
|
I группа МЭК 1)
б-амилаза 2) протеаза 3) в-глюканаза + арабиноксиланаза
|
1)
«Тermamyl SC»
|
«Novozymes»
(Дания)
|
термостабильная
бактериальная б-амилаза, продуцируемая Bacillus
stearothermophilus.
Включает эндоамилазу, которая гидролизует 1,4-б-глюкозидазные связи в амилозе
и амилопектине
|
альфа-амилазная-120;
|
70-85
|
5,0-7,0
|
|
2)
«Alphalase®AP3»
|
«DuPont»
(США)
|
ферментативный
препарат нейтральной протеазы, полученный из Bacillus
amyloliquefaciens.Увеличивет
количество растворенного белка, а также улучшает жизнеспособность дрожжей при
брожении
|
протеолитическая-
550;
|
60-62
|
6,0-6,7
|
|
3)
«Attenuzime®Fleх»
|
«Novozymes» (Дания)
|
представляет
собой смесь глюко-амилазы и б-амилазы. Получен из
генетически-модифицированных микроорганизмов (ГММ) - Aspergillus
niger, Bacillus
subtillis
|
глюко-амилазная-400;
пуллуланазная-80; альфа-амилазная- 120
|
60-65
|
5,5-6,5
|
|
II группа МЭК 4)
б-амилаза 5) в-глюканаза
|
4)
«Ultraflo
MAX»
|
«Novozymes» (Дания)
|
ферментативный
комплекс б-амилазы и в-глюканазы и арабиноксиланазы, расщепляет клеточные
стенки. Позволяет увеличить производительность и снизить расходы, продуцируемый
Aspergillus
oryzae
|
ксиланазная-
250;
|
65-70
|
4,8-5,3
|
|
5)
«Laminex®BG2»
|
«DuPont»
(США)
|
ферментативный
комплекс, расщепляющий в-глюканы и пентозаны, получается в результате
ферментации штамма Trichoderma
reesei
|
в-глюканазная-350;
ксиланазная-1120; целлюлазная-3100;
|
60-65
|
4,9-6,0
|
|
III группа 6) МЭК,
составленный фирмой производителем
|
6)
«Ondea Pro»
|
«Novozymes»
(Дания)
|
включает
ферменты альфа-амилазу, глюка амилазу,пуллуланазу, в-глюканазу, липазу,
полученный из генетически-модифицированных микроорганизмов (ГММ) - Aspergillus
oryzae, Bacillus
subtillis, Bacillus
licheniforms
|
альфа-амилазная-120;
глюко амилазная-400; пуллуланазная-637; в-глюканазная-350; липазаная-870;
протеолитическая-550
|
60-63
|
5,5-6,0
|
Из ККС («Русский квас», Россия) сусло готовили с
содержанием сухих веществ 6% с внесением сахарного сиропа с массовой долей
сухих веществ 65%.
Дрожжи - сахаромицеты: Дрожжи хлебопекарные
сухие быстродействующие (САФ-Момент), Saccharomyces
cerevisiae. Низовые дрожжи
штамма 8а(М).
Спирулина платенсис (Spirulina
platensis). Микроводоросль
спирулина в своём составе содержит все незаменимые аминокислоты, которые
представлены в таблице 4.
Таблица 4. Аминокислотный состав спирулины
платенсис [23].
|
Аминокислоты
|
%
от общего белка
|
|
Изолейцин
|
5,7
|
|
Лизин
|
8,7
|
|
Лейцин
|
5,1
|
|
Фенилаланин
|
5,0
|
|
Треонин
|
5,4
|
|
Глутаминовая
кислота
|
12,7
|
|
Глицин
|
4,8
|
|
Гистидин
|
1,5
|
|
Пролин
|
4,1
|
|
Тирозин
|
4,6
|
|
Метионин
|
2,6
|
|
Триптофан
|
1,5
|
|
Валин
|
7,5
|
|
Цистеин
|
0,9
|
|
Аспарагиновая
кислота
|
9,1
|
|
Аланин
|
7,9
|
|
Серин
|
5,3
|
|
Аргинин
|
7,6
|
Также микроводоросль спирулина в своем составе
обладает богатым набором витаминов, микроэлементов и жирных кислот, которые
представлены в таблицах 5 и 6.
Таблица 5. Витамины, минералы и микроэлементы
спирулины платенсис
|
Витамины
|
мг/кг
|
Минералы,
микроэлементы
|
мг/кг
|
|
в-каротин
(провитамин А)
|
1500
|
Кальций
|
1000
|
|
В12
|
1,6
|
Фосфор
|
8000
|
|
В5
|
11
|
Железо
|
500
|
|
Тиамин
(В1)
|
55
|
Хлор
|
4000
|
|
В3
|
4
|
Магний
|
1600
|
|
Инозитол
|
350
|
Йод
|
1,5
|
|
Фолиевая
кислота
|
0,5
|
Марганец
|
3
|
|
Ниацин
(РР)
|
118
|
Цинк
|
30
|
|
Пиридоксин
|
3
|
Калий
|
1400
|
|
Токоферол
|
190
|
Молибден
|
0,2
|
|
Аскорбиновая
кислота
|
150
|
Вольфрам
|
0,3
|
Таблица 6. Состав жирных кислот спирулины
платенсис
|
Жирные
кислоты
|
Содержание,
мг/кг
|
|
Лауриновая
С12
|
200
|
|
Миристиновая
С14
|
600
|
|
Пальмитиновая
С16
|
16500-21141
|
|
Пальмитолеиновая
С16
|
1490-2035
|
|
Пальмитоленоленовая
С16
|
1750-2365
|
|
Гептадекановая
С17
|
90-142
|
|
Стеариновая
С18
|
20-353
|
|
Олеиновая
С18
|
1970-3009
|
|
Линолевая
С18
|
10920-13784
|
|
г
- линоленовая С18
|
8750-11970
|
|
б
- линоленовая С18
|
160-427
|
|
Другие
|
70-800
|
В работе была использована спирулина платенсис с
размером частиц 3-10 мкм, влажностью 4,8 %.
.2 Методы исследований
.2.1 Определение содержания азотистых веществ
Количество белка определяли по методу Лоури
[152].
.2.2 Определение количества редуцирующих веществ
Количество редуцирующих веществ определяли по
методу, основанному на образовании редуцирующих веществ с 3,5 -
динитросалициловой кислотой окрашенной жидкости. Реакция углеводов с этой
кислотой протекает в щелочной среде при нагревании в кипящей водяной бане.
Динитросалициловая кислота восстанавливается сахарами в
3-амино-5-нитросалициловую кислоту, которая имеет яркий желто-оранжевый цвет.
По интенсивности окраски раствора, полученной в результате реакции, определяют
содержание углеводов. Для определения количества сахаров используют
калибровочную кривую. Для этого 100мг глюкозы растворяют в 100 мл воды, из
этого исходного раствора готовят дальнейшие разведения[89].
.2.3 Определение количества сухих веществ
Количество сухих веществ определяли
рефрактометрическим методом [92].
2.2.4 Определение активной кислотности (pH)
Активную кислотность (pH)
определяли на микропроцессорном лабораторном pH-метре
210 (HANNA
Instruments).
.2.5 Определение качественного и количественного
состава аминокислот
Определение свободных аминокислот проводили на
хроматографе жидкостном «Agilent
1200» c диоднометричным
дедектором, оснащенном автосэмплером (программируемый ввод), градиентным
насосом (обеспечивающим смешивание 2 растворителей), автоматической системой
сбора и обработки информации.
.2.6 Определение количества сахаров в растворах
БАД методом высокоэффективной жидкостной хроматографии (ВЭЖХ)
Определение сахаров проводили с
рефрактометрическим детектором и колоночным термостатом, снабженным
автоматической системой сбора и обработки информации, с колонкой хроматографической
NH 250*4,6 мм с
предколонкой. Метод позволяет количественно определять глюкозу, фруктозу,
сахарозу и глицерин.
.2.7 Определение концентрации дрожжевых клеток
Подсчет количества дрожжевых клеток определяли
методом прямого подсчета с использованием камеры Горяева.
.2.8 Определение бродильной активности дрожжей
Бродильную активность дрожжей определяют по
количественному учету диоксида углерода или этанола, образующихся при брожении.
При количественном определении диоксида углерода
пользуются весовым методом, который заключается в определении количества
выделившегося диоксида углерода по разности между массой сусла до и после
брожения.
По разности начальной и конечной масс определяют
бродильную активность дрожжей, выражая ее в граммах образовавшегося диоксида
углерода на 100см3 сусла [89,92].
.2.9 Вакуум-выпаривание
Концентрирование ферментолизата пивной дробины
для получения БАВ проводили путем вакуум-выпаривания с помощью испарителя
ротационного ИР-1-ЛТ, Labtech.
.2.10 Установка для приготовления ЭХА растворов
и технология их производства
ЭХА - раствор готовился на установке СТЭЛ
-10Н-120-01 (мод. 20-03), которая предназначена для униполярной (катодной и
анодной) электрохимической обработки воды и водных растворов электролитов с
целью их активации и получения активированных продуктов электрохимического
синтеза.
Главный узел установки - электрохимический
реактор, который представляет собой блок гидравлически
параллельно-последовательно соединенных электролитических элементов ПЭМ-3,
каждый из которых является самостоятельным проточным электрохимическим
реактором. Блок реакторов компактно размещен в корпусе установки.
Принцип работы установки заключается в
электрохимическом синтезе активированных растворов (католит и анолит)
соответственно в катодной и анодной камерах электролитического элемента ПЭМ-3
из водопроводной воды. Во время протока каждый микрообъем воды соприкасается с
поверхностью электрода. В результате происходит неравновесное изменение
структуры воды и обогащение ее продуктами электрохимических реакций.
На рисунке 1 представлена схема установки СТЭЛ -
10Н-120-01.
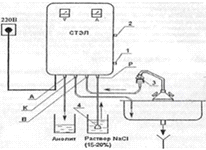
Рисунок 1. Схема установки СТЭЛ -10Н-120-01
(мод. 20-03): 1 - вентиль регулирования подачи солевого раствора; 2 - вентиль
регулирования слива католита; 3 - насадка на водопроводный кран; 4 - фильтр; А
- выход анолита; К - выход католита; В - вход воды; Р - вход солевого раствора.
.2.11 Обработка ферментализатов
Обработку ферментолизатов проводили на:
а) магнитной мешалке - ММ-5(Россия);
б) гомогенизаторе - Ultra-Turrax
T25(Германия),
8500-9500 об/мин ;
в) ультразвуком - СТ-410А,100W,Ultrasonic
Cleaner (Китай), частота
колебания х=37 кГц.
Статистическую обработку полученных результатов
исследований проводили с помощью компьютерной программы Statistica
6.0 for
Windows.
Структурная cхема
исследований представлена на рисунке 2.
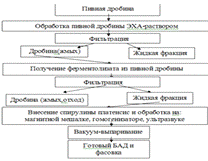
Рисунок 2. Структурная схема исследований
получения БАД.
Глава 3. Разработка технологии бад из пивной
дробины
3.1 Исследование дезинфицирующих свойств
ЭХА-растворов
Как известно, пивная дробина в процессе хранения
обсеменяется различными микроорганизмами, в связи с чем срок её утилизации
ограничен.
Множество исследований, проведенных в разных
странах определили несколько основных путей решения этой проблемы:
обезвоживание, консервирование, сушка и гранулирование. Нами было решено
отказаться от этих энергоёмких способов в пользу нового и очень перспективного
способа стерилизации пивной дробины - водой, полученной на ЭХА установке.
Согласно литературным данным, в анодной камере
вода насыщается высокоэффективными окислителями, в связи с чем вредные
органические примеси, например, фенолы, микробные токсины разлагаются на
простые и безопасные вещества.
Первым этапом эксперимента была обработка пивной
дробины ЭХА-водой. Как было сказано выше, ЭХА-воду получали на установке СТЭЛ
-10Н-120-01 (мод. 20-03). Режим работы установки следующий: скорость потока 15
дм3/ч, I = 9A, U = 28В. Анолит служил, как асептик
Были проведены исследования по определению
дезинфицирующей способности полученного анолита (табл. 7). Для этого были получены
два варианта раствора анолита: №1 с pH
3, ц=200мВ; №2 с pH
5, ц=100мВ. Гидромодуль 1:1 (соотношение дробины и анолита по массе). Контролем
служил образец дробины, обработанной водопроводной водой.
Как видно, из таблицы 7, наиболее эффективным
оказался 1 вариант раствора с режимом обработки 12 мин. Дальнейшее увеличение
времени выдержки дробины в растворе не целесообразно. При обработке различными
реагентами существенным является определение гидромодуля (соотношение твердой и
жидкой фракции). Полученные данные представлены в таблице 8.
Таблица 7. Влияние растворов анолитов,
полученных при разных режимах на их дезинфицирующую активность
|
Вариант
раствора, (гидромодуль 1:1)
|
Количество
микроорганизмов, КОЕ/см3 пивной дробины
|
|
Длительность
обработки
|
|
0
мин
|
5
мин
|
10
мин
|
12мин
|
20
мин
|
30
мин
|
|
1
|
35
|
15
|
4
|
0
|
0
|
0
|
|
2
|
37
|
30
|
23
|
23
|
20
|
15
|
|
Контроль
|
37
|
50
|
62
|
65
|
72
|
87
|
Таблица 8. Влияние гидромодуля (дробина:анолит)
на дезинфицирующую активность анолита
|
Гидромодуль
(соотношение дробины и анолита по массе)
|
Количество
микроорганизмов, КОЕ/см3 пивной дробины
|
|
Длительность
обработки
|
|
0
мин
|
10
мин
|
20
мин
|
30
мин
|
|
Контроль
|
39
|
43
|
54
|
75
|
|
1:3
|
40
|
0
|
0
|
0
|
|
1:2
|
40
|
0
|
0
|
0
|
|
1:1
|
36
|
4
|
0
|
0
|
Как видно, из таблицы 8, наиболее оптимальным
режимом обеззараживания дробины является гидромодуль 1:2 с продолжительностью
обработки 10 мин. Таким образом, для дальнейшей обработки пивной дробины нами
был выбрано соотношение дробины и анолита по массе 1:2 с продолжительностью
обработки 10 мин.
Исследовав, что анолит способен стерилизовать
пивную дробину, нами было решено определить, как обработка данным раствором
может повлиять на длительность хранения дробины, т.к. ионы анолита должны
воспрепятствовать развитию посторонней микрофлоры. Для этих целей был проведен
эксперимент, где пивная дробина подвергалась обработке анолитом варианта №1.
Далее обработанная дробина хранилась в течении нескольких суток при комнатной
температуре в нестерильных условиях.
Результаты эксперимента по определению влияния
анолита на срок хранения пивной дробины представлен в таблице 9.
Таблица 9. Исследование влияние анолита на срок
хранения дробины
|
Длительность
хранения, ч
|
Количество
микроорганизмов, КОЕ/см3 (опыт/контроль)
|
|
0
|
0/400
|
|
24
|
0/сплошной
рост
|
|
48
|
0/сплошной
рост
|
|
72
|
0/сплошной
рост
|
|
96
|
2/сплошной
рост
|
|
120
|
50/сплошной
рост
|
В результате проведенных исследований нами был
сделан вывод о том, что при обработке дробины анолитом варианта №1 срок
хранения дробины увеличивается до 96-120 часов в нестерильных условиях.
Полученный после фильтрации жмых пивной дробины
использовали в последующих опытах.
Автором [61] был исследован выход белковых и
редуцирующих веществ в зависимости от гидромодуля (ПД : ЭХА-вода) и ее
параметров. Установлено, что наиболее оптимальным соотношением фаз является
гидромодуль 1:4. Повышение фаз более, чем 1:4 нецелесообразно.
Так как нами были использованы растворы,
полученные на более модернизированных установках, эффект воздействия анолита
проявляется в более низких концентрациях, поэтому гидромодуль может быть
уменьшен до 1:2.
.2 Подбор ферментного препарата для гидролиза
ингредиентов, входящих в состав пивной дробины
Цель данного этапа исследования работы -
провести скрининг ФП с целью отбора наилучшего. Главный критерий выбора ФП -
это максимальный выход азотистых и редуцирующих веществ в конце ферментолиза
пивной дробины, а также определение оптимальных дозировок, и в тоже время
дозировка ФП должна быть экономически рациональной.
Источниками ассимилируемого азота для дрожжей
являются низкомолекулярные продукты распада белков. Легче всех усваиваются
аминокислоты, несколько хуже ди- и трипептиды. Известно, что содержание азота в
усвояемой форме в значительной степени определяет синтез и образование биомассы
дрожжей. Если состав сред сбалансирован по аминокислотам, повышается бродильная
активность дрожжей, их продуктивность, а также скорость потребления углеводов.
Известно, что наиболее интенсивно рост и
размножение дрожжей происходит на средах, содержащих смесь аминокислот.
Использование ферментных препаратов (ФП) эндогенного происхождения позволяет
проводить гидролиз составных частей субстрата в мягких условиях, не затрагивая
не свойственных тем или иным ферментам различных соединений.
В начале исследований был проведен скрининг
ферментных препаратов, имеющихся на российском рынке, исходя из состава пивной
дробине.
Для поставленной задачи были выбраны следующие
дозировки ФП (%) от количества сухих веществ пивной дробины, равных 30%: 0,1;
0,2; 0,4; 0,6; 0,8; 1. Ферментные растворы готовили разведением в
приготовленном ЭХА растворе (гидромодуль 1:4). Далее полученным водным
раствором ФП проводили ферментолиз пивной дробины при гидромодуле 1:4 (дробина
: ФП), при оптимальных условиях действия фермента. Учитывая состав пивной
дробины, нами помимо отдельных ферментных препаратов были составлены
мультиэнзимные композиции (МЭК), в состав которых входили амилолитические,
протеолитические и целлюлолитические ферменты.
.2.1 Исследование ферментного препарата Laminex®BG2
Как видно, из данных рисунка 3(а), наибольшее
количество азотистых веществ получены при дозировке 0,4% на 6ч ферментации, а
по редуцирующим веществам, рисунок 3(б), при дозировке 1% на 12ч ферментации.
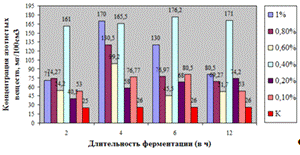
Рисунок 3(а). Влияние длительности обработки
пивной дробины ферментным препаратом «Laminex®BG2»
на выход азотистых веществ
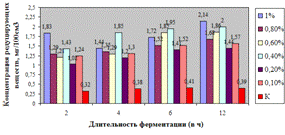
Рисунок 3(б). Влияние длительности обработки
пивной дробины ферментным препаратом «Laminex®BG2»
на выход редуцирующих веществ
Результаты испытаний показали, что при
соответствующих условиях ФП позволяет гидролизовать пивную дробину с
максимальным количеством азотистых и редуцирующих веществ.
.2.2 Исследование ферментного препарата Alphalase®AP3
Как видно, из рисунка 4(а), максимальное
количество азотистых веществ получено на 4ч ферментолиза дозировкой 0,4%, как и
на рисунке 3(а). Более длительный ферментолиз вызывает замедление в накоплении
веществ, что связано, вероятно, с ингибированием за счет побочных продуктов,
образовавшихся в процессе ферментолиза.
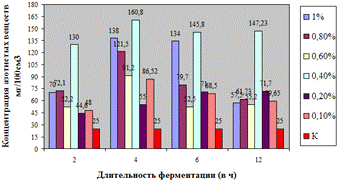
Рисунок 4(а). Влияние длительности обработки
пивной дробины ферментным препаратом «Alphalase®AP3»
на выход азотистых веществ
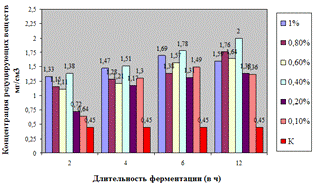
Рисунок 4(б). Влияние длительности обработки
пивной дробины ферментным препаратом «Alphalase®AP3»
на выход редуцирующих веществ
По накоплению редуцирующих веществ лучший
результат достигнут также дозировкой 0,4% на 12ч ферментолиза.
.2.3 Исследование комплексного действия
ферментных препаратов Laminex®BG2
и Alphalase®AP3
Известно, что отдельные ферментные препараты не
удовлетворяют в полном объёме тем требованиям, которые к ним предъявляет
перерабатывающая промышленность. Сочетание ферментных препаратов грибного и
бактериального происхождения позволяет повышать выход конечного продукта. Кроме
того, под действием композиции ферментов удаётся максимально гидролизовать
некрахмальные полисахариды, представленные целлюлозой, гемицеллюлозой,
пектиновыми и слизистыми веществами [21].
Поэтому для повышения эффективности ферментолиза
использовали комплексное действие ранее испытуемых ФП, содержащие ферменты
в-глюканазного и протеазного действия.
Комплекс использовали в виде смеси. Выбор
дозировок исходил из наилучших показателей ранее исследуемых опытов, показанных
на рисунках 3 и 4. Контролем служили образцы без добавления ферментных
препаратов.
Следовательно, был проведен ферментолиз со
следующими дозировками вариантов (результаты исследований представлены на
рисунках 5, 6 и 7):
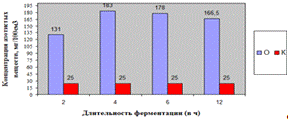
Рисунок 5(а). Влияние длительности обработки
пивной дробины комплексным действием ферментных препаратов 0,4% «Laminex®BG2»
+ 0,2% «Alphalase®AP3»
на выход азотистых веществ
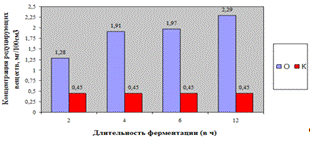
Рисунок 5(б). Влияние длительности обработки
пивной дробины комплексным действием ферментных препаратов 0,4% «Laminex®BG2»
+ 0,2% «Alphalase®AP3»
на выход редуцирующих веществ
I. 0,4% «Laminex®BG2»
+ 0,2% «Alphalase®AP3»
II. 0,4% «Laminex®BG2» + 0,4%
«Alphalase®AP3». 0,4% «Laminex®BG2» + 0,6% «Alphalase®AP3»
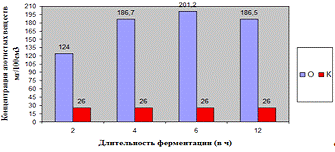
Рисунок 6(а). Влияние длительности обработки
пивной дробины комплексным действием ферментных препаратов 0,4% «Laminex®BG2»
+ 0,4% «Alphalase®AP3»
на выход азотистых веществ
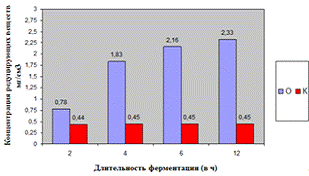
Рисунок 6(б). Влияние длительности обработки
пивной дробины комплексным действием ферментных препаратов 0,4% «Laminex®BG2»
+ 0,4% «Alphalase®AP3»
на выход редуцирующих веществ
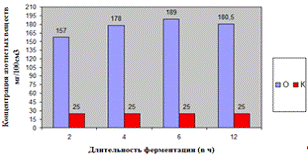
Рисунок 7(а). Влияние длительности обработки
пивной дробины комплексным действием ферментных препаратов 0,4% «Laminex®BG2»
+ 0,6% «Alphalase®AP3»
на выход азотистых веществ
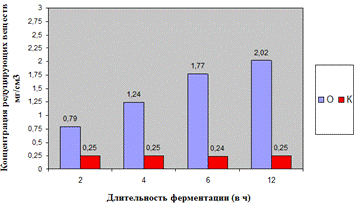
Рисунок 7(б). Влияние длительности обработки
пивной дробины комплексным действием ферментных препаратов 0,4% «Laminex®BG2»
+ 0,6% «Alphalase®AP3»
на выход редуцирующих веществ
Как показали результаты эксперимента комплексной
ферментации на рисунках 5,6 и 7, наилучшие результаты были получены при
равноценной дозировке ферментов с показателями 0,4%, представленные на рисунке
6 (а,б). Этот вариант превзошел результаты действия отдельно взятых ферментов
по азотистым веществам из данных рисунков 3(а) и 4(а) на 14% и 25,6%
соответственно. Также на 13,5% превзошел данные рисунков 3(б) и на 17,6%
результат 4(б) по содержанию редуцирующих веществ. Аналогичные данные были
получены в ранее приведенных работах. По данным автора [124], такой результат
может достигаться за счет действия композиции ферментов, которые более
максимально гидролизуют некрахмальные полисахариды.
3.2.4 Исследование ферментного препарата Ultraflo
MAX
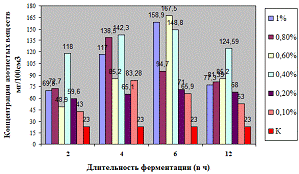
Рисунок 8(а). Влияние длительности обработки
пивной дробины ферментным препаратом «Ultraflo
MAX» на выход
азотистых веществ
ФП амилолитического действия «Ultraflo
MAX», обладающий
ксиланазными и бета-глюканазным комплексом действия не дал более лучших
показателей, чем опыты проведенные с предыдущими ФП.
Ксиланазы представляют собой пентоназы, группу
ферментов, разрушающих структурные компоненты клеточной стенки растений.
Ксиланазы разрушают ксиланы (компоненты группы гемицеллюлоз) - вязкую
субстанцию, вместе в целлюлозой образующую стенки клеток. Большое содержание
ксилана отмечается в злаках.
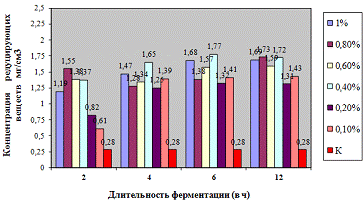
Рисунок 8(б). Влияние длительности обработки
пивной дробины ферментным препаратом «Ultraflo
MAX» на выход
редуцирующих веществ
Как видно, из полученных данных рисунка 8 (а,б),
наилучшие результаты по показателям азотистых веществ были получены при
дозировке 0,6% на 6ч ферментации, в то время как по содержанию редуцирующих
веществ при дозировке 0,4%, также на 6ч ферментации.
.2.5 Исследование ферментного препарата Attenuzime®Flex
Как видно, из представленных данных рисунка 9,
наибольшее количество азотистых веществ накоплено при дозировке 0,6%. Как можно
заметить, после 6ч ферментации произошел резкий скачок в показателях накопления
азотистых веществ более чем в 2 раза и составил 171,2мг/см3 , что
составило максимальное значение при работе с данным ФП.
По содержанию редуцирующих веществ наилучший
результат достигнут с дозировкой 0,8% с показателем 1,92 мг/см3.
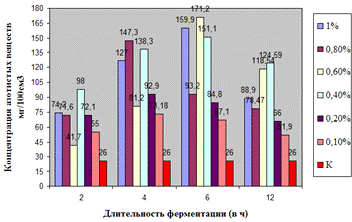
Рисунок 9(а). Влияние длительности обработки
пивной дробины ферментным препаратом«AttenuzimeFlex»
на выход азотистых веществ
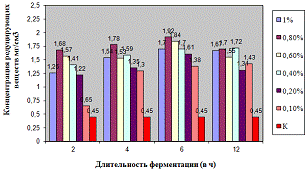
Данный ФП обладает в своем составе
глюкоамилазой, которая ускоряет реакцию гидролиза в-глюкана в молекуле
крахмала, олигосахаридов и даже дисахаридов отщепляя остатки глюкозы от
невосстанавливающегося конца молекулы. Однако, после 6ч ферментации показатели
содержания азотистых и редуцирующих веществ снизились (рисунок 9), что
вероятно, связано с эффектом катаболитной репрессии.
.2.6 Исследование ферментного препарата Тermamyl
SC
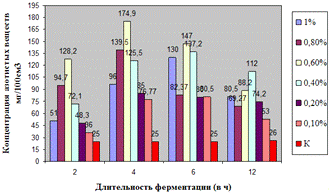
Рисунок 10(а). Влияние длительности обработки
пивной дробины ферментным препаратом «Тermamyl
SC» на выход
азотистых веществ
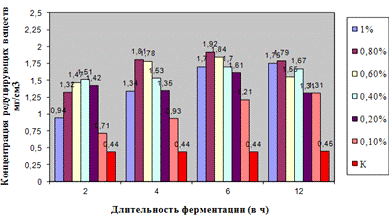
Рисунок 10(б). Влияние длительности обработки
пивной дробины ферментным препаратом «Тermamyl
SC» на выход
редуцирующих веществ
Из представленных данных на рисунка 10 видно,
что при дозировке 0,6% на 4ч ферментации произошло максимальное накопление
азотистых веществ с показателем 174,9 мг/см3 В то время как
максимальное накопление редуцирующих веществ зафиксировано при дозировке 0,8%
только на 6ч ферментации с показателем 1,92 мг/см3. Известно, что ФП
«Термамил SC» обладает
универсальным свойством, который способен работать при низких pH,
более низком содержании ионов кальция, при более низкой температуре, чем
остальные термостабильные альфа-амилазы. ФП способен гидролизовать 1,4
альфа-гликозидные связи в амилозе и амилопектине. Расщепленными продуктами
являются декстрины с цепями различной длины и олигосахариды.
.2.7 Исследование комплексного действия
ферментных препаратов Ultraflo
MAX и Attenuzime®Flex
Как и ранее из экспериментов рисунка 5, 6 и 7,
нам представлял интерес проведение комплексного ферментолиза, потому как данный
прием дает превосходящие результаты.
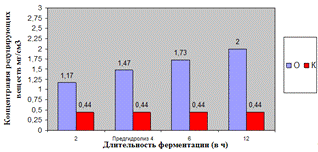
Рисунок 11(а). Влияние длительности обработки
пивной дробины комплексным действием ферментных препаратов 0,6%«Ultraflo
MAX» + 0,6% «Attenuzime®Flex»
на выход редуцирующих веществ
В отличие от предыдущего эксперимента,
ферментолиз комплексным препаратом проводили в две стадии. В начале проводили
предварительный гидролиз ФП «Ultraflo
MAX», а после 4-х
часов ферментации вносили ФП «Attenuzime®Flex».
При работе в комплексе с данными ФП выбор
дозировок исходил из наилучших показателей ранее исследуемых экспериментов с
этими же препаратами в отдельности, следовательно, исследовалась комплексная
(суммарная) дозировка ФП 0,6%.
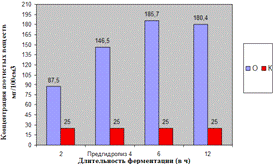
Рисунок 11(б). Влияние длительности обработки
пивной дробины комплексным действием ферментных препаратов 0,6%«Ultraflo
MAX» + 0,6% «Attenuzime®Flex»
на выход азотистых веществ
На представленных данных из рисунка 11 наглядно
видно, что комплексный ферментолиз превосходит результаты эксперимента
проведенный с ФП «Attenuzime®Flex»,
представленного на рисунке 8. Результаты по азотистым и редуцирующим веществам
превзошли на 14,2% и 4% соответственно. Также получены превосходящие результаты
эксперимента по сравнению с ФП «Ultraflo
MAX» из рисунка 9.
Результат по белковым и редуцирующим показателям был превышен на 19,2% и 13%
соответственно. Данный комплекс ФП позволяет получить более глубокий гидролиз,
что связано с содержанием ксиланазной, глюкоамилазной и альфа-амилазной
активностью комплекса.
Стоит отметить, что прием с применением
предварительного гидролиза не дал существенной динамики в накоплении
редуцирующих и азотистых веществ. Также можно отметить, что комплексный ферментолиз,
показанный на рисунках 7, 8 и 9, показал превосходящий результат на17% и 8% по
белковым и редуцирующим веществам соответственно.
.2.8 Исследование комплексного действия
ферментных препаратов Ultraflo
MAX и Attenuzime®Flex
Как показали предшествующие эксперименты,
действие ферментов в комплексе способствуют более высокому накоплению азотистых
и редуцирующих веществ.
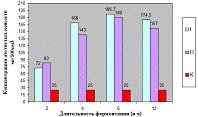
Рисунок 12(а). Влияние длительности обработки
пивной дробины комплексным действием ферментных препаратов 0,6%«Ultraflo
MAX» + 0,6% :0,8% «Тermamyl
SC» на выход
азотистых веществ
Как и в предыдущем эксперименте, показанный на
рисунке 11, интерес для исследования представляла наилучшая дозировка 0,6% ФП «Ultraflo
MAX». Исходя из
полученных результатов ферментолиза с ФП «Тermamyl
SC» отобраны две
дозировки с наилучшими результатами по азотистым и редуцирующим веществам,
следовательно 0,6% и 0,8%. Были отобраны следующие варианты комплексного
ферментолиза:
I. 0,6% «Ultraflo
MAX» + 0,6% «Тermamyl
SC»;
II. 0,6% «Ultraflo MAX» + 0,8% «Тermamyl
SC».
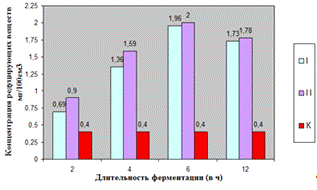
Рисунок 12(б). Влияние длительности обработки
пивной дробины комплексным действием ферментных препаратов 0,6%«Ultraflo
MAX» + 0,6% :0,8% «Тermamyl
SC» на выход
редуцирующих веществ
Из данных рисунка 12 видно, что комплексное
действие ферментов вариантов I
и II превосходит
показатели по азотистым и редуцирующим веществам действию ферментов по
отдельности.
В частности, вариант I
по накоплению азотистых веществ превзошел на 11,5% и 3% действие данных
ферментов по отдельности, а также на 10% и 2% по накоплению редуцирующих
веществ.
Вариант II
также показал лучшие результаты, которые превзошли на 8% и 6,7% по накоплению
азотистых веществ и на 13% и 4,2% по содержанию редуцирующих веществ.
3.2.9 Исследование ферментного препарата Ondea
Pro
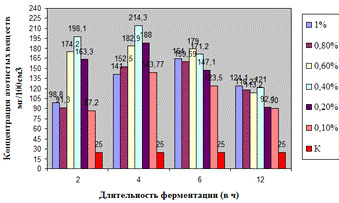
Рисунок 13(а). Влияние длительности обработки
пивной дробины ферментным препаратом «Ondea
Pro» на выход
азотистых веществ
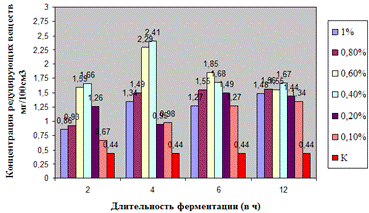
Рисунок 13(б). Влияние длительности обработки
пивной дробины ферментным препаратом «Ondea
Pro» на выход
редуцирующих веществ
Как видно на представленных данных на рисунка
13, дозировка 0,4% ФП «Ondea
Pro» обеспечивает
максимальный выход азотистых и редуцирующих веществ, показатели которых
составляют 214,3 и 2,41 соответственно, что на 6% и 3% превосходит ранее
максимально полученные результаты из опыта, показанного на рисунках 7, 8 и 9.
Также стоит отметить, что наилучший результат был достигнут уже на 4ч
ферментации, что также играет немаловажную роль с экономической точки зрения.
Тогда как с другими ФП лучшие результаты достигнуты только на 6ч ферментации и
более.
Стоит отметить, что объяснения таких результатов
с ФП «Ondea
Pro» связаны с
уникальной мультиферментной составляющей препарата.
ФП «Ondea
Pro» - это композиция
ферментов, состоящая из следующих ферментативных активностей:
б-амилазной (1,4-б-D-глюканглюканогидролаза),
которая является эндоамилазой, вызывающей гидролитическое расщепление б-1,4-гликозидных
связей внутри полимерного субстрата. Это водорастворимый белок, обладающий
свойствами глобулина и имеющий молекулярную массу 45-60 кДа. Все б-амилазы
относятся к металлоэнзимам, содержание в них Са колеблется от 1до 30 г-атом/
г-моль фермента. Полное удаление Са приводит к инактивации фермента.
Глутаминовая и аспарагиновая кислоты составляют 25 масс. % от массы белка.
Присутствие в промышленных препаратах протеиназ снижает каталитическую
активность б-амилазы[165].
В результате воздействия б-амилазы на первых
стадиях в гидролизате накапливаются декстрины, затем появляются
неокрашивающиеся иодом тетра- и тримальтоза, которые очень медленно
гидролизуются б-амилазой до ди- и моносахаридов;
глюкоамилазной (1,4-б-D-глюканглюкогидролаза),
которая катализирует последовательное отщепление концевых остатков б-D-глюкозы
с нередуцирующих концов субстрата. Этот фермент проявляет экзогенный механизм
воздействия на субстрат. Многие глюкоамилазы обладают также способностью
гидролизовать б-1,6-глюкозидные связи. Однако это происходит в том случае,
когда за б-1,6-связью следует б-1,4-связь, поэтому декстран ими не
гидролизуется. Глюкоамилаза значительно быстрее гидролизует полимерный
субстрат, чем олиго- и дисахариды. Почти все глюкоамилазы являются гликопротеидами,
содержащими от 5 до 35 % углеводов, которые состоят из олиго-, ди- и
моносахаридов;
пуллуланазной, которая гидролизует в пуллулане
б-1,6 связи, в результате чего возникают молекулы триоз, состоящих из 3
остатков глюкоз. Если между двумя б-1,6-связями расположено более трех остатков
глюкозы, то разрыв б-1,6-связи идет значительно медленнее, поэтому амилопектин
гидролизуется пуллуланазой хуже других разветвленных полисахаридов.
Пуллуланаза, как и б-амилаза, является
эндогенным ферментом, но в отличие от нее способна неупорядоченно гидролизовать
б-1,6-связи в пуллулане, амилопектине, гликогене и предельных декстринах,
получаемых при совместном воздействии на крахмал и гликоген б- и в-амилаз.
Наиболее частым отщепляемым фрагментом является мальтотриоза;
в-глюканазной совместно с в-ксилазной
(пентозаназа), относящиеся к гемицеллюлазам, которая расщепляет растворимые и
нерастворимые в-глюканы в коротко-цепочные полисахариды и молекулы глюкозы.
в-ксиланазы,катализирующие расщепление в-гликозидных связей в в-ксиланах.
Расщепляет арабиноксиланы, структурные компоненты клеточной стенки;
липазной, которая производит гидролитическое
расщепление триацилглицерола до диацилглицерола и жирной кислоты. Затем идет
отщепление следующих остатков жирных кислот до образования глицерина. При этом
скорость отщепления ацильной группы от триацилглицерола в несколько раз выше,
чем от ди- и моноацилглицерола. Ферментативный гидролиз липидов представляет
собой гетерогенный процесс;
протеазной, которая относится к классу
пептид-гидролаз, ускоряющих реакции гидролиза белков, пептидов и других
соединений, содержащих пептидные связи, тем самым увеличивая количество
растворенного белка.
Таким образом, исследовав ФП на содержание
азотистых и редуцирующих веществ можно сделать заключение.
Исследовав шесть ФП и МЭК композиции, полученные
на их основе по их влиянию на накопление азотистых и редуцирующих веществ в
ферментолизате, установлено, что наиболее эффективным оказался ФП «Ondea
Pro». Дозировка 0,4%
дала максимальный результат. Количество азотистых и редуцирующих веществ
составило (мг/100см3 ): 214,3 и 2,41 соответственно.
Активное действие ФП «Ondea
Pro» можно рассмотреть
на примере ячменного сиропа, полученного настойным способом, в отличие от
прежней технологии, по которой разваривание ячменной крупы было обязательным в
целях разжижжения и декстринизации ее крахмала. В симбиозе активностей этого
фермента с активностями ферментов, присутствующих в ячмене, процессы гидролиза
эндосперма ячменя протекали подобно процессам в солодовом заторе [39].
Полученный ферментолизат «Ondea
Pro» далее применялся
для разработки биологически активной добавки (БАД).
Согласно схемы, изображенной на рис.4 следующим
этапом эксперимента, является фильтрация полученного ферментолизата с выходом
дробины и суспензии. Последняя исследуется в дальнейшем, как БАД для
интенсификации процесса брожения, а дробина согласно литературным данным может
использоваться, как источник пищевых волокон в хлебопечении.
Сравнительная характеристика всех ФП по выходу
азотистых и редуцирующих веществ представлена в итоговой таблице 10.
Однако, исходя из экономических соображений
(стоимость ФП «Ondea
Pro» в 2 раза выше,
чем моноферменты) нами также рассматривается возможность использования МЭК «Laminex®BG2»+
«Alphalase®AP3»,
так как полученные результаты были близки по значению.
Таблица 10. Влияние ФП на выход азотистых и
редуцирующих веществ
|
Название
ферментного препарата
|
Содержание
веществ (мг/100см3)
|
|
Азотистых
|
Редуцирующих
|
|
«Laminex®BG2»
|
176,2
|
2,14
|
|
«AlphalaseAP3»
|
160,8
|
2,0
|
|
«Laminex®BG2»+
«Alphalase®AP3»
|
201,2
|
2,33
|
|
«Ultraflo
MAX»
|
167,5
|
1,77
|
|
«Attenuzime®Fleх»
|
171,2
|
1,92
|
|
«Тermamyl
SC»
|
174,4
|
1,92
|
|
«Ultraflo
MAX» + «Attenuzime®Fleх»
|
185,7
|
2,0
|
|
«Ultraflo
MAX» + «Тermamyl SC»
|
186,7
|
2,0
|
|
«Ondea
Pro»
|
214,3
|
2,41
|
.3 Исследование влияния ферментолизата пивной
дробины на бродильную активность дрожжей
Согласно ГОСТу, квас - национальный
безалкогольный напиток с объемной долей этилового спирта не более 1,2 %,
изготовленный в результате незавершенного спиртового или спиртового и молочнокислого
брожения сусла из растительного сырья или продуктов его переработки, сахара,
фруктозы, декстрозы, мальтозы, сиропа глюкозы и других натуральных
сахаросодержащих веществ с последующим добавлением или без добавления пищевых
добавок, кроме искусственных и идентичных натуральным вкусоароматических
веществ, искусственных и идентичных натуральным ароматизаторов, синтетических и
неорганических красителей, подсластителей, консервантов [4,5].
Актуальная задача пищевой промышленности, в
частности бродильной - разработка новых ресурсосберегающих технологий,
позволяющих повышать эффективность производства, увеличить выход и качество
продукции без существенных дополнительных материальных затрат. Одно из
направлений реализации этой задачи - интенсификация производства и повышение
бродильной активности дрожжей за счет введения в питательную среду активаторов
брожения.
В наших исследованиях действия ферментолизата
пивной дробины в качестве БАД, как активизатора процесса брожения проверяли при
брожении кваса и пива. Использовали квасное сусло, полученное из ККС с
содержанием СВ 6%.
Для определения количества ферментолизата пивной
дробины, активизирующего процесс брожения, исследовали следующие дозировки (см3/100см3):
0,2; 0,5; 1; 2; 3; 4; 5;6. Добавка вносилась одновременно с внесением дрожжей.
Дрожжи Saccharomyces
cerevisiae задавались в
количестве 0,1г/100см3 (1млн. клеток/см3) [23,111].
Брожение сусла проходило при температуре 25-30 єС в течение 24 ч. Контролем
служили образцы без добавления добавки. Исследовали такие параметры как:
бродильная активность дрожжей, концентрация дрожжевых клеток, концентрация
сухих веществ и активную кислотность (pH).
Данные параметров представлены на рисунках 14, 15, 16 и 17.
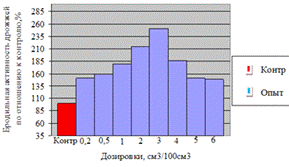
Рисунок 14. Влияние различных дозировок БАД на
бродильную активность дрожжей по отношению к контролю, %
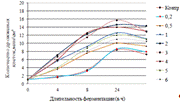
Рисунок 15. Влияние различных дозировок БАД на
накопление дрожжевых клеток в процессе брожения квасного сусла
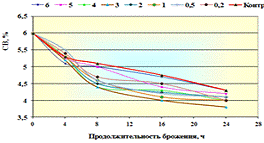
Рисунок 16. Влияние различных дозировок БАД на
содержание сухих веществ в процессе брожения квасного сусла
Из полученных данных рисунка 14 видно, что
наиболее активной оказалась дозировка 3 см3, бродильная активность
составила 155% в сравнении с контролем.
Также на данных из рисунка 15 видно, что
наиболее предпочтительной оказалась дозировка 3 см3.
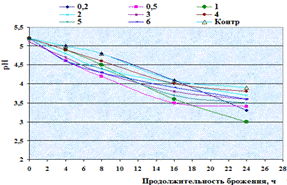
Рисунок 17. Изменение pH
в процессе брожения квасного сусла
Известно, что различные типы обработки
(гомогенизация, ультразвук) активизируют метаболические процессы. Нами была
установлена возможность активизации процессов брожения в результате такой
обработки.
Глава 4. Интенсификация процессов брожения при
производстве кваса и пива
.1 Исследование использования спирулины
платенсис в качестве дополнительного источника питания БАД
Как было сказано ранее в литературном обзоре,
спирулина платенсис, является ценнейшим источником биологически активных
веществ.
Микроводоросль обладает в составе множеством
необходимых компонентов питательной среды - факторами роста (витаминами,
аминокислотами, макро- и микроэлементами), которые участвуют в процессе
метаболизма дрожжей. Все эти компоненты содержатся в препарате в
сбалансированном количестве.
Так, особенность спирулины в ее высоком
содержании в биомассе белка, около 60-70% на сухое вещество. А как уникальность
- это ее аминокислотный состав, который представлен всеми незаменимыми
аминокислотами.
Для метаболизма дрожжей важно, как содержание
жира, так и жироподобных веществ в среде. Как показали исследования, жирные
кислоты являются не только структурными компонентами и энергетическими
ресурсами, но и выполняют важнейшие регуляторные функции в обмене веществ
клетки, взаимодействуя с белками, мембраной и энзиматическим комплексом [42].
К липидам относят: жирные кислоты, полярные
липиды, моноглицериды, стерины и др. Так как липиды влияют на интенсивность и
характер брожения, то они участвуют в формировании органолептических
показателей напитка [124,154].
Особое физиологическое значение имеют
полиненасыщенные жирные кислоты, входящие в состав клеточных мембран. Дрожжи не
способны синтезировать липидные компоненты мембран (жирные кислоты и стеролы) в
отсутствие кислорода, так как синтез этих соединений имеет окислительный механизм.
Липиды влияют на устойчивость дрожжевой клетки к этанолу, так как липидный
состав мембран влияет на их проницаемость и транспортировку этанола через
мембрану. Добавление этих компонентов в среду способствует более быстрому росту
дрожжей [130].
Данные спирулины платенсис по жирнокислотному
составу [113] представлены в таблице 7.
На данном этапе исследования спирулину вносили в
БАД в количестве 1(мг)%. Брожение сусла проходило при t=25-30єС,
в течение 24ч. Контролем служили образцы без добавления БАВ. Результаты влияния
различных дозировок БАД с добавлением спирулины на бродильную активность
дрожжей в процессе брожения кваса представлены на рисунке 18.
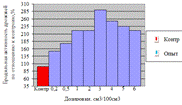
Рисунок 18. Влияние различных дозировок БАД с
добавлением спирулины на бродильную активность дрожжей по отношению к контролю,
%
Как видно из представленных данных рисунков
18,19,20, наиболее активной добавкой оказалась дозировка величиной 3см3,
бродильная активность составила 190% в сравнении с контролем.
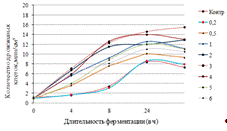
Рисунок 19. Влияние различных дозировок БАД с
добавлением спирулины на накопление дрожжевых клеток в процессе брожения
квасного сусла
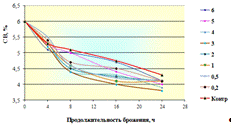
Рисунок 20. Влияние различных дозировок БАД с
добавлением спирулины на содержание сухих веществ в процессе брожения квасного
сусла
В целях оптимальной дозировки спирулины было
решено провести эксперимент с различными дозировками - 0,5; 2; 3 (мг). Данные
эксперимента представлены на рисунке 21.
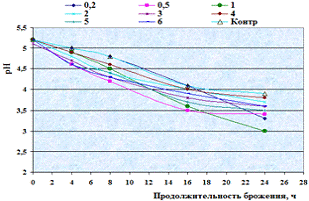
Рисунок 21. Изменение pH
в процессе брожения квасного сусла
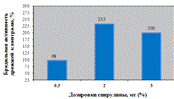
Рисунок 22. Влияние различных дозировок
спирулины в составе БАД на бродильную активность дрожжей по отношению к
контролю, %
Как видно из рисунка 22, наилучшей дозировкой
спирулины к БАД оказалась в количестве 2 (мг).
Известно, что спирулина плохо растворима,
поэтому нами были испытаны различные типы обработок для максимального
извлечения из неё питательных веществ. Известно, что различные типы обработки
(гомогенизация, ультразвук) позволяют наиболее полно разрушать клетки,
извлекать из субстрата необходимые питательные вещества, что положительно
сказывается на метаболические процессы. Автором [23] разработан способ
интенсификации брожения пивного сусла с использованием в качестве активатора
препарата на основе сине-зеленой водоросли спирулина платенсис.
.2 Исследование обработки БАД из ферментолизата
пивной дробины на процесс брожения квасного сусла
Следующим этапом эксперимента был подбор оптимального
типа обработки, ранее полученного ферментолизата. С целью активизации процессов
брожения, при добавке в бродящее сусло.
Были выбраны следующие типы обработок БАД на:
мешалке(контроль); гомогенизаторе; ультразвуке.
Добавки применялись в следующих дозировках (см3/100см3):
0,2; 0,5; 1; 2; 3; 4; 5; 6.
Ранее было изучено влияние препарата спирулины
платенсис молоткового (250-300мкм) и криогенного (3-10мкм) измельчения,
соответственно влажностью 3,5% и 4,8% на физиологическое состояние дрожжей рас
8а(М) и 34 [23].
Полученные результаты показали, что в случае
использования препарата спирулины молоткового и криогенного измельчения
превышают контрольные образцы по количеству клеток, содержащих гликоген и по
приросту биомассы.
Однако, как показали результаты исследований,
внесение препарата водоросли криогенного измельчения способствует более
интенсивному накоплению гликогена в дрожжевых клетках, также клетки отличались
более крупными размерами. Причем максимальный эффект достигался при
использовании дозировки препарата в количестве 2мг.
Криогенное измельчение является перспективным
методом в измельчении пищевых продуктов и различных препаратов. Как отметили
авторы, Такому методу свойственны химическая инертность, низкая температура
кипения, обеспечивающая достижение хрупкости различных материалов, а также
безопасность для обслуживающего персонала. С ростом дисперсности измельченного
растительного материала увеличивается его удельная поверхность, улучшается
растворимость в жидкостях, происходит более полное экстрагирование
биологически-активных веществ, ароматических и питательных веществ
растворителем [32,33].
В западных странах технологию криогенного
измельчения применяют в промышленном масштабе в различных отраслях, например, в
пищевой и фармацевтической.
Динамика брожения показала, что опытный образец
более интенсивно потребляют углеводы и азотистые вещества, содержащиеся в
сусле. Можно отметить, что дрожжи, активированные спирулиной отличала более
высокая скорость размножения.
Отмечено, что в период логарифмической фазы
роста дрожжи потребляют лизин, тирозин, лейцин, аминомасляную кислоту,
фенилаланин, глутаминовую кислоту. В данной фазе перечисленные аминокислоты
усваиваются на 44-77% [124].
.2.1 Обработка БАД на магнитной мешалке
Обработку БАД на магнитной мешалке проводили в
режиме 600 об/мин длительностью 5мин и при 30°С. Результаты эксперимента
представлены на рисунках 20, 21, 22 и таблице 12.
Как видно из данных представленных на рисунке
23, наибольшей бродильной активностью обладает добавка с величиной дозировки 2
см3, бродильная активность составила 261 % по отношению к контролю.
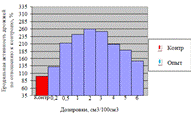
Рисунок 23. Влияние различных дозировок БАД на
бродильную активность дрожжей, %
В результате проведенных исследований можно
выделить снижение содержания всех аминокислот относительно их начального
содержания. Внесение спирулины, как дополнительного источника питательных
веществ благоприятствует более полному потреблению аминокислот.
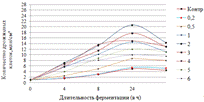
Рисунок 24. Влияние различных дозировок БАД на
накопление дрожжевых клеток в процессе брожения квасного сусла, млн/см3,
24ч
Внесение дополнительного источника аминокислот
способствует сокращению расхода сахаров на построение биомассы дрожжей, более
полному использованию редуцирующих сахаров, что дает предпосылки к снижению
образования побочных продуктов брожения, также улучшает физиологическое
состояние клетки и стимулирует метаболизм.
Как видно из представленных данных рисунка 24,
наибольший прирост биомассы дрожжей был получен при использовании добавки с
величиной дозировки 2 см3. Концентрация дрожжевых клеток составила
21,6 млн/см3.
Это может говорить о том, что введение
дополнительного источника аминокислот (препарат спирулина платенсис) улучшает
физиологическое состояние клетки и стимулирует метаболизм дрожжей. Аналогичные
результаты были получены Хохловым в работе [125].
Таблица 11. Влияние различных дозировок БАД на
изменение содержания сухих веществ в процессе брожения квасного сусла
|
Продолжительность
брожения, ч
|
Дозировка
(см3)/100см3 /СВ, %
|
|
0,2
|
0,5
|
1
|
2
|
3
|
4
|
5
|
6
|
К
|
|
0
|
6
|
|
4
|
5,7
|
5,5
|
5,3
|
5,2
|
5,7
|
5,8
|
5,95
|
5,8
|
5,8
|
|
8
|
5,4
|
5,3
|
4,6
|
4,4
|
5,3
|
5,6
|
5,77
|
5,7
|
5,6
|
|
16
|
5,1
|
4,7
|
4,3
|
4,1
|
5
|
5,35
|
5,5
|
5,6
|
5,5
|
|
24
|
5,1
|
4,7
|
4,3
|
4,1
|
5
|
5,3
|
5,5
|
5,6
|
5,5
|
Как видно из представленных данных таблиц 11,
наиболее интенсивное брожение наблюдалось с использованием добавки с величиной
концентрации 2см3. Как было сказано выше, это может быть связано с
дополнительным введением источника аминокислот в виде препарата спирулина
платенис.
.2.2 Обработка БАД методом гомогенизации
Под гомогенизацией (буквально слово
«гомогенизация» обозначает повышение однородности) понимают процесс обработки
эмульсий, который приводит к дроблению дисперсной фазы.
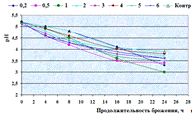
Рисунок 25. Изменение pH
в процессе брожения квасного сусла
Процесс гомогенизации оказался достаточно
сложным для экспериментального изучения. Недостаток экспериментальных данных
привел к рождению множества гипотез гомогенизации. Поэтому единый взгляд,
единая точка зрения на процесс гомогенизации отсутствует. Нет и общепризнанной
единой теории процесса гомогенизации, а немногочисленные экспериментальные
данные часто входят в противоречие с существующими теориями [117].
Гомогенизация, разработанная Голеном (Gaulin)
еще в 1899г., сегодня широко используется в производстве пищевых продуктов. Она
существенно улучшает их свойства и физическую структуру [59].
При работе с гомогенизатором его техническая
характеристика давала возможность обрабатывать БАД при следующих оборотах
(мин): 8500 и 9500. Нами были выбраны следующие длительности обработки (мин):
2, 5, 7 и 10. Известно, что температура обработки не должна превышать 20-25° С,
во избежание инактивации биологически активных веществ.
При гомогенизации достигается однородность распределения
спирулины в растворе БАД, что дает предпосылки для более глубокого потребления
питательных веществ.
Как показали наши исследования, лучшие
показатели были достигнуты в процессе обработки при режиме 9500 об/мин,
результаты которых и будут описаны ниже.
Результаты исследований после обработки БАД при
9500 об/мин в течение 2 мин.
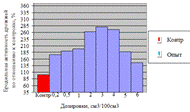
Рисунок 26. Влияние различных дозировок БАД на
бродильную активность дрожжей, %
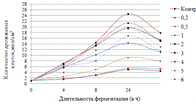
Рисунок 27. Влияние различных дозировок БАД на
накопление дрожжевых клеток в процессе брожения квасного сусла, млн/см3,
24 ч
Как видно из представленных данных на рисунке
26, наибольшей бродильной активностью обладает добавка с величиной дозировки 3
см3, бродильная активность составила 280,5 % по отношению к
контролю.
Как видно из представленных данных рисунка 27,
наибольший прирост биомассы дрожжей был получен при использовании добавки с
величиной дозировки 3 см3. Концентрация дрожжевых клеток составила
24,5 млн/см3.
Таблица 12. Влияние обработки различных
дозировок БАД на изменение содержания сухих веществ в процессе брожения
квасного сусла
|
Продолжительность
брожения, ч
|
Дозировка
(см3)/100см3 / СВ,%
|
|
0,2
|
0,5
|
1
|
2
|
3
|
4
|
5
|
6
|
К
|
|
0
|
6
|
|
4
|
5,5
|
5,18
|
5,45
|
5
|
4,9
|
5,6
|
5,72
|
5,8
|
5,8
|
|
8
|
5,12
|
4,7
|
5,1
|
4,23
|
4,2
|
5,28
|
5,13
|
5,44
|
5,6
|
|
16
|
4,7
|
4,6
|
4,9
|
4
|
3,7
|
4,63
|
4,91
|
5,1
|
5,4
|
|
24
|
4,4
|
4,2
|
3,9
|
3,82
|
3,5
|
3,9
|
4
|
4,7
|
5,2
|
|
|
|
|
|
|
|
|
|
|
|
|
Как видно из представленных данных таблиц 12,
наиболее активное брожение наблюдалось с использованием добавки с величиной
дозировки 3см3, о чем также свидетельствуют данные рисунка 26 и 27.
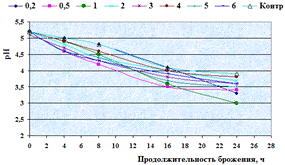
Рисунок 28. Изменение pH
в процессе брожения квасного сусла
Результаты исследований после 5 минут обработки
БАД при 9500 об/мин
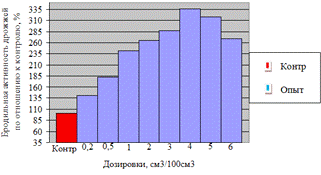
Рисунок 29. Влияние различных дозировок БАД на
бродильную активность дрожжей, %
Как видно из представленных на рисунке 29,
наибольшей бродильной активностью обладает добавка с величиной дозировки 4 см3,
бродильная активность составила 340 % по отношению к контролю.
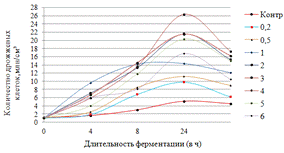
Рисунок 30. Влияние различных дозировок БАД на
накопление дрожжевых клеток в процессе брожения квасного сусла, млн/см3,
24ч
Как видно из представленных данных рисунка 30,
наибольший прирост биомассы дрожжей был получен при использовании добавки с
величиной дозировки 4 см3. Концентрация дрожжевых клеток составила
25,7 млн/см3
Таблица 13. Влияние различных дозировок БАД на
изменение содержания сухих веществ в процессе брожения квасного сусла
|
Продолжительность
брожения, ч
|
Дозировка
(см3)/100см3 /СВ,%
|
|
|
0,2
|
0,5
|
1
|
2
|
3
|
4
|
5
|
6
|
К
|
|
|
0
|
6
|
|
|
4
|
5,8
|
5,7
|
5,6
|
5,7
|
5,5
|
5,4
|
5,7
|
5,8
|
5,7
|
|
8
|
5,5
|
5,3
|
5,1
|
4,6
|
5,3
|
4,6
|
5,2
|
5,5
|
5,5
|
|
16
|
5,1
|
5,1
|
5
|
4,4
|
5,0
|
4,2
|
5
|
5,3
|
5,3
|
|
24
|
4,6
|
4,5
|
4,6
|
4,4
|
4,2
|
3,6
|
4,6
|
5,1
|
5
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Как видно из представленных данных таблицы 13,
наиболее активное брожение наблюдалось с использованием добавки с величиной
дозировки 4 см3.
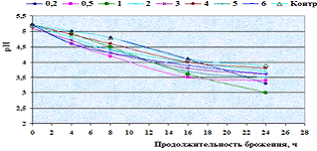
Рисунок 31. Изменение pH
в процессе брожения квасного сусла Результаты исследований после 7 минут обработки
при 9500 об/мин
Рисунок 32. Влияние различных дозировок БАД на
бродильную активность дрожжей, %
Как видно из представленных на рисунке 32,
наибольшей бродильной активностью обладает добавка с величиной дозировки 3 см3,
бродильная активность составила 322 % по отношению к контролю.
Стоит отметить, что более длительная обработка
при 9500 об/мин не дает дополнительных преимуществ.
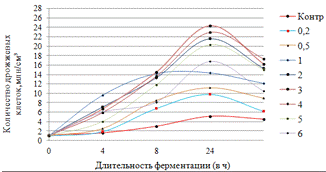
Рисунок 33. Влияние различных дозировок БАД на
накопление дрожжевых клеток в процессе брожения квасного сусла, млн/см3,
24ч
Как видно из представленных данных рисунка 33,
наибольший прирост биомассы дрожжей был получен при использовании добавки с
величиной дозировки 3 см3. Концентрация дрожжевых клеток составила
24,3 млн/см3.
Как отмечалось ранее, более длительна обработка
не дает превосходящих результатов.
Таблица 14. Влияние различных дозировок БАД на
изменение содержания сухих веществ в процессе брожения квасного сусла
|
Продолжительность
брожения, ч
|
Дозировка
(см3)/100см3 /СВ,%
|
|
0,2
|
1
|
2
|
3
|
4
|
5
|
6
|
К
|
|
0
|
6
|
|
4
|
5,8
|
5,7
|
5,6
|
5,7
|
5,5
|
5,4
|
5,7
|
5,8
|
5,7
|
|
8
|
5,5
|
5,3
|
5,1
|
4,6
|
5,3
|
4,6
|
5,2
|
5,5
|
5,5
|
|
16
|
5,1
|
5,2
|
5
|
4,4
|
4,3
|
4,3
|
5
|
5,3
|
5,3
|
|
24
|
4,5
|
4,5
|
4,6
|
4,2
|
3,7
|
3,9
|
4,6
|
5,1
|
5
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Как видно из представленных данных таблицы 14,
наиболее активное брожение наблюдалось с использованием добавки с величиной
дозировки 3 см3. Такие результаты по содержанию сухих веществ
косвенно подтверждаются также результатами данных рисунками 29 и 30.
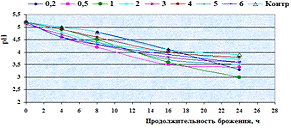
Рисунок 34. Изменение pH
в процессе брожения квасного сусла Результаты исследований после 10 минут
обработки при 9500 об/мин
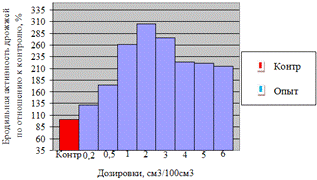
Рисунок 35. Влияние различных дозировок БАД на
бродильную активность дрожжей, %
Как видно из представленных на рисунке 35,
наибольшей бродильной активностью обладает добавка с величиной дозировки 2 см3,
бродильная активность составила 305,6 % по
отношению к контролю.
Можно утверждать, что наиболее длительная
обработка, более 5минут, не дала превосходящих результатов.
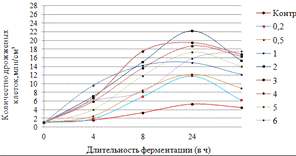
Рисунок 36. Влияние различных дозировок БАД на
накопление дрожжевых клеток в процессе брожения квасного сусла, млн/см3,
24ч
Как видно из представленных данных рисунка 36,
наибольший прирост биомассы дрожжей был получен при использовании добавки с
величиной дозировки 2 см3. Концентрация дрожжевых клеток составила
22,2 млн/см3.
Таблица 15. Влияние обработки различных
дозировок БАД на изменение содержания сухих веществ в процессе брожения квасного
сусла
|
Продолжительность
брожения, ч
|
Дозировка
(см3)/100см3 /СВ,%
|
|
0,2
|
0,5
|
1
|
2
|
3
|
4
|
5
|
6
|
К
|
|
0
|
6
|
|
4
|
5,7
|
5,3
|
5,3
|
5,5
|
5,4
|
5,3
|
5,2
|
5,7
|
5,8
|
|
8
|
5,4
|
5
|
4,9
|
4,6
|
4,8
|
4,8
|
4,7
|
5,5
|
5,6
|
|
16
|
5,2
|
4,7
|
4,4
|
4
|
4,4
|
4,5
|
4,4
|
5,3
|
5,4
|
|
24
|
4,9
|
4,2
|
4,2
|
3,8
|
4
|
4,2
|
4
|
5
|
5,2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Как видно из представленных данных таблицы 15,
наиболее активное брожение наблюдалось с использованием добавки с величиной
дозировки 4 см3.
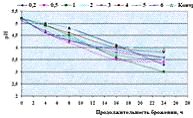
Рисунок 37. Изменение pH
в процессе брожения квасного сусла
Сам процесс гомогенизации представляет собой
операцию измельчания, проходящую под высоким давлением. Обычно гомогенизацию
проводят при температуре от 55 до 80єС и давлении от 10 до 25 МПа(100-250 бар)
в зависимости от типа обрабатываемого продукта. При этом эмульсии или суспензии
перекачиваются через узкий щелевой зазор под давлением. Давление жидкости
мгновенно преобразуется в скорость. Наряду с турбулентным потоком и эффектом
срезания за счет достижения давлений ниже давления пара жидкости возникает
эффект кавитации. Кавитация рассматривается как основной фактор по
совершенствованию работы измельчения частиц [125].
Как показали результаты исследований интенсификации
процесса брожения после обработки на гомогенизаторе: из двух режимов обработок
более эффективным оказался с частотой вращения 9,500 об/мин и длительностью
5минут. В результате данного режима бродильная активность дрожжей составила
340% по отношению к контролю, а концентрация дрожжевых клеток составила 25,7
млн/см3.
.2.3 Обработка БАД ультразвуком
Ультразвук - это упругие звуковые колебания
высокой частоты, распространяющиеся в виде волнового процесса в газах,
жидкостях и твердых телах. Поэтому некоторые закономерности, характерные для
звуковых колебаний, могут быть перенесены и на ультразвуковые колебания[19].
Упругие ультразвуковые колебания малой
интенсивности (порядка 10-9вт/см2, что соответствует
интенсивности разговорной речи), проходя через жидкость, не вызывают в ней
никаких остаточных изменений. Сжатия и разрежения, образовавшиеся под действием
звуковой волны, выравниваются тотчас же после ее прохождения. Волны высокой
интенсивности (порядка 1 вт/см3) вызывают ряд так называемых
вторичных эффектов; некоторые из них продолжают существовать и после
прохождения волны [7].
Результаты исследований после 5 минут обработки
на УЗ - установке
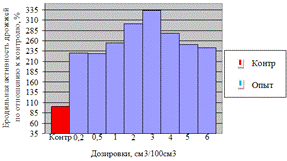
Рисунок 38. Влияние различных дозировок БАД на
бродильную активность дрожжей, %
Как видно из представленных на рисунке 38,
наибольшей бродильной активностью обладает добавка с величиной дозировки 3 см3,
бродильная активность составила 335,6 % по отношению к контролю.
Также стоит отметить, что при дальнейшем
увеличении дозы результаты бродильной активности ухудшаются.

Рисунок 39. Влияние различных дозировок БАД на
накопление дрожжевых клеток в процессе брожения квасного сусла, млн/см3,
24ч
Как видно из представленных данных рисунка 39,
наибольший прирост биомассы дрожжей был получен при использовании добавки с
величиной дозировки 3 см3. Концентрация дрожжевых клеток составила
24,2 млн/см3.
Таблица 16. Влияние различных дозировок БАД на
изменение содержания сухих веществ в процессе брожения квасного сусла
|
Продолжительность
брожения, ч
|
Дозировка
(см3)/100см3 /СВ,%
|
|
0,2
|
0,5
|
1
|
2
|
3
|
4
|
5
|
6
|
К
|
|
0
|
6
|
|
4
|
5,5
|
5,3
|
5,5
|
5,1
|
5
|
5,7
|
5,77
|
5,8
|
5,9
|
|
8
|
5,3
|
5,12
|
5,2
|
4,4
|
4
|
5,45
|
5,23
|
5,55
|
5,8
|
|
16
|
4,78
|
4,5
|
4,56
|
4,1
|
4
|
4,73
|
4,83
|
5
|
5,6
|
|
24
|
4,8
|
4,2
|
3,87
|
3,7
|
3,5
|
4
|
4,2
|
4,76
|
5,25
|
Как видно из представленных данных таблицы 16,
наиболее активное брожение наблюдалось с использованием добавки с величиной
дозировки 3 см3, в которой наблюдалась наибольшая убыль концентрации
сухих веществ.
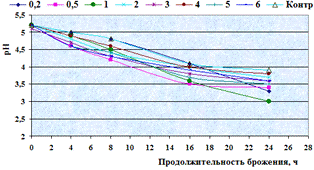
Рисунок 40. Изменение pH
в процессе брожения квасного сусла
Результаты после 7 минут обработки на УЗ -
установке
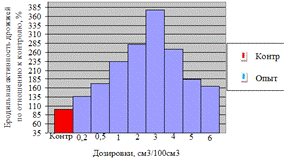
Рисунок 41. Влияние различных дозировок БАД на
бродильную активность дрожжей, %
Как видно из представленных данных на рисунке
41, наибольшей бродильной активностью обладает добавка с величиной дозировки 3
см3, бродильная активность составила 378,5 % по отношению к
контролю.
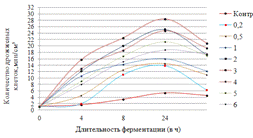
Рисунок 42. Влияние различных дозировок БАД на
накопление дрожжевых клеток в процессе брожения квасного сусла, млн/см3,
24ч
Как видно из представленных данных рисунка 42,
наибольший прирост биомассы дрожжей был получен при использовании добавки с
величиной дозировки 3 см3. Концентрация дрожжевых клеток составила
28,4 млн/см3 .
Таблица 17. Влияние различных дозировок БАД на
изменение содержания сухих веществ в процессе брожения квасного сусла
|
Продолжительность
брожения, ч
|
Дозировка
(см3)/100см3 /СВ, %
|
|
0,2
|
0,5
|
1
|
2
|
3
|
4
|
5
|
6
|
К
|
|
0
|
6
|
|
4
|
5,5
|
5,3
|
5,2
|
5,2
|
5,1
|
5,6
|
5,7
|
5,7
|
5,6
|
|
8
|
5,3
|
5,2
|
5
|
4,7
|
4,3
|
5,2
|
5,2
|
5,5
|
5,4
|
|
16
|
5,1
|
5,1
|
4,8
|
4,3
|
3,8
|
4,8
|
4,9
|
5,3
|
5,1
|
|
24
|
3,9
|
3,8
|
3,7
|
3,6
|
3,1
|
4
|
4,2
|
4,8
|
5
|
Как видно из представленных данных таблицы 17,
наиболее активное брожение наблюдалось с использованием добавки с величиной
дозировки 3 см3, о таком результате также свидетельствуют данные
экспериментов на рисунках 41 и 42.
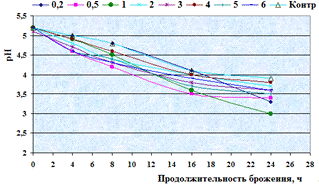
Рисунок 43. Изменение pH
в процессе брожения квасного сусла
Результаты после 10 минут обработки на УЗ -
установке
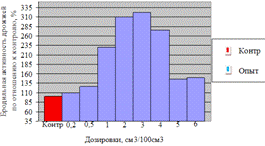
Рисунок 44. Влияние различных дозировок БАД на
бродильную активность дрожжей, %
Как видно из представленных на рисунке 44,
наибольшее максимальной бродильной активностью обладает добавка с величиной
дозировки 3 см3, которая составила 378,5 % по отношению к контролю.
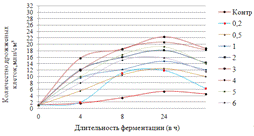
Рисунок 45. Влияние различных дозировок БАД на
накопление дрожжевых клеток в процессе брожения квасного сусла, млн/см3,
24ч
Как видно из представленных данных рисунка 45,
наибольший прирост биомассы дрожжей был получен при использовании добавки с
величиной дозировки 3 см3. Концентрация дрожжевых клеток составила
22,4 млн/см3
Таблица 18. Влияние обработки различных
дозировок БАД на изменение содержания сухих веществ в процессе брожения
квасного сусла
|
Продолжительность
брожения, ч
|
Дозировка
(см3)/100см3 /СВ,%
|
|
0,2
|
0,5
|
1
|
2
|
3
|
4
|
5
|
6
|
К
|
|
0
|
6
|
|
4
|
5,88
|
5,77
|
5,7
|
5,71
|
5,34
|
5,5
|
5,72
|
5,8
|
5,8
|
|
8
|
5,5
|
5,5
|
5,65
|
4,66
|
4,3
|
5
|
5,2
|
5,5
|
5,7
|
|
16
|
5,1
|
5,2
|
5,28
|
4,5
|
4,1
|
4,87
|
5
|
5,3
|
5,5
|
|
24
|
4,5
|
4,5
|
4,5
|
4,2
|
3,9
|
4,3
|
4,6
|
5,1
|
5,1
|
Как видно из представленных данных таблицы 18,
наиболее активное брожение наблюдалось с использованием добавки с величиной
дозировки 3 см3, где достигнута максимальная убыль концентрации
сухих веществ.
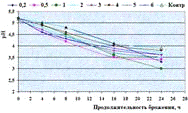
Рисунок 46. Изменение pH
в процессе брожения квасного сусла
Результаты испытаний показали, что из трех типов
обработки БАД наиболее эффективным оказался процесс обработки ультразвуком, о
чем свидетельствуют данные пункта 4.2.3.
Известно, что механическое перемешивание
уменьшает величину пограничного слоя до 10-3 см, в то время как
озвучивание практически полностью его разрушает. Поэтому, упругие
ультразвуковые колебания значительно ускоряют протекание гетерогенных
диффузионных процессов в тех случаях, когда интенсивное механическое
перемешивание (2000-3000 об/мин) не дает ощутимого эффекта [20,78,122].В
результате проведенных исследований [20] установлено, что интенсивность
диффузионных процессов в ультразвуковом поле, в некоторых случаях в 9 раз
превосходила скорость процесса при перемешивании.
В других исследованиях [162] были выделены
эффекты, ответственные за ускорение диффузионных процессов в ультразвуковом
поле (переменное давление и давление излучателя, перемешивающий и тепловой
эффект). Эти эффекты были разделены на легко воспроизводимые другими способами
(перемешивающий и тепловой эффект) и эффекты, свойственные только физическому
воздействию ультразвука (переменное давление, кавитация). Было определено
процентное участие перечисленных эффектов в интенсификации диффузионных
процессов. При этом установлено, что на долю собственно ультразвукового
воздействия приходится 40-60%. Тем самым было выяснено, что воздействие
интенсивного акустического поля на среду приводит к возникновению в ней
разнообразных, иногда достаточно сложных физических или химических явлений,
механизм и закономерность которых определяют эффективность ультразвуковой
интенсификации технологических процессов.
Известно, что возникновение кавитации
облегчается на границе раздела сред с различным акустическим сопротивлением.
Развитие кавитационных процессов способствует изменению проницаемости мембран
клеток, набуханию и разволокнению. Кроме того, увеличение проницаемости через
мембраны можно объяснить интенсификацией процессов турбулизации, появлением в
среде микропотоков, приводящих к уменьшению толщины диффузионного слоя и
увеличению градиента концентрации диффундируещего вещества на границе раздела.
Эти процессы интенсифицируют извлечение биологически активных веществ из сырья,
данные которые подтверждены экспериментально [11].
Способность ультразвука вызывать под действием
кавитации разрушение клеток выявлена многими исследователями [107]. В
зависимости от параметров звукового поля удается наблюдать или мгновенные
разрывы клеточных структур и клеток или быстро проходящие обратимые сдвиги в
физиологическом состоянии клетки.
Рассмотренное авторами воздействие ультразвука
на клетки показала, что извлечение содержимого клетки в окружающую среду в
ультразвуковом поле протекает с высокой интенсивностью. Это происходит за счет
различных эффектов возникающих под действием ультразвука, следствием которых
является разрыв клеток, клеточных структур, перемешивание содержимого клетки,
увеличение проницаемости клеточных структур и т.д.
Действие ультразвуковых волн не сводится только
к механическим разрывам клеток и клеточных структур с освобождением содержимого
в окружающую среду. В результате этого воздействия можно наблюдать
биохимические и функциональные изменения извлекаемых продуктов. Большое влияние
на направление и скорость этих физико-химических изменений оказывает состав и
реакция среды, наличие примесей и особенно - строение самого обрабатываемого
вещества. Не меньшее значение имеют и параметры ультразвукового поля.
Действие ультразвука является избирательным. Это
установлено как в отношении клеток и тканей, так и в отношении различных
пептидов, аминокислот и биологических активных веществ.
Количество продуктов распада алифатических
аминокислот зависит от длины цепи озвучиваемой аминокислоты - чем больше длина
цепи аминокислоты, тем больше образуется продуктов распада. Меньше продуктов
распада в растворе гликокола, несколько больше в растворе аланина, а еще больше
в растворе лейцина [132].
В ультразвуковом поле происходят изменения
структуры, формы и функции молекулы белка. Направление этих изменений зависит
от строения боковых и концевых групп белка и свойств газа, содержащегося в
водном растворе. При озвучивании белковых растворов особенно важное значение
приобретает выбор режима обработки [83]. Влияние ультразвука на аминокислоты и
белки многообразно и зависит от строения и концентрации их в растворе,
молекулярного веса, длины полипептидной цепи, вида белка и параметров
акустического поля. Приведенные выше изменения аминокислот и белков происходили
в результате длительного воздействия ультразвука на растворы чистых
аминокислот, при большей интенсивности ультразвука (от 4 до 15 вт/см2)
и при относительно высоких температурах (от 30° до 50°С ). По видимому,
создание более «мягких» режимов воздействия не будет приводить к столь глубоким
изменениям белковые вещества [128].
Действие ультразвуковых волн на свойства
извлекаемых биологически активных веществ зависит от состояния последних в
момент озвучивания, в частности, связаны ли они с клеточными структурными
элементами или находятся в свободном состоянии водном растворе. Одним из
критериев физико - химического нарушения субмикроструктур является сдвиги в
состоянии клеточных биокатализаторов - их количества и степени активности.
Изучая влияние ультразвуковых колебаний интенсивностью 10 вт/см2 на фермент
рибонуклеазу, было установлено, что ее ферментативная активность не снижалась
ни в присутствии кислорода, ни в присутствии водорода [133]. Более того,
некоторые разновидности ферментов (инвертаза), не обладающие в обычных условиях
ферментативной активностью приобретают эту способность под влиянием
ультразвуковых колебаний [95].
Преимущество ультразвуковой обработки
заключается в том, что происходит резкое извлечение веществ. При этом
увеличивается степень извлечения вещества из сырья и сокращается
продолжительность процесса. Это достигается благодаря сильному кавитационному
разрушительному действию ультразвука, следствием которого является расслоение и
разволокнение ткани, что приводит к увеличению поверхности взаимодействия фаз и
проницаемости мембраны клеток и в целом мембраны сырья, а также разрыв клеток с
освобождением содержимого в окружающую среду.
Использование ультразвуковых устройств в
отраслях пищевой промышленности открывает возможности для интенсификации ряда
технологических процессов [129].
Резюмируя полученные экспериментальные данные
можно сделать следующее заключение.
Нами была подобрана биологически активная
добавка (БАД) на основе ферментолизата пивной дробины с добавлением спирулины
платенсис, обработанная на ультразвуковой установке, позволяющая увеличить
бродильную активность и концентрацию дрожжевых клеток соответственно на 378 % и
568 % по отношению к контролю.
.3 Исследование влияние БАД на показатели
молодого пива
Также, полученная нами БАД применялась в
процессе брожения пивного сусла. С используемой расой дрожжей Saccharomyces
cerevisiae 8а(М) применение
БАД, как активатора, позволяет повысить действительную степень сбраживания к
контролю на 117% , также с увеличением степени сбраживания увеличилось
содержание этанола, которое составило 129%. Концентрация дрожжевых клеток
достигла 14,6 млн/см3, что составило 132% по отношению к контролю.
Цвет молодого пива сброженного с добавлением БАД была ниже контрольного
значения на величину 0,3. Содержание редуцирующих веществ в пиве было ниже, чем
в контрольном образце без добавления БАД, что свидетельствует о более
интенсивном потреблении углеводов сусла дрожжами. Физико-химические показатели
молодого пива описаны в таблице 19.
Таблица 19. Физико-химические показатели
молодого пива, полученного с использованием дрожжей 8а(М)
|
Показатель
|
Контроль
|
БАД
|
|
Содержание
алкоголя, % об.
|
4,13
|
4,7
|
|
Массовая
доля действительного экстракта, %
|
5,2
|
4,11
|
|
Действительная
степень сбраживания, %
|
53,4
|
62,6
|
|
Кислотность,
ед.к.
|
2,5
|
|
рH
|
4,3
|
4,0
|
|
Цветность,
ед.ц.
|
1,0
|
0,7
|
|
Массовая
доля редуцирующих веществ, г/100см3
|
4,2
|
3,3
|
.4 Получение БАД и исследование ее состава в
сравнении с известным зарубежным аналогом
Полученная нами биологически активная добавка
(БАД) содержала сухих веществ 3%, что является нестабильным соединением для ее
длительного хранения. Нами проведено концентрирование БАД на вакуум - выпарной
установке ИР-1-ЛТ, Labtech,
при температуре 30-35 єC
до концентрации 50% и более. Было показано, что концентрирование при
исследованных температурах не приводило к потере биологической активности
разработанного БАД.
Концентраты были испытаны в технологии
производства кваса и пива. Полученные данные подтвердили полную сохранность
биологически активных веществ в концентратах.
Данные, полученные по аминокислотному составу, с
использованием метода хроматографии показывают сбалансированное соотношение
незаменимых и заменимых аминокислот, что дает предпосылки для возможной
интенсификации процесса брожения с её использованием. Данные анализа
представлены в таблице 20.
Сравнивая, полученную добавку с аналогичной
комплексной смесью питательных веществ «Истлайф Экстра» можно выделить
отсутствие в последней такой незаменимой аминокислоты, как триптофан, а также
ряд некоторых других аминокислот.
Рядом ученых выдвинута теория прямого усвоения
аминокислот и доказано, что лучшим источником азота для дрожжей является азот
аминокислот.
Известно, что дрожжи наиболее активно в период
лаг-фазы ассимилируют метионин, серин и цистеин. В период интенсивного
размножения клеток, в экспоненциальной фазе, биосинтез белка обеспечивает
лейцин, лизин, тирозин и глутаминовая кислота.
При декарбоксилировании триптофана образуется
биологически активное вещество триптамин, которое в совокупности с другими
аминокислотами участвует в формировании вкуса, цвета и букета.
Кроме того, если питательные среды
сбалансированы по аминокислотам, то при развитии дрожжевых клеток в 1,3-1,6 раз
снижается уровень синтезируемых высших спиртов.
Азотсодержащие вещества потребляются клеткой в
процессе брожения и роста. От азотного обмена зависит построение компонентов
клетки дрожжей и образование в готовом продукте ароматических веществ.
Таким образом, азотное питание играет огромную
роль в процессе жизнедеятельности дрожжей, а возможность его регуляции
позволяет наметить перспективные направления совершенствования
биотехнологических процессов в бродильных производствах.
Таблица 20. Сравнительная характеристика
содержания аминокислот
|
БАД
(мг/см3) / а.с.в.
|
«Истлайф
Экстра» (мг/см3) / а.с.в.
|
|
Незаменимые
|
|
валин
- 3,65; изолейцин - 2,79; лейцин - 8,9; лизин - 5; метионин - 2,46; треонин -
2,87; триптофан-1,33; фенилаланин - 5,4;
|
валин
- 5; изолейцин - 4,5; лейцин - 7; лизин - 5,4; метионин - 1,5; треонин - 3;
фенилаланин - 5;
|
|
Заменимые
|
|
аргинин-6,96;
аланин - 4,29; аспарагин-1,24; аспарагиновая к-та - 11,56; глютаминовая к-та
- 4,46; глицин - 1,5; гистидин-2,7; глютамин-6,26; серин - 2,76; тирозин -
3,67;
|
аланин
- 8; аспарагиновая к-та - 4; глютаминовая к-та - 9; глицин - 2; серин - 4;
тирозин - 2;
|
Также в БАД были обнаружены следующие углеводы
(мг/см3): фруктоза - 29,3; глюкоза - 103,23.
Использование сбалансированных по аминокислотам
сред способствует активизации процессов генерации дрожжей, синтеза биомассы и
спиртового брожения [101].
Применение БАД позволяет сократить
продолжительность брожения квасного сусла на 20-30%.
Опытно-промышленные испытания показали
результаты идентичные с лабораторными.
Дегустационная оценка качества кваса,
полученного по контрольной (К) без добавки и опытной (О) с добавкой
представлена на рисунке 47.
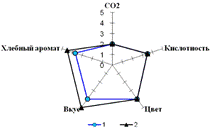
Рисунок 47. Профилограмма органолептической
оценки кваса: 1 - «К» (контроль); 2 - «Опыт».
Использование БАД позволяет улучшить вкус
готового напитка, получить более насыщенный аромат ржаного хлеба; бальная
оценка опытного образца составляет 19 против 17 баллов в контрольном.
.5 Технологическая блок-схема получения БАД из пивной
дробины
На основании проведенных исследований нами
разработана процессуальная схема производства биологически-активного вещества
(БАД), полученная путем ферментолиза пивной дробины. Далее в ферментолиз
вносится спирулина с последующей обработкой на ультразвуке. Полученное
биологически активное вещество положительно влияло на дрожжи, что и повышало
бродильную активность.
Технологическая схема включала в себя следующие
операции:
- приготовление ЭХА-раствора (анолит);
дезинфекция пивной дробины;
ферментативный гидролиз пивной дробины (ФП «Ondea
Pro»);
внесение препарата спирулина платенсис в БАД;
обработка БАД на ультразвуке;
вакуум-выпаривание БАД;
фасовка и упаковка готового продукта.
Технологическая блок-схема процесса получения
БАД представлена на рисунке 48.
Из бункера 6 пивная дробина дозатором объемного
действия 5 доставляется в емкость для предобработки 7, куда также из резервуара
3 водным насосом 4 через дозатор 5 вносится анолит, полученный на установке
электрохимической активации воды 1. Анолит служил как экстрагент. В емкости 9
пивная дробина обрабатывается анолитом, обладающий следующими характеристиками:
pH 3; ц=200mV.
Гидромодуль 1:2 (дробина:анолит). Длительность обработки 10 мин. Температура
25-30 °С.
Далее, полученная смесь пивной дробины и анолита
проходит через фильтр-пресс 8, с выходом дробины влажностью 70%.
После чего промывные воды анолита направляются в
реактор использованного анолита 9. В дальнейшем этот анолит может
использоваться в различных технологических целях и по истечении 7-10 дней
сливается в канализацию. Полученный жмых пивной дробины может храниться и не
обсеменяться в течение 72 ч. Жмых направляется в реактор 10, где смешивается с
ферментным раствором в количестве 0,4%, полученным в реакторе 12, который
получается добавлением ЭХА воды из 1. Ферментолиз протекает 4ч, при t=60°С.
Гидромодуль 1:4 (дробина : фермент).
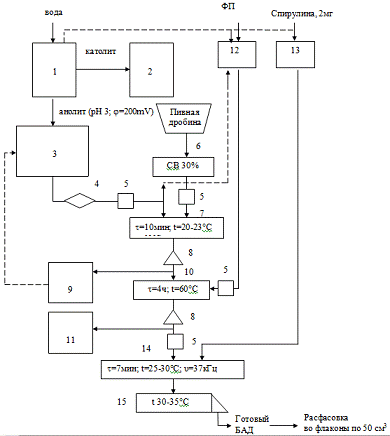
Рисунок 48. Технологическая блок-схема
производства биологически активной добавки (БАД) из пивной дробины: 1-установка
ЭХА воды; 2-сборник для католита; 3-резервуар для хранения анолита; 4-насос
водяной; 5- дозатор объемного действия; 6-бункер для пивной дробины; 7-емкость
для предобработки пивной дробины; 8-фильтр-пресс; 9-реактор для использованного
анолита; 10-реактор для получения БАД; 11-реактор для обработанной дробины; 12-
реактор для получения ферментного раствора: 13-бункер для спирулины;
14-УЗ-установка; 15-аппарат вакуум-выпаривания
Далее, полученный раствор фильтруется 8, где
твердая фаза дробины направляется в реактор для обработанной дробины 11.
Ферментолизат (БАД) дозатором 5 направляется на УЗ-установку 14. Из бункера 13
дозатором 5 вносится Спирулина в количестве 2мг. Продолжительность обработки
БАД на УЗ-установке 7 мин, при 25-30°С и частотой колебаний х=37кГц.
Далее насосом 4 полученный БАД направляется в
аппарат вакуум-выпаривания 15. БАД концентрируется до 50% и более для более
длительного срока хранения. Выпаривание проводится при температуре не более
30-35°С, во избежание инактивации биологически активных веществ.
Далее готовая продукция разливается в стеклянную
тару и отправляется на склад.
Хранить при температуре не более 12-15°C
в течение 1года.
Выводы
1. Разработана технология получения БАД из
пивной дробины на основе биотехнологических принципов.
. Установлены оптимальные режимы (рН 3,
продолжительность 10 мин, гидромодуль 1:2) обработки пивной дробины ЭХА
раствором (анолитом) для ее дезинфекции, которые позволяют увеличивать срок
хранения до 72 ч при температуре 25-30°С.
3. Подобран ферментный препарат Ondea
Pro и его дозировка
0,4 % от количества сухих веществ пивной дробины, позволяющий получить
максимальные значения белковых и редуцирующих веществ, соответственно (мг/100см3):
214,3 и 2,41.
4. Определены способы интенсификации
процессов брожения, а именно внесение спирулины платенсис в количестве 2 мг и
УЗ-обработка при получении БАД, позволяющие более чем в 2 раза превысить
бродильную активность дрожжей.
5. Подобрана дозировка спирулины платенсис
- 2 мг. При этом бродильная активность дрожжей увеличилась в 2,33 раза по
сравнению с контролем.
6. Из приведенных сравнительных методов
дополнительной обработки ферментолизатов (магнитное перемешивание,
гомогенизация, УЗ-обработка) выбрана УЗ-обработка, позволяющая более чем в 2
раза превысить бродильную активность дрожжей и их концентрацию.
. Получен опытно-промышленный образец
БАД; исследован его углеводный и аминокислотный состав в сравнении с известным
зарубежным аналогом, позволяющий сократить продолжительность брожения квасного
сусла на 20-30 %. Установлено наличие в опытном образце аминокислоты триптофан,
что положительно сказывается на органолептических показателях кваса.
. Разработана технологическая инструкция
(ТИ) на производство биологически активной добавки (БАД) из пивной дробины.
Ожидаемый экономический эффект от внедрения технологии получения 10 т БАД из
пивной дробины составляет 1 млн 940 тыс р в год.
Список использованных источников
1. А.С. 134 1743, СССР, 1985.
2. А.С. 138 7911, СССР, 1985.
. А.С. 175 2409, СССР, 1986.
4. ГОСТ Р 53094-2008. «Квасы. Общие
технические условия».
5. ГОСТ Р 52409-2005 «Продукция
безалкогольного и слабоалкогольного производства. Термины и определения».
6. Азарскова А.В. Термовлажностная
обработка пшеницы и её текстурные свойства
[Текст] //
Дисс.канд. техн. наук. - М., 1995. - С.216.
. Акопян В.Б. Ультразвук в
производстве пищевых продуктов [Текст] // Пищевая промышленность. - 2003. - №3.
- С.54.
. Антипов, С.Т. Сушка пивной
дробины в аппарате с закрученным потоком фаз [Текст]
/
Антипов С.Т., В.Е. Добромиров, А.В. Прибытков; Воронеж, гос. технол. акад.
Воронеж, 2005г. - С.164.
9. Антипов С.Т., Шахов
С.В.,Фараджева Е.Д. Способ получения пищевой биодобавки и сушилка для его
осуществления. - Патент RU
№2204263 С1. Заявка 2001131709/13, 23.11.2001 Опубликовано: 20.05.2003.
10. Апаликов М.А. Продуктивные
качества молодняка при использовании активированной воды (католита):
автореф.дис. на соиск. учен. степ. канд. с.-х.наук: спец. 06.02.04./Оренбург,
ОГАУ.-2004г.-С.24.
11. Архангельский М.Е., Пинус
Г.Н. Исследование влияния ультразвуковых колебаний на диффузию электролита в
гель желатины [Текст]/ Акустический журнал, №6, вып.3. 1960г. - С.278
. Бабаев И.Э., Сницарь А.И.,
Иванов А.В., Минко Н.Д., Кириллов М.П. и др. Биологически активная мука из
пивной дробины и способ ее получения. - Патент RU
2 250 045 C2. Заявка
2003116285/13, 03.06.2003. Опубликовано: 20.04.2005
13. Бахир В.М. - Электрохимическая
активация: история, состояние, перспективы [Текст]/
М.:
ВНИИМТ, 1999.-С. 256.
14. Бахир В.М. «Электрохимическая
активация 1997». Первый международный симпозиум. «Электрохимическая активация в
медицине, сельском хозяйстве, промышленности» [Текст]/ - М., 1997 -С. 247.
15. Бахир В.М. Регулирование
физико-химических свойств технологических водных растворов униполярным электрохимическим
воздействием и опыт его практического использования. // Дисс. канд. техн. наук.
- Казань: Казанский хим.-технол. институт, 1985. - С.146.
16. Бахир В.М., Кирпиченков П.А.,
Лиакумович А.Г. и др. [Текст]/Изв.
АН УзбССР, сер.техн.наук, 1982, Т.4, - С.70.
17. Бахир В.М., Полухин П.П,
Научно-технический отчет по теме ТТУ-667-82. [Текст]/Раздел исследование
эффективности метода электроактивации жидких продуктов бытового назначения.
Ташкент, 1983 - с.20.
18. Бахир В.М., Задорожный Ю.Г.,
Леонов Б.В. и др. [Текст]/Электрохимическая активация: очистка воды и получение
полезных растворов. - Издательство «Маркетинг Саппорт Сервисиз», ВНИИМТ -
2001г.- с.85-86
. Беззубов А.Д. Ультразвук и
его применение в пищевой промышленности [Текст]/ -2-е изд., доп. и перераб. М.:
Пищевая промышленность, 1964г. с.31-33.
. Белов Б.Г. Влияние
ультразвука на процессе диффузии в гелях и жидкостях. Применение ультразвука к
исследуемому веществу[Текст]/ вып. 25, -1961г. - С.309.
. Берестень Н.Ф. «Разработка
интенсивной технологии концентрата квасного сусла с применением
биокатализаторов». Дисс. канд. техн. наук. -М.:1987г. с.75-79.
. Берри Д. Биология дрожжей:
Пер. с англ. [Текст] - М.: Мир, 1985. - С.96.
23. Бидихова М.Э. Интенсификация
брожения в пивоварении с использованием «Spirulina
Platensis».// Дисс…канд.
техн. наук. - М.:2003г. - С.180.
24. Бирюлина Т.В. Активированная
вода[Текст] (М.:
ВНИИМТ),1996,№3, с.22-34.
25. Бочкарева Н.Г., Белогорцев
Ю.А., Удалова Э.В., Козлова Р.Г. «Штамм бактерий Bacillus
subtilis - продуцент
комплекса гидролитических ферментов, обогащённых b-глюканазой».
-Патент RU №2046141
С1.
Заявка 93017716/13, 05.04.1993
Опубликовано 20.10.1995
. Букин В.Н. Витамины в
животноводстве[Текст]/-М.: «Знание»,1966г.-С.30.
27. Букин Ю.Б., Немойтин М.М., Блинков
С.Д., Федоров А.Л., Попова В.А. «Способ получения спирта из гемицеллюлозных
гидролизатов растительного сырья». - Патент RU №2109058 С1.Заявка 97113656/13,
20.08.1997 Опубликовано: 20.04.1998
28. Булгаков Н. /Техно-химический
контроль и учет пивоваренного производства [Текст]/ - М.: Пищепромиздат, 1952.
- С. 219
29. Бушина И.А. Совершенствование
технологии коньяков на основе использования электрохимически активированной
воды и дубового экстракта.// Автореф.дисс. на соиск.учен.степ.канд.техн.наук:
спец. 05.18.07.МГУПП..М.:2005.
30. Быкова И.А. Разработка способов
использования пивной дробины в качестве компонента различных биологических
систем : Автореф.дисс.канд. биол.наук/ Оренбург. гос. мед. акад. Оренбург,2003.
31. Васильев Е.П. Термодинамические
свойства растворов электролитов [Текст]/
- М.: Высшая школа, 1982 - С.319.
32. Веркин Б.И., Павлюк Р.Ю.,
Максименко Г.И., Малют В.И. Технология криогенного измельчения сырья при
получении порошкообразных концентратов для безалкогольных напитков[Текст]/.
- Агрониитэип, М, 1998,С.102.
. Веркин Б.И. и др.
Криогенное измельчение фармакологических и других препаратов[Текст]/
. - Харьков, 1985 - С.37.
34. Вторичные материальные ресурсы
пищевой промышленности (Оборудование и использование) [Текст]/. - М.:
Экономика,1984. - С.328.
35. Гарманова Е.Л. Изыскание новых
источников аминного азота для производства хлебопекарных дрожжей.
Дисс..к.т.н.,Воронеж, 1978 -
С. 90.
36. Гернет М.В., Кочеткова А.А.,
Ковалева Л.Г. и др. Использование электрохимической активированной воды для
стабилизации пива против коллоидных помутнений//Первый международный симпозиум.
Электрохимическая активация в медицине, сельском хозяйстве, промышленности[Текст]/.
- 1997. - «МИС-РТ» -1991г. - №21.-С.138-139.
37. Гинзбург А.С. Основы теории и
техники сушки пищевых производств[Текст]/
А.С. Гинзбург. - М.: Пищевая пром-ть, 1973. - С.528.
38. Гинзбург А.С. Сушка пищевых
продуктов в кипящем слое [Текст]/
А.С. Гинзбург, В.А. Резчиков. - М.: Пищевая пром-ть,1966. - С.196.
39. Главарданов В. Производство
сиропообразных продуктов на основе хлебных злаков[Текст]// Пиво и напитки,
2010г. - №5, - С.44-47.
40. Главачек, Ф. Пивоварение
[Текст]// Пер. с нем. под ред. А.П.Колпакчи./ Ф.Главачек, А.Лхотский. - М.:
Пищевая промышленность, 1977. - С.623.
41. Голикова Н.В., Комплексное
использование сырья при производстве пива в СССР и зарубежом [Текст]/
Н.В.Голикова, О.В. Андреева, Л.В. Киселева. ЦНИИТЭ Пищевая промышленность:
Обзорная информация. Серия:. - Пивоваренная и безалкогольная промышленность. -
М., 1985. - Вып. 4. - С.24.
. Голубев В.Н., Жиганов И.Н.
Пищевая биотехнология[Текст]/ М, ДеЛи принт, 2001, - с.72-73.
43. Гончаренко С. Кому нужна «живая
вода»? [Текст]/ Техника и наука: Научно - технический журнал Всесоюз. Совета
Научно - технического Общества, №10, 1982, с.10 -11.
. Горлов И.Ф.,Осадченко
И.М.,Сложенкина М.И.,Бущуева И.С./Применение электрохимически активированной
воды и водых растворов при производстве и переработке сельскохозяйственной
продукции:рекомендации//ГУ ВНИТИ и ППЖ Россельхозакадемии. - Волгоград,2006. -
С.32.
. Григорьев М.А. Разработка
биотехнологических процессов комплексной конверсии растительного сырья и
вторичных сырьевых ресурсов АПК с получением кормовой добавки для
животноводства / Автореф. дис. на соиск. учен. степ. канд. биол. наук: специальность
03.00.23 биотехнология.
46. Данченко О.С. Рациональное
использование отходов пивоваренного производства [Текст]/ Минск,1970.
47. Дегтярев С.В. Технология
комплексной переработки отходов пивоварения: Автореф. дис. на
соиск.учен.степ.канд.биол.наук- Пермь, 2000г. - С.28.
48. Денщиков М.Т. Отходы пищевой
промышленности и их использование [Текст]/
М.Т. Денщиков. - М.:. - Пищепромиздат, 1963. -С. 615.
. Денщиков М.Т. Использование
отходов пищевой промышленности[Текст]/
- М.: Пищевая промышленность, 1959, - С. 151.
50. Дерягин Б. В., Гураев Н. В.
Новые свойства жидкостей[Текст]/ М.: Наука, 1971 - С.174.
51. Диксон М., Уэбб.Э. Ферменты:
пер. с англ. [Текст]/ - М.:Мир,1982 - т.1. - С.43.
52. Евсеев Е. Эти активированные
жидкости[Текст]/ Техника и наука: Научно - технический журнал Всесоюз. Совета
Научно - технического Общества, 1982, №1, 11 -12 с; №2, - С.13-14.
53. Егорченков М.Х.
Кормоприготовительный цех с использованием пищевых отходов[Текст]/ Опыт совхоза
«Белая Дача».-М.: Россельхозиздат, 1985. - С.79.
. Ермолаева Г.А., Колчева Р.А.
[Текст]//Технология
и оборудование производства пива и безалкогольных напитков: /Учеб. для нач.
проф. образования. - М.: ИРПО; Изд. Центр «Академия», 2000. - С. 380.
55. Ершов В.Г. Успехи химии[Текст]/
1981, Т.50, №12, - с.21-57.
56. Журков В.И. Использование
отходов солодовенного и пивоваренного производства[Текст]/
В.И. Журков ЦБТЭИ Центросоюз. Потребительская кооперация: Экспресс-информация.
- Серия. - Пивобезалкогольная промышленность. - М.: 1980.- Вып. 6. -С.17.
. Закомырдин А.А. Применение
установок СТЭЛ в животноводстве для получения моющих и дезинфицирующих
растворов [Текст]/
С.63-65.
58. Зафрен С.Я. Технология
приготовления кормов (Справочное пособие)[Текст]/
С.Я.Зафрен. - М.: Колос, - 1977. -С.240.
59. Информация от «Тетра Пак».
Особенности использования гомогенизаторов[Текст]//Молочная промышленность.-
2008г.- №5, - с.12.
. Исламмагомедова Э.А. Влияние
питательной среды на содержание фосфора в биомассе дрожжей Saccharomyces
cerevisiae
I-503[Текст]//
Хранение и переработка сельхозсырья, 1998,№10, - С.19.
61. Казидо Г.М. «Разработка способов
получения растительных белков из пивной дробины с применением микробных
ферментных препаратов». Автореф.дисс.канд.техн.наук/ -М.:1989г. -С.33.
62. Калимулов М.Ю., Дрягин С.В., Тилинина
Ж.В. «Способ производства хлеба». Патент RU
№2159549 2000 г. Заявка: 99108301/13, 19.04.1999 Опубликовано: 27.11.2000
63. Калошина Е.Н.
Ресурсосберегающие технологии кормопродуктов на базе вторичного сырья
спиртового и пивоваренного производств[Текст]/
Монография. - М.: Издательский комплекс МГУПП, 2006. - С. 280.
64. Калунянц К.А., Яровенко В.Л.,
Домарецкий В.А, Колчева Р.А. [Текст]/Технология солода, пива и безалкогольных
напитков. - М.: Колос, 1992. -с.425 - 446.
. Карпенко Д.В. Биосорбция:
способ интенсификации технологических процессов бродильных производств[Текст]/Монография.
- Москва, 2003г. с.84-87.
66. Карбаинов Ю.А., Томский
политехнический институт/ Электрохимическая активация водных сред в новых
ресурсосберегающих технологиях [Текст]//
Соровский образовательный журнал,№10,1999г, с.51-54.
67. Кирпичников П.А., Бахир В.М.,
Гамер П.У. и др. Докл. АН СССР, 1986, Т.286,№3, с.663-666.
68. Киселева И.В., Пучкова Е.В.,
Кобелев К.В., ГУ ВНИИ ПБ и ВП (г.Москва); Гернет М.В., Лаврова В.Л. (МГУПП) -
Способ интенсификации процесса сбраживания сусла[Текст]// «Пиво и
напитки»,2004г, №2, С.38 - 39.
69. Кнорре Д.Г.,
Мызина С.Д. Биологическая химия [Текст] - М.:ФГУП «Издательство «Высшая школа»,
2002 - С.468.
70. Ковалев Н.Г., Рабинович Р.М.,
Сульман Э.М., Рабинович Г.Ю., Фомичева Н.В. «Способ приготовления компоста с
использованием пивной дробины». - Патент RU
№2249581 С1. Заявка 2003138196/12, 31.12.2003. Опубликовано: 10.04.2005
71. Коваленко В.И. Рациональное
использование отходов пивоваренного производства[Текст]/ Тезисы докладов к
всесоюзному совещанию «Улучшение комплексного использования сырья и отходов
производства в пищевой промышленности» (г.Крымск, Краснодарского края, 16-18
мая 1979г) - М.:ЦНИИТЭИ пищепром, 1979. -С.76.
72. Колпакчи А.П. и др. Вторичные
материальные ресурсы пивоварения[Текст]/-М.: Агропромиздат, 1986 г, - С.160.
. Комаров В.И., Мануйлова
Т.А. / Обзор: Переработка вторичных сырьевых ресурсов - важнейшее направление
повышения эффективности производства [Текст]/М.:АгроНИИТЭИПП, 1995.,сер.,28.,
вып.3,-С.30-31.
74. Комплексное использование сырья
в пищевой промышленности [Текст]/
Под редакцией Ю.П. Лебединского. - Киев: Техника, 1983, -С.144.
75. Коновалов С.А. Биохимия дрожжей
[Текст]/ - М.: Пищевая промышленность,1980. - С.271.
76. Коротаев В.М., Балашов В.Е,
Чернов М.Е. Сушка гранулированной пивной дробины на вибросушилках [Текст]//
ЦНИИТЭИпищепром. - 1980. - Вып.5. - с.20-22.
77. Коротаев В.М., Балашов В.Е.,
Панищев В.Г. Исследование гранулируемости пивной дробины прессованием[Текст]//
ЦНИИТЭИпищепром. - 1980. - Вып.5. - с. 18-20.
78. Кортнев А.В., Макаров Г.В.
Воздействие ультразвуковых колебаний на диффузионные процессы в жидкости,
Акустика и ультразвук[Текст]/
Киев. - 1966г.
. Кретов И.Т. Сушка пивной
дробины [Текст]/И.Т. Кретов //Изв.вузов. Пищ. технология,1961. - №4. -
с.124-127.
80. Кругликов Б.В., Гернет М.В.
Применение ЭХА-растворов для экстракции горьких веществ хмеля [Текст]// Пиво и
напитки.-№2,2011г. - с.36-38.
. Куватов Д.М., Касперович
В.Л., Иванова А.П. Биотехнология кормопроизводства [Текст]/- Издательство
«Гилем», Уфа - 2003, - С.195.
82. Куцакова В.Е. Интенсификация
тепло-массообмена при сушке пищевых продуктов [Текст]
/ В.Е. Куцакова, А.Н. Богатырев. - М.: Агропромиздат, 1987.- С.236.
83. Лапинская Е.Р., Миронов А.Н.,
Хенок М.А. Воздействие ультразвука на белки и аминокислоты [Текст]/
ДАНССР, том 95, I, 109-117, -
1954г.
84. Ларивошина Н.В. Эффективность
обработки воздушной среды инкубатория электроактивированной водой [Текст]/
В сб. Электрохимическая активация в медицине, сельском хозяйстве и
промышленности, М.: 20-24 дек. 1994, Тез. докл., Ч.1,М., 1995г. - С.72-73
85. Ленинджер А. Основы
биохимии[Текст]/ - М.:Мир,1985-т.1-С.108-221.
. Леонов Б.И. Электрохимическая
активация воды и водных растворов: прошлое, настоящее, будущее[Текст]//
Сборник трудов Первого международного Симпозиума по электрохимической
активации. М.: ВНИИИМТ, 1997, С.3-5.
87. Лыков А.В. Теория сушки[Текст]/.
- М.: Энергия, 1968. -С.470.
. Мальцев П.М.
Химико-технологический контроль производства солода и пива[Текст]/ П.М.
Мальцев, Великая Е.М., Зазирная М.В.- М.: Пищевая пром-ть, 1976.-С.259.
89. Мальцев П.М., Великая Е.И,
Зазирная М.В., и др. Химико-технологический контроль производства солода и
пива[Текст]/-М.: Пищевая промышленность, 1976. - С.477.
. Мартынов А.А. Применение
активаторов брожения «ВИТОЛ» в пивоваренной промышленности[Текст]// Пиво и
напитки.-№1,2011г. с.18-19.
. Масленникова Е.В.
Использование отходов пиво-безалкогольной промышленности[Текст] // ЦНИИТЭИ
Пищевая промышленность :экспресс-информация. - Сер.7: Винодельческая,
спиртовая, ликеро - водочная и пиво - безалкогольная промышленность. - М.,1984.
- Вып.1.- С.17.
92. Методические указания к
выполнению лабораторных по курсу «Технология пивоваренного и безалкогольного
производства» [Текст]/ Часть1/ М.:1999г,-С.13.
. Микеладзе Г.Г., Кешелашвили
Н.Г., Шарашеидзе Н.Н. Получение пищевого белка при поверхностном выращивании
дрожжей и мицелиальных грибов в симбиозе на растительных отходах
сельскохозяйственного производства[Текст]/Сборник
научных трудов: Использование биомассы микроорганизмов для пищевых целей. -
Пущино,1985г .
94. Морозов В.Ю., Галкина Г.В.,
Илларионова В.И. «Штамм бактерий Enterococcus
faecium B-2240
D-продуцент
оптически чистой L
(+)-молочной кислоты». Патент 2205216 С2. Заявка: 2000125372/13, 10.10.2000
Опубликовано 27.05.2003
95. Опарин А.И., Гельман., Эльпинер
И.Е. Изучение локализации ферментов в клетках Endomyces
magnussi при помощи
ультразвука[Текст]/
ДАНСССР, т.44, №3, 1954г.
96. Пазизина К.В. Кормовая ценность
пивной дробины[Текст]
//Корма и кормопроизводство. - 1984. - Т.18. - с. 56-58.
97. Паничева С.А. Новый способ
санобработки техоборудования, трубопроводов. Тары в пищевой промышленности. В
сб. Всерос. конф. Методы и средства стерилизации и дезинфекции в медицине[Текст]/М.:
ВНИИМТ, 1992, - С.198-199.
98. Пойманов В.В. Об утилизации
вторичных материальных ресурсов пивоваренного производства[Текст] /В.В.
Пойманов, А.В. Прибытков, Р.В. Кораблин // Материалы XL
отчетной научной конференции за 2001 год: В 3ч. Воронеж. гос. технол. акад.
Воронеж. - 2002. - Ч.1. - с. 224 - 225.
99. Рензяева Т.В., Назимова Г.И.,
Кудинова В.М., Рензяев О.П. Растительное сырьё с функциональными свойствами для
производства вафель[Текст]/
- В кн.: Переработка сельскохозяйственного сырья. - Кемерово, 1999. - с. 64-65.
100. Риберо-Гайон
Ж., Пейно Э., Риберо-Гайон П., Сюдро П. Теория и практика виноделия[Текст]/ Том
2. - М.: Пищевая промышленность, 1979. -С. 352.
101. Римарева Л.В. Теоретические и
практические основы биотехнологии дрожжей[Текст]
/ Л.В. Римарева. - М.:ДеЛи Принт, 2010. - С.94.
102. Романков П.Г.,Рашковская Н.Б.
Сушка во взвешенном состоянии[Текст].
- Л.:Химия,1979. - С.271.
103. Руле А. Справочник пивовара
[Текст]/ Л.П. Рудинов. - М.:Пищевая промышленность,1969. - С.543.
. Рыжанова И.И. Использование
пивной дробины в хлебопечении[Текст]
/Опыт США, ФРГ и др./. - Науч.-техн. реф. сб./ ЦНИИТЭЙпищепром. Хлебопекарная,
макаронная, дрожжевая пром-сть, 1981, вып.5, С.22-24. - Библиогр.: С.24.
105. Рыжкова Д. Ксилит родился из
пивной пены. Производство на «Парнасе» может потеснить на мировом рынке финских
поставщиков[Текст]
// «Деловой Петербург». - 2003г. - №179.
106. Сазонова И.А. Разработка
технологии стабилизации, биотрансформации и применение пивной дробины:
автореф.дисс. на соиск учен. степ. канд. биол. наук: специальность 03.00.23
биотехнология.
107. Самосудова Н.В., Эльпинер И.Е.
Об ультраструктуре миофибрилл, подвергшихся действию ультразвуковых волн [Текст]/
Биофизика, том 9, вып.4, - 1966г.
108. Свиридов Д.А., Гернет М.В.,
Кобелев К.В. Пивная дробина в производстве белковых концентратов [Текст]// Пиво
и напитки. - №6. -2005, с. 28-30.
109. Серик А.П. «Технология солода,
пива и безалкогольных напитков» [Текст] / А.П. Серик. - М.: Пищевая
промышленность, 1991г. - С.178 .
110. Сизенко Е.И., Вторичные
сырьевые ресурсы пищевой и перерабатывающей промышленности АПК России и охрана
окружающей среды[Текст]/
- М.: Пищепромиздат, 1999. - С. 468.
111. Скрябин В.И. «Разработка
технологии кваса длительного срока хранения с использованием иммобилизованных
дрожжей». //Дисс…канд.техн.наук.-М.:2005г.-С.62.
112. Сницарь А.И.. О перспективах
использования пивной дробины[Текст]
//Мясная индустрия. - 2000. - №7. - с. 45-47.
113. Соловьев А.А., Лямин М.Я.,
Ковешинков Л.П., Зайцев С.И., Киселева С.В., Чернова Н.И. «Водорослевая
энергетика» [Текст]/ М.,МГУ, 1997г., С.7-8.
. Страйер Л. Биохимия[Текст]/ -
М.: Мир, 1984 - т.1, - с. 18-102.
. Фараджева Е.Д. Разработка
способа утилизации пивной дробины / Е.Д. Фараджева, Р.В. Кораблин, О.С. Банина,
С.В.Шахов, А.В. Прибытков// Хранение и переработка сельхозсырья., 2001.,№1,
с.57-59.
. Фертман Г.И., Исаков Э.А.
Использование отходов солодовенного производства[Текст]/-
М.: ЦИНТИпищепром, 1967, - С.28.
. Фиалкова Е.А. Гомогенизация.
Новый взгляд: монография-справочник[Текст]/ Е.А.Фиалкова, Санкт-Петербург:
ГИОРД, 2006г. С.10.
. Филиппович Ю.Б. Основы
биохимии[Текст]/- М.: Агар, 1999. - С.512.
. Филоненко, В.И.
Активированная вода [Текст]/
В.И. Филоненко, С.Н. Спирина, Е.Ю. Байкова.-М.: ВНИИИМТ, 1996.-№5.-с.10-12.
120. Филоненко В.И., Фисинин
В.И.,Шоль В.Г. и др // Электрохимическая активация в медицине, сельском
хозяйстве и промышленности[Текст]/:
Тез. докл. Всероссийской конф. М., 1994. - с. 75-76.
. Фисинин В.И., Егоров И.А.,
Сницарь А.И., Мурачев Д.А. Белково-минеральная добавка на основе пивной дробины
в рационе бройлеров[Текст]
//Мясная индустрия. - 2000. - №8. - с. 45-47.
. Фридман В.М.
Физико-химическое действие ультразвука на гетерогенные диффузионные процессы
жидкостной, обработки материалов[Текст]/
сб.докл. Всесоюзной конференции «Применение ультразвука в
химико-технологических процессах», М. - 1960г. с.107-118.
123. Фролов В.П. О рациональном
использовании отходов пивоваренной промышленности [Текст]/ В.П. Фролов. ЦНИИТЭ
Пищевая промышленность: Научн. - технич. ред. сб. - Пивоваренная и
безалкогольная промышленность. - М., 1983. - Вып. 4. - с.21-22.
. Хорунжина С.И. Биохимическое
и физико-химические основы технологии солода и пива[Текст]/ М., Колос, 1999,
С.186.
125. Хохлов Ф.В. ООО
«Пищмашсервис»(Москва) Гомогенизаторы, которые не подводят[Текст]//Пиво и
напитки,2004г.-№4,С.50.
126. Храпенков С.Н. Применение
ЭХА-растворов и ферментных препаратов для экстракции хмеля[Текст]/С.Н.
Храпенков, М.В.Гернет, Д.А. Свиридов//Пиво и напитки. -2004.-№2.-с.32-33.
127. Храпенков С.Н., Гернет М.В.
Воздействие электрохимически активированных систем на ферменты солода [Текст]
//Пиво и напитки.-№5,2002г. с.27-28.
128. Хромова Р.А. Исследование
влияния ультразвуковых колебаний на интенсификацию процесса экстракции
сычужного фермента. Дисс..канд.техн.наук. -М.:1971г. - С.167.
129. Царахова Э.Н., Касьянов Д.Г.,
Одинец Н.А. Интенсификация технологических процессов с помощью
ультразвука[Текст]// Известия вузов, пищевая технология. - 2010. - №2-3. -
с.122-123.
130. Шабурова Л.Н. Разработка
технологии активирования пивных дрожжей для заводов малой мощности. Автореф.
дисс…к.т.н. М., 2001, С.24.
131. Шишков Ю.И., Плахов С.А., ГУП
напитков в Хамовниках РСНХ, - Увеличение физиолого - биохимической активности
посевных дрожжей[Текст]// «Пиво и напитки», 2002г, №3, с.14 - 19.
132. Эльпинер И.Е., Сокольская А.В.
Действие ультразвука на некоторые белки и аминокислоты в зависимости от природы
присутствующего газа[Текст]/ ДАНСССР, 123, 4, 659, - 1958г.
133. Эльпинер И.Е. Ультразвук.
Физико-химические и биологическое действие[Текст]/ М.:1963г.
134. Юрина О.С., Осадченко И.М.,
Скачков Д.А. Перераспределение примесей ионов тяжелых металлов в водопроводной
воде при её активации [Текст]/
с.256-267.
135. Antonetti T. For
breakfast bars, breads, snack foods… Brewers’s spent grain flour adds protein,
fiber, malt flavor. - Baking Industry, 1979, vol.146, №1786, Р.34-35,
ill., tab.
136. Arnould R. et al.
Recuperation des bieres demousse pour l'alimentation du betail//Cerevisiae. -
1983. - N 2. - S.89-103.
. Barclay Ron. Upgrading
spent grains. - Brew. Guard., 1982 (111), N 7, Р.
18-19.
138. Boughton R.A. Spent
Grains. - A Protein Source Brewer, 1976 (62), N 743, Р.
286-289.
. Burroughs W., Woods
W., Ewing S.A., Greig J., Theurer B.J. // Animal Sci. - 1960, - № 19, - P.
458-464.
. Cyrill Roy Elson, Jill
Mayreen Griffin, Robert Tudor Roberts. Baker Brettell and Duncan(GBR). Заявка
2105565 GB, МКИі А 23
1/10 Edible
products/ - N
8227080. Заявлено 22.09.82. Опубл 30.03.83; Приоритет 22.02.81. №
8128659. (GBR) - 9с.,ил.
1л.
. Dreese P.S., Hoseney
R.S., Baking properties of Bran fraction fon Brewers' spent grains//Grains
Chemistry. - 1982. - Vol. 59. - N2. - P. 89 - 91.
. Finley J.W., Hanamoto
M.M. Milling and baking properties of Brewer’s spent grain. - Cereal Chemistry,
1980, vol. 57, №3, Р.166-168,
ill., tab. - Bibliogr.: Р.168.
. Friedrich H. - P.,
Handreck B., Rȍhring
W. Zum Einsatz von Biertrebern in Spezialbrot\\ Backer und Konditer. - 1986 Bd
34. - N 1. S. 5-6.
. Gill J.W., King K.W.J.
Agr. Food Chem. - 1957, - № 5, - P. 363-367.
. Hang J.D. Citric Acid
Fermentation of Brewery Waste. - Journal of Food Science, 1977 (42), N 2, Р.
383-384.
. Hang J.D. Utilization
of Brewery Spent Grain Liquor. by Aspergillus niger. - Applied Microbiology,
1975, v. 30, N 5, Р.
879-880.
. Hernader-Pinerva J.R.,
Lewis M.J. Disposal of excess brewers yeast by recycling to the Brewhouse //
Jour. Inst. Brew. - 1975, v.81. - P.476-483.
. Hodapp F. Biertreber
und ihre Verwendungsmoglichkeiten. - Monatsschrift fur Brauerei, 1979, Bd 32,
№2, S.88-90, tab.
149. Hug H. Malrtreber-ein
preissunstiges kraftfutter - mittel// Brauerei-Rundschau. - 1981. - 92 - N 12.
- 8. 293 - 297.
. Jensen L.S., Fry R.E.,
Allred J.B., McGinis J. // Poultry Sci. - 1957, № 36, - P. 919-921.
151. Lippmann P.Schlammenwаsserung
durch schwerkraft - Filtraton// Brauwelt/ -1983. - 123. N 7. - S. 254 - 255.
. Lowry O.H., Rosebrough
N.J., Farr A.L., Randall R.J. Protein measurement with Folin phenol reagent//
J.Biol. Chem. 1951. V. 193. №1. P. 265-275.
. Meuser F., Niefind H.,
Kȍnler F. Verwertung
von Treber fȕr
ballaststoffongereichertes Brot//Getreide Mehl und Brot . -1982. - Bd 36. - N
4. -S.92-97.
. OʼСonnor
- Cox Improvid yeast handing in the brewery. Part. I: Yeast croppind// Brevery
Guardian, December 1997, Р.26-33
. Ozturk S., Ozboy O.,
Cavidoglu I., Koksel H. Effects of brewer’s spent grain on the quality and
dietary fibre content of cookies. - J. Inst. Brewing, 2002, Vol. 108, №1. - Р.23-27.
. Ponz M.-N., Chanel S.
Effect of heavy metaks on volatiles production by S. cerevisiae.// J.Ferment.
and Bioeng.
- 1991. - Vol.72, N1.-
P.61-63.
157. Prentice, N. Enzymic
hydrolis of brewers spent grains /. N. Prentice // Refsquard Journal of the
American Sosiety of Brewering Chemists. - 1978/ - № 4. - P. 196-200.
. Reed G. Enzymes in food
processing - New York and London. - 1966.
159. Roberts R.T. Use of an
Extract of Spent Grains as an Antifoaming Agent in Fermentators. - Journal
Institute of Brewing., 1976 (82), N 2, Р.
96.
. Smith A.J.T. Recovery
and Handling of Surplus Yeast // Brewers Guardian. - 1979, - № 6, - P. 35-38.
. Tim O'Rourke. Making
money of spent grains and byproducts/Tim O'Rourke//Brewers Guardian January. -
1984. - 113. - №1. - P. 33 - 34.
. Tarnoezy Th., Tamas
Gy., Uber die Diffussionssteigernde Wirkung der Ultraschalls, Elektromedizin,
5,4,Р.222,
1960.
. Townsley P.M.
Preparation of commercial products from brewer’s waste grain and trub. MMBA,
Techn. Quart, 1979, N 16, Р.130.
. Townsley P.M.
Preparation of commercial products from brewer’s waste grain and trub. -
Beverages, 1981, v. 38, N 4, Р.18-20.
165. Wang Jun-Ying, Hu
Zhi-Xiang. Application of microbial amilases in food industry // Biotechnology
and Food Industry / Ed. by J. Hollo, D. Torley. Budapesht:
Akademiai Kiado, 1988. Р.211-223.
166. Weaver, L.Robert,
Townsley, M.Philip (Канада);
Molson Companies Limited (The).(Канада.).
- № 334936; Заявл. 18.02.79.Пат.
1133 748 Канада, МКИі
А23
1/00. Process for preparing protein from Brewery Waste.
Приложение 1
Экономические расчеты


Приложение 2
Технологическая инструкция (ТИ)

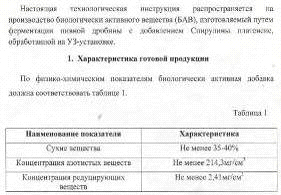



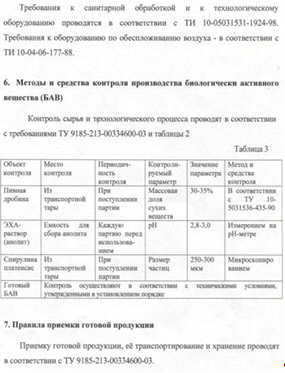

Приложение 3
Результаты физико-химических испытаний БАД
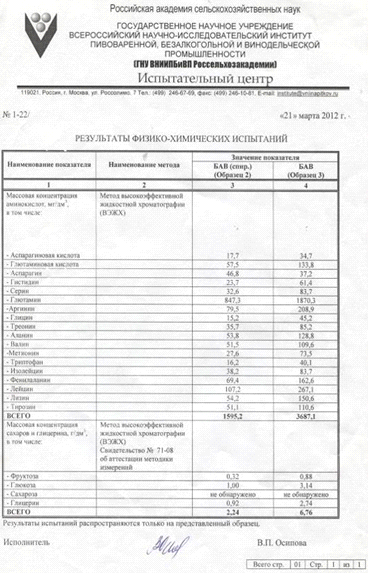

Акт испытаний
