Отримання губчастого титану магнієтермічним способом
РЕФЕРАТ
Курсова робота: с.30, табл. 10., 8
джерела.
Об’єкт дослідження - металургія
титану.
Предмет дослідження - хлорування
титану.
Мета роботи - проаналізувати основні
стадії переробки титанвмісної сировини та отримання губчастого титану.
У першому розділі описано
властивості, історія відкриття титану, технологічна схема переробки
ільменітового концентрату та отримання губчастого титану магнієтермічним
способом, області застосування титану і сплавів на його основі.
У другому розділі виконано
розрахунок складу шихти та зведений матеріальний баланс для одержання
титанового шлаку.
ТЕТРАХЛОРИД ТИТАНУ, ТИТАНОВА ГУБКА,
ТУГОПЛАВКІСТЬ, ТИТАНОВИЙ ШЛАК, ХЛОРУВАННЯ, ПРОДУКТИ ХЛОРУВАННЯ, МАТЕРІАЛЬНИЙ
БАЛАНС.
ВСТУП
У першому розділі розглядається таке
питання як теоретичні особливості вироблення титану, а саме: фізико-хімічні
властивості та історія відкриття титану, основні області застосування,
технологічна схема отримання губчастого титану магнієтермічним способом,
теоретичні основи хлорування і технологія та обладнання для отримання
тетрахлориду титану.
Хлорування в кольоровій металургії -
технологічний процес нагріву матеріалів, що містять кольорові метали, в
атмосфері хлору, хлорвмісних газів або у присутності хлористих солей з метою
витягання і розділення кольорових металів.
У основі процесу лежить взаємодія
оксидів або сульфідів металів з хлором або хлоридом водню по оборотних
реакціях. Оксиди, у яких гиббсова енергія цих реакцій має великі негативні
значення (PbO, ZnO, Ag2O та ін.), хлоруються при малих концентраціях хлору в
газовому середовищі і у присутності кисню; оксиди з великими позитивними
значеннями гиббсовой енергії (SiO2, TiO2, Al2O3) практично не взаємодіють з
газоподібним хлором, оскільки навіть сліди кисню в газовому середовищі
перешкоджають утворенню хлоридів. Хлорування оксидів полегшується у присутності
речовин, що зв'язують вільний кисень і зменшують його концентрацію в газовій
фазі, наприклад вуглецю, водню, сірчистого ангідриду. В якості хлоруючих
агентів, окрім елементарного хлору і HCl, застосовують дешеві солі - кам'яну
сіль (NaCl), сильвініт, хлорид кальцію (CaCl2 ) та інші.
У другому розділі виконано
розрахунок матеріального балансу руднотермічної відновної плавки ільменітового
концентрату з одержанням титанового шлаку й чавуна.
1. ВИРОБНИЦТВО ГУБЧАСТОГО ТИТАНУ
1.1 Фізико-хімічні
властивості титану. Історія відкриття
Титан був відкритий в 1791 р.
англійським мінералогом У. Грегором, а в металевому вигляді добутий лише в 1910
р. Проте практичне використання розпочалося лише в 40-х роках з появою
технологій, які забезпечували на стадії виробництва ефективний захист титану
від взаємодії з воднем, киснем та азотом. Температура плавлення титану - 1668
оС, кипіння - 3300 оС. Питома густина 4,5 г/см3. Титан має дві алотропні
модифікації: низькотемпературний титан (щільно упакована гексагональна ґратка з
параметрами а = 0,29 нм, с = 0,467 нм.) і високотемпературний (882 оС) -
бета-титан (об’ємно центрована кубічна ґратка з параметром 0,331 нм). Механічна
міцність титану приблизно вдвічі більша за чисте залізо i в 6 разів перевищує
міцність алюмінію. Титан сприятливо поєднує високу механічну міцність,
корозійну стійкість, жароміцність i порівняно малу густину. Питома міцність
(відношення міцності до густини) кращих титанових сплавів досягає 30...35 i
більше, що майже вдвічі перевищує питому міцність легованих сталей. Такі
властивості зумовлюють особливий інтерес до титану як матеріалу для літако- та
ракетобудування. Сплави на основі титану все більше використовуються при
будівництві морських суден, автомобільного та залізничного транспорту.
Підвищена корозійна стійкість
зумовлює використання титану та його сплавів у хімічному та металургійному
машинобудуванні, при виготовленні медичних приладів та в інших галузях техніки.
Діоксид титану ТіО2 застосовують для виготовлення титанових білил i емалей, які
вигідно відрізняються високою корозійною стійкістю та теплостійкістю.
числа відомих мінералів титану
головне промислове значення мають два: рутил - природний діоксид титану ТіО2 та
ільменіт FeTiO2, який входить до складу титаномагнієвих залізних руд. До
перспективних руд належать також офен CaO·TіO2·SiO2 та перовскіт CaO·TіO2.
Відкриття TiO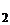 зробили
практично одночасно і незалежно один від одного англієць У. Грегор і німецький
хімік М. Г. Клапрот
<#"809959.files/image002.gif">.
зробили
практично одночасно і незалежно один від одного англієць У. Грегор і німецький
хімік М. Г. Клапрот
<#"809959.files/image002.gif">.
Метал отримав свою назву на
честь титанів
<#"809959.files/image003.jpg">
Рисунок 1.1 - Технологічна
схема отримання губчастого титану магнієтермічним способом
Титан випускають у вигляді
губки або злитків, які потім на інших заводах переробляють на лист, профілі,
труби, поковки та інші напівфабрикати. Технологічна схема виробництва
складається з шести основних переділів.
. Відновлювальна плавка
ільменітових концентратів в руднотермической печі. Продуктами плавки є чавун і
титанвмісткі шлаки, які після відповідної підготовки надходять на наступний
переділ.
. Хлорування титанових
шлаків і очищення при цьому одержуваного чотирихлористого титану. Хлор для
хлорування шлаків надходить у вигляді анодного газу з магнієвих електролізерів.
. Відновлення тетрахлориду
титану магнієм. При цьому утворюється реакційна маса (~ 60% Ti, 15% MgCl2 і 25%
Mg) і хлористий магній, який відокремлюється протягом всього процесу. Останній
надходить у цех електролізу для виробництва магнію і хлору, а реакційна маса
надходить на наступний переділ.
. Вакуумна сепарація.
Титанову губку відокремлюють від магнію та хлористого магнію. Магній повертають
на відновлення, хлористий магній - в електроліз або разом з магнієм в наступний
процес, блок титанової губки надходить на наступний переділ.
. Дроблення, оброблення на
певні сорти і фракції сортуванням титанової губки.
. Плавка злитків в
електродугових печах.
Титанова губка в чистому
вигляді або змішана з легуючими добавками переплавляється на злитки.
.4 Теоретичні основи процесу хлорування
Хлорування в кольоровій
металургії - технологічний процес нагріву матеріалів, що містять кольорові
метали, в атмосфері хлору, хлорвмісних газів або у присутності хлористих солей
з метою витягання і розділення кольорових металів.
У основі процесу лежить
взаємодія оксидів або сульфідів металів з хлором або хлоридом водню по
оборотних реакціях. Оксиди, у яких гиббсова енергія цих реакцій має великі
негативні значення (PbO, ZnO, Ag2O та ін.), хлоруються при малих концентраціях
хлору в газовому середовищі і у присутності кисню; оксиди з великими
позитивними значеннями гиббсовой енергії (SiO2, TiO2, Al2O3) практично не
взаємодіють з газоподібним хлором, оскільки навіть сліди кисню в газовому
середовищі перешкоджають утворенню хлоридів. Хлорування оксидів полегшується у
присутності речовин, що зв'язують вільний кисень і зменшують його концентрацію
в газовій фазі, наприклад вуглецю, водню, сірчистого ангідриду. Таким чином,
змінюючи склад газової фази і температуру процесу, можна підібрати умови
селективного хлорування; зокрема, у присутності кисню і пари води можна
прохлорировать ряд кольорових металів, залишивши в окисленій формі залізо, а у
відновній атмосфері перевести у форму хлоридів оксиди заліза. В якості
хлоруючих агентів, окрім елементарного хлору і HCl, застосовують дешеві солі -
кам'яну сіль (NaCl), сильвініт, хлорид кальцію (CaCl2 ) та ін. При цьому Х.,
особливо при використанні малолеткого CaCl2 , йде переважно через розкладання
солі парами води з утворенням HCl; розкладанню соли-хлоринатора сприяє
присутність SO2 або SO2 , CaSO4 , що утворюють, CaSiO3 і тому подібне.
Різновиди хлорування :
хлоруюче випалення, хлоридовозгонка і сегрегація. Хлоруюче випалення проводять
при відносно низькій температурі, при якій хлориди, що утворюються, ще
нелетучи. Х. здійснюють в електропечах, печах киплячого шару, трубчастих або
багаточереневих обпалювальних печах. Процес застосовується у виробництві магнію
для перекладу окислу магнію в хлорид, який потім піддають електролізу, а також
для витягання кобальту і міді з бідних матеріалів, найчастіше з піритових
огарків і кобальт-никелевых штейнов; кобальт, мідь, цинк переходять у форму
хлоридів і вилуговуються водою або слабкою кислотою, а залізо не хлорується і
залишається у формі оксидів в твердому залишку.
Хлоридовозгонка, на відміну
від хлоруючого випалення, ведеться при більш високих температурах, що
забезпечують звітрювання хлоридів металів; процес більше універсальний:
дозволяє витягати більше різних кольорових і рідкісних металів, а також золото
і срібло. Сегрегація, на відміну від хлоридовозгонки, вимагає меншої витрати
хлоринаторов і ведеться при нижчій температурі, але для отримання концентрату
потрібна додаткова операція - флотація або магнітна сепарація.
Хлорування застосовується
також для рафінування розплавлених металів від домішок: алюмінію - від натрію і
кальцію, свинцю - від цинку, олова - від свинцю. Розробляються процеси
видалення міді і кобальту з нікелевого файнштейна хлоридными розплавами.
1.5
Технологія та обладнання для отримання тетрахлориду титана
Отримання тетрахлориду титана
TiCl4 здійснюють дією газоподібного хлору на TiO2 при температурах 700-900 °C,
при цьому протікає реакція: TiO2 + 2Cl2 + 2С = TiCl4 + 2СО. Початковою
титаносодержащим сировиною при цьому є титановий шлак. Хлорування здійснюють в
шахтних хлораторах безперервної дії або в сольових хлораторах. Шахтний хлоратор
- це футерований циліндр діаметром до 2 і заввишки до 10 м, в який згори
завантажують брикети з подрібненого титанового шлаку і знизу вдувають газ
магнієвих електролізерів, що містить 65-70 %% Cl2. Взаємодія TiO2 брикетів і
хлору йде з виділенням тепла, що забезпечує необхідні для процесу температури
(~ 950 °C в зоні реагування). Що утворюється в хлораторі газоподібний TiCl4
відводять через верх, залишок шлаку від хлорування безперервно вивантажують
знизу. Сольовий хлоратор для виробництва титану є футерованою шамотом камерою,
наполовину заповненою відпрацьованим електролітом магнієвих електролізерів, що
містить хлориди калію, натрію, магнію і кальцію. Згори в розплав завантажують
подрібнені титановий шлак і кокс, а знизу вдувають хлор. Температура 800-850
°З, необхідна для інтенсивного протікання хлорування титанового шлаку в
розплаві, забезпечується за рахунок тепла протікаючих екзотермічних реакцій
хлорування. Газоподібний TiCl4 з верху хлоратора відводять на очищення від
домішок, відпрацьований електроліт періодично замінюють. Основна перевага
сольових хлораторів полягає в тому, що не потрібно дороге брикетування шихти.
Що відводиться з хлораторів газоподібний TiCl4 містить пил і домішки газів -
CO, СO2 і різні хлориди, тому його піддають складному очищенню, що проводиться
в декілька стадій.
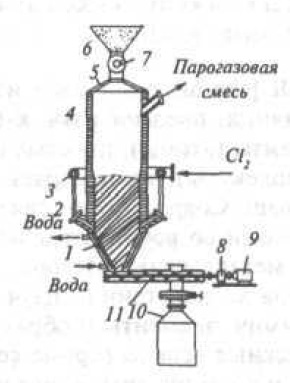
Рис 1. Схема шахтного
хлоратора безперервної дії : 1 - водоохолоджуваний конус; 2 - фурма; 3 -
хлорний колектор; 4 - корпус хлоратора; 5 - водоохолоджуване зведення; 6 -
бункер; 7 - золотниковий живильник; 8 - редуктор; 9 - електродвигун; 10 -
збірка огарка; 11 - розвантажувальний шнек.
Шахта хлоратора (внутрішній
діаметр 1,8 м, висота 10 м) футерована динасним і щільною шамотною цеглиною.
Брикети подають з бункера через золотник, живильник, залишок вивантажують
шнеком. Фурми подання хлору розташовуються на висоті близько 2 м від місця
вивантаження залишку. Хлорування йде при 900-1000 °Із за рахунок теплоти
реакцій; питома продуктивність 1,8 - 2 тонни TiCl4 /сут. на 1 м об'єму
хлоратора; хлоратор з сольовим розплавом (конструкція і спосіб хлорування
розроблені в Росії). У шахту хлоратора заливають сольовий розплав, наприклад,
відпрацьований електроліт Mg- електролізерів. Розмолоту шихту подають на
дзеркало розплаву, хлор - фурмами в нижню частину хлоратора.
2. МАТЕРІАЛЬНИЙ БАЛАНС
ОДЕРЖАННЯ ТИТАНОВИХ ШЛАКІВ
.1 Розрахунок складу шихти для плавки
Відновлюваній електроплавці
піддається шихта, що складається з концентрату і твердого відновника
(антрациту).
Розрахунок матеріального
балансу плавки ільменітового концентрату виконаний за методикою [3], в основу
якого покладений принцип розподілу складових концентрату по продуктах плавки. У
тому випадку, коли ці дані точно відомі, тобто дані по знятих матеріальних
балансах, вони дають невеликі похибки по складу шлаку й чавуні.
У дійсному розрахунку
прийнятий принцип, заснований на конкретно заданому змісті FeO у шлаку,
наприклад, 5 % [2], що дозволяє уникнути відзначених недоліків.
Склад концентрату
(Малишевського), що надходить на плавку, приведений у таблиці 1.1.
Таблиця 2.1 - Хімічний склад
концентрату, %
|
Компоненти
|
TiO2
|
Fe2O3
|
FeO
|
SiO2
|
Al2O3
|
MgO
|
MnO
|
V2O5
|
Cr2O3
|
P2O5
|
CaO
|
|
Вміст
|
49,4
|
17,00
|
25,3
|
2,63
|
1,5
|
0,45
|
1,14
|
0,12
|
0,2
|
0,26
|
2
|
Склад антрациту приведений у таблиці
1.2.
Таблиця 2.2 - Склад антрациту, %
|
Компоненти
|
C
|
H2O
|
Летучі (CH4)
|
Зола
|
|
Вміст
|
88,00
|
1,50
|
2,50
|
8,00
|
Зола антрациту містить, %: 35,0
Fe2O3; 45,0 SiO2; 20,0 Al2O3.
Розрахунок матеріального балансу
проводимо на 1000 кг концентрату. Діоксид титану відновлюється до Ti3O5, оксиди
алюмінію, магнію, кальцію цілком переходять у шлак, інші елементи -
відновлюються, %: до 7,5 SiO2; до 21,0 Cr2O3; до 30,0 V2O5; до 6,0 MnO; до 46,0
P2O5 та усі переходять у чавун, інше - у шлак. Сірка елементарна переходить у
чавун 15 %, у пил газів, що відходять - 2,6 %, механічні витрати - 2,5 %, інше
переходить у шлак.
На підставі досліджень [2] перехід
титану в чавун складає 0,01 - 0,06 %; утрати з пилом газів, що відходять - 2,3
- 5,45 %; механічні втрати й нев’язання балансу 2,15 - 3,7 %. При розрахунку
матеріального балансу приймаємо, %: 0,05; 2,6; 2,5.
Склад пилу газів, що відходять, і
механічні утрати відповідають складу концентрату.
Таким чином, кількість пилу
дорівнює:
(1000 ×
2,6) / 100 = 26 кг.
механічні втрати
(1000 ×
2,5) / 100 = 25 кг.
Склад компонентів пилу газів, що
відходять, і механічні утрати пропорційний їхній кількості в концентраті:(26 ×
49,4) / 100 = 12,844 кг і т.д.
Результати розрахунку приведені в
таблиці 1.3.
Таблиця 2.3 - Кількість і склад пилу
газів, що відходять та механічні втрати, кг
|
Сполука
|
Пил газів
|
Механічні втрати
|
Сума
|
На плавку
|
|
TiO2
|
12,844
|
12,35
|
25,194
|
468,806
|
|
Fe2O3
|
4,42
|
4,25
|
8,67
|
165,75
|
|
SiO2
|
0,683
|
0,658
|
1,342
|
24,959
|
|
Al2O3
|
0,39
|
0,375
|
0,765
|
14,235
|
|
MgO
|
0,117
|
0,112
|
0,229
|
4,271
|
|
Cr2O3
|
0,052
|
0,05
|
0,102
|
1,898
|
|
MnO
|
0,296
|
0,285
|
0,582
|
10,819
|
|
V2O5
|
0,031
|
0,03
|
0,061
|
1,139
|
|
P2O5
|
0,067
|
0,065
|
0,132
|
2,468
|
|
FeO
|
6,578
|
6,325
|
12,903
|
240,097
|
|
CaO
|
0,52
|
0,5
|
1,02
|
18,98
|
|
Разом:
|
26,000
|
25,00
|
51,00
|
949,00
|
У процесі плавки беруть участь
компоненти концентрату, кг:: 494 - 25,194 = 468,806;O3: 170 - 4,25 = 165,75;:
26,3 - 1,341 = 24,959;O3: 15 - 0,765 = 14,235;: 4,5 - 0,229 = 4,271;O3: 2 -
0,102 = 1,819;: 11,4 - 0,581 = 10,819;O5: 1,2 - 0,061 = 1,139;O5: 2,6 - 0,132 =
2,468;: 253 - 12,903 = 240,097;
СаО: 20
- 1,02 = 18,98;
Разом: 1000 - 51 = 949.
При руднотермічній плавці Fe2O3
відновлюється до FeO:
|
Fe2O3
|
+ C
|
= 2 FeO
|
+ CO
|
(1.1)
|
|
160
|
12
|
144
|
28
|
|
|
165,75
|
а
|
б
|
в
|
|
|
а = 12,431;
|
б = 149,175;
|
в = 29,006 кг.
|
|
|
При плавці шлаку протікають реакції:
|
TiO2
|
+
|
2 C
|
=
|
Ti
|
+
|
2 CO
|
(1.2)
|
|
MnO
|
+
|
2 C
|
=
|
Mn
|
+
|
2 CO
|
(1.3)
|
|
SiO2
|
+
|
2 C
|
=
|
Si
|
+
|
2 CO
|
(1.4)
|
|
V2O5
|
+
|
5 C
|
=
|
V
|
+
|
5 CO
|
(1.5)
|
|
3TiO2
|
+
|
C
|
=
|
Ti3O5
|
+
|
CO
|
(1.6)
|
|
Cr2O3
|
+
|
3C
|
=
|
2Cr
|
+
|
3CO
|
(1.7)
|
|
FeO
|
+
|
C
|
=
|
Fe
|
+
|
CO
|
(1.8)
|
|
Fe2O3
|
+
|
3C
|
=
|
2Fe
|
+
|
3CO
|
(1.9)
|
Кількість компонентів, що вступають
у хімічні реакції (1.2), (1.3), (1.4), (1.5), (1.7), кг:(468,806 ×
0,05) / 100 = 0,234;(10,819 ×
6) / 100 = 0,649;(24,959 ×
7,5) /100 = 0,187;O5 (1,139 ×
30) / 100 = 0,342;O3 (1,898 · 21) / 100 = 0,399;O5 (2,468 ∙ 46) / 100 =
1,135
Визначаємо витрату вуглецю й
кількість одержуваних продуктів по реакції (1.2):
+ 2C = Ti + 2CO
24 48
56
,234
а б в
а = 0,07 кг С; б = 0,14 кг Ti; в
= 0,16 кг СО.
Вступить у реакцію (1.2) 468,806 -
0,234 = 468,572.
По реакції (1.3):
+ C = Mn + CO
12
55 28
,649 а б
в
а = 0,11 кг С; б = 0,502 кг Mn; в =
0,256 кг СО.
У шлак перейде 10,819 - 0,649 =
10,17 кг MnO.
По реакції (1.4):
+ 2C = Si + 2CO
24
28 56
,871 а б
в
а = 0,748 кг С; б = 0,873 кг Si; в
= 1,746 кг СО.
У шлак перейде 24,959 - 1,871 =
23,088 кг SiO2.
По реакції (1.5):
O5 + 5C = 2V = 5CO
60
102 140
,342 а б
в
а = 0,113 кг С; б = 0,192 кг V; в
= 0,263 кг CO.
У шлак перейде 1,139 - 0,342 = 0,797
кг V2O5.
По реакції (1.6):
TiO2 + С = Ti3O5 + CO
12
224 28
,806 а б в
а = 23,44 кг С; б = 437,552 кг
Ti3O5; в = 54,694 кг СО.
По реакції (1.7):
O3 + 3C = 2Cr + 3CO
36
104 84
,399 а б в
а = 0,095 кг С; б = 0,273 кг Cr; в
= 0,22 кг СО.
У шлак перейде 1,898 - 0,399 = 1,499
кг Cr2O3.
По реакції (1.8)
O5 + 5С = 2Р + 5СО
50 62 140
,135 а б в
а = 1,621кг С; б = 1,675 кг Р; в
= 3,783 кг СО.
У шлак перейде 2,468 - 1,135 = 1,333
кг P2O5.
У шлаку залишається, кг: 14,235
Al2O3; 4,271 кг MgO; 18,98 СаО.
Таким чином, склад шлаку, кг:
,55 Ti3O5; 23,088 SiO2; 14,235
Al2O3; 4,271 MgO; 1,499 Cr2O3; 10,17 MnO; 0,797 V2O5; 1,333 P2O5; 18,98 СаО
Разом: 511,779 кг.
Якщо плавку проводити до одержання в
шлаку 5 % FeO, то його кількість складе:(511,799 ∙ 5) / 95 = 26,936 кг.
Кількість FeO, що вступає в реакцію
(1.8):
,272 - 26,936 = 362,336 кг.
+ C = Fe + CO
титан сплав хлорування
плавка
72 12 56
28
,336 а б в
а = 60,389 кг С; б = 281,817 кг Fe;
в = 140,908 кг СО.
Кількість компонентів чавуна, кг:
0,14 Ti; 0,502 Mn; 0,873 Si; 0,192 V; 0,273 Cr; 282,594 Fe.
Разом: 286,249 кг.
Зміст вуглецю в чавуні складає 2%:
(286,249 ∙ 0,02) / 0,98 =
5,842 кг.
Загальна витрата вуглецю складає:
,431 + 0,07 + 0,11 +0,748 + 0,113 +
23,44 + 0,095 + 1,621 + 60,389 + 5,842 = 104,869 кг.
Визначаємо кількість активного
вуглецю в 100 кг антрациту.
Оксид Fe2O3 золи антрациту цілком
відновлюється до металу, Al2O3 цілком переходить у шлак, SiO2 на 75%
відновлюється до кремнію і переходить у чавун.
По реакції (1.9):
O3 + 3С = 2Fe + 3CO
36
112 84
,0 ∙ 0,35 = 2,80 а б в
а = 0,630 кг С; б = 1,960 кг Fe; в =
1,470 кг СО.
По реакції (1.4):
+ 2С = Si + 2CO
24
28 56
,0 ∙ 0,45 ∙ 0,75 = 2,70
а б в
а = 1,080 кг С; б = 1,260 Si; в =
2,520 CO.
Загальна витрата вуглецю на
відновлення складових золи:
,630 + 1,080 = 1,710 кг.
У 100 кг антрациту залишається
активного вуглецю
,0 - 1,710 = 86,290 кг.
Таким чином, для відновлення
концентрату необхідно антрациту:
,869 / 0,8629 = 121,531 кг.
З обліком пиловиносу антрациту 1,43
% [13] витрата його складе:
,531 / 0,9857 = 123,294 кг.
Пиловинос антрациту складе 123,294 -
121,531 = 1,766 кг,
у ньому: 1,766 ∙ 0,880 = 1,554
кг С;
,766 ∙ 0,025 = 0,044 кг
летучих;
,766 ∙ 0,015 = 0,026 кг
вологи;
,766 ∙ 0,080 = 0,141 кг золи.
В антрациті міститься
,294 ∙ 0,880 = 108,499 кг С;
,294 ∙ 0,025 = 3,082 кг
летучих;
,294 ∙ 0,015 = 1,849 кг
вологи;
,294 ∙ 0,080 = 9,864 кг золи.
Пішло на реакції:
,499 - 1,554 = 106,945 кг С;
,082 - 0,044 = 3,038 кг летучих;
,848 - 0,026 = 1,824 кг вологи;
,864 - 0,141 = 9,723 кг золи.
У 8,137 кг золи міститься;
,723 ∙ 0,35 = 3,403кг Fe2O3;
,723 ∙ 0,45 = 4,375 кг SiO2;
,723 ∙ 0,2 = 1,945 кг Al2O3.
Кількість SiO2 золи антрациту по
реакції (1.4):
,375 ∙ 0,75 = 3,281 кг.
Перейшло в шлак 4,375 -3,281 = 1,095
кг.
Утвориться Si (3,281 ∙ 28) /
60 = 1,531 кг;
СО (3,281 ∙ 56) / 60 = 3,062
кг.
По реакції (1.8) утвориться:(3,403∙
112) / 60 = 6,352 кг;
СО (3,403∙ 84) / 160 = 1,787
кг.
СН4 + 1,5 О2 = СО + 2 Н2О (1.10)
48 28 36
,043 а б в
а = 9,129 кг О2; б = 5,325 кг СО; в
= 6,847 кг Н2О.
Кількість і склад товарного чавуну
приведений у таблиці 1.4.
Витрату електродів приймаємо рівним
25 кг на 1 т шлаку. Отже, витрата електродів на процес складе:
,922 ∙ 0,025 = 13,048 кг.
Таблиця 2.4 - Кількість і склад
товарного чавуна
|
Елемент
|
кг
|
%
|
|
Ti
|
0,14
|
0,047
|
|
Mn
|
0,502
|
0,168
|
|
Si
|
0,873 + 1,534 = 2,407
|
0,806
|
|
V
|
0,192
|
0,064
|
|
Cr
|
0,273
|
0,091
|
|
Fe
|
282,594 + 6,362 = 288,956
|
96,738
|
|
C
|
5,842
|
1,956
|
|
Разом:
|
298,699
|
100,000
|
Кількість і склад шлаку приведені у
таблиці 1.5
Таблиця 2.5 - Кількість і склад
шлаку
|
Сполуки
|
кг
|
%
|
|
Ti3O5
|
437,55
|
83,834
|
|
MnO
|
10,17
|
1,949
|
|
SiO2
|
23,088 + 1,095 = 24,183
|
4,633
|
|
V2O5
|
0,797
|
0,153
|
|
Al2O3
|
14,235 + 1,947 = 16,182
|
3,1
|
|
MgO
|
4,271
|
0,818
|
|
Cr2O3
|
1,499
|
0,287
|
|
FeO
|
25,937
|
0,255
|
|
СаО
|
18,98
|
0,195
|
|
P2O5
|
1,333
|
4,969
|
|
Разом:
|
521,922
|
100,000
|
Вуглець електрода згоряє по реакції
(1.11):
C + O2 = 2 CO
(1.11)
32 56
,048 а б
а = 17,397 кг O2; б = 30,445 кг С.
Витрата кисню на реакцію (1.11):
,129 + 17,397 = 26,526 кг.
З киснем повітря надходить в азот
(26,526 ∙ 77) / 23 = 88 кг,
де 77 і 23 - склад повітря (азот і
кисень).
Витрата повітря:
,526 + 88 = 114,526 кг.
Склад газів:
СО = 29,006 + 0,16 + 0,256 + 1,746 +
0,263 + 54,694 + 0,22 + 3,783 + 141,297 + +3,068 + 2,386 + 5,325 + 30,445 =
272,049 кг.
Н2О = 1,852 + 6,847 = 8,699 кг.
N2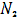 = 88 кг.
= 88 кг.
Усього: 369,348 кг.
За результатами розрахунку
складаємо матеріальний баланс плавки ільменітових концентратів у таблиці 1.6
Таблиця 2.6 - Матеріальний
баланс плавки ільменітового концентрату
|
Завантажено
|
Отримано
|
|
Продукт
|
кг
|
Продукт
|
кг
|
|
1
|
2
|
3
|
4
|
|
Концентрат, у т.ч.:
|
1000
|
Шлак, у т.ч.:
|
521,92
|
|
TiO2
|
494,000
|
Ti3O5
|
437,55
|
|
Fe2О3
|
170,000
|
MnO
|
10,17
|
|
FeO
|
253,000
|
SiO2
|
24,183
|
|
SiO2
|
26,300
|
V2O5
|
0,797
|
|
Al2О3
|
15,000
|
Al2О3
|
16,182
|
|
MgO
|
4,500
|
MgO
|
4,271
|
|
Cr2O3
|
2,000
|
Cr2O3
|
1,499
|
|
MnO
|
11,400
|
FeO
|
25,937
|
|
V2O5
|
1,200
|
СаО
|
18,98
|
|
P2O5
|
2,600
|
P2O5
|
1,333
|
|
СаО
|
20,000
|
|
|
|
Антрацит, у т.ч.:
|
123,294
|
Чавун, у т.ч.:
|
298,99
|
|
C
|
108,499
|
Ti
|
0,14
|
|
Летючі
|
3,082
|
Mn
|
0,502
|
|
H2O
|
1,849
|
Si
|
2,407
|
|
Зола
|
9,864
|
V
|
0,192
|
|
Електроди
|
13,048
|
Cr
|
0,273
|
|
Повітря, у т.ч.:
|
114,526
|
Fe
|
288,956
|
|
О2
|
26,526
|
C
|
5,842
|
|
N2
|
88
|
Пил газів, у т.ч.:
|
27,765
|
|
|
TiO2
|
12,844
|
|
|
Fe2О3
|
4,42
|
|
|
SiO2
|
0,683
|
|
|
Al2О3
|
0,39
|
|
|
MgO
|
0,117
|
|
|
Cr2O3
|
0,052
|
|
|
MnO
|
0,296
|
|
|
V2O5
|
0,031
|
|
|
P2O5
|
0,067
|
|
|
FeO
|
6,578
|
|
|
CaO
|
0,52
|
|
|
С
|
1,554
|
|
|
Летучі
|
0,044
|
|
|
Волога
|
0,026
|
|
|
Зола
|
0,141
|
|
|
Механічні утрати, у т.ч.:
|
25,000
|
|
|
TiO2
|
12,350
|
|
|
Fe2О3
|
4,250
|
|
|
SiO2
|
0,658
|
|
|
Al2О3
|
0,375
|
|
|
MgO
|
0,112
|
|
|
Cr2O3
|
0,05
|
|
|
MnO
|
0,285
|
|
|
V2O5
|
0,030
|
|
|
P2O5
|
0,065
|
|
|
FeO
|
6,325
|
|
|
СаО
|
0,500
|
|
|
Гази, у т.ч.:
|
369,348
|
|
|
CO
|
272,049
|
|
|
H2O
|
8,699
|
|
Разом
|
1250,9
|
N2
|
88
|
|
|
Разом
|
1243,023
|
|
|
Нев’язання
|
7,277
|
Нев'язання балансу складає +0,38 %,
що допускається при розрахунках.
При контакті шлаку з повітрям
після випуску з печі відбувається окислювання Ti3O5 до TiO2 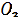 по реакції
(1.12):
по реакції
(1.12):
Ті3О5 + 0,5 О2 = 3 TiО2
(1.12)
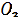 224 16 240
224 16 240
,55 а б
а = 31,254 кг О2; б = 468,804
кг TiО2.
Товарний шлак має склад, що
представлений у таблиці 2.7.
Таблиця 2.7 - Кількість і
склад товарного шлаку
|
Сполука
|
кг
|
%
|
|
TiО2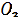 468,804 468,804
|
86,628
|
|
|
MnO
|
10,17
|
0,419
|
|
SiO2
|
24,183
|
4,405
|
|
V2O5
|
0,797
|
0,395
|
|
Al2О3
|
16,182
|
2,038
|
|
MgO
|
4,271
|
0,297
|
|
Cr2O3
|
1,499
|
0,352
|
|
P2O5
|
1,333
|
0,241
|
|
FeO
|
25,937
|
4,691
|
|
СаО
|
18,98
|
0,195
|
|
Разом:
|
553,176
|
100,000
|
Матеріальний баланс окислювання
шлаку при обробленні наданий у таблиці 2.8.
Таблиця 2.8 - Матеріальний баланс
окислювання шлаку при обробленні
|
Завантажено
|
Отримано
|
|
Продукт
|
кг
|
Продукт
|
кг
|
|
Шлак, у т.ч:
|
521,922
|
Шлак, у т.ч:
|
553,176
|
|
Ti3O5
|
437,55
|
TiO2
|
468,804
|
|
MnO
|
10,17
|
MnO
|
10,17
|
|
SiO2
|
24,183
|
SiO2
|
24,183
|
|
V2O5
|
0,797
|
V2O5
|
0,797
|
|
Al2O3
|
16,182
|
Al2O3
|
16,182
|
|
MgO
|
4,271
|
MgO
|
4,271
|
|
Cr2O3
|
1,499
|
Cr2O3
|
1,499
|
|
FeO
|
25,937
|
FeО
|
25,937
|
|
P2O5
|
1,333
|
P2O5
|
1,333
|
|
СаО
|
18,98
|
СаО
|
18,98
|
|
Кисень повітря
|
31,254
|
|
|
|
Разом:
|
Разом:
|
553,176
|
2.2
Зведений матеріальний баланс одержання титанового шлаку
На основі даних, наданих у таблицях
1.6, 1.7, 1.8, представляємо зведений матеріальний баланс одержання титанового
шлаку в таблиці 1.9.
Таблиця 2.9 - Зведений матеріальний
баланс одержання титанистих шлаків.
|
Завантажено
|
Отримано
|
|
Продукт
|
кг
|
Продукт
|
кг
|
|
Концентрат
|
1000,0000
|
Шлак
|
553,176
|
|
Антрацит
|
123,294
|
Чавун
|
298,99
|
|
Електроди
|
13,048
|
Гази
|
369,348
|
|
Повітря
|
145,78
|
Пил газів
|
27,765
|
|
|
Механічні утрати
|
25,000
|
|
Разом:
|
1282,122
|
Разом:
|
1248,637
|
|
|
|
|
|
|
|
Нев’язання складає: (1282,122 ∙
100) / 1248,637 = 102,681, тобто 2,681 %, що цілком припустимо при ручному
рахуванні (припускаючи округлення).
2.3 Витрата
сировини, матеріалів на 1 т ільменітового концентрату та 1 т титанистого шлаку
Витрата сировини, матеріалів на 1 т
(1000 кг) ільменітового концентрату шлаку знаходимо з таблиці 1.9.
Витрата сировини й матеріалів на 1 т
(1000 кг) титанистого шлаку визначаємо у відповідності з формулою:
Х = (А ∙ Б) / У,
де А - кількість сировини чи
матеріалу, що витрачається на 1 т концентрату, таблиця 1.9;
Б - кількість шлаку, 1 т;
В - кількість шлаку, що утвориться з
1 т шлаку, таблиця 1.9.
На 1 т шлаку витрата концентрату й
матеріалів складає:
(1∙1) / 0,553176 = 1,808 т;
антрациту - (0,123294 ∙ 1) /
0,553176 = 0,223 т;
електродів - (0,015041 ∙ 1) /
0,553176 = 0,024 т;
повітря - (0,157241 ∙ 1) /
0,553176 = 0,264 т.
Утвориться:
пилу - (0,027765∙ 1) /
0,553176 = 0,050 т;
механічні втрати (у виді пилу)
(0,025 ∙ 1) / 0,553176 = 0,045
т;
газів - (0,369348 ∙ 1) /
0,553176 = 0,668 т.
Результати розрахунку представляємо
у зведеній таблиці 1.10.
Таблиця 2.10 - Витрата сировини та
матеріалів на 1 т концентрату, а також продуктів, що утворяться на 1 т шлаку
|
На 1 т концентрату, т
|
На 1 т шлаку, т
|
|
Антрацита
|
0,123294
|
Концентрату
|
1,808
|
|
Електродів
|
0,013048
|
Антрацита
|
0,223
|
|
Повітря
|
0,14578
|
Повітря
|
0,264
|
|
|
Утвориться:
|
|
|
|
Газів
|
0,668
|
|
|
Пилу
|
0,050
|
|
|
Механічних утрат
|
0,045
|
ВИСНОВКИ
В першому розділі курсової роботи
було розглянуто: технологію виробництва титану, його фізико-хімічні властивості
та історію відкриття; основні області застосування титану та сплавів на його
основі; технологічну схему отримання губчатого титану магнієтермічним методом
та її опис; теоретичні основи хлорування і обладнання для отримання
тетрахлориду титану.
Титан - тугоплавкий метал.
Найважливішою особливістю титану як металу є його унікальні фізико-хімічні
властивості: низька щільність, висока міцність, твердість і ін.
Титан завдяки хорошому поєднанню
механічних і технологічних властивостей і високої корозійної стійкості
знаходить широке застосування в найрізноманітніших галузях промисловості:
авіакосмічної, хімічному і нафтовому машинобудуванні, чорної і кольорової
металургії, харчової промисловості і в інших галузях.
Титанове
виробництво засноване на переробці різних залізо титанових концентратів на
багаті діоксидом титану шлаки в руднотермічних електропечах. В результаті
рудновідновної плавки виходить титановий шлак і залізо близьке за складом до
чавуну.
У другому розділі курсової роботи
був проведений розрахунок матеріального балансу, до якого входило розрахунок
складу шихти для плавки, розрахунок зведеного матеріального балансу та витрати
сировини і матеріалів, у результаті отримано матеріальний баланс у кількості
1282,122 г.
На 1 т концентрату, т: 0,123294 антрациту,
0,013048електродів, 0,14578 повітря.
На 1 т шлаку, т: 1,808 концентрату;
0,223 антрациту; 0,264 повітря; 0,668 газів; 0,050 пилу; 0,045 механічних
утрат.
ПЕРЕЛІК ПОСИЛАНЬ
1
Тарасов, A.B. Металлургия титана [Текст] : учебное пособие для студен-тов /
A.B. Тарасов - М.: ИКЦ «Академкнига», 2003. - 328 с. - 400 экз.
Лебедєв,
В.В. Металургія рідкісних металів [Текст] : конспект лекцій / В.В. Лебедєв -
Запоріжжя : ЗДІА, 2006. - 100 с. - Бібліогр. : 98 . - 75 прим.
Байбеков,
М.К. Производство четырёххлористого титана [Текст] : пособие молодого рабочего
цветной металлургии / М.К. Байбеков, В.Д. Попов, И.М. Чеп-расов - 2-е изд.,
перераб. и доп. - М. : Металлургия, 1987. - 128 с. - 1900 экз.
Іващенко,
В.І. Металургія рідкісних металів [Текст] : навчальний посібник для студентів
ЗДІА спеціальності 7.090402 "Металургія кольорових металів" денної та
заочної форм навчання / Укл.: В.І. Іващенко, О.В. Іващенко, В.В. Лебедєв. -
Запоріжжя : ЗДІА, 2005. - 168 с. - 100 прим.
Надольский,
А.П. Расчёты процессов и аппаратов производства тугоплавких металлов [Текст] :
учебное пособие для студентов вузов / А.П. Надольский. - М. : Металлургия,
1980. - 128 с.
Иващенко,
В.И. Методические указания к практическим занятиям, курсовому и дипломному
проектированию по курсу "Металлургия тугоплавких редких металлов"
[Текст] / Сост. В.И. Иващенко. - Запорожье : ЗИИ, 1989. - 45 с.
Іващенко,
В.І. Металургія рідкісних металів : навчальний посібник для студентів ЗДІА
спеціальності 7.090402 "Металургія кольорових металів" денної та
заочної форм навчання / Укл.: В.І. Іващенко, О.В. Іващенко, В.В. Лебедєв. -
Запоріжжя : ЗДІА, 2005. - 168 с.
8 Гармата, В.А.
<http://lib.bittu.org.ru/CGI/irbis64r_91_opac/cgiirbis_64.exe?Z21ID=&I21DBN=SGTU&P21DBN=SGTU&S21STN=1&S21REF=&S21FMT=&C21COM=S&S21CNR=20&S21P01=0&S21P02=1&S21P03=A=&S21STR=%D0%93%D0%B0%D1%80%D0%BC%D0%B0%D1%82%D0%B0,%20%D0%92.%20%D0%90.>
<http://lib.bittu.org.ru/CGI/irbis64r_91_opac/cgiirbis_64.exe?Z21ID=&I21DBN=SGTU&P21DBN=SGTU&S21STN=1&S21REF=&S21FMT=&C21COM=S&S21CNR=20&S21P01=0&S21P02=0&S21P03=M=&S21STR=>Титан
: Свойства, сырьевая база, физико-химические основы и способы получения / В. А.
Гармата, А. Н. Петрунько, Н. В. Галицкий. - М. : Металлургия, 1983. - 559 с.