|
Характеристика
|
Платина
|
|
Порядковый
номер
|
78
|
|
Конфигурация
внешних электронных оболочек
|
5d96s1
|
|
Число
неспаренных электронов
|
2
|
|
Атомная
масса
|
195.09
|
|
Атомный
объем, см3
|
9.10
|
|
Эффективный
атомный радиус, нм
|
Pt
4 + =0.064
|
|
Потенциалы
ионизации, В
|
9.0;
18.56; (23.6)
|
|
Возможные
степени окисления
|
0,
II, III, IV, VI
|
|
Характерные
степени окисления
|
II,
IV
|
Будучи элементом переходного периода, платина
характеризуется различным степенями окисления. В большинстве своих соединений
платина проявляет степени окисления +2 и +4. С этими степенями окисления,
благодаря высоким зарядам, небольшим ионным радиусам и наличию незаполненных
d-орбиталей, она представляет собой типичный комплексообразователь. Так, в
растворах все его соединения, включая простые (галогениды, сульфаты, нитраты),
превращаются в комплексные, поскольку в комплексообразовании участвуют ионы
соединений, присутствующих в растворе, а также вода. Поэтому гидрометаллургия
платины основана на использовании ее комплексных соединений.
1.2 Электронная структура
Платина относится к «переходным» металлам
периодической системы, которые отличаются от остальных элементов
недостроенностью d- и f-уровней
электронной оболочки. При этом «бывшие» электроны недостроенных а- и f-уровней
изолированных атомов вместе с валентными электронами образуют
коллективизированную подсистему кристаллической решетки. Последнее определяет
большое разнообразие физико-химических свойств переходных металлов, причем
особое место здесь занимают металлы VIII
группы (в том числе и платиновые) расположенные в концах IV
и V периодов. Атомы
этих металлов характеризуются существенной локализацией d-электронов.
Если ряд Зd-элементов
завершается известными магнитноупорядоченными металлами-ферромагнетиками -
железом, кобальтом, никелем, то ряды 4d-и
5d-элементов -
благородными металлами (4d
- рутений, родий, палладий; 5d
- осмий, иридий, платина) характеризующимися повышенной коррозионной
стойкостью, жаропрочностью, особым комплексом физико-механических свойств. У
платины, так же как у осмия и иридия, застраивается 5d-оболочка
при наличии электронов во внешней 6s-оболочке.
Электронная конфигурация платины может быть
записана как 5d96s.
Как известно, форма и протяженность поверхности
Ферми определяют механические, технологические и электрические свойства
металлов. Электронные свойства оказывают решающее влияние на такие
характеристики, как электросопротивление, электропроводность, т.э.д.с,
верхпроводимость, фото-, термо- и вторичная эмиссии.
Наиболее полную информацию о свойствах металла
можно получить с помощью представлений о поверхности Ферми, ее форме, площади,
плотности состояний. Поверхность Ферми - это изоэнергетическая поверхность в
пространстве квазиимпульсов, отделяющая заполненные электронные состояния от
незаполненных . Форма и топологические особенности поверхности Ферми того или
иного металла определяются взаимодействием электронных волн с атомными
плоскостями кристалла (отражения Вульфа - Брэгга) и числом валентных
электронов. Экспериментальное построение поверхностей Ферми металлов основано
на изучении ряда физических свойств.
.3 Характеристика
Платина (лат. Platinum, обозначается символом
Pt) - химический элемент с атомным номером 78 и атомной массой 195,08. Является
элементом третьей триады (платиновые металлы) восьмой группы шестого
переходного периода периодической системы Дмитрия Ивановича Менделеева. Платина
- серовато-белый пластичный ковкий благородный металл. Семьдесят восьмой
элемент один из самых тяжелых (плотность 21,5 г\см3) и тугоплавких металлов, в
горячем состоянии хорошо прокатывается и сваривается. В природе платина
представлена следующими изотопами: 190Pt и 192Pt (эти изотопы являются слабо
радиоактивными); 194Pt (32,9 %), 196Pt (25,2 %), 198Pt (7,19 %). Существует
немало сведений о том, что самородная платина была известна с древнейших времен
народам, проживающим на различных континентах: от Южной Америки до Эфиопии.
В Европе сведений о платине не существовало
вплоть до XVI века, первым упомянул этот «весьма огнестойкий» металл
итальянский врач Скалингер в 1557 году. Исследовать платину ему позволили
находки испанских конкистадоров, обнаруживших в Южной Америке вместе с
самородным золотом очень тяжелый белый тусклый металл, который никак не
удавалось расплавить. За столь малую обрабатываемость и, как следствие, малую
пригодность испанцы нарекли новый металл platina, что является уменьшительным
производным от испанского наименования серебра - plata.
Если дословно перевести на русский язык, то мы
получим пренебрежительное название столь благородного металла - «серебришко».
Из Испании платина отправилась в Англию, но это произошло гораздо позднее -
лишь в 1748 году - когда морской офицер А. де Ульоа привез первые образцы Pt в
Лондон. Можно считать, что только с этого момента ученые Европы действительно
заинтересовались этим металлом, занявшись изучением его свойств. Примерно в это
же время платина признается самостоятельным металлом (ранее она считалась белым
золотом), а в 1803 году английский химик У. Волластон впервые получает платину
в чистом виде. Если в XVI веке испанцы вменяли в вину платине ее высокую
тугоплавкость, то современная промышленность широко использует это ее качество
в совокупности с высокой химической стойкостью при изготовлении лабораторной
посуды из этого металла: тигли, чашки, лодочки и прочие. В химической
промышленности семьдесят восьмой элемент применяется для изготовления
коррозионностойких деталей аппаратуры.
Широко применение этого благородного металла в
качестве катализатора (особенно при проведении окислительно-восстановительных
реакций), ведь платина представляет собой первый, известный еще с начала XIX
века гетерогенный катализатор. Платиновые аноды используются в ряде
электрохимических производств: надсерной кислоты, перхлоратов, перборатов. Из
платины изготовляют нагревательные элементы электрических печей и приборы для
измерения температуры (термопары, термометры сопротивления). Не стоит забывать
и о том, что платина один из драгоценных металлов, по этой причине она часто
употребляется ювелирами при изготовлении драгоценностей и аксессуаров.
Однако в наше время платину принято заменять
более дешевыми металлами, возможно вскоре семьдесят восьмой элемент перестанет
быть металлом ювелиров, так же как он когда-то перестал быть монетным металлом.
Четвертая часть от производимой платины расходуется на нужды электротехники,
автоматики, радиотехники и телемеханики. Ведь наиболее долговечные и стабильные
электроконтакты и сплавы для радиотехники именно из платины - ПлИ-10, ПлИ-20,
ПлИ-30 (платина-иридий). Платина применяется и как антикоррозионное покрытие -
платинирование. Соли платины употребляются в фотографии, для живописи по
фарфору и платинирования стекла; хлорная платина - важный реактив при
количественном анализе.
.4 Физические свойства
Металл поддается полировке; вследствие высокой
тягучести легко прокатывается в листы (платиновая жесть) и тончайшую проволоку.
По своим пластическим качествам этот благородный металл уступает лишь двум
другим - золоту и серебру, что усложняет его обработку в ювелирном деле в
отличие от вышеназванных металлов. В то же самое время примесь любого другого
платинового металла значительно снижает тягучесть семьдесят восьмого элемента.
Так платина, которая идет на продажу обычно содержит до 2 % иридия, такая
добавка делает ее более твердой и увеличивает способность противостоять
химическим воздействиям.
Платина, как и железо, легко сваривается при
проковке в накаленном состоянии, чем прежде исключительно пользовались для
получения сплошного металла из губчатой платины. Семьдесят восьмой элемент -
один из самых тяжелых металлов, его плотность при температуре 20 °C составляет
21,5 г/см3. Для сравнения свинец почти в два раза легче платины (плотность Pb
11,34 г/см3), железо почти в три раза легче (плотность Fe 7,87 г/см3) этого
благородного металла, а алюминий легче платины (плотность Al 2,70 г/см3) почти в
восемь раз! Даже такие «тяжеловесы» как золото (плотность Au 19,3 г/см3) и
тантал (плотность Ta 16,6 г/см3) уступают семьдесят восьмому элементу.
Неудивителен тот факт, что изначально «непригодная» платина привлекла внимание
именно фальшивомонетчиков и нечистых на руку ювелиров, ведь как заманчиво
сэкономить дорогое золото и серебро (плотность 10,5 г/см3), заменив их тяжелой
платиной.
Тугоплавкость платины известна с давних времен,
однако точно установить температуру плавления благородного металла не могли
долгое время, так температура плавления Pt по Девиллю составляет 2 000 °C, по
Виоллю 1 775 °C, при новейших исследованиях с помощью термоэлемента Ле-Шателье
эта температура составила 1 760 °C. Линейный коэффициент теплового расширения
для платины при 0 °C составляет 8,9∙10-6. Теплоемкость при 0 °C равна
0,0314 кал/(г∙°C) или 0,131 кДж/(кг∙К); теплопроводность - 0,17
кал/(см∙сек°C) или 71 вт/(м∙К).
Удельное электросопротивление при 0 °C для
платины составляет 9,81 Ом∙м∙10-8. Температурный коэффициент электросопротивления
в коридоре 0-100° C равен 39,23∙10-4. Модуль нормальной упругости платины
17330 кгс/мм2. Предел прочности при растяжении - 14,3 кгс/мм2. Относительное
удлинение при разрыве для платины составляет 31 %. Холодное деформирование
упрочняет платину, относительное удлинение уменьшается от 31 до 1-2 %, а
твердость по Виккерсу увеличивается до 90-95. Отжиг Pt приводит к
восстановлению ее пластичности. Кроме всего прочего платина проявляет свойства
парамагнетика. Характерным свойством платины является ее способность
абсорбировать на поверхности некоторые газы, особенно водород и кислород.
Склонность к абсорбции значительно возрастает у
металла, находящегося в мелкодисперсном и коллоидном состоянии. Платина
(особенно платиновая чернь) довольно активно поглощает кислород - сто объемов
кислорода на один объем платиновой черни. Вследствие способности к абсорбции
газов платину применяют в качестве катализаторов при реакциях гидрогенизации и
окисления.
.5 Технологические свойства
Способность металла к пластической деформации
определяется главным образом его чистотой (видом и содержанием примесей) и
структурой - величиной зерна, размером субзерен, состоянием границ зерен и
субзерен, а также средой, в которой производится деформация, ее скоростью и
температурным режимом.
Как известно, пластическая деформация в основном
осуществляется путем скольжения или двойникования либо тем и другим
одновременно. В г. ц. к. металлах преобладает первый вид деформации, причем
напряжения, действующие в плоскостях скольжения, вызывают в кристаллической
решетке сдвиги атомных слоев с наиболее плотной упаковкой, приводящие к
поворотам и искажениям в решетке.
Механизм деформации платины не отличается от
механизма деформации других металлов с г. ц. к. решеткой. Как и в указанных металлах,
скольжение происходит в основном по плоскостям (111) и (100), а
преимущественным направлением скольжения является [110]. Деформация
двойникованием в платине встречается относительно редко. Так, этот вид
деформации наблюдали при помощи автоионного микроскопа в слое платины толщиной
5∙10‾8 м, электролитически осажденной на вольфрамовое
острие при низких температурах (78 К). Двойникование проходило по плоскостям
(111), а сами двойники представляли собой тонкие пластинки (в отличие от
двойников роста). В большинстве случаев образование двойников объясняется
дефектами структуры, свойственными каждому осажденному металлу. После
пластической деформации при той же температуре в платине, осажденной на
иридиевую подложку, наблюдали двойники, следы скольжения и трещины,
образовавшиеся в процессе пластической деформации. И скольжение, и
двойникование проходили по одним и тем же плоскостям (111), что
свидетельствовало о том, что в платине при 78 К величины критических напряжений
сдвига и механического двойникования имели один и тот же порядок.
Платина - пластичный металл, деформация ее не
представляет трудностей и обычно проводится вхолодную, причем все виды
пластической деформации - протяжка проволоки (волочение), прокатка, вытяжка и
т. п. - осуществляются одинаково легко. Высокая пластичность сохраняется до
низких температур (около 196° С).
В процессе деформации металл наклёпывается. Так
твердость отожженной платины равна HV
40, после холодной деформации она повышается примерно до HV
100. Изучено влияние степени деформации при холодной прокатке на твердость
платины физической чистоты, частично и полностью отожженной перед пластической
деформацией. Твердость металла перед прокаткой составляла HV
63 и HV 36
соответственно. Отмечается, что в первом случае твердость с увеличением степени
деформации повышалась незначительно и лишь при обжатиях выше 60% начинала
заметно возрастать. Во втором случае наблюдалось резкое повышение этой
характеристики даже при небольших обжатиях. Максимальной степени деформации
(95%) соответствовали значения твердости HV
115 и HV 100. На
степень упрочнения после холодной деформации влияет также чистота металла.
Более свободная от примесей физически чистая
платина меньше наклёпывается в процессе прокатки даже при несколько большей
деформации.
Влияние технологии изготовления полуфабриката
проявляется не так резко, как влияние чистоты металла. Различие в свойствах
прутка и листа, по-видимому, связано с меньшей однородностью деформации и
соответственно большим наклепом металла при плоской прокатке по сравнению с
протяжкой и волочением.
Изделия из платины, так же как и из других
благородных металлов, изготовляют способом листовой прокатки, как правило, по
обычной технологии, без специальных технологических операций. Выбор схемы
прокатки определяется чистотой обрабатываемого металла, необходимыми размерами
готовых листов и полос, назначением изделий и техническими условиями на них.
Технологическая схема изготовления изделий листовой прокаткой состоит из
нескольких операций: обработки давлением, термической обработки и (если
требуется) химической обработки.
Листовую прокатку платины и ее сплавов обычно
проводят в холодном состоянии (за исключением сплавов и биметаллов с высоким
содержанием родия, иридия и других легирующих элементов) на двухвалковых прокатных
станах с диаметром валков от 220 до 420мм и длиной бочки от 280 до 900 мм.
Заготовки для проката полуфабрикатов,
предназначенных для изготовления стеклоплавильных сосудов, можно получать
методом плазменного переплава. Последующую прокатку ведут с небольшими
единичными обжатиями и малыми суммарными степенями деформации, а промежуточные
отжиги производят при несколько более высокой, чем обычно, температуре.
.6 Кристаллическая структура
Платина имеет гранецентрированную кубическую
структуру типа Cu(A1).
Параметр кристаллической решетки платины при комнатной температуре составляет
0,392 нм. Исследование проводили на металле чистотой 99,99% с основными
примесями-0,001% Rh;
0,002% Са; 0,001% Mg
и 0,001% Fe. Параметр
решетки был определен также рентгеновским методом показанинейный характер
температурной зависимости этой характеристики в интервале от -190 до 1709° С.
Отмечается хорошее соответствие полученных результатов с данными других
исследователей.
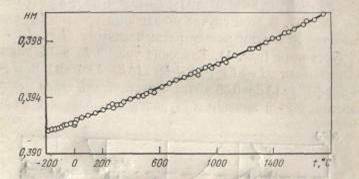
Рисунок 1- Зависимость параметра решетки платины
от температуры.
Величина межатомного расстояния для платины
составляет 0,277, диаметра атома 0,278, а диаметра иона 0,128 нм [3].
2. Способы
получения платины
Несмотря на то, что платина встречается в
природе в самородном состоянии, процесс ее получения весьма сложен. На первом
этапе платина, как и другие платиновые металлы, извлекается из россыпей. Сам
процесс извлечения можно разделить на две группы операций: добыча песков и их
обогащение гравитационными методами. Добыча платиносодержащих песков
производится подземными либо открытыми способами. В основном используется
открытый способ добычи, при котором идет вскрытие пустой породы и извлечение
платиносодержащих песков. Добычу, как правило, совмещают с гравитационным обогащением
в драге, после которой горная масса поступает в промывочную бочку, где
осуществляется дезинтеграция и грохочение. В процессе этих двух операций рудная
масса механически разделяется и размывается водой на два продукта - верхний
(галька, крупные камни, неразбитые комья глины), не содержащий платины и
отправляемый в отвал и нижний, который поступает последовательно на шлюзы,
отсадочные машины и концентрационные столы.
В результате обогащения получается шлиховая
платина, содержащая до 70-90 % платиновых металлов. Ее направляют на аффинажный
завод. Дальнейшее разделение платиновых металлов и получение их в чистом виде
из обогащенной руды осложнено большим сходством химических свойств этих
родственных металлов. Процессы, которые при этом необходимо произвести требуют
больших затрат труда, времени и дорогих реактивов. Так, для получения чистой
платины исходные материалы - самородный металл, обогащенные платиновые шлихи
либо платиновый лом (непригодные для дальнейшего использования изделия из
драгоценного металла) подвергают обработке подогретой царской водкой в
фарфоровых котлах.
В ходе такой процедуры в раствор переходят
платина и палладий, частично иридий и родий (в виде комплексных соединений), а
также железо и медь (в виде FeCl3 и CuCl2). Кроме того, в раствор переходят
другие металлы, содержащиеся в сырье. Нерастворимый в царской водке остаток
состоит из хромистого железняка FeCrO2, осмистого иридия, кварца и ряда других
минералов. Осадок подвергают фильтрации, после чего отправляют на повторную
обработку царской водкой для извлечения ценных компонентов - осмия и иридия. Из
раствора осаждают платину в виде (NH4)2[PtCl6] хлористым аммонием. Для того
чтобы в осадок вместе с платиной не выпал иридий в виде аналогичного
нерастворимого соединения (NH4)2[IrCl6] его предварительно восстанавливают:
Ir(+4) до Ir(+3). Такое восстановление возможно добавлением сахара (по способу
Черняева) или прогревая его с кислотами (серной или щавелевой). Другие
платиновые металлы NH4Cl не осаждает. Раствор хлористого аммония отфильтровывают,
промывают концентрированным раствором NH4Cl, в котором осадок практически не
растворим, затем сушат и прокаливают при температуре 800...1000° C.
Полученную губчатую платину измельчают и еще раз
промывают соляной кислотой и водой, после чего спрессовывают, а затем оплавляют
в кислородно-водородном пламени или в электрической печи высокой частоты. После
чего уже получаются платиновые слитки. При восстановлении платиновых растворов
химическим или электрохимическим способом получают мелкодисперсную платину -
платиновую чернь. При добыче платины из сульфидных медно-никелевых руд, в
которых содержание семьдесят восьмого элемента не превышает нескольких граммов
на тонну руды, источником платины и ее спутников служат шламы цехов электролиза
меди и никеля, так называемые черновые металлы - нечистые никель и медь. Шламы
обогащают обжигом, электролитическим рафинированием и рядом других способов.
В полученных концентратах содержание платины и
прочих платиновых металлов достигает 60 %. Обогащенные концентраты отправляются
на аффинаж и проходят абсолютно те же стадии, что и шлиховая платина. Россия
долгое время была лидером в добыче платины, однако должного применения этому
благородному металлу в нашей стране не могли найти, по этой причине большей
частью металл шел на экспорт. До Первой мировой войны второй после России
страной по объёмам добычи платины была Колумбия; с 1930-х гг. стала Канада, а
после Второй мировой войны - Южная Африка. Затем данные по добыче платины в
СССР были засекречены, также как и данные по другим стратегическим материалам.
Современная статистика говорит о том, что на первое место по добыче семьдесят
восьмого элемента в мире вышла ЮАР (более 150 тонн в год), на втором месте
Россия, добывающая в шесть раз меньше платины, чем ЮАР! Кроме того, платина
добывается в Канаде, Зимбабве, США и Колумбии. Разведанные мировые запасы
металлов платиновой группы составляют около 80 000 т и распределены, в
основном, между Южной Африкой (87,5 %), Россией (8,3 %) и США (2,5 %).
Основным источником добычи платины являются
медно-никелевые месторождения, из руд которых платина добывается попутно. В
природе металлы платиновой группы обычно сопутствуют друг другу. Попутно
платину и другие платиновые металлы получают при аффинаже золота.
Аффинированная платина выпускается в слитках со степенью чистоты до 99,99 %.
.1 Формы нахождения платины в рудах
Формы нахождения платины в рудах определяют ее
поведение в последующих процессах обогащения. Поэтому их изучение имеет большое
значение для выбора технологической схемы переработки платиносодержащих руд и
концентратов.
Кларк и Вашингтон, а позднее и И.В. Ноддак
подсчитали содержание платины в земной коре. Первые принимали в расчет только
ту платину, которая находится в россыпях и коренных ультраосновных породах, а
вторые учитывали также платину, находящуюся в рассеянном состоянии. Иногда
пользуются данными по распространенности платины, приводимыми Гольдшмидтом.
Обобщение ряда исследований на основе многочисленных определений дано А .
П.Виноградовым.
Таблица 2 - Содержание платины в земной коре, %.
|
По
Кларку и Вашингтону
|
По
И. и В. Ноддаку
|
По
Гольдшмидту
|
По
А.В. Виноградеву
|
|
1,2
*10-8
|
5*10-6
|
1*10-8
|
5*10-7
|
Платину добывают в “первичных” и “вторичных”
месторождениях. К первым относятся открытые в 1908 году канадские медно-никелевые
магнитные колчеданы в округе Садбери, южноафриканские медно-никелевые колчеданы
в Трансваале и месторождения Норильска; здесь платина присутствует в виде
сульфидов.
Вторичные месторождения обязаны своим появлением
выветриванию первичных месторождений и последующему смыванию выветренных пород,
причем платиновые металлы, имеющие большую плотность, оседали в определенных
местах.
Вторичные месторождения находятся в Колумбии. Но
они утратили свое значение в 20-х годах прошлого века, когда на западных и
восточных склонах Уральского хребта были найдены большие залежи платиновых руд.
В уральских месторождениях минералы платиновых металлов генетически связаны с
глубинными ультраосновными породами, главным образом, с дунитами.
Таблица 3 - Средний состав уральской россыпной и
коренной платины, %
|
Тип
месторождения
|
Рt
|
|
Россыпная
|
77.5
|
|
Коренная
|
76.7
|
|
Средний
состав аффинируемой платины
|
78.4
|
В канадских месторождениях платина встречается в
виде сперилита PtAs2, куперита PtS и некоторых более редких минералов. Однако
большая часть платиновых металлов находится в сульфидах в виде твердого
раствора.
Содержание платины в рудах достигает 1.5-2.0
грамма на 1 тонну руды. Примерно такой же минералогический состав имеют
южноафриканские руды, кроме того здесь найдена самородная платина и
ферроплатина.
Каждому типу руд и их минеральным разновидностям
свойственны свои особенности платиновой минерализации, обусловленные различной
обогащенностью платиновыми металлами, различным соотношением платины, палладия,
иридия, родия, рутения и осмия, а также различием форм нахождения металлов.
Многообразие типов руд и различие форм
нахождения платиновых металлов в медно-никелевых рудах вызывает большие
сложности с полнотой извлечения платиновых металлов в готовые концентраты,
направляемые в металлургическую переработку.
.2 Получение платиновых металлов из россыпей
Основными источниками получения металлов
платиновой группы являются отходы медно-никелевого производства, а также
металлы, полученные из россыпей. Химический передел богатых платиновыми
металлами шламов производится на аффинажных заводах первичного и вторичного
сырья.
Процессы аффинажа платиновых металлов до сих пор
являются предметом научных исследований. Однако и сейчас еще порошковые металлы
содержат большое количество металлических и неметаллических примесей.
Процесс извлечения платиновых металлов из
россыпей сводится к двум группам операций: добыче песков и их обогащению
гравитационными методами. Пески можно добывать подземными и открытыми
способами; как правило, применяют открытые горные работы, выполняемые в два
этапа: вскрытие пустой породы и добыча платиносодержащих песков. Добычу песков
обычно совмещают с их гравитационным обогащением в одном агрегате, например,
драге.
Добытая горная масса из дражных черпаков поступает
в промывочную бочку, где осуществляется дезинтеграция и грохочение. Процесс
дезинтеграции горной массы в бочке происходит посредством механического
разделения и размыва ее водой при перекатывании породы внутри бочки и орошении
напорной струей воды. Порода при этом разделяется на два продукта: верхний
(галька, крупные камни, неразмытые камни глины) не содержит платины и
направляется в отвал; нижний поступает последовательно на шлюзы, отсадочные
машины и концентрационные столы. В результате обогащения получается шлиховая
платина, содержащая до 70-90 % платиновых металлов. Ее направляют на аффинаж.
.3 Извлечение платины при обогащении сульфидных
платиносодержащих руд
Технологические схемы извлечения платиновых
металлов при обогащении вкрапленных руд определяются формами нахождения этих
металлов в данном месторождении. Если платиновые металлы представлены
самородной платиной и ферроплатиной, то в технологическую схему обогащения
входит операция по получению гравитационного концентрата, содержащего повышенные
концентрации платиновых металлов. Если в рудах платиновые металлы, в частности
платина, находятся в виде магнитной ферроплатины, то обычно применяют магнитную
сепарацию с последующей переработкой богатого продукта либо в отдельном цикле,
либо совместно с никелевым концентратом в пирометаллургическом процессе. Первую
схему применяют, например, для обогащения платиносодержащих руд Южной Африки.
Технологический процесс
гравитационно-флотационного обогащения южноафриканских руд включает дробление
исходной руды с последующим тонким измельчением ее в две стадии в шаровых
мельницах, работающих в замкнутом цикле с гидроциклонами.
Свободные зерна самородной платины отделяют в
цикле измельчения на шлюзах с кордероевым покрытием. Полученные концентраты
подвергают перечистке на концентрационных столах с получением гравитационного
концентрата, содержащего 30-35 % Pt, 4-6 % Pd и 0.5 % других металлов
платиновой группы.
Пульпу после выделения гравитационного
концентрата сгущают и направляют на флотацию. Конечным продуктом флотации
является концентрат, содержащий: 3.5-4.0% Ni, 2.0-2.3% Cu, 15.0% Fe, 8.5-10.0%
S; сумма платиновых металлов 110-150 г/т. Этот концентрат поступает в
металлургическую переработку. При обогащении вкрапленных руд отечественных
месторождений получаются два концентрата: медный и никелевый. Значительные
потери металлов-спутников с хвостами обогащения объясняются тем, что они
ассоциированы с пирротином, уходящим в отвал.
Никелевый концентрат после агломерации или
окатывания плавят в электротермических (реже отражательных) печах с получением
штейна и шлака. Шлак на некоторых заводах после грануляции и измельчения
подвергают флотации для извлечения взвешенных частиц штейна, содержащих
платиновые металлы. Штейн, концентрирующий основную массу платиновых металлов,
проходит операцию конвертирования с получением шлаков, направляемых на
обеднительную электроплавку, и файнштейна, который медленно охлаждается,
дробится, измельчается и флотируется с получением медного концентрата,
перерабатываемого в медном производстве, и никелевого, направляемого на обжиг в
печах кипящего слоя.
При охлаждении файнштейна компоненты
претерпевают кристаллизацию в следующей последовательности: первичные кристаллы
сульфида меди-двойная эвтектика, состоящая из сульфидов меди и никеля-тройная
эвтектика, состоящая из сульфидов меди, никеля и медно-никелевого
металлического сплава. Металлический сплав, выход которого на различных заводах
составляет 8-15 %, коллектирует до 95 % платиновых металлов, содержащихся в
файнштейне. Поэтому на некоторых заводах металлическую фазу выделяют магнитной
сепарацией и направляют на восстановительную плавку с получением анодов.
Полученную после обжига никелевого концентрата
закись никеля подвергают восстановительной плавке на аноды в дуговых
электропечах. Аноды подвергают электрорафинированию; выпадающий на аноде шлам
концентрирует основную массу платиновых металлов.
Платиновые металлы, находящиеся в медном
концентрате, после обжига, отражательной плавки, конвертирования и огневого
рафинирования концентрируются в медных анодах, откуда после
электрорафинирования переходят в медный шлам. Медный и никелевый шламы
обогащают с получением концентратов, содержащих до 60 % платиновых металлов.
Эти концентраты направляют на аффинаж.
3. Примеси в платине
В платиносодержащих рудах установлено около 90
минералов, в том числе сульфоарсениды и селеносульфиды Pd и Bi, висмутиды и
антимониды Pd, сульфиды Pd и Pb, висмутиды Pt и Pb. Содержание Pd в рудах
составляет 0,5-240 г/т, Pt - 0,05-30 г/т, Rh - до 0,6 г/т, Os - 0,2 г/т, Au -
0,01-250 г/т, Ag - до 1,5 кг/т, V2O5 - 1,5-10% (в среднем 2,7%), U -
0,008 - 0,5%, Re - 0,005-0,2%. Всего свыше 20 элементов(Pt, Pd, Rh, Ir, Os, Au,
Ag, V, U,Co, Mo, Zn, Pb, Se, Te, Bi, As, Ni, Cu, Re и др.) присутствуют в этих
и окаймляющих их залежах медно-молибденовых руд в промышленных концентрациях.
платина легирование сплав
термический
4. Основы
легирования платины. Растворимость Л.Э. Основные промышленные сплавы
Платина имеет сравнительно низкую температуру
плавления и хорошую технологичность. Легкость получения ее в компактном виде
позволила сравнительно давно начать изучение ее систем. В настоящее время есть
более или менее полные сведения о системах платины со всеми элементами
Периодической системы. Анализ диаграмм состояния платины показал, что в
характере взаимодействия этого металла наблюдаются отклонения от существующих
положений.
Платина - очень активный металл. Для него
неизвестны системы с расслоением в жидком состоянии. Хотя платина также не
образует непрерывных рядов твердых растворов во всем интервале температур и
концентраций, известны сравнительно широкие области твердых растворов на основе
платины. При этом в платине хорошо растворяются тугоплавкие металлы - вольфрам,
молибден, тантал и рений, среднетугоплавкие металлы - цирконий, ванадий,
некоторые редкоземельные металлы и легкоплавкие металлы - алюминий, магний,
индий, галлий. Растворимость этих металлов в платине колеблется от 5 до 50%
(ат.). И сама платина значительно хуже растворяется в элементах Периодической
системы. Образование областей твердых растворов в системах платины сопровождается
образованием достаточно большого числа химических соединений. Количество
химических соединений возрастает по мере удаления второго компонента по
Периодической системе и в диаграммах платины с редкоземельными металлами
достигает 7-9, в системах палладия с редкоземельными металлами 5-6.
Удельное сопротивление по мере легирования
серебром возрастает почти линейно до 5% (ат.) Аg, после чего наблюдается более
плавный его рост. Обращает на себя внимание резкое увеличение значений
твердости до содержания примерно 13-14% (ат.) Ag,
после чего эта характеристика с увеличением концентрации серебра практически не
изменяется.
Значительно влияет легирование золотом на
твердость и удельное электросопротивление платины. Обе характеристики в
исследованных условиях возрастают по мере легирования, причем
электросопротивление линейно, а твердость линейно до 6% (ат.) Аu после/чего до
20% (ат.) Аu изменяется незначительно.
Легирование платины бериллием значительно
повышает ее прочность при комнатной температуре. Предел прочности сплава с
0,08% Be выше, чем у
нелегированной платины, более чем в пять раз. Пластичность при этом снижается
всего в два раза, оставаясь на достаточно высоком уровне (18%).
Легирование бериллием значительно снижает
деформацию сплава при ползучести, т. е. сплав, содержащий даже 0,02% Be,
гораздо меньше «ползет», чем нелегированная платина. Показано также, что
легирование бериллием улучшает жаростойкость платины при 1300° С на воздухе.
Даже минимальная концентрация этого элемента (0,02%) заметно снижает свойственную
нелегированной платине летучесть.
Легирование бором способно упрочнить платину при
комнатной температуре, но, как и следовало ожидать, даже в условиях
кратковременного нагружения при высокой температуре прочность сплавов резко
падает и сплав с 0,05% В при температуре 1200° С вообще разрушается, в то время
как кратковременная прочность нелегированной платины, даже при 1300° С
составляет 270 МПа.
Платина в чистом виде очень мягкая, поэтому ее
легируют, например, иридием, палладием, родием и другими металлами. Для
изготовления ювелирных изделий в сплав кроме указанных легирующих элементов
добавляют еще и медь.
Иридий. Легирование платины иридием способствует
резкому возрастанию твердости и прочностных характеристик сплавов. Сплавы с
иридием по сравнению с другими сплавами платины наиболее химически устойчивы,
особенно по отношению к кислотам.
Палладий. Добавки палладия снижают температуру
плавления, повышают пластичность, улучшают обрабатываемость и ковкость сплавов
платины, осветляют их.
Чтобы создать сплавы для литья с разным уровнем
чистоты, используется кобальт и (или) палладий. Кобальт снижает уровни
кислорода в плавке, повышает текучесть и литейные свойства и дает хорошую
конечную твердость, не сокращая в значительной степени пределов плавления. Сплавы
с кобальтом предпочтительней для колец, брошей и деталей браслетов из-за
прочности и твердости. Сплавы с палладием мягче и предпочтительней для закрепок
и хрупких моделей. Сплавы с кобальтом немного более голубые, а сплавы палладия
немного более серые, чем чистая Pt.
Сплав с медью можно также отливать, если это
необходимо, но поверхности литья имеют тенденцию к большей шероховатости и их
труднее полировать, чем литые кобальтовые сплавы. Сплав с 85 % платины, 10 %
палладия и 5 % меди используется в Германии, Италии и Японии.
Комплексное легирование может также усилить
отдельные свойства. Например, введение 3 % Co и 2 либо 7 % Pd в сплавы платины
950-й или 900-й пробы улучшает литейные свойства, способность к полировке и
цвет. Все сплавы для литья можно соединить с коваными компонентами пайкой или
сваркой.
Платиновые сплавы очень чувствительны к
присутствию примесей и инородных включений, которые при нагреве могут
взаимодействовать с матрицей с образованием легкоплавких составляющих и
приводить к хрупкому разрушению.
Количество химических соединений, прогнозируемых
в системах платиновых металлах, очень велико. Многие из них известны давно,
некоторые синтезированы в последнее время. Полной ясности в характере
образования и характерных структурах соединений этих металлов пока нет. Большое
количество соединений, наблюдаемое в системах платиновых металлов, типично
вообще для переходных металлов. К этим соединениям относятся соединения типа
фаз Лавеса, σ- и χ-фаз,
соединения эквиатомного состава типа CsCl,
AuCd, CrB,
CuAu, соединения типа Cr3Si,
Сu3Аu,
CaCu5
и некоторые другие. Спецификой платиновых металлов является образование
гексагональных плотноупакованных ε-фаз
с широкими областями твердых растворов, ε-фазы
образуются в системах сплавов о.ц.к. металлов VI
группы
с г.ц.к. металлами VIII
группы и по своим параметрам (кристаллическим) близки к твердым растворам на
основе г.п.у. металлов.
Платина, как и палладий, имеет наибольшее
удельное электрическое сопротивление среди благородных металлов и низкую
теплопроводность, обладает незначительной летучестью по сравнению с другими
благородными металлами. Твердость и прочность платины могут быть увеличены
вдвое путем холодной обработки (по сравнению с отожженным состоянием). Примеси
многих металлов повышают твердость и удельное электрическое сопротивление
платины. Платина обладает высокой устойчивостью к коррозии на воздухе, не
образует окисных и сернистых пленок, обеспечивает устойчивое контактное
сопротивление, мало растворяет водород, поэтому в противоположность палладию
может отжигаться в водороде без снижения своих свойств. В углеродистой среде
платина науглероживается и становится хрупкой.
Контактные свойства платины: наиболее высокие
параметры дуги (по сравнению с другими благородными металлами), близкие к
вольфраму (дуга между платиновыми контактами трудно зажигается); платина
подвергается мостиковой эрозии с образованием игл (как все неокисляющиеся
металлы); легко обрабатывается давлением. Вследствие невысокой твердости в
чистом виде платину применяют очень редко - только для контактов прецизионных
приборов. Она находит использование как основа для производства контактных
сплавов.
В качестве контактных материалов применяют
сплавы платины с иридием, родием, никелем (образуют непрерывный ряд твердых
растворов), рутением, осмием, молибденом, вольфрамом (образуют ограниченную
область твердых растворов). Известен также тройной сплав платина - палладий -
рутений (84-10-6), Сплавы серебро,- платина рассмотрены ранее.
Платина - иридий. Для контактов применяют
сплавы, содержащие 5-30 % Ir. Наибольшее применение они нашли для прецизионных
контактов. Иридий значительно повышает твердость и механическую прочность,
ухудшая обрабатываемость платины. Сплавы, содержащие свыше 30 % Ir,
обрабатываются с трудом. Сплавы с 7- 99 % Ir могут «стареть» (за счет распада
твердого раствора при температуре ниже 1000 °С). Старение при 750 °С
значительно повышает твердость cплавов, содержащих 15-25 % Ir.
Иридий значительно повышает удельное
электрическое сопротивление и стойкость к атмосферной коррозии, но при нагреве
сплавов выше 900 °С окисляется и улетучивается. Параметры дуги у
платиново-иридиевых сплавов выше, чем у платины, а склонность к иглообразованию
меньше. Контакты из платиново-иридиевых сплавов очень износоустойчивы и имеют
продолжительный срок службы.
Платина - родий. Как контактный материал
наиболее известен сплав с 10 % Rh. Он имеет высокие механические свойства
(твердость и прочность на разрыв вдвое больше, чем у платины) и большое
электрическое сопротивление, обладает малой летучестью при высокой температуре.
Используется для свечей зажигания.
Платина - никель. Никель значительно повышает
твердость и удельное электрическое сопротивление сплавов. Как контактный
материал наиболее известен сплав, содержащий 5 % Ni. Он имеет высокие параметры
дуги, но ниже, чем у платины; эрозия при размыкании омической цепи меньше, чем
у платины; малая склонность к иглообразованию при малых токах;
малая склонность к свариванию; сплав в
незначительной степени повышает контактное сопротивление при образовании
сернистых пленок. Сплавы платины с никелем пластичны, поэтому хорошо
обрабатываются.
Платина - рутений. Рутений чрезвычайно сильно
повышает твердость платины и электрическое сопротивление. В качестве контактных
материалов применяют сплавы, содержащие до 14 % Ru. При большом содержании
рутения сплавы обрабатываются с трудом. Сплавы обладают меньшей, чем у платины,
склонностью к свариванию и образованию игл. Минимальный ток дуги у сплава с 5 %
Ru почта тот же, что у сплава с 10 % Ir. При нагревании на воздухе рутений
окисляется с образованием летучих окислов.
Платина - осмий. Осмий сильно повышает твердость
и электрическое сопротивление платины. Сплавы летучи и при нагревании теряют в
массе (за счет осмия); обрабатываются при содержании не более 10 % Os, Известен
сплав с 7 % Os, обладающий исключительно высоким минимальным током дуги (2,5
А),
Платина - молибден. Для контактов применяют
сплав с 10 % Мо. Он имеет высокие электрическое сопротивление, твердость и
склонность к иглообразованию и старению.
Платина - вольфрам. Вольфрам значительно
повышает температуру плавления сплава и его твердость. Для контактов и свечей
зажигания применяют сплавы с 4-5 % W, имеющие высокое удельное электрическое
сопротивление и твердость. Они достаточно пластичны - обрабатываются
пластически в горячем и холодном состоянии (поддаются ковке, прокатывайте,
волочению на холоде); стойки к атмосферной коррозии; склонны к иглообразованию;
имеют минимальный ток дуги несколько меньший, чем у платины.
Платина - палладий - рутений (84-10-6) - тройной
сплав, обладающий высоким электрическим сопротивлением, твердостью и
пластичностью, коррозионноустойчивостью.
Платину для изготовления ювелирных изделий
легируют иридием, медью, палладием, родием. Для промышленного применения к
платине добавляют железо, кобальт, никель.
Таблица 4 Свойства сплавов на основе платины
даны в таблице
|
Марка
|
Расчетная
плотность, г/см3
|
Температура
плавления, °С
|
Твердость
HV кгс/мм2
|
|
|
|
Твердый
|
Мягкий
|
|
Пл
И 900-100
|
21,54
|
1790-1800
|
145
|
80
|
|
Пл
М 900
|
18,82
|
1650-1700
|
335
|
155
|
|
Пл
И 950-50
|
21,50
|
1790-1800
|
145
|
75
|
|
Пл
Пд 950-50
|
20,66
|
1700-1750
|
150
|
65
|
|
Пл
Пд 950-50
|
20,70
|
1800-1825
|
195
|
80
|
|
Пл
М 950
|
20,05
|
1700-1730
|
275
|
122
Платина и родий неограниченно растворимы друг в
друге. Сплавы, содержащие до 30 % Rh,
хорошо деформируются в холодном состоянии. Сплавы с более высоким содержанием
родия обрабатываются с большими трудностями.
Коррозионная стойкость в кислотах постепенно
возрастает с увеличением содержания родия. Сплавы с концентрацией Rh
20 % и выше не растворяются в царской водке.
Из всех сплавов благородных металлов сплавы
платины с иридием обладают наибольшей коррозионной стойкостью даже по отношению
к хлору и царской водке (смесь соляной и азотной кислот) и отличаются большой
прочностью и упругостью. См рис. 9.10.
Платина и медь образуют непрерывный ряд твёрдых
растворов. При охлаждении наблюдается упорядочение твёрдых растворов с образованием
химических соединений Pt
Cu и Pt
Cu5. Механические
свойства сплавов рассматриваемой системы сильно зависят от содержания второго
компонента. С повышением содержания меди прочность возрастает, а пластичность
падает. Так, отожженные сплавы с 4,88 % Qi
обладают ов = 440 МПа и 5 = 20 %, а при повышении содержания d
до 9,08 % эти характеристики составляют соответственно 560 МПа и 17 %.
При нагревании на воздухе сплавы, содержащие
менее 10 % Oi, не
окисляются. При большем содержании меди происходит избирательное окисление и
поверхность покрывается окислами меди. Азотная кислота не действует на сплавы,
если содержание Oi
не превышает 50 %.
Платина с у-железом образует непрерывный ряд
твёрдых растворов. В сплавах с 40-50 % Fe
наблюдается отрицательный температурный коэффициент теплового расширения.
Сплавы, закалённые с 1100 0С, имеют высокую коэрцитивную силу с
максимумом при 22,2 % (массовых) Fe
(50 % атомных Fe),
достигающим 1,2-105 А/м. В отожженном состоянии коэрцитивная сила
2,5-105 А/м.
5. ТО и ХТО платины
Термической обработкой называют процесс
обработки изделий из металлов и сплавов путем теплового воздействия с целью
изменения их структуры и свойств в заданном направлении. ТО - самый
распространенный в современной технике способ изменения свойств металлов и
сплавов. Термообработку применяют как промежуточную операцию для улучшения
технологических свойств(обрабатываемости резанием, давлением и т.д.) и как
окончательную операцию для придания металлу или сплаву такого комплекса
механических, физических и химических свойств, который обеспечивает необходимые
эксплуатационные характеристики изделия.
Любой процесс термической обработки можно
описать графиком, показывающим изменение температуры во времени. По такому
графику можно определить температуру нагрева, время нагрева и охлаждения,
средние и истинные скорости нагрева и охлаждения, время выдержки при
температуре нагрева и общую продолжительность производственного цикла. Но по
форме этого графика ничего нельзя сказать о том, с каким видом термообработки
мы имеем дело. Вид термообработки определяется не характером изменения
температуры во времени, а типом фазовых и структурных изменений в металле.
Производственные названия отдельных процессов термообработки складывались
исторически и основывались не на характере внутренних превращений в металле или
сплаве, а на чисто внешних признаках. Поэтому один и тот же термин иногда
используют для обозначения разновидностей термообработки, совершенно различных
по своей физической сущности. Например, нагрев с переходом за критическую
точку, выдержку и охлаждение на воздухе обычно называют нормализацией.
Химико-термическая обработка - это термическая
обработка, сочетающая тепловое воздействие с химическим, в результате чего
изменяются состав и структура в поверхностных слоях, а иногда и по всему объему
изделия. Для изменения химического состава изделие нагревают в активной среде.
Во время выдержки изделие диффузионно обогащается элементами из внешней среды.
Кроме того, химико-термическую обработку можно использовать для диффузионного
удаления из изделия примесей, а в отдельных случаях и основных компонентов.
Подавляющее большинство промышленных процессов
химико-термической обработки включает диффузионное обогащение поверхностных
слоев изделий неметаллами или металлами из внешней активной среды, для чего
используют газовые, жидкие и твердые среды. Самый известный из этих процессов -
цементация (науглероживание стальных изделий в древесном угле при высоких
температурах) относится к числу древнейших операций термической обработки,
использовавшихся задолго до н. э.
Возврат происходит в металлах при температуре
ниже температуры рекристаллизации и, как правило, снимает только часть наклепа.
Обычно возвратом называют процесс любого изменения структуры или свойств,
происходящий в результате отжига деформированного металла без образования новых
рекристаллизованных зерен. Возврат рассматривается как термически активируемый
процесс перераспределения и аннигиляции точечных дефектов, возникших в процессе
деформации.
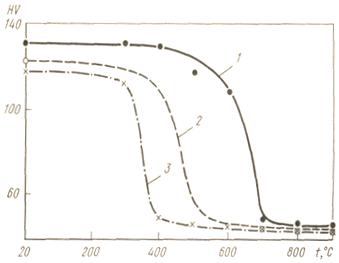
Рисунок 2 - Зависимость твердости
деформированной платины разной чистоты от температуры отжига: 1 -Pt
т.ч.; 2 -Pt х. ч.; 3 - Pt
ф. ч.
Температура начала возврата определяется
степенью пластической деформации и чистотой металла. На рис.5 приведены кривые
возврата твердости платины технической, химической и физической чистоты. При
одинаковых степени деформации и продолжительности отжига возврат твердости для
платины самой высокой чистоты происходит в интервале 300-400° С, для менее
чистой - при 400-500° С, а для технической платины- между 600 и 700° С.
На кривой аналогичной зависимости для платины
высокой чистоты, переплавленной электроннолучевой плавкой, практически нет
точки перегиба. Возврат продолжается до более высоких температур и заканчивается
лишь при 800° С. Объясняется это тем, что присутствовавшие в исходном металле
примеси палладия, золота и серебра, температура плавления которых значительно
ниже, чем у платины, в процессе плавки испаряются, в связи с чем проявляется
действие более тугоплавких родия и иридия на температуру возврата платины.
Кроме того, в платине, переплавленной электроннолучевой плавкой, обнаружены
следы вольфрама и молибдена, которые могли попасть из стенок медного тигля и
также повлиять на температуру возврата.
На возврат и рекристаллизацию платины и других
г. ц. к. металлов той же группы оказывают влияние в основном металлические
примеси, в то время как влияние газов незначительно.
С увеличением количества примесей температура
начала процессов возврата и рекристаллизации заметно повышается.
Влияет также технология получения металла: при
одинаковых степенях деформации холоднотянутая проволока имеет более высокие
температуры возврата, чем холоднокатаный лист.
На первой стадии возврата (отдых) в
деформированном металле происходит уменьшение концентрации точечных дефектов и
перераспределение дислокаций, на второй (полигонизация) - образование и
миграция малоугловых границ.
Непосредственное выявление дефектов,
устраняющихся в процессе отдыха, затруднено. Поэтому в металл вводят либо путем
высокотемпературной закалки, либо облучением частицами с высокой энергией
точечные дефекты, а затем по изменению физических свойств материала - удельного
электрического сопротивления, плотности и т. п. - при нагреве изучают кинетику
и энергию активации исчезновения этих дефектов.
Процессы отдыха в некоторых случаях требуют
очень малой энергии активации и проходят при низких температурах (сотые доли от
абсолютной температуры плавления). Обобщение результатов исследований,
выполненных на медных и золотых деформированных, облученных и закаленных
образцах, дало условное разделение процессов восстановления
электросопротивления при возврате в свою очередь на четыре стадии, на каждой из
которых происходит уничтожение той или иной группы точечных дефектов: I
стадия - рекомбинация пар межузельный атом+вакансия (т.е. пар Френкеля); II
стадия- миграция межузельных атомов и групп вакансий (бивакансий); III
стадия - миграция вакансий к ловушкам, миграция бивакансий; IV
стадия - миграция вакансий к дислокациям, способствующая их перераспределению с
образованием малоугловых границ и частичной аннигиляцией (полигонизация).
Обычно, I
стадия наблюдается при температурах около 0,03 Тпл и требует энергии
активации 0,1 эВ; II
стадия-в интервале 0,15 Тпл , 0,2-0,5 эВ; Ш стадия - в интервале 0,16-0,20 Т„л,
0,7 эВ; IV стадия- в
интервале 0,27-0,35 Гм, 1,2 эВ (полигонизация). Следующая стадия
соответствует рекристаллизации, проходит при температуре около 0,4 Тпл, с
энергией активации 2,1 эВ. С изменением чистоты металла указанные температурные
интервалы могут смещаться
Установлено образование в облученной платине
нескольких типов точечных дефектов. Так облученной нейтронами фольги из платины
высокой чистоты (99,999%) при помощи трансмиссионной электронной микроскопии
позволило обнаружить три типа дефектов: дислокации Франка, призматические
дислокационные петли и поры, возникшие в результате образования скоплений
вакансий.
Количество дефектов, как правило, увеличивается
с повышением дозы облучения до определенной «критической» величины,
соответствующей «насыщению» решетки металла дефектами. С дальнейшим повышением
дозы облучения скорость образования дефектов снижается из-за спонтанной
рекомбинации последних в результате насыщения. Предварительная (перед облучением)
закалка образцов, приводящая к образованию дополнительных вакансий
сопровождается снижением плотности дефектов и способствует их рекомбинации.
Введение в платину закалочных вакансий приводит к ускорению возврата на первой
его стадии, которая начинается с отжига пар Френкеля и сама по себе может быть
разделена на четыре подстадии. Заканчивается эта стадия миграцией межузельных
атомов.
Исследовали I
стадию возврата деформированной растяжением на 1-3% при 5 К платины высокой
чистоты (99,999%) методом измерения удельного электрического сопротивления. При
16, 28 и 36 К наблюдали пики возврата; этим пикам отвечали соответственно
значения энергии активации 0,05; 0,073 и 0,14 эВ. Первый пик связывают с
миграцией дефектов на близкие расстояния, второй - с миграцией внедренных
атомов; природу третьего не указывают, но считают, что он аналогичен пикам
возврата других металлов, например меди и алюминия.
У деформированной платины высокой чистоты на I
стадии возврата обнаружено некоторое смещение первых двух пиков электросопротивления
в область более низких температур (12 и 22 К вместо 16 и 28 К). Показано, что
при многократной деформации возврат в ис-следованной платине начинается при
более низких температурах.
Вторая стадия возврата связывается с
освобождением межузельных атомов из примесных ловушек, а на III
стадии происходит миграция второго типа межузельных атомов. Исследовали образцы
платины высокой чистоты (99,999%), деформированной при -196° С растяжением на
3, 6 и 10%. Перед деформацией проводили либо отжиг при 900° С, либо закалку при
1310° С со скоростью охлаждения 5-105°С/с.
Возврат изучали в интервале температур от -196
до 900° С, причем основное внимание было направлено на изучение III
(от -40 до 180° С) и IV
(180-380° С) стадий возврата. В интервале температур III
стадии были обнаружены две подстадии: при температурах от -20 до 80° С (ША) и
от 100 до 160 °С (ШБ). Энергия активации на этих подстадиях составила 0,7 и 1,1
эВ соответственно. Считается, что на подстадии ША межузельные атомы
аннигилируют либо на дислокациях, либо присоединяя вакансии. На подстадии ШБ
дивакансии аннигилируют на дислокациях. На IV
стадии возврата, соответствующей полигонизации, в платине начинается миграция
вакансий и дивакансии.
На стадии рекристаллизации происходит
значительное уменьшение объемной энергии деформированных зерен за счет
дальнейшего уменьшения числа дефектов структуры, внесенных деформацией, и
восстановление структуры и свойств недеформированного металла. Сущность
процесса состоит в том, что в деформированной матрице формируются и растут
центры рекристаллизации (зародыши) - участки с неискаженной решеткой,
отделенные от матрицы границами с большими углами разориентировки
(высокоугловыми границами). Процесс рекристаллизации охватывает широкий круг
структурных изменений, происходящих при нагреве металла (или сплава),
приводящих к уменьшению свободной энергии системы. Процессы заканчиваются
заменой одних зерен другими того же фазового состава, но с меньшей энергией.
На ход процесса влияют условия деформации и
нагрева, содержание примесей и их распределение, структура деформированного
состояния, полнота прохождения отдыха и полигонизации.
Различают так называемую первичную
рекристаллизацию или рекристаллизацию обработки, которая заканчивается при
полном поглощении новыми зернами старых, деформированных зерен, и вторичную,
или собирательную рекристаллизацию, в процессе которой происходит рост
образовавшихся зерен. В процессе первичной рекристаллизации происходят
переползание и термически активированное скольжение дислокаций, вызывающее их
частичную аннигиляцию и образование высокоугловых подвижных границ, причем
скольжение дислокаций участвует лишь в формировании зародышей рекристаллизации.
Дальнейшие стадии процесса связаны с движением высокоугловых границ, с
коллективными атомными перемещениями и с диффузией одиночных атомов.
В конечном счете рекристаллизация обеспечивает
полное снятие наклепа, т. е. разупрочнение деформированного металла, что
облегчает его дальнейшее деформирование или какую-либо другую последующую
обработку.
Температура рекристаллизации платины, так же как
и других металлов, определяется рядом факторов: степенью и характером
деформации, чистотой исходного материала и технологией его получения.
Исследование температуры рекристаллизации
платины разной чистоты, полученной разными методами, но деформированной и
отожженной по одним и тем же режимам, показало, что холоднотянутая с обжатием
92% проволока из плавленой платины рекристаллизовалась при температурах ниже
700° С. Проволока из полученной порошковым методом платины такой же чистоты
после аналогичной обработки рекристаллизовалась в зависимости от тем-пературы
спекания в интервале от 800 до 1200° С, а платина физической чистоты начинала
рекристаллизоваться уже при 200° С.
Путем легирования платины элементами, образующими
с ней твердые растворы, можно на сотни градусов повысить или понизить
температуру рекристаллизации. При этом на ход процесса влияют состав сплава,
распределение компонентов, их диффузионная подвижность, энергия поверхностей
раздела и т. д.
6. Основные области применения платины и её
сплавов
Платина нашла широкое применение в
промышленности и научных исследованиях. Без нее не возможна работа многих
современных аппаратов приборов.
До второй мировой войны платину применяли в
основном в медицине и ювелирном деле, на долю которых приходилось около 60%
всего потребления этого металла. После войны использование платины для этих
целей увеличилось примерно в два раза, однако их доля в общем потреблении
металла упала до 8-10%.
В настоящее время использование платины в
ювелирном деле сокращается, что объясняется ее широким применением после второй
мировой войны в химической, нефтеперерабатывающей, электротехнической, военной
и других отраслях промышленности .
Уникальный комплекс физико-химических и механических
свойств - повышенная коррозионная стойкость в самых различных средах,
каталитическая активность, стабильные электрические, термоэлектрические и
эмиссионные характеристики - делает сплавы платины незаменимым конструкционным
материалом для промышленности.
Большая часть всей потребляемой платины
приходится на долю химической промышленности и приборостроения. Платина до сих
пор является основным материалом для коррозионностойкой и жаропрочной
химической аппаратуры и посуды различного назначения.
В приборостроении используют основную часть
сплавов платины. Из них изготовляют электрические сопротивления и контакты,
термометры сопротивления и термопары высокой чувствительности, постоянные
магниты, тензодатчики, упругие элементы и т. д.
Надежность работы электроизмерительных,
радиотехнических и электронных приборов в значительной мере зависит от качества
материала электрических контактов, сопротивлений, потенциометров. Сплавы для
таких элементов должны обладать необходимым комплексом физических, химических и
технологических свойств и к тому же соответствовать определенным требованиям по
служебным характеристикам.
В качестве материалов скользящих и разрывных
электрических контактов в приборах и устройствах, работающих в агрессивных
средах, применяют литые и металлокерамические сплавы платины с благородными и
неблагородными металлами. Чистую платину применяют редко. По сравнению с
серебряными сплавами такие сплавы служат значительно дольше, не взаимодействуют
со средой, содержащей серу, и не снижают в этих условиях своих служебных
характеристик, а также обладают более высокой по сравнению со сплавами рения,
золота и серебра эрозионной стойкостью и сопротивлением износу, хотя несколько
уступают в этом отношении сплавам других благородных металлов - иридия, родия,
рутения.
Электрические контакты из платиновых сплавов
отличаются стабильностью и высоким уровнем электрических и механических
свойств.
В качестве материала для термометров
сопротивления обычно применяют платину высокой чистоты. Этому способствуют
высокое значение коэффициента сопротивления и стабильность электрических
свойств. Термометры из платины отличаются высокой точностью, чувствительностью
и стабильностью показаний. Они находят широкое применение при точном измерении
температур от 1000 до -260° С, а также для обычных измерений в промышленности .
Такие термометры одинаково необходимы как для
измерения температуры топлива, нефти, воздуха в кабине самолета и вне ее (для
предупреждения обледенения), при хранении и перевозке пищевых продуктов, для
контроля температуры в больших зданиях (кинотеатры, силосные сооружения и т.
д.), а также для контроля температуры нагрева металлических изделий
(подшипников). Подобные термометры применяются и в медицине.
Термопары из платины и ее сплавов широко
применяют для точного измерения температур процессов, проходящих в различных
средах.
Платина и её сплавы широко используются для
производства ювелирных предметов торговли.
Как самый драгоценный, редкий, чистый и трудный
металл, платина является символом любви и привязанности. Поэтому свадебные
кольца и кольца для помолвки, годовщины привлекают к себе все большее внимание
и ювелиров, и покупателей.
Большинство платиновых ювелирных предметов
торговли содержат 95% чистой Платины в отличие от 18-каратного желтого металла,
в котором только 75% желтого металла. Не бывает металлов без примесей, все они
являются сплавами, содержащими другие металлы. В Платине минимум примесей,
поэтому она настолько настолько чистая, что не тускнеет, не меняет цвет и
сохраняет блеск на долгие годы.
Яркий блеск чистого белого металла лучше всего
отражает истинное сияние бриллиантов, является прекрасной оправой для
драгоценных камней и сочетается с натуральными желтыми оттенками желтого
металла. Благодаря чистоте платина не раздражает кожу, так как в отличие от
некоторых других металлов не содержит аллергенных примесей.
Платина в 35 раз более редкий металл по
сравнению с желтым металлом, и ее добывают всего в нескольких странах, в
основном в Южной Африке и Российской Федерации, а также в небольших количествах
в Зимбабве, Стране кленового листа и пылающему континенту. Каждый год для
изготовления ювелирных предметов торговли используется всего 88 тонн Платины по
сравнению с 2700 тонн желтого металла. Чтобы получить всего одну унцию (31,1
грамма) Платины, требуется 8 недель и 10 тонн руды. В мире гораздо меньше
Платины, чем желтого металла, на каждые 10 золотых рудников приходится всего 1
платиновая шахта.
Высокая плотность и вес Платины делают ее более
долговечной по сравнению с другими ювелирными металлами. Вес куба Платины со
стороной 15 см составляет 75 кг, то есть вес среднего человека. Платина также
устойчива к высоким температурам, воздействию кислот и имеет высокую
температуру плавления - 1768 градусов С, температура кипения - 4410 градусов С.
Плотность Платины 21,45 грамм на сантиметр кубический, твердость по Бринелю 50
кг на квадратный миллиметр (по шкале Мооса - 4,3). Платина не растворяется ни в
горячей соляной, ни в кипящей азотной кислотах. Лишь царская водка может
перевести Платину в раствор. Серная кислота только при 250 градусах С слегка
действует на нее. Платина не изнашивается и является надежной оправой для
драгоценных камней.
Помимо прочности и высокой плотности платина
обладает таким замечательным качеством, как пластичность. Платина настолько
пластична, что всего из 1 гр этого металла можно сделать тонкую проволоку
длиной почти 2 километра. Это свойство позволяет ювелирам создавать
удивительные аксессуары из гибкой платиновой сетки, что не может быть
воспроизведено в других драгоценных металлах. Платина также пользуется спросом
и в других областях - ее используют в промышленности, наиболее активно - в
нейтрализаторах автомобильных выхлопов.
Платина широко используется в медицине. Она не
подвергается окислению при контакте с кровью, имеет прекрасные
электропроводящие свойства и совместима с человеческими тканями. Благодаря этим
свойствам платина используется для электронных стимуляторов сердца.
Литература
1. «Платина, ее сплавы и
композиционные материалы». Васильева Е.В., Волкова Р.М., Захарова М.И.,М.,
”Металлургия”,1980. 296 с.
2. ”Металловедение платиновых
металлов”. Савицкий Е.М., Полякова В.П., Горина Н.Б., Рошан Н.Р.,
М.,”Металлургия”, 1975.с.424.
. “Платиновые металлы”,
Буслаева Т.М., Соровский образовательный журнал, №11, 1999г.
. “Справочник по редким
металлам”, Бимиш Ф.Э., Мак-Брайд У.А., Бэйрфут Р.Р., Пер. с англ. М., «Мир»,
1965 с. 469-510.
. Рудницкий А.А., Полякова P.С.-
ЖНХ, 1957, т. II, в 12, с.
2758-2761.
. Зильберштейн В. А., Эстрин
Э. И. -ФММ, 1969, т. 28, в. 2, с. 369-370
. Шок Р. Н., Джонсон К.- ФММ,
1971, т. 31, в. 5, с. 1100-1101.
. “Электронная теория
металлов”, Лифшиц И.М., Азбель М.Я., Каганов М. И., М., «Наука», 1971. 253 с. с
ил
. Алексеевский Н.Е., Дубровин
А.В., Каpтенс Г.Э., Михайлов
Н.Н. -ЖЭТФ, 1968, т. 54, в. 2, с. 350-354.
10. Болотин Г.А., Волкенштейн Н.
В., Новоселов В.А., Старцев В.Е. - ФММ, 1972, т. 33, в. 4, с. 740-745 с ил.
11. “Справочник по ядерной
физике”, Пер. с англ. М., Физматгиз, 1963-632 с. с ил.
. Львов С. Н., Малько П.И.,
Немченко В.Ф. - ФММ,1971, т. 31, в. 1, с. 108-115.
. “Термоэлектрические
свойства благородных металлов и их сплавов”, Рудницкий А.А.. М., Изд-во АН
СССР, 1956. 148 с. с ил.
. Васильевa
P.П., Черемушкинава
Н.Н. - ФММ, 1973, т. 5, в. 4, с. 872-875.
. Кренгл Дж. - В кн.:
Электронная структура переходных металлов и химия их сплавов. М. «Металлургия»,
1966, с. 69-73.
Похожие работы на - Легирование платины
|