Биологически активные вещества из морского сырья и их добавление в продукты питания
ВВЕДЕНИЕ
Интерес к морским гидробионтам как источникам биологически активных
веществ (БАВ) (лекарств и препаратов) особенно возрос в конце 60-х гг., после
открытия простагландинов в мягких морских кораллах. С тех пор учеными выделены
и изучены многие БАВ, нашедшие применение в биология (тетродотоксин), медицине
(домоевая кислота, цефалоспорины и др.) и сельском хозяйстве (падан, полиеновые
соединения и др.). Активно ведутся исследования гидробионтов и в настоящее
время во многих странах мира, особенно прибрежных и островных. Признанными
лидерами в данной области являются США, Япония и Россия.
Основные усилия ученых направлены на изучение и получение БАВ из морских
гидробионтов, однако широкое применение и производство БАВ сдерживаются их
высокой себестоимостью. Одним из путей снижения себестоимости БАВ является
комплексное и рациональное использование всех органов и тканей морских
гидробионтов.
Под комплексной и рациональной переработкой понимают наиболее полное
использование органов и тканей гидробионтов, которое обеспечивает получение в
первую очередь пищевых продуктов, а также кормовых, технических и специального
назначения (химических соединений, представляющих интерес для народного
хозяйства).
Комплексное и рациональное использование гидробионтов позволяет расширить
ассортимент выпускаемой продукции, что существенно повышает рентабельность
основного производства. Выбор технологии переработки сырья требует
индивидуального подхода с учетом природы основного вещества, содержащегося в
сырье, его свойств и биологической активности.
Цель данной работы изучить БАВ из морского сырья и добавление их в
функциональные продукты питания.
1. ПРОЦЕССЫ ФЕРМЕНТОЛИЗА И ЭКСТРАГИРОВАНИЯ
Ферментация - частный случай катализа, имеющий место в пищевых продуктах
и пищеварительных трактах живых организмов. Ферменты - белковые вещества,
которые служат активными катализаторами (ускорителями) химических реакций в
этих средах. В присутствии ферментов изменяется путь протекания химических
реакций; они проходят через другие промежуточные элементы, в образовании
которых участвуют данные катализаторы. В результате этого суммарные энергии
активации химических реакций значительно снижаются, а массовые скорости реакций
увеличиваются.
Ферментативные реакции бывают и микробиальными, в которых ферменты
вырабатываются микроорганизмами, или немикробиальными. Микроорганизмы могут
вызывать желательные и нежелательные изменения в пиве, вине, сыре, квашеной
капусте и других продуктах, ферментами обычно являются их метаболиты.
Ферментативную реакцию можно изобразить в виде схемы (рисунок 1).
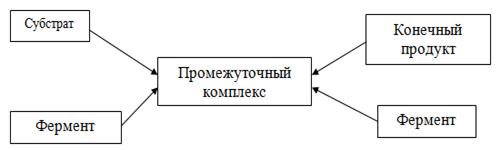
Рисунок 1. - Схема ферментативной реакции
Эта реакция протекает в две стадии. На первой стадии обратимо реагируют
субстрат и фермент, а на второй - распадается появившийся в результате первой
стадии реакции комплекс и образуется конечный продукт. При этом биохимические
реакции формально рассматриваются так же, как и простые химические.
Массовая скорость процесса dC/dτ (где С - концентрация конечного
продукта, а τ- время) зависит от концентрации субстрата С (рис. 41.2). При
увеличении концентрации субстрата скорость реакции асимптотически стремится к
максимальной величине. График этой зависимости - гипербола; для ее определения
необходимы два параметра: максимальная скорость реакции (dC/dτ)max и константа Микаэлиса
- Ментена Кс, равная значению концентрации субстрата, при которой
скорость реакции составляет половину от максимальной.
Вместо константы Кс, можно использовать константу Кп,
которая связана с температурой среды Т (как и скорость простой химической
реакции) аррениувской зависимостью:
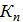
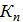 =
= 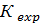
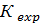
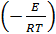
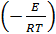 ,
,
где
К - постоянная; Е - энергия активации реакции, Дж/кмоль; R-универсальная
газовая постоянная среды, Дж/(кмоль * К).
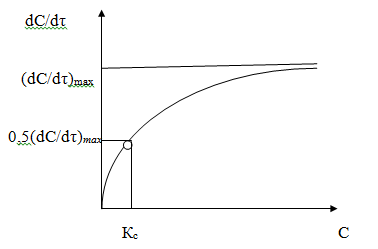
Рисунок
2. - Зависимость скорости ферментативной реакции от концентрации субстрата
Понятие
«моль» микроорганизмов в данном случае употребляется условно. В этом условном
выражении величина энергии активации обычно равна Е = 3 *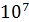
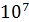 … 12 *107
Дж/кмоль, что соответствует средним и очень большим скоростям реакций.
… 12 *107
Дж/кмоль, что соответствует средним и очень большим скоростям реакций.
В
жизни микроорганизмов, используемых для ферментации, можно выделить три
периода: скрытый (латентный), или лагфазу, период логарифмического роста их
концентрации и период ослабления и гибели. Процессы ферментации протекают,
главным образом, во второй период.
Применение
аррениусовской зависимости, описывающей массовую скорость химической реакции, к
оценкам массовой скорости размножения и гибели микроорганизмов основано на
идентичности физической сущности механизмов протекания этих явлений. Если
химическая реакция идет вследствие достаточно сильных соударений реагирующих
молекул, то и гибель, и активация микроорганизмов также происходят вследствие
соответствующих по энергии соударений молекул окружающей среды с
микроорганизмами.
Воздействие
температуры среды на жизнедеятельность микроорганизмов можно представить
следующим образом. Микроорганизмы, размеры которых сравнимы с размерами молекул
среды, находятся в постоянном взаимодействии с ними. Каждое взаимодействие
микроорганизма с таким крупным телом, как молекула окружающей среды,
существенно влияет на его дальнейшую жизнедеятельность. Оно может привести и к
активации, и к инактивации микроорганизма.
Изменение
температуры среды однозначно связано с изменением скорости осциллирующего
движения молекул (амплитуды их колебаний). Повышенные скорости их движения
вызывают передачу микроорганизмам чрезмерно большой энергии соударений, что
связано с их инактивацией или гибелью. Понижение скорости осциллирующего
движения молекул (уменьшение амплитуды колебаний) также вызывает увеличение
энергии соударений с микроорганизмами, но только до максимального уровня,
соответствующего соударениям движущихся микроорганизмов с менее подвижными
молекулами среды. Энергия таких соударений вызывает только инактивацию
микроорганизмов.
Уровни
температурных (энергетических) воздействий, при которых происходят характерные
переходы активности микроорганизмов от инактивации к активной жизнедеятельности
и далее - к гибели, различны для спорообразующих (покрытых оболочкой) и
неспорообразующих микроорганизмов.
Аррениусовскую
зависимость можно применять только в диапазоне температур, ограниченном снизу
максимальной температурой ферментации, а сверху - температурой начала
инактивации.
Скорость
процессов ферментации в реальных условиях определяется штаммом микроорганизмов,
составом среды, степенью перемешивания, температурой.
Оборудование
для ферментации. Для организации ферментативных реакций используют ферменторы:
чаны-реакторы с мешалками; барботажные колонны и петлевые ферменторы.
Работа
ферментора состоит в создании тесного контакта субстрата и фермента путем
перемешивания, а также в удалении теплоты ферментации. При аэробной ферментации
он обеспечивает поступление воздуха к реагирующим молекулам, для чего
снабжается аэрационным устройством. Рабочая камера ферментора должна быть
стерильной, конструкция должна предупреждать попадание в него нежелательных
микроорганизмов и фагов (вирусов и других микроорганизмов, уничтожающих
ферменты). Образование завихрений и больших градиентов скоростей нежелательно.
Экстракция
жидкостная. Экстракция - метод извлечения вещества из раствора или сухой
смеси с помощью подходящего растворителя. Для извлечения из раствора
применяются растворители, не смешивающиеся с этим раствором, но в которых
вещество растворяется лучше, чем в первом растворителе.
Экстракция может быть разовой (однократной или многократной) или
непрерывной (перколяция).
Простейший способ экстракции из раствора - однократная или многократная
промывка экстрагентом в делительной воронке. Делительная воронка представляет
собой сосуд с пробкой и краном для слива нижнего слоя жидкости. Для непрерывной
экстракции используются специальные аппараты - экстракторы, или перколяторы.
Для извлечения индивидуального вещества или определённой смеси из сухих
продуктов в лабораториях широко применяется непрерывная экстракция по Сокслету.
В лабораторной практике химического синтеза экстракция может применяться
для выделения чистого вещества из реакционной смеси или для непрерывного
удаления одного из продуктов реакции из реакционной смеси в ходе синтеза.
Для
характеристики экстракционном разделения двух веществ используют коэффициент
разделения 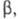 численно равный отношению соответствующих
коэффициенту распределения этих веществ (обычно большего к меньшему) в
экстракте и рафинате:
численно равный отношению соответствующих
коэффициенту распределения этих веществ (обычно большего к меньшему) в
экстракте и рафинате:
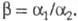
Факторы,
влияющие на экстракционном разделение, многочисленны и определяются не только
закономерностями экстракционном равновесия, но и способом организации процесса.
Например, при однократном контакте фаз наилучшее разделение двух компонентов в
состоянии равновесия достигается при максимальном различии их степеней
извлечения. Для практической реализации разделения при многоступенчатой
противоточной жидкостная экстракция бывает достаточно 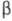 = 1,5-2,0[7].
= 1,5-2,0[7].
2.
ТЕХНОЛОГИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ
.1
Биологически активные вещества водорослей и трав
Агар.
Агар (сульфитированные галактогликаны) представляет собой смесь полисахаридов
агарозы и агаропектина. Агар содержится в красных водорослях, из которых его
получают в промышленности. Важнейшим источником агара является анфельция
(Ahnfeltia plicata). Значительное количество технологий (и их модификаций)
получения агара обусловлено разнообразием агаровых производств.
Пищевой
и микробиологический агар. Перед варкой анфельцию замачивают в щелочном
(известковом) растворе с содержанием оксида кальция 1-2 % при соотношении от
1:12 до 1:15. При этом происходит расщепление коркового слоя водоросли, ее
набухание, и, как следствие, увеличивается выход целевого продукта.
Продолжительность замачивания 20-24 ч, Затем известковый раствор сливают, а
анфельцию промывают. Процесс проводят в моечных чанах в периодически сменяемой
воде или в машинах непрерывного действия. Промытую анфельцию варят в
известковом растворе в закрытых аппаратах (автоклавах, прессбойлерах) или
открытых аппаратах (диффузорах). Во время варки извлекается агар при pH не ниже
8. Полноту извлечения агара обеспечивают созданием оптимальных условий процесса
(продолжительность и кратность варок, соотношение между массой водорослей и
раствором, гидромодуль, температура раствора и др.)
Рисунок
4. - Производство пищевого и микробиологического агара
Извлечение
агара из анфельции производят в батарее из трех автоклавов семикратной варкой
по принципу противотока. Готовым к сливу считают навар первой варки с
прочностью студня не менее 500 г по прибору Валента. Остальные навары
перекачивают по батарее. (На первую варку направляют навар от второй варки без
добавления известкового раствора. При второй, третьей и четвертой варках к
наварам добавляют известковый раствор. При пятой, шестой и седьмой варках
добавляют горячую воду). Общий расход извести на варку (в пересчете на активный
оксид кальция) составляет 8-9 % от массы кондиционной анфельции. Процесс
ведется при избыточном давлении 14,4- 102 Па и температуре 120-126
°С. Полный цикл автоклава составляет 29 ч. Слив навара из батареи производят
каждые 9-10 ч. Объем сливаемого навара го одного автоклава 10 м3.
Водорослевый остаток после седьмой варки выгружают, автоклав зачищают. В
водорослевом остатке оценивают содержание агара и обрабатывают отдельно. Затем
в навароотстойнике навар отстаивается 4 ч при температуре поступающего навара
не ниже 90 °С. Отстоянный навар направляют на сепарирование. В зависимости от
условий варки и качества анфельции очищенный водорослевый навар содержит
3,1-4,7 % сухих веществ, в том числе 2,5-2,9% органических и 0,6-1,8%
минеральных. В органических веществах собственно агар составляет 0,7-1,2%. В
составе неагаровых органических веществ преобладают окрашенные продукты
щелочного гидролиза полисахаридов и белковых веществ. Охлаждают навар до 60 “С
проточной водой с целью превращения его в студень. Охлажденный навар подают в
желировочный аппарат. Желирование навара осуществляют при непрерывной подаче
рассола, циркулирующего в зарубашечном пространстве и имеющего температуру на
входе в аппарат 0...-8 °С. Продолжительность желирования не менее 2 ч, после
его завершения студень измельчают и подают на промывку. Промывают с целью
удаления из студня неагаровых примесей, используя воду с температурой 18-20 °С.
Соотношение студня и воды при промывке составляет 1:2,0-2,5 при кратности
промывок 15-19. Процесс занимает 30-36 ч. Заканчивают его при достижении
полного обесцвечивания студня. Затем студень направляют в баки-отцеживатели,
где происходит отекание воды в течение 2-4 ч. Концентрация агара в студне при
этом достигает 0,6-0,8 %. Промытый и освобожденный от избытков воды студень
подают в реакторы плавления для получения раствора агара с температурой 85-90
°С, сепарируют, обрабатывают на двухступенчатой вакуум-выпарной установке с
целью концентрирования до 2-2,5 % агара и подают на сушку в распылительные
сушилки, предварительно пропуская через спаренную установку пластинчатых
фильтров для удаления нерасплавившихся кусочков студня и механических включений.
Температура сушки 160-170 °С. Готовый агар подают на вибросито для просеивания,
упаковывают, маркируют и направляют на хранение.
Агар
издавна и широко применяется в пищевой промышленности при производстве
различных продуктов (кондитерских изделий, мороженого, соков, пива, соусов,
желе, супов и т.д.). Его используют в качестве стабилизатора при производстве
майонеза, щербетов, помадок и других кондитерских изделий. В микробиологии агар
необходим для приготовления питательных сред (например, мясопептонный агар), в
медицине и фармакологии - в качестве стабилизатора эмульсий и суспензий
лекарственных веществ, разрыхляющего (в сухом виде) и склеивающего (в виде
раствора) вещества при производстве таблеток, антикоагуляционных средств.
Входит агар в виде основы в состав мазей, является компонентом пластырей,
суппозиториев и пилюль. Способность агара стабилизировать дисперсные системы
используется при изготовлении косметических продуктов (кремов, теней, пудры,
помады и др.). Агар ингибирует рост и развитие многих вирусов. При приеме
внутрь агар оказывает слабительный эффект, особенно при хронических запорах.
Студни агара уменьшают болевые ощущения и ускоряют образование эпителия на
ранах и ожогах. Также используются в офтальмологии для создания прозрачных глазных
пленок, применяющихся при введении разнообразных лекарственных средств в
конъюнктиву глаза.
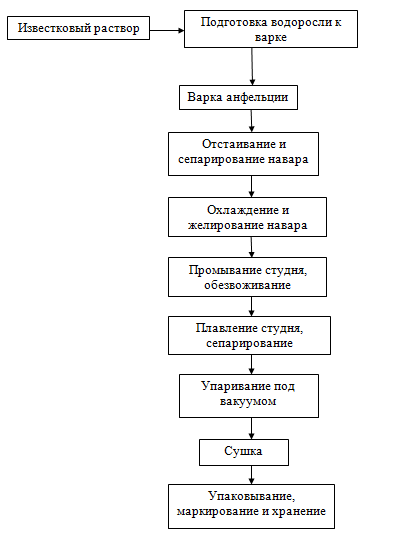
Каррагинан
- это полисахарид, содержащийся в водорослях Chondrus crispus, С. ocellatus,
Eucheuma spinosum и др. От агара он отличается тем, что содержит только D-галактозу.
Содержание каррагинана в сухих водорослях достигает 55-80%. Процесс получения
каррагинана начинается с промывания водорослей проточной водой. Варку
водорослей проводят с целью удаления солей при кипении массы. Соотношение
водоросли и воды составляет 1:100. Затем массу центрифугируют, отделяя жидкую
фазу. Очищают раствор каррагинана многократной обработкой его активированным
углем. При этом удаляются посторонние включения. Концентрирование раствора
каррагинана до 0,8 -2,0% сухих веществ осуществляют под вакуумом, затем раствор
сушат в барабанных сушилках.
Рисунок
7. - Технологическая схема производства каррагинана
Высушенный
каррагинан измельчают, упаковывают и хранят так же, как и агар. Полученный
продукт имеет вид порошка белого цвета, хорошо растворим в горячей воде. Гели
каррагинана менее прочные, чем гели агара и агароида, что объясняется
содержанием в нем сульфатных групп.
Так
же как и другие полисахариды, каррагинан находит самое широкое применение в различных
отраслях промышленности. Наиболее перспективно его применение в медицине, так
как он обладает противовирусным и антикоагуляционным действием. Особенно ярко
выражены антиульцерогенные (противоязвенные) свойства каррагинана. Можно
использовать каррагинан в пищевой промышленности для приготовления кулинарных
изделий, желе, мороженого, майонеза и др. Находит каррагинан применение в
производстве красителей в качестве стабилизатора пигментов, в текстильной
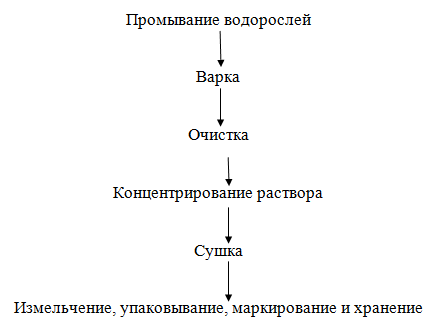
промышленности для шлихтования тканей. Ламинарин. Он, являясь депозитным
углеводом, играет в водорослях роль энергетического резерва клеток, как крахмал
в наземных растениях. Ламинарин существует в двух формах, близких по
химическому составу, но отличающихся по способности растворяться в холодной
воде (нерастворимый - самопроизвольно осаждающийся в холодной воде, и
растворимый - растворяющийся в холодной воде и осаждающийся при добавлении
спирта). Обе формы ламинарина содержат 2,4-3,7% маннита. Ламинарин состоит из
двух компонентов: ламинарозы и ламинарата, различающихся по содержанию
шестиатомных спиртов.
Сырьем
для его производства являются ламинарии, заготавливаемые в свежем или сушеном
виде. При получении растворимой в воде формы ламинарина высушенные водоросли
измельчают и обрабатывают холодным 0,09 н раствором хлористоводородной кислоты
в течение 2 ч, затем жидкую часть отделяют центрифугированием, и водорослевый
остаток повторно обрабатывают 0,05 н раствором хлористоводородной кислоты.
Жидкую часть отделяют и смешивают с жидкой частью, полученной ранее, затем
фильтруют и смешивают с этиловым спиртом до получения 85%-й концентрации
(осаждение ламинарина). Осадок отделяют фильтрованием, промывают спиртом и
эфиром и высушивают на воздухе. Выход ламинарина - сырца составляет 70 % массы
осадка.
Очистку
ламинарина от сопутствующих примесей проводят, растворяя осадок в воде с
последующей хроматографией на колонке. Элюированный ламинарин осаждают хлоридом
натрия, получая высокоочищенный продукт, который отделяют центрифугированием и
высушивают в вакууме.
Рисунок
9. - Технологическая схема получения растворимого в воде ламинарина
При
получении нерастворимого в воде ламинарина свежезаготовленные водоросли
обрабатывают 0,09 н раствором соляной кислоты при температуре 70 °С в течение
30 мин. Водорослевый остаток отделяют фильтрованием и промывают горячей водой.
Затем объединяют кислую фракцию и промывные воды, перемешивают в течение 3 ч и
отстаивают 3 суток. Выпавший осадок отделяют центрифугированием, промывают
спиртом и эфиром. При обработке сухих водорослей экстракцию ламинарина проводят
при температуре окружающей среды с добавлением 0,15% формальдегида. Затем
отделяют ламинарин, нейтрализуют, промывают холодной водой и очищают
перекристаллизацией из 10%-го водного раствора.
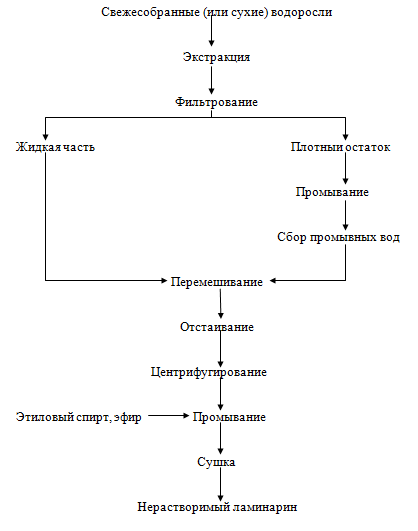
Рисунок
10. - Технологическая схема получения нерастворимого в воде ламинарина
Ламинарин
представляет собой порошок белого или кремового цвета без запаха и вкуса.
Ламинарин оказывает ингибирующее действие на рост и развитие вирусов.
Этерифицированный ламинарин обладает свойствами антикоагулянта, удлиняет время
свертывания крови, понижает содержание липидов, в том числе холестерина, в
сыворотке крови.
Зостерин.
Морские травы (зостера, филлоспадикс), запасы которых представляют промышленный
интерес, могут быть использованы для получения ряда продуктов, находящих самое
широкое применение в различных отраслях производства. В состав органических
веществ входят клетчатка, азотистые вещества, растворимые в спирте (хлорофилл),
и растворимые в эфире вещества.
Зостера
представляет большой интерес как сырье для получения зостерина (пектина),
имеющего формулу 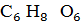 и на 90-95 % представленного смесью
полигалактуроновых и полигалактуроновых кислот. Имея в составе молекулы
свободные карбоксильные группы, он образует соли - зостераты. Технологическая
схема производства зостерина приведена на рисунке 11.
и на 90-95 % представленного смесью
полигалактуроновых и полигалактуроновых кислот. Имея в составе молекулы
свободные карбоксильные группы, он образует соли - зостераты. Технологическая
схема производства зостерина приведена на рисунке 11.
Для производства зостерина используют свежезаготовленную морскую траву
зостеру (Zostera marina, Zostera папа и Zostera pacifica). Траву скашивают на
зарослях и транспортируют к месту переработки. Допускается хранение зостеры в
течение 10 дней в проточной морской или пресной воде.
Для производства зостерина сырье измельчают до частиц размерами не более
10 см и промывают в пресной воде для удаления механических примесей.
Измельченную траву загружают на 2/3 объема в нержавеющую емкость, снабженную
паровой рубашкой для обогрева и нижним сливом, и заливают пресной водой до 0,8
объема емкости. Гидролиз ведут 3 ч при 50±2°С при перемешивании, поддерживая pH
3-4 добавлением соляной кислоты. В водный раствор переходят манозы (12-13%) и
дисахара (8-9%), из которых сбраживанием получают 6-7% этилового спирта. После
гидролиза массу промывают водой до нейтральной реакции промывных вод. Остаток
заливают равным по объему количеством 1%-го раствора щавелевокислого аммония и
проводят экстракцию в течение 3 ч при температуре 70 °С и периодическом
перемешивании.
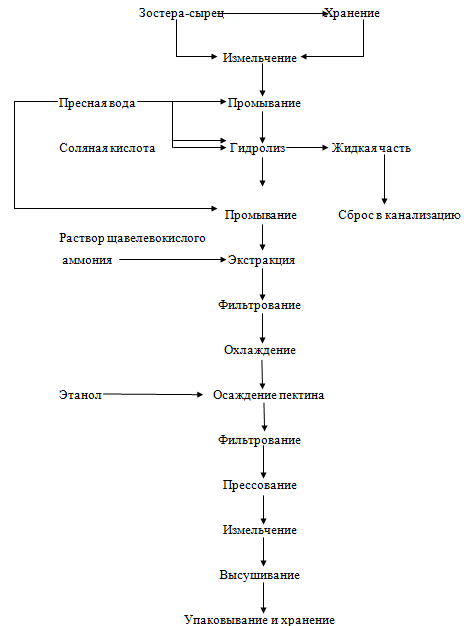
Рисунок 11. - Технологическая схема производства зостерина
Готовый экстракт сливают, фильтруют через 2 слоя бязи и охлаждают до
комнатной температуры. Затем к экстракту добавляют двойной объем этанола.
Полученный осадок зостерина отделяют от водно-спиртового раствора
фильтрованием, подпрессовывают с целью отделения излишков воды, измельчают в
порошок на шнековой мясорубке и сушат любым способом при температуре не выше 60
°С до содержания воды не более 12%, расфасовывают в пакеты из пленочных
материалов. Хранят зостерин при температуре не выше 30 °С и относительной
влажности воздуха не более 85 %. Готовый продукт представляет собой порошок от
желтовато-коричневого до светло-коричневого цвета, массовая доля зостерина в
пересчете на полигалактуроновую кислоту должна составлять не менее 60%,
кинематическая вязкость 1%-го раствора - не менее 6,0 мм2/с.
Коллоидные свойства зостерина и его солей (зостератов аммония, калия и
натрия) позволяют использовать их в качестве стабилизаторов, загустителей и
желирующих добавок при приготовлении пищевых продуктов. На основании зостерата
натрия получают прозрачные пленки.
.2 Биологически активные вещества рыб и млекопитающих
Ферментные препараты. Пилорические придатки различных видов рыб (трески,
макрели, морского окуня) давно известны как источники протеолитических
ферментов, получаемых в виде общих протеолитических комплексов. Одним из
примеров служит ферментный препарат «Океан», технология производства которого
разработана АтлантНИРО и успешно реализована в производственных условиях для
приготовления целого ряда деликатесных рыбных продуктов из плохо созревающих
видов рыб (например, пресервов из ставриды), и препарат протеолитических
ферментов, технология которого разработана в ТИНРО-центре. Сырьем для
производства препарата протеолитических ферментов служат внутренности рыб,
обладающих достаточно высокой протеолитической активностью (скумбрия, ставрида,
иваси, лососи дальневосточные, сельдь тихоокеанская, сайра).
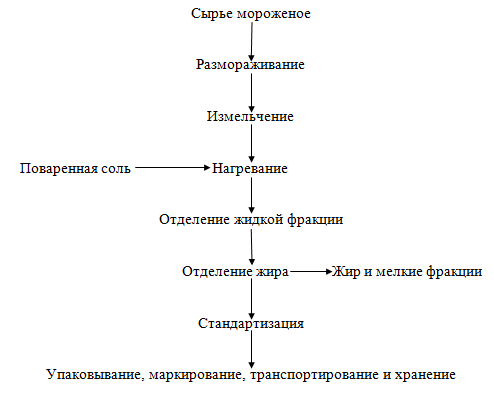
Рисунок 14. - Технологическая схема получения препарата протеолитических
ферментов
активный
морской майонез рецептура
Для производства ферментного препарата используют мороженое или соленое
сырье. Размораживание производят на воздухе до температуры -10. . .-15 °С.
Размороженные или соленые внутренности измельчают до частиц размерами 8-12 мм и
направляют в подогреватель (аппарат, оснащенный водяной рубашкой и мешалкой).
При использовании мороженого сырья добавляют 10-12% поваренной соли к массе
обрабатываемого сырья и нагревают. Процесс ведут при перемешивании до
достижения температуры в массе 35-38 °С и подают на горизонтальную центрифугу
для отделения жидкой фракции (ферментного препарата) из гомогената
внутренностей. Дальнейшую обработку ферментного препарата проводят на
сепараторе. При этом отделяют жир и мелкие белковые частицы. В очищенном
ферментном препарате определяют протеолитическую активность (при pH 5,5±0,2 не
менее 0,6; при pH 7,2+0,2 не менее 2 ед./г). Для получения большей активности
препарата добавляют поваренную соль (стандартизация).
Готовый препарат фасуют, маркируют и хранят в течение 3 мес. при
температуре от 0 до -8 °С или б месяцев при температуре -12.. .-18 °С.
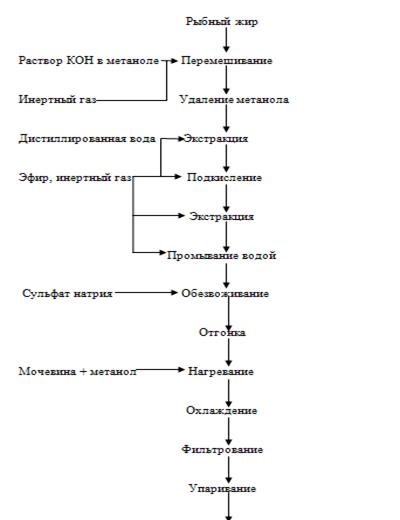
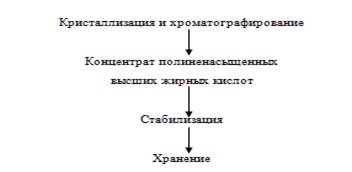
Рисунок 15. - Технологическая схема получения арахидоновой кислоты
Препарат протеолитических ферментов используют для ускорения ферментного
гидролиза белковых веществ при получении рыбных гидролизатов, белковых паст, а
также для ускорения процесса созревания соленой продукции и пресервов.
Арахидоновая кислота. Важнейшими из полиненасыщенных высших жирных кислот
липидов рыб являются арахндоновая, эйкозапентаеновая и докозагексаеновая.
К рыбному жиру, полученному любыми известными способами, добавляют 40%-й
раствор КОН в метаноле. Обработку ведут в токе инертного газа при температуре
окружающей среды и при постоянном перемешивании массы в течение 2-3 ч. После
завершения процесса метанол удаляют до 1/3 первоначального объема. К оставшейся
массе добавляют двойное количество дистиллированной воды и проводят экстрагирование
неомыляемых веществ эфиром, насыщенным дистиллированной водой и инертным газом.
Подкисление производят 5 н серной кислотой под слоем эфира в токе
инертного газа и при охлаждении до pH 3,0 и трижды экстрагируют равными
объемами эфира, насыщенного инертным газом. Затем эфирные вытяжки объединяют и
промывают водой, насыщенной эфиром и инертным газом, до нейтральной реакции и
обезвоживают сульфатом натрия. Полученный продукт освобождают от эфира
(отгонкой) и получают концентрат ненасыщенных высших жирных кислот, содержащий
2-4% арахидоновой кислоты. Дальнейшая обработка заключается в добавлении
мочевины и метанола, нагревании смеси при температуре 45 °С до растворения
мочевины, охлаждении до 4 °С и выдерживании при этой температуре в течение 6 ч.
Далее проводят фильтрацию и упаривание фильтрата, содержащего ненасыщенные
полиеновые кислоты и освобожденного от комплекса насыщенных и моноеновых кислот
с мочевиной, низкотемпературную кристаллизацию и хроматографирование.
Полученный концентрат содержит около 10% арахидоновой кислоты. Все
операции проводят в среде инертного газа. Арахидоновую кислоту хранят в
стеклянных емкостях из темного стекла, герметически укупоренных, в среде
инертного газа при температуре -20 °С в течение 6 мес. Полученные
полиненасыщенные высшие жирные кислоты используют в медицине, ветеринарии,
животноводстве, птицеводстве и звероводстве. Иммуностимулятор. Для получения
иммуностимулятора молоки лососевых размораживают, измельчают, заливают
дистиллированной водой (1:6) с добавлением хлорида цинка и перемешивают. Затем
добавляют уксусную кислоту и проводят экстрагирование в течение 24-48 ч при
комнатной температуре и периодическом перемешивании. Очистку проводят следующим
образом. Экстракт центрифугируют при 315,8 рад/с в течение 40 мин. Осадок не
используют, а центрифугат фильтруют последовательно через мембранные фильтры с
размерами пор 0,8; 0,45; 0,22 мкм. К фильтрату добавляют 0,9%-й раствор хлорида
натрия (1:4) и проводят диа- и ультрафильтрацию экстракта на полых волокнах с
пределом разделения 5000 Д. Очищенный экстракт концентрируют до содержания 0,5
мг белка в 1 мл, подвергают стерилизующей фильтрации на мембранных фильтрах,
разливают во флаконы или ампулы и проводят лиофильное высушивание.
В результате получают нетоксичный, стерильный, апирогенный препарат для
инъекций. Выход целевого продукта составляет 0,12% массы сырья, поступившего на
обработку. Препарат, полученный из молок лососевых, представляет собой порошок
белого цвета, содержит комплекс полипептидов и белков с молекулярной массой
5000-20000 Д. Используется в медицине и медицинской промышленности. Обладая
иммуномодулирующей активностью в дозе 0,01-0,1 мг на 1 кг массы, может быть
использован как иммуностимулятор.
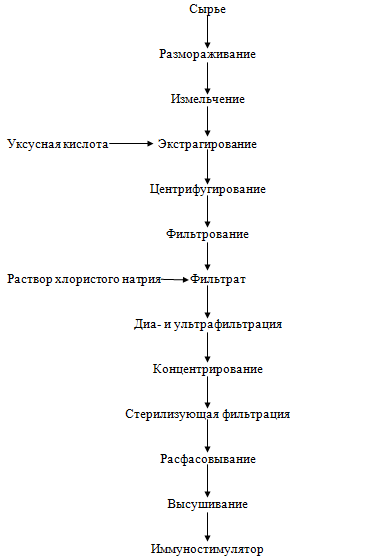
Рисунок 16. - Технологическая схема получения иммуностимулятора из молок
лососевых
Инсулин. Основным источником получения инсулина является поджелудочная
железа крупного рогатого скота. Потребность в инсулине вследствие расширения
сферы его применения (лечение сахарной болезни, шизофрении, истощения,
пневмонии и др.) растет, что влечет необходимость изыскания новых источников
сырья для его производства. Таковым может служить рыбное сырье. Впервые
сведения о получении инсулина из рыб появились в литературе в 1924 г. Наиболее
богатым источником инсулина являются голубые тунцы, инсулярный аппарат которых
содержит инсулина в 40 раз больше, чем ткани крупного рогатого скота. В
поджелудочной железе акул содержание инсулина составляет 2-3 ед./г. Выделение
инсулина из рыбного сырья значительно проще в технологическом отношении, чем из
тканей наземных животных. Для получения инсулина рыбу разделывают, извлекают
тельца Станиуса, которые погружают в насыщенный раствор пикриновой кислоты, и
оставляют на несколько дней для фиксации инсулинсодержащих компонентов. В
дальнейшем раствор пикриновой кислоты отфильтровывают, а плотный остаток
тщательно растирают и обрабатывают 70%-м ацетоном с целью экстрагирования
пикрата инсулина и сопутствующих ему пикратов других белков. Затем к массе в
избытке добавляют ацетон, образовавшийся осадок растворяют разбавленной
хлористоводородной кислотой, доводят pH до 5,5 (изоэлектрическая точка инсулина
рыб). При отстаивании в осадок выпадает инсулин с активностью 14 ед./мг.

Рисунок 16. - Технология производства инсулина из рыбного сырья
2.3 Биологически активные вещества беспозвоночных
Коллагеназа. Сырьем для производства коллагеназы служит свежий или
мороженый гепатопанкреас - печень крабов (камчатского, стригуна).
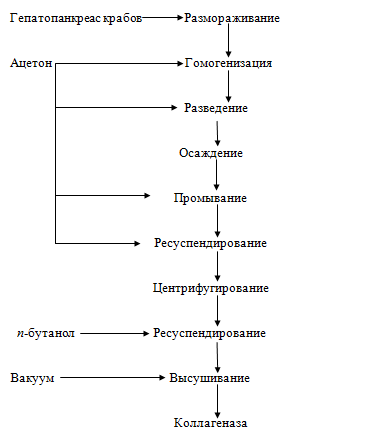
Рисунок 17. - Технологическая схема получения коллагеназы
Для получения фермента сырье гомогенизируют 8-12-кратным объемом ацетона.
Гомогенизат гепатопанкреаса охлаждают до температуры 15...-20 °С, разводят
двойным количеством ацетона, осаждают, осадок декантируют, промывают
охлажденным до -20 °С ацетоном, ресуспендируют в 10 объемах ацетона и
центрифугируют при скорости вращения 12000 с-1 20 мин и температуре
-20 °С. Осадок ресуспендируют в 10 объемах n-бутанола с целью удаления липидов
и центрифугируют. Осадок промывают охлажденным ацетоном для очистки целевого
вещества от n-бутанола и центрифугируют. Полученный осадок (коллагеназу)
высушивают под вакуумом при -20 °С в течение 10-12 ч. Хранят препарат при
температуре -20 °С.
Препарат коллагеназы представляет собой желтоватое вещество с удельной
активностью 93-106 ед. на 1 мг препарата, он находит применение при обработке
коллагенсодержащего сырья (например, для снятия кожицы кальмара при
производстве натуральных консервов, при обработке ястыков).
Ганглиин. Технологическая схема получения ганглиина разработана в
ТИНРО-центре. Замороженные ганглии кальмара размораживают на воздухе до
температуры в центре блока -4 °С, измельчают до частиц размерами не более 4 мм
и направляют на экстракцию целевого вещества раствором уксусной кислоты.
Процесс ведут при температуре окружающей среды и перемешивании массы.
Продолжительность процесса составляет до двух суток. После завершения обработки
сырья уксусной кислотой проводят разделение фракций центрифугированием,
фильтрованием или иным известным способом, жидкую часть обрабатывают ацетоном с
целью осаждения целевого вещества. Процесс ведут при перемешивании. Полученный
осадок отделяют и промывают ацетоном, выдерживают в течение нескольких часов
для удаления излишков ацетона и высушивают до содержания воды не более 15 %.
Высушенный полуфабрикат растворяют в дистиллированной воде, взвешенные частицы
отделяют, оставшийся раствор замораживают и направляют на сублимирование до
содержания воды в готовом продукте (ганглиине) не более 10%. Готовый продукт
расфасовывают и хранят при температуре 6 °С в течение 3 лет.
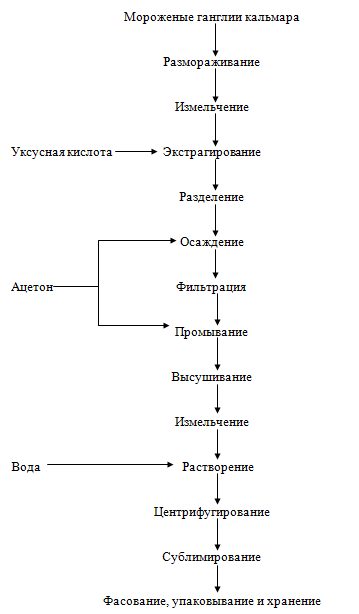
Рисунок 18. - Технологическая схема получения ганглиина
Полиненасыщенные высшие жирные кислоты. Сырьем для получения
эйкозапентаеновой и докозапентаеновой кислот могут служить мелкие ракообразные,
например антарктический криль. Сырье измельчают и обрабатывают охлажденным до 0
°С хлороформом. Полученный экстракт высушивают, добавляя безводный сульфат
натрия, затем растворитель удаляют в вакууме, получают липиды, содержащие
11,5-13,0 % кислот С2о:5 и С22-.б, которые загружают в
реактор с обратным холодильником и подвергают щелочному гидролизу раствором КОН
в этиловом спирте при перемешивании. Продолжительность обработки - один час при
температуре 80 °С. Затем избыток спирта отгоняют, экстракт охлаждают до 30 °С и
нейтрализуют раствором серной кислоты до pH 1,0. При дальнейшей обработке
температуру массы понижают до 70-75 °С, образовавшийся прозрачный слой жирных
кислот отделяют от водного слоя и добавляют двойной объем этилового спирта, а
также смесь равных количеств концентрированной серной кислоты и этанола.
Этерификацию проводят при температуре 80 °С в течение 2,5 ч при перемешивании.
Далее отгоняют спирт, экстрагируют этиловые эфиры жирных кислот петролейным
эфиром, промывают их насыщенным раствором гидрокарбоната натрия до нейтральной
реакции промывных вод, высушивают безводным сульфатом натрия и отгоняют
растворитель. Полученные этиловые эфиры жирных кислот растворяют в ацетоне и
дважды кристаллизуют при температуре -30 °С, отделяют фильтрат и излишки
растворителя. Продукт подвергают разгонке в глубоком вакууме, выделяя фракцию,
перегоняющуюся при температуре 191-210°С, т.е. концентрат эйкозапентаеновой и
докозагексаеновой кислот. Содержание этих кислот в продукте достигает 86-92%.
Хитин. Выделение хитина из хитинсодержащего сырья сводится практически к
удалению сопутствующих ему белковых веществ и минеральных солей путем обработки
сырья разбавленными растворами кислот и щелочей. В качестве кислотного реагента
чаще всего используется соляная кислота, щелочного - едкий натрий. Очередность
обработки сырья кислотой и щелочью может быть различной. Существуют способы
выделения хитина, при которых сырье вначале обрабатывается раствором щелочи для
удаления белковых веществ, затем раствором кислоты - для удаления минеральных
солей. Другие методы предусматривают обратный порядок обработки сырья.
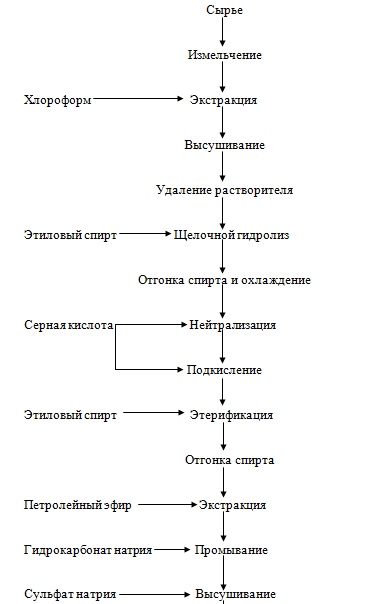
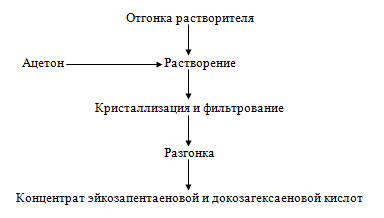
Рисунок 19. - Технологическая схема получения эйкозапентаеновой и
докозагексаеновой кислот
Известна модификация методов выделения хитина, предусматривающая
многократную, чередующуюся обработку хитинсодержащего сырья кислыми и щелочными
агентами. Хитин можно выделить и другими способами, например с использованием
протеолитических ферментов, действующих в кислой среде, при этом одновременно
удаляются белки и минеральные вещества. Выбор очередности обработки сырья
определяется его видом. Обработку сильно минерализованного сырья, например
панцирей крабов, целесообразно начинать с воздействия кислоты. При этом
предварительная деминерализация сырья создает условия для свободного доступа
раствора щелочи к белкам, что способствует наиболее полному их удалению.
Обработку сырья, в котором значительную часть составляют белковые вещества,
рекомендуется начинать с щелочного гидролиза. Деминерализацию обычно проводят
при температуре окружающей среды во избежание возможной деструкции полимерной
цепи хитина. Продолжительность операции зависит от вида обрабатываемого
хитинсодержащего сырья и условий проведения процесса (от 0,5 до 24 ч). Удаление
белковой части проводят при температуре, близкой к 100 °С, растворами щелочей
различных концентраций (от 2 до 10%). Продолжительность процесса определяется
видом обрабатываемого сырья и условиями проведения процесса и составляет около
2 ч. Увеличение скорости деминерализации и депротеинизации достигается за счет
перемешивания обрабатываемого материала. В настоящее время способы получения
хитина отличаются очередностью обработки сырья кислотными и щелочными агентами,
кратностью обработок и режимами деминерализации и депротеинизации. Для
получения хитина по технологии, например, Дальрыбвтуза могут быть использованы
различные виды хитинсодержащих отходов. Отходы переработки антарктического
криля обрабатывают вначале щелочью, затем кислотой.
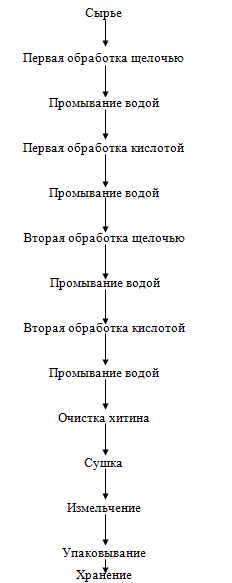
Рисунок 20. - Технологическая схема получения хитина
При первой обработке щелочью удаляется основная масса белка из панциря.
Процесс ведется в специальных емкостях из материалов, способных противостоять
химической коррозии и имеющих зарубашечное пространство для подачи пара.
Аппараты оснащены мешалками и фильтрующими приспособлениями для отделения
растворов реагентов и промывных вод. Загружают сырье через люк в верхней части
аппарата. Одновременно в емкость подается 4%-й раствор щелочи, и масса
перемешивается. Соотношение массы сухих отходов и щелочи 1:5. Процесс ведут в
течение 60 мин при температуре 95-100 °С при постоянном перемешивании. Затем
щелочной гидролизат отфильтровывают и отстоявшуюся массу панциря пятикратно
промывают пресной водой до нейтральной реакции промывных вод (соотношение массы
панциря и промывных вод 1:20, продолжительность одной промывки 5 мин). Промытую
массу обрабатывают 4%-м раствором соляной кислоты с целью удаления основного
количества минеральных веществ (соотношение массы панциря и раствора 1:15).
Обработку кислотой производят в течение 30 мин при температуре окружающей среды
и при периодическом перемешивании. Затем удаляют соляно-кислый гидролизат
фильтрованием через сетчатый фильтр аппарата в течение 15-20 мин. После этого
массу промывают пресной водой до нейтральной реакции промывных вод (соотношение
массы панциря и промывных вод 1:20, кратность промывок - 5, продолжительность
одной промывки - 5 мин). Излишки воды отделяют через фильтр аппарата в течение
16-20 мин. Повторные обработки щелочью и кислотой проводят аналогично первым с
целью более полного удаления белков и минеральных веществ. Воду отделяют
центрифугированием массы в течение 5-10 мин, после чего готовый продукт сушат
при температуре не более 100 °С в ленточных или камерных сушилках различных
типов, оборудованных калориферами для нагрева воздуха и системой принудительной
его циркуляции. Продукт распределяют по ленте сушилки или противням слоем
толщиной не более 20 мм. Содержание воды в хитине после сушки не должно
превышать 10%. Высушенный хитин измельчается до размеров частиц 2-3 мм. При
необходимости, в зависимости от направления использования, хитин дополнительно
очищают от красящих веществ. Для этого хитин после второй обработки соляной
кислотой последовательно обрабатывают 1%-м раствором перманганата калия
(соотношение массы хитина и раствора 1:5, продолжительность обработки 30 мин,
процесс ведут при перемешивании и температуре окружающей среды). После удаления
фильтрацией излишков раствора перманганата калия массу обрабатывают 2 %-м
раствором щавелевой кислоты в течение 30 мин (при обработке соотношение массы
хитина и раствора кислоты составляет 1:5). Затем массу промывают 2%-м раствором
соляной кислоты и отмывают водой до нейтральной реакции. Готовый хитин имеет
белый цвет.
Хитозан. При получении хитозана основной операцией является
дезацетилирование хитина, т.е. удаление ацетильных групп, которое протекает
сравнительно трудно и требует значительных энергетических затрат.
Дезацетилирование должно проводиться в течение минимального времени с целью
сохранения длины полимерной цепи. Хитозан получают путем обработки хитина
горячим раствором натриевой щелочи (от 38 до 50%) в течение нескольких часов
при постоянном перемешивании. Степень дезацетилирования хитина, определяемая
количеством удаленных ацетильных групп, является функцией времени и
регулируется продолжительностью процесса. Характерным показателем величины
степени дезацетилирования является содержание общего азота в полимере. В
недезацетилированном хитине содержится 6,89% азота и 8,7% - в полностью
дезацетилированном хитине. Регулируя этот показатель, можно получать
производные хитина с широким спектром свойств. Получают хитозан путем
дезацетилирования хитина концентрированным раствором натриевой щелочи при
повышенной температуре.
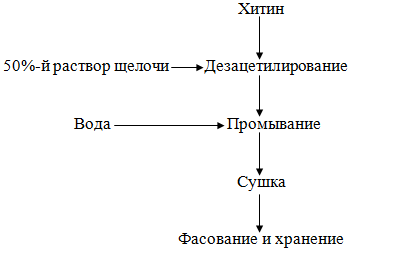
Рисунок 21. - Технологическая схема производства хитозана
Хитин обрабатывают 50 %-м раствором едкого натрия при температуре 100 °С
в течение 30 мин при периодическом перемешивании. После окончания процесса
массу отмывают от щелочи дистиллированной водой до нейтральной реакции
промывных вод и сушат при температуре 60-80 °С до содержания воды в готовом
продукте не более 10%. Затем хитозан измельчают и фасуют.
Хитозан в производстве продуктов питания применяют целенаправленно в
последние 20 лет. Использование хитозана в технологии пищи определяется его
функциональными свойствами и практически полным соответствием требованиям,
предъявляемым к пищевым добавкам. С токсико - гигиеннческих позиций изучен
достаточно полно для обоснования рекомендаций по его использованию как пищевой
добавки с лечебно - профилактическими свойствами. В России допустимая норма
хитозана составляет 0,5% массы продукта. В зависимости от цели хитозан вводится
в состав изделий или используется как технологический фактор.
В технологии формованных изделий хитозан используется как
структурообразующий агент, повышающий значения реологических характеристик
пищевых масс. Хитозан обладает редким свойством соединять в упорядоченную
структуру фрагменты материалов различного влагосодержания - сухих с промежуточной
влажностью и, что особенно ценно, высоковлажных. Раствор хитозана после его
внесения в материал располагается в пространстве между соединяемыми гранулами в
виде сплошного слоя, непрерывность которого со временем нарушается. В связи с
уплотнением геля хитозана и уменьшением его объема между гранулами образуются
пустоты. К концу становления структуры образуется конструкция, связанная
тонкими волокнами и пленками хитозана в монолит требуемой прочности.
Хитозан обладает эмульгирующей способностью при определенных условиях:
содержании полимера, температуре и pH среды, а также способе перемешивания
компонентов. Эмульгирующая способность хитозана возрастает при его сочетании с
анионным полисахаридом агаром, некоторыми белками животного и растительного
происхождения.
Функциональные свойства хитозана как загустителя, адгезива и
пленкообразователя могут быть использованы при обжаривании и бездымном копчении
рыбы. Раствор хитозана повышает вязкость жидкой панировки, придает ей
способность прочно удерживать на поверхности изделия слой сухарей или муки.
Наличие прочного слоя панировки предупреждает излишнее испарение воды из
продукта во время обжаривания, способствует образованию равномерной хрустящей
корочки и сохраняет качество масла, в котором ведется обжарка.
Нанесение смеси коптильного препарата с раствором хитозана на поверхность
рыбы погружным способом перед подсушкой обеспечивает образование у продукта
однородной золотисто-коричневой блестящей окраски.
Факт бактерицидного действия хитозана, установленный для живых
организмов, подтверждается и при хранении различных видов пищевых продуктов.
Наиболее широко показано защитное действие пленок из хитозана, нанесенных на
поверхность плодов и овощей, - яблок, апельсинов, земляники, томатов, перца.
Однородные, гибкие, не дающие трещин хитозановые пленки обладают избирательной
проницаемостью и подобно другим полимерным покрытиям способствуют продлению
срока хранения мороженой рыбы.
Глюкозамин. Глюкозамин относится к производным сахаров, в структурных
формулах которых одна, реже две гидроксильные группы замещены аминогруппой.
Глюкозамин по химической номенклатуре называют 2-амино-2-дезокси-Д-глюкозой и
относят к группе аминосахаров. Из аминоса- харов в тканях рыб и беспозвоночных
обнаружены в основном глюкозамин, галактозамин и маннозамин.
Глюкозамин обладает характерными свойствами аминов. Он является сильным
основанием и легко образует устойчивые соли. В виде оснований глюкозамин
неустойчив, поэтому в практике обычно используют его хлоргидраты. Глюкозамин
проявляет также свойства аминосахаридов, характерные для гидроксильной и
альдегидной групп. Он способен образовывать оксиметилфурфурол - вещество,
являющееся промежуточным соединением реакции покоричневения пищевых продуктов.
Чистые препараты гексозаминов и биополимеры, в состав которых они входят,
обладают биологической активностью и могут использоваться в медицине с целью
диагностирования болезней и контроля за процессами лечения.
В качестве сырья могут быть использованы панцирьсодержащие отходы,
образующиеся при переработке криля, а также панцири различных ракообразных и
гладиус кальмара.
Производство глюкозамина можно разделить на два этапа - получение хитина
и его гидролиз. Гидролитическое расщепление хитина до глюкозамина проводят
концентрированной соляной кислотой при соотношении воздушно-сухого хитина и
кислоты 1:5 и температуре 100 °С в течение 2,5 ч при непрерывном перемешивании.
Полученный гидролизат, имеющий черный цвет, очищают активированным углем - 10 %
от массы хитина. При очистке к раствору добавляют воду в объеме, равном объему
кислоты, и в течение 1 ч тщательно перемешивают при 60 °С. После обесцвечивания
раствор фильтруют через стеклянную вату или воронку Бюхнера. Затем фильтрат
концентрируют упариванием под вакуумом при температуре 50 °С до минимального
объема. Выпавшие кристаллы соляно- кислого глюкозамина промывают 95%-м спиртом
и при соотношении 1:1,5 сушат на воздухе. Выход глюкозамина составляет 60-70 %
массы хитина, взятого для обработки. Для получения более чистого препарата его
подвергают перекристаллизации. Идентификацию полученного вещества проводят по
температуре плавления (210 °С), величине удельного вращения раствора
соляно-кислого глюкозамина (65,4) и хроматографически.
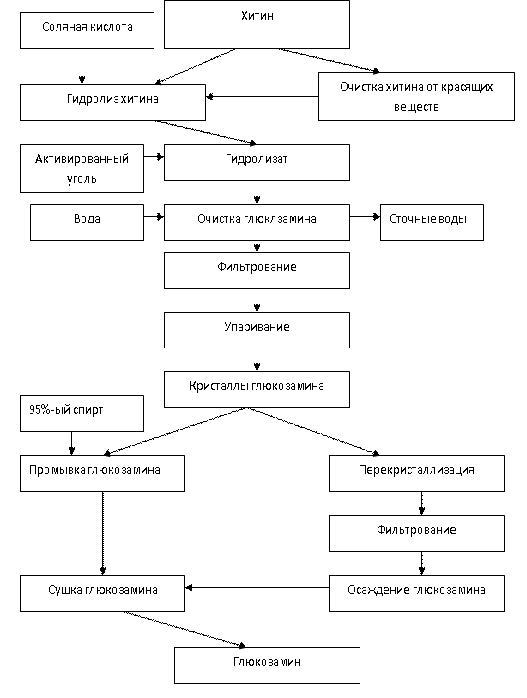

Рисунок 22. - Технологическая схема получения гюкозамина
Митилан. Препарат митилан, выделенный из экстракта мидии, оказывает
влияние на компоненты иммунной системы животных, усиливает фагоцитарную
активность и гуморальные факторы иммунитета. Он может использоваться в
косметической промышленности.
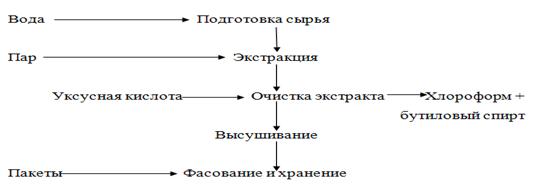
Рисунок 23. - Технологическая схема получения митилана
Для производства митилана (углевод-белкового комплекса из мидии) живых
мидий выдерживают в чистой проточной воде в течение 24 ч с целью очистки от
возможных загрязнений. Затем их заливают водой температурой 50-60 °С и
выдерживают 5-15 мин (в зависимости от вида сырья), после чего воду сливают.
Экстракцию проводят паром в автоклаве в течение 2-3 мин. После этого жидкую
часть (сок) сливают и направляют на дальнейшую обработку для получения
митилана, а мидии поступают на производство пищевых продуктов. Сок охлаждают до
температуры 4-6 °С, фильтруют на нутч-фильтре с целью отделения взвешенных
частиц белка и проводят его очистку путем добавления 50 %-й уксусной кислоты до
pH 7,8-5,5. Образовавшийся осадок отделяют от раствора фильтрованием или
центрифугированием, а жидкую часть очищают от низкомолекулярных примесей,
пропуская через ультрафильтрационную установку или осуществляя диализ. Для
этого экстракт разливают в пакеты из гемодиализной пленки и помещают их в
емкость с дистиллированной водой. Диализ ведут при температуре 4-6 °С в течение
72 ч. Очищенный раствор митилана фильтруют, разливают в кюветы из нержавеющей стали
и высушивают в установке для лиофильной сушки. Готовый продукт - митилан -
расфасовывают в пакеты из полимерных материалов, герметично укупоривают и
хранят при температуре не выше 25°С и относительной влажности воздуха не выше
85%.
3. ФУНКЦИОНАЛЬНЫЕ ПРОДУКТЫ ПИТАНИЯ, ОБОГАЩЕННЫЕ БАВ МОРСКОГО ГЕНЕЗА
.1 Обоснование технологии эмульсионной продукции, обогащенной БАВ
морского генеза
Проблема производства продуктов высокого качества, обогащенных
физиологически ценными веществами с защитными свойствами, перспективным
источником которых являются морские гидробионты и, что в особенности важно,
отходы их переработки, является приоритетной и значимой.
Использование голотурий в мировой практике определяется не только
употреблением их в пищу, но и получением из них ценных химических соединений. В
проблеме поиска новых лекарственных и лечебно-профилактических продуктов,
стимулирующих иммунную систему, голотурии представляют значительный интерес.
japonica - наиболее крупный представитель дальневосточных голотурий. В тканях
кукумарии содержится большое количество макро- и микроэлементов, таких как
магний, кальций, калий, натрий, медь, титан, железо, алюминий, марганец, цинк,
сера, что позволяет полагать, что кукумарию можно рассматривать как пищевой
источник минеральных композиции.
Следует отметить, что, несмотря на значительные промысловые запасы, этот
объект используется недостаточно, хотя на Дальнем Востоке подробно разработана
технология приготовления продуктов из кукумарии.
В процессе получения пищевой продукции из Cucumaria japonica образуется
достаточное количество отходов переработки, содержащих ценный комплекс
биологически активных веществ (тритерпеновые гликозиды и гексозамины) (табл.
1).
Таблица 1. - Химический состав венчика и щупалец кукумарии[9].
|
Вода, %
|
Минеральные вещества, %
|
Общий белок, %
|
Липиды, %
|
Тритерпеновые гликозиды,
мкг/г
|
Гексозамины, мкг/г
|
|
80,8±4,0
|
4,80 ± 0,24
|
11,60±0,58
|
0,80±0,04
|
960 ± 48
|
650,0±32,5
|
Так как при разделке кукумарии около 7 % отходов приходится на щупальца и
венчики, рассматривали возможность получения из них ферментативных гидролизатов
(ФГ), путем подбора рациональных условий гидролиза.
Выбор рациональных условий гидролиза венчика и щупалец кукумарии
осуществляли исходя из максимальной степени гидролиза белков тканей и содержания
сухих веществ в ферментативном гидролизате, с учетом ферментсубстратного
соотношения и продолжительности гидролиза. Процесс осуществляли при комнатной
температуре (21ᵒС) и оптимуме для данного ферментного препарата (45ᵒС).
Использовались следующие ферментсубстратные соотношения: 1 : 2, 1 : 4, 1 : 8
(табл. 2).
Полученные экспериментальные данные показывают, что при ферментативном
гидролизе венчика и щупалец кукумарии происходит разрушение белков и накопление
растворимых веществ в ФГ. Повышение температуры увеличивает степень гидролиза и
накопление растворимых сухих веществ в ФГ.
Так как доказано повышение степени гидролиза при измельчении нативного
сырья, представлялось интересным изучить экспериментально зависимость
накопления сухих растворимых веществ в ферментативном гидролизате от степени
измельчения и времени гидролиза. Кроме того, рассматривалось влияние
используемого гидромодуля (отношения ферментсубстратной смеси и воды) - 1 : 2
(0,5), 1,0 : 1,5 (0,67), 1 : 1 (1), 1,0 :0,5 (2) на накопление растворимых
сухих веществ в ферментативном гидролизате.
Таблица 2. - Влияние различных факторов на процесс гидролиза венчика и
щупалец кукумарии.
|
Ферментсубстратное
соотношение
|
Продолжительность
гидролиза, ч
|
Степень гидролиза, %
|
Массовая доля сухих веществ
в ФГ, %
|
|
|
21ᵒС
|
45ᵒС
|
21ᵒС
|
45ᵒС
|
|
1 : 2
|
4
|
18,4+0,92
|
29,3+1,4
|
2,7+0,13
|
3,8+0,18
|
|
8
|
25,1+1,26
|
38,7+1,9
|
3,9+0,19
|
5,3+0,26
|
|
12
|
41,9+2,10
|
62,1+3,1
|
4,9+0,25
|
6,7+0,33
|
|
16
|
52,3+2,62
|
68,9+3,4
|
6,0+0,3
|
8,4+0,42
|
|
20
|
62,8+3,13
|
79,2+3,9
|
5,8+0,29
|
8,1+0,40
|
|
24
|
68,8+3,44
|
82,1+4,1
|
5,7+0,28
|
7,9+0,40
|
|
1 : 4
|
4
|
13,2+0,66
|
15,2+0,76
|
2,5+0,12
|
3,3+0,16
|
|
8
|
19,3+0,97
|
25,1+1,26
|
3,3+0,16
|
4,9+0,24
|
|
12
|
36,1+1,81
|
45,0+2,25
|
4,5+0,22
|
6,1+0,31
|
|
16
|
45,9+2,29
|
58,7+2,9
|
5,8+0,29
|
7,9+0,39
|
|
20
|
56,4+2,82
|
69,8+3,49
|
5,5+0,28
|
7,6+0,38
|
|
24
|
60,3+3,02
|
73,4+3,67
|
5,3+0,27
|
7,5+0,38
|
|
1 : 8
|
4
|
8,6+0,43
|
15,6+0,8
|
2,1+0,11
|
2,6+0,13
|
|
8
|
13,8+0,69
|
21,3+1,1
|
2,9+0,14
|
3,8+0,19
|
|
12
|
19,2+0,96
|
32,4+1,6
|
3,8+0,19
|
5,2+0,26
|
|
16
|
26,4+1,32
|
41,2+2,1
|
4,6+0,23
|
6,3+0,31
|
|
20
|
33,7+1,69
|
50,8+2,5
|
4,4+0,22
|
6,0+0,30
|
|
24
|
39,1+1,96
|
58,1+2,9
|
4,2+0,21
|
5,9+0,30
|
Для дальнейших исследований по органолептическим показателям и
соотношению массовой доли сухих растворимых веществ и условий гидролиза
перспективным является ферментативный гидролизат полученный из нативного сырья,
измельченного до размера 3-5 мм при ферментсубстратном соотношении 1 : 4,
используемом гидромодуле 1 : 1 и продолжительности гидролиза16-18 ч.
Ферментативные гидролизаты, полученные при более высоком ферментсубстратном
соотношении (1 : 2) имеют темно-коричневый цвет, вязкую консистенцию и запах,
свойственный морепродуктам.
В результате ферментативного гидролиза происходит переход биологически
активных веществ (тритерпеновых гликозидов и гексозаминов) в ферментативный
гидролизат. Основными факторами, влияющими на накопление в ферментативных
гидролизатах тритерпеновых гликозидов и гексозаминов, являются
ферментсубстратное соотношение и продолжительность обработки.
Полученные гидролизаты обогащены биологически активными веществами
кукумарии - содержание тритерпеновых гликозидов составило 558 мкг/ , содержание гексозаминов - 269 мкг/
, содержание гексозаминов - 269 мкг/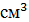 .
.
Полученный ферментативный гидролизат использовали в качестве
соэмульгатора в технологии получения эмульсионного соуса. Экспериментальным
путем определена массовая доля гидролизата в рецептуре майонеза, которая
составила 10 %. Использование бинарного композиционного эмульгатора на основе
обезжиренной соевой муки и ферментативного гидролизата из венчика и щупалец
кукумарии позволило получить эмульсионный продукт с традиционными
органолептическими показателями, обогащенный биологически активными веществами
морского генеза, что позволяет предположить проявление им биологической
активности, свойственной данным соединениям.
3.2 Использование продуктов ферментолиза рыбного сырья в технологии
мучных кондитерских изделий профилактического назначения
Ферментолиз рыбного фарша приводит к распаду белков мышечной ткани рыб до
крупномолекулярных соединений: альбуминов, пептонов, пептидов. Ферментолиз
мышечной ткани рыб способствует приобретению рыбной белковой массой свойств,
необходимых для её использования в качестве наполнителя пищевых продуктов с
целью повышения их биологической ценности.
С помощью автопротеолиза рыбного сырья за счёт частичного расщепления
молекул белков мышечной ткани рыб можно улучшить вкус, аромат и консистенцию
конструируемого продукта и получить белково-минеральный наполнитель (БМН) с
необходимыми свойствами. Исследование процессов биотрансформации при
автопротеолизе рыбного сырья позволит задать профилактическую направленность
производимым продуктам питания.
Использование БМН из мышечной ткани рыб является перспективным
направлением для создания изделий с профилактическими свойствами, так как
рыбный белок содержит все незаменимые аминокислоты, а также такие важные для
организма человека микроэлементы, как кальций и фосфор в усвояемой форме.
В качестве объектов исследования рассматривались морские виды рыб -
путассу, треска, имеющие промысловое значение. В таблице 3 приведен
аминокислотный состав белков мышечной ткани исследованных рыб.
Таблица 3. Аминокислотный состав рыбного сырья, г/100г белка[8].
|
Аминокислота
|
Исследованные рыбы
|
|
треска
|
путассу
|
|
Изолейцин
|
3,76
|
|
|
Лейцин
|
8,39
|
4,02
|
|
Лизин
|
10,26
|
8,54
|
|
Фенилалланин+Тирозин
|
7,77
|
10,38
|
|
Метионин
|
2,73
|
2,387,44
|
|
Треонин
|
3,85
|
4,06
|
|
Валин
|
4,55
|
5,12
|
|
Всего
|
4131
|
41,94
|
По содержанию жира в мышечной ткани данные виды рыб
относятся к тощим, а по содержанию белка - к белковому сырью. Для
технологических исследований имеют значение коэффициент пищевой насыщенности и
степень обводнения белков.
Коэффициент пищевой насыщенности рассчитывали по формуле:
Κ= (Б+Ж+У) : В
где Б, Ж, У, В - содержание соответственно белка, жира, углеводов, воды в
объектах исследования, %.
Расчёт степени обводнения белков осуществляли по формуле:
К= В: Б
где Б, В - содержание соответственно белка и воды в объектах
исследования, %.
Технологические свойства объектов исследования приведены в таблице 4.
Таблица 4. Технологические свойства объектов исследования[8].
|
Объект исследования
|
Химический состав мышечной
ткани, %
|
Выход съедобной части, %
|
Калорийн. съедобной части,
ккал/100г
|
Степень обводнения белков
|
|
вода
|
белок
|
жир
|
Минерал. вещества
|
|
|
|
|
Треска балтийская
|
79,7
|
17,7
|
1,3
|
1,3
|
48,5
|
75
|
4,5
|
|
Путассу южная
|
80,2
|
18,1
|
0,3
|
1,4
|
49, 4
|
72
|
4,4
|
По степени обводнения мясо исследуемых объектов является плотным и
сочным.
Низкий коэффициент пищевой насыщенности у исследуемых объектов
показывает, что их можно причислить к группе низконасыщенных и использовать в
качестве сырья для получения диетической продукции, а также БМН при создании
продуктов нового поколения.
Технология приготовления БМН методом горячего ферментолиза была выбрана
на основе изученных литературных и патентных данных, а также на основании
предварительных экспериментов.
В результате исследований было установлено, что рыбный фарш, полученный
из мышечной ткани путассу и трески, не подвергнутый ферментолизу, имеет
неоднородную консистенцию, в нем выделяются отдельные комочки; этот фарш не
обладает достаточной вязкостью и липкостью, необходимой для однородного замеса
теста. Эксперименты по использованию фарша этих рыб без специальной обработки в
технологии хлебобулочных изделий показали необходимость технологических
решений, которые должны быть направлены на получение белково-минерального
наполнителя с требуемыми свойствами.
По результатам проведенных исследований была установлена оптимальная
продолжительность ферментолиза. При продолжительности ферментолиза рыбного
фарша 20 мин выход белковой массы составляет 90 % и при дальнейшем увеличении
продолжительности ферментолиза до 30 и 40 мин практически не изменяется. Таким
образом, было установлено, что ферментолиз целесообразно проводить в течение 20
мин, что соответствует наибольшему выходу белковой массы. Были определены
значения величин накопленных при ферментолизе продуктов распада белка (ФТА)
мышечной ткани всех исследованных рыб.
Исследования показали, что введение воды в количестве 50 % к фаршу перед
ферментолизом с последующим её удалением после ферментолиза позволяет получить
БМН с реологическими свойствами, которые способствуют лучшему сочетанию его с
тестом, приготовленным на основе пшеничной муки при замесе. БМН, полученный
таким способом, обладает хорошей вязкостью, липкостью и соответствующими
гидрофильными свойствами.
Использование ферментолиза позволило получить гидрофильное рыбное тесто
однородной консистенции. Добавление воды перед ферментолизом и её удаление
после этого процесса способствовали снижению значений азота летучих оснований
(АЛО) и некоторому увеличению влагоудерживающей способности (ВУС). Этот эффект
усиливается в присутствии воды, которая вводится в рыбный фарш, что
способствует более эффективному ферментолизу и заметному увеличению значений
ФТА на 44 % по сравнению со значениями ФТА рыбного фарша, ферментолиз которого
проводился без добавления воды. Мышечные ферменты (протеазы) обладают
относительно невысокой протеолитической активностью по сравнению с ферментами
внутренних органов, поэтому при кратковременном горячем ферментолизе не
наблюдается заметного увеличения продуктов распада белков.
Удаление воды из проферментированной массы позволило увеличить
относительное содержание солерастворимых белков, обуславливающих гидрофильные
свойства фарша. Это установлено по увеличению значения влагоудерживающей
способности рыбной массы. Известно, что промывка фарша позволяет замедлить его
денатурационные изменения, которые при холодильном хранении в короткие сроки и
с наибольшей интенсивностью протекают в фарше из тощих рыб, что сопровождается
потерей ВУС и фаршеобразующей способности.
Причинами таких изменений являются:
ферментное восстановление триметиламмониевых оснований (ТМО) и
формальдегида, обладающих активным денатурационным влиянием на белки;
окислительная порча липидов и как следствие образование свободных жирных
кислот (СЖК), которые влияют на растворимость белка.
Улучшить качество рыбного фарша для получения БМН и увеличить сроки его
хранения возможно путем промывки проферментированной белковой массы питьевой водой,
при этом:
удаляются водорастворимые белки, большинство из которых являются
ферментами с высокой реакционной способностью, интенсивно денатурируют и
отрицательно влияют на изменения других компонентов фарша при хранении;.
повышается относительное содержание белков солерастворимой фракции, что
имеет значение для формирования структуры;
удаляются геминовые вещества, содержащие Fe, катализирующие процессы
изменения липидов фарша;
удаляется часть свободных липидов и извлекаются небелковые азотистые
соединения, что влияет на формирование запаха получаемого наполнителя.
Удаление воды из проферментированной рыбной массы ведет также к
уменьшению значений показателя АЛО на 6,4 мг%. При этом, как уже говорилось
выше, удаляются основные экстрактивные вещества, в том числе триметиламминоксид
(ТМА), являющийся одним из важных компонентов, входящих в композицию рыбного
запаха.
Готовый белково-минеральный наполнитель из мышечной ткани исследованных
рыб может служить обогатителем, как для печенья, так и при производстве других
хлебобулочных, бараночных, а также кулинарных изделий [8]. В настоящих
исследованиях БМН использовали для приготовления печенья профилактического
назначения, обогащенного недостающими в мучных продуктах аминокислотами, а
также микроэлементами, такими как кальций и магний.
При изготовлении печенья с белково-минеральным наполнителем из мышечной
ткани рыб за основу была взята базовая рецептура песочного печенья, в которую
на этапе приготовления теста вносили белково-минеральный наполнитель.
В экспериментальную партию песочного печенья вносили по 5 и 10 % от массы
сырого теста белково-минеральный наполнитель из мышечной ткани трески. Для
приготовления песочного печенья использовали рецептуру печенья с низким
содержанием жира и сахара, в рецептуре которого изначально присутствует
морковь; оно рекомендовано для школьного и диетического питания. Для оценки
органолептических показателей качества печенья была разработана 5-балльная
шкала, учитывающая коэффициенты значимости отдельных показателей. За основу оцениваемых
показателей были приняты органолептические показатели согласно ГОСТ 24901-89.
Все образцы печенья сохранили хороший внешний вид, форму, состояние и
цвет поверхности, вид на изломе, вкус и запах, свойственный продукции данного
наименования. Изменялась при хранении только интенсивность вкуса и запаха
печенья.
Образцы песочного печенья с 10 %-ным содержанием белково-минерального
наполнителя из трески после 3 недель хранения приобрели лёгкий рыбный запах,
ощутимый при открытии упаковки, при его дегустации ощущалась жёсткость при
надкусывании. У отдельно взятого для оценки запаха печенья рыбный оттенок
запаха отсутствовал. При дегустации печенья большинство респондентов дали
высокую оценку качества исследуемых образцов.
Результаты исследований позволили сделать вывод, что обе исследуемые
рецептуры подходят для создания печенья профилактического назначения, так как
все партии экспериментального печенья обладали высокими органолептическими
свойствами и соответствовали требованиям нормативной документации. Были
подобраны оптимальные количества БМН, вносимого в рецептуру песочного и
затяжного печенья, и определены сроки хранения печенья с БМН.
Таким образом, экспериментально подтверждена возможность создания
продукции на основе пшеничной муки, обогащенной незаменимыми аминокислотами и
микроэлементами. Установлены режимы приготовления БМН из мышечной ткани трески.
.3 Разработка рецептур новых майонезов с функциональными свойствами на
основе морского сырья
“Морская серия” - это группа майонезов, состоящих из трех новых
продуктов: “Здоровье”, “Восточный” и “Особый”. Майонез “Особый” содержит в
качестве ингредиента морскую капусту, обогащенную селеном. Для изготовления
майонеза “Особый” использовалась морская капуста - ламинария японская
(Laminaria japonica), собранная в экологически чистом районе - заливе Восточный
Японского моря. Эта водоросль отличалась высоким содержанием альгиновых кислот,
йода и селена. Для изготовления обогащенного микроэлементами продукта
свежесобранная морская капуста предварительно выдерживалась в течение трех
суток в ваннах с раствором селенита натрия с массовым содержанием селена 0,1
мг/л. Для изготовления майонеза “Здоровье” использовали лиофилизованный водный
экстракт кукумарии, полученный лиофильной сушкой отвара кукумарии (отход при
обработке этого моллюска). Содержание тритерпеновых гликозидов в высушенном
экстракте составлял 150 мкг/г, а хлорида натрия - 300 мг/г. Майонез “Восточный”
обогащали бланшированными мелкоизмельченными молоками минтая.
Рецептура майонезов представлена в таблице 5 в сравнении со стандартным
образцом майонеза “Приморский”.
Выбор добавок был обусловлен тем, что при разработке новых видов
эмульсионных продуктов функционального назначения необходимо включать в
рецептуру ингредиенты с научно обоснованными лечебными эффектами:
микроэлементы, протеины, полиненасыщенные жирные кислоты растительных масел и
жиров морского зверя и рыб, пищевые волокна, токоферолы, аскорбиновую кислоту и
другие компоненты. Большое физиологическое значение придается эйкозаноидам -
арахидоновой, эйкозапентаеновой и докозагексаеновой жирным кислотам, которые
содержатся в значительном количестве в жирах гидробионтов. Арахидоновая и
другие эйкозаполиеновые кислоты являются предшественниками в биосинтезе
простагландинов и лейкотриенов, регуляторов липидной природы, синтезирующиеся
внутриклеточными ферментами. Простагландины уменьшают артериальное давление,
являются ингибиторами тромбообразования, влияют на железы внутренней секреции.
Таблица 5. - Рецептура майонезов “Морская серия ”
|
Компонент
|
|
“Особый”
|
“Здоровье”
|
“Восточный”
|
“Приморский”, стандартный
образец, ТУ 429-10-005-92
|
|
Масло растительное
|
47
|
47
|
47
|
47
|
|
Мука соевая
|
5
|
5
|
5
|
5
|
|
Сухое обезжиренное молоко
|
1,6
|
1,6
|
1,6
|
1,6
|
|
Сахар-песок
|
1,5
|
1,5
|
1,5
|
1,5
|
|
Соль
|
1,3
|
1,0
|
1,3
|
1,3
|
|
Горчица сухая
|
0,75
|
0,75
|
0.75
|
0,75
|
|
Сода пищевая
|
0,05
|
0,05
|
0,05
|
0,05
|
|
Уксусная кислота
|
0,75
|
0,75
|
0,75
|
0,75
|
|
Вода
|
41,05
|
41,75
|
32,05
|
42,05
|
|
Морская капуста
|
1
|
-
|
-
|
-
|
|
Лиофилизат кукумарии
|
-
|
0,6
|
-
|
-
|
|
Молоки минтая
|
-
|
-
|
10
|
-
|
|
Итого:
|
100
|
100
|
100
|
100
|
Морская капуста, использованная для майонеза “Особый”, служит источником
макро- и микроэлементов. Органические соединения йода в ламинарии японской
быстрее, чем эквивалентное количество йодистого натрия, содействуют
нормализации функции щитовидной железы, что очень важно для человека.
Другой биогенный микроэлемент ламинарии - селен, как установлено в
последнее время, является одним из важнейших компонентов антиоксидантной защиты
организма, способствует повышению устойчивости организма к различным
неблагоприятным воздействиям окружающей среды (селен зависимая
супероксиддисмутаза снижает уровень перекисного окисления липидов, является
синергистом витамина Е).
Дефицит селена является одним из факторов риска возникновения
злокачественных новообразований, заболеваний сердца, сосудов, болезней
суставов, катаракты. Обеспечение селеном приобретает особое значение для людей,
живущих в экологически неблагоприятных условиях. В целях профилактики состояний
недостаточности селена для населения создаются специализированные продукты,
обогащенные селеном. При этом витамины, содержащиеся в растительном сырье (в
частности, аскорбиновая кислота), способствуют лучшему усвоению этого
микроэлемента.
Особый интерес представляет присутствующая в морской капусте альгиновая
кислота.
Альгинаты - студнеобразователи, они хорошо сочетаются с различными
пищевыми продуктами и не случайно нашли широкое применение в качестве
ингредиентов при изготовлении кондитерских изделий, мороженого, соусов,
майонезов, кремов, сыров, различных напитков.
В сырье, полученном из кукумарии для майонеза “Здоровье”, содержится
комплекс ценных, биологически активных веществ, в том числе суммарная фракция
водорастворимых гликозидов, гексозаминов.
Ткани кукумарии богаты источником углеводов, среди которых имеются и
гликозиды, сходные по литературным данным с гликозидами трепанга и женьшеня.
Исследованные липиды кукумарии состояли из триглицеридов (45%),
фосфолипидов (20%), диглицеридов (2-12%), моноглицеридов, свободных жирных
кислот, стеринов и их эфиров. Высоким явилось содержание ненасыщенных жирных
кислот (65-68°/о), из них около половины приходилось на эйкозапентаеновую
кислоту.
Ценность молок минтая, введенных в майонез “Восточный”, определяется
наличием в них большого количества хорошо усвояемых организмом человека белков,
жиров, содержащих полиненасыщенные высшие жирные кислоты омега-3 ряда, и
присутствием витаминов группы В.
Кроме того, содержащаяся в составе молок низкомолекулярная ДНК обладает
биологической активностью, в результате чего использование майонеза с добавкой
из молок как пищевого продукта способствует повышению физической выносливости
организма, активизации умственной деятельности, замедлению процессов старения,
повышению иммунитета и сопротивляемости к инфекциям.
Майонезы были приготовлены на сырье, отвечающем соответствующим
санитарным правилам и нормам, предъявляемым к пищевому сырью по всем
нормированным показателям.
Качество майонезов по органолептическим, физико-химическим,
микробиологическим и токсикологическим показателям определяли стандартными
методами.
По всем исследованным показателям майонезы соответствовали установленным
требованиям.
Физико-химические показатели и пищевая ценность продуктов представлены в
таблице 6, 7.
Таблица 6. - Физико-химические показатели майонезов
|
Показатель
|
Наименование майонеза
|
|
“Особый”
|
“Здоровье”
|
“Восточный”
|
“Приморский”, стандартный
образец, ТУ 429-10-005-92
|
|
Массовая доля жира, %
|
47
|
47
|
47
|
Не более 47
|
|
Массовая доля влаги, %
|
41
|
42
|
40
|
Не более 45
|
|
Массовая доля соли, %
|
1,3
|
1,0
|
1,3
|
Не более 1,3
|
|
Кислотность в пересчете на
уксусную кислоту, %
|
0,78
|
0,52
|
0,60
|
Не более 0.85
|
|
Водородный показатель (pH)
при 20°С
|
4,30
|
4,25
|
4,21
|
Не более 4,4
|
|
Стойкость эмульсии, %
неразрушенной эмульсии
|
99,8
|
99,7
|
99,5
|
Не менее 98
|
Таблица 7. - Пищевая и энергетическая ценность новых видов майонезов
“Морская серия ”
|
Пищевая ценность на 100 г
продукта, г
|
Майонезы
|
|
“Здоровье”
|
“Восточный”
|
“Особый”
|
|
Жиры
|
47,1
|
47.3
|
47,12
|
|
Белки
|
3,6
|
4,45
|
3,42
|
|
Углеводы
|
3,43
|
3,42
|
3,86
|
|
Энергетическая ценность на
100 г продукта, ккал/кДж
|
451,2/1886
|
456,3/1907
|
451,4/1887
|
Полученные майонезы содержат функциональные ингредиенты (микроэлементы,
ненасыщенные жирные кислоты, витамины) и являются качественными и экологически
чистыми продуктами. Эти продукта можно рекомендовать для
лечебно-профилактического питания, а также в качестве корригирующих продуктов
для повышения устойчивости организма к различным неблагоприятным воздействиям
окружающей среды.
ЗАКЛЮЧЕНИЕ
По многочисленным литературным данным морские
гидробионты содержат уникальные БАВ разнонаправленного действия. Это связанно с
условиями их существования в водной среде, характеризующейся высоким
содержанием соли, низким освещением или полным его отсутствием, высоким
давлением и необычно высокими или низкими температурами. Подобные условия жизни
обеспечивают отличие морских организмов и их метаболитов, от организмов с
земной биологией. Как природные источники они характеризуются не только
разнообразием и высокой эффективностью содержащихся в них БАВ, которые зачастую
лишены отрицательных свойств, присущих веществам, полученным из традиционных
источников, но и широкой и успешно воспроизводимой сырьевой базой. Последнее
обстоятельство может оказаться важным при необходимости получения каких-либо
определенных химических веществ (белков, полисахаридов, нуклеиновых кислот и
т.д.) в промышленном масштабе.
Полученный в лаборатории прикладной биохимии
ТИНРО-центра метод ферментативного гидролиза, - новое, ранее неизученное
вещество, биологическая активность которого была установлена при проведении
скриннингового исследования различных БАВ морского происхождения. Преимуществом
ферментативного гидролиза, в сравнении с другими видами - кислотным, щелочным,
- является его простота, непродолжительность (около 5 часов), экономичность
(используемый в реакции фермент пилорин получают из отходов лососевых рыб)[6].
Преимуществами использования объектов рыбного промысла
являются: использование доступного морского сырья (массовых промысловых
объектов), экологическая безопасность, широкий спектр лечебно-профилактического
действия.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Кавецкий,
Г. Д. Процессы и аппараты пищевой технологии: Учебник/ Г. Д. Кавецкий, Б. В.
Васильев.-М.: Колос, 2000.- 551 с.
. Палагина,
М.В., Приходько, Ю.В. Использование дальневосточных дикоросов и гидробионтов в
продуктах функционального назначения / М.В. Палагина, Ю.В. Приходько. -
Владивосток: Изд-во ТГЭУ, 2009. - 216 с.
. Панфилов,
В. А. Машины и аппараты пищевых производств. В 2 кн. Кн. 1: Учебник для
вузов/С. Т. Антипов, И. Т. Кретов, А. Н. Остряков и др.; под ред. акад. РАСХН
В. А. Панфилова.-М.: Высш. шк.,2001.-703 с.
. Сафронова,
Т.М. Технология комплексной переработки гидробионтов. / Т. М. Сафронова, В. Д.
Богданов, Т. М. Бойцова, В. М. Дацун, Г. Н. Ким, Э. Н. Ким, Т. Н. Слуцкая. -
Уч. пос. - Владивосток: Дальрыбвтуз, 2002. - 512 с.
5. БАД ТИНРО-Центр
[Электронный ресурс]: [Информация по Дальнему востоку] / Электрон. дан.: ТИНРО
- Центр, [2011].- Режим доступа: URL: <http://www.tinro-center.ru/>, 28.
12. 2011
. Экстракция
жидкостная: / Электрон. дан.: Химическая энциклопедия, [2011].- Режим доступа:
<http://www.chemport.ru/>, 28.12.2011