Создание линии хромирования стальных деталей и очистки сточных вод
Введение
В современном развитии технологий и процессов
деталям приходится часто контактировать с различными реагентами. Такой контакт
может привести к выходу из строя оборудования, различных его частей, а также
может являться причиной человеческих жертв. Чтобы избежать таких проблем,
применяется осаждение какого-либо защитного металла. Этот процесс называется
гальванотехника.
Одним из металлов, применяемым для данных
процессов, является хром, а сам процесс осаждения хрома на деталь называется
хромирование. Хромирование изделий широко распространено в промышленности
вследствие ценных свойств хрома.
Электролитический хром - металл
серебристо-белого цвета с синеватым оттенком. Температура плавления 1530 °С.
Электролитический хром обладает рядом ценных физико-химических свойств,
благодаря которым он широко используется в промышленности. Твердость его,
выраженная в единицах Бринеля, достигает 1000-1100 НВ, что значительно
превышает твердость закаленной стали. Большая твердость наряду с низким
коэффициентом трения, жаростойкостью, высокой коррозионной стойкостью и другими
свойствами обусловливают высокую износостойкость хромированных деталей. Хром
обладает большой стойкостью против воздействия многих кислот и щелочей: он не
растворяется в слабых растворах азотной и серной кислот; в соляной и горячей
концентрированной серной кислоте хром легко растворяется. На воздухе и под
действием окислителей хром пассивирует за счет окисной пленки.
Хромовые покрытия сохраняют свой вид, не
окисляясь, при нагревании до 450-500 °С. Полированные хромовые покрытия
обладают хорошей отражательной способностью, уступая в этом отношении лишь
серебру, которое, однако, со временем темнеет и его отражательная способность
падает, в то время как хромовые покрытия сохраняют первоначальный вид.
Защитно-декоративное хромирование применяется
для отделки деталей автомобилей, приборов, медицинских инструментов,
фотоаппаратов, изделий массового потребления и многих других.
Износостойкое хромирование применяется для
повышения эксплуатационных свойств режущих и мерительных инструментов,
инструментов для холодной обработки металлов, пресс-форм, а также с целью
восстановления изношенных деталей при ремонте оборудования.
Целью данного проекта служит создание линии
хромирования стальных деталей и очистки сточных вод с наименьшим воздействием
на окружающую среду.
В ходе работы будут решены следующие задачи:
создание технологии нанесения хромового покрытия, создание технологической
схемы очистки сточных вод, выбор оборудования, расчет технологический, расчет
оборудования, расчет материального баланса.
. Теория получения хромового покрытия
.1 Подготовительные операции
Перед тем как поступить в гальванический цех
детали должны пройти особую обработку. На своей поверхности они имеют
загрязнения различные по своей природе и свойствам. От качества очистки
напрямую зависит результат покрытия защитным слоем металла.
Первой стадией обработки является обезжиривание.
Способ очистки поверхности деталей от жировых
загрязнений определяется их природой. Жиры минерального происхождения, к
которым относится полировочные пасты, минеральные масла, не растворяются в
воде, и для их удаления применяют специальные органические растворители. Жиры
растительного или животного происхождения практически не растворяются в воде,
но взаимодействуют с водными растворами щелочей или солей щелочных металлов,
образуя растворимые в воде мыла.
Щелочные растворы обеспечивают удаление с
поверхности металла животных и растительных жиров в результате химического или
физико-химического взаимодействии с ними. При этом, хотя минеральные жиры не
участвуют в реакции, при определенных условиях под воздействием щелочных
растворов они могут образовывать водные эмульсин, что облегчает их последующее
отделение от поверхности металла. Вводя в щелочные растворы поверхностно
активные вещества, можно усилить их эмульгирующее действие и тем самым активное
влияние на минеральные жировые загрязнения. Под воздействием горячего щелочного
раствора, содержащего эмульгаторы и вещества, понижающие межфазное натяжение на
границе раствор - жир и раствор - металл, происходит разрыв жировой пленки,
уменьшение ее толщины, образование отдельных капель места и отрыв их от
поверхности металла. При этом одновременно отделяются также мелкие механические
загрязнения.
Органические растворители токсичны, и применять
их можно только при использовании специального оборудования и соблюдения,
соответствующих правил техники безопасности. Пожароопасными растворителями, как
бензин и керосин, не следует пользоваться. После удаления следов растворителей
детали поступают на химическое или электрохимическое обезжиривание.
Типичная реакция омыления представляет собой
гидролиз сложного эфира с образованием спирта и кислоты (или её соли, когда для
омыления берут раствор щёлочи):
−СО−ОR' + НОН → R−СООH +
R'−ОН 1.1
При декоративном хромировании по подслою
производится электролитическое обезжиривание по обычной технологии. Детали,
подлежащие износостойкому хромированию, также могут обезжириваться
электролитически, кроме деталей из высокопрочных сталей, для которых допустимо
только химическое обезжиривание. Если после предварительного обезжиривания или
последующих операций деталь имеет значительные загрязнения, то она может
обезжириваться повторно в горячем щелочном растворе или путем протирки
хромируемой поверхности кашицей из венской извести. Если на хромируемой
поверхности нет заметных загрязнений, то можно, не производя специального
дополнительного обезжиривания, освежить хромируемую поверхность шкуркой
непосредственно перед загрузкой деталей в ванну. Выбор способа подготовки
поверхности связан с особенностями деталей, их монтажом на приспособлениях,
наличием изоляции и дополнительных анодов.
В ГОСТ 9.305-84 [6] для каждой технологии и для
каждой стадии процесса записаны условия их проведения. В проекте используется
электролит представленный в таблице 1.1. Для него допускается вводить 5-10
г/дм3 едкого натра технического, марки ТР. Допускается вводить 3-5 г/дм3 стекла
натриевого жидкого или соответствующее количество метасиликата натрия. При
обработке меди и ее сплавов перед нанесением на них медных покрытий из
цианистых электролитов допускается вводить 5-15 г/дм3 цианистого натрия;
обработку проводят только на катоде при температуре 30-40 °С, плотность тока до
5 А/дм2.
Таблица 1.1 - Состав ванны обезжиривания
|
Состав электролита
|
Режим обработки
|
|
наименование компонентов
|
количество, г/дм3
|
температура, °С
|
плотность тока, А/дм2
|
продолжительность, мин
|
|
|
|
|
катод
|
анод
|
|
Тринатрийфосфат
|
20-40
|
30-80
|
2-10
|
0,5-10
|
1-5
|
|
Сода кальцинированная техническая
|
20-40
|
|
|
|
|
Второй стадией обработки является травление.
Состав окисного слоя, образующегося на металле
под воздействием окружающей среды, неодинаков по толщине. Внешний слой обычно
обогащен высшими окислами, тогда как у поверхности находятся, преимущественно,
низшие окислы. Так окалина на железе состоит, если рассматривать ее от внешнего
слоя к внутреннему, из окислов Fе2О3, Fе3О4, а у поверхности металла - из
закиси FеО.
Процессы, происходящие при травлении в серной
кислоте, на поверхности которого имеется окалина, выражаются следующими
реакциями:
еО + H2SО4
= FеSО4
+ H2О 1.2
Fе2О3 + 3H2SО4=Fе2(SО4)3
+ ЗН2О 1.3
Fе3О4 + 4H2SО4
= FеSО4
+ Fе2(SО4)3
+ 4H2О 1.4
Так как слой окалины пористый, неравномерный по
толщине, а на отдельных участках вообще отсутствует, то при травлении вместе с
окислами происходит и частичное растворение металлического железа по реакции:е
+ H2SО4 = FеSО4 + H2 1.5
Одновременное растворение металла и окислов
можно представить следующими реакциями:
Fе + Fе2О3
+ 4H2SО4
= 4FеSО4
+ ЗН2О + H2 1.6
Fе + Fе3О4
+ 5H2SО4
= 5FеSО4
+ 4H2О + H2
1.7
Для травления черных металлов используются в
основном растворы серной и соляной кислот. Скорость растворения в них окислов
зависит от концентрации и температуры кислоты. При концентрации до 5%
растворимость Fе3О4 в обеих кислотах почти одинаковая. При концентрации свыше
40% окалина лучше растворяется в соляной кислоте, чем в серной. В последней из
них окалина удаляется в значительной мере благодаря нарушению ее связи с
металлом в результате подтравливания и разрыхления выделяющимся при реакции
водородом. Повышение в определенных пределах концентрации кислоты и температуры
раствора ускоряет травление.
Учтивая различный характер воздействия кислот на
железо и окислы, целесообразно применить для травления следующие смеси (%): серная
кислота - 5, соляная кислота - 15 или серная кислота - 10, соляная кислота -
10. Независимо от того, в какой кислоте проводится травление стали, оно
сопровождается нежелательными побочными процессами. Растворение основного
металла может привести к перетравливанию поверхности, неравномерному съему,
увеличению микрошероховатости. Все это ухудшает внешний вид изделий и
недопустимо при обработке точных элементов аппаратуры. С этой целью в
травильные растворы вводят ингибиторы коррозии, которыми служат некоторые соли
и органические соединения.
В проекте используется электролит состава,
представленного в таблице.
Таблица 1.2 - Состав ванны травления
|
Состав электролита
|
Режим обработки
|
|
Наименование компонентов
|
Количество, г/дм3
|
Температура, °С
|
Продолжительность, мин
|
|
Кислота серная техническая
|
350-450
|
40-45
|
1-2
|
|
Кислота азотная концентрированная
|
70-90
|
|
|
|
Кислота соляная синтетическая
техническая
|
70-90
|
|
|
.2 Основы процесса хромирования [2]
Электролитическое хромирование существенно
отличается от других гальванических процессов. Выделение хрома производится из
растворов хромовых кислот (смесь кислот Н2Сr2О7 и Н2СrО4), а не из солей хрома.
При этом в растворе обязательно должны присутствовать в большом количестве
добавки активных анионов (SО42-, SiF62-, F-), без которых хром не выделяется из
хромовой кислоты.
Важной особенностью хромирования является более
легкое выделение водорода на катоде, чем хрома. Водород начинает выделяться при
более положительном потенциале, чем хром, и выход по току при хромировании намного
(в три - пять раз) меньше, чем при осаждении других металлов. На выход хрома по
току существенно влияют плотность тока и температура электролита.
Рассеивающая и кроющая способности хромовых
электролитов в отличие от других процессов низки, что заставляет применять при
хромировании особые приемы для повышения равномерности покрытия. Низкая кроющая
способность связана со сравнительно высокой минимальной плотностью тока, при
которой начинается выделение хрома.
В хромировочных ваннах применяются только нерастворимые
аноды, что требует периодического пополнения убыли хромовой кислоты путем ее
непосредственного введения в электролит в необходимых количествах.
Растворы хромовой кислоты токсичны, они
увлекаются выделяющимися при электролизе газами. Это создает необходимость
принятия мер предосторожности для оздоровления условий труда при работе на
хромировочных ваннах.
Во время хромирования на катоде происходят
следующие основные процессы: осаждение хрома, выделение водорода,
восстановление аниона хромовой кислоты, где хром шести валентен, до соединений,
в которых хром имеет меньшую валентность, в основном, трехвалентного хрома,
образование на поверхности катода тонкой пленки состоящей из активного аниона и
продуктов восстановления хромовой кислоты.
На нерастворимом свинцовом аноде при электролизе
происходит выделение кислорода и активное окисление Cr
(III) до Cr
(VI).
Реакции проходящие на катоде (1.8-1.9) и аноде
(1.10) представлены ниже:
СrО42-
+ 8H+ + 6е- → Сr0
+ 4H2О 1.8
H+ + 2е → H2
1.9
H2О + 4е- → О2
+ 4H+ 1.10
При хромировании применяются только
нерастворимые аноды из свинца и его сплавов с сурьмой и оловом. Это обусловлено
непригодностью хромовых анодов, так как выход по току при их растворении в семь
- восемь раз больше, чем выход хрома по току на катоде. В результате этого
концентрация хрома в электролите в процессе хромирования будет непрерывно
возрастать, нарушая условия электролиза.
Кроме того, окислительные процессы на
растворимом аноде недостаточно интенсивны, чтобы перевести накапливающиеся в электролите
ионы трехвалентного хрома в шестивалентные. Превышение допустимой концентрации
трехвалентного хрома приводит к нарушению работы электролита.
Показатели процесса и качества покрытия при
хромировании в значительно большей степени зависят от режима электролиза
(плотности тока и температуры электролита), чем при других гальванических
процессах.
Важное значение в процессе имеет состав
электролита, который задает режим электролиза. Наиболее часто используемыми
являются сульфатные, сульфатно-кремнефторидные, тетрахроматные электролиты.
Сульфатные электролиты. Концентрация хромового
ангидрида в электролитах с добавкой серной кислоты может изменяться в широких
пределах (от 100 до 500 г/л). Для получения покрытия хорошего качества
необходимо, чтобы отношение концентраций СrО3 : H2SО4 в электролите
поддерживалось постоянным на уровне около 100. Значительное понижение
концентрации серной кислоты в электролите вызывает отложение серых
недоброкачественных осадков хрома, повышение ее концентрации - отложение мягкозернистых
блестящих осадков.
Увеличение концентрации хромового ангидрида
повышает электропроводность раствора. Изменение концентрации серной кислоты в
указанных пределах практически не оказывает влияния на электропроводность
раствора
Для стабилизации электролита по содержанию
серной кислоты предложено вводить ее в виде соли трудно растворимого
сернокислого стронция. Избыток сернокислого стронция, находящийся в осадке,
длительное время поддерживает требуемую концентрацию сернокислотного аниона в
электролите.
Сульфатно-кремнефторидные электролиты. Введение
в сульфатный электролит анион кремнефтористоводородной кислоты повышает выход
по току, расширяет интервал блестящих осадков и улучшает рассеивающую
способность при значительных плотностях тока и повышенных температурах.
Введение SО42- и SiF62- в виде труднорастворимых
солей (сернокислого стронция и кремнефтористого калия) обеспечивает высокую
стабильность электролита, если их содержание превышает предел растворимости. По
этой причине электролиты такого состава называют саморегулирующимися.
Оптимальный состав электролита установлен следующий, г/л: хромовый ангидрид -
250-300, сернокислый стронций - 5,5-6,5, кремнефтористый калий - 18-20.
Внутренние напряжения в хромовых покрытиях,
осажденных из сульфатно-кремнефторидного электролита, и их микротвердость
несколько ниже, чем покрытий из универсального электролита. Влияние покрытия на
усталостную прочность стали и антифрикционные свойства не отличается от влияния
покрытий из универсального электролита.
Преимуществом сульфатно-кремнефторидного
электролита является малая зависимость выхода по току от колебаний режима
электролиза и повышенный выход по току по сравнению с универсальным
электролитом. Для такого электролита рекомендуется использовать аноды с 5-10 %
содержанием олова. Серьезный недостаток - сравнительно высокая химическая
агрессивность.
Тетрахроматный электролит. Основной
представитель этого типа имеет следующий состав, г/л: хромовый ангидрид -
350-400, едкий натр - 50-60, серная кислота - 2,5-2,7, трехвалентный хром (в
пересчете на хромовый ангидрид) - 10-15.
Тетрахроматные электролиты отличаются хорошей
рассеивающей способностью. Осадки хрома имеют низкую твердость (примерно вдвое
ниже, чем осадки из сульфатных электролитов), менее частую сетку трещин и меньшую
пористость. Внешний вид осадков хрома матовый, но они сравнительно легко
полируются.
Достоинством тетрахроматных электролитов
является высокий выход по току, а их недостатком - необходимость специальной
подготовки для обеспечения сцепления покрытия с основой. Кроме того, для
поддержания температуры электролита при больших загрузках ванны требуется
охлаждение электролита. Декоративное хромирование требует дополнительной
полировки покрытия.
В проекте используется электролит из таблицы
1.3. Для него допускается применять для получения защитно-декоративных и
износостойких хромовых покрытий.
Таблица 1.3 - Состав ванны хромирования
|
Состав электролита
|
Режим обработки
|
Скорость осаждения, мкм/мин
|
|
Наименование компонентов
|
Количество, г/дм3
|
температура, °С
|
Плотность тока, А/дм2
|
|
|
Ангидрид хромовый
|
125-250
|
45-60
|
45-60
|
0,3-0,7
|
|
Кислота серная
|
1,2-2,5
|
|
|
|
.3 Промывка
Целью промывки является снижение концентрации
раствора на поверхности обрабатываемых деталей, выносимых из технологических
ванн, до допустимой величины, гарантирующей качество получаемого покрытия.
Система промывки включает: ванны промывки с устройствами для перемешивания,
подачи и отвода воды; трубопроводы подачи воды и отвода сточных вод с
соответствующей арматурой; устройства регулирования расхода и напора воды;
контрольно-измерительные приборы, обеспечивающие непрерывный или периодический
контроль качества и количества воды.
Системы промывки могут выполнять две функции -
промывки и улавливания. При этом улавливание предполагает возврат уловленного
раствора в технологические ванны, из которых он был вынесен на поверхности
деталей в систему улавливания. Такие технологические ванны по отношению к
системе улавливания называют обслуживаемыми. На практике применяют следующие
системы промывок: без улавливания, с частичным и полным улавливанием.
Основным способом промывки в гальваническом
производстве является объемный, осуществляемый погружением обрабатываемых
деталей в заполненные промывной водой ванны с целью разбавления раствора,
увлеченного из ванн для нанесения покрытий. В качестве вспомогательного способа
в сочетании с объемным может применяться поверхностный способ промывки,
осуществляемый потоком воды или воздуха с целью удаления и (или) замещения
пленки раствора, покрывающей поверхность. Применение только поверхностного
способа промывки допускается при покрытии деталей простой конфигурации (листы,
проволока) с обязательной предварительной экспериментальной проверкой
достигаемой полноты промывки. Комбинированный способ промывки включает объемный
и поверхностный способы, которые могут чередоваться в различной
последовательности: поверхностный - объемный; объемный - поверхностный;
поверхностный - объемный - поверхностный.
Техническая вода, используемая для промывки
изделий, деталей и приготовления электролитов и растворов в гальваническом
производстве, должна быть безопасной в эпидемиологическом отношении и химически
инертной к покрытию. Следует применять системы многократного использования
воды, обеспечивающие регенерацию воды и рекуперацию ценных компонентов.
Вода 1-й категории с 01.01.93 не используется.
На вновь проектируемых и реконструируемых
гальванических производствах при промывке деталей и приготовлении электролитов
в операциях подготовки поверхности деталей к покрытию необходимо применять воду
2-й и 3-й категории. При промывке применять схемы многократного использования
воды. В системах многократного использования воды допускается содержание
вредных ингредиентов в очищенной воде не выше допустимых значений.
Все характеристики вод используемых в гальваническом
производстве приведены в таблицах 1.4-1.6.
Таблица 1.4 - Физико-химические показатели воды
|
Название показателя
|
Норма для категории
|
|
2
|
3
|
|
1
|
2
|
3
|
|
Водородный показатель рH
|
6,5-8,5
|
5,4-6,6
|
|
Сухой остаток, мг/дм3, не более
|
400
|
5,0
|
|
Жесткость общая, мг-экв/дм3, не
более
|
6,0
|
0,35
|
|
Мутность по стандартной шкале,
мг/дм3, не более
|
1,5
|
-
|
|
Сульфаты(SО42-), мг/дм3, не более
|
50
|
0,5
|
|
Хлориды(Сl-), мг/дм3, не более
|
35
|
0,02
|
|
Нитраты(NО3-), мг/дм3, не более
|
15
|
0,2
|
|
Фосфаты(РО43-), мг/дм3, не более
|
3,5
|
1,0
|
|
Аммиак, мг/дм3, не более
|
5,0
|
0,02
|
|
Нефтепродукты, суммарно, мг/л, не
более
|
0,3
|
-
|
|
ХПК, мг/дм3, не более
|
50
|
-
|
|
Остаточный хлор, мг/дм3, не более
|
1,7
|
-
|
|
ПАВ, мг/дм3, не более
|
1,0
|
-
|
|
Ионы тяжелых металлов, мг/дм3, не
более:
|
5,0
|
0,4
|
|
Железо
|
0,1
|
0,05
|
|
Медь
|
0,3
|
0,02
|
|
Никель
|
1,0
|
-
|
|
Цинк
|
1,5
|
0,2
|
|
Хром трехвалентный
|
0,5
|
-
|
|
Удельная электропроводность, См/м
|
1*10-3
|
5*10-4
|
Таблица 1.5 - Концентрации основных ингредиентов
в воде на выходе из гальванического производства
|
Наименование ингредиента
|
Концентрация основных вредных
ингредиентов в воде на выходе из гальванического цеха, мг/л, не более
|
|
Хром шестивалентный
|
1000
|
|
Медь
|
30
|
|
Никель
|
50
|
|
Цинк
|
50
|
|
Кадмий
|
15
|
|
Свинец
|
10
|
|
Олово
|
10
|
|
Хлориды (Сl-)
|
500
|
|
Сульфаты (SО42-)
|
1000
|
|
Цианиды (СN-)
|
30
|
|
Нитраты (NО3-)
|
60
|
|
Аммиак
|
15
|
Таблица 1.6 - Область применения воды
|
Категория воды
|
Область применения
|
Дополнительные указания
|
|
2
|
Приготовление электролитов и
промывка во всех случаях, кроме перечисленных для воды 3-й категории
|
-
|
|
3
|
Приготовление электролитов и
промывка перед обработкой в электролитах (растворах), составленных на воде
3-й категории, а также при специальных требованиях к качеству и внешнему
виду, для особо ответственных деталей
|
Вода, использованная на промывку,
может быть применена повторно как вода 2-й категории
|
2. Технология хромирования
Для любого гальванотехнического процесса
применяют все вышеописанные процессы. В данном проекте разработанная линия
хромирования представляет последовательность операций, представленную ниже.
Стальная деталь монтируют на подвеску 1 линии
хромирования, далее деталь обезжиривают химическим методом в ванне 2. После
обезжиривания деталь промывают теплой и холодной водой проточного типа в ваннах
3 и 4 соответственно. Следующей стадией идет травление в серной кислоте в ванне
5. Деталь после травления промывают в ваннах каскадного типа с холодной водой 6
и 7.
В ванне 8 деталь хромируют. Ванна имеют рубашку,
которая нагревает содержимое паром, чтобы контролировать температуру в ванне
присутствует водяное охлаждение из оборотной воды, которая на выходе проходит
через охладитель и возвращается в оборот.
После проведения хромирования идет ряд промывных
ванн. В ванне-уловителе 9 остатки раствора смывают с детали, который подается
вместе с водой в ванну 8. В ваннах 10 и 11 промывают в холодной проточной воде
каскадом. Завершительная промывка осуществляется в ванне 12 горячей непроточной
водой.
После всех стадий промывки деталь на этапе 13
сушат и далее снимают с подвески, производят демонтаж 14.
Сводные данные приведены в следующей таблице.
хром абсорбер сталь антифрикционный
Таблица 3.1 - Технологический процесс
|
Наименование
|
Состав
|
Режим
|
|
компонент
|
концентрация, г/л
|
температура, °С
|
время, мин
|
плотность тока, А/дм2
|
состояние воды в ванне
|
тип подачи воды в ванну
|
|
1 Монтаж
|
-
|
-
|
-
|
1
|
-
|
-
|
-
|
|
2 Обезжиривание
|
Nа3РО4* 12H2О
|
30
|
30-80
|
1-5
|
2-10
|
-
|
-
|
|
Nа2СО3
|
30
|
|
|
|
|
|
|
NаОH
|
8
|
|
|
|
|
|
|
3 Промывка теплая 1
|
|
|
50
|
10
|
-
|
проточная
|
прямоточная
|
|
4 Промывка холодная 1
|
|
|
10
|
10
|
-
|
проточная
|
прямоточная
|
|
5 Травление
|
H2SО4
|
400
|
40-45
|
1-2
|
-
|
-
|
-
|
|
HNО3
|
80
|
|
|
|
|
|
|
HСl
|
80
|
|
|
|
|
|
|
6 Промывка холодная 2
|
|
|
10
|
10
|
|
проточная вода из каскадной ванны
2
|
каскадная ванна 1
|
|
7 Промывка холодная 3
|
|
|
10
|
10
|
|
проточная
|
каскадная ванна 2
|
|
8 Хромирование
|
СrО3
|
200
|
45-60
|
5-10
|
45-60
|
-
|
-
|
|
H2SО4
|
2
|
|
|
|
|
|
|
9 Промывка в уловителе
|
|
|
20
|
10
|
-
|
непроточная
|
проточная
|
|
10 Промывка холодная 4
|
|
|
10
|
10
|
-
|
проточная вода из каскадной ванны
4
|
каскадная ванна 3
|
|
11 Промывка холодная 5
|
|
|
10
|
10
|
-
|
проточная
|
каскадная ванна 4
|
|
12 Промывка теплая 2
|
|
|
50
|
10
|
-
|
непроточная
|
проточная
|
|
13 Сушка
|
-
|
-
|
75-85
|
10
|
-
|
-
|
-
|
|
14 Демонтаж
|
-
|
-
|
-
|
1
|
-
|
-
|
-
|
3. Утилизация и регенерация стоков сточных вод
.1 Реагентная очистка сточных вод от
шестивалентного хрома
Сточные воды содержащие шестивалентный хром
обрабатываются в две стадии: восстановление шестивалентного хрома до
трехвалентного, осаждение трехвалентного хрома в виде гидроксида.
В качестве реагентов-восстановителей наибольшее
применение получили натриевые соли сернистой кислоты - сульфит (Nа2SО3),
бисульфит (NаHSО3), пиросульфит (Nа2S2О5),
а также дитионит натрия (Nа2S2О4). Восстановление Сr6+
до Сr3+ происходит по
реакциям:
Сr2О72-
+ 3SО32- + 8Н+ = 2Сr3+
+ 3SО42- + 4Н2О 3.1
Сr2О72-
+ 3HSО3- + 5Н+ = 2Сr3+
+ 3SО42- + 4Н2О 3.2
Сr2О72-
+ S2О42- +6Н+ = 2Сr3+
+ 2SО42- + 3Н2О 3.4
Наибольшая скорость восстановления этими ионами
достигается при рН 2-2,5, что обычно требует дополнительного подкисления
сточных вод 10-15 % раствором серной кислоты.
Чаще всего в качестве реагента - восстановителя
используют металлическое железо (в виде стальной стружки, скрапа) или сульфат
двухвалентного железа. В первом случае подкисленные до рН 2 сточные воды
фильтруют через находящийся в реакторе слой железной стружки при постоянном
барботировании воздухом. Во втором случае раствор сульфата железа в виде 10 %
водного раствора вводят в реактор, в который поступают сточные воды. В отличие
от солей сернистой кислоты восстановление шестивалентного хрома до
трехвалентного солями двухвалентного железа протекает с достаточно высокой
скоростью не только в кислой, но и в нейтральной и щелочной средах по реакциям:
Сr2О72-
+ 6Fе2+ +14H+
= 6Fе3+ + 2Сr3+
+ 7H2О 3.5
Сr2О72-
+ 3Fе(ОH)2
+ 4H2О = Сr(ОH)3
+ 3Fе(ОH)3
+ 2ОH- 3.6
Поэтому в случае применения сульфата
двухвалентного железа в качестве реагента-восстановителя шестивалентного хрома
до трехвалентного предварительное подкисление сточных вод не требуется.
Необходим лишь незначительный избыток реагента (около 5 % от стехиометрического
количества) независимо от исходной концентрации шестивалентного хрома в сточных
водах и величины рН.
После окончания реакции восстановления
шестивалентного хрома в кислой среде сточные воды подвергают нейтрализации с
целью осаждения трехвалентного хрома в виде гидроксида по реакции:
Сr3+ + 3ОH- = Сr(ОH)3 3.7
Для нейтрализации обычно используют известковое
молоко, в более редких случаях- соду и едкий натр. Оптимальная величина рН для
осаждения Сr(ОH)3 составляет 8,5-9,0 при выходе за эти пределы растворимость
Сr(ОH)3 увеличивается и, как следствие, ухудшается полнота извлечения
гидроокиси хрома из сточных вод.
.2 Электрокоагуляционный метод [8]
Электрокоагуляция - метод превращения примесей в
грубодисперсное состояние. Он основывается на множестве физико-химических
процессов, протекающих в жидкости под воздействием электрического тока:
электростатическая (поляризационная) коагуляция, электрохимическая коагуляция,
электролитическая коагуляция, гидродинамическая коагуляция, концентрационная
коагуляция.
Сущность электрохимической обработки воды
заключается в том, что при подаче напряжения постоянного тока на электроды
начинается процесс растворения железных анодов. В результате электрохимической
обработки в аппарате осуществляется изменение дисперсного состояния примесей за
счет их коагуляции под действием электрического поля продуктов электродных
реакций и закрепление пузырьков электролитического газа на поверхности
коагулирующих частиц, что обеспечивает их последующую флотацию. Образующиеся
соединения нерастворимого гидроксида железа сорбируют на своей поверхности ионы
тяжелых металлов и выпадают в осадок.
Результат электролитического растворения
стальных анодов при рН>2 происходит по следующей схеме:
е + ОН- ↔ FеОH+(адс) + е- 3.8еОH+(адс) +
ОН- ↔ Fе(ОН)2(адс) 3.9
Fе(ОН)2(адс) →
Fе(ОН)2(водн) 3.10
Fе(ОН)2(водн) ↔
FеОH+
+ ОH- 3.11еОH+ ↔
Fе2+ + ОH- 3.12
Содержащиеся в сточных водах ионы NО2-, NО3-,
СО32-, РО43- при проведении процесса электролиза вызывают пассивацию
поверхности анодов. Для активации анодов применяют добавление хлорида натрия,
ультразвуковую очистку электродов, вибрацию, встряхивание, высокую скорость
движения воды в межэлектродном пространстве при напорном режиме или за счет
рециркуляции, однопоточную схему движения воды, механическую чистку электродов
скребками, продувку межэлектродного пространства газом, вращающийся растворимый
электрод и другие меры снижают опасность пассивации анодов.
.3 Метод элетродиализа
Электродиализатор разделен чередующимися
катионитовыми и анионитовыми мембранами, образующими те же чередующиеся
концентрирующие (рассольные) и обессоливающие (диэлюатные) камеры. Через такую
систему пропускается постоянный ток, под действием которого катионы, двигаясь к
катоду, проникают через катионитовые мембраны, но задерживаются анионитовыми, а
анионы, двигаясь в направлении анода, проходят через анионитовые мембраны, но
задерживаются катионитовыми. Так происходит очистка загрязненной ионами воды,
которая из четных камер собирается в один поток, а сконцентрированные соли из
нечетных камер - в другой поток. Катоды в электродиализаторах изготавливаются
из нержавеющей стали или титана, аноды - из платинированного титана или
графита.
. Расчет материального баланса технологического
процесса
.1 Расчет гальванической линии [9]
Годовая программа 10000 м2 хромирования стальных
деталей, режим работы гальванического цеха двухсменный (действительный годовой
фонд времени работы оборудования при работе в две смены составляет 4015 ч);
средняя толщина покрытия 3 мкм. Допустимое количество бракованных изделий
составляет 2 %. Составы растворов и соответствующие технологические режимы
представлены в таблице 3.1.
Рассчитываем продолжительность хромирования по
формуле:
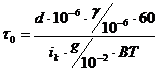 (4.1)
(4.1)
где 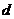 - толщина покрытия, м;
- толщина покрытия, м;
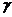 - удельный вес осаждаемого металла,
г/м3 (
- удельный вес осаждаемого металла,
г/м3 (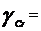 7,1 г/см3);
7,1 г/см3);
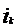 - плотность тока, А/м2;
- плотность тока, А/м2;
g - электрохимический
эквивалент осаждаемого металла, г/(А·ч)
(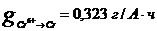 );
);
ВТ - выход металла по току;
- коэффициент перевода часов в
минуты.
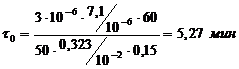
Количество ванн каждого вида
покрытий и других лимитирующих (по времени выдержки деталей в них)
технологических операций определяют по формуле
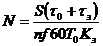 (4.2)
(4.2)
где N -
количество ванн (округляется до целого числа в большую сторону);
S - годовая
программа, м2;
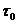 - продолжительность процесса в
ванне, мин;
- продолжительность процесса в
ванне, мин;
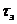 - продолжительность загрузки -
выгрузки ванн, мин;
- продолжительность загрузки -
выгрузки ванн, мин;
n -
количество рядов катодных штанг в ванне при обработке деталей на подвесках, шт;
f -
единовременная загрузка ванны, м2;
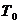 - действительный годовой фонд
времени работы оборудования, ч;
- действительный годовой фонд
времени работы оборудования, ч;
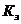 - коэффициент загрузки линии или
ванны.
- коэффициент загрузки линии или
ванны.
Рассчитаем количества ванн
хромирования, количество остальных ванн принимаем по одной для каждой операции.
Для рассматриваемой линии выбираем
ванну с внутренними размерами 1000 × 800 × 500 мм,
длина катодной штанги 1 м, единовременная загрузка ванны 0,4 м2. Действительный
годовой фонд времени работы неавтоматизированного оборудования 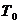 при
двухсменной работе составляет 4015 ч. Коэффициент загрузки
при
двухсменной работе составляет 4015 ч. Коэффициент загрузки 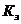 ванн
принимаем 0,8. Количество рядов катодных штанг принимаем 1 шт.
Продолжительность загрузки - выгрузки принимаем 1 мин.
ванн
принимаем 0,8. Количество рядов катодных штанг принимаем 1 шт.
Продолжительность загрузки - выгрузки принимаем 1 мин.
Подставляем принятые значения в
формулу (4.2) и определяем количество ванн хромирования:
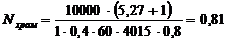
принимаем 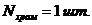
После определения количества ванн
рассчитаем ритм Ri работы по каждой i-й
лимитирующей операции (мин/загрузку) по формуле:
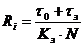 (4.3)
(4.3)
где 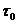 - продолжительность процесса в
ванне, мин;
- продолжительность процесса в
ванне, мин;
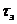 - продолжительность загрузки -
выгрузки ванн, мин;
- продолжительность загрузки -
выгрузки ванн, мин;
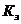 - коэффициент загрузки линии или
ванны;
- коэффициент загрузки линии или
ванны;
N -
количество ванн, шт.
Ритм работы по операции
хромирования:
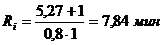
Исходя из ритма работы линии
определяют производительность F линии (м2/ч) определяют по формуле:
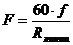 (4.4)
(4.4)
где f -
единовременная загрузка ванны, м2;
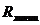 - ритм работы линии хромирования.
- ритм работы линии хромирования.
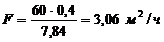
С учетом заданной возможной величины
брака 2 %, производительность линии хромирования по нанесению годных покрытий
будет меньше производительности ванн хромирования на величину брака:
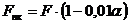 (4.5)
(4.5)
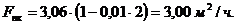
4.2 Расчет материального баланса по операции
хромирование
Площадь единовременной загрузки
ванны 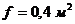 , площадь
одной детали примем
, площадь
одной детали примем 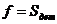 . Тогда
число деталей в ванне при одной загрузке будет равно
. Тогда
число деталей в ванне при одной загрузке будет равно 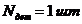 .
.
Толщина покрытия 3 мкм, тогда объем
хрома, высадившегося на одной детали рассчитаем по формуле:
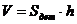 (4.6)
(4.6)
где 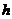 - толщина покрытия, м.
- толщина покрытия, м.
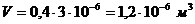 .
.
Массу хрома, высадившегося на
детали, рассчитаем по формуле:
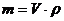 (4.7)
(4.7)
где 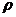 - плотность хрома, кг/м3.
- плотность хрома, кг/м3.
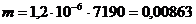 кг.
кг.
Масса хрома высадившегося при одной
загрузке при ВТ 15 % составляет 8,63 г, тогда масса хрома, высадившегося при
одной загрузке, при ВТ 100 % составит:
,63/0,15 = 57,53 г.
По реакциям протекающим на катоде
(1.8-1.9) и аноде (1.10) составим общее уравнение реакции протекающей в ванне
хромирования:
СrО3 + H2О → Сr + 2О2 + H2 4.8
Расчет массы i-го
компонента ведует по формуле
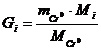 (4.9)
(4.9)
где 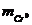 - масса хрома, высадившегося при
одной загрузке;
- масса хрома, высадившегося при
одной загрузке;
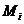 - молекулярная масса i-го
компонента, г/моль;
- молекулярная масса i-го
компонента, г/моль;
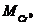 - молекулярная масса хрома, г/моль.
- молекулярная масса хрома, г/моль.
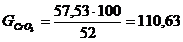 г,
г,
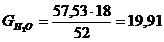 г,
г,
 г,
г,
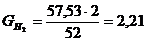 г.
г.
Результаты расчетов материального
баланса по операции хромирование представлены в виде таблицы 4.1.
Таблица 4.1 - Материальный баланс по
операции хромирование
|
Приход
|
Расход
|
|
Статья баланса
|
г/0,4 м2
|
%
|
Статья баланса
|
г/0,4
м2
|
%
|
|
СrО3
|
110,63
|
84,75
|
Сr
|
8,63
|
10,57
|
|
H2О
|
19,91
|
15,25
|
H2
|
2,21
|
2,71
|
|
|
|
О2
|
70,81
|
86,72
|
|
Итого:
|
130,54
|
|
Итого:
|
81,65
|
|
Расчет относительной ошибки материального
баланса по операции хромирование можно рассчитать по формуле:
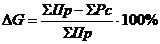 (4.10)
(4.10)
где 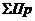 - суммарный приход, г/0,4 м2;
- суммарный приход, г/0,4 м2;
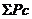 - суммарный расход, г/0,4 м2.
- суммарный расход, г/0,4 м2.
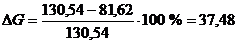 %.
%.
Большая относительная ошибка получается
вследствие того, что на катоде идет реакция образования Сr (III).
Данные таблицы 4.1 представлены на
диаграммах статей прихода и расхода.
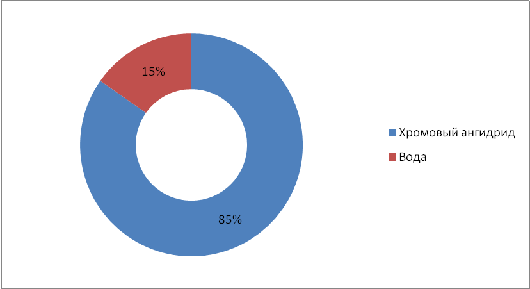
Рисунок 4.1 - Диаграмма статей
прихода операции хромирование
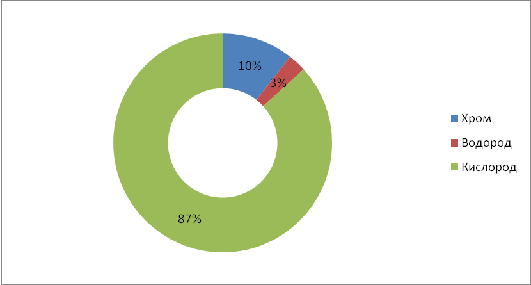
Рисунок 4.2 - Диаграмма статей
расхода операции хромирование
4.3 Расчет годового расхода химикатов и воды на
промывку
Расход химикатов (компонентов технологических
растворов) обусловлен их полезным расходом на образование покрытия,
технологически неизбежными потерями, сменой отработанных растворов и
приготовлением растворов при первичном запуске оборудования:
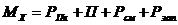 (4.11)
(4.11)
где 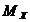 - годовой расход химикатов, кг;
- годовой расход химикатов, кг;
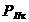 - полезный расход химикатов на
образование покрытия, кг;
- полезный расход химикатов на
образование покрытия, кг;
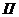 - технологически неизбежные потери
химикатов, кг;
- технологически неизбежные потери
химикатов, кг;
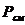 - расход химикатов при замене
отработанного раствора, кг;
- расход химикатов при замене
отработанного раствора, кг;
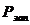 - расход химикатов на приготовление
растворов при первичном запуске оборудования, кг.
- расход химикатов на приготовление
растворов при первичном запуске оборудования, кг.
Технологически неизбежные потери
включают в себя:
- уменьшение содержания компонентов за счет
химического взаимодействия с материалом деталей, продуктами коррозии и жировыми
загрязнениями;
- унос растворов деталями и
приспособлениями при выгрузке их из ванны;
- унос растворов в виде аэрозолей и
капель в вентиляционные каналы для вентилируемых ванн;
- потери при фильтрации растворов и
чистке ванн;
- потери при приготовлении и
корректировании растворов;
- потери при регенерации электролитов
под током.
Технологически неизбежные потери химиката
рассчитывают по формуле:
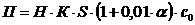 (4.12)
(4.12)
где Н - норматив технологически
неизбежных потерь, л/м2 (таблица 6.6) [9];
К - поправочный коэффициент;
S - годовая
программа нанесения покрытия, м2/год;
α - количество бракованных
покрытий, %;
с0 - концентрация химиката в
технологическом растворе, кг/л.
Нормативы технологически неизбежных
потерь (Н) зависят от сложности профиля деталей и характеристики оборудования и
установлены в л раствора на 1 м2 при обработке II группы сложности на подвесках
в стационарных ваннах, а в других случаях умножаются на поправочные
коэффициенты.
Расход химикатов при замене
отработанного раствора (Рсм, кг/год) определяют по формуле:
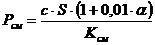 (4.13)
(4.13)
где Рсм - расход химиката при замене
раствора, кг/год;
с - концентрация химиката в
технологическом растворе, кг/л;
S - годовая
программа нанесения покрытия, м2/год;
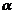 - величина брака, %;
- величина брака, %;
Ксм - удельная работоспособность
технологических растворов (таблица 6.12) [9].
Расход химикатов на приготовление
растворов при запуске оборудования определяют на основании рабочего объема
ванны и рецептурного содержания компонентов по формуле:
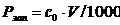 (4.14)
(4.14)
где 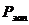 - расход химиката при запуске
оборудования, кг;
- расход химиката при запуске
оборудования, кг;
с0 - максимальная концентрация
химиката в технологическом растворе, г/л;
V - объем
ванны, л.
При нанесении покрытий полезный
расход и технологически неизбежные потери хромового ангидрида рассчитывают по
формуле:
 (4.15)
(4.15)
Норматив расхода хромового ангидрида
рассчитывают по формуле:
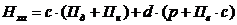 (4.16)
(4.16)
где 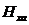 - норматив расхода хромового
ангидрида, г/м2;
- норматив расхода хромового
ангидрида, г/м2;
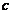 - концентрация хромового ангидрида
в электролите, г/л;
- концентрация хромового ангидрида
в электролите, г/л;
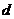 - средняя толщина покрытия, мкм;
- средняя толщина покрытия, мкм;
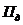 - потери электролита за счет уноса
с деталями и приспособлениями, л/м2;
- потери электролита за счет уноса
с деталями и приспособлениями, л/м2; 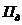 =0,05 л/м2 (таблица 6.9)[9];
=0,05 л/м2 (таблица 6.9)[9];
 - потери электролита при
корректировании, фильтровании и анализе, л/м2;
- потери электролита при
корректировании, фильтровании и анализе, л/м2; 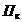 =0,05 л/м2;
=0,05 л/м2;
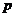 - количество хромового ангидрида,
необходимое для покрытия 1 м2 при толщине слоя 1мкм, г/(м2 ·мкм);
- количество хромового ангидрида,
необходимое для покрытия 1 м2 при толщине слоя 1мкм, г/(м2 ·мкм); 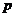 =14 г/(м2
мкм);
=14 г/(м2
мкм);
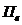 - потери электролита за счет уноса
в вентиляцию, л/(м2· мкм);
- потери электролита за счет уноса
в вентиляцию, л/(м2· мкм); 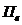 =0,18 л/(м2· мкм).
=0,18 л/(м2· мкм).
Годовой расход реагентов по
операциям обезжиривание, травление и хромирование (кроме хромового ангидрида)
рассчитаем по формулам (4.11 - 4.13):
Nа3РО4*10H2О:
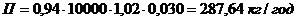 ,
,
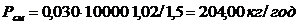 ,
,
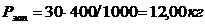 ,
,
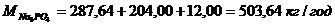 .
.
Расчетные значения остальных
реагентов представлены в следующей таблице.
Таблица 4.2 - Расчетные значения
реагентов
|
Реагент
|
 , кг/год , кг/год ,
кг/год ,
кг/год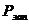 ,
кг ,
кг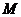 ,
кг/год ,
кг/год
|
|
|
|
|
Nа3РО4*10H2О
|
287,64
|
204,00
|
12,00
|
503,64
|
|
NаОH
|
76,70
|
122,40
|
2,40
|
201,50
|
|
Nа2СО3
|
287,64
|
204,00
|
12,00
|
503,64
|
|
НСl
|
767,04
|
544,00
|
32,00
|
1343,04
|
|
HNО3
|
767,04
|
544,00
|
32,00
|
1343,04
|
|
H2SО4
|
3840,30
|
2720,41
|
160,80
|
6721,51
|
Годовой расход хромового ангидрида рассчитаем в
соответствии с формулами (4.15) - (4.16):
H2СrО4
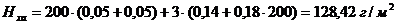 ,
,
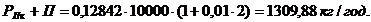
Расход воды на промывку
рассчитывается по формуле:
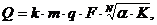 (4.17)
(4.17)
где Q - расход
воды на промывку, л/ч;
k -
коэффициент, учитывающий способ промывки: 1,0 при объемном способе, 0,7 при
поверхностном и 0,5 при комбинированном;
m -
количество ступеней промывки с автономной подачей воды;
q - удельный
вынос (унос) раствора, л/м2;
F - площадь
обрабатываемой поверхности в единицу времени (производительность линии или
технологической ванны), м2/ч;
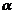 - коэффициент, учитывающий наличие
ванн улавливания: 0,4 при одной ванне, 0,15 при двух и 0,06 при трех ваннах
улавливания;
- коэффициент, учитывающий наличие
ванн улавливания: 0,4 при одной ванне, 0,15 при двух и 0,06 при трех ваннах
улавливания;
К - кратность разбавления.
Кратность разбавления определяется
по формуле:
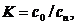 (4.18)
(4.18)
где с0 - концентрация отмываемого
компонента в технологической ванне, г/л;
сn -
предельная концентрация отмываемого компонента в последней (по ходу движения
деталей) ступени промывки, г/л (таблица 9.4) [9].
Рассчитываем расход воды на
обезжиривание.
Концентрации всех компонентов в
ванне обезжиривания пересчитывают на общую щелочность едкого натра, используя
коэффициенты пересчета: 0,315 для тринатрийфосфата и 0,755 для кальцинированной
соды.
с0=8+30 0,315+30
0,315+30 0,755=40,1 г/л;
0,755=40,1 г/л;
сn=0,2+0,001 0,315+0,1
0,315+0,1 0,755=0,275815 г/л;
0,755=0,275815 г/л;
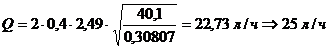 .
.
Для расчета воды на травление
определяем концентрации кислот в пересчете на серную по формуле, используя
переводные коэффициенты 0,78 и 1,34 для азотной и соляной кислот
соответственно:
с0=400+80 0,78+80
0,78+80 1,34=569,6 г/л;
1,34=569,6 г/л;
сn=1+0,06 0,78+0,5
0,78+0,5 1,34=1,7168 г/л;
1,34=1,7168 г/л;
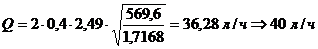
После хромирования расход воды на
промывку составит
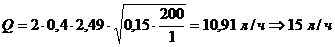
Суммарный расход воды на промывку
составит:
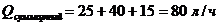
Умножим суммарный расход воды на
действительный годовой фонд времени:
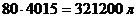
Рассчитаем массу воды:
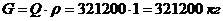
Безвозвратный унос электролитов
составляет около 10 %. Представим результаты расчета в виде таблицы 4.1.
Таблица 4.3 - Материальный баланс
процесса хромирования
|
Приход
|
Расход
|
|
Статья баланса
|
кг/год
|
%
|
Статья баланса
|
кг/год
|
%
|
|
Nа3РО4*10H2О
|
503,64
|
0,048
|
Nа3РО4*10H2О
|
453,28
|
0,043
|
|
|
|
Унос Nа3РО4*10H2О
|
50,36
|
0,005
|
|
NаОH
|
201,50
|
0,019
|
NаОH
|
181,35
|
0,017
|
|
|
|
Унос NаОH
|
20,15
|
0,002
|
|
Nа2СО3
|
503,64
|
0,048
|
Nа2СО3
|
453,28
|
0,043
|
|
|
|
Унос Nа2СО3
|
50,36
|
0,005
|
|
НСl
|
1343,04
|
0,127
|
НСl
|
1208,74
|
0,114
|
|
|
|
Унос НСl
|
134,30
|
0,013
|
|
HNО3
|
1343,04
|
0,127
|
HNО3
|
1208,74
|
0,114
|
|
|
|
Унос HNО3
|
134,30
|
0,013
|
|
H2SО4
|
6721,51
|
0,637
|
H2SО4
|
6049,36
|
0,573
|
|
|
|
Унос H2SО4
|
672,15
|
0,064
|
|
СrО3
|
1309,88
|
0,124
|
Сr
|
86,3
|
0,008
|
|
|
|
H2
|
22,1
|
0,002
|
|
|
|
О2
|
708,1
|
0,067
|
|
|
|
Прочие потери
|
493,38
|
0,047
|
|
H2О
|
1043900
|
98,870
|
H2О
|
1043900
|
98,870
|
|
Итого
|
1055826,25
|
100
|
Итого
|
1055826,25
|
100
|
Данные о статьях прихода таблицы 4.3
представлены на следующей диаграмме.
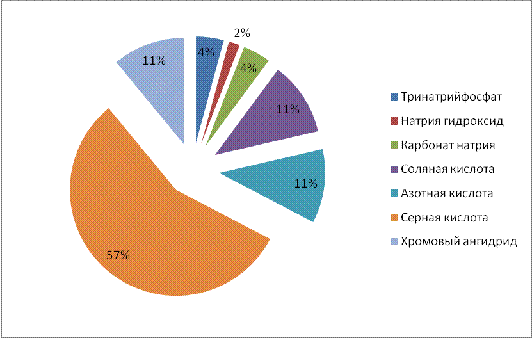
Рисунок 4.3 - Диаграмма статей
прихода материального баланса процесса хромирования
5. Расчет материального баланса очистки сточных
вод [9]
Очистка хромсодержащих стоков производится
реагентным методом по реакциям 2.5 и 2.7. Основными компонентами в реакции
будут кислота серная, натрия гидроксид, железо сернокислое. Задавшись основными
реактивами получим следующие реакции проведения очистки хромсодержащих стоков:
СrО3
+ 6FеSО4
+ 6H2SО4
= 3Fе2(SО4)3
+ Сr2(SО4)3+6H2О 5.1
Сr2(SО4)3
+ 6NаОH
= 2Сr(ОH)3
+ 3Nа2SО4 5.2
Из таблицы 3.1 принимаем значение концентрации
хромового ангидрида в стоках и умножаем на действительный годовой фонд времени
вместе с количеством воды на промывку.
·4015·15=60225 г/год.
Используя формулу находим количество реагентов:
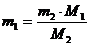 (5.3)
(5.3)
где 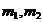 - масса первого и второго веществ
соответственно, кг;
- масса первого и второго веществ
соответственно, кг;
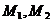 - молярная масса первого и второго
веществ соответственно, кг/кмоль.
- молярная масса первого и второго
веществ соответственно, кг/кмоль.
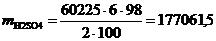 г/год,
г/год,
 г/год,
г/год,
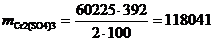 г/год,
г/год,
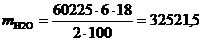 г/год,
г/год,
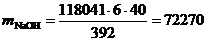 г/год,
г/год,
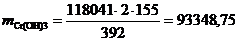 г/год,
г/год,
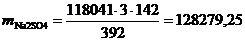 г/год.
г/год.
Полученные результаты представим в
таблице материального баланса.
Таблица 5.1 - Материальный баланс
процесса очистки хромсодержащих сточных вод
|
Приход
|
Расход
|
|
Статья баланса
|
г/год
|
%
|
Статья баланса
|
г/год
|
%
|
|
СrО3
|
60225
|
9,78
|
Fе2(SО4)3
|
361350
|
58,71
|
|
FеSО4
|
305943
|
49,71
|
H2О
|
32521,5
|
5,28
|
|
H2SО4
|
177061,5
|
28,77
|
Сr(ОH)3
|
93348,75
|
15,17
|
|
NаОH
|
72270
|
11,74
|
Nа2SО4
|
128279,25
|
20,84
|
|
Итого
|
615499,5
|
100
|
Итого
|
615499,5
|
100
|
6. Расчет насадочного абсорбера [11]
Геометрические размеры колонного массообменного
аппарата определяются в основном поверхностью массопередачи, необходимой для
проведения данного процесса, и скоростями фаз.
Поверхность массопередачи может быть найдена из
основного уравнения массопередачи:
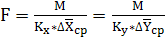 (6.1)
(6.1)
где 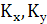 -
коэффициенты массопередачи соответственно по жидкой и газовой фазам, кг/(м2*с).
-
коэффициенты массопередачи соответственно по жидкой и газовой фазам, кг/(м2*с).
Абсорбция проходит при атмосферном давлении,
удельный расход 2,5 м3/с, температура поглощающей жидкости 20 оС, данные
концентраций представлены ниже:
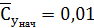 мг/м3;
мг/м3;
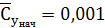 мг/м3;
мг/м3;
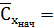 100 мг/л.
100 мг/л.
Массу хромового ангидрида, переходящего в
процессе абсорбции из загрязненного воздуха в поглотитель за единицу времени,
находят из уравнения материального баланса:
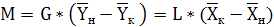 (6.2)
(6.2)
где 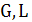 -
расходы соответственно чистого поглотителя и инертной части газа, кг/с;
-
расходы соответственно чистого поглотителя и инертной части газа, кг/с;
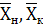 - начальная и
конечная концентрация хромового ангидрида в воде, кг СrО3/кг
H2О;
- начальная и
конечная концентрация хромового ангидрида в воде, кг СrО3/кг
H2О;
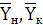 - начальная и
конечная концентрация хромового ангидрида в газе, кг СrО3/кг
воздуха.
- начальная и
конечная концентрация хромового ангидрида в газе, кг СrО3/кг
воздуха.
Выразим составы фаз, нагрузки по газу и жидкости
в выбранной для расчета размерности
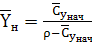 , (6.3)
, (6.3)
где 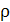 -
плотность смеси, кг/м3.
-
плотность смеси, кг/м3.
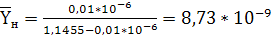 кг СrО3/кг
воздуха,
кг СrО3/кг
воздуха,
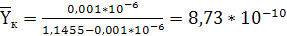 кг СrО3/кг
воздуха,
кг СrО3/кг
воздуха,
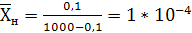 кг СrО3/кг
H2О.
кг СrО3/кг
H2О.
Заданный коэффициент избытка поглотителя имеет
значение 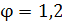 .
В этом случае конечную концентрацию
.
В этом случае конечную концентрацию 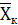 определяют
из уравнения материального баланса, используя данные по равновесию (см. рис.
6.1 и 6.2)
определяют
из уравнения материального баланса, используя данные по равновесию (см. рис.
6.1 и 6.2)
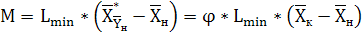 (6.4)
(6.4)
Уравнение равновесной линии имеет вид
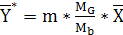 (6.5)
(6.5)
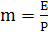 , (6.6)
, (6.6)
где  -
коэффициент распределения, кг H2О/кг воздуха;
-
коэффициент распределения, кг H2О/кг воздуха;
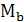 - молярная масса
воздуха;
- молярная масса
воздуха;
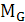 - молярная масса
воды;
- молярная масса
воды;
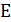 - коэффициент
Генри, 79993,2 Па;
- коэффициент
Генри, 79993,2 Па;
 - общее давление
смеси газов, Па.
- общее давление
смеси газов, Па.
Известно, что равновесная линия проходит через
начало координат. Найдем значение 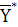 при
при
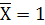 и
построим равновесную линию по двум точкам:
и
построим равновесную линию по двум точкам:
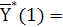 0,49.
0,49.
Отсюда:
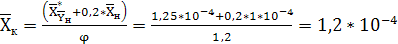 кг СrО3/кг
H2О
кг СrО3/кг
H2О
где 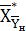 -
концентрация хромового ангидрида в жидкости, равновесная с газом начального
состава.
-
концентрация хромового ангидрида в жидкости, равновесная с газом начального
состава.
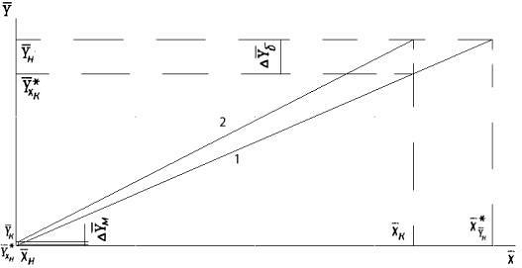
- равновесная линия; 2 - рабочая линия
Рисунок 6.1 - Зависимость между содержанием
хромового ангидрида в воздухе Y кг NH3/кг воздуха и поглощающей воде X кг СrО3/кг
H2О
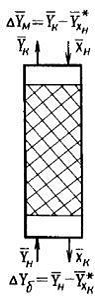
Рисунок 6.2 - Схема распределения концентраций в
газовом и жидкостном потоках в абсорбере
Расход инертной части газа:
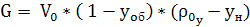 , (6.7)
, (6.7)
где 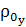 -
средняя плотность хромового ангидрида при нормальных условиях;
-
средняя плотность хромового ангидрида при нормальных условиях;
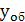 - объемная доля
хромового ангидрида в газе, равная
- объемная доля
хромового ангидрида в газе, равная
 , (6.8)
, (6.8)
где 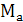 -
молярная масса хромового ангидрида.
-
молярная масса хромового ангидрида.
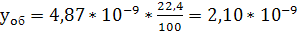 м3 СrО3/м3
воздуха.
м3 СrО3/м3
воздуха.
Тогда:
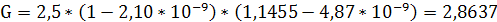 кг/с.
кг/с.
Производительность абсорбера по поглощаемому
компоненту:
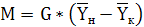 , (6.9)
, (6.9)
 кг/с.
кг/с.
Расход поглотителя (воды) равен
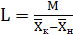 , (6.10)
, (6.10)
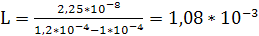 кг/с.
кг/с.
Тогда соотношение расходов фаз, или удельный
расход поглотителя, составит
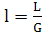 , (6.11)
, (6.11)
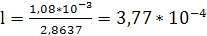 .
.
Движушая сила в соответствии с уравнением (6.1)
может быть выражена в единицах концентраций как жидкой, так и газовой фаз. Для
случая линейной равновесной зависимости между составами фаз. принимая модель
идеального вытеснения в потоках обеих фаз, определим движущую силу в единицах
концентраций газовой фазы
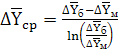 , (6.12)
, (6.12)
где 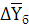 и
и
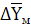 -
большая и меньшая движущие силы на входе потоков в абсорбер и на выходе из
него, кг СrО3/кг воздуха (рис.
2.1 и 2.2).
-
большая и меньшая движущие силы на входе потоков в абсорбер и на выходе из
него, кг СrО3/кг воздуха (рис.
2.1 и 2.2).
В данном примере:
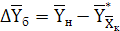 (6.13)
(6.13)
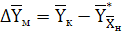 , (6.14)
, (6.14)
где 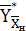 и
и
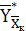 -
концентрации аммиака в воздухе, равновесные с концентрациями в жидкой фазе
(поглотителе) соответственно на входе в абсорбер и на выходе из него (см. рис.
2.1):
-
концентрации аммиака в воздухе, равновесные с концентрациями в жидкой фазе
(поглотителе) соответственно на входе в абсорбер и на выходе из него (см. рис.
2.1):
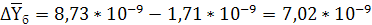 кг СrО3/кг
воздуха,
кг СrО3/кг
воздуха,
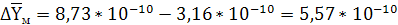 кг СrО3/кг
воздуха,
кг СrО3/кг
воздуха,
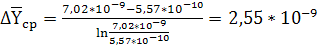 кг СrО3/кг
воздуха.
кг СrО3/кг
воздуха.
Коэффициент массопередачи 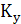 находят
по уравнению аддитивности фазовых диффузионных сопротивлений
находят
по уравнению аддитивности фазовых диффузионных сопротивлений
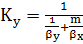 (6.15)
(6.15)
где 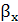 и
и
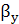 -
коэффициенты массоотдачи соответственно в жидкой и газовой фазах, кг/(м2*с).
-
коэффициенты массоотдачи соответственно в жидкой и газовой фазах, кг/(м2*с).
Для расчета коэффициентов массоотдачи необходимо
выбрать тип насадки и рассчитать скорости потоков в абсорбере.
В рассматриваемом примере выберем насадку -
керамические кольца Рашига, размером 50×50×5
мм. Удельная поверхность насадки а = 90 м2/м3, свободный объем ε
= 0,785 м3/м3, эквивалентный диаметр dэ
= 0,035 м, насыпная плотность 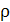 = 530 кг/м3.
= 530 кг/м3.
Предельную скорость газа, выше которой наступает
захлебывание насадочных абсорберов, можно рассчитать по уравнению
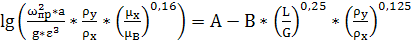 (6.16)
(6.16)
где 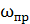 -
предельная фиктивная скорость газа, м/с;
-
предельная фиктивная скорость газа, м/с;
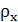 и
и 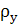 -
плотность поглощающей воды и смеси воздуха с аммиаком, кг/м3;
-
плотность поглощающей воды и смеси воздуха с аммиаком, кг/м3;
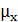 ,
, 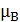 -
вязкость соответственно поглотителя при температуре в абсорбере и воды при
20°С, Па*с;
-
вязкость соответственно поглотителя при температуре в абсорбере и воды при
20°С, Па*с;
А, В - коэффициенты, зависящие от типа насадки;и
G - расходы фаз, кг/с.
Для колец Рашига внавал значения коэффициентов А
= -0,073 и В = 1,75.
Пересчитаем плотность газа на условия в
абсорбере
 , (6.17)
, (6.17)
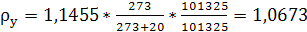 кг/м3.
кг/м3.
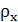 и
и 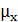 соответственно
равны 1000 кг/м3 и
соответственно
равны 1000 кг/м3 и 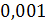 Па*с.
Па*с.
Предельную скорость 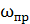 находим
из уравнения (6.16), принимая при этом, что отношение расходов фаз в случае
разбавленных смесей приблизительно равно отношению расходов инертных фаз
находим
из уравнения (6.16), принимая при этом, что отношение расходов фаз в случае
разбавленных смесей приблизительно равно отношению расходов инертных фаз
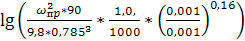 =
=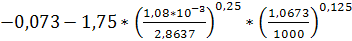 .
.
Решая это уравнение, получим  м/с.
м/с.
Выбор рабочей скорости газа обусловлен многими
факторами. В общем случае ее находят путем технико-экономического расчета для
каждого конкретного процесса. Обычно рабочую скорость  принимают
равной 0,75-0,9 от предельной, т.о.
принимают
равной 0,75-0,9 от предельной, т.о. 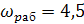 м/с.
м/с.
Диаметр абсорбера находят из уравнения расхода
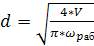 , (6.18)
, (6.18)
где 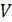 -
объемный расход газа при условиях в абсорбере, м3/с.
-
объемный расход газа при условиях в абсорбере, м3/с.
Отсюда:
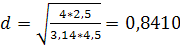 м.
м.
Выбираем стандартный диаметр обечайки абсорбера 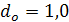 м.
При этом действительная рабочая скорость газа в колонне
м.
При этом действительная рабочая скорость газа в колонне
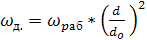 , (6.19)
, (6.19)
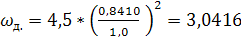 м/с.
м/с.
Плотность орошения (скорость жидкости)
рассчитывают по формуле
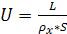 , (6.20)
, (6.20)
где 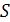 -
площадь поперечного сечения абсорбера, м2.
-
площадь поперечного сечения абсорбера, м2.
Подставив, получим:
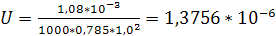 м3/(м2*с).
м3/(м2*с).
Существует некоторая минимальная эффективная
плотность орошения 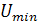 , выше которой всю
поверхность насадки можно считать смоченной. Для насадочных абсорберов
минимальную эффективную плотность орошения Umin находят по соотношению
, выше которой всю
поверхность насадки можно считать смоченной. Для насадочных абсорберов
минимальную эффективную плотность орошения Umin находят по соотношению
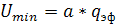 , (6.21)
, (6.21)
где 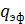 -
эффективная линейная плотность орошения, м2/с.
-
эффективная линейная плотность орошения, м2/с.
Для колец Рашига размером 75 мм и хордовых
насадок с шагом более 50 мм 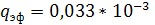 м2/с; для всех
остальных насадок
м2/с; для всех
остальных насадок 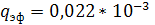 м2/с.
м2/с.
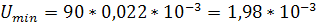 м3/(м2*с).
м3/(м2*с).
Коэффициент смачиваемости насадки 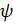 для
колец Рашига при заполнении колонны внавал можно определить из следующего
эмпирического уравнения
для
колец Рашига при заполнении колонны внавал можно определить из следующего
эмпирического уравнения
 (6.22)
(6.22)
где 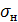 -
поверхностное натяжение, мН/м;
-
поверхностное натяжение, мН/м;
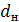 - диаметр насадки,
см;
- диаметр насадки,
см;
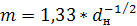 . (6.23)
. (6.23)
Поверхностное натяжение принимаем 72 мН/м.
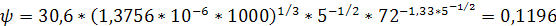 .
.
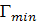 может быть
рассчитано по уравнению
может быть
рассчитано по уравнению
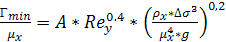 (6.24)
(6.24)
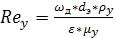 (6.25)
(6.25)
где А - коэффициент который зависит от краевого
угла смачивания и изменяется в пределах 0,12-0,17;
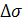 - разница между поверхностным
натяжением жидкости, подаваемой на орошение колонны, и жидкости, вытекающей из
нее;
- разница между поверхностным
натяжением жидкости, подаваемой на орошение колонны, и жидкости, вытекающей из
нее;
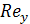 - критерий
Рейнольдса для газовой фазы в насадке;
- критерий
Рейнольдса для газовой фазы в насадке;
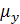 - вязкость газа.
- вязкость газа.
Вязкость газов находится берем 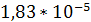 Па*с.
Па*с.
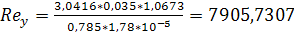 .
.
Поверхностное натяжение жидкости вытекающей из
колонны составляет 67 мН/м.
Разница между поверхностным натяжением жидкости,
подаваемой на орошение колонны, и жидкости, вытекающей из нее имеет вид
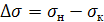 , (6.26)
, (6.26)
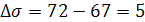 мН/м,
мН/м,
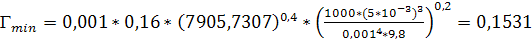 кг/(м*с)
кг/(м*с)
Доля активной поверхности насадки 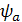 может
быть найдена по формуле
может
быть найдена по формуле
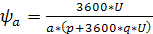 (6.27)
(6.27)
где 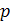 и
и
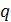 -
коэффициенты, зависящие от типа насадки.
-
коэффициенты, зависящие от типа насадки.
Подставив численные значения, получим:
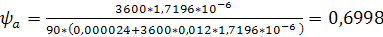 .
.
Для колонн с неупорядоченной насадкой
коэффициент массоотдачи в газовой фазе 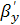 можно
найти из уравнения
можно
найти из уравнения
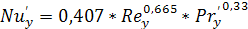 (6.28)
(6.28)
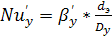 (6.29)
(6.29)
где 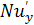 -
диффузионный критерий Нуссельта для газовой фазы.
-
диффузионный критерий Нуссельта для газовой фазы.
Отсюда 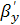 равен:
равен:
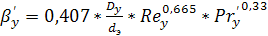 (6.30)
(6.30)
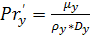 (6.31)
(6.31)
где 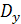 -
средний коэффициент диффузии аммиака в газовой фазе, м2/с;
-
средний коэффициент диффузии аммиака в газовой фазе, м2/с;
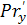 - диффузионный
критерий Прандтля для газовой фазы, Па*с.
- диффузионный
критерий Прандтля для газовой фазы, Па*с.
Коэффициент диффузии хромового ангидрида в газе
можно рассчитать по уравнению
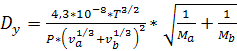 (6.32)
(6.32)
где 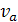 и
и
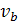 -
мольные объемы хромового ангидрида и загрязненного воздуха в жидком состоянии
при нормальной температуре кипения, см3/моль;
-
мольные объемы хромового ангидрида и загрязненного воздуха в жидком состоянии
при нормальной температуре кипения, см3/моль;
Подставив, получим:
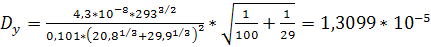 м2/с,
м2/с,
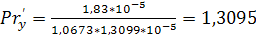 ,
,
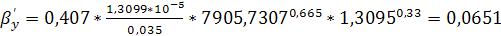 м/с.
м/с.
Выразим 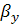 в
выбранной для расчета размерности:
в
выбранной для расчета размерности:
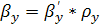 , (6.33)
, (6.33)
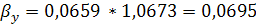 кг/(м2*с).
кг/(м2*с).
Коэффициент массоотдачи в жидкой фазе 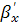 находят
из обобщенного уравнения:
находят
из обобщенного уравнения:
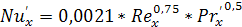 , (6.34)
, (6.34)
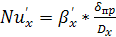 , (6.35)
, (6.35)
где 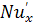 -
диффузионный критерий Нуссельта для жидкой фазы.
-
диффузионный критерий Нуссельта для жидкой фазы.
Отсюда 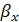 (в
м/с) равен:
(в
м/с) равен:
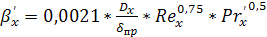 (6.36)
(6.36)
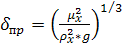 (6.37)
(6.37)
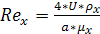 , (6.38)
, (6.38)
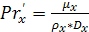 , (6.39)
, (6.39)
где 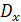 -
средний коэффициент диффузии хромового ангидрида в поглотительной воде, м2/с;
-
средний коэффициент диффузии хромового ангидрида в поглотительной воде, м2/с;
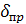 - приведенная
толщина стекающей пленки жидкости, м;
- приведенная
толщина стекающей пленки жидкости, м;
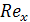 - модифицированный
критерий Рейнольдса для стекающей по насадке пленки жидкости;
- модифицированный
критерий Рейнольдса для стекающей по насадке пленки жидкости;
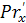 - диффузионный
критерий Прандтля для жидкости.
- диффузионный
критерий Прандтля для жидкости.
В разбавленных растворах коэффициент диффузии 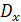 может
быть достаточно точно вычислен по уравнению
может
быть достаточно точно вычислен по уравнению
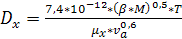 (6.40)
(6.40)
где  -
мольная масса поглотительной воды, кг/кмоль;
-
мольная масса поглотительной воды, кг/кмоль;
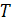 - температура
воды, К;
- температура
воды, К;
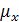 - вязкость
поглотительной воды, мПа*с;
- вязкость
поглотительной воды, мПа*с;
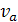 - мольный объем
хромового ангидрида, см3/моль;
- мольный объем
хромового ангидрида, см3/моль;
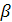 - параметр,
учитывающий ассоциацию молекул, для воды
- параметр,
учитывающий ассоциацию молекул, для воды 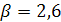 .
.
Молярная масса поглотительной воды равна 17,99
кг/кмоль.
Подставив, получим:
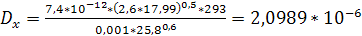 м2/с;
м2/с;
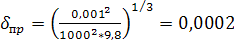 м;
м;
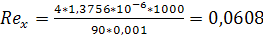 ;
;
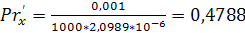 ;
;
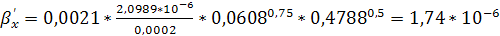 м/с.
м/с.
Выразим 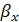 в
выбранной для расчета размерности
в
выбранной для расчета размерности
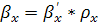 , (6.41)
, (6.41)
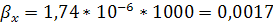 кг/(м2*с).
кг/(м2*с).
По уравнению (6.15) рассчитаем коэффициент
массопередачи в газовой фазе:
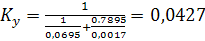 кг/(м2*с).
кг/(м2*с).
Поверхность массопередачи в абсорбере по
уравнению (6.1) равна:
 м2 .
м2 .
Высоту насадки, необходимую для создания этой
поверхности массопередачи, рассчитаем по формуле
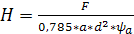 (6.42)
(6.42)
Подставив численные значения, получим:
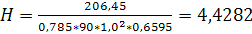 м.
м.
Обычно высота скрубберов не превышает 40-50 м, в
нашем случае это условие выполняется.
С учетом того, что высота слоя насадки в одной
секции 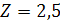 м,
общее число секций в колонне составляет 4.
м,
общее число секций в колонне составляет 4.
Общую высоту абсорбционной установки определяют
по формуле
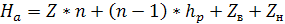 , (6.43)
, (6.43)
где 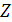 -
высота насадки в одной секции;
-
высота насадки в одной секции;
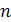 - число секций;
- число секций;
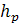 - высота
промежутков между секциями насадки, в которых устанавливают распределители
жидкости, м;
- высота
промежутков между секциями насадки, в которых устанавливают распределители
жидкости, м;
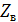 и
и 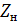 -
соответственно расстояние от верха насадки до крышки и расстояние между днищем
и низом насадки.
-
соответственно расстояние от верха насадки до крышки и расстояние между днищем
и низом насадки.
Расстояние между днищем абсорбера и насадкой 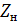 определяется
необходимостью равномерного распределения газа по поперечному сечению колонны.
Расстояние от верха насадки до крышки абсорбера
определяется
необходимостью равномерного распределения газа по поперечному сечению колонны.
Расстояние от верха насадки до крышки абсорбера 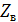 зависит
от размеров распределительного устройства для орошения насадки и от высоты
сепарационного пространства (в котором часто устанавливают каплеотбойные
устройства для предотвращения брызгоуноса из колонны). Согласно, примем эти
расстояния равными соответственно 2,5 и 1,4 м. Тогда общая высота абсорбера:
зависит
от размеров распределительного устройства для орошения насадки и от высоты
сепарационного пространства (в котором часто устанавливают каплеотбойные
устройства для предотвращения брызгоуноса из колонны). Согласно, примем эти
расстояния равными соответственно 2,5 и 1,4 м. Тогда общая высота абсорбера:
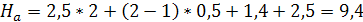 м.
м.
. Основные аппараты процесса хромирования,
процессов утилизации и регенерации сточных вод
.1 Технологическая ванна
В зависимости от назначения ванн применяются
различные типы корпусов. Показанный на рисунке 7.1 корпус ванны без кармана
применяется для следующих технологических операций: электролитического
нанесения покрытий, травления, улавливания, декапирования, пассивирования,
осветления, оксидирования, окрашивания алюминия, нейтрализации, химического и
электрохимического полирования, редукции, удаления некачественных покрытий,
сатинирования, снятия шлама. Корпус ванны с карманом, показанный на рисунке
7.2, применяется в основном для ванн холодной и горячей промывки, химического и
электрохимического обезжиривания и травления алюминия. Корпуса ванн, показанных
на рисунках 7.3 и 7.4, предназначены для ванн двух- и трехступенчатой
противоточной промывки. В ваннах многоступенчатой противоточной промывки чистая
вода поступает сначала в секцию, наиболее удаленную от кармана, переливается в
следующую секцию и так до тех пор, пока не попадает в карман, а из него на
очистку. Промываемые детали движутся навстречу потоку воды, т. е. сначала
попадают в наиболее «грязную» секцию с карманом, потом - в следующую и так до
тех пор, пока не попадут в последнюю «чистую» секцию. Применение противоточной
каскадной промывки сокращает расход воды.

Рисунок 7.1 - Корпус ванны без кармана
Рисунок 7.2 - Корпус ванны с карманом

Рисунок 7.3 - Корпус ванны двухкаскадной
промывки
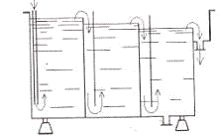
Рисунок 7.4 - Корпус ванны трехкаскадной
промывки
Для изготовления корпусов ванн холодной
промывки, декапирования, цинкования, улавливания, осветления, пассивирования
применяют Ст3.
Внутренние стороны стенок ванн желательно
футеровать винипластом или пластикатом, что предохраняет растворы ванн от
попадания в них загрязнений материала стенок.
Для изготовления корпусов ванн обезжиривания и
горячей промывки применяют сталь 12Х18Н10Т. Футеровка этих материалов в ваннах
обезжиривания и горячей промывки не требуется.
Добавка в сталь титана предохраняет ее от
межкристаллитной коррозии, наиболее опасного вида коррозии, которая, не
разрушая зерен металла, продвигается внутрь по их менее стойким границам. Почти
не оставляя следов на поверхности, эта коррозия может привести к полной потере
прочности и разрушению детали или конструкции.
Из всех относительно доступных металлов титан
наиболее коррозионностоек. Сравнительно высокая его стоимость оправдывается
большим экономическим эффектом, химической стойкостью его к воздействию
различных сред.
Процессом футеровки называется облицовка
внутренних поверхностей корпусов гальванических ванн химически стойкими
материалами. Она выполняет двоякую роль: защищает стенки ванн от разрушения при
воздействии растворов и предохраняет раствор от загрязнений продуктами
растворения материала стенок.
В каждом конкретном случае материал для
футеровки выбирается в зависимости от агрессивности раствора, его температуры,
размеров ванны и других эксплуатационных условий.
Для футеровки применяют пластмассовые или
металлические материалы, резину или керамические плитки. В настоящее время
наибольшее применение в практике защиты корпусного гальванического оборудования
находят пластмассовые и металлические материалы, а также резина. Объясняется
это менее трудоемкой по сравнению с облицовкой керамической плиткой технологией
нанесения покрытия, позволяющей применять средства механизации при подготовке
поверхности и нанесении покрытия, менее строгими требованиями к жесткости
корпуса ванны, возможностью защищать оборудование, имеющее не только плоские
внутренние поверхности.
В гальванических цехах для нагрева растворов в
ваннах используют в качестве теплоносителя насыщенный и перегретый пар,
электроэнергию, горячую воду.
Для нагрева растворов в ваннах в качестве
теплоносителя используют насыщенный и перегретый пар, электроэнергию, горячую
воду. При рабочих температурах растворов 80-90 °С и ниже применение насыщенного
пара является предпочтительным, так как такой способ нагрева является наиболее
дешевым и безопасным. Нагревателем является паровой змеевик. Он может быть
изготовлен из углеродистой стали, коррозионностойкой хромоникелевой стали.
Располагаться может у боковой стенки ванны, боковой змеевик, (рисунок 7.5) или
на дне ванны, донный змеевик, (рисунок 7.6).

Рисунок 7.5 - Боковой змеевик
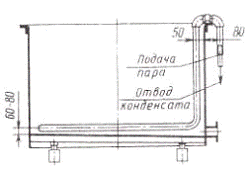
Рисунок 7.6 - Донный змеевик
Разновидностью нагрева раствора является нагрев
пароводяной рубашкой (рисунок 7.7). При таком способе нагрева раствора пар и
вода поступают в тройник 3 одновременно, смешиваются в нем и в барботер 4
поступает горячая вода, которая через отверстия попадает в рубашку и нагревает
в ней воду. Верхний, более холодный слой воды при этом сливается в канализацию
через патрубок 12 к воронку 11. Сечение патрубка 12 принимается примерно в 4
раза большим, чем диаметр барботера. Отверстии в барботере расположены
несколькими группами. Диаметр этих отверстий в небольших по длине ваннах
принимается 2-4 мм, а в более длинных ваннах 3-6 мм. Диаметр этих отверстий
увеличивается по мере их удаления от начала барботера. Для более равномерного
нагрева водяной рубашки барботер может иметь две параллельные трубы,
расположенные под дном ванны 2.
Пароводяная рубашка нагревает ванну медленнее,
чем паровой змеевик. Однако при правильно выбранном объеме она гораздо точнее
поддерживает заданную температуру раствора в рабочей ванне. Объем рубашки
должен составлять 40-60 % от объема раствора в рабочей ванне, а уровень
растворов в обеих ваннах принимается примерно одинаковым или немного большим в
рубашке. Температуру раствора в ванне хромирования при таких соотношениях можно
поддерживать с точностью ±1 °С.
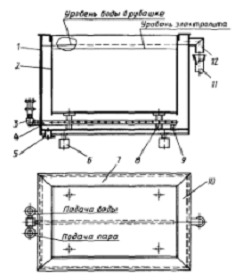
- внешняя ванна; 2 - рабочая ванна; 3 - тройник;
4 - барботер; 5 - патрубок слива воды из рубашки; 6 - ножка ванны;7, 10 -
обвязка уголков; 8 ножка рабочей ванны; 9 - опора; 11 - воронка;12 - патрубок
Рисунок 7.7 - Ванна с пароводяной рубашкой
7.2 Электрокоагулятор
Электрокоагуляторы могут быть горизонтальными
или вертикальными. Электрокоагулятор обычно представляет собой корпус
прямоугольной или цилиндрической формы, в который помещают электродную систему
- ряд электродов. Обрабатываемая вода протекает между электродами. Электроды
обычно располагаются по вертикали, бывают плоскими и цилиндрическими. С внешней
стороны к корпусу крепят две токоподводящие медные шины, которые соединяют с
электродами. В результате растворения стальных анодов вода обогащается ионами
железа, которые под действием растворенного в воде кислорода переходит в
гидроксид железа.
Простейший электрокоагулятор представляет собой
проточный резервуар с внутренним диэлектрическим покрытием.
Для очистки сточных вод, содержащих в основном
всплывающие вещества, рекомендуется применять электрокоагулятор вертикального
типа, встроенный в горизонтальный отстойник, представленный на рисунке ниже.
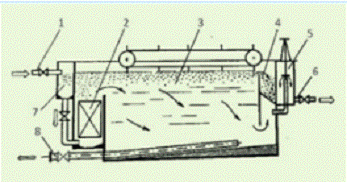
, 6 - поступающая и очищенная вода; 2 -
электродный блок коагулятора; 3 - зона флотации и осаждения; 4 - пеносборный
жёлоб; 5 - устройство, задающее уровень воды; 7 - выпускная камера; 8 - отвод
осадка Рисунок 7.8 - Электрокоагулятор вертикального типа, встроенный в
отстойник
7.3 Электродиализатор
Процесс проводят в электродиализаторах,
простейшая конструкции которых состоит из трех камер, отделенных одна от другой
мембранами. В среднюю камеру заливают раствор, а в боковые, где расположены
электроды, - чистую воду. Анионы током переносятся в анодное пространство. На
аноде выделяется кислород и образуется кислота. Одновременно катионы
переносятся в катодное пространство. На катоде выделяется водород и образуется
щелочь. По мере прохождения тока концентрация солей в средней камере
уменьшается до тех пор, пока не станет близкой к нулю.
За счет диффузии в среднюю камеру поступают ионы
Н+ и ОН-, образуя воду. Этот процесс замедляет перенос ионов соли к
соответствующим электродам. В электродиализаторе (рисунок 7.9) имеется две
мембраны. Одна из них- анионообменная - пропускает в анодную зону анионы.
Другая мембрана - катионообменная, расположена со стороны катода и пропускает
катионы в катодное пространство.
Обычно электролизеры для очистки воды делают
многокамерными (100-200 камер) с чередующимися катионо- и анионопроницаемыми
мембранами. Электроды помещают в крайних камерах. В многокамерных аппаратах
достигается наибольший выход по току.
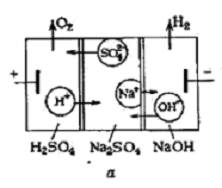
Рисунок 7.9 - Схема электродиализатора
Заключение
В ходе проделанной работы была разработана линия
по нанесения хромового покрытия на 10000 м2/год с последующей очисткой сточных
вод. Для процесса создана технологическая схема, выбрано наиболее рациональное
оборудование, а также произведен расчет насадочного абсорбера для улавливания
хромового ангидрида, тем самым снизив его потери. Рассчитан материальный баланс
по процессам хромирования и очистки сточных вод.
Приложение
Перечень принятых сокращений
ПАВ - поверхностные активные вещества,
ХПК - химическая потребность в кислороде.
Библиографический список
1
Ямпольский, А.М. Краткий справочник гальванотехника [Текст]: учеб. / А.М.
Ямпольский, В.А. Ильин. - М.: МАШГИЗ, 1962. - 244 с.
Богорад,
Л.Я. Хромирование [Текст]: учеб./ Л.Я. Богорад - 5-е изд., испр. и доп. - СПб.:
Машиностроение, 1984. - 94 с.: ил.
Гамбург,
Ю.Д. Гальванические покрытия. Справочник по применению [Текст]: учеб./ Ю.Д.
Гамбург - М.: Техносфера, 2006. - 216 с.: ил.
Грилихес,
С.Я. Обезжиривание, травление и полирование металлов [Текст]: учеб./ С.Я.
Грилихес - СПб.: Машиностроение, 1983. - 101 с.: ил.
ГОСТ
9.314-90. Вода для гальванического производства и схемы промывок. Общие
требования [Текст]. - Введ. 1991-07-01. - М.: Изд-во стандартов, 1990. - 15 с.
ГОСТ
9.305-84. Покрытия металлические и неметаллические неорганические. Операции
технологических процессов получения покрытий [Текст]. - Введ. 1986-01-01. - М.:
Изд-во стандартов, 1984. - 104 с.
Гибкие
автоматизированные гальванические линии: справочник [Текст] / В. Л. Зубченко,
В. И. Захаров, В. М. Рогов [и др.] - М.: Машиностроение, 1989.
Виноградов
С. С. Организация гальванического производства. Оборудование, расчет
производства, нормирование [Текст]: под редакцией проф. В. Н. Кудрявцева. - 2-е
изд., перераб., доп. - М.: Глобус, 2005. - 256 с.
Хранилов,
Ю.П. Автооператорные гальванические линии. Курсовое и дипломное проектирование
[Текст]: учеб. пособие: специальность 240302 и для студентов направления
подготовки бакалавров 240100.62 всех форм обучения / ВятГУ, ХФ, каф. ТЭП; Ю. П.
Хранилов, В. И. Мамаев. - Киров, 2012. - 86 с.
Основные
процессы и аппараты химической технологии: пособие по проектированию [Текст] /
Г.С. Борисов, В.П. Брыков, Ю.И. Дытнерский [и др.] - 2-е изд., перераб. и доп.
/ под ред. Ю.И. Дытнерского - М.: Химия, 1991