Иммуногистохимическая демонстрация обонятельных свойств глутатиона S-трансферазы класса pi (N24)в обонятельной системе озерной нерки в процессе онтогенеза и клеточной пролиферации
Иммуногистохимическая демонстрация
обонятельных свойств глутатиона S-трансферазы класса pi
(N24)в обонятельной системе озерной нерки в процессе онтогенеза и клеточной
пролиферации
Аннотация
У млекопитающих, глутатион S-трансферазы
(GST) содержится в
обонятельном эпителии и включен в работу обонятельных рецепторов для
метаболизма ксентобиотиков. Ранее, мы рассмотрели протеиновую и генную
экспрессию лососевой обонятельной ГСТ класса pi
(soGST) в обонятельных
клетках-рецепторах (ОРК) рыб семейства лососевых. Однако, хронологическая
последовательность soGST
в ОРК в процессе онтогенеза и клеточной пролиферации все еще неизвестна у этого
семейства. В этом исследовании, мы исследовали soGST
с точки зрения иммуногистохимии, используя специфичность антител к soGST
в обонятельной системе (обонятельные плакоды, обонятельные ямки, обонятельный
эпителий, обонятельные нервы и обонятельная луковица) эмбрионов озерной нерки
(Oncorhynchus nerka) и 5-бром-2`-деоксиуридин (BrdU)
экспериментальной рыбы. Проекция обонятельных нервных пучков из обонятельной
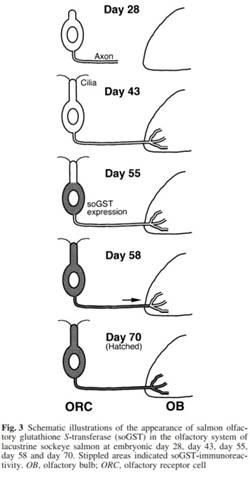
ямки на внеменную обонятельную луковицу была опознана у эмбриона на 28 дне
после оплодотворения. Обонятельные реснички были впервые обнаружены на
апикальной поверхности ОРК на 43. soGST-иммунореактивность
была впервые обнаружена внутри клеток обонятельных ямок на 55 день. На 58 день,
число soGST-иммунореактивных
клеток значительно увеличилось в обонятельном эпителии; и soGST-иммунореактивные
фибры были замечены в обонятельных нервах и обонятельных луковицах. Ин виво
усвоение БДУ у рыбы, возрастом 1 год, мы наблюдали впервые на 7 день после
маркировки, которую обонятельный эпителий проявил в ОРК в которых оба soGST-иммунореактивность
и БДУ сосуществуют. Эти результаты показывают, то soGST-иммунореактивность
синтезируется в зрелых ОРК озерной нерки после клеточного формирования и
дифференцирования.
Ключевые слова: рыба,
обонятельный эпителий, обонятельный нерв, обонятельная луковица,
иммуногистохимия.
Вступление
Глутатион -S-
трансфераза (GST; EC 2.5.1.18) является суперсемейством
ксентобиотико-детоксицирующих ферментов, связывающих различные лиганды и
катализирующие нуклеофильные добавки у глутатиона, для несходных электрофильных
субстратов в ряде тканей (Jakoby 1978; Salinas and Wong 1999). Основанные на
этой биохимической характеFigтике, цитозольные GST
обычно разделяются на четыре класса : альфа, мю, пи и тета (Mannervik and
Danielson 1988; Meyer et al.1991). Предыдущие исследования показали высокую
экспрессию GST протеинов
и/или м-РНК в обонятельном эпителии крыс (Banger et al. 1993; Ben-Arie et al.
1993). Иммунореактивностью GST
были локализованы в поддерживающих эпителиоцитах и железах Боумена
обонятельного эпителия у взрослых крыс (Banger et al. 1994) и крыс в процессе
взросления (Krishna et al. 1994). Наша предыдущая научная работа рассказывала о
том, то у крыс со спровоцированной (дефицитом цинка) аносмией (потерей
обоняния) наблюдалось понижение экспрессии GST
в обонятельном эпителии (Kudo et al. 2000). Эти работы показали, что GST
имеет решающее значение в метаболизировании различных субстанций,
представленных обонятельному эпителию в качестве одорантов и токсичных
субстанций. Было предложено, что GST
могут помогать обонятельным рецепторам ксенобиотическим метаболизмов, как
составная часть «перирецепторного явления».
У радужной форели (Oncorhynchus
mykiss), обонятельные рецепторы изучались на предмет содержания глутатиона
путем гистохимического анализа (Starcevic et al. 1993). GST
класса пи был обнаружен в ОРК путем иммуногистохимии со специфичными к, GST
класса пи млекопитающих (Starcevic and Zielinski 1995),антителами. Мы
распознавали лососевые обонятельные системно-специфичные протеины от 24 а.е.м.
(N24) у рыбы,
семейства лососевых - озерной нерки, Oncorhynchus nerka(Shimizu et al. 1993).N24
формировал гомодимер на ~43,3 а.е.м. неповрежденной молекулярной массы и
демонстрирует глутатиоидную связывающую активность (Kudo et al. 1999). Кроме
того, протеиное и нуклеотидное секвенирование демонстрирует заметную
гомологичность между N24
и GST класса пи (Kudo et
al. 1999). Иммунореактивные сайты N24
изучавшиеся в цитоплазме и аксонах ОРК озерной нерки (Kudo et al. 1996) имеют
схожую с GST класса пи
локализацию в обонятельной системе радужной форели (Starcevic and Zielinski
1995). К тому же, сильно гибридизированные связи N24
м-РНК были обнаружены в ОРК (Kudo et al. 1999). Это является убедительным
доказательством того, что N24
- это изомер GST класса пи лосося. Однако, цитофизиология лососевых
обонятельных GST (soGST)
клеток в обонятельной системе не была проанализирована еще ни у одной особи
лосося в течении онтогенеза.
В этом научном труде, мы
изучаем хронологическую последовательность soGST
в обонятельной системе (обонятельный плакод, обонятельная ямка обонятельный
эпителий, обонятельные нервы и обонятельная луковица) эмбриона озерной нерки,
используя иммуногистохимические методы с использованием специфичных к soGST
(анти-N24 антитела)
антител. Мы также насмотрели развитие обонятельной системы, используя
окрашивание гематоксилином и эозином. В дополнение, мы провели эксперименты по
усвоению БДУ, ин виво, с целью проанализировать взаимосвязь между экспрессией GST
и клеточной пролиферацией ОРК.
Материалы и методы
Материалы
Оплодотворенные яйца озерной
нерки (Oncorhynchus nerka), полученные из : Toya Lake Station, Field Science
Center for Northern Biosphere, Hokkaido University в Ноябре 1994г.
Оплодотворенным яйцам искусственно поддерживали жизнь вплоть до их вылупления в
минеральной воде, температурой 8-10°С. Эти яйца вылупились на 70 день после
оплодотворения. Были произведена выборка эмбрионов на 19, 26, 28, 34, 43, 52,
58 и 70 дни после оплодотворения. В каждый день бралась выборка из минимум 10
эмбрионов. Для опыта усвоения БДУ ин виво, годовалая озерная нерка была
получена из Лаборатории в Toya Lake Station в августе 1994 (длина тела 12,8 -
15, 8 см; вес тела,16,1 - 51,6 г.)
Гистологическая процедура.
Все животные были убиты путем
обезглавливания, целое тело или голова эмбриона фиксировалась раствором 4%
параформальдегида в 0,1 М фосфатного буфера (рН 7,2; РВ); промывалась 0,1 М РВ
содержащего 10 % сахарозы при 4 °С, обезвоживалась через градуированную серию
этанола, и заливалась в парафин (Histosec; Merck, Darmstadt, Germany). Серия
срезов производилась примерно 5  m толщиной,
используя микротом, установленным на покрытое желатином стекло, и сушилась на
воздухе, при температуре 4°С. После депарафинизации и гидратации, срезы
окрашивались гематоксилином Делафильда и эозинов; и изучались под световым
микроскопом.
m толщиной,
используя микротом, установленным на покрытое желатином стекло, и сушилась на
воздухе, при температуре 4°С. После депарафинизации и гидратации, срезы
окрашивались гематоксилином Делафильда и эозинов; и изучались под световым
микроскопом.
Иммуногистохимия.
Гидратированные срезы были
инкубированы с 0,1 % пероксидом водорода (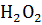 )
в метаноле на 15 минут, что бы заблокировать активность эндогенной пероксидазы,
и промывали фосфатно-солевым буфером (PBS).
Срезы инкубировались с нормальной козьей сывороткой на 15 минут, после
инкубированных во влажных камерах с поликлональным, к лососевым обонятельным soGST,
антителам, в соотношении 1 : 1000 в PBS
на 2 часа при комнатной температуре. Специфичность антител к анти-soGST
уже была рассмотрена (Shimizu et al.1993). Метод помеченного
стрептавидин-биотин комплекса Histofine Kit; Nichirei, Tokyo, Japan)
использовался в иммуногистохимии. Пероксидазный комплекс был визуализирован с
помощью обработки свежеприготовленным диаминобензидин тетрагидрохлоридным (0,1
мг/мл) раствором с 0,01 %
)
в метаноле на 15 минут, что бы заблокировать активность эндогенной пероксидазы,
и промывали фосфатно-солевым буфером (PBS).
Срезы инкубировались с нормальной козьей сывороткой на 15 минут, после
инкубированных во влажных камерах с поликлональным, к лососевым обонятельным soGST,
антителам, в соотношении 1 : 1000 в PBS
на 2 часа при комнатной температуре. Специфичность антител к анти-soGST
уже была рассмотрена (Shimizu et al.1993). Метод помеченного
стрептавидин-биотин комплекса Histofine Kit; Nichirei, Tokyo, Japan)
использовался в иммуногистохимии. Пероксидазный комплекс был визуализирован с
помощью обработки свежеприготовленным диаминобензидин тетрагидрохлоридным (0,1
мг/мл) раствором с 0,01 % 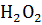 на 5 минут. После
дегидратации, срезы были закреплены покровным стеклом “Entellan neu” (Merck).
Специфичность иммунной реакции была подтверждена как пред адсорбционным тестом
с очищенным soGST (N24)
белком (Kudo et al. 1999); так и путем замещения главного антитела нормальной
кроличьей сывороткой.
на 5 минут. После
дегидратации, срезы были закреплены покровным стеклом “Entellan neu” (Merck).
Специфичность иммунной реакции была подтверждена как пред адсорбционным тестом
с очищенным soGST (N24)
белком (Kudo et al. 1999); так и путем замещения главного антитела нормальной
кроличьей сывороткой.
Усвоение
5-бром-2`-дезоксиуридина (БДУ) ин виво.
Тридцати рыбам вводили
внутрибоюшинно 1 мл БДУ меченого реактива (3 мг/мл бду; набор клеточной
пролиферации, Amersham Pharmacia Biotech, Buckinghamshire, UK) на 100 г веса
рыбы. После инъекции, рыбы разводились в крытом пластиковом баке с притоком
минеральной воды. На дни 0.5, 1, 3, 7, 15, 30 и 60, после маркирования, образцы
тканей из обонятельного эпителия были подготовлены, следуя процедуре, описанной
Kudo et al. (1996). Срезы, смежные к рассмотренным в GST-иммуногистохимии
были изучены на предмет наличия БДУ меченых клеток, следу рекомендациям
производителя набора клеточной пролиферации. Для оценки специфичности
обнаружения БДУ- меченых пролиферирующих клеток, две негативных контрольных
процедуры были представлены. В качестве отрицательного контроля для маркировки
БДУ, использовали PBS вместо маркировки реагента. В качестве отрицательного
контроля для иммуногистохимического обнаружения БДУ, PBS, использовали вместо
antiБДУ антитела.
Результаты
Гистологические изменения в
обонятельной системе в течении онтогенетического развития.
Гистогенезис обонятельных
плакоидов уже наблюдается на передней поверхности головы озерной нерки на 19
дне жизни эмбриона. Обонятельные плакоды состояли из нескольких слоев
недифференцированных эпителиальных клеток яйцевидной формы. (Fig 1А). На 25 дне
жизни зародыша, обонятельные плакоды выросли, путем увеличения их количества
клеток и слоев (Fig 1В). На 28 день, стала наблюдаться толстая кромка
соединительной ткани вокруг обонятельных плакод. Свободные поверхности
обонятельных плакод были инвагинированы, обонятельные нервные аксоны выступающие
из обонятельных плакодов к обонятельным луковицам были идентифицированы впервые
(Fig. 1С). На 34 день у эмбриона были впервые обнаружены бокаловидные клетки в
новообразовавшихся обонятельных ямках (Fig. 1Д). На 43 день у эмбриона были
замечены реснички мерцательного эпителия на поверхности обонятельных ямок (Fig.
1Е). На 58 день после образования ноздрей, обонятельные ямки начинали обрастать
соединительной тканью. Псевдомногослойный эпителий обонятельных ямок показал
сходную структуру с обонятельным эпителием взрослого лосося (Fig. 1F).
На 70 день эмбриона (день вылупления), компоненты клеток обонятельных ямок
можно разделить на 4 типа ( ОРК, базальные клетки, поддерживающие эпителиоциты
и бокаловидные клетки; Fig. 1Н). Обонятельные ямки и носовые полости высоко
развиты однако, формирование ноздрей еще не было закончено (Fig. 1G).
Эти результаты были занесены в таблицу 1.
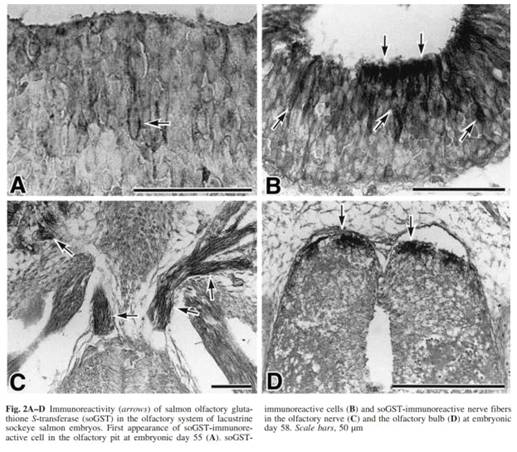
Используя иммуногистохимические
методики, мы добились того, что ОРК, которые были гистохимически обнаружаемы не
эспрессировались в soGST
вплоть до 52 дня. soGST-иммунореактивы
были впервые обнаружены в перинуклеарной цитоплазме этих клеток на 55 день
жизни эмбриона (Fig. 2А). До этого времени не было обнаружено soGST-иммунореактивов
в предполагаемых обонятельных нервных пучках. На 58 день, число soGST-иммунореактивных
клеток в обонятельных ямках резко увеличилось; а сильная soGST-иммунореактивность
была обнаружена в дендритной и перинуклеальной цитоплазме ОРК (Fig. 2В). В то
же время, soGST-иммунореактивные
аксоны были обнаружены в обонятельных нервных пучках и обонятельных ямках (Fig.
2С, D). Эти аксоны
входят в ростральную часть обонятельных ямок (Fig. 2D).
soGST-иммунореактивы
были полностью удалены методом предварительной адсорбции (не было получено
данных). Эти результаты занесены в хронологическом порядке в таблице 1 и
схематически обозначены в Figунке 3.
Взаимосвязь между GST
экспрессией и клеточной пролиферацией ОРК.
Обонятельный эпителий
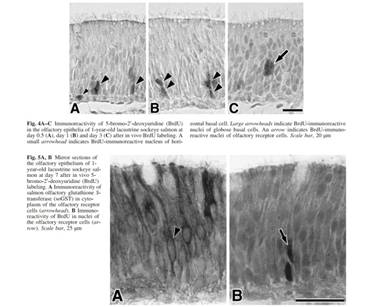
годовалого лосося проявил БДУ иммунореактивность в ядрах (Fig. 4,5). Эти
БДУ-иммунореактивные были классифициорованы как горизонтальные и шаровидные
базальные клетки, и поддерживающие эпителиоциты на 12 час после маркирования
БДУ ин виво. Эти БДУ-иммунореактивы были преимущественно обнаружены как в
горизонтальных, так и в шаровидных базальных клетках (Fig. 4А). На 3 день после
маркирования, БДУ-иммунореактивные клетки, находящиеся вблизи промежуточного
слоя обонятельного эпителия начали делиться (начался рост численности). Эти
клетки были определены как молодые ОРК, из-за их местонахождения (Fig. 4С).
Анализ зеркальных секций
обонятельного эпителия показал, что иммунореактивность для soGST
есть как в цитоплазме, так и в аксонах ОРК, но нет в поддерживающих
эпителиоцитах, бокаловидных клетках, так же как ее нету и в горизонтальных и
шаровидных базальных клетках (Fig. 5А). Иммунореактивность для БДУ наблюдалась
в ядрах обонятельных нервных пучков в зеркальной секции по Figунку 5А (Fig 5В).
ОРК, в которых существует иммунореактивность как для soGST,
так и для БДУ была впервые замечена на 7 день после маркирования. На 60 день
после маркирования, эти иммунореактивы равномерно рассеялись по всему
обонятельному эпителию.
Обсуждение
Эта научная работа предоставляет
первый иммуногистохимический анализ онтогенетической экспрессии GST
субъедениц в обонятельной системе рыб. В предыдущих работах об обонятельном
эпителии грызуны, иммунореактивность GST
класса альфа и мю была найдена в поддерживающих эпителиоцитах и ацинарных
клетках желез Боумена у взрослых крыс (Bangeret al. 1994). Иммунореактивность GST
класса пи не была обнаружена в обонятельном эпителии ни на одном из изучаемых
этапов развития (Krishna et al. 1994). Однако, GST
класса пи был выражен в ОРК лосося (Starcevic and Zielinski 1995; Kudo et al.
1999). Это различие в выраженности GST
между млекопитающими и костистыми рыбами - нынешний вопрос. Следует изучить,
так ли это, что soGST
регулируется экспрессией обонятельного нейронного активатора транскрипции (НАТ
-1 ) в ОРК лосося; потому что НАТ-1 регулирует экспрессию множества генов
отвечающих за ОРК у млекопитающих (Wang et al. 1993). Нынешнее исследование
зафиксировало появление soGST
после дифференциации ОРК в обонятельных ямках на 55 дне, и не нашло никаких
значительных отличий между локализацией soGST
у взрослого и молодого (после 55 дня) обонятельного эпителия. Zielinski and
Hara (1988) обнаружили, что после дифференцировки, реснитчатые ОРК могут
реагировать на аминокислоты у эмбрионов радужной форели; с помощью
ультраструктурного и электрофизиологического анализов. Эти открытия указывают
на то, что soGST
синтезируется во взрослых ОРК после клеточной дифференциации в процессе
онтогенеза. Подобным образом, обонятельные маркерный белок (ОМБ) выделялся во взрослых
ОРК после организации сенсорных синапсов в обонятельных ямках эмбриона мыши
(Farbman and Margolis
1980; Monti-Graziadei
et al.
1980). Более того, данный тайминг экспрессии soGST
подразумевает, что функции ксенобиотиков для веществ из внешней среды, нужные
после вылупления, были предоставлены этим клеткам еще в яйце.
В лягушках и грызунах, анализ
клеточных оборотов был представлен мониторингом клеточной пролифераии, с
использованием 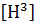 тимидина
(Graziadei and Metcalf 1971; Graziadei and Monti-Graziadei 1979) или БДУ
(Nakamura 1991; Suzuki and Takeda 1993), включенный в ДНК клеток в обонятельном
эпителии. Эти исследования показали, что клетки-предшественники ОРК - базальные
клетки. Механизм клеточного оборота в обонятельном эпителии костистых был
приравнен к таковому у лягушек и грызунов, но прямых доказательств этого
утверждения нет. Данное исследование первым сообщает о мониторинге клеточной
пролиферации в обонятельном эпителии костистых рыб. Полученные данные БДУ-иммунореактивности
после маркирования схожи с результатами, полученными при использовании
обонятельного эпителия мыши (Suzuki and Takeda 1993). В дополнение к
вышесказанному, период дифферинцировани от базальных клеток ко взрослым ОРК,
длился, около 1 недели у взрослой мыши и был исследован путем
авторадиографического анализа (Graziadei and Monti-Graziadei 1979). Данное
исследование демонстрирует, что ОРК и БДУ совместная иммунореактивность впервые
наблюдалась на 7 день после маркировании. Эти результаты показывают, что soGST
синтезировался во взрослых клетках годовалого лосося так же, как и у эмбриона.
У взрослой радужной форели, развитые ОРК проявили иммунореактивность к
вышеупомянутым ОМР, используя анти - млекопитающие ОМР сыворотки (Riddle and
Oakley 1992). Несмотря на то, что функции ОМР и soGST
различны, очень похоже на то, что эти молекулы являются полезными молекулярными
маркерами для детекции степени развитости клеточных рецепторов у лосося.
тимидина
(Graziadei and Metcalf 1971; Graziadei and Monti-Graziadei 1979) или БДУ
(Nakamura 1991; Suzuki and Takeda 1993), включенный в ДНК клеток в обонятельном
эпителии. Эти исследования показали, что клетки-предшественники ОРК - базальные
клетки. Механизм клеточного оборота в обонятельном эпителии костистых был
приравнен к таковому у лягушек и грызунов, но прямых доказательств этого
утверждения нет. Данное исследование первым сообщает о мониторинге клеточной
пролиферации в обонятельном эпителии костистых рыб. Полученные данные БДУ-иммунореактивности
после маркирования схожи с результатами, полученными при использовании
обонятельного эпителия мыши (Suzuki and Takeda 1993). В дополнение к
вышесказанному, период дифферинцировани от базальных клеток ко взрослым ОРК,
длился, около 1 недели у взрослой мыши и был исследован путем
авторадиографического анализа (Graziadei and Monti-Graziadei 1979). Данное
исследование демонстрирует, что ОРК и БДУ совместная иммунореактивность впервые
наблюдалась на 7 день после маркировании. Эти результаты показывают, что soGST
синтезировался во взрослых клетках годовалого лосося так же, как и у эмбриона.
У взрослой радужной форели, развитые ОРК проявили иммунореактивность к
вышеупомянутым ОМР, используя анти - млекопитающие ОМР сыворотки (Riddle and
Oakley 1992). Несмотря на то, что функции ОМР и soGST
различны, очень похоже на то, что эти молекулы являются полезными молекулярными
маркерами для детекции степени развитости клеточных рецепторов у лосося.
Лососевые проявляют
отличительную способность возвращаться домой во время миграции из океана в
родную реку. Хорошо известно, что лососевые возвращаясь из океана в родную реку
ориентируются на обоняние (Stabell 1992; Dittman and Quinn 1996). Наша
предыдущая работа с использованием вестерн-блота показала, что уровень soGST
(N24) был выше у рыб
в родной реке, чем у рыб в море в обоих периодах импринтинга (запечатления) от
родной реки и при возвращении домой (Shimizu et al. 1993). В добавок, мы
подтвердили, что soGST
выражаются в ОРК взрослой кеты (Oncorhynchus keta) во время периода возвращения
в родную реку (исследование не публиковалось). Теперь мы рассматриваем, что soGST
могут поддерживать обоняние ксенобиотическими функциями в оба периода.
Дальнейшие исследования направлены на изучение изменений soGST-экспрессии
в ОРК в течении миграции лосося, особенно во время импринтинга и возвращения
домой.
В общем, мы гистологически
охарактеризовали дифференциацию о обонятельной системе в процессе онтогенеза и
продемонстрировали, что soGST
выражаются в развитых ОРК в обонятельной системе озерной нерки.
обонятельный
эмбрион нерка гистологический
Использовалась
литература
Banger KK, Foster
JR, Lock EA, Reed CJ (1994) Immunohistochemical localization of six
glutathioneS-transferases within the nasal cavity of the rat. Arch Toxicol
69:91-98 Banger KK, Lock EA, Reed CJ (1993) The characterization of
glutathioneS-transferases from rat olfactory epithelium. Biochem J 290:199-204
Ben-Arie N, Khen M, Lancet D (1993) GlutathioneS-transferase in rat olfactory
epithelium: purification, molecular properties and odorant biotransformation.
Biochem J 292:379-384 Dittman AH, Quinn TP (1996) Homing in pacific salmon:
mechanisms and ecological basis. J Exp Biol 199:83-91 Farbman AI, Margolis FL
(1980) Olfactory marker protein during ontogeny: immunohistochemical
localization. Dev Biol 74: 205-215 Graziadei PPC, Metcalf JF (1971)
Autoradiographic and ultrastructural observations on the frog’s olfactory
mucosa. Z Zellforsch Mikrosk Anat 116:305-318 Graziadei PPC, Monti-Graziadei GA
(1979) Neurogenesis and neuron regeneration in the olfactory system of mammals.
I. Morphological aspects of differentiation and structural organization of the
olfactory sensory neurons. J Neurocytol 8:1-18 Jakoby WB (1978) The
glutathioneS-transferase: a group of multifunctional detoxification proteins.
Adv Enzymol Relat Areas Mol Biol 46:383-414 Krishna NS, Getchell TV, Getchell
ML (1994) Differential expression of alpha, mu, and pi classes of
glutathioneS-transferases in chemosensory mucosae of rats during development.
Cell Tissue Res 275:435-450 Kudo H, Doi Y, Nishino T, Nara S, Hamasaki K,
Fujimoto S (2000) Dietary zinc deficiency decreases glutathione S-transferase
expression in the rat olfactory epithelium. J Nutr 130:38-44 Kudo H, Ueda H,
Mochida K, Adachi S, Hara A, Nagasawa H, Doi Y, Fujimoto S, Yamauchi K (1999)
Salmonid olfactory systemspecific protein (N24) exhibits glutathione
S-transferase class pi-like structure. J Neurochem 72:1344-1352 Kudo H, Ueda H,
Yamauchi K (1996) Immunocytochemical investigation of a salmonid olfactory
system-specific protein in the olfactory system of kokanee salmon (Oncorhynchus
nerka). Zool Sci 13:647-653 Mannervik B, Danielson UH (1988) Glutathione
transferases, structure and catalytic activity. Crit Rev Biochem 23:283-337
Meyer DJ, Coles B, Pemble SE, Gilmore KS, Fraser GM, Ketterer B (1991) Theta, a
new class of glutathione transferases purified from rat and man. Biochem J
274:409-414 Monti-Graziadei GA, Stanley RS, Graziadei PPC (1980) The olfactory
marker protein in the olfactory system of the mouse during development.
Neuroscience 5:1239-1252 Nakamura H (1991) Immunohistochemical observations of
dividing cells in olfactory epithelium using anti-BrdU antibody. Eur Arch
Otorhinolaryngol 248:298-301 Riddle DR, Oakley B (1992) Immunocytochemical
identification of primary olfactory afferents in rainbow trout. J Comp Neurol
324:575-589 Salinas AE, Wong MG (1999) GlutathioneS-transferases: a review.
Curr Med Chem 6:279-309 Shimizu M, Kudo H, Ueda H, Hara A, Shimazaki K,
Yamauchi K (1993) Identification and immunological properties of an olfactory
system-specific protein in kokanee salmon (Oncorhynchus nerka). Zool Sci
10:287-294 Stabell OB (1992) Olfactory control of homing behaviour in
salmonids: In: Hara TJ (ed) Fish Chemoreception. Chapman, London, pp 249-270
Starcevic SL, Muruganandam A, Mutus B, Zielinski BS (1993) Glutathione in the
olfactory mucosa of rainbow trout (Oncorhynchus mykiss). Chem Senses 18:57-65
Starcevic SL, Zielinski BS (1995) Immunohistochemical localization of glutathione
S-transferase pi in rainbow trout olfactory receptor neurons. Neurosci Lett
183:175-178 Suzuki Y, Takeda M (1993) Basal cells in the mouse olfactory
epithelium during development: immunohistochemical and electron-microscopic
studies. Brain Res Dev Brain Res 73:107- 113 Wang MM, Tsai RY, Schrader KA,
Reed RR (1993) Genes encoding components of the olfactory signal transduction
cascade contain a DNA binding site that may direct neuronal expression. Mol
Cell Biol 13:5805-5813 Zielinski B, Hara TJ (1988) Morphological and
physiological development of olfactory receptor cells in rainbow trout (Salmo
gairdneri) embryos. J Comp Neurol 271:300-311
Приложение
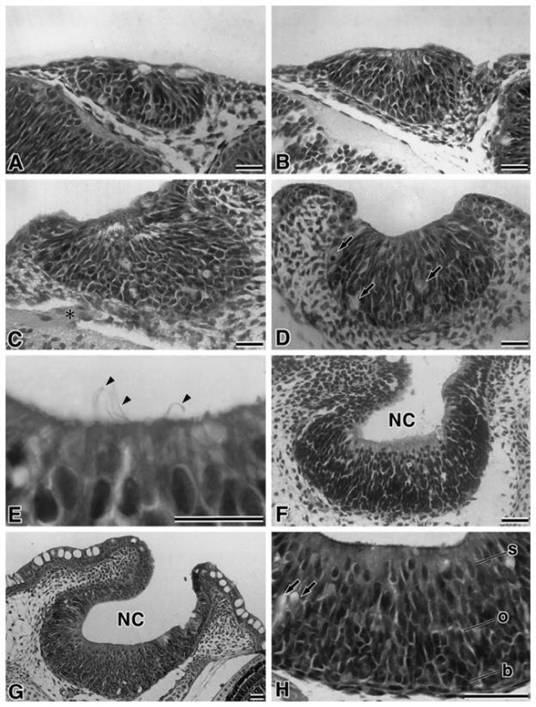
Fig.
1A-EPhotomicrographs of the olfactory placodes and pits in lacustrine sockeye
salmon at embryonic day 19 (A), day 25 (B), day 28 (C), day 34 (D), day 43 (E),
day 58 (F) and day 70 (G, H) stained with hematoxylin and eosin.
Anasteriskindicates olfactory nerve axon.Arrowsindicate goblet cells.
Arrowheadsindicate olfactory cilia. b, basal cell; o, immature olfactory
receptor cell; s, sustentacular cell;NC, nasal cavity; Scale bars,20 m